与间水杨酸形成的烟碱盐的制作方法
本申请是2014年7月11日提交的发明名称为“与间水杨酸形成的烟碱盐”的中国专利申请201480050267.x的分案申请。相关申请本申请要求myers2013年7月11日申请的标题为“nicotinesaltwithmeta-salicylicacid”的美国临时申请序列号第61/845,333号的优先权。本申请要求cassella2014年7月3日申请的标题为“drugdeliveryandcessationsystem,apparatus,andmethod”的美国临时申请序列号第62/020,766号的优先权。此处将其整个全部公开内容援引加入本文。在上述申请的审查期间发生的任何放弃都明确地撤销,并恳请对所有相关技术的重新考虑。本发明大体上涉及烟碱递送领域。本发明教导了间水杨酸烟碱。更具体地,本发明教导了冷凝烟碱气雾剂,其中将间水杨酸烟碱气化。本发明涉及气雾剂烟碱递送装置。所述递送装置可以通过启动机构激活以将包含间水杨酸烟碱的薄膜气化。更具体地,本发明涉及用于治疗烟碱渴求和用于实现戒烟的间水杨酸烟碱的薄膜。本发明还涉及用于将药物剂量递送至使用者以及用于药物中断(drugcessation)控制的方法、系统、装置和电脑软件,更具体地涉及用于将烟碱的剂量递送至使用者以及用于烟碱中断(nicotinecessation)控制的方法、系统、装置和电脑软件。
背景技术:
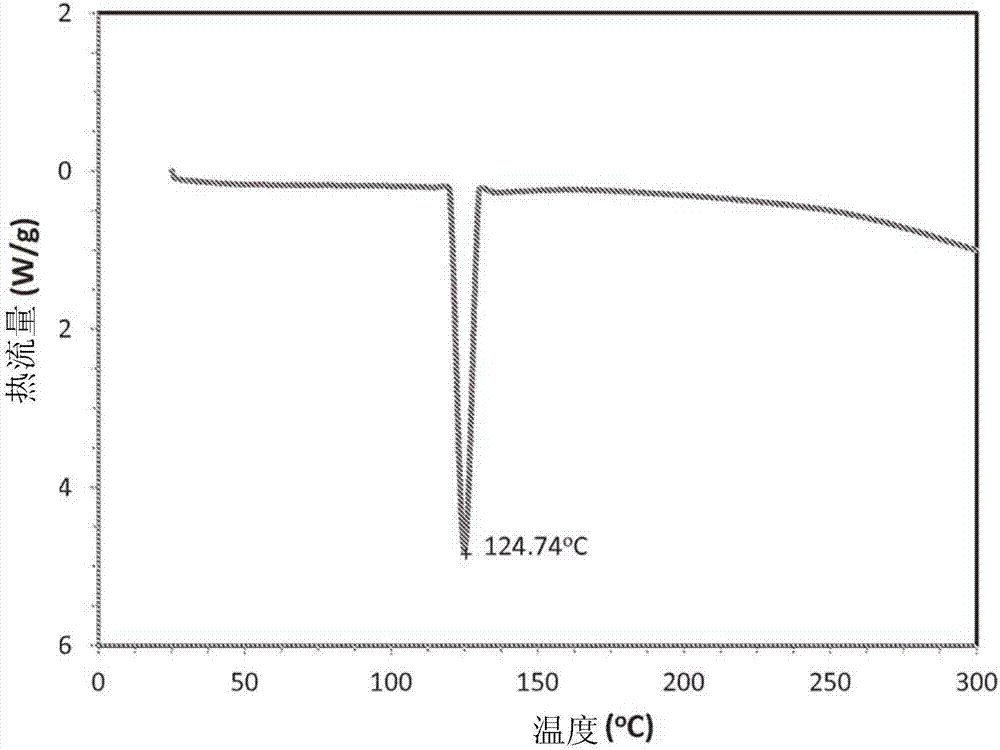
:由于烟碱通过吸烟者的肺被吸收,因此吸烟提供了烟碱血液水平的初始的快速上升。通常,在吸烟的10分钟内,保持30-40ng/ml的由香烟产生的血液水平峰值(hukkanen等,amsoc.pharmexptherap2013)。烟碱血液水平的迅速上升被假定为是诱发吸烟者经历的症状的中枢神经系统中烟碱型胆碱能受体处和自主神经中枢处的突触后作用的原因,并且可能也是与戒烟相关的渴求症状的原因。尽管已开发了许多烟碱替代治疗,但似乎没有一种治疗再现由香烟提供的全身烟碱血浓度的药代动力学特征。因此,未证明常规的烟碱替代治疗能够特别有效地使得人们放弃吸烟。例如,在戒烟治疗中许多可商购的用于烟碱替代的产品意图在血液中提供稳定的烟碱基线浓度。烟碱口香糖和烟碱透皮贴是戒烟产品的两个实例,尽管其在大于约30分钟的时间提供与香烟提供的烟碱血液浓度相似的烟碱血液浓度,但不再现通过吸烟获得的烟碱血液浓度的初始的快速上升。烟碱口香糖为离子交换树脂,当患者咀嚼时其缓慢地释放烟碱,且口中存在的烟碱通过口腔吸收被递送至系统循环。烟碱贴提供持续的稳定的释放速率,其导致低的稳定的烟碱血液水平。因此,烟碱口香糖和烟碱透皮贴两者均不能再现通过吸烟获得的烟碱血液水平的药代动力学特征,并因此不满足许多吸烟者当试图放弃吸烟时经历的渴求症状。由于吸入的蒸汽主要通过舌、口和喉吸收且不沉积于肺中,因此产生烟碱蒸汽的吸入产品也是无效的。无烟的烟碱产品例如咀嚼烟、口腔鼻烟或烟草袋将烟碱递送至口腔黏膜,如使用烟碱口香糖那样,释放的烟碱在口腔黏膜处仅缓慢地且无效率地被吸收。来自这些产品的烟碱血液水平要求约30分钟的使用以获得约12ng/ml的最大烟碱血液浓度,其小于由吸一根香烟获得的峰值的一半。使用口腔吸收途径获得的低烟碱血液水平可能是由于首过肝代谢。口服给药制剂和锭剂也是相对无效的。药物薄膜在高至600℃的温度下在小于500毫秒内在气流中的快速气化可能产生具有高收率和高纯度的药物气雾剂,并伴随最小程度的药物降解。冷凝药物气雾剂可用于使用吸入医学装置有效地肺部递送药物。已证明其中沉积于金属基底的药物薄膜通过电阻加热而气化的装置和方法。包括处于包装内的能够经历放热的金属氧化还原反应的燃料的基于化学的热包也可以用于产生能够使薄膜气化以产生高纯度气雾剂的快速热脉冲,例如在2004年5月20日申请的标题为“self-containedheatingunitanddrug-supplyunitemployingsame”的美国申请第10/850,895号中,和2004年5月20日申请的标题为“percussivelyignitedorelectricallyignitedself-containedheatingunitanddrugsupplyunitemployingsame”的美国申请第10/851,883号中公开的那样,这两件申请的全文均援引加入本文。这些装置和方法适于能够以物理上和化学上稳定的固体的形式沉积的化合物。除非在被沉积至金属表面上不久后即被气化,否则液体可能自所述表面蒸发或移动。因此,尽管这样的装置可用于气化液体,但液体药物的使用可能带来某些不期望的复杂度。烟碱在室温下为液体,具有相对高的蒸汽压。因此,已知的装置和方法并非特别适于使用液体药物制备烟碱气雾剂。推测对烟碱渴求和戒烟的治疗可以通过能够再现在吸烟期间的高烟碱血液浓度的快速发生的治疗方案和/或治疗而解决。在约5分钟的期间内,吸烟者通常吸入约10次。因此,能够模拟吸烟的使用特征的烟碱递送装置可以包含约5-20剂量,每剂量多达约200μg烟碱,随后其可以在使用者要求时间歇地释放。因此,仍亟需对于能够提供与通过吸烟获得的药代动力学特性相似的药代动力学特性并因此直接解决与戒烟相关的渴求症状的烟碱替代治疗。发明概述因此,本发明的一个方面教导了间水杨酸烟碱。本发明的一个方面提供了包含挥发性间水杨酸烟碱化合物的化合物,其中所述化合物在被加热时选择性地气化。本发明的一个方面提供了包含如图13中所述的电子多剂量平台(emd)的烟碱递送装置。本发明的一个方面提供了烟碱递送装置,其包含界定气道的外壳、设置于所述气道内的至少一个热包(heatpackage)、设置于所述至少一个热包上的至少间水杨酸烟碱、和设置用于启动所述至少一个热包的机构,其中所述气道包含至少一个空气入口和具有至少一个空气出口的吹口(mouthpiece)。本发明的一个方面提供了烟碱递送装置,其包含界定气道的外壳、设置于所述气道内的至少一个冲击激活(percussivelyactivated)热包、设置于所述至少一个冲击激活热包上的至少间水杨酸烟碱、和设置用于撞击所述至少一个冲击激活热包的机构,其中所述气道包含至少一个空气入口和具有至少一个空气出口的吹口。为清楚的目的,本文中的“冲击激活热包”指已设置使得其可以通过冲击而被点燃或激活热包。本文中的“未激活热包”或“非激活热包”指装置中的冲击激活热包,但其尚未被放置于装置中以使其可以被直接地撞击或激活,但当如此放置时所述热包自身经设置以待通过冲击而激活。本发明的一个方面提供了通过将来自包含间水杨酸烟碱的薄膜的化合物选择性地气化而制备烟碱的气雾剂的方法。本发明的一个方面提供了将烟碱递送至人的方法,其包括提供烟碱递送装置(其包含界定气道的外壳、设置于所述气道内的至少两个或更多个热包、设置于所述热包上的至少间水杨酸烟碱、和设置用于激活所述热包的机构,其中所述气道包含至少一个空气入口和具有至少一个空气出口的吹口),通过所述吹口吸入,并将所述热包激活,其中所述激活热包将所述至少间水杨酸烟碱气化以在气道中形成包含烟碱的气雾剂,其被人吸入。本发明的一个方面提供了使用烟碱气雾剂治疗烟碱渴求和戒烟的方法。本发明的一个方面提供了利用通过剂量减少的电子剂量控制和/或逐渐降低而通过行为修正治疗逐渐降低烟碱剂量。应理解的是,先前的一般描述和以下的详细描述仅为示例性和示例性的,且并非对于如所要求保护的某些实施方案的限制。本发明涉及制备方法以及用作吸烟替代物和戒烟辅助或如以下将讨论的那样用于治疗疾病的促进烟碱至患者的吸入递送的组合物。本发明的一个实施方案能够以产生与通过吸烟获得的血液烟碱浓度类似的血液烟碱浓度的方式将烟碱递送入患者的血液中,由此解决吸烟者发生的对于烟碱的生理学渴求。此外,如果期望,所公开的含烟碱的剂型为患者提供了与将剂型重复地插入或移出患者的口腔相关的物理操作和口腔刺激的机会,以由此解决吸烟者发生的一些生理学渴求。本发明的一个目的是提供含烟碱的剂型,其可用作长期戒烟程序的一部分。另一个目的是提供含烟碱的剂型,其适于在任何不允许或期望吸烟时用作吸烟替代物。本发明的另一个目的是提供高度不含香烟中存在的毒素的烟碱气雾剂。本发明的另一个目的是提供含烟碱的剂型,其可以将烟碱血浆浓度保持在缓解戒烟症状的范围内。本发明的另一个目的是提供含烟碱的剂型,其能够提供与通过吸烟获得的烟碱血浆浓度相似的烟碱血浆浓度,包括相似的烟碱递送的药理学特性。此外,本发明教导了含烟碱的剂型,其解决了期望戒烟的个体的生理学需要。本发明还教导了含烟碱的剂型,其易于使用以促进患者依从性。本发明还教导了通过允许患者自滴定用于克服人类个体的渴求的烟碱的量而戒除/缩减对于香烟的渴求。本发明教导了新的烟碱盐间水杨酸烟碱。应注意的是间水杨酸也被称为3-羟基苯甲酸。在一个方面中,本发明教导了用于递送烟碱的新组合物,其包括通过在有效地产生所述间水杨酸烟碱组合物的经加热的蒸汽并将药物组合物的经加热的蒸汽冷凝以形成冷凝气雾剂颗粒的条件下将热稳定的间水杨酸烟碱组合物气化而形成的冷凝气雾剂,其中所述冷凝气雾剂颗粒的特征在于少于10%的烟碱降解产物,其中所述气雾剂mmad小于3微米且其中所述热稳定的间水杨酸烟碱组合物包含间水杨酸烟碱。在一些变体中,所述气雾剂包含至少50重量%的烟碱冷凝颗粒。在其他变体中,所述气雾剂包含至少90重量%或95重量%的烟碱冷凝颗粒。相似地,在一些变体中,所述气雾剂基本上不含热降解产物,且在一些变体中,所述冷凝气雾剂具有0.1-3μm范围内的mmad。在某些实施方案中,所述颗粒具有小于5微米,优选地小于3微米的mmad。优选地,所述颗粒具有0.2-5微米,或最优选地0.2-3微米的总气体动力学中位数直径。通常,所述气雾剂包含质量有效量的烟碱,且在一些变体中可以包含药学上可接受的赋形剂。在一些变体中,所述载气为空气。在一些变体中,可以使用其他气体或多种气体的组合。在一些变体中,烟碱游离碱的百分比为至少10%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为至少20%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为至少30%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为至少40%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为至少50%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为1%至10%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为10%至20%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为20%至30%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为30%至40%。在一些变体中,所述气雾剂中烟碱游离碱的百分比为40%至50%。在本发明的另一个方面,本发明提供了用于吸入递送的组合物,其包含冷凝为颗粒的气化烟碱的气雾剂,其特征在于少于5%的药物降解产物,且其中所述气雾剂具有0.1-3微米的总气体动力学中位数直径。在气雾剂组合物的一些变体中,所述载气为非抛射剂非有机溶剂载气。在气雾剂组合物的一些变体中,所述载气为空气。在一些变体中,所述气雾剂基本上不含有机溶剂和抛射剂。在其他实施方案中,提供包含少于5%的烟碱降解产物以及载气和冷凝颗粒的混合物的烟碱气雾剂,所述载气和冷凝颗粒的混合物是通过烟碱蒸汽在所述载气中冷凝而形成的;其中由于所述蒸汽通过与载气接触而冷却,气雾剂的mmad在0.1-3微米的大小范围内随时间增加。在一些实施方案中,所述气雾剂包含至少50重量%的烟碱冷凝颗粒。在其他变体中,所述气雾剂包含至少90重量%或95重量%烟碱冷凝颗粒。在一些变体中,所述气雾剂的mmad为小于2微米且随时间增加。在一些变体中,所述载气为空气。在一些变体中,可以使用其他气体或多种气体的组合。各实施方案的冷凝气雾剂通常是通过以下而形成的:在导热且不可渗透的基底上制备期望厚度的包含间水杨酸烟碱的膜并将所述基底加热以使所述膜气化,并将所述蒸汽冷却由此制备包含所述组合物的气雾剂颗粒。快速加热和气流的组合有助于减少分解的量。因此,使用通常将基底加热至高于200℃,优选地至少250℃,更优选地至少300℃或350℃的温度,并且在2秒的时间段内,优选地在1秒的时间段内,更优选地在0.5秒的时间段内产生间水杨酸烟碱组合物的基本上完全的气化的热源。通常,气化化合物的蒸汽流速为约1-10l/分钟。进一步地,气化化合物的蒸汽流速可以为约2-8l/分钟。膜厚度使得通过加热基底气化间水杨酸烟碱并将气化的化合物冷凝而形成的气雾剂包含10重量%或更少的烟碱降解产物。薄膜的使用允许更快的气化速率,且因此通常允许较少的烟碱热降解。通常,所述膜具有0.05至30微米的厚度。在一些变体中,所述膜具有0.5至25微米的厚度。在一些变体中,所述膜具有约21微米的厚度。所选择的基底表面区域的面积使得产生有效剂量的烟碱气雾剂。在相关的方面,本发明教导了用于递送烟碱冷凝气雾剂的药盒,其通常包含不含溶剂和赋形剂并且包含热稳定的间水杨酸烟碱的组合物;以及用于形成和经由吸入递送冷凝气雾剂的装置。用于形成药物气雾剂的装置通常包含设置用于加热组合物以形成蒸汽的元件、允许蒸汽冷凝以形成冷凝气雾剂的元件、和允许使用者吸入冷凝气雾剂的元件。通常,设置用于加热组合物的元件包含导热基底并且当烟碱以气雾剂形式给药时通常在基底上形成包含有效剂量的烟碱的间水杨酸烟碱组合物膜。装置中的热源可被操作从而将热供应至基底以产生基底温度,其通常为高于300℃,以基本上在2秒或更短的时间段内,更优选地在500毫秒或更短的时间段内将间水杨酸烟碱组合物自基底气化。所述装置可以包含其他特征例如呼吸-启动、锁定元件、剂量计数/记录或逐渐降低方法。在另一个方面中,本发明教导了用于递送烟碱气雾剂的药盒,其包含间水杨酸烟碱组合物的薄膜和用于以冷凝气雾剂的形式分配所述膜的装置。通常,膜厚度为0.5-30微米。所述膜可以包含药学上可接受的赋形剂,并且通常以使得基本上在500毫秒或更少的时间内将膜基本上气化的速率加热。为了实现前述目的,并且根据本文中实施的且广泛地描述的发明,提供了含烟碱的剂型。所述剂型设置为具有含烟碱的组合物,其中所述烟碱组合物包含间水杨酸烟碱。当结合附图阅读本发明的以下详细说明时,将更完全地理解本发明的这些和其他目的和特征。附图说明图1为邻水杨酸、对水杨酸和3-羟基苯甲酸(间水杨酸)。图2显示间水杨酸烟碱粉末的典型量热扫描。图3显示邻位异构体。图4显示对位异构体。图5显示间位异构体。图6为显示间水杨酸烟碱的等温质量损失小于邻水杨酸烟碱的等温质量损失的热重分析图。图7显示热重分析。扫描数据自室温至500℃,显示在暴露于高温之后最小化的酸的碳化。图8显示在烟碱杂质方法中运行的典型样品的色谱。图9显示在间水杨酸盐杂质方法中运行的典型样品的色谱。图10显示各冲击器阶段中的粒径分布。图11显示粒径分布。图12显示烟碱质量损失随时间的变化。图13显示间水杨酸质量损失随时间的变化。图14显示未装袋的稳定性总结。图15显示未装袋的稳定性总结。图16烟碱装置1。图17烟碱装置2。图18烟碱装置3。图19烟碱装置4。现将详细参考本发明的实施方案。尽管将描述本发明的某些实施方案,但应理解的是其不意图将本发明的实施方案限于描述的那些实施方案。相反,对于本发明的实施方案的参考意图涵盖如所附的权利要求限定的可能会包括在本发明的实施方案的精神和范围内的可选方案、改进方案和等效方案。发明详述定义如本文所定义的,当在整个说明书中引用以下术语时,它们应具有以下含义。给定颗粒的“空气动力直径”指具有与给定颗粒相同的沉降速率的密度为1g/ml(水的密度)的球形液滴的直径。“气雾剂”指悬浮于气体中的固体或液体颗粒的集合。“气雾剂质量浓度”指每单位体积气雾剂的颗粒状物质的质量。“冷凝气雾剂”指已通过组合物的气化和随后的蒸汽冷却而使得蒸汽冷凝以形成颗粒而形成的气雾剂。“分解指数”指来自测定的数字。所述数字通过从1减去以份数形式表示的产生的气雾剂的纯度而确定。“药物”指在病症的预防、诊断、缓解、治疗或治愈中使用的任何物质。所述物质优选地为适于热蒸汽递送的形式例如酯、游离酸或游离碱形式。术语“药物”、“化合物”和“药剂”在本文可互换地使用。如在整个说明书中描述的那样,术语药物包括烟碱和间水杨酸烟碱。“药物组合物”指仅包含纯药物、两种或更多种药物的组合、或者一种或多种药物与其他组分的组合。其他组分可以包括例如药学上可接受的赋形剂、载体和表面活性剂。“药物降解产物”或“热降解产物”可互换地使用,并且指任何副产物,其由加热药物而获得并且不是产生疗效的原因。“供药物体”或“供药单元”可互换地使用,并且指其表面的至少一部分覆盖有一种或多种药物组合物的基底。本发明的供药物体还可以不含其他元件,例如但不限于加热元件。“有效量的烟碱”指实现通过吸烟而获得的来自烟碱的作用所需的烟碱的量。所述作用可以为从缓解与戒烟有关的症状至症状治疗的任何作用。在一个实施方案中,烟碱的有效量为50-200μg/剂。“药物降解产物分数”指气雾剂颗粒中存在的药物降解产物的量除以气雾剂中存在的药物加上药物降解产物的量,即,(气雾剂中存在的所有药物降解产物的总量)/((气雾剂中存在的药物的量)+(气雾剂中存在的所有药物降解产物的总量))。本文使用的术语“药物降解产物百分比”指药物降解产物分数乘以100%,其中气雾剂的“纯度”指100%减去药物降解产物百分比。“热稳定药物”指当自0.05μm至20μm的一些厚度的膜气化时tsr≥9的药物。气雾剂的“总气体动力学中位数直径”或“mmad”指以下空气动力直径:气雾剂的一半颗粒质量由空气动力直径大于mmad的颗粒贡献且颗粒的一半具有小于mmad的空气动力直径。“数浓度(numberconcentration)”指每单位体积气雾剂的颗粒数。本文使用的关于气雾剂纯度的“纯度”指药物组合物在气雾剂中的分数/药物组合物在气雾剂加上药物降解产物中的分数。因此,纯度相对于起始物质的纯度。例如,当用于基底涂层的起始药物或药物组合物包含可检测杂质时,报告的气雾剂的纯度不包括也在气雾剂中找到的存在于起始原料中的那些杂质,例如在某些情况中如果起始原料包含1%的杂质且发现气雾剂包含相同的1%杂质,则气雾剂的纯度仍然可以报告为>99%纯,反映出以下事实:可检测的1%纯度并非在气化-冷凝气雾剂生成过程期间生成。“沉降速率”指在空气中经历重力沉降的气雾剂颗粒的终速。“支持物”指组合物附着于其上(通常以涂层或薄膜的形式)的物质。术语“支持物”和“基底”在本文可互换地使用。“基本上不含”指描述的物质、化合物、气雾剂等至少95%不含基本上不含的其他组分。“典型患者潮气量(typicalpatienttidalvolume)”对于成年患者为1l且对于儿科患者为15ml/kg。“治疗有效量”指实现疗效所需要的量。疗效可以为从预防、症状缓解、症状治疗至疾病终止或治愈的任何疗效。如果纯度%<99.9%,则“热稳定性比例”或“tsr”指纯度%/(100%-纯度%),且如果纯度≥99.9%,则“热稳定性比例”或“tsr”指1000。例如,在90%纯度下气化的呼吸药物的tsr为9。“4μm热稳定性比例”或“4tsr”指通过以下测定的药物的tsr:在足以气化膜中的药物的至少50%的条件下将厚度为约4微米的含药物的膜加热,收集生成的气雾剂,确定气雾剂的纯度,并使用该纯度计算tsr。在这样的气化中,通常将约4微米厚度的药物膜加热至约350℃但不低于约200℃,持续约1秒,以将膜中的药物的至少50%气化。“1.5μm热稳定性比例”或“1.5tsr”指通过以下测定的药物的tsr:在足以气化膜中的药物的至少50%的条件下将厚度为约1.5微米的含药物的膜加热,收集生成的气雾剂,确定气雾剂的纯度,并使用该纯度计算tsr。在这样的气化中,通常将约1.5微米厚度的药物膜加热至约350℃但不低于约200℃,持续约1秒,以将膜中的药物的至少50%气化。“0.5μm热稳定性比例”或“0.5tsr”指通过以下测定的药物的tsr:在足以气化膜中的药物的至少50%的条件下将厚度为约0.5微米的含药物的膜加热,收集生成的气雾剂,确定气雾剂的纯度,并使用该纯度计算tsr。在这样的气化中,通常将约0.5微米厚度的药物膜加热至约350℃但不低于约200℃,持续约1秒,以将膜中的药物的至少50%气化。“蒸汽”指气体,且“蒸汽相”指气相。术语“热蒸汽”指优选地通过加热形成的气相、气雾剂、或气雾剂-气相的混合物。烟碱为既可以游离碱形式存在又可以盐形式存在的杂环化合物。游离碱形式具有以下结构:在25℃下,烟碱为无色至浅黄色挥发性液体。烟碱具有-79℃的熔点和247℃的沸点,且在25℃下具有0.0425mmhg的蒸汽压。液体性质防止稳定的膜的形成,且高蒸汽压可能导致储存期间的气化。尽管已考虑了用于在储存期间防止烟碱气化和降解的多种方法(例如经由喷墨装置由储罐递送、以环糊精复合物的形式将烟碱化学包封、和将烟碱包入泡罩包装),但未证明这样的措施适于低成本制造,也不容易降低以在实际装置中实践。间水杨酸烟碱间水杨酸也被称为3-羟基苯甲酸,其结构示于图2中。本发明教导了与间水杨酸形成的烟碱盐。间水杨酸烟碱的合成描述于实施例1中。与可商购的邻水杨酸烟碱相比较,间水杨酸烟碱具有两个潜在的重要优势。首先,热重分析数据显示间水杨酸烟碱的等温质量损失可以小于邻水杨酸烟碱的等温质量损失。例如,在40-60℃的储存温度下,自间水杨酸烟碱的烟碱质量损失比邻水杨酸烟碱少2-3倍。考虑到产品稳定性(即,在产品的储藏期内提供一致的药物给药的能力),由于烟碱和/或水杨酸的气化导致的质量损失是不利的。间水杨酸盐在气化期间较不易于热降解,特别是就苯酚的形成而言。这是本发明的另一个显著优势。羟基基团在水杨酸上的位置可通过对离子或自由基的共振稳定化起作用(或不起作用)而影响水杨酸脱羧基成为苯酚的可能性。邻位(和对位)异构体具有共振结构,其中负电荷位于氧原子上,而间位异构体不能形成此结构。此结构增加了离子/基团的稳定性,并且因此增加了由邻-或对-水杨酸形成苯酚的可能性或速率。气雾剂组合物本文描述的组合物通常包含烟碱化合物。所述组合物也可以包含其他化合物。例如,所述组合物可以包含药物化合物的混合物、烟碱化合物和药学上可接受的赋形剂的混合物、或者烟碱化合物与具有可用的或期望的性质的其他化合物的混合物。所述组合物也可以包含纯烟碱化合物。在优选的实施方案中,所述组合物基本上由纯间水杨酸烟碱组成且不包含抛射剂或溶剂。此外,药学上可接受的载体、表面活性剂、增强剂和无机化合物可以包含在所述组合物中。此类物质的实例是本领域中已知的。在一些变体中,所述气雾剂基本上不含有机溶剂和抛射剂。此外,水通常不以间水杨酸烟碱的溶剂的形式添加,但在形成期间可以将来自大气的水引入所述气雾剂中,特别是当使空气经过膜时和在冷却过程期间。在其他变体中,所述气雾剂完全不含有机溶剂和抛射剂。在另一个变体中,所述气雾剂完全不含有机溶剂、抛射剂和任何赋形剂。这些气雾剂仅包含纯药物、少于10%的药物降解产物和载气,所述载气通常为空气。通常,所述药物具有小于0.15的分解指数。优选地,所述药物具有小于0.10的分解指数。更具体地,所述药物具有小于0.05的分解指数。最优选地,所述药物具有小于0.025的分解指数。在一些变体中,所述冷凝气雾剂包含至少5重量%的冷凝药物气雾剂颗粒。在其他变体中,所述气雾剂包含至少10重量%、20重量%、30重量%、40重量%、50重量%、60重量%、或75重量%的冷凝药物气雾剂颗粒。在其他变体中,所述气雾剂包含至少95重量%、99重量%、或99.5重量%的冷凝气雾剂颗粒。在一些变体中,所述冷凝气雾剂颗粒包含少于10重量%的热降解产物。在其他变体中,所述冷凝药物气雾剂颗粒包含少于5重量%、1重量%、0.5重量%、0.1重量%或0.03重量%的热降解产物。在本发明的某些实施方案中,所述药物气雾剂具有90%-99.8%、或93%-99.7%、或95%-99.5%、或96.5%-99.2%的纯度。在本发明的某些实施方案中,所述药物气雾剂具有90%-99.8%、或93%-99.7%、或95%-99.5%、或96.5%-99.2%的烟碱游离碱在气雾剂中的百分比。通常,所述气雾剂具有大于106颗粒/ml的数浓度。在其他变体中,所述气雾剂具有大于107颗粒/ml的数浓度。在其他变体中,所述气雾剂具有大于108颗粒/ml、大于109颗粒/ml、大于1010颗粒/ml、或大于1011颗粒/ml的数浓度。所述气雾剂的气体通常为空气。然而,可以使用其他气体特别是惰性气体例如氩、氮、氦等。所述气体还可以包括尚未冷凝以形成颗粒的组合物的蒸汽。通常,所述气体不包括抛射剂或气化的有机溶剂。在一些变体中,所述冷凝气雾剂包含至少5重量%的冷凝药物气雾剂颗粒。在其他变体中,所述气雾剂包含至少10重量%、20重量%、30重量%、40重量%、50重量%、60重量%、或75重量%的冷凝药物气雾剂颗粒。在其他变体中,所述气雾剂包含至少95重量%、99重量%或99.5重量%的冷凝气雾剂颗粒。在一些变体中,所述冷凝药物气雾剂具有约0.01-3μm的mmad。在一些变体中,所述冷凝药物气雾剂具有约0.1-3μm的mmad。在一些变体中,所述冷凝药物气雾剂颗粒的mmad的几何标准差为小于3.0。在其他变体中,所述冷凝药物气雾剂颗粒的mmad的几何标准差为小于2.5,或小于2.0。在本发明的某些实施方案中,所述药物气雾剂包含一种或多种具有至少为5或10的4tsr,至少为7或14的1.5tsr,或至少为9或18的0.5tsr的药物。在本发明的其他实施方案中,所述药物气雾剂包含一种或多种具有5-100或10-50的4tsr,7-200或14-100的1.5tsr,或9-900或18-300的0.5tsr的药物。冷凝气雾剂的形成可以使用任何适合的方法形成本文描述的冷凝气雾剂。一个此类方法涉及组合物的加热以形成蒸汽,随后将蒸汽冷却使得其形成气雾剂(即冷凝气雾剂)。方法先前已描述于美国专利第7,090,830号中。将此参考文献全文援引加入本文。通常,将组合物涂布在基底上,随后将基底加热以使组合物气化。所述基底可以为任何几何形状且为多种不同大小。经常期望的是基底提供大的表面/体积比(例如大于每米100)和大的表面/质量比(例如大于每克1cm2)。所述基底可以具有多于一个表面。一种形状的基底也可以被转化为具有不同性质的另一种形状。例如,0.25mm厚度的平板具有约每米8000的表面/体积比。将所述板辊轧成1cm直径的中空圆筒产生保持原始的板的高表面/质量比但具有较低的表面/体积比(约每米400)的支持物。多种不同物质可以用于构建基底。通常,所述基底为导热的且包括金属(例如铝、铁、铜、不锈钢等)、合金、陶瓷和填充的聚合物。在一个变体中,所述基底为不锈钢。也可以使用物质的组合和物质的经涂布的变体。当期望使用铝作为基底时,铝箔为适合的物质。实例为基于氧化铝和硅的物质bcr171(获自aldrich,st.louis,mo的具有大于2m2/g的给定表面积的氧化铝)和如半导体工业中使用的硅晶片。通常,期望的是基底具有相对少的表面不规则度或基本上不具有表面不规则度。尽管可以使用多种支持物,但具有不可渗透的表面或不可渗透的表面涂层的支持物通常为期望的。此类支持物的示例性实例包括金属箔、光滑的金属表面、无孔陶瓷等。或者,除优选的具有不可渗透的表面的基底以外,基底表面区域的特征在于约20mm2的邻接表面积。或者,除优选的具有不可渗透的表面的基底以外,基底表面区域的特征在于大于约1mm2,优选地10mm2,更优选地50mm2,更优选地100mm2的邻接表面积,和大于0.5g/cc的物质密度。相反地,非优选的基底通常具有小于0.5g/cc的基底密度,例如纱、毛毯或泡沫,或具有小于1mm2/颗粒的表面积,例如氧化铝小颗粒和其他无机颗粒,这是由于在这些类型的表面上难以经由气化产生治疗量的具有小于10%的药物降解的药物气雾剂。在一个变体中,本发明教导了不锈钢箔基底。可以将中空的不锈钢管用作药物-膜基底。在其他变体中,将铝箔用作用于测试药物的基底。所述组合物通常以膜的形式涂布在固体支持物上。可以使用任何适合的方法将膜涂布于固体支持物上。适于涂布的方法通常取决于化合物的物理性质以及期望的膜厚度。在固体支持物上涂布的一个示例性的方法是通过制备化合物在适合的溶剂中的溶液(单独的或与其它期望的化合物组合),将溶液施加至固体支持物的外表面,随后移除溶剂(例如经由气化等)从而在支持物表面上留下膜。常用的溶剂包括甲醇、二氯甲烷、甲基乙基酮、乙醚、丙酮、乙醇、异丙醇、3:1氯仿:甲醇混合物、1:1二氯甲烷:甲基乙基酮混合物、二甲基甲酰胺和去离子水。在一些情况中(例如当使用氨苯喋啶时),期望使用诸如甲酸的溶剂。如必要也可以使用超声以溶解化合物。还可以通过将支持物浸于组合物溶液中,或通过喷涂、刷涂或以其他方式将溶液施加至支持物上而将组合物涂布于固体支持物上。或者,可以制备药物的熔体并将其施加至支持物。对于在室温下为液体的药物,可以将增稠剂与药物混合以允许固体药物膜的施加。根据化合物和期望的热降解的最大量,膜可以为不同厚度。在一个方法中,所述组合物的加热涉及将具有约0.1μm-30μm的厚度的组合物的薄膜加热以形成蒸汽。在另一个变体中,所述组合物具有约0.5μm-21μm的膜厚度。最通常地,气化的膜厚度为0.5μm-25μm。其上涂布有组合物的膜的支持物可以通过多种方式加热以将所述组合物气化。示例性的加热方法包括使电流通过电阻元件、电磁辐射(例如微波或激光)的吸收和放热的化学反应(例如放热的溶剂化,自燃物质的水合和可燃物质的氧化)。通过导电加热而加热基底也是适合的。一个示例性的加热源描述于2003年5月21日申请的美国专利申请ussn60/472,697,self-containedheatingunitanddrug-supplyunitemployingsame中。将其中公开的示例性加热源的描述援引加入本文。热源通常以实现至少200℃,优选地至少250℃,或更优选地至少300℃或350℃的基底温度,并在2秒的时间段内,优选地在1秒的时间段内,或更优选地在0.5秒的时间段内导致药物组合物自基底基本上完全气化的速率将热供应至基底。适合的热源包括优选地在50-500ms内,更优选地在50-200ms的范围内,以足以实现快速加热至例如至少200℃、250℃、300℃或350℃的基底温度的速率提供电流的电阻加热装置。包含在启动(例如通过火花或加热元件例如在若干实施例中描述的类型的闪光灯泡类型的加热器)时经历放热反应的化学反应性物质的热源或装置,以及上述美国专利申请self-containedheatingunitanddrug-supplyunitemployingsame中描述的加热源也是适合的。具体而言,假定热源和基底之间具有良好的热耦合,其中热源的化学“负载”在50-500毫秒或更短的期间被消耗的通过放热反应产生热量的热源通常是适合的。当加热所述组合物的薄膜时,为了避免分解,期望的是气化的化合物应迅速地自加热的表面或周围的加热气体转移至较冷的环境。这不仅可以通过基底的快速加热而完成,而且可以通过使用跨基底表面的气流而完成。尽管源自表面的气化的化合物可以通过brownian运动或扩散转移,但此转移的短暂的持续时间可能受到通过表面的气体的速率梯度和表面的物理性状确立的表面处升温区域的大小影响。通常用于使这样的分解最小化并产生期望的粒径的气体流速在1-10l/分钟的范围内。用于给药的气雾剂颗粒通常可以使用任何所述方法,以大于每秒108个可吸入颗粒的速率形成。在一些变体中,用于给药的气雾剂颗粒以大于每秒109或1010个可吸入颗粒的速率形成。相似地,对于气雾剂形成(即每单位时间由递送装置产生的气雾化的颗粒物质的质量),气雾剂可以大于0.25mg/秒、大于0.5mg/秒、或大于1或2mg/秒的速率形成。此外,对于气雾剂形成,关注于药物气雾剂形成速率(即每单位时间由递送装置以气雾剂的形式释放的药物化合物的速率),药物可以大于每秒0.05mg药物、大于每秒0.1mg药物、大于每秒0.5mg药物、或大于每秒1或2mg药物的速率气雾化。在一些变体中,所述药物冷凝气雾剂由提供至少5重量%的药物冷凝气雾剂颗粒的组合物形成。在其他变体中,所述气雾剂由提供至少10重量%、20重量%、30重量%、40重量%、50重量%、60重量%、或75重量%的药物冷凝气雾剂颗粒的组合物形成。在其他变体中,所述气雾剂由提供至少95重量%、99重量%、或99.5重量%的药物冷凝气雾剂颗粒的组合物形成。在一些变体中,当形成时,所述药物冷凝气雾剂颗粒包含至少10重量%的热降解产物。在其他变体中,当形成时,所述药物冷凝气雾剂颗粒包含少于5重量%、1重量%、0.5重量%、0.1重量%、或0.03重量%的热降解产物。在一些变体中,在以使得所生成的气雾剂具有约0.1-3μm的mmad的速率的气流中制备药物冷凝气雾剂。在一些变体中,所述药物冷凝气雾剂颗粒的mmad的几何标准差为小于3.0。在其他变体中,所述药物冷凝气雾剂颗粒的mmad的几何标准差为小于2.5,或小于2.0。递送装置本文描述的用于给药冷凝药物气雾剂的递送装置通常包含用于加热组合物以形成蒸汽的元件和允许蒸汽冷却由此形成冷凝气雾剂的元件。这些气雾剂通常经由吸入至患者的肺而递送,用于局部或系统治疗。或者,本发明的冷凝气雾剂可以在气流中制备,用于将药物-气雾剂颗粒施用至目标位点。例如,携带药物-气雾剂颗粒的气流可以被施用以治疗急性或慢性皮肤病症,可以在手术期间被施用至切口部位,或可以被施用至开放性伤口。可以将递送装置与包含药物的组合物在单位剂型中组合以用作药盒。本文描述的装置可以额外地包含多个组件以促进气雾剂递送。例如,所述装置可以包含任何本领域中已知的用于控制药物气雾化相对于吸入的定时(例如呼吸-启动)的组件。相似地,所述装置可以包含为患者提供关于吸入速率和/或体积的反馈的组件,或用于防止过量使用(即“锁定”特征)的组件。所述装置还可以包含特征例如剂量计数/记录或逐渐降低方法。此外,所述装置还可以包含用于防止被未经授权的个体使用的组件,和用于记录给药历史的组件。这些组件可以单独使用或与其他组件组合使用。额外地,所述装置可以包含允许烟碱剂量逐渐降低的特征。允许冷却的元件可以为任何构造。例如,其可以为将加热工具与吸入工具连接的惰性通道。相似地,允许被使用者吸入的元件可以为任何构造。例如,其可以为在冷却元件和使用者的呼吸系统之间形成连接的出口。通常,将供药物体加热至足以将所有膜或膜的一部分气化的温度,使得所述组合物形成蒸汽,其在吸入期间变得被携带于气流中。如上所述,可以使用例如嵌于或插入于基底中并且连接至置于外壳中的电池的电阻丝完成供药物体的加热。如本领域中公知的,可以例如使用外壳上的按钮或经由呼吸启动而启动加热。可以用于形成并递送本文所述的气雾剂的另一个装置如下所述。所述装置包含用于加热组合物以形成蒸汽的元件、和允许蒸汽冷却由此形成冷凝气雾剂的元件、和允许使用者吸入气雾剂的元件。所述装置还包含彼此匹配的上部外壳部件和下部外壳部件。各外壳部件的下游末端缓缓地逐渐变细,以插入使用者的口中。上部和下部外壳部件的上游末端开槽(其中之一开槽或两者均开槽),以当使用者吸入时提供空气进入。当彼此匹配时,上部和下部外壳部件限定室。供药单元置于室中。固体支持物可以为任何期望的构造。基底表面的至少一部分涂布有组合物膜。在铝热剂类型的加热源的情况中,基底的内部区域包含适于产生热的物质。所述物质可以为固体化学燃料、放热地混合的化学试剂、电阻丝等。电源供应(如果加热需要)和吸入装置需要的任何阀门可以被包含入最终的块中。电源供应可以为与供药单元匹配的块。在使用的装置的一个变体中,所述装置包含药物组合物递送物体,其包含基底、在基底上的所选药物组合物的膜、和用于以有效地将基底加热至高于200℃的温度或在其他实施方案中加热至高于250℃、300℃或350℃的温度并在2秒或更少的时间段内导致药物组合物的基本上完全的气化的速率将热供应至基底的热源。其他供药物体可以与本文描述的装置组合使用。各种涂布方法是本领域公知的和/或已在以上描述。示例性的加热元件以电阻丝的形式示出,当电流流经时其产生热,但如上所述,多种不同的加热方法和相应的装置是可接受的。例如,可接受的热源可以快速地获得足以完全地将组合物自支持物表面气化的温度的速率将热供至供药物体。例如,在2秒的时间段内实现200℃-500℃的温度的热源是通常的,但应理解的是所选的温度将取决于组合物的气化性质,但通常被加热至至少约200℃,优选地至少约250℃,更优选地至少约300℃或350℃的温度。加热基底产生药物组合物蒸汽,其在存在流动气体的条件下产生在期望的大小范围内的气雾剂颗粒。气流的存在通常在加热基底之前,加热基底的同时,或在加热基底之后。在一个实施方案中,将基底加热少于约1秒,更优选地少于约500毫秒,更优选地少于约200毫秒的时间段。药物-气雾剂颗粒被个体吸入以递送至肺。所述装置还可以包含置于固体支持物上游的气流控制阀,其用于限制通过冷凝区域的气流速率。所述气流阀可以例如包括与室相连的入口,以及经适配以递送或限制逐渐增加的离开所述入口的气流的可形变折翼,跨阀门的压降逐渐增加。相似地,所述气流阀可以包括启动开关。在此变体中,阀移动会响应跨阀门的气压差,其例如可以起作用以关闭开关。所述气流阀也可以包括经设计用于限制进入室的气流速率的孔。所述装置还可以包含与在单元下游的室相连的旁通阀,当使用者将空气抽入室时用于抵消由气流控制阀产生的气流下降。以此方式,所述旁通阀可以与气流控制阀配合以控制通过室的冷凝区域的气流以及被通过装置抽入的空气的总量。因此,在此变体中,通过装置的总气流体积应为通过气流控制阀的气流体积和通过旁通阀的气流体积之和。所述气流控制阀可以例如起作用以将被抽入装置的空气限制在预先选择的水平,例如15l/分钟。以此方式,可以预先选择并生成用于产生具有期望的大小的颗粒的气流。例如,一旦达到此选择的气流水平,则被抽入装置的额外的空气将产生跨旁通阀的压降,其继而将调节通过旁通阀进入邻近使用者的口腔的装置的下游末端的气流。由此,使用者感觉到被抽入的全部呼吸,其中两个阀门将全部气流在期望的气流速率和旁通气流速率之间分配。这些阀可以用于控制通过室的冷凝区域的气体速率,并因此控制产生的气雾剂颗粒的粒径。通常,气流越快,颗粒越小。因此,为了获得更小的或更大的颗粒,可以通过调整气流控制阀以增加气流体积流速从而改变通过室的冷凝区域的气体速率。例如,为了产生大小为约1-3.5μmmmad的冷凝颗粒,具有基本上平滑的表面壁的室会具有1-10l/分钟的经选择的气流速率。此外,如本领域技术人员将理解的那样,可以通过改变室冷凝区域的横截面以增加或减少对于给定体积流速的线性气体速率和/或在室内产生湍流的结构的存在与否而改变粒径。因此,例如为制备大小为10-100nmmmad的冷凝颗粒,室可能提供用于在冷凝室内建立空气湍流的气流屏障。这些屏障通常置于距基底表面千分之几英寸的距离内。粒径在以下详细讨论。药物组合物膜厚度通常,涂布在固体支持物上的药物组合物膜具有0.05-30μm的厚度,通常为0.1-30μm的厚度。更通常地,厚度为0.2-30μm;甚至更通常地,厚度为0.5-30μm,最通常地,厚度为0.5-25μm。对于任何给定的药物组合物,期望的膜厚度通常通过文献中的方法测定,其中冷凝气雾剂组合物的期望的收率和纯度经选择或是已知的。例如,如果颗粒的纯度小于期望值,或如果收率百分比小于期望值,则将药物膜的厚度调节至与初始的膜厚度不同的厚度。随后,在经调节的膜厚度下测定纯度和收率,且重复此过程直至获得期望的纯度和收率。在选择适合的膜厚度之后,测定为提供治疗有效剂量而需要的基底的面积。一般地,给定药物组合物的膜厚度使得通过由加热基底使所述药物组合物气化和将蒸汽夹带入气流中从而形成的药物-气雾剂颗粒:(i)具有10重量%或更少,更优选地5重量%或更少,最优选地2.5重量%或更少的药物降解产物,和(ii)为膜中包含的药物组合物的总量的至少50%。如下所述,选择在其上形成药物组合物膜的基底的面积以获得药物气雾剂的有效的人治疗剂量。为了测定药物膜的厚度,可以使用的一个方法是测定基底的面积并使用以下等式计算药物膜厚度:膜厚度(cm)=药物质量(g)/[药物密度(g/cm3)x基底面积(cm2)]可以通过在药物膜的形成之前和之后称量基底或通过提取药物并分析地测量而测定药物质量。药物密度可以通过本领域技术人员公知的多种技术试验地测定或在文献或参考书中例如crc中找到。如果不知道实际的药物密度,则对单位密度的假设是可接受的。将具有已知厚度的药物膜的基底加热至足以产生热气的温度。回收所有或一部分热气并分析药物降解产物的存在,以测定热气中气雾剂颗粒的纯度。在膜厚度和气雾剂颗粒纯度之间具有明显的关系,而膜厚度减少,纯度增加。除了对提供包含10%或更少药物降解产物(即90%或更高的气雾剂颗粒纯度)的气雾剂颗粒的药物膜厚度进行选择以外,对膜厚度进行选择使得当将基底加热至足以使膜气化的温度时膜中包含的药物组合物的总量的至少约50%被气化。为了获得更高纯度的气雾剂,可以涂布较少量的药物,获得较薄的待加热膜,或者使用相同量的药物但使用较大的表面积。如上所讨论的,一般地,除了厚度极薄的药物膜以外,膜厚度的线性降低与纯度的线性降低相关。因此,对于其中随膜厚度增加(特别是在大于0.05-30微米的厚度下)气雾剂显示出增加水平的药物降解产物的药物组合物,基底上的膜厚度通常为0.05至30微米,例如允许颗粒气雾剂的形成且药物降解少于5%的范围之内的最大厚度或接近最大厚度。另一个方法预期了通过在受控的惰性气体例如氩、氮、氦等的气氛下形成热气而生成具有期望的药物组合物纯度水平的药物-气雾剂颗粒。一旦已获得期望的纯度或产率,或期望的纯度和产率可以由测定的气雾剂纯度相对膜厚度的图和相应的膜厚度估算,则确定提供治疗有效剂量所需的基底的面积。基底面积如上所述,选择基底表面的表面积使得其足以产生治疗有效的剂量。提供治疗剂量的药物的量一般是本领域已知的并在以下更详细地描述。以上讨论的所需剂量和选择的膜厚度根据以下关系确定需要的最小基底面积:膜厚度(cm)x药物密度(g/cm3)x基底面积(cm2)=剂量(g)或者基底面积(cm2)=剂量(g)/[膜厚度(cm)x药物密度(g/cm3)]可以通过在药物膜的形成之前和之后称量基底或通过提取药物并分析地测量而测定药物质量。药物密度可以通过多种公知的技术试验地测定或可以在文献或参考书中例如crc中找到。如果不知道实际的药物密度,则对单位密度的假设是可接受的。为了制备能够给药有效的人治疗剂量的包含在导热基底上的药物膜的供药物体,使用上述关系确定最小基底表面积以确定会产生治疗剂量的药物气雾剂的用于所选膜厚度的基底面积。在一些变体中,选择的基底表面积为约0.05-500cm2。在其他变体中,表面积为约0.05-300cm2。在一个实施方案中,基底表面积为0.05-0.5cm2。在一个实施方案中,基底表面积为0.1-0.2cm2。自供药物体递送的药物的实际剂量(即,百分比收率或百分比释放)与其他因素一起将取决于在加热基底时气化的药物膜的百分比。因此,对于在加热100%药物膜时生成具有100%药物纯度的气雾剂颗粒的药物膜,以上给出的剂量、厚度和面积与提供至使用者的剂量直接相关。随着百分比收率和/或颗粒纯度降低,可以根据需要调节基底面积,以提供期望的剂量。此外,如本领域技术人员会认识到的,对于具体膜厚度,除了最小计算面积以外的较大基底面积可以用于递送治疗有效剂量的药物。此外,如本领域技术人员能够理解的那样,如果选择的表面积超过对于由选择的膜厚度递送治疗剂量所需的最小值,则膜无需涂布整个表面积。含药物的气雾剂的剂量所述气雾剂中给药的药物的剂量指通过在限定的条件下加热药物、冷却因而产生的蒸汽、并递送所生成的气雾剂而生成的单位剂量量。“单位剂量量”为在给定体积的吸入的气雾剂中的药物的总量。单位剂量量可以通过收集气雾剂并如本文所述分析其组成,并且将气雾剂的分析结果与包含已知量的药物的一系列参考标准的分析结果比较而确定。在用于以气雾剂的形式递送的起始组合物中所需的一种或多种药物的量取决于当被加热时进入热蒸汽相的一种或多种药物的量(即由一种或多种起始药物产生的剂量)、一种或多种气雾剂药物的生物利用度、患者吸入的体积、以及一种或多种气雾剂药物的效力作为血浆药物浓度的函数。人们可以使用诸如动物实验和剂量关系(i/ii期)临床试验的方法确定用于治疗具体病症的含药物气雾剂的适合的剂量。这些实验也可以用于评价气雾剂的可能的肺毒性。一个动物实验涉及在动物暴露于气雾剂之后测量动物中的药物的血浆浓度。哺乳动物例如犬类或灵长类通常地用于这样的研究中,这是由于它们的呼吸系统与人类的呼吸系统相似且它们为人类通常地提供准确的测试结果的外推。对于在人类中的测试,初始的剂量水平一般小于或等于哺乳动物模型中的剂量,其结果是在与人类中的疗效相关的血浆药物水平。随后在人类中进行剂量增加,直至获得优化的治疗反应或遇到限制剂量的毒性。对于具体的患者,实际的有效量可能根据被使用的具体药物或其组合,配制的具体组合物,给药模式和患者的年龄、体重和病症,以及受治疗的发病期的严重性而改变。粒径到达肺的有效的气雾剂递送要求颗粒具有某些穿透和沉降或扩散特性。深入肺部的沉积通过重力沉降而发生,且药物颗粒具有以总气体动力学中位数直径(mmad)定义的有效沉降大小,通常为1-3.5μm。对于较小的颗粒,通过扩散过程发生深入肺部的沉积,需要具有10-100nm,通常20-100nm的粒径。用于深入肺部的递送的吸入药物递送装置应产生具有在这两种大小范围内之一内的,优选地为0.1-3μmmmad的颗粒的气雾剂。通常地,为了产生具有期望的mmad的颗粒,以某流速使气体或空气经过固体支持物。在冷凝阶段期间,气雾剂的mmad随时间增加。通常地,在本发明的标题中,由于蒸汽通过与载气接触而被冷却从而冷凝,mmad在0.01-3微米的大小范围内增加,随后由于气雾剂颗粒彼此碰撞并且凝聚成较大的颗粒而进一步增加。最通常地,在小于1秒内,mmad由<0.5微米生长至>1微米。由此,通常地,在冷凝成颗粒之后,冷凝气雾剂mmad立即每秒至少翻倍一次,通常每秒至少2、4、8、或20次。在其他变体中,mmad在0.1-3微米的大小范围内增加。通常,流速越高,形成的颗粒越小。因此,为了获得较小的或较大的颗粒,可以改变通过递送装置的冷凝区域的流速。通过以使得当混合物的数浓度达到约109颗粒/ml时获得期望粒径的比例将化合物以其气态混入某体积的载气中,从而获得期望的粒径。随后,此数浓度下的颗粒生长足够慢,使得在单独的深吸的情况下认为粒径是“稳定的”。这可以通过例如改变气流控制阀以增加或降低体积空气流速而实现。例如,在0.1-3μmmmad大小范围内的冷凝颗粒可以通过将气化药物的蒸汽流速选择为在1-10l/分钟的范围内,优选地在2-8l/分钟的范围内而产生。此外,如本领域技术人员会理解的那样,可以通过改变室冷凝区域的横截面以增加或减少对于给定的体积流速的线性蒸汽速率而改变粒径。此外,还可以通过在室内产生湍流的结构的存在与否而改变粒径。因此,例如为制备在大小范围10-100nmmmad内的冷凝颗粒,室可能提供用于在冷凝室内建立空气湍流的气流屏障。这些屏障通常置于距基底表面千分之几英寸的距离内。含药物的气雾剂的分析可以使用多种不同方法测定含药物的气雾剂的纯度。应注意的是,当使用术语“纯度”时,其指气雾剂的百分比减去此形成中产生的副产物的百分比。副产物例如为在气化期间产生的那些不期望的产物。例如,副产物包括热降解产物以及一种或多种活性化合物的任何不期望的代谢物。适于测定气雾剂纯度的方法描述于sekine等,journalofforensicscience32:1271-1280(1987)和martin等,journalofanalytictoxicology13:158-162(1989)中。一个适合的方法涉及使用捕捉器。在此方法中,在捕捉器中收集气雾剂,以测定副产物的百分比或分数。可以使用任何适合的捕捉器。适合的捕捉器包括过滤器、玻璃棉、撞击器、溶剂捕捉器、冷阱等。过滤器通常是最期望的。随后,通常地使用溶剂例如乙腈提取捕捉器,并通过本领域中已知的多种分析方法中的任意方法对提取物进行分析,例如气相、液相和高效液相色谱特别有用。气相或液相色谱方法通常包括检测器系统例如质谱检测器和紫外吸收检测器。理想地,检测器系统允许测定药物组合物的组分以及副产物组分的量(重量)。这在实践中通过测量对药物组合物或副产物的组分(标准品)的一个或多个已知的质量进行分析时获得的信号并随后将对气雾剂进行分析时获得的信号与在对标准品进行分析时获得的信号进行比较而实现,这是本领域公知的方法。在许多情况中,副产物的结构可能不是已知的或其标准可能无法获得。在这样的情况中,可以通过假定副产物具有与药物组合物中的一种或多种药物组份相同的响应系数(例如对于紫外吸收检测,具有相同的消光系数)而计算重量分数。当进行这样的分析时,通常地将存在的小于药物化合物的极小的分数,例如小于药物化合物的0.1%或0.03%,的副产物排除。由于在计算副产物的重量百分比时经常需要假设药物和副产物之间的响应系数相同,因此经常更期望使用其中这样的假设具有高有效性可能性的分析方法。就此而言,具有通过在225nm处的紫外光吸收检测的高效液相色谱通常是期望的。在其中化合物的吸收在250nm处更强的情况中或本领域技术人员由于其他原因将认为在250nm下检测是使用hplc分析估测重量纯度的最适合的方式时,在250nm处的uv吸收可以用于化合物的检测。在其中通过uv分析药物不可行的某些情况中,其他分析工具例如gc/ms或lc/ms可以用于测定纯度。改变在其中发生组合物气化的气体也可能影响纯度。其他分析方法也可以使用本领域中任何适合的方法(例如多级撞击)测定含药物的气雾剂的粒径分布。通过进气孔口(usp进气孔口,mspcorporation,shoreview,mn)与气化装置连接的nextgenerationcascadeimpactor(mspcorporation,shoreview,mn)是用于多级撞击研究的一个系统。可以例如通过经由吸入装置将含药物的气雾剂递送入受限的室并测量室中收集的质量而测定可吸入气雾剂质量密度。通常地,通过在装置和室之间具有压力梯度而将气雾剂抽入室中,其中室的压力低于装置的压力。室的体积应与吸入患者的吸入体积近似,通常地为约2-4升。可以例如通过经由吸入装置将含药物的气雾剂递送入受限的室并测量室中收集的活性药物化合物的量而测定可吸入气雾剂质量密度。通常地,通过在装置和室之间具有压力梯度而将气雾剂抽入室中,其中室的压力低于装置的压力。室的体积应与吸入患者的吸入体积近似,通常地为约2-4升。通过提取室,对提取物进行色谱分析并将色谱分析的结果与含已知量的药物的标准品的结果进行比较,从而测定室中收集的活性药物化合物的量。可以例如通过经由吸入装置将气雾剂相药物递送入受限的室并测量室中收集的给定大小的颗粒的数目而测定可吸入的气雾剂颗粒浓度。给定大小的颗粒的数目可以直接地基于颗粒的光散射性质测量。或者,给定大小的颗粒的数目可以通过测量给定的大小范围内的颗粒的质量并如下基于质量计算颗粒的数目而测定:颗粒的总数目=各大小范围内的颗粒的数目的总和(由大小范围1至大小范围n)。给定的大小范围内的颗粒的数目=所述大小范围内的质量/所述大小范围内的通常的颗粒的质量。给定的大小范围内的通常的其中d为所述大小范围内的典型的粒径(一般地,限定所述大小范围的平均边界mmad,微米),为颗粒密度(g/ml),且质量以皮克的单位(g-12)给出。可以例如通过经由吸入装置将气雾剂相药物递送入受限的室中而测定可吸入的气雾剂颗粒形成的速率。递送持续设定的时间段(例如3秒),且如上所述测定在室中收集的给定大小的颗粒的数目。颗粒形成的速率等于收集的10nm-5微米颗粒的数目除以收集时间的持续时间。可以例如通过经由吸入装置将气雾剂相药物递送入受限的室中而测定气雾剂形成的速率。递送持续设定的时间段(例如3秒),且通过在颗粒物质的递送之前和之后称量受限的室而测定收集的颗粒物质的质量。气雾剂形成的速率等于室中的质量的增加除以收集时间的持续时间。或者,当递送装置或其组件的质量变化仅能通过气雾剂相颗粒物质的释放而发生时,颗粒物质的质量可以等同于在气雾剂的递送期间装置或组件的质量损失。在此情况中,气雾剂形成的速率等于递送事件期间装置或组件的质量的减少除以递送事件的持续时间。可以例如通过在设定的时间段(例如3秒)内经由吸入装置将含药物的气雾剂递送至受限的室中而测定药物气雾剂形成的速率。当气雾剂为纯药物时,如上所述测量室中收集的药物的量。药物气雾剂形成的速率等于室中收集的药物的量除以收集时间的持续时间。当含药物的气雾剂包含药学上可接受的赋形剂时,将气雾剂形成的速率乘以气雾剂中药物的百分比得到药物气雾剂形成的速率。药盒在本发明的实施方案中,提供了供卫生保健提供者(或更具体地,患者)使用的药盒。用于递送冷凝气雾剂的药盒通常地包括含药物的组合物以及用于形成冷凝气雾剂的装置。组合物通常没有溶剂和赋形剂,且一般地包含热稳定的药物。用于形成冷凝气雾剂的装置通常地包含经设置用于加热组合物以形成气的元件、允许气冷凝以形成冷凝气雾剂的元件、和允许使用者吸入冷凝气雾剂的元件。药盒中的装置还可以包括特征例如呼吸-启动或锁定元件或剂量计数/记录或逐渐降低装置。示例性的药盒应提供手持的气雾剂递送装置和至少一个剂量。在另一个实施方案中,提供包含间水杨酸烟碱的薄膜和用于以冷凝气雾剂的形式分配所述薄膜的装置的用于递送烟碱气雾剂的药盒。组合物可以包含药物赋形剂。用于以气雾剂的形式分配所述药物组合物的膜的装置包含经设置以加热膜以形成蒸汽的元件和允许气冷凝以形成冷凝气雾剂的元件。在本发明的药盒中,通常地以薄膜的形式在通过热源加热的基底上涂布组合物,一般地以约0.5-30微米的厚度。热源通常以能够获得至少200℃,优选地至少250℃,或更优选地至少300℃或350℃的基底温度并在2秒的时间段内,优选地在1秒的时间段内,或更优选地在0.5秒的时间段内导致药物组合物自基底基本上完全气化的速率将热供应至基底。为了防止药物降解,优选的是当药物膜在基底上时热源不将基底加热至高于600℃的温度以防止。更优选地,热源不将基底加热至超过500℃的温度。本发明的药盒可以包括多种烟碱和药物递送装置的组合。在一些实施方案中,装置可以与另一种药物一起存在。其它药物可以口服给药或局部给药。一般地,药盒中包括使用说明。在某些实施方案中,可以将间水杨酸烟碱的薄膜用于提供多剂量的在带盘或带卷上提供的烟碱。例如,带可以包含多个供药单元,各供药单元包含其上放置有包含间水杨酸烟碱的薄膜的热包。各热包可以包括可以例如通过电阻加热或冲击而被点燃的引发剂组合物,和能够提供足以选择性地将间水杨酸烟碱气化的快速的高温热脉冲的燃料。各加热包可以沿带长度具有一定的空间间隔。在使用期间,可以将一个或多个热包置于气道中,并且当空气流经气道时,热包可以被激活以选择性地气化间水杨酸烟碱。气化的烟碱可以在气流中冷凝以形成包含烟碱的气雾剂,其随后可以被使用者吸入。带可以包含多个薄膜,其限定放置引发剂组合物、燃料和包含间水杨酸烟碱的薄膜的区域。多个层中的某些可以另外提供未填充的体积,用于释放的蒸汽聚集以使得压力累积最小化。所述多个层可以由能够提供机械支持且在加热包达到的温度下不会明显地化学分解的机械支持物。在某些实施方案中,层可以包括金属或聚合物例如聚酰亚胺、氟聚合物、聚醚酰亚胺、聚醚酮、聚醚砜、聚碳酸酯或其他耐高温聚合物。在某些实施方案中,带可以另外包括经放置以物理地和/或环境地保护药物的上层和下层。所述上保护层和下保护层可以包括例如金属箔、聚合物,或可以包括包含金属箔和聚合物的多层。在某些实施方案中,保护层可能显示出对于氧、水汽和/或腐蚀性蒸汽的低渗透性。全部保护层或保护层的一部分可以在使用前被移除,以暴露药物和燃料。引发剂组合物和燃料组合物可以包含例如任何以上公开的那些。薄膜热包和带、碟、或其他基本上平面的结构形式的供药单元可以为提供物质的大量剂量提供简洁的且可制造的方法。在某些治疗中,例如在给药烟碱以治疗烟碱渴求和/或实现戒烟中,以低成本提供大量的剂量可能是特别有用的。本发明提供了实施药物递送和药物中断控制的技术。在药物为烟碱、间水杨酸烟碱或其他与烟碱有关的药物的情况中,可以提供具有与香烟或雪茄相似的规格的药物递送系统。在香烟或雪茄-形状的药物递送装置内,线圈排列、箔排列、或电阻触点排列可能形成至电源的电路通道。各线圈、箔或电阻触点可以涂布有基于烟碱的药物,或可以与涂布有基于烟碱的药物的基底热接触。控制装置可能无线地与香烟或雪茄-形状的药物递送装置交互,以在药物的使用中无线地控制或管理基于烟碱的药物的递送和控制中断。在某些实施方案中,本发明教导了药物递送和药物中断系统,包括:便携控制装置,包含使用者输入装置的第一无线收发器、第二无线收发器、处理器、内存装置、和网络交互装置;药物递送装置,包含第三无线收发器、给药控制装置、药物有效载荷、和给药递送装置;和一个或多个使用者传感器,各自与使用者的身体的一部分接触,所述一个或多个使用者传感器中的每一个都包含第四无线收发器和一个或多个测量传感器,所述一个或多个测量传感器包含血氧仪、脉冲测量传感器、呼吸速率传感器或血压传感器中的一个或多个。使用者输入装置接收来自使用者的使用者输入以控制至使用者的身体的药物递送并控制药物中断;药物有效载荷包含经设置以包含对于一个或多个剂量而言充足的药物量;处理器基于经由第二和第四无线接收器传送至便携控制装置的一个或多个使用者输入、一个或多个与药物递送和药物中断相关的预设的指令、或一个或多个来自一个或多个测量传感器的测量结果,经由第一和第三无线收发器与药物递送装置通讯以将第一指令发送至给药控制装置;给药控制装置基于来自处理器的第一指令确定对于各给药将制备的药物的量,并将第二指令发送至药物递送装置以制备和递送用于各给药的递送的确定量的药物;给药递送装置基于来自给药控制装置的第二指令将药物自药物有效载荷递送至使用者;内存装置储存使用系统的药物递送的历史,药物递送的历史包括以下中的一个或多个:在每次给药前的一个或多个测量结果、对于各预先确定的时间段的药物剂量、药物剂量的增加、药物剂量的减少、对于各预先确定的时间段的给药数、对于各预先确定的时间段的给药数的增加、对于各预先确定的时间段的给药数的减少、由使用者引起的药物递送撤销数、由使用者引起的药物递送撤销类型、或与使用者相关的主治医师的联系信息;网络交互通过网络与主治医师的计算装置通讯地连接,以将药物递送的历史发送至主治医师并接受来自主治医师的给药处方。本发明还教导了药物递送和药物中断系统,包括:便携药物递送装置,包含药物有效载荷、给药递送装置、和第一无线收发器;便携控制装置,包含第二无线收发器,便携控制装置经由第一无线收发器和第二无线收发器与便携药物递送装置无线通讯;便携药物递送装置经设置以基于自便携控制装置接收的指令将药物递送至使用者的身体。药物递送装置的进一步的特征可以在于其中便携药物递送装置为基于气的药物递送装置。本发明进一步教导了药物递送和药物中断系统,其中便携药物递送系统还包括呼吸启动器和锁定单元,其中呼吸启动器经设置以基于使用者已自便携药物递送装置吸入的判断导致给药递送装置自药物有效载荷递送补充剂量的药物,且其中锁定单元经设置以基于补充剂量将超过对于预先确定的时期预先确定的最大的药物剂量的判断在预先确定的时期期间防止呼吸启动器导致给药递送装置递送补充剂量的药物。药物递送和药物中断系统的进一步的特征可以在于其中呼吸启动器经设置以基于使用者已自便携药物递送装置吸入的判断导致给药递送装置自药物有效载荷递送补充剂量的药物,而不接收来自便携控制装置且与任何预设的给药计划相反的指令。药物递送和药物中断系统的进一步的特征可以在于其中药物有效载荷包括一个或多个涂布有药物的箔,其中给药递送装置包括加热器,其经设置以在小于2秒内将各箔的一部分或各箔的整个表面加热至至少200摄氏度。药物递送和药物中断系统的进一步的特征可以在于其中所述加热器经设置以在小于0.5秒内将各箔的一部分或各箔的整个表面加热至至少300摄氏度。药物递送和药物中断系统的进一步的特征可以在于其中药物有效载荷包括多个串联连接的电阻线圈和多个连接至地线的保险丝,各保险丝将各线圈与串联中的下一个邻近的线圈隔开,其中多个线圈中的每一个都涂布有药物,其中给药递送装置包括电源,其经设置以在小于2秒内将各线圈加热至至少200摄氏度,其中建立由电源至多个串联的线圈至地线的电路通道,各保险丝限定各线圈与串联中的下一个邻近的线圈之间的短路通道,且其中电源进一步经设置以发送短电流爆发以导致最接近电源的未失效保险丝的失效,由此允许串联中的下一个邻近的线圈通过电源通电。药物递送和药物中断系统的进一步的特征可以在于其中药物有效载荷包括包含多个串联连接的线圈的薄膜结构和多个与薄膜结构的地线部分连接的保险丝,各保险丝将各线圈与串联中的下一个邻近的线圈隔开,其中多个线圈中的每一个都涂布有药物,其中给药递送装置包括电源,其经设置以在小于2秒内将各线圈加热至至少200摄氏度,其中建立由电源至多个串联的线圈至地线的电路通道,各保险丝限定各线圈与串联中的下一个邻近的线圈之间的短路通道,且其中电源进一步经设置以发送短电流爆发以导致最接近电源的未失效保险丝的失效,由此允许串联中的下一个邻近的线圈通过电源通电。药物递送和药物中断系统的进一步的特征可以在于其中薄膜结构具有以下整体形状之一:卷成楔形式的平线圈、卷成管形式的平线圈、或平面结构。药物递送和药物中断系统的进一步的特征可以在于其中便携药物递送装置为基于透皮的药物递送装置。药物递送和药物中断系统的进一步的特征可以在于其中药物有效载荷包括含液体形式的药物的液体储库,其中给药递送装置包括可变渗透性膜和膜启动器,所述可变渗透性膜经设置以基于来自膜启动器的控制信号改变液体渗透性,以自液体储库递送不同量的药物。药物递送和药物中断系统的进一步的特征可以在于其中药物有效载荷包括置于包含第一组多个排和第一组多个列的第一网格中的多个箔,各箔涂布有药物且各箔通过不导电或不导热的物质彼此分离,其中药物递送装置包括第一组开关、第二组开关、与第一组开关中的每一个电连接的电源、与第二组开关中的每一个电连接的电接地路径、置于包含第二组多个排和第二组多个列的第二网格中的多个启动器、第一组多个线性电路径、第二组多个线性电路径,其中对于第二组多个列中的每一列,由第一组开关中的一个至置于第二组多个列中的目标列中的多个启动器中的每一个建立第一电路径,其中对于第二组多个行中的每一行,由第二组开关中的一个至置于第二组多个行中的目标行中的多个启动器中的每一个建立第二电路径,其中排列于第一网格中的多个箔与排列于第二网格中的多个启动器对准,以实现与其直接接触。药物递送和药物中断系统的进一步的特征可以在于其中多个启动器中的每一个均包括经设置以通过施加预定量的电流二在小于2秒内达到至少200摄氏度的温度的电阻元件,其中置于第一网格中的多个箔中的每一个都单独地通过以下加热:关闭第一组开关之一和关闭第二组开关之一由此使得目标电阻元件与所述第一组开关之一和所述第二组开关之一电连接,继而加热与目标电阻元件直接接触的多个箔中的目标箔。药物递送和药物中断系统的进一步的特征可以在于其中药物递送装置进一步包括与使用者的身体物理接触的膜,其中通过目标箔加热的药物以蒸汽或液体之一的形式流经待被通过使用者的身体的皮肤部分吸收的膜。药物递送和药物中断系统的进一步的特征可以在于其中第一组和第二组开关中的各开关均为晶体管。本发明教导了药物递送和药物中断系统,进一步包括:一个或多个使用者传感器,每一个均与使用者的身体的一部分接触,一个或多个使用者传感器中的每一个均包含第三无线收发器和一个或多个测量传感器,所述一个或多个测量传感器包含一个或多个血氧仪、脉搏测量传感器、呼吸速率传感器、或血压传感器,其中便携药物递送装置经设置以基于自便携控制装置接受的指令和基于经由第三无线收发器自一个或多个测量传感器接收的测量结果将药物递送至使用者的身体。本发明教导了药物递送和药物中断系统,其中所述便携控制装置还包括内存装置的网络交互,其中内存装置经设置以储存使用系统的药物递送的历史,药物递送的历史包括以下中的一个或多个:对于各预先确定的时间段的药物剂量、药物剂量的增加、药物剂量的减少、对于各预先确定的时间段的给药数、对于各预先确定的时间段的给药数的增加、对于各预先确定的时间段的给药数的减少、由使用者引起的药物递送撤销数、由使用者引起的药物递送撤销类型、或与使用者相关的卫生保健专家的联系信息;其中网络交互通过网络与卫生保健专家的计算装置通讯地连接,以将药物递送的历史发送至卫生保健专家并接受来自卫生保健专家的给药处方。本发明教导了药物递送和药物中断方法,包括:提供包括以下的药物递送和药物中断系统:便携药物递送装置,包含药物有效载荷、给药递送装置、和第一无线收发器;便携控制装置,包含第二无线收发器,便携控制装置经由第一无线收发器和第二无线收发器与便携药物递送装置无线通讯;基于自所述便携控制装置接收的指令,通过所述药物递送装置将储存于药物有效载荷中的药物剂量递送至使用者的身体。药物递送和药物中断方法的进一步的特征可以在于包括:在便携控制装置处接收包括基于使用者输入的指令、基于预设的给药的指令、或通过网络经由卫生保健专家的电脑装置的来自卫生保健专家的指令中的至少一个指令的第二指令,其中第一指令基于第二指令;并且在便携药物递送装置处接收来自便携控制装置的第一指令。本发明教导了药物递送和药物中断装置,包括:处理器;非暂时性计算机可读介质,其具有储存于其上的包含一组指令的电脑软件,当被处理器执行时,其导致装置实施一个或多个功能,所述一组指令包括:用于基于自包括第二无线收发器的便携控制装置接收的第一指令,通过包含药物有效载荷、给药递送装置、和第一无线收发器的便携药物递送装置将储存于药物有效载荷中的药物剂量递送至使用者的身体的指令,便携控制装置经由第一无线收发器和第二无线收发器与便携药物递送装置无线通讯。药物递送和药物中断装置的进一步的特征可以为,其中所述一组指令还包括:接收包括以下指令中的至少一个的第一组给药指令的指令:基于使用者输入的给药指令、基于预设的给药的给药指令、或通过网络经由卫生保健专家的电脑装置的来自卫生保健专家的给药指令;以及在便携药物递送装置处接收来自便携控制装置的第一指令的指令。本发明的各实施方案应也包括权利要求中所述的各要素的排列,如同各从属权利要求为引入各先前的从属权利要求以及独立权利要求的限定的多重引用权利要求。这样的排列明确地处于本发明的范围内。尽管已参考多个实施方案具体地显示和描述了本发明,但本领域技术人员应理解可以对本文公开的各实施方案进行形式和细节的变化,而不脱离本发明的精神和范围,并且本文公开的各实施方案并非意图其对于本发明的限制作用。本文引用的所有参考文献均全文援引加入本文。实施例以下实施例仅为说明的目的提供,并非意图限制本发明的范围。实施例1间水杨酸烟碱的合成:将1.385g间水杨酸(sigmaaldrich)溶于25ml乙醇。在室温下滴加1.62g烟碱并充分混合约30分钟。将溶液缓慢地转转蒸发以将体积降低至约10ml。随后添加5ml乙酸乙酯并搅拌3-5分钟。将溶液置于干冰上,持续约1.5小时,这产生粘性的固体物质。在将溶剂蒸发后,添加20ml乙醇以溶解所述粘性的固体,随后蒸发。此用于纯化晶体的重结晶是本领域公知的。晶体固体保留在烧瓶中。将粉末自烧瓶移除并在40℃下在真空箱中干燥。回收2.6克(约87%收率)。固体的熔点为125℃。实施例2间水杨酸烟碱的合成:将液体烟碱(alfaaesar,批次#10150504,纯度99%)和间水杨酸(3-羟基苯甲酸,sigmaaldrich,批次#stbb7747,纯度99%)以1:1的烟碱:酸比例用于合成间水杨酸烟碱。以下合成途径获得60-70%的通常收率和99.7%纯度。样品合成:1.将0.03摩尔间水杨酸(~4.16g)溶于65ml乙醇(200标准酒精度),并充分混合约20分钟。2.将0.03摩尔液体烟碱(~4.86g)滴加至上述溶液,在搅拌盘上混合30-40分钟,伴随定期的振荡。随后添加间水杨酸烟碱的籽晶,并将溶液再搅拌40分钟,随后置于干冰上,持续约40分钟。3.过滤并使用100%丙酮洗涤间水杨酸烟碱,并将其风干~20分钟;为使盐均质,使用砂浆和杵,随后将盐在40℃下在真空炉中干燥1小时。4.将盐转移入闪烁管并称量。回收6.0g(~67%收率)。盐为熔点为125℃的白色粉末。值得注意的是在此物质的最初始的合成中(在有利用的籽晶之前),在步骤2(烟碱的滴加)之后,将溶液缓慢地旋转蒸发以减小至~10ml体积。随后添加50ml乙酸乙酯,充分混合,并将溶液置于干冰上。生成粘性物质,将其进一步蒸发。添加20ml乙醇,将溶液再次置于干冰上,在此时发生结晶。将晶体过滤、洗涤并在40℃下在真空下干燥。实施例3:api评价:使用多种分析方法表征间水杨酸烟碱原料(api)。结果证明合成的间水杨酸烟碱具有高纯度。间水杨酸烟碱粉末的通常的量热扫描示于图2中。熔点为125℃。在扫描和等热两种模式下对粉末进行热重分析。图7显示由室温至500℃的扫描数据。值得注意的是平坦的基线近似于(实际上,略低于)0%,表明几乎没有留下或没有留下残留物。在外部平衡之前和之后称量平底锅,残留物仅为~0.2%。此结果暗示在暴露于高温之后酸的最小碳化。还在40℃、50℃、和60℃下,在至少3天的时间段内获得api粉末(每次运行~10mg)的等热数据。在所有情况中,质量变化基本上为随时间的线性降低。数据以及多种其他烟碱盐获得的相似的数据的总结详述于表2中。间水杨酸烟碱(上方线)与邻水杨酸烟碱(第二条线)相比较损失的烟碱少约2-3倍。与间水杨酸盐相比较,测试的大多数烟碱盐是较不稳定的(损失较多的烟碱)。表1:在对多种烟碱盐的热重分析实验期间观察的烟碱质量损失实施例4:溶解度在多种相关溶剂中对间水杨酸烟碱进行溶解度限测试。结果收集于表2中。近似饱和限的单位为每ml溶剂mg烟碱当量。值得注意的是在纯乙腈(~10mg/ml)和丙酮(<10mg/ml)中间水杨酸烟碱的溶解度低。间水杨酸烟碱最容易溶于含甲醇的溶剂系统中。然而,经开发用于检测与间水杨酸相关的杂质的分析方法使用236nm作为检测波长。甲醇在此范围内具有高吸收,并且因此可以与关注的分析物相互干扰。另一方面,乙腈在此波长范围内具有低的背景吸收,且因此对于使用是理想的。为了解决溶解度不佳的问题,使用水和乙腈的混合物进行提取。表2:间水杨酸烟碱在各溶剂中的近似溶解度限溶剂饱和点(mg烟碱/ml)乙腈9乙醇33水5850/50乙腈/水6480/20甲醇/水118丙酮<<10甲醇103实施例5烟碱涂布开发喷涂是生成冷凝气雾剂的用于制备药物膜的关键制造步骤之一。使用在甲醇中的~75mg/ml的溶液进行间水杨酸烟碱的喷涂。还尝试了丙酮,但溶解度有限。通常的喷涂参数为1.3w(broadbandultrasonicgeneratorpower),溶液流速10-12ml/小时,涂布台速率25mm/s,和空气压力1-1.5psi。较高的流速倾向于导致视觉上更均质的涂层。阵列内相对标准差经常在203%范围内,但阵列内变化性较高(可能是由于在相邻的阵列上的过喷涂)。涂布的膜的结晶是优选的,且其通常在喷嘴的人工引晶之后非常容易发生。制备涂层使得200μg烟碱等价剂量覆盖箔的一个表面(9x2mm面积)。这等价于约20μm的膜厚度。对于下述的表征研究,在相同的表面积上涂布较低的剂量。然而,由于发现最高剂量的机械稳定性是可接受的,且较厚的膜的气化损失较少,因此本发明教导20μm厚度的涂层。已制备新的喷涂掩膜以在25、50、和100μg烟碱当量下制备这样的膜。实施例6分析方法开发与间水杨酸烟碱的药物产品开发结合,已得到多种分析方法以辅助api和气雾剂的定量和定性(纯度)评价。烟碱定量:此等梯度分析使用geminic18,50x3.0mm,3μm柱,0.1%氢氧化铵在水/乙腈流动相中,流速为0.6ml/min,且在245nm下检测。此方法的总运行时间为3分钟。此步骤适用于测定烟碱盐中8-200μg/ml(对于低量)和100-600μg/ml(对于高量)范围内的烟碱浓度。其不意图用于杂质或烟碱的分解产物的测量。间水杨酸定量方法:此等梯度分析使用luna,c18,3μm,75x4.6mm柱,0.1%三氟乙酸(tfa)在水/乙腈流动相中,流速为1.0ml/min,并在248nm下检测。此方法的总运行时间为3.5分钟。此步骤适用于测定20-600μg/ml范围内的间水杨酸浓度。其不意图用于杂质或间水杨酸的分解产物的测量。烟碱纯度方法:此反相hplc方法应用梯度流,使用包含0.1体积%的氢氧化铵在水/乙腈中的溶液作为流动相,流速为0.8ml/min,并使用geminirp18,150x4.6mm,3μm柱,并在260nm下uv检测。此方法的总运行时间为20分钟。此步骤适于测定300-500μg/ml的烟碱浓度范围内的烟碱浓度和烟碱相关的杂质。其用于间水杨酸烟碱中的烟碱相关的总杂质的测定。间水杨酸纯度方法(aard-020-049):此反相hplc方法应用梯度流,使用包含0.1体积%的三氟乙酸(tfa)在水/乙腈中的溶液作为流动相,流速为0.8ml/min,并使用geminic18,150x3.0mm,5μm柱,并在236nm下uv检测。此方法的总运行时间为20分钟。此步骤适于测定300-500μg/ml的间水杨酸盐浓度范围内的间水杨酸盐浓度和间水杨酸盐相关的杂质。其用于间水杨酸烟碱中的间水杨酸相关的总杂质的测定。实施例7emd表征释出的剂量和质量平衡释出的剂量和质量平衡:由于烟碱的挥发性质,已证明完全收集烟碱颗粒和气是极具挑战性的。进行了多次释放剂量测试已发现能够使100%质量平衡成为可能的优化的收集方法。最终,发现装在ngi过滤器支架中的76mm直径玻璃纤维过滤器(1.0um孔径,型号a/e)为烟碱和间水杨酸两者仅提供了最优的回收。对于适当的收集,水杨酸烟碱盐可能要求相对低的跨过滤器的面速率。使用具有用于提供用于加热箔并使药物气化的能量的外部电源的开关盒进行释放的剂量试验。可以将多至3个箔点火于一个过滤器中,而不会不利地影响回收(将更多的箔启动入一个过滤器中会降低气雾剂回收,可能是由于烟碱游离碱跨收集过滤器自外部气流的挥发性)。设置开关盒以提供3.7伏特/4.0安培,持续0.5秒。将气流速率设为28.3lpm。随后使用多至10ml的50体积%乙腈在水中的溶液自过滤器提取捕捉的药物气,并超声10分钟。在分析物被准备好进行hplc分析之前,通过离心将过滤器纤维制成球。自涂布有200μg烟碱的箔释放的平均烟碱剂量为涂布的剂量的99.5%(6.8%sd),而与涂布的剂量相比较,平均间水杨酸回收为101.8%(6.3%sd)。均具有最小的沉积/箔上的残留物和气道外壳。此外,涂布的剂量和释出的剂量的烟碱与反荷离子的摩尔比分析结果显示在气化和捕捉过程中保持1:1的关系。气雾剂纯度使用释出的剂量步骤捕捉气雾剂,提取在50/50乙腈/水中进行。气雾剂的纯度由烟碱和水杨酸盐实体两者决定。烟碱部分似乎几乎完全地完整气化,具有最小的(≤0.5%)分解。检测到少量的麦斯明烟草碱。图8显示在烟碱杂质方法中运行的通常的样品的色谱图。许多烟碱盐例如酒石酸盐面临的挑战是酸的分解。使情况变得更复杂的是在观察它们的分解副产物中的分析挑战,这是由于羧酸为小分子,具有最小的uv吸收。幸运的是,就此而言,间水杨酸具有一些优势。我们已能够开发用于筛选间水杨酸盐的分解的hplc方法。已检测到由间水杨酸的最小的分解产物(≤0.5%)。图9显示在间水杨酸盐杂质方法中运行的通常的样品的色谱图。对间水杨酸的额外的考虑时可能形成苯酚。已检测苯酚为邻水杨酸烟碱的分解产物,水平为~0.1-0.5%。尽管苯酚为相对普遍存在的分子,但有一些关于基因毒性和刺激的报导。将灵敏的lc方法用于苯酚检测,此方法未观察到间水杨酸烟碱气雾剂中的苯酚。由于此方法的灵敏性,我们可以估计苯酚在间水杨酸烟碱气雾剂中的最大含量为约0.013%。评价气雾剂纯度的补充方法为计算质量平衡,即将烟碱和反荷离子的涂布的剂量量与释出的剂量加上残留的量相比较。对涂布的药物中的烟碱和间水杨酸的量和比例与释出的+残留的药物相比较,显示出与盐例如酒石酸氢烟碱中看到的巨大差异不同,两种实体中的质量平衡均为约100%且气雾剂中的比例与涂布的剂量中的比例一致。气雾剂粒径结果在nextgenerationimpactor(ngi)上进行粒径实验。将气流速率设为30lpm。使用emd剂量药筒开关盒,在与释出的剂量试验相似的设置下,将涂布有200μg烟碱等价物(总计约370g间水杨酸烟碱)的箔阵列气化。将4-11张箔气化入各ngi装置,并且使用4ml50体积%乙腈在水中的溶液测定杯。初始地,空ngi杯产生低低mmad值,平均值为0.7μm。随后,将硅酮喷至杯上,以降低粒径实验中经常见到的波动作用。喷有硅酮的杯对于mmad没有作用,但质量平衡稍微上升,烟碱回收自空杯的涂布的剂量的76%增加至硅酮杯上的89%。随后使用1重量/体积%的苯甲酸的薄层涂布ngi杯,以降低波动和烟碱挥发性。将溶剂的等分试样移液至各杯中,并将杯旋转以加速表面覆盖。苯甲酸的存在将mmad增加至0.9um,而烟碱回收增加至涂布的剂量的93%。图10显示这些方案的各冲击器阶段中的粒径分布。用于测定苯甲酸涂布均匀性和厚度的作用的其它实验(通过改变自喷涂瓶的喷涂数)显示mmad的最小差异,结果在0.8-1.0μm的范围内。参见图11。粒径为约11μm,或仅略小,这应适于肺部沉积。可能的是间水杨酸烟碱气雾剂将在呼吸道中的潮湿(接近100%rh)气氛中在某种程度上生长。实施例8稳定性一旦与反荷离子酸结合,烟碱游离碱的固有挥发性可能大大改变。在生成的盐形式中,烟碱的稳定性可以广泛地变化,最终影响其商业考虑的期望度。某些包装构造可以减轻烟碱损失。先前的试验结果暗示一旦达到烟碱的平衡蒸汽压烟碱损失就停止。认为降低平衡蒸汽压点可以使总烟碱损失最小化。为此研究,对不同的包装构造进行测试以研究以下变量:容器材料、附件的存在、和空间的总体积。容器材料由玻璃或多层铝箔袋组成。玻璃对于气是不可渗透的。一旦玻璃容器的总体积充满烟碱气且发生任何表面吸附,则达到平衡且不应观察到任何额外的烟碱损失。尽管箔也是不可穿透的,但袋的内表面衬有能够促进气吸收性的乙烯酸共聚物。与相同总体积的玻璃瓶相比较,在袋内共聚物应导致更高的烟碱损失。附件例如药筒外壳的存在对于最终的商业产品而言可能是一种方案。如果其优选地吸收气,则附件的组成将影响平衡蒸汽压点。为此研究,将表面积为~150cm2的聚碳酸酯附件引入玻璃瓶和袋方案。最终,检查总包装体积。可获得的空间越小,可以更迅速地达到平衡压力。敞开的容器表示最差的情况方案,这是由于无限的空间意味着永远无法达到平衡压力。为了准备实验,将1x2cm的间水杨酸烟碱覆盖区喷涂在筛箔上,直至~11ug烟碱/mm2的厚度(等价于在emd箔上200ug烟碱等价物的涂布剂量)。在对一些随机的筛箔进行初始时间点涂布的剂量的分析时,将剩余的箔置于以下容器之一中:·有盖的玻璃瓶(~40ml体积)·热密封的标准袋(~133mmx87mm)·热密封的标准袋,与聚碳酸酯物质一起储存(~150cm2表面积)·无盖的玻璃瓶(与第一组相同的瓶)·活页夹加持的(半密封的)标准袋(~133mmx87mm)·有盖的玻璃瓶,与聚碳酸酯一起储存·热密封的半袋(~69mmx87mm)·无盖的培养皿将包装的筛箔在40℃(炉)或25℃(实验橱)下储存,而不进行相对湿度控制。在预先确定的时间点,将获自各条件的3张箔用5ml的50体积%乙腈在水中的溶液洗涤,并在hplc上分析烟碱和间水杨酸盐含量。40℃样品的结果示于图14和图15中。在整个储存持续期间,仅两个条件先试吃烟碱的持续损失:开放的玻璃瓶和无盖的培养皿。其中将包装密封的所有其它条件显示在初始的损失后烟碱挥发性的稳定化。含聚碳酸酯物质的密封的标准大小的袋似乎是稳定化的烟碱条件中最差的(~20%烟碱含量损失)。喷涂的烟碱盐暴露于共聚物层和聚碳酸酯附件且总体积为一半大小的袋的两倍。所有其他稳定化的烟碱条件损失其烟碱含量的≤10%。由于其储存构造,培养皿条件具有最迅速的烟碱损失。喷涂的箔的整个表面持续地暴露于外部环境。同时,开放的玻璃瓶中的箔向上储存于狭窄的瓶中,仅小直径的空间暴露于外部,由此减少损失率。无论包装结构如何,间水杨酸都似乎非常稳定。由于其最大地暴露于外部环境,因此培养皿条件是最差的情况方案。然而,在40℃下在最小的湿度下储存4周后,间水杨酸盐的含量保持在初始值的~80%。否则,对于所有其他构造,在16周的储存之后,稳定性结果在初始值的约100-110%的范围内。在25℃下储存的样品的结果是特别有希望的。除培养皿条件(18周时烟碱含量损失13%)以外,对于所有条件,多至18周的储存后烟碱损失在初始值的7%内。对于所有8个条件,间水杨酸含量是稳定的。由挥发性和吸湿作用导致的烟碱和间水杨酸的损失:烟碱盐可能受挥发性问题困扰且还可能是极具吸湿性的。例如,硫酸烟碱易于吸收水,使得其在水溶液中运输。在2种条件下评价2个剂量的间水杨酸烟碱的吸湿作用:22℃/44%rh(环境条件)和40℃/75%rh。根据水的antoine方程,将40℃/75%rh转化为22℃下的过饱和湿度。将各经涂布的emd阵列平置于培养皿(无盖)上,随后将其在22℃/44%rh或40℃/75%rh下储存。在各时间点,自阵列移除至少4张随机的单独的箔,且各箔用1.5ml的50/50acn/水提取,用于涂布的剂量测定。40-μg/箔和170-μg/箔的整体烟碱结果总结如下。参见图14。对于40μg/箔剂量,涂布的膜在60℃/35%rh下相对稳定(定义为不超过20%损失)多至4小时,在35℃/80%rh下5天,且在22℃/60%rh下4周。对于170μg/箔剂量,涂布的膜在60℃/35%rh下稳定至少8小时,在35℃/80%rh下7天,在25℃/90%rh下13天,且在22℃/60%rh下4周。稳定性结果证明,跨所有稳定性条件,较厚的涂布的膜(170μg/箔)比较薄的涂布的膜(40μg/箔)显著地更稳定。40μg/箔和170μg/箔的间水杨酸结果总结如下。参见图15。除了在25℃/90%rh下的40μg/箔剂量以外,在所有条件下间水杨酸都似乎相对稳定。幸运的是,此问题可以通过增加涂布的膜厚度而减轻。机械稳定性使用每箔涂布有~200μg烟碱(~11μg烟碱/mm2,这为间水杨酸烟碱的约21μm厚的膜)的两个箔阵列测试喷涂的易碎性。分析获自各阵列的5张箔的下落前的涂布的剂量。随后将各箔阵列置于给药药筒中,密封入塑料管中,并由约1米的高度下落至地板3次。分析获自各阵列的5张另外的箔的下落后的涂布的剂量。对于下落后和下落前的比较,发现箔阵列内涂布的剂量为0.1和1.4%高出,平均为~0.8%。在这些情况中,这些差异是不显著的且显示在emd箔上的即使200μg烟碱当量的间水杨酸烟碱涂层也是机械稳定的。表3.机械稳定性测试的结果*假定单位密度(1g/cm3)在随后的研究中,我们研究了厚度对于膜的机械完整性的作用。在此实验中,分析获自阵列的3张箔的下落前的涂布的剂量。随后将各箔阵列置于给药药筒中,密封入塑料管中,并由约1米的高度下落至地板5次。分析获自各阵列的3张箔的下落后的涂布的剂量。数据表明对应于350μg烟碱的膜厚度(~37μm厚度)开始显示出易碎的迹象—药物的成片剥落。在~29μm厚度的膜的下落之后药物没有损失。因此,对于机械墓地,间水杨酸烟碱膜厚度不应超过约30微米。实施例9装置装置1:已在电子多剂量(emd)平台中测试如图16中所示的基础设计。将有效的箔包装转化为大量的剂量。所述箔经由喷涂过程容易地涂布。装置2:参见图17。剂量为由固体的电阻丝例如ni-chrome卷绕成的小线圈的形式。线圈的连接方式使得最远离吹口的线圈提供最小电阻的途径。选择线直径使得短电流爆发将首先加热此线圈,并随后吹向保险丝连接点(红点)。在此点处,线圈用尽且不再与电路连接。在另一个加热循环时,另一个线圈代表最小电阻的路径,因此其成为下一次剂量。持续此循环直至所有的剂量都被消耗。可以不使用软件而实施单剂量的防故障设计。可以为一次性的单元。规格可以与香烟相似。可以将线结合技术用于线圈附着。可以被转化为加热元件的软件控制。装置3:参见图18。装置依赖于与装置2相同的保险方法,但其使用箔而不是由线卷绕成的线圈。可以不使用软件而实施单剂量的防故障设计。装置可以为一次性的单元。规格与香烟近似。具有有效的面积输出,其转化为每装置高剂量数。仅有2个连接点。保险面积的降低的实施可以容易地使用线圈实现。此装置可以被容易地转化为软件控制的加热元件。可以经由喷涂过程容易地涂布平坦的箔。装置4:参见图19.此装置依赖于与装置2和装置3相同的保险方法。其采用卷为管形式的箔以允许类似与香烟的规格。本发明的说明书已出于解释和说明的目的进行展示,但其不意图相近的或将本发明限于公开的形式。本发明的范围仅由以下权利要求的范围限制。许多修改和变体对于本领域普通技术人员而言将是显而易见的。描述的以及在附图中显示的实施方案经选择和描述以最佳的解释本发明的原理、实际应用、以及使得本领域其他普通技术人员能够理解本发明,具有不同修改的不同实施方案适于考虑的具体应用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1