一种多组分注射液的制作方法
本发明属于医药
技术领域:
,具体涉及一种多组分注射液及其制备工艺和用途。
背景技术:
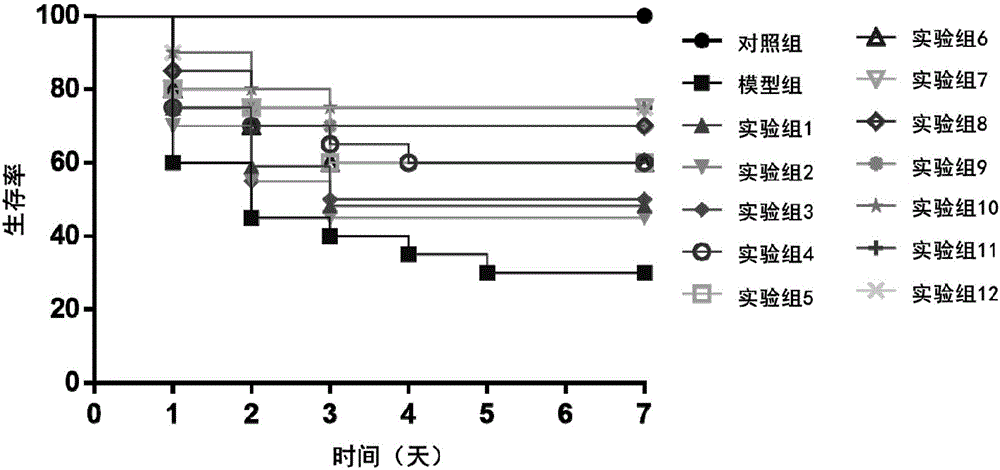
:脓毒症(Sepsis)是针对感染的宿主反应失调引起的致命性器官功能障碍,其院内病死率高达10%以上,已经对人类健康造成了巨大威胁,成为医学界关注的焦点[参见JAMA.2016Feb23;315(8):801-10]。经大数据回顾性分析,结合微阵列技术和白细胞基因表达分析,人们逐渐认识到脓毒症不仅是一个全身炎症反应或免疫失调的过程,而且是一个持续炎症、免疫抑制、分解代谢3者相结合的复杂慢性危重病。[参见JTraumaAcuteCareSurg.2012June;72(6):1491-501、BMJ.2016May23;353:i1585和Medicine(Baltimore).2015Dec;94(50):e2044.]。多年以来,抗生素、抗病毒药物、血管升压药物等均用于脓毒症传统治疗,但尚未有足够的针对脓毒症发病机制的特异性药物投入临床实践。[参见CritCareMed.2013Feb;41(2):580-637]如何及时纠正脓毒症发生发展过程中的全身性炎症反应、凝血功能障碍和免疫功能紊乱,尽早恢复机体促炎-抗炎动态平衡,有效改善患者预后,成为了脓毒症治疗药物研发中亟待解决的重要课题。70年代,中国著名急救医学专家王今达教授就提出了治疗急性危重病中医治则:清热解毒法治疗毒热证,活血化瘀法治疗血瘀证,扶正固本法治疗急性虚症,即“三证三法”,并以此作为治疗脓毒症的基本大法,用于临床实践[参见中国危重病急救医学,2006,18(11):643-4]。1975年,他首次证实内毒素血症是感染性多脏衰的始动病因,提出了“菌毒并治”的治疗新对策,随着认为内毒素对于机体危害是诱导体内炎性介质的产生,从而发挥毒性作用,进一步提出细菌、内毒素、炎性介质并治,即“菌毒炎并治”[参见中国中西医结合外科杂志,2012,18(6):553-554]。血必净注射液是依据“三证三法”的辨证原则,在“菌毒炎并治”的理论指导下,以清代王清任《医林改错》所载“血府逐瘀汤”为基础,研制而成的一种静脉注射液,由红花、赤芍、川芎、丹参、当归五味药材经提取、精制、干燥、调配等现代工艺制备而成,属于化瘀解毒类中药,用于温热类疾病,症见发热、喘促、心悸、烦躁等瘀毒互结症;适用于因感染诱发的全身炎症反应综合征;也可配合治疗多器官功能失常综合征的脏器功能受损期。血必净注射液具有拮抗细菌内毒素[参见中国危重病急救医学,2006,18(11):643-4]、抑制炎症因子过度释放[参见中国危重病急救医学,2006,18(11):643-4、EvidBasedComplementAlternatMed.2015;2015:860259和ChinJIntegrMed.2009;15(1):13-5]、克服凝血功能障碍[参见中华实验外科杂志,2010,27(1):32-4和中国中西医结合急救杂志,2009,16(4):218-22]、保护血管内皮细胞[参见中国中西医结合急救杂志,2009,16(4):218-22]、改善组织微循环[参见JSurgRes.2016May1;202(1):147-54]、改善免疫功能紊乱[参见中华外科杂志,2009,47(1):58-61和EvidBasedComplementAlternatMed.2015;2015:352642]等药理作用,充分体现了中药多成分、多环节、多渠道、多靶点的整合调节作用。大样本量多中心临床研究和荟萃分析(Meta)分析结果表明,在常规综合治疗基础上联合使用血必净注射液能降低脓毒症患者28d病死率、并发症发生率,缩短平均住院时间,有效改善患者全身炎症反应、凝血功能和急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分等临床指标,保护器官功能,显著提高临床疗效[参见中华危重病急救医学,2015,27(6):465-76、中华急诊医学杂志,2013,22(2):130-5和解放军医学杂志,2010,35(1):9-12]。2003年,中国专利03104977.X公开了“一种治疗脓毒症的中药制剂及其制备方法”,即血必净注射液的制备方法,其制备工艺已经非常成熟。随着科技的进步、技术的创新,我们对工艺过程进行优化和工艺参数细化,如变更原来制剂过程1%活性炭除热原为超滤,保障了成品的安全和质量均一稳定。发明人借助先进研究理念及先进仪器设备,已实现该注射液的全成分检测,通过血必净注射液物质基础的研究,我们得到了一种全新的多组分注射液,保留了原血必净注射液中有效成分。技术实现要素:本发明提供一种多组分注射液,其特征在于,含有以下重量份的活性成分芍药内酯苷8.66-35.26份,芍药苷1000.0-1700.0份,氧化芍药苷11.13-68.07份,苯甲酰芍药苷12.20-52.98份,苯甲酰氧化芍药苷0.667-1.617份,牡丹皮苷J1.915-3.202份,没食子酰芍药苷10.63-20.13份,牡丹皮苷C0.804-1.338份,苯甲酸10.0-200.0份,没食子酸0.21-15.88份,没食子酸乙酯0.2396-0.6860份,儿茶素1.31-12.60份。上述所述的多组分注射液,其特征在于,制备方法如下:取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏;取上述干膏适量,用注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。在以上多组分注射液的基础上,本发明进一步提供一种多组分注射液,其特征在于,含有以下重量份的活性成分芍药内酯苷8.66-35.26份,芍药苷1000.0-1700.0份,氧化芍药苷11.13-68.07份,苯甲酰芍药苷12.20-52.98份,苯甲酰氧化芍药苷0.667-1.617份,牡丹皮苷J1.915-3.202份,没食子酰芍药苷10.63-20.13份,牡丹皮苷C0.804-1.338份,苯甲酸10.0-200.0份,没食子酸0.21-15.88份,没食子酸乙酯0.2396-0.6860份,儿茶素1.31-12.60份,山柰素-3-O-葡萄糖苷1.232-3.547份,野黄芩苷0.0500-0.4184份,槲皮素-3-O-葡萄糖苷0.755-2.570份,山柰素-3-O-芸香糖苷8.42-29.40份,山柰素-3-O-槐糖苷4.036-7.695份,槲皮素-3-O-芸香糖苷1.517-5.598份,羟基红花黄色素A200.0-500.0份,尿嘧啶0.316-0.774份,腺嘌呤13.77-30.56份,苯丙氨酸20.50-44.99份,尿苷11.44-27.13份,腺苷5.07-12.63份,鸟苷8.00-24.11份,丁二酸4.96-16.86份,对羟基苯甲酸2.384-5.404份,对香豆酸3.00-17.98份,咖啡酸4.837-7.806份,绿原酸3.83-8.59份。上述所述的多组分注射液,其特征在于制备方法如下:取红花饮片100g,加入8倍量的30%乙醇浸提8小时,滤取4~6倍量药液,加入95%乙醇使含醇量至70%,冷存48小时,过滤,滤液减压浓缩至100ml;浓缩液加入95%乙醇使含醇量至80%,冷存48小时,滤过,滤液回收乙醇,浓缩,真空干燥制成红花干膏;取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏;取两种干膏各适量,用注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。在以上多组分注射液的基础上,本发明进一步提供一种多组分注射液,其特征在于含有以下重量份的活性成分芍药内酯苷8.66-35.26份,芍药苷1000.0-1700.0份,氧化芍药苷11.13-68.07份,苯甲酰芍药苷12.20-52.98份,苯甲酰氧化芍药苷0.667-1.617份,牡丹皮苷J1.915-3.202份,没食子酰芍药苷10.63-20.13份,牡丹皮苷C0.804-1.338份,苯甲酸10.0-200.0份,没食子酸0.21-15.88份,没食子酸乙酯0.2396-0.6860份,儿茶素1.31-12.60份,山柰素-3-O-葡萄糖苷1.232-3.547份,野黄芩苷0.0500-0.4184份,槲皮素-3-O-葡萄糖苷0.755-2.570份,山柰素-3-O-芸香糖苷8.42-29.40份,山柰素-3-O-槐糖苷4.036-7.695份,槲皮素-3-O-芸香糖苷1.517-5.598份,羟基红花黄色素A200.0-500.0份,尿嘧啶0.316-0.774份,腺嘌呤13.77-30.56份,苯丙氨酸20.50-44.99份,尿苷11.44-27.13份,腺苷5.07-12.63份,鸟苷8.00-24.11份,丁二酸4.96-16.86份,对羟基苯甲酸2.384-5.404份,对香豆酸3.00-17.98份,咖啡酸4.837-7.806份,绿原酸3.83-8.59份,洋川芎内酯I(42)6.51-69.39份,洋川芎内酯H1.55-18.27份,洋川芎内酯N4.30-14.22份,开环洋川芎内酯I2.460-5.648份,洋川芎内酯G1.55-10.74份,3-羟基-3-丁基苯酞1.43-8.67份,洋川芎内酯A0.10-0.961份,阿魏酸7.66-47.15份。上述所述的多组分注射液,其特征在于制备方法如下:取红花饮片100g,加入8倍量的30%乙醇浸提8小时,滤取4~6倍量药液,加入95%乙醇使含醇量至70%,冷存48小时,过滤,滤液减压浓缩至100ml;浓缩液加入95%乙醇使含醇量至80%,冷存48小时,滤过,滤液回收乙醇,浓缩,真空干燥制成红花干膏;取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏;取川芎、当归饮片各100g,按赤芍工艺方法处理,每次浓缩液为300ml,萃取用水饱和正丁醇每次为150ml,制成干膏;取三种干膏各适量,用适量注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。在以上多组分注射液的基础上,本发明进一步提供一种多组分注射液,其特征在于含有以下重量份的活性成分芍药内酯苷8.66-35.26份,芍药苷1000.0-1700.0份,氧化芍药苷11.13-68.07份,苯甲酰芍药苷12.20-52.98份,苯甲酰氧化芍药苷0.667-1.617份,牡丹皮苷J1.915-3.202份,没食子酰芍药苷10.63-20.13份,牡丹皮苷C0.804-1.338份,苯甲酸10.0-200.0份,没食子酸0.21-15.88份,没食子酸乙酯0.2396-0.6860份,儿茶素1.31-12.60份,山柰素-3-O-葡萄糖苷1.232-3.547份,野黄芩苷0.0500-0.4184份,槲皮素-3-O-葡萄糖苷0.755-2.570份,山柰素-3-O-芸香糖苷8.42-29.40份,山柰素-3-O-槐糖苷4.036-7.695份,槲皮素-3-O-芸香糖苷1.517-5.598份,羟基红花黄色素A200.0-500.0份,尿嘧啶0.316-0.774份,腺嘌呤13.77-30.56份,苯丙氨酸20.50-44.99份,尿苷11.44-27.13份,腺苷5.07-12.63份,鸟苷8.00-24.11份,丁二酸4.96-16.86份,对羟基苯甲酸2.384-5.404份,对香豆酸3.00-17.98份,咖啡酸4.837-7.806份,绿原酸3.83-8.59份,洋川芎内酯I(42)6.51-69.39份,洋川芎内酯H1.55-18.27份,洋川芎内酯N4.30-14.22份,开环洋川芎内酯I2.460-5.648份,洋川芎内酯G1.55-10.74份,3-羟基-3-丁基苯酞1.43-8.67份,洋川芎内酯A0.10-0.961份,阿魏酸7.66-47.15份,原儿茶醛1.43-17.25份,原儿茶酸2.361-4.030份,丹参素2.776-6.845份,迷迭香酸5.07-12.78份,丹酚酸D0.0697-0.4005份,丹酚酸C1.123-4.732份,丹酚酸A0.366-2.505份,紫草酸0.429-0.945份,丹酚酸B4.00-11.00份。上述所述多组分注射液,其特征在于制备方法如下:取红花饮片100g,加入8倍量的30%乙醇浸提8小时,滤取4~6倍量药液,加入95%乙醇使含醇量至70%,冷存48小时,过滤,滤液减压浓缩至100ml;浓缩液加入95%乙醇使含醇量至80%,冷存48小时,滤过,滤液回收乙醇,浓缩,真空干燥制成红花干膏;取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏;取川芎、丹参、当归饮片各100g,按赤芍工艺方法处理,每次浓缩液为300ml,萃取用水饱和正丁醇每次为150ml,制成干膏;取三种干膏各适量,用适量注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。本发明所述任一种多组分注射液,其特征在于给药方式为注射给药。本发明所述任一种多组分注射液,用于制备治疗脓毒症药物的用途。由于本发明的多组分注射液中的活性成分均属于已知物质,可以通过已知方法得到,因此本发明的以上多组分注射液其制备方法还包括,将购买或制备得到的上述多种活性成分经过混合,用制剂学常规技术制备成注射剂。通过如下实验进一步说明本发明专利的技术方案:本发明的多组分注射液,对脓毒症细胞模型及脓毒症小鼠模型均存在治疗作用,提示,本发明所述多组分注射液,对于哺乳动物的脓毒症具有治疗作用,进而对人体的脓毒症具有治疗作用。以下通过实验数据进一步说明本发明的有益效果:实验一多组分注射液对内毒素诱导脓毒症小鼠死亡的影响实验动物Balb/C雄性小鼠(购自中国协和医科大学实验动物中心),清洁级,6-8周龄,体重19-23g,适应性饲养3天。药物与试剂本发明药物按照实施例2-5制备,;内毒素购自美国Sigma公司。实验方法3.1分组与干预280只小鼠随机分为正常组、模型组、实验组1-实验组12,每组各20只。实验前12h禁食,称重并按照随机数字表法进行分组。模型组仅进行内毒素攻毒造模;实验组1-实验组12在内毒素攻毒造模后,分别接受实施例2-5,12个批次多组分注射液(从实施例2第一批至实施例5第三批依次给予实验组1-实验组12)注射给药干预;正常组不做额外干预。内毒素攻毒造模过程如下:麻醉药物选用盐酸氯胺酮:速眠新II:PBS(磷酸盐缓冲液)=1:1.5:2.5混合液,以2mL/kg剂量肌肉注射麻醉。麻醉满意后,固定小鼠在手术台,腹腔内注射内毒素10mg/kg。实验组1-实验组12在内毒素攻毒前30min、60min及内毒素攻击后30min各自耳缘静脉分别注射实施例2-5,12个批次多组分注射液,剂量为4mL/kg体重;模型组在此前30min、60min及内毒素攻击后30min各自耳缘静脉再注射生理盐水4mL/kg体重。3.2观察与死亡率统计每24h观察计数死亡小鼠,Kaplan-Merer法做统计分析(统计软件采用SPSS16.0),p<0.05为存在显著差异。实验结果结果表明,注射内毒素后7天内,脓毒症模型组的死亡率为100%,而实验组1-实验组12的死亡率如下表所示,十二组的死亡率均明显低于脓毒症模型组(p<0.05)。上述发现提示,提示实施例2-5,12个批次多组分注射液对内毒素所致脓毒症小鼠具有保护作用。表1实施例2-5,12个批次多组分注射液对内毒素所致脓毒症小鼠死亡的影响注:*表示与模型组相比p<0.05。实验二多组分注射液对盲肠结扎穿孔术介导的脓毒症小鼠死亡的影响实验动物Balb/C雄性小鼠(购自中国协和医科大学实验动物中心),清洁级,6-8周龄,体重19-23g,适应性饲养3天。药物与试剂本发明药物按照实施例2-5制备。实验方法3.1分组与干预280只小鼠随机分为对照组、模型组、实验组1-实验组12,每组各20只。实验前12h禁食,称重并按照随机数字表法进行分组。对照组仅进行同样手术过程,但是盲肠既不结扎也不穿刺;模型组进行盲肠结扎穿孔术(CLP)造模;实验组1-实验组12在CLP造模后,分别注射实施例2-5,12个批次多组分注射液(从实施例2第一批至实施例5第三批依次给予实验组1-实验组12)给予药物干预。CLP造模过程如下:麻醉药物选用盐酸氯胺酮:速眠新II:PBS=1:1.5:2.5混合液,以2mL/kg剂量肌肉注射麻醉。麻醉满意后,固定小鼠在手术台,胸腹部常规消毒铺巾,剑突下lcm处做腹正中切口,切口长度1.5cm。暴露盲肠,于1/2处结扎,并用21G针头避开血管贯穿结扎的盲肠一次。确认无活动出血后,将盲肠还纳腹腔,缝合腹壁切口。术后颈后皮肤常规消毒,皮下注射生理盐水lmL液体复苏,麻醉苏醒后单笼饲养。小鼠行CLP手术后,实验组1-实验组12在术后0.5h,12h,24h,36h,48h,60h,72h,84h,96h自耳缘静脉分别注射实施例2-5,12个批次多组分注射液,剂量为4mL/kg;模型组和对照组在相应时间自耳缘静脉注射生理盐水4mL/kg体重。3.2观察与死亡率统计每24h观察计数各组死亡小鼠,Kaplan-Merer法做统计分析(统计软件采用SPSS16.0),p<0.05为存在显著差异。实验结果结果表明,CLP手术后7天内,脓毒症模型组的死亡率为70%,而实验组1-实验组12的死亡率如下表所示。其中,实验组7-12的死亡率均明显低于脓毒症模型组(p<0.05),提示实施例4(实验组7-9)和实施例5(实验组10-12),多个个批次多组分注射液对内毒素所致脓毒症小鼠具有保护作用。表2实施例2-5,12个批次多组分注射液对CLP介导的脓毒症小鼠死亡的影响注:*表示与脓毒症模型组相比P<0.05。实验三多组分注射液对脓毒症大鼠高迁移率族蛋白B1表达的影响实验动物Wistar雄性大鼠(购自中国医学科学院实验动物研究所),清洁级,体重180-220g,适应性饲养1周。药物与试剂本发明药物按照实施例2-5制备;高迁移率族蛋白B1(HMGB1)酶联免疫吸附法(ELISA)试剂盒(日本Shino-Test公司)。实验方法3.1分组与干预140只大鼠随机分为对照组、模型组、实验组1-实验组12,每组各10只。实验前12h禁食,称重并按照随机数字表法进行分组。对照组仅开腹暴露盲肠后缝合皮肤,皮下注射10ml生理盐水复苏;脓毒症模型组进行盲肠结扎穿孔术(CLP)造模;实验组1-实验组12在CLP造模后,分别注射实施例2-5,12个批次多组分注射液(从实施例2第一批至实施例5第三批依次给予实验组1-实验组12)给予药物干预。CLP造模过程如下:用氯胺酮注射液+速眠新II注射液2:1混合液肌肉注射麻醉大鼠,采用CLP制备脓毒症动物模型。结扎盲肠与回肠连接处,用18号针头贯通盲肠2次形成肠瘘,并留置2条引流条(0.5cm×2.0cm)防止针孔愈合,后逐层缝合皮肤,术毕立即皮下注射10mL生理盐水复苏。大鼠行CLP手术后,实验组1-实验组12在术后2h,12h,24h,36h,48h和60h经阴茎背静脉注射分别注射实施例2-5,12个批次多组分注射液,剂量为4mL/kg;模型组和对照组在相应时间经阴茎背静脉注射生理盐水4mL/kg体重。3.2采血与检测CLP后2h,8h,24h,48h和72h,将各组动物麻醉后腹主动脉无菌采血3mL,利用酶联免疫吸附法(ELISA),检测血浆HMGB1含量。实验结果结果表明,对照组血浆中含有少量HMGB1;CLP手术后早期,模型组HMGB1含量即明显增加,8hHMGB1水平进一步提高,于24h逐渐下降,但术后72h仍高于对照组,差异均有统计学意义(p<0.05)。而实验组1-实验组12分别经实施例2-5,12个批次多组分注射液注射干预治疗,术后2h后血浆含量均明显低于模型组(p<0.05),24h后HMGB1下降更为明显(p<0.01),接近对照组水平。上述发现提示,提示实施例2-5,12个批次多组分注射液对脓毒症时HMGB1的表达具有抑制作用。表3实施例2-5,12个批次多组分注射液对脓毒症大鼠血浆HMGB1水平的影响(n=10)单位:μg/L注:#表示与对照组相比p<0.05;*表示与模型组相比p<0.05。实验四多组分注射液对脓毒症大鼠单核细胞蛋白酶激活受体-1与组织因子表达的影响实验动物Wistar雄性大鼠(购自中国医学科学院实验动物研究所),清洁级,体重180-220g,适应性饲养1周。药物与试剂本发明药物按照实施例2-5制备;组织因子(TF)酶联免疫吸附法(ELISA)试剂盒(美国USCN公司);异硫氰酸荧光素(FITC)标记抗大鼠单核细胞蛋白酶激活受体-1(PAR-1)抗体(美国SantaCruz公司)。实验方法3.1分组与干预140只大鼠随机分为对照组、模型组、实验组1-实验组12,每组各10只。实验前12h禁食,称重并按照随机数字表法进行分组。对照组仅开腹暴露盲肠后缝合皮肤,皮下注射10mL生理盐水复苏;脓毒症模型组进行盲肠结扎穿孔术(CLP)造模;实验组1-实验组12在CLP造模后,分别注射实施例2-5,12个批次多组分注射液(从实施例2第一批至实施例5第三批依次给予实验组1-实验组12)给予药物干预。CLP造模过程如下:用氯胺酮注射液+速眠新II注射液2:1混合液肌肉注射麻醉大鼠,采用CLP制备脓毒症动物模型。结扎盲肠与回肠连接处,用18号针头贯通盲肠2次形成肠瘘,并留置2条引流条(0.5cm×2.0cm)防止针孔愈合,后逐层缝合皮肤,术毕立即皮下注射10mL生理盐水复苏。大鼠行CLP手术后,实验组1-实验组12在术后2h,12h,24h,36h,48h和60h经阴茎背静脉注射分别注射实施例2-5,12个批次多组分注射液,剂量为4mL/kg;模型组和对照组在相应时间经阴茎背静脉注射生理盐水4mL/kg体重。3.2采血与检测CLP后12h,24h,48h和72h,将各组动物麻醉后腹主动脉无菌采血3mL。利用流式免疫荧光法,检测血浆单核细胞蛋白酶激活受体-1(PAR-1)表达;利用酶联免疫吸附法(ELISA),检测血浆组织因子(TF)含量。PAR-1表达检测:取2mL肝素抗凝血,采用大鼠淋巴细胞分离液分离单个核细胞。用10%胎牛血清-RPMI1640完全细胞培养液重悬单个核细胞,调整细胞密度为4×106/mL,孵育2h后用细胞培养液冲洗细胞培养板。加0.25%胰蛋白酶-EDTA消化液消化3min,待大部分细胞脱落后,加10%胎牛血清-RPMI1640完全细胞培养液2mL,终止消化。磷酸盐缓冲液(PBS)冲洗3次,以获得外周血单核细胞。于细胞悬液中加入1μg/1×106细胞异硫氰酸荧光素(FITC)标记抗大鼠PAR-1抗体,4℃避光孵育15min,加入2mLPBS洗涤1次,加入0.4mLPBS,上流式细胞仪检测其平均荧光强度。实验结果结果表明,对照组单核细胞PAR-1存在一定表达;模型组在术后12hPAR-1表达量与对照组比较差异无统计学意义,在术后24h,48h和72h其平均荧光强度则显著高于对照组(p<0.05),且随术后时间的延长而逐渐增高。实验组1-3在24h和48hPAR-1平均荧光强度低于模型组,但无显著差异;在72h荧光强度显著低于模型组(p<0.05)。实验组4-实验组12九个干预组的PAR-1平均荧光强度在24h、48h和72h与模型组相比均出现显著降低(p<0.05)。而对照组单核细胞TF存在一定表达;模型组在术后12h,24h,48h和72hTF表达均显著高于对照组(p<0.05),且随术后时间的延长而逐渐增高,在48h达到顶点。实验组1-3在12h和72hTF表达低于模型组,但无显著差异;在24h和48h表达强度显著高于模型组(p<0.05)。实验组4-实验组12九个干预组的TF表达在24h、48h和72h与模型组相比均出现显著降低(p<0.05)。上述发现提示,实施例3-5,9个批次多组分注射液可下调脓毒症诱导的单核细胞PAR-1的表达,明显减少TF的分泌,改善单核细胞介导的凝血功能紊乱。表4-1多组分注射液对脓毒症大鼠PAR-1表达的影响(n=10)注:#表示与对照组相比p<0.05;*表示与模型组相比p<0.05。表4-2多组分注射液对脓毒症大鼠血浆TF表达的影响(n=10)单位:ng/L注:#表示与对照组相比p<0.05;*表示与模型组相比p<0.05。实验五多组分注射液对脓毒症大鼠调节T细胞凋亡与辅助性T细胞漂移的影响实验动物Wistar雄性大鼠(购自中国医学科学院实验动物研究所),清洁级,体重180-220g,适应性饲养1周。药物与试剂本发明药物按照实施例2-5制备;藻红蛋白(PE)-抗大鼠CD25、异硫氰酸荧光素(FITC)标记抗大鼠CD4、别藻蓝蛋白(APC)标记膜联蛋白V(AnnexinV)凋亡试剂盒(美国BD公司);大鼠抗-PE试剂盒、CD4磁珠、MiniMACS磁性分离仪以及分选柱(德国MiltenyiBiotec公司);PE标记叉头翼状螺旋转录因子(Foxp3)试剂盒、PE标记T淋巴细胞毒性相关抗原4(CTLA-4)、抗大鼠CD3单克隆抗体、抗大鼠CD28单克隆抗体(美国eBioscience公司);干扰素(IFN)-7、IL-4、IL-10酶联免疫吸附法(ELISA)试剂盒(美国Biosource公司);IL-17ELISA试剂盒(美国UsenlifeScience公司);锥虫蓝(美国Sigma公司)。实验方法3.1分组与干预140只大鼠随机分为对照组、模型组、实验组1-实验组12,每组各10只。实验前12h禁食,称重并按照随机数字表法进行分组。对照组仅开腹暴露盲肠后缝合皮肤,皮下注射10mL生理盐水复苏;脓毒症模型组进行盲肠结扎穿孔术(CLP)造模;实验组1-实验组12在CLP造模后,分别注射实施例2-5,12个批次多组分注射液(从实施例2第一批至实施例5第三批依次给予实验组1-实验组12)给予药物干预。CLP造模过程如下:用氯胺酮注射液+速眠新II注射液2:1混合液肌肉注射麻醉大鼠,采用CLP制备脓毒症动物模型。结扎盲肠与回肠连接处,用18号针头贯通盲肠2次形成肠瘘,并留置2条引流条(0.5cm×2.0cm)防止针孔愈合,后逐层缝合皮肤,术毕立即皮下注射10mL生理盐水复苏。大鼠行CLP手术后,实验组1-实验组12在术后经阴茎背静脉注射分别注射实施例2-5,12个批次多组分注射液,剂量为4mL/kg;模型组和对照组在相应时间经阴茎背静脉注射生理盐水4mL/kg体重。3.2细胞分离及培养各组大鼠分别经断颈处死后无菌取脾脏,研磨后过400目滤网,细胞悬液离心后加入淋巴细胞分离液离心取中层白色细胞。加入PE-抗CD25和PE磁珠,阳性选择(阳选)获得CD25+T细胞,阴性选择(阴选)获得CD25-T细胞。用CD25+T细胞解离试剂解离后,阴选细胞以FITC-抗CD4和CD4磁珠阳选即得CD4+CD25+Treg;CD25-T细胞以FITC-抗CD4和CD4磁珠阳选即得CD4+CD25-T细胞。流式细胞仪检测双阳性细胞的纯度。用质量分数0.4%锥虫蓝对CD4+CD25+Treg进行染色,观察细胞存活率。用含体积分数20%小牛血清的RPMll640培养液于48孔培养板中,在CO2培养箱中培养。各组于第3日分离CD4+CD25+Treg培养12h,再以培养液调整CD4+CD25+Treg和CD4+CD25-T细胞浓度为1:1培养,刀豆素A(ConA,5mg/L)进行刺激,37℃CO2培养箱中培养68h后离心取上清液,于-70℃冰冻待检。3.3检测与分析Treg凋亡率检测:分离细胞后培养12h,悬浮CD4+CD25+Treg(1×109/L)用磷酸盐缓冲液(PBS)洗2次,加入100μL结合缓冲液和APC标记的AnnexinV(20mg/L)10μL,室温避光30min,再加入放线菌素D(7-AAD)10μL,避光反应5min后,加入400μL结合缓冲液,流式细胞仪选择7-AAD阴性AnnexinV阳性细胞为凋亡细胞,检测细胞凋亡率。Foxp3和CTLA-4表达检测:100μL制备好的CD4。CD25+Treg(1×109/L)加1m1新配制的破膜液,4℃避光孵育2h,再用2mL破膜缓冲液洗涤;加PE-抗Foxp3,暗处4℃孵育30min后用2mL破膜缓冲液洗涤,离心弃上清液,加入0.5mLPBS,流式细胞仪检测Foxp3的平均荧光强度。重悬细胞(1×109/L)中直接加PE-CTLA-4,4℃避光孵育30min,检测CTLA-4平均荧光强度。细胞因子检测:包括Treg分泌的主要抑制性细胞因子IL-10,Thl分泌的IFN-γ,Th2分泌的IL-4。IL-10标本来源于各组分离的Treg培养12h后收集的上清液,IFN-γ、IL-4标本来源于CD4+CD25+Treg和CD4+CD25-T细胞共培养68h后的上清液。用ELISA试剂盒检测,严格按说明书操作,分别计算出标准曲线和回归方程,将样品吸光度代入标准曲线,计算出样品中细胞因子的蛋白浓度。实验结果结果表明:模型组Treg凋亡率明显低于对照组(p<0.05),实验组4-实验组12均显著高于模型组(p<0.05),实验组1-实验组3趋势相近,但无显著差异。模型组Foxp3、CTLA-4表达明显高于对照组(p<0.05),实验组4-实验组12均显著低于模型组(p<0.05),实验组1-实验组3趋势相近,但无显著差异。模型组IL-10分泌水平明显高于对照组(p<0.05),而实验组4-实验组12均显著低于模型组(p<0.05),实验组1-实验组3趋势相近,但无显著差异。模型组IFN-γ和IL-4水平较对照组大幅度升高,实验组4-实验组12的IFN-γ和IL-4水平均进一步增加,与模型组相比差异有统计学意义(p<0.05);实验组1-实验组3趋势相近,但无显著差异。上述发现提示,实施例3-5,9个批次多组分注射液可促进脓毒症Treg凋亡,改善Treg、效应T细胞的细胞因子分泌,有助于纠正机体细胞免疫抑制状态。表5-1实施例2-5,12个批次多组分注射液对脓毒症大鼠Treg凋亡率及Foxp3、CTLA-4表达的影响(n=10)单位:%注:#表示与对照组相比p<0.05;*表示与模型组相比p<0.05。表5-2实施例2-5,12个批次多组分注射液对脓毒症大鼠Treg、效应T细胞分泌细胞因子水平的影响(n=10)单位:ng/L注:#表示与对照组相比p<0.05;*表示与模型组相比p<0.05。经过相关检测我们发现,本发明所述的多组分注射液具有质量稳定,生产工艺简单,便于生产,安全有效等特点。本申请中提到相关化合物简表:附图说明图1组间内毒素诱导脓毒症小鼠生存率的比较注:实验组1-12与模型组相比均具有显著统计学差异(p<0.05)。图2组间盲肠结扎穿孔术介导的脓毒症小鼠生存率的比较注:实验组7-12与模型组相比均具有显著统计学差异(p<0.05)。具体实施方式通过以下具体实施例对本发明作进一步的说明,但不作为限制。实施例1注射液中有效成分的检测方法方法1:用于红花和赤芍成分分析的色谱分离条件色谱柱:WatersHSST3UPLCC18色谱柱(100mm×2.1mm;1.8μM,Waters,USA);柱温:45℃;流动相:A:H2O(含25mMHCOOH,B:MeOH(含25mMHCOOH);梯度洗脱见表6;流速:0.35mL/min;进样量:5μL;分析时间:13min。表6红花和赤芍成分液相梯度洗脱条件方法2:用于丹参成分分析的色谱分离条件色谱柱:WatersHSST3UPLCC18色谱柱(100mm×2.1mm;1.8μM,Waters,USA);柱温:45℃;流动相:A:H2O(含25mMHCOOH),B:MeOH(含25mMHCOOH);梯度洗脱见表7;流速:0.35mL/min;进样量:5μL;分析时间:20min。表7丹参成分液相梯度洗脱条件时间(min)溶剂A溶剂B0.098%2%1.098%2%15.030%70%17.02%98%20.098%2%方法3:用于川芎和当归成分、腺嘌呤及腺苷分析的色谱分离条件色谱柱:WatersHSST3UPLCC18色谱柱(100mm×2.1mm;1.8μM,Waters,USA);柱温:45℃;流动相:A:MeOH-H2O(v/v,1:99),其中包含1mMHCOOH和25μM,CH3COOLi;B:MeOH-H2O(v/v,99:1),其中包含1mMHCOOH和25μM,CH3COOLi;梯度洗脱见表8;流速:0.35mL/min;进样量:5μL;分析时间:8min。表8川芎和当归成分、腺嘌呤及腺苷液相梯度洗脱条件时间(min)溶剂A溶剂B0.094%6%7.05%95%8.094%6%实施例2多组分注射液的制备取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏。取上述干膏适量,用注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。按此工艺制备三批注射液,有效成分检测结果如下:实施例3多组分注射液的制备工艺取红花饮片100g,加入8倍量的30%乙醇浸提8小时,滤取4~6倍量药液,加入95%乙醇使含醇量至70%,冷存48小时,过滤,滤液减压浓缩至100ml;浓缩液加入95%乙醇使含醇量至80%,冷存48小时,滤过,滤液回收乙醇,浓缩,真空干燥制成红花干膏。取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏。取两种干膏各适量,用注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。按此工艺制备三批注射液,有效成分检测结果如下:实施例4多组分注射液的制备工艺取红花饮片100g,加入8倍量的30%乙醇浸提8小时,滤取4~6倍量药液,加入95%乙醇使含醇量至70%,冷存48小时,过滤,滤液减压浓缩至100ml;浓缩液加入95%乙醇使含醇量至80%,冷存48小时,滤过,滤液回收乙醇,浓缩,真空干燥制成红花干膏。取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏。取川芎、当归饮片各100g,按赤芍工艺方法处理,每次浓缩液为300ml,萃取用水饱和正丁醇每次为150ml,制成干膏。取三种干膏各适量,用适量注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。按此工艺制备三批注射液,有效成分检测结果如下:实施例5多组分注射液的制备工艺取红花饮片100g,加入8倍量的30%乙醇浸提8小时,滤取4~6倍量药液,加入95%乙醇使含醇量至70%,冷存48小时,过滤,滤液减压浓缩至100ml;浓缩液加入95%乙醇使含醇量至80%,冷存48小时,滤过,滤液回收乙醇,浓缩,真空干燥制成红花干膏。取赤芍饮片100g,加入10倍量工艺用水加热煮沸,保持微沸两小时,滤过,收集滤液I,药渣继续用8倍量工艺用水加热煮沸,保持微沸一小时,弃去药渣,收集滤液II,合并药液I和II,浓缩至100ml;第一次浓缩液搅拌下加入适量明胶溶液,加入95%乙醇使含醇量达70%,冷存24小时,滤过,滤液浓缩至100ml;第二次浓缩液加入水饱和正丁醇萃取四次,每次50ml,合并萃取液,回收正丁醇至无醇味,真空干燥制成赤芍干膏。取川芎、丹参、当归饮片各100g,按赤芍工艺方法处理,每次浓缩液为300ml,萃取用水饱和正丁醇每次为150ml,制成干膏。取三种干膏各适量,用适量注射用水溶解,稀释至200ml,冷存;取冷存液,按注射液总量4.5%比例加入无水葡萄糖,加入注射用水至1000ml,用10%氢氧化钠调节PH值至5.5-7.0,冷存,取冷存液超滤,取适量增溶辅料加适量注射用水溶解,加入上述超滤液中,用10%氢氧化钠调节PH值至5.5-7.0,过滤,灌封,灭菌即得注射液。按此工艺制备三批注射液,有效成分检测结果如下:当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1