CAR-T细胞的肝动脉灌注的制作方法
这项申请要求美国临时申请No.62/147793的利益,2015年4月15日提交,其内容全部纳入参考。
关于政府利益的声明
这项发明是由国家卫生研究院授予的合同K08CA160662政府支持的。政府在这项发明中有一定的权利。
对序列列表的引用
一个序列列表是通过EFS以电子方式提交的,其形式是2016年4月14日创建的文本文件,命名为"0962010121SequenceListing.txt"(14034字节),其中的内容通过引用完整地合并在这里。
技术领域
本文所述的主题涉及一种治疗肝相关癌症和经肝动脉输注基因修饰或嵌合抗原受体T细胞(例如,汽车t)表达受体蛋白的方法肿瘤特异性抗原,激活修饰T细胞的活性。
背景技术:
肝转移(LM)是癌变的肿瘤,从身体的另一部分扩散到肝脏。大多数肝转移病例是由结肠癌或直肠癌形成的,约60至70%的人结直肠癌最终发展为肝癌。肝转移是胃肠道腺癌患者发病率和死亡率的重要原因。肝切除术已被认为是治疗切除肝转移的标准,但许多患者并不是肝转移的候选者。化疗不能治疗肝转移,造成大量未满足的临床需要。
肿瘤浸润淋巴细胞(直到)的研究表明,宿主T细胞对LM的反应是患者生存的重要相关性(Katz et al.,2013,Ann外科Oncol,20:946-955;Katz等al.,2010,HPB(牛津),12:674-683;Katz等al.,安外科Oncol,16:2524-2530;瓦格纳等al.,2008,安外科Oncol,15:2310-2317;特科特et al.,癌症免疫水库,2:530-537)。虽然那些对LM有效免疫应答的人往往有延长的生存期,但绝大多数的患者在内源性免疫衰竭的情况下屈服于他们的疾病。肝内环境的免疫抑制性(康托等al.,1967,自然,215:744-745;Katz等al.,2005,Hepatol,42:293-300;Katz等al.,2004,J免疫,173:230-235;Katz et al.,2011,J免疫,187:1150-1156)可以促进LM的发展,并有助于侵袭性疾病生物学。
因此,需要有治疗策略,以促进宿主或提供免疫反应的存在肝转移。鉴于强健的肝脏对反应的良好影响和肝内间隙的内在抑制性,为治疗LM提供高度特异的immunoresponsive细胞是一种合理的方法。本文介绍了抗CEA汽车的肝动脉灌注(海)的组成和方法,既能限制肝外毒性,又能优化治疗肝脏转移瘤的效果。
技术实现要素:
下面所描述和说明的以下方面和实施例是示范性的,而且是不受限制的。
在一个方面,一个治疗肝转移的方法在一个被诊断为肝转移的主题提供,包括注入到主体的肝动脉的成分组成一个immunoresponsive细胞,表达一个嵌合抗原t细胞受体蛋白(汽车),其中嵌合t细胞受体蛋白结合到一个抗原表达的转移肝细胞。
在一些实施例中,表达汽车的immunoresponsive细胞由t细胞、造血干细胞、自然杀伤细胞、自然杀伤t细胞、B细胞和细胞谱系细胞组成的组中选择。在特定实施例中,immunoresponsive单元格是T单元格。
在一些实施例中,immunoresponsive细胞是自体的主体。在另一个实施例中,immunoresponsive细胞不是自体地向主体。
在某些实施例中,immunoresponsive细胞是T细胞,该方法包括从该主体的血清中采集细胞。在其他实施例中,从该主题的血清中获取至少108、109或1010细胞。在其他的实施例中,该方法还包括分离和激活所采集细胞的外周血单个核细胞(PBMC),以产生自体T细胞的数量。
在一些实施例中,该方法包括染immunoresponsive细胞与核酸载体,包括核酸序列编码的汽车序列,以产生immunoresponsive细胞的人口表达的汽车蛋白。在其他实施例中,该方法还包括选择和扩展表达汽车蛋白的immunoresponsive细胞的数量。在一些实施例中,immunoresponsive细胞是自体T细胞的种群。
在一些实施例中,该方法包括注入一剂量的immunoresponsive细胞,将汽车蛋白表达到病人的治疗期间,从约1至8周,2至8周,2至6周,2至4周,1至4周,1至3星期,1至2星期,3至6星期,或4至6星期。在其他实施例中,注入immunoresponsive细胞的表达的汽车包括注入细胞每周,2周,3周或4周的治疗期。在优选的实施例中,immunoresponsive细胞的输注包括将CEA的汽车t细胞每周注射一次,为期3周。
在一些实施例中,表达汽车(车载t细胞)的immunoresponsive细胞和汽车与CEA的结合是自体T细胞。在另一个实施例中,表达汽车(汽车t细胞)和汽车绑定到CEA的immunoresponsive细胞是nonautologous T细胞。
在一些实施例中,注入病人的immunoresponsive细胞的剂量大约是107-1010或108-109的汽车t细胞。在其他实施例中,注入患者的immunoresponsive细胞剂量约为107、108、109或1010immunoresponsive细胞。在优选的实施例中,immunoresponsive细胞是T细胞,汽车结合到CEA。
在一些实施例中,该方法包括注入由immunoresponsive细胞组成的成分和药学相容的溶液,其中总体积的组成范围从大约25毫升到125毫升,50毫升到75毫升,75毫升到100毫升,或50毫升,以100毫升。在优选的实施例中,immunoresponsive细胞是T细胞,汽车结合到CEA。
在一些实施例中,该组合物通过外科技术对肝动脉进行管理。在其他实施例中,该组合物通过经皮穿刺技术对肝动脉进行管理。在其他实施例中,经皮穿刺技术的管理在胃十二指肠动脉和/或胃动脉栓塞之前。
在一些实施例中,该方法进一步包括使用血管造影来确认输液过程中肝内血流动力学的完整性。
在一些实施例中,该方法包括通过经皮导管注入包含immunoresponsive细胞的组合物和药学相容的溶液,并进行肝脏容积计算来划分肝动脉剂量以反映异常的解剖考虑。
在某些实施例中,该方法还包括将第二治疗剂注入到该主题的肝动脉中。在其他实施例中,第二治疗剂为interleukin-2(IL-2)。在其他实施例中,第二种治疗剂抑制immunoresponsive细胞在主体中的抑制,与immunoresponsive细胞在不被管理的IL-2中的抑制相比较。
在一些实施例中,该方法的结果是15-50%,20-50%,30-50%,40-50%,或19至48%的血清cea降低与cea水平相比,之前的IL-2管理的主题。在另一个实施例中,血清CEA的下降发生在输液后1、2、3、4或5天。
在一些实施例中,IL-2是以连续的系统剂量进行管理的,范围从2.5万至15万人/千克/日,2.5万至7.5万人/千克/日,5万至10万每千克/公斤/日在车t处理期间。在其他实施例中,IL-2是以连续的系统剂量进行管理,大约2.5万、3.5万、4万、5万、6万、7.5万、8.5万或10万/公斤/日。在一个优选的实施例中,IL-2是以连续的系统剂量,大约5万每千克/公斤/天。
在某些实施例中,在表达嵌合T细胞受体蛋白的immunoresponsive细胞输注之前、期间或之后进行第二治疗剂的注入。
在一些实施例中,该方法还包括对主体的肝动脉进行放射治疗的管理。在其他实施例中,辐射疗法包括对含有yttrium-90(90Y)的多个微球进行管理。在其他实施方案中,管理辐射疗法包括管理约1至4gigabecquerels(GBq)、1至3GBq、2至4GBq、3至4GBq、或2至3GBq放射性物质。在其他实施方案中,管理辐射疗法包括管理大约1GBq、1.5GBq、2GBq、2.5GBq、3GBq、3.5GBq或4GBq放射性物质。
在一些实施例中,放射治疗的管理包括放射治疗的1周,2周,或3周后的最后一个汽车t输液。
在一些实施例中,该主题被诊断为一种转移性疾病,其局限性是肝脏。在其他实施例中,转移性疾病是一种癌症。在其他的实施例中,癌细胞从乳腺、结肠、直肠、食道、肺、胰腺和/或胃的原发性肿瘤转移。在其他实施例中,该主题被诊断为无法切除的转移性肝肿瘤。在其他实施例中,该主题被诊断为无法切除的原发性结直肠癌转移性肝肿瘤。在某些实施例中,该主题被诊断为肝细胞癌。
在某些实施例中,该主题被诊断为肝转移,其中肝转移的恶性细胞已被证明表达了癌胚抗原(CEA)蛋白。
在某些实施例中,该方法导致肝脏肿瘤负担降低。在其他实施例中,使用正电子发射断层扫描(PET)、磁共振成像(MRI)或活检来测量肿瘤负担的减少。在仍然其他实施例中,其中肿瘤负担被测量1-8星期,或大约1,2,3,4,5,6,7或8星期在治疗期间以后。在其他的实施例中,相对于肿瘤负担的减少是在注入T细胞剂量之前测量的。
在一些实施例中,肿瘤负担测量1-8周,或约1,2,3,4,5,6,7或8周后的治疗期不超过50%到90%的肿瘤负担之前,第一剂量的汽车t细胞。
在一些实施例中,一种降低被诊断为肝转移的主题的肿瘤负担的方法,包括对本主题中描述的汽车t细胞的管理。在其他实施例中,肿瘤负担减少到小于10%,20%,30%,40%,50%,60%,70%,80%或90%的肿瘤负担之前,管理的汽车t细胞的主题。
在一些实施例中,一种减少诊断为肝转移的患者血清中CEA含量的方法,包括对本主题中所述的汽车t细胞进行管理。在其他实施例中,在管理汽车t细胞之前,cea的数量减少到小于10%、20%、30%、40%、50%、60%、70%、80%或90%的cea的数量。
在一些实施例中,嵌合T细胞受体蛋白包括一个胞外域,它特异地结合在肝脏转移细胞表面表达的肿瘤抗原。在其他实施例中,嵌合T细胞受体蛋白包括一个特异结合癌胚抗原(CEA)蛋白的胞外域。
在某些实施例中,嵌合T细胞受体蛋白包括在N端至C端方向、CEA结合IgG免疫球蛋白域、CD8铰链域、CD28胞外域、CD28跨膜域、CD28胞质域和CD3泽的细胞质域。
在某些实施例中,CEA-结合IgG免疫球蛋白域包括SEQ ID NO:1。
在一些实施例中,CD8铰链区域包括一个序列,它是12氨基酸的长度,这是至少75%,83%,91%,或100%相同的序列的残留169-180的SEQ ID NO:2。
在一些实施例中,CD28胞外域包括一个序列,它是40氨基酸的长度,这是至少92%,95%,97%,或100%相同的序列的残留113-152的SEQ ID NO:4。
在一些实施例中,CD28跨膜领域包括一个序列,它是27氨基酸的长度,这是至少88%,92%,96%,或100%相同的序列的残留153-179的SEQ ID NO:4。
在一些实施例中,CD28信号域包括一个序列,它是41氨基酸的长度,这是至少90%,92%,95%,97%,或100%相同的序列的残留180-220的SEQ ID NO:4。
在一些实施例中,泽塔细胞质域包括一个序列,它是113氨基酸的长度,这是至少90%,95%,97%,98%,99%,或100%相同的序列的残留52-164的SEQ ID NO:3。
在某些实施例中,嵌合的t细胞受体蛋白在t细胞受体蛋白的N末端有一个信号序列。在其他实施例中,信号肽至少84%、89%、94%或100%与SEQ ID NO:6相同。
在一些实施例中,该方法是肝免疫治疗转移瘤。
附图说明
图1说明了在经修饰的immunoresponsive细胞输注前患者的CD3+和汽车+细胞的平均百分比。
图2说明了检测CEA+靶细胞的病人产品的结果。
图3说明了一个阶段1临床试验协议,以测试改良immunoresponsive细胞的治疗效果,如下所述。
图4说明了根据本文所述方法治疗的患者血清CEA水平。
无花果5a-5b说明lm纤维化(图5A)和lm坏死(图5B)的病人按照本文所述方法治疗。
图6示出了根据本文所述方法处理的患者的IFNy水平。
图7示出了根据本文所述方法处理的患者中的峰和平均IFNy水平。
具体实施方式
下文将更全面地介绍各个方面。然而,这些方面可以以许多不同的形式体现出来,不应被解释为仅限于此处所述的实施例;相反,提供这些实施例是为了使这一披露彻底和完整,并将其范围充分传达给那些熟练的art。
I.一种i定义
如本规范所用,单数形式的"a"、"a"和"the"包括复数指,除非上下文明确规定。因此,例如,提及"聚合物"包括一个单一的聚合物,以及两个或多个相同或不同的聚合物,参考"辅料"包括一个单一的赋形剂以及两个或多个相同或不同的辅料,等等。
如果提供了一系列值,则在该范围的上限和下限与任何其他声明的或干预的值之间的每个干预值都包含在披露中。例如,如果一个范围为1毫升到8毫升的陈述,它的目的是,2毫升,3毫升,4毫升,5毫升,6毫升,7毫升也明确披露,以及范围的价值大于或等于1毫升和范围的价值小于或等于8毫升。
"病人"、"主语"、"个人"等术语在本协议中交替使用,并引用任何动物或细胞,不论是体外还是原位,均符合本文所述的方法。在某些限制性实施例中,患者、主体或个人是人。
此处使用的"治疗"一词指治疗和/或预防。治疗效果是通过抑制、缓解或根除疾病状态而获得的。
"治疗"一词在本协议中的使用,意味着减少某一主题所经历的疾病或紊乱的至少一个征兆或症状的频率或严重性。此处使用的"转染"或"转化"或"转"一词是指将外源核酸转移或引入宿主细胞的过程。"转染"或"转化"或"转"细胞是一个已被转染,转化或转与外源核酸。单元格包括主要的主题单元格及其子代。
在这里使用的术语"治疗有效"适用于剂量或数量指的是化合物或药物组成的数量(例如,组成包括免疫细胞,如T淋巴细胞和/或NK细胞)组成的嵌合受体的披露,并进一步组成一种耐药性多肽,足以使所需的活动在管理上对需要的对象产生影响。在本项披露的范围内,"治疗有效"一词指的是一种化合物或药物组合物的数量,足以延缓其表现,逮捕进展,减轻或减轻至少一由目前披露的方法处理的一种紊乱症状。请注意,当有效成分的组合被管理时,该组合的生效量可能会也可能不包括每种成分的数量,如果单独管理,它们将有效。
在这里使用,"肿瘤负荷"或"肿瘤负担"的表达是指肿瘤细胞的数量,瘤的大小,或在主体体内的癌症的数量。
这个术语"嵌合受体"被定义为一个细胞表面受体,包括一个胞外配体结合域,跨膜域和一个或多个细胞质刺激信号域的组合,是不自然发现一起在一个单一的蛋白质。这特别包括受体,其中细胞外域和细胞质领域是不自然地发现在一起的单一受体蛋白。目前披露的嵌合受体主要用于T细胞和自然杀伤细胞。本文所述的嵌合受体也可称为嵌合抗原受体(CAR)、嵌合配体受体或嵌合T细胞受体。
在这里使用的,"具体结合"在一个嵌合t细胞受体的表达,意味着嵌合t细胞受体结合其目标蛋白与更大的亲和力,它对一个结构不同的蛋白质(s)。
II.的CAR-T细胞肝动脉输注
研究表明,肝转移(lm)患者的强健T细胞反应有显著改善的结果,然而,大多数LM患者未能安装有效的肝内抗肿瘤免疫(Katz et al.,2003,Ann外科复习,20:946-955)。嵌合抗原受体修饰t细胞(车t),高度特异的免疫产品设计靶向特定肿瘤抗原,在提供所需的抗肿瘤免疫,特别是在诊断为不能切除的肿瘤患者的承诺。虽然对抗原特异性的t细胞的管理在白血病的早期临床试验中显示出令人鼓舞的结果,但成功地适应了CEA表达腺癌LM的汽车t技术,这是患者死亡的主要原因。胃肠癌,尚未实现。据此,本文设计并进行了一期临床试验,以说明汽车t技术是治疗LM的一种可行的选择。此外,临床研究通过系统性输液解决了低效肝内分娩的问题,从而限制了LM治疗的有效性。以下是对t型肝动脉输注(海)的研究,以表明在治疗lm时,直接区域送t对lm是安全有效的。总之,数据表明,巴哈是良好的耐受性和证据的肿瘤细胞的杀害,表明,肝动脉输注(海)的车t到lm可以确实有效地治疗lm患者的需要。
嵌合抗原受体T细胞
T细胞工程与嵌合抗原受体(汽车),以使高度特异的肿瘤识别和杀戮得到了相当大的关注后,有希望的临床结果(Grupp et al.,2013,N英医学,368:1509-1518;波特et al.,2011,N英医学,365:725-733;Sadelain et al.,2009,课程奥平免疫,21:215-223)。用汽车基因重新编程T细胞提供了一种独立于MHC的机制来对接和溶肿瘤细胞。这种修饰的t细胞被称为"设计t细胞","t体"或"汽车t细胞"(Ma et al.,2002,癌症化疗和生物反应修饰剂:唯科学,pp 319-345;公园et al.,2011,趋势生物技术,29:550-557;Ma et al.,2014,前列腺,74:286-296)。癌胚抗原(cea)是一种有吸引力的靶向治疗腺癌LM高度的cea表达和能力的检测cea在血清(门撒尔et al.,2007,BMC癌,7:2;Midiri et al.,1985,癌症,55:2624-2629)。抗原识别,抗CEA的汽车Ts增殖,产生细胞因子,并杀死目标细胞(Emtage et al.,临床癌症水库,14:8112-8122)。
产生嵌合抗原受体(汽车)蛋白和免疫细胞(例如,immunoresponsive或T细胞)表达这些蛋白质是众所周知的艺术,并结合了靶向功能和特异性的配体或抗体或片段,其与免疫细胞的抗肿瘤活性。见例如,Sadelain et al.,2013,癌症发现,3:388-398。嵌合抗原受体蛋白通常包括在N端至C端方向:靶结合域,该区域专门绑定在病变靶细胞表面表达的蛋白质(如癌细胞或恶性肿瘤细胞。腹膜腔)、铰链域、跨膜域和免疫调节信号域。
在优选的实施例中,汽车蛋白的目标结合域与CEA蛋白有关。这种CEA结合蛋白是由一种人性化的单克隆抗体(美国Pat)产生的。No.6676924;赤松et al.,1998,临床癌Res,4:2825-2832;诺兰et al.,1999,临床癌症水库,5:3928-3941)。在生成反CEA的汽车结构,抗体结构是由重和轻链变量域的方法在艺术中使用的惯例,然后抗体片段(在此披露为SEQ ID NO:1)被融合到其他受体领域,以产生在目前所描述的治疗方法中使用的汽车。
以下表1提供了每个铰链域、跨膜域和信令域的首选实施例。在一些实施例中,该汽车构造包括在N端向C终端方向的CEA-结合域,一个CD8铰链域,一个CD3的齐塔链跨膜领域,和一个CD3的齐塔链细胞质领域。在优选实施例中,该汽车构造包括在N端向C终端方向的CEA-结合域、CD8铰链域、CD28胞外域、CD28跨膜域、CD28信号域和CD3泽塔链细胞质域。在某些实施例中,该构造还包括与目标绑定域的N末端融合的信号肽。据了解,信号肽是不存在的汽车蛋白表达的管理immunoresponsive细胞,因为它已经在体内被劈开。
表1
在某些实施例中,嵌合受体蛋白的靶结合域包括免疫球蛋白的抗原结合部分,其中免疫球蛋白将蛋白质附着在患病细胞的表面上。抗原结合域可以是任何领域,绑定到细胞表面抗原,包括但不限于配体的受体或免疫球蛋白蛋白,如单克隆抗体,多克隆抗体,合成抗体,人的抗体,人性化的抗体,以及其中的片段。在优选的实施例中,汽车的抗原结合域是由抗体的可变域构造的,当某一汽车构造的一部分时,能够特别地结合抗原。在某些情况下,这是有益的抗原结合领域,从同一物种的汽车将最终使用。例如,在人类的使用,它可能是有益的抗原结合领域的汽车,包括一个片段的人或人性化的抗体。因此,在某些实施例中,汽车的抗原结合域部分包括人类或人性化抗体的肿瘤抗原结合片段。在每个实施例中,抗体的抗原结合域,如单可变片段(抗体)或一个晶圆片或被融合到跨膜领域和信号细胞内域(endodomain)的T细胞受体。通常,在胞外抗原结合域和跨膜域之间引入一个间隔或铰链,以提供灵活性,使抗原结合域在不同方向定向,以促进抗原识别和结合。
在某些实施例中,嵌合抗原T细胞受体的抗原结合基团部分靶向cea抗原,包括抗体的cea结合域,它已被证明对细胞表面表达的cea有约束力。嵌合受体结构可以根据通常熟练的工匠所知的方法和组合生成。例如,在下面的例子中使用的CEA汽车t构造包含了一个人性化的MN14抗体的可变域的部分(在美国专利No.5874540中描述,其中的内容通过引用它的全部来并入这里)。根据诺兰et al.的方法,可以从CEA抗体中生成一个抗体结构。(1999,临床癌症Res,5:3928-3941)包括cea抗体的cea结合域。在某些实施例中,CEA CAR结构包括一个氨基酸序列,它至少90%、95%、96%、97%、98%、99%或100%相同于SEQ ID:1如下所示:
DIQLTQSPSSLSASVGDRVTITCKASQDVGTSVAWYQQKPGKAPKLLIYWTSTRHTGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQYSLYRSFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:1)
在一些实施例中,cea车t构造进一步包括在NO:1的N端的信号肽,它是在cea T型结构的体内表达后从构造中切割出来的。信号序列是众所周知的一般技能工匠和功能,以指导翻译的蛋白质的细胞表面。从内质网在汽车蛋白质易位到细胞表面的过程中,信号序列被劈开。在其他实施例中,信号肽具有序列MGWSCIILFLVATATGVHS(SEQ ID NO:6)。在其他实施例中,在信号肽和CEA结合域之间存在一个包含1、2、3、4、5或6氨基酸的链接器序列。
然后,抗体域可以通过一个多肽键与铰链域(如从CD8铰链域(见SwissProt/基因库Acc)的C终点融合。不。P01732;SEQ ID NO:2)。在优选的实施例中,铰链域包括长度为12氨基酸的序列,并且至少83%、91%或100%相同于序列的残滓169-180的序列号NO:2。在其他实施例中,铰链域包括至少95%、96%、97%、98%、99%或100%相同的序列,其continguous序列为10-20、10-30、10-40或10-50残滓,在残留111-190中存在于SEQ ID NO:2。
然后铰链域可以融合在其C总站到跨膜领域。在一些实施例中,跨膜领域包括一个序列,这是从CD3泽塔链(基因库/SwissProt Acc。不。P20963;SEQ ID NO:3)。在这个实施例中,跨膜域包括一个序列,它是20-30氨基酸或20,21,22,23氨基酸的长度和至少85%,90%,95%或100%相同的连续序列15-25或20-30残留在残留31-51的SEQ ID NO:3。在某些实施例中,CD3泽塔链的跨膜领域包括在SEQ ID NO:3的位置31-51的氨基酸序列。在优选的实施例中,该汽车的跨膜领域来自CD28蛋白(如基因库/SwissProt Acc。不。P10747;SEQ ID NO:4)。跨膜领域可以包括一个序列,这是27氨基酸的长度和至少88%,92%或100%相同的序列的残留153-179的SEQ ID NO:4。在其他实施例中,跨膜域包括至少95%、96%、97%、98%、99%或100%的序列,其相同于20-30、20-40或20-50残滓序列中存在的连续序列,即残留150-190的SEQ ID NO:4。当汽车跨膜领域作为一个CD28跨膜领域如上所述,该车可以进一步组成一个CD28胞外领域,其中的胞外领域是定位之间的CD8铰链领域和CD28跨膜领域。CD28胞外域是35-45,或约38,39,40,41,或42氨基酸的长度,是至少92%,95%,97%或100%相同的连续序列的35-45残留物的序列中存在110-160的序号ID NO:4。
CD3泽塔链细胞质域是存在于汽车构造的C端,包括一个序列,它是至少90%,93%,95%,96%,97%,98%,99%或100%相同的连续序列100-120氨基酸存在于残留序列40-164的SEQ ID NO:3。在优选的实施例中,泽塔链域包括至少97%、98%、99%或100%相同的序列,其残滓52-164为SEQ ID NO:3。
在优选的实施例中,该车进一步包括CD28信号域C终端到跨膜域和N终端到CD3泽塔链细胞质域。在某些实施例中,CD28信令域包括至少92%、95%或100%相同的序列,它与35-45氨基酸的连续序列相一致,在残余序列中存在175-220的SEQ ID NO:4。在优选的实施例中,CD28信令域包括至少92%、95%或100%与残留180-220的SEQ ID NO:4相同的序列。
在优选实施方案中,CAR多肽序列包括N-端到C-端的方向:包括SEQ ID NO:l的CEA结合域,如上所述的CD 8铰链结构域,如上所述的CD 28细胞外域,如上文所述的CD 28跨膜结构域,如上所述的CD 28信号域和如上所述的CD 3ζ细胞质域在一个实施例中,该CAR序列包括在N-端到C端域中的每个下段:SEQ ID NO:l(CEA结合域),SEQ ID NO:2的残基169-180(CD 8铰链),SEQ ID NO:4的残基113-152),SEQ ID NO:4的残基153-179),SEQ ID NO:4的残基180-220(CD 28胞质域),SEQ ID NO的残基52-164一种3ζ链胞质域)(在本文中称为"抗CEA 80")使用常规方法构建CAR构建体可包括使用全长度基因序列的PCR扩增和引入限制核酸内切酶位点,所述限制性核酸内切酶位点允许各种域的消化和连接以生成所需融合构建物,还可以在所述嵌合构建体的每个域之间编码一种或多种氨基酸因此,在一些实施例中,CAR序列包括1的连接序列,2或3个氨基酸,所述两个或3个氨基酸在所述铰链与
在跨膜和信令域之间的细胞外域和跨膜结构域之间的CD 28细胞外结构域,在所述跨膜和ζ胞质域之间,和/或在所述CD 28信号和ζ胞质域之间
一种CAR-T细胞的制备方法
在扩张和基因修饰之前,从一个需要治疗肝转移的课题获得了一个T细胞来源。T细胞可以从多个来源获得,包括外周血单个核细胞、骨髓、淋巴结组织、脐血、胸腺组织、感染部位的组织、腹水、胸腔积液、脾脏组织和肿瘤。在目前的披露的某些方面,任何数量的T细胞线可在艺术中使用。T细胞可以从一个对象收集的血液单位使用的技术熟练的工匠,如FicollTM分离。在优选的实施例中,个体的循环血液中的细胞由采。采产品通常含有淋巴细胞,包括T细胞、单核、粒、B细胞、其他有细胞核的白细胞、红细胞和血小板。由采收集的细胞可以被洗涤去除血浆分数和安置细胞在适当的缓冲或媒介为后继处理步。因为那些在艺术中的普通技能会很容易地欣赏一个洗涤步骤可以完成的方法已知的艺术,例如通过使用半自动流式离心机根据制造商的指示。洗涤后,细胞可以悬浮在各种生物相容性的缓冲区,例如,例如,无钙,无镁PBS,或其他含或无缓冲的盐水溶液。或者,采样品的不良成分可能被移除,细胞直接悬浮在培养基中。
T细胞的特定亚群,如CD3+,CD28+,CD4+,CD8+,CD45RA+和CD45RO+t细胞,可以被分离和/或丰富的积极或消极的选择技术。例如,在某些实施例中,t细胞是通过孵化与anti-CD3/anti-CD28-conjugated珠分离的,在一段时间内就足以使所需的t细胞得到积极的选择。熟练的工匠会认识到,在这一披露的背景下,还可以使用多轮的选择。在某些方面,可能需要执行选择过程并在激活和扩展过程中使用未选定的单元格。未选定的单元格也可能受到进一步的选择。
在某些实施例中,可以选择一个T细胞群来表达一个或多个干扰素、TNFα、IL-17A、IL-2、IL-3、IL-4、GM-CSF、IL-10、IL-13、颗粒B和穿孔,或其他合适的分子,如其他细胞因子。可以确定细胞表达的筛选方法,例如,按PCT出版物No.:禾2013/126712所述的方法。T细胞可以被激活和扩大一般使用的方法,例如,在美国帕特。Nos.6352694;7232566;6797514;6867041;和美国专利申请出版物No.20060121005。
为治疗被诊断为肝转移的受试者的汽车t细胞的准备,患者接受leukapheresis至少4x109t细胞的收获,以一个理想的目标大约6x 109t细胞。对leukapheresis产品中T细胞数的初步评估可以在2小时内进行,并在随后被视为必要时重复进行。细胞被纯化,以检索外周血单个核细胞(PBMC),或者称为淋巴细胞丰富(PBL)。淋巴细胞通过暴露于50ng/ml OKT3和3000毫升IL-2(沃克et al.,1993,4:659-680)激活。活化细胞是转与高效价上清的逆转录病毒含有重组嵌合体汽车如上所述,10微克/毫升鱼精蛋白(Cornetta et al.,1989,23:187-194)。第二天,重复该过程,以增加转细胞的分数。两天后转导细胞的小分分析的流式细胞仪表达的转基因。如果转细胞的分数小于10%,细胞可以再接受两轮转导,再通过流式细胞仪分析转细胞的百分比。当足够数量的T细胞被转(例如,>>10%)细胞被培养,例如,在1.2-1.5x 106/毫升的活化条件下(以上)。激活细胞的其余部分一直保持到传导结果已知,并在必要时用于第二次尝试。转t细胞在培养和监测的增长/转导参数(加倍时间,总细胞数,%转导,T细胞活化指标)。在冷冻储存细胞之前,增加了10%亚甲基亚砜、20%人血清和3000毫升的IL-2。关于何时收获细胞的决定是建立在足够的总细胞的基础上的,这样,在收获之后,足够的细胞就会留在培养基中,以备将来注入。通常,从T细胞活化到剂量收获的间隔时间从2-3周不等。在扩张过程中,流式细胞术用于记录表达嵌合受体的T细胞的存在。其他测试将包括生存能力,不育,和标准的细胞毒性检测cea+和cea目标。多达三的尝试是由患者T细胞,以获得足够的转导效率和细胞数量构成的剂量。在一些实施例中,从不同的transductions中扩展的细胞被汇集在一起以达到剂量。
治疗性的汽车t细胞可以被设计来表达汽车核酸结构的染的人口淋巴细胞与表达载体编码的汽车构造。适当的方法来准备一个转人口的淋巴细胞表达选定的汽车构造是众所周知的熟练技工,包括但不限于逆转录病毒,制造载体,adenovirus-based载体,腺相关病毒(AAV)基源、逆转录病毒载体、反转录酶载体和单纯疱疹病(HSVs)的载体。下面的示例1描述了用于生成用于患者的汽车t细胞的方法。
在优选的实施例中,T细胞被转染为所需的汽车构造的反转录病毒。制造逆转录病毒及其在染真核细胞中的应用是众所周知的人在art.的普通技能对于生成的汽车t细胞,一个表达式卡带编码的CEA汽车可以插入之间的NcoI-BamHI网站的制造逆转录病毒载体骨干。插入序列的起始密码子恰好位于病毒性的起始密码子的位置。制造向量,称为MPSV/PBSQ,可用于其中MoMLV公升已被替换的同源序列从骨髓病毒,和5'入门结合点已被替换的同源序列从一个变种利用tRNAglu而不是tRNApro作为一个积极的股底漆。在某些实施例中,反转录病毒载体不包含可选择的标记基因。从转染细胞的逆转录病毒载体上清液可以使用PG13包装细胞线产生。通过将长臂猿猿白血病病毒(GALV)辅助包装系统稳定地引入小鼠3T3细胞,PG13细胞系的产生。向量生产者细胞(VPC)线是由一个two-step的过程。首先,汽车制造矢量转到GP+E86 ecotropic包装细胞线。从转染细胞中收集并用于感染PG13细胞的瞬态病毒上清液。在感染后,PG13细胞通过流式细胞仪检测汽车转基因表达。然后对细胞进行分类,以稳定表达的汽车转基因由外地资产管制局建立一个主工作的细胞库,并测试安全,不育,身份和缺乏复制能力的逆转录病毒(RCR)。转细胞被冷冻成数量来弥补病人的剂量。在一些实施例中,适当数量的汽车t细胞储存在液氮蒸气阶段在一个包中,其中包含约50-100毫升,75-100毫升,75-125毫升,或约50毫升,75mL,100毫升,或135毫升的解决方案,这是等渗和药学可以接受。在某些实施例中,该解决方案包含约15-25%、15%、20%或25%白蛋白。在其他实施例中,该溶液含有约5-15%、5%、10%或15%二甲基亚砜(亚砜)。在优选的实施例中,溶液体积约100毫升,包含适当数量的细胞,约20%白蛋白和约10%的亚甲基亚砜。在一些实施例中,在冷冻之前,大约4亿IL-2或大约45万个单位被添加到袋子中,以便在管理之前维持细胞的活力。解决方案在管理之前解冻。
车T细胞的肝动脉输注(海)
本文的研究和结果表明,通过肝动脉灌注immunoresponsive细胞的管理可以提供治疗转移到肝脏的癌症的疗效。管理的细胞已被修改为目标肝转移,特别是转移细胞表达CEA,是一个显着更复杂的过程相比,输液,例如,一个小分子化疗。正常细胞,如结肠中的,表达CEA。重要的是要尽量减少或消除正常细胞接触的修改车t细胞,以减少或防止破坏健康细胞。汽车t细胞是免疫细胞,可以分泌各种细胞因子,造成不良副作用。下面介绍的方法来解决这个问题,特别是,手段,以尽量减少暴露的修改immunoresponsive细胞的健康细胞,同时优化接触的修改细胞与患病细胞。
在优选的实施例中,表达immunoresponsive细胞的汽车是反CEA的汽车t细胞,它是用被工程细胞处理的t细胞生成的。当被改变的细胞有效地被转移到肝脏的时候,海T细胞治疗被诊断与肝脏转移的患者将是最有效的,在那里细胞存在。此外,还选择了海T,以尽量减少免疫介导的损伤CEA表达肝外组织。最有可能受益于汽车t疗法的病人是那些被诊断为肝转移,如结直肠癌肝转移。然而,据了解,本文所披露的治疗方法可以有效地治疗患者的肝脏肿瘤细胞或肝转移细胞表达一个或多个蛋白质,被设计和管理的汽车t细胞认可。这种肿瘤抗原包括但不限于碳水化合物抗原(ca)19-9,碳水化合物抗原(ca)125,和胸苷激酶。在优选的实施例中,在车载t细胞表面表达的嵌合受体能识别并结合已知的癌抗原胚抗原。癌胚抗原(CEA)是一种由多种恶性细胞类型表达的mrna细胞表面糖蛋白,包括但不限于大肠、胃、胰、肺、乳腺和甲状腺髓样癌细胞。这样的恶性细胞,转移到另一种器官,如肝脏保持其表型包括表达cea和因此的目标,抗cea免疫。CEA有多个异构体,在结构和序列上是众所周知的,良好的(例如,基因库加入号NP_001171742,NP_001171744,NP_001020083和SwissProt加入号P13688)。目前的方法使用的immunoresponsive细胞的设计,以表达一个嵌合受体蛋白,特别是承认CEA蛋白已知的art。在某些实施例中,嵌合受体蛋白特别结合了CEA蛋白,该蛋白质包括至少90%、95%、98%或99%相同于SEQ ID NO:5的氨基酸序列。
用T细胞治疗的病人已经被诊断出患有肝癌。在一些实施例中,患者可检测到不能切除的cea阳性肝转移或血清cea水平。在其他实施例中,患者失败了一条或多行常规全身治疗或化疗。肝脏MRI和PET检查前进行的汽车t治疗,以确定的位置和程度的癌症或转移。
当将修饰细胞直接注入肝动脉时,大部分被修饰的细胞会直接进入肝脏,许多细胞会因肝动脉解剖的变化而被转移,多达40-45%的人被观察到。在大约80-85%的人口中,正确的肝动脉分支到右、左肝动脉以供应整个肝脏。例如,在其余的人口中,肝动脉仅可分支到右肝动脉,或仅向左肝脏(分别喂养肝的右或左叶)或正常的肝动脉,由异常血管转移一些血液流向肝脏以外的器官因此,重要的是要映射的船只,导致的权利和左叶的肝脏之前,执行海,并在必要时,咬合血管,不导致肝脏。在一些实施例中,在输液之前,病人会进行一个映射血管造影,例如,通过股动脉共同的方法。
在人体内绘制血管的方法是众所周知的熟练工匠。在治疗前完成此类测绘后,医生将确定哪些船只将被阻塞。例如,通过使用圈栓塞,使医生能够阻断不相干动脉或血管,从而优化将改良的细胞送到肝脏,从而实现闭塞。圈栓塞可以在需要之前执行的第一剂量的汽车t细胞,以促进最佳输液的药物组成,包括汽车t细胞。
该方法涉及治疗CAR-T细胞管理经导管肝动脉直接放进。例如,一种药物组合物治疗CAR-T细胞一方面通过肝动脉注射率<1毫升/秒的注射器,<2毫升/秒,或在速度约1至2毫升/次,1~3毫升/次,1~5毫升/次,1毫升/次,2毫升/秒,或3毫升/秒。所述药物组合物包含治疗性CAR-T细胞的剂量(例如,约108,109或1010))总体积为约25-100mL,25-75mL,40-60mL,50-75mL,50-100mL,或其总体积为约25mL,40mL,50mL,60mL,75mL或100mL本文所公开的方法还可包括执行肝脏体积计算以确保给予患者的经修饰细胞的剂量针对右和左肝动脉,从而在整个肝脏中提供治疗有效剂量。根据本领域公知的标准方法进行肝脏容积计算本领域技术人员可以包括但不限于闪烁,超声波,单光子发射计算机断层摄影,计算机断层摄影和磁共振成像。一旦患者的体积计算完成,将所述剂量或数量的经修饰的细胞分成左,左肝动脉#t所述的t型其中,所述多个被修改的小区的数量被传送到所述右瓣和左瓣,所述多个被修改的小区被传送到所述右瓣和左瓣,所述多个被修改的小区被传送到所述右瓣分别与左右瓣的体积成比例
在某些实施例中,50%的总容积被注入到患者体内,车t溶液被搅动以确保完整的细胞悬浮,然后最终50%的总容积被注入病人体内。输液可以用18针的针头来完成。
IL-2的联合管理
患者接受汽车t输液,例如,每周或每2星期在车t治疗期间的期间。车t治疗期间可以是2,3,4,5,6 7,8,9,或10星期或可以为时从2-10,4-9,2-8,2-6,2-4,3-6,4-8或4-6星期。开始的汽车-T治疗期(0天)的一天,血液细胞是从病人得到治疗(或者,或者,从一个主体谁不是病人接受治疗)。接受输注T细胞的患者也可以IL-2。IL-2促进了在输注后的汽车t细胞的生存能力,但是,最好使用剂量的IL-2,不造成或加强不良副作用,如发烧,恶心,呕吐,和/或心动过速。在一些实施例中,IL-2在整个车t处理期内连续地被管理。这种连续输液可以使用泵的蓄水池进行,并通过中央静脉导管或其他方法进行管理,使病人能够行走。IL-2输液可以启动少于1,2或3小时前开始的车t输液,在或期间的第一次车-t输液开始,或在大约1,2或3小时后完成第一个汽车t输液。
CEA轿车第一期试验
1期临床试验,其中8例肝转移瘤(LM)最初登记和治疗的抗CEA汽车t细胞如本文所述。六的病人完成了这个协议。患者分为队列1和队列2。0天所有患者都采集了细胞,用于产生抗cea的汽车t细胞(抗cea scfv-CD8α-CD28/CD3ζ的汽车t细胞)。在天14,28和42,每名患者在队列1在天108,14个细胞在天109和28细胞在天1010接受了42细胞的输注。对于队列2,在天14,28和42,每一个患者接受了输液1010年细胞。队列2中的患者也接受了连续输注7.5万IL-2/千克/日的剂量,从14天开始,在55天或56天结束。关于天56。1和2组患者在56天进行MRI和PET分析。6例完成了该协议的患者的数据表明,巴哈的抗CEA汽车Ts是良好的耐受性和没有系统IL-2输液。在所有患者中,有或没有系统IL-2(见图6),IFNγ的峰值在剂量后24到48小时发生。虽然没有影像学部分或完整的反应,1的6患者有稳定的疾病和存活至少24月随访。
本文所述的研究建立了抗CEA汽车巴哈的安全性和无系统IL-2支持,达到了1010年细胞的最大计划剂量。因此,关于汽车巴哈的安全性和有效性,研究结果支持使用巴哈治疗LM。在研究对象中,有限的系统暴露的汽车t可能占有利的不良事件剖面。系统性IL-2支持与提高血清IFNγ水平和改善CEA反应,以牺牲更严重但可控的不良事件的代价。如例4所示,与正常肝脏和外周血相比,海中的5的6的患者在肝转移中导致了优先积聚的汽车t。在6例患者中,4的人在外周血中未发现汽车Ts,仅在7和8患者中处于瞬时。重要的是,更多的LM坏死和纤维化的组织学证据出现在车t海后的大多数科目(见图5)。这些数据都表明,cea t细胞的有效交付cea+肿瘤沉积与肿瘤的组织学证据和血清细胞因子的激增,支持的治疗效果的汽车t细胞(例如,抗CEA scfv-CD8α-CD28/CD3ζ汽车t细胞)肝动脉灌注治疗肝转移瘤。
在5的6HITM患者中,海中的汽车t在LM的优势积累,与正常的肝脏和外周血相比。在6例患者中,4的人在外周血中未发现汽车Ts,仅在7和8患者中处于瞬时。适度海拔的肝功能测试值(例如,碱性磷酸酶的瞬时升高,总胆红素和天门冬氨酸转氨酶水平)可能与汽车-T海有关,但没有导致临床显著的后果。系统输注t细胞表达抗CEA汽车t以前报告结果的剂量限制毒性(帕克赫斯特et al.,2011,摩尔,19:620-626)。在目前的研究中,类似的毒性在抗CEA车t的系统注入,特别是IL-2支持(未显示)。连续的动态输液剂量的IL-2,7.5万/公斤/日,是several-fold低于什么是在其他协议(罗森博格et al.,1999,J临床Oncol,17:968-975。尽管这项研究的IL-2的每日剂量很低,2患者经历了3级事件,需要IL-2剂量的减少。这些不良事件,包括严重的发热和结肠炎,可归因于IL-2的事实,即症状迅速解决后,IL-2剂量减少。在一个主题,这是可能的IL-2激活了少量的系统循环的抗CEA汽车t,介导发热和结肠炎。总的来说,IL-2输液管理是良好的耐受和不良事件容易管理的剂量减少。
在目前披露的一个方面,每位患者的CEA T细胞的剂量水平是每星期通过海路管理的1010细胞。一周一次的细胞输注的治疗效果由血清肝脏化学和细胞因子的数据支持的1阶段试验公开。在1阶段的研究中,每2周进行一次输液,大多数患者在CEA汽车-T海后的血清碱性磷酸酶、胆红素和天门冬氨酸转氨酶(AST)水平上表现出短暂但临床上微不足道的升高(请参见示例7)。在几乎所有情况下,级别在3-4天内正常化。同样,患者在1周内,在IFNγ和IL-6的水平上表现出了血的激增,后者返回基线或接近基线水平。这些数据表明,1周的时间间隔足以解决急性炎症反应的汽车-t海,并允许安全重复汽车-t。改变汽车t间隔从2周到1周也将减少IL-2暴露的患者,并允许更迅速的返回到系统治疗,为那些在临床上表明。在一个优选的实施例中,病人被管理的CEA t细胞每周一次的输液接受持续的全身输注IL-2,剂量为5万公斤/千克/天。在一些实施例中,被诊断为不能切除的肝转移的患者,在车t输液治疗期间连续静脉注射5万IL-2 28天,包括最后一辆车后的14天。输液.
肝转移治疗的治疗效果可以通过常规成像技术,如磁共振成像(MRI),正电子发射断层扫描(PET),或超声来确定。这样的成像程序可以测量肿瘤的负担或肿瘤在肝脏的程度,在治疗前后。一个治疗有效的对海T细胞的剂量方案可以减少肿瘤负担相对于肿瘤的负担在第一个输前细胞之前由大约10%到100%,10%到80%,10%到60%,10%到40%,20%到40%,20%到60%,20%到80%。
选择性内照射疗法(SIRT)
选择性内照射疗法(SIRT)是一种放射疗法,一般用于诊断不能切除的癌症患者。SIRT是作为放射性微球被作为一个靶器官,组织或肿瘤,以有效地提供治疗剂量的电离辐射的目标,造成损害或死亡的目标器官,组织或肿瘤。
用于治疗的放射性微球通常包括可作为放射性核素材料的载体的基质材料,该物质可发出电离辐射。特别是,以前已经表明,一些β辐射发射放射性核素,如Phosphorus-32,Holmium-166或Yttrium-90,可以附加到基质微球,如高分子树脂或玻璃微球注入血液有治疗作用的癌症患者的流。
放射性微球通常通过靶组织或肿瘤的动脉供血来传递。为此目的,导管被引导到血管的分支,即喂养靶组织或肿瘤以向循环中注入微球。放射性微球可以被引入到动脉血液供应的整个肝脏,一个部分的肝脏,或进入动脉血液供应的那部分的肝脏包含的肿瘤是要处理,通过注射的放射性微球进入肝动脉,门静脉,或上述两种血管的一个分支。放射性微球被困在靶组织或肿瘤的毛细血管床上,为靶组织或肿瘤提供有选择的辐射剂量。
可用于SIRT治疗肝癌的两种商用产品包括(MDS Nordion、Inc.)和医学Ltd.)。两种产品都是Yttrium-90标签的微球:是玻璃微珠,直径为25±10μm;是树脂微球,直径为32±2.5μm。
尽管本文公开了1阶段试验的结果和CEA的疗效,但最好尽可能地优化治疗效果和方便。组合策略常常能使确诊为不治之症的病人获得最大的益处。放疗通过抗原释放和效应T细胞的招募,诱导免疫肿瘤细胞死亡。仅放疗很少能产生有效的抗肿瘤免疫。然而,当结合靶向免疫治疗药物,放疗显着有助于治疗有效的抗肿瘤免疫应答。"HITM先生"试验的目的是测试的安全和潜在的增加,在肿瘤杀害的使用后,车吨海。HITM-先生是一个新的迭代的既定原则和方法,证明安全。这一新颖的试验有可能为LM的管理产生范例变化的数据。
在一个方面,治疗被诊断为肝转移的对象的方法是提供的,其中的主题是用汽车-T海如上所述,有或没有系统的IL-2管理,其次是行政SIRT。患者的剂量与爵士球相当于2GBq,2.5GBq,或3GBq的90Y活动的基础上的体积肿瘤。在一些实施例中,肿瘤体积小于25%,大约25%-50%或大于50%的总肝体积的患者,分别给出了相当于2GBq、2.5GBq或3GBq的90Y活动的球体。一剂量的SIR球是管理给病人约1周,2周,或3周后,最后的汽车t海输液。在一个优选的实施例中,在最后的车t海输注后的1周左右的剂量的爵士球。
免疫代理
嵌合抗原受体T细胞输注的治疗效果可能受到免疫抑制的影响,例如抑制肿瘤细胞或降低抗癌因子的表达。重要的是要考虑免疫环境的影响,腹腔空间在存在的癌症和治疗病人接受嵌合受体T细胞治疗相应。
免疫抑制调节T细胞(Tregs)和髓系衍生抑制细胞(肌)在肿瘤微环境中的积累是发展有效的抗肿瘤免疫(韦斯et al.的一个潜在的主要障碍,2014,J免疫,192:5821–5829)。肌的消除已证明可以显著改善荷瘤小鼠和癌症患者的免疫应答(Ostrong-罗森博格et al.,2009,J免疫,182:4499-4506);中新网,2007,临床癌Rres,13:5243-5248)。本发明提供了一种抑制免疫抑制的方法,例如,在接受嵌合受体T细胞治疗的患者中,t和MDSC,该患者也被管理抑制免疫抑制细胞功能的药物。MDSC和t都被很好的描述为内源性t细胞抑制剂和汽车t抗肿瘤反应(al.,2013,免疫细胞生物制品,91:493-502;伯克霍尔德et al.,2014,Biochim,Biophys学报,1845:182-201)。IP MDSC也表达了高水平的PD-L1(程控death-1受体配体),这是以前证明是一个重要的调停人的汽车t抑制(Burga et al.,2015,64:817-829)。因此,在目前披露的一个方面,接受汽车的病人也被管理一个immunosuppressing剂,抑制抑制T细胞的活动,如肌或Tregs。在一些实施例中,immunosuppressing剂是一种MDSC的损耗抗体,它结合Gr1(粒髓细胞标记蛋白)或PD-L1阻断抗体。
在某些实施例中,immunosuppressing剂是一种抗体,它结合IL-10、PD-1(程控death-1受体)、PD-L1(程序death-1受体配体1)、PD-L2(程序death-1受体配体2)、STAT3(信号换能器和活化剂转录3),GM-脑脊液,CD25,GITR(糖皮质激素诱导的TNFR相关蛋白),TGFβ,或CTLA4。在其他实施例中,immunosuppressing剂在输注的汽车t细胞之前被管理到主体。在其他实施例中,immunosuppressing剂在输注后的汽车t细胞中被管理。Immunosuppressing代理可以管理多次,例如,每一天,每2天,每3天,每4天,每5天,每6天或每周一次(每7天)后,汽车吨海。Immunosuppressing剂可以在同一天进行输液,也可以被管理1天,2天,3天,4天,5天,6天,7天或更早之前的第一次车-T肝动脉输液。一个以上的immunosuppressing剂可以被管理的病人,例如,该主题可能是co-administered或串行管理抗体绑定CD25和抗体绑定GR1。
上述相关艺术和相关限制的例子,意在说明性的,而不是排他性的。有关的艺术的其他限制将成为明显的技能,在艺术后,阅读的规范和研究的图纸。
IV.实例
下面的例子在本质上是说明性的,绝不是有意限制的。
示例1
人车t细胞生产
如下面更详细的描述,六例患者(称为患者的数字1,4,5,6,7和8)接受了肝输注的汽车t细胞,其中明确靶向转移细胞表达CEA抗原的表面。反CEAscfv-CD8α-CD28/CD3ζ(串联)嵌合抗原受体被克隆到制造逆转录病毒骨干,如前所述(FDA BB工业10791)(Emtage et al.,临床癌症Res,14:8112-8122,在这里通过参考完整)。简单地说,一个串联分子是由分子融合生成的一个N终端到C终端方向,一个hMN14sFv(SEQ ID NO:1)的单克隆抗体,具体结合CEA,CD8铰链段,CD28胞外领域,跨膜领域和细胞质域和ζ细胞质域。合成的嵌合结构被克隆成反转录病毒载体,并通过限制性消解和测序进行验证。采用PG13细胞生成的逆转录病毒载体上清液,型病毒颗粒,如前所述(Beaudoin et al.,2008,J Virol方法,148:253-259)。所有临床批次都是在印第安纳大学向量生产设施(印第安纳波利斯,在)和存储在-80°c,直到使用。
罗德岛血液中心人员在罗杰威廉斯医疗中心(RWMC,普罗维登斯,RI)执行leukapheresis。抗CEA汽车Ts是在RWMC细胞免疫治疗和基因治疗(CITGT)良好的生产实践(GMP)的设备和标准操作程序(sop)的加工,制造,扩展,剂量收获,标签,储存和分布.简要地,患者外周血单个核细胞(PBMCs)从leukapheresis产品中分离使用聚(西格玛,St;路易斯,莫)。然后,我们激活PBMCs 48-72小时的组织培养烧瓶(BD猎鹰,富兰克林湖,新泽西州)包含目标V媒体(生活技术,大岛,NY)补充5%无菌的人AB血清(山谷生物医学,温彻斯特,VA),50ng/毫升的anti-CD3单克隆抗体(OKT3;邻生物技术,霍舍姆,PA)和3000U/毫升的IL-2(普罗米修斯,圣迭戈,加利福尼亚州)。
使用spinoculation法(Quintas-Cardama et al.2007,嗡嗡基因,18:1253-1260),7.2–14.4x 108T细胞从患者获得转在retronectin(宝生物公司,日本)涂敷6-井板在AIM V培养基5%人AB血清,3000U/毫升IL-2和精蛋白硫酸盐(MP Biomedicals)在室温下低速离心1小时。转导步骤共进行了三次超过24小时。转导后,细胞在培养基上进行洗涤,在37℃时孵育48-72小时。在Lifecell组织培养袋(巴克斯特,迪尔菲尔德,IL)进一步扩大的汽车Ts 10-14天。定期检查汽车t生长曲线和细胞活力,并根据需要更换细胞生长培养基。通过流式细胞仪检查荧光标记抗体特异的CD3(UCHT1,Invitrogen,弗雷德里克,MD),CD4(SK3,BD生物科学,圣何塞,加利福尼亚州),CD8(3B5,Invitrogen)和汽车表达(WI2抗体,Immunomedics,诺里斯平原,新泽西州).WI2抗体作为APC共轭(WI2-APC;分子探针)。流式细胞术是在青色(贝克曼犁刀,布雷,ca)或LSR II(BD生物科学,圣何塞,ca)的机器上进行的。用生物荧光法测定患者产品的体外活性。荧光表达cea+肿瘤细胞与抗cea车t在不同的比率在96井圆底板和生物发光损失从每井测量(阿卜杜勒·拉希姆·卡里米et al.,2014,公共科学图书馆一,9:e89357)。转T细胞的培养和扩展存在IL-2(500毫升),和汽车表达水平检查后48小时转导。
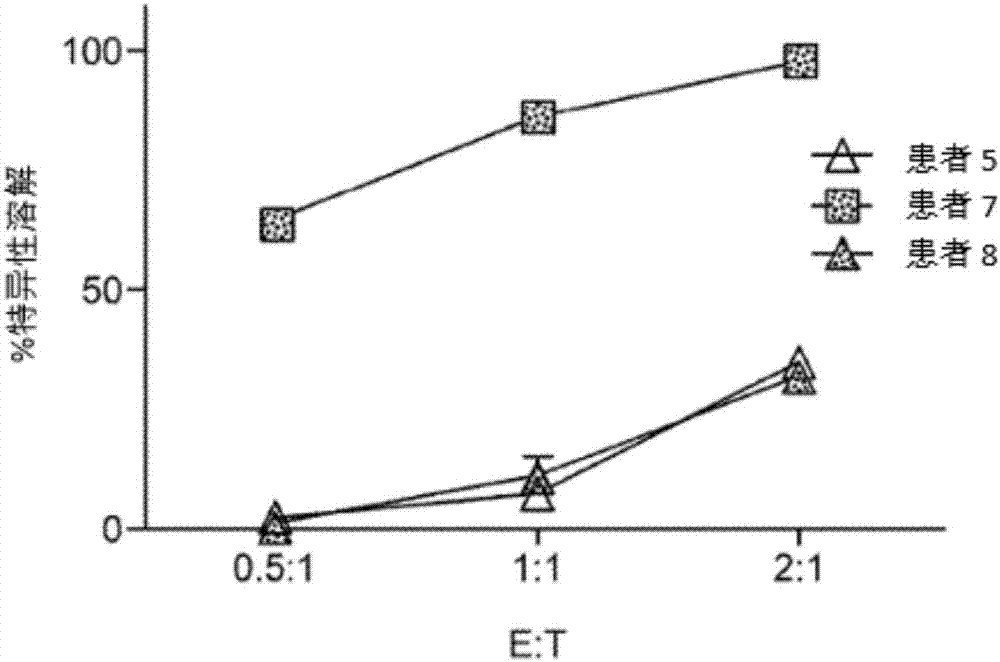
为了评估汽车t细胞,leukapheresis的产品从每个病人的流式细胞仪分析前和后续转导与反CEA的汽车构造。对于患者1,4,5,6,7和8,leukapheresis后CD3+细胞的平均百分比是55%(范围,12.0-82.0),并增加到91%(范围,72-97)继激活和转导(图1)。平均CD4:CD8比率是2.4(范围,1.4-4.7)在leukapheresis样品和0.8(0.2-2.2)在最后的产品(未显示)。转导效率(汽车+)从10%到64%不等,平均为45%(图1)。在输注前,在汽车+T细胞中检测到可忽略的FoxP3染色(未显示)。最终产品的细胞在输注前是85%可行的(范围,71-95)。体外细胞毒性试验检测CEA+靶细胞对患者产品的杀灭作用。采用cea+MC38大肠癌靶细胞培养抗cea t细胞。靶细胞杀死是量化的损失的生物发光后添加素。根据残余光子计数计算了具体的裂解量。这些化验证实,患者产品特别裂解CEA+靶细胞(图2)。
临床剂量是使用芬细胞收割机系统(巴克斯特,迪尔菲尔德,IL)在冷冻培养基中含有PlasmaLyte(巴克斯特),20%人牛白蛋白(谷Biomedicals),10%亚砜(Bioniche制药,湖福雷斯,IL)和IL-2。细菌和真菌培养物分别监测14和28天。采用拉尔内毒素检测试剂盒(龙沙、Walkersville、MD)进行细菌内毒素检查。临床剂量贮存于液氮中,并在输液前立即解冻。
示例2
临床研究设计
一期临床研究(NCT01373047,RWH 11-335-99)进行。这项研究招收了八例不能切除的CEA+腺癌LM,平均2.5(2-4)行常规全身治疗(表2)。
表2-患者特征
DFI=无病间隔从原发性肝转移的诊断;肝转移;尺寸=最大LM前的汽车-T处理;IL-2=连续IL-2输液与车t;RPN=腹膜后淋巴结;*壶癌的胰亚型;^=在2药量以后让步了由于肝外进展;^^=由于不相关的医疗条件退出;**在肿瘤标本中经免疫组织化学证实的CEA表达。
六例患者完成了该项协议(图3),一名患者在治疗前因不相关的感染而退出,另一名病人因肝外疾病进展在第三辆汽车-T海之前退出。在完成该议定书的病人中,有4人是男性,2是女性。五例患者均有IV期大肠癌,其中一个患者有胰壶癌。平均年龄是57(范围,51-66)。患者出现了巨大的疾病负担,平均大小的最大lm是8.4厘米(范围,1.7-14.4)和五患者有超过10lm。平均CEA水平在注册时是807ng/毫升(范围,2-3265)。五八例患者均有同步大肠lm,平均无疾病间隔为异lm患者27.3月(范围,9至37)。所有进一步的分析仅包括完成这项研究的六患者。
在这项研究中,两组三例患者采用抗CEA巴哈无或全身IL-2支架治疗(图3)。队列1(患者1,4和5)治疗的巴哈intrapatient剂量升级时尚(108,109,1010细胞)没有IL-2。特别地,T细胞从每名患者收集了0天,第一次输液是在天14在108细胞被注射了,第二次输液在天28在期间109细胞被注射了,并且第三次输液在天44期间1010细胞被infused.那些在队列2(患者6,7和8)接受了3海1010年汽车Ts在天14,28和44除连续全身IL-2输液以外在7.5万U或公斤或天通过一台流动输液泵为6星期从第一输液的时期开始在天14。
合格的患者可测量不可切除的cea阳性LM或检测血清cea水平,并失败一条或多行常规全身治疗。允许在肺部或腹部最小的肝疾病。临床评估是在基线,输液天数,和1,2,4,和7天post-infusion。计划成像评估与肝脏MRI和PET检查计划在一个月前的第一次输液,然后在一个月后的第三个汽车-T海。研究放射学(BS)分级反应根据修改实体(mRECIST)和免疫相关的反应标准(Wolchok et al.,2009,临床癌Res,15:7412-7420)。一个失明的病理学家在治疗前和第二次剂量后的两周内,从经皮穿刺活检中取得肿瘤坏死和纤维化。根据协议进行安全评估。不良事件的严重性被分级使用国家癌症协会的共同术语标准的不良事件版本3.0。
示例3
车t细胞肝动脉灌注
在基线处,通过右共股动脉方法进行测绘血管造影。除了其他潜在的极肝灌注源之外,胃十二指肠和右胃动脉用微线圈进行栓塞。对于CAR-T输注,进行相同的动脉进入程序,并通过步骤T将细胞手动注入60cc注射器,其具有小于2cc秒的速率,总体积为100cc在第一50cc后和在CAR-T输注完成后,执行具有校准对比度的血管造影术以确认被保存的动脉流。当可能时,输注被输送到适当的肝动脉中。在异常肝动脉解剖的情况下,在正确的肝动脉中没有出现右或左肝动脉,基于lobar体积计算对所述剂量进行分离在这种情况下,将拆分剂量分别输送到右和#T中左肝动脉以确保向两个叶瓣成比例的CAR-T递送。
在下面的例子中使用的抗CEA scfv-CD8α-CD28/CD3ζ(串联)嵌合抗原受体被克隆到制造逆转录病毒骨干,如前所述(FDA BB工业10791)(诺兰,et al.,1999,临床癌Res,5:3928-394;Emtage et al.,2008,临床癌Res,14:8112-8122;参见上面的示例1)。简单地,串联分子是由分子融合一个片段编码hMN14sFv-CD8铰链段在制造逆转录病毒骨干与混合CD28/CD3ζ分子。通过约束消解和测序验证了该结构的正确性。采用PG13细胞生成的逆转录病毒载体上清液,型病毒颗粒,如前所述(Beaudoin et al.,2008,J Virol方法,148:253-259)。所有的临床批次都是在印第安纳大学向量生产设施(印第安纳波利斯,在)和储存在-80°c,直到使用。
示例4
输注后的汽车t细胞贩运
CT引导下经皮穿刺活检,以样本LM和正常肝前的第一辆车-T海和当时的最后海。用流式细胞仪测定了LM活检、正常肝活检和外周血标本的lymphocyte%比例。例如,7例患者的样本显示,1.8%的正常肝淋巴细胞为汽车+继海T和7.6%的肿瘤淋巴细胞是汽车+。证实post-infusion LM活检标本中的汽车+细胞CD3+。对所有患者的外周血、正常肝和LM的车t数据进行了测定。与正常肝脏相比,5的6例患者的汽车Ts更丰富。在病人5,汽车Ts被发现包括1.4%的LM淋巴细胞在一个样本中获得的微波消融术12周后,他最后的车t输液。在4例患者中,汽车Ts在外周血中是不可检测的,但在最终输液时,患者的7和患者8时是瞬时出现的,而在3天后的检测水平下降。在最后输液后2天进行的外周血标本进行定量PCR;只有患者7有一个可测量的增加(1.1倍)的汽车DNA相对基线。在T型车输注后,患者血清中没有检测到抗汽车抗体。
示例5
治疗活动
在最后的随访中,完成试验的6例重度预处理患者中,有5人因疾病进展而死亡(表3)。
表3-患者结局
^折叠从基线在第二活检或IL-2输液中断时的变动;SAE:严重不良事件;国防部:死于疾病;活着的;有疾病的PD:渐进性疾病;SD:稳定
病人2后撤回2车t剂量,由于肝外进展和国防部23天后,第二车t输液。患者3因不相关的医疗条件而在细胞收集后撤回。
MRI和PET扫描进行了5 6患者的基线和2-4周后,第三汽车-T海。病人8没有得到最终成像后返回他的祖国,并最终死于疾病进展。除患者5外,所有患者均经mRECIST和标准确定有影像学疾病进展。患者5被发现有稳定的疾病,MRI和PET。患者7开发了新的病灶,并显示了一些原有病变的大小增加,而其他病变的大小下降。在7患者的后部病变在MRI上的体积减小,在PET上是不可见的。更多的内侧疾病,在MRI上的大小下降被注意到成为hypometabolic的post-infusion宠物为患者7。
鉴于有限的效用,短期随访常规成像后,输液的车-t,我们测量血清CEA水平在多个时间点后,每一个病人的三巴哈。在队列1的患者中,两例患者的血清CEA的瞬时下降表现在每辆车-T海(图4,患者1和5)。CEA动力学与血清CA19-9水平的变化紧密相平行(未显示)。病人4,谁提出与肝胆亚型壶癌,是唯一的病人没有CEA减少在任何时候的试验,他也有最短的生存时间。
在队列2患者接受全身IL-2与抗cea汽车t有更有利的cea反应的治疗。由于三例队列2患者中的每一个都需要IL-2中断或剂量减少,这可能会影响汽车t功能,我们比较了CEA水平的基线和时间点之前,IL-2剂量的变化(指示箭头在图4)。当使用这些时间点,所有三名队列2患者的血清CEA浓度下降(图4和表3)。患者7和8的血清CEA浓度分别为48%和43%,在IL-2剂量中断或减少之前。平均总生存时间为6患者谁完成了试验是30星期以中位数15星期(范围,8-73)。患者5在他的最后的汽车t海以后24月是活与疾病。在HITM试验完成后,患者5被确定有稳定的疾病,我们进行了微波消融残余不能切除的肿瘤。
在严重预处理的晚期转移性疾病患者中检测放射学反应是具有挑战性的,而且在免疫治疗中,肿瘤炎症和水肿可能使标准实体标准的相关性降至最低(Wolchok etal.,2009,临床癌症水库,15:7412-7420)。因此,我们获得了LM活检之前和后面的巴哈,以评估程度的肿瘤坏死和纤维化。正常肝和肝转移的核心针(16-表)活检获得了超声引导下的基线和当时的第三个汽车吨海。三核获得正常肝和肝转移,每一个经细胞学证实。每种情况下,4至5毫米的部分染色苏木素和曙红(H和E)和额外的不幻灯片染色的抗CEA抗体(TF 3H8-1;拿)。所有免疫组织化学染色在拿医疗系统上进行,法蒂玛医院的夫人(普罗维登斯,RI)。所有的幻灯片都以盲的方式进行评审,并分级为坏死和纤维化。纤维化评分如下:0%,0级;5%至10%,1级;11%至50%,2级;50%,3级坏死评分如下:0%、0级;0%至10%,1级;11%至50%,2级;50%,3级流式细胞术在新的活检组织的汽车t细胞和外周血如上所述。经盲病理学家审查后,4例患者的肿瘤纤维化增加,3例在其LM内的坏死增加(图5)。对于每个病人,基线和后输液评分从左向右显示在图5。1、4、7和8的患者显示纤维化的增加,而患者4和5显示出坏死的增加。
示例6
血清IFNγ浓度与CEA反应与IL-2管理的关系
在多个时间点检测血清IFNγ水平。IFN中的尖峰在所有患者的剂量后24-48小时内发生,无或全身IL-2(图6;虚线垂直线表示车t输液时间点,第一个数据点代表的基线值之前的汽车t输液)。血清CEA变化与IFN的峰值变化进行比较(图7,顶部)。峰值IFNγ水平与CEA变化之间的反比关系是显著的(R=-0.94,p=0.02)。所有患者的海车t剂量包含了数量的IL-2(60万)。三患者(患者数字6,7和8)与连续系统IL-2曝光和最大的汽车t药量有最佳的CEA反应和最高的平均IFN水平(P=0.03,图7,底部)。
示例7
安全数据
所有完成试验的患者均观察到任何可归因于任何原因的不良事件(AE)(表4)。队列1的剂量达到了计划的最大海车t输液水平在1010细胞。在队列1中不需要减少汽车的剂量,因此,队列2中的所有患者在1010级接受了3剂量的IL-2支持。没有等级4或5的不良事件。4例发热性AEs观察。患者7例经历3级发热和心动过速,体温峰值为f。发烧和心动过速在患者7 50%剂量减少后在全身IL-2输液中解决。注意,患者7也经历了她周围嗜酸性粒细胞计数的增加,峰值20%和绝对计数3740/毫升。鉴于IL-2输液与心脏血栓形成与吕弗勒氏综合征的其他特点(荣瀚et al.,2001,新的英语医学,344:859-860),我们得到了一个正常的超声心动图和心电图。她的嗜酸性粒细胞计数回到正常限度,没有具体的干预。
表4-不良事件
*第三次输液后28天疾病进展死亡。
^导致IL-2药量减少。
患者#2经历3级腹痛和脱水;他在第二海之后被取消了礼节并且在23天以后死了由于疾病进展。患者3因不相关的医疗条件而在不输液前被撤回。
肝功能测试不良事件反映的是正常范围以外的值,而不一定与基线发生变化。
巴哈后,正常肝实质和胆道结构保存完好。从正常肝脏活检没有显示出增加的炎症或纤维化的水平后,汽车吨海无论是否系统IL-2的管理。尽管所有患者都经历了碱性磷酸酶(磷)、总胆红素和天门冬氨酸转氨酶水平(AST)的短暂升高,但只有1例经验丰富的3级海拔和大部分的价值并没有明显偏离基线水平。门静脉压力和肝脏合成功能没有负面影响的汽车t巴哈,反映了没有病人成为血小板减少或coagulopathic。
示例8
安全数据
一个阶段的临床研究,其中病人分别管理1010抗CEA scfv-CD8α-CD28/CD3ζ车t细胞通过海。执行(如上述示例所述)。T细胞将被隔离,从每个病人在0天,转染和选择表达反CEA scfv-CD8α-CD28/CD3ζ结构。每个病人在14、21和28天被管理1010细胞。在44天(在最后的细胞输注后的2周休息后),一剂量的SIR包含在每个病人体内。
对于剂量患者将获得预定数量的这将取决于肿瘤体积相对于正常肝脏体积的大小。肿瘤的病人,要么是<25%,25%-50%=""or="">50%的总肝脏体积被授予相当于2gigabecquerels(GBq),2.5GBq,或3GBq的90Y活动.</25%,>对肺-肝breaththrough扫描indicatied的患者,有超过10%的微球通过肝脏并在肺部内的病人作出了规定。每1%的90Y活动量减少了2%,肺-肝突破率大于10%。病人在治疗后的同一天或次日出院。
患者被评估为有一个完整的反应,部分反应,稳定的疾病或渐进性疾病的最后输液后一个月,适当的临床和放射学研究。采用流式细胞仪监测改良T细胞的循环水平,检测抗CEA scfv-CD8α-CD28/CD3ζ、CD4/CD8和PCR。LM和正常肝脏活检标本是用来确定的程度的车t肿瘤浸润。用流式细胞仪和/或免疫组织化学方法对活检标本进行分析,以量化抗CEA scfv-CD8α-CD28/CD3ζ的存在。样本是为血清细胞因子水平和正常肝T细胞数量的变化绘制的。ELISA法测定血清IL-2、IFNγ、IL6、IL17和IL10。中性粒细胞:淋巴细胞比值是由cbc同时确定的,同时通过流式细胞仪对肝和外周血T细胞的数量进行详细评估。肝内和外周血T细胞染色的抗体特异的CD3,CD4,CD8,FOXP3,PD-1,CD25,CTLA4,CD69。
虽然上面已经讨论了一些示范性的方面和实施例,但艺术中的技巧会识别某些修改、排列、添加和子。因此,现将下列所附的索赔和索赔解释为包括所有这些修改、排列、增补和子,其真实的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!