一种脱脂米糠中多酚物质的提取方法与流程
本发明涉及一种脱脂米糠中多酚物质的提取方法。
背景技术:
米糠是碾米过程中剥落下来的皮层、米胚和少量碎米的混合物,是稻米加工不可避免的副产物,约占稻谷谷粒质量的5-5.5%。现代流行病学研究表明,食用全粒谷物或相关产品对降低心脑血管等慢性疾病具有很好的效果,这主要归功于全粒谷物中独一无二的游离多酚类物质。但谷物中单纯的游离酚酸含量并不多,主要通过氢键、疏水相互作用或共价键与蛋白质、糖类等结合。根据结合紧密程度,可以将稻谷中的酚酸分为游离形式、可溶性结合形式或不可溶结合三种,其中游离酚酸与其他基质集合较为松散,用有机溶剂可以直接将其提取出来。而与纤维素、脂蛋白结合形成的不溶性多酚化合物采用一般的有机溶剂很难将其提取出来。
从目前资料分析,大多数研究者都直接利用甲醇、乙醇或丙酮对谷物中多酚物质进行,为了提高提取得率,多采用降低颗粒度、延长提取时间或者提高提取稳定等方法,但此类方法仅能提取出谷物中的游离多酚和可溶性结合酚酸,无法提取不溶性的结合多酚,因此提取效果均不理想。
技术实现要素:
本发明所要解决的技术问题是克服现有技术的缺陷,提供一种脱脂米糠中多酚物质的提取方法,可获得较高的提取率。
为解决上述技术问题,本发明提供一种脱脂米糠中多酚物质的提取方法,包括以下步骤:
步骤一,预处理:取新鲜米糠晾干后粉碎,20-60目过筛后-20℃冷冻存储;
步骤二,脱脂:称取粉碎后的米糠粉,放入己烷中浸泡,抽滤后再加入己烷浸泡,重复3-5次以去除米糠中的脂肪,抽滤完成后将滤渣后放于70℃恒温烘箱干燥;
步骤三,碱水解:称取干燥后的脱脂米糠粉,按照料液比为1:5~1:9放入浓度为0.5~3.0mol/l的naoh溶液中进行结合酚类物质的水解,水解1~4h后hcl调节ph至3.0-5.0;
步骤四,提取:将步骤三获得的水解液用乙醇提取3-5次,混合提取液真空浓缩后,用乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容。
优选地,步骤四中进行所述乙醇提取的过程中,将水解液与50-100%的乙醇混合后,放入超声仪中超声处理6-12min,然后再采用离心分离的方法取上清液,重复3-5次。
优选地,步骤一中进行所述预处理时,先将新鲜米糠放入100℃烘箱中,15min后取出晾干。
优选地,步骤一中所述米糠的粉碎粒度为60目,步骤三中所述料液比为1:8,naoh浓度为2.5mol/l、水解时间为2.0h。
优选地,步骤四中所述超声处理时间为11.72min、乙醇浓度为71.56%,步骤三中所述ph调节至4.56。
优选地,步骤二中所述米糠粉和己烷的料液比为1:20,浸泡时间为60min。
本发明所达到的有益效果:
1.采用本发明所获得的提取液,多酚提取得率高;
2.本发明采用超声波处理方法辅助进行水解,进一步提高多酚提取率,经含量测定检测,提取得率均为60mg/100g以上;在将提取方法优化为以下参数的情况下,可使提取得率提高至200mg/100g以上:米糠的粉碎粒度为60目,步骤三中所述料液比为1:8,naoh浓度为2.5mol/l、水解时间为2.0h,ph调节至4.56,步骤四中所述超声处理时间为11.72min、乙醇浓度为71.56%;
3.本发明预处理工艺中,新鲜米糠自工厂取样后迅速放入100℃烘箱中,可消除内源脂肪酶活性,避免了新鲜米糠因组织破坏而游离出来的脂肪酶水解脂肪产生恶臭的游离脂肪酸。
因此,本发明所提供的一种脱脂米糠中多酚物质的提取方法,多酚提取得率高、对多酚提取物的活性破坏小,可应用到脱脂米糠中多酚物质的提取生产中,为脱脂米糠的资源开发应用提供较好的途径。
附图说明
图1是阿魏酸与提取液紫外扫描光谱图;
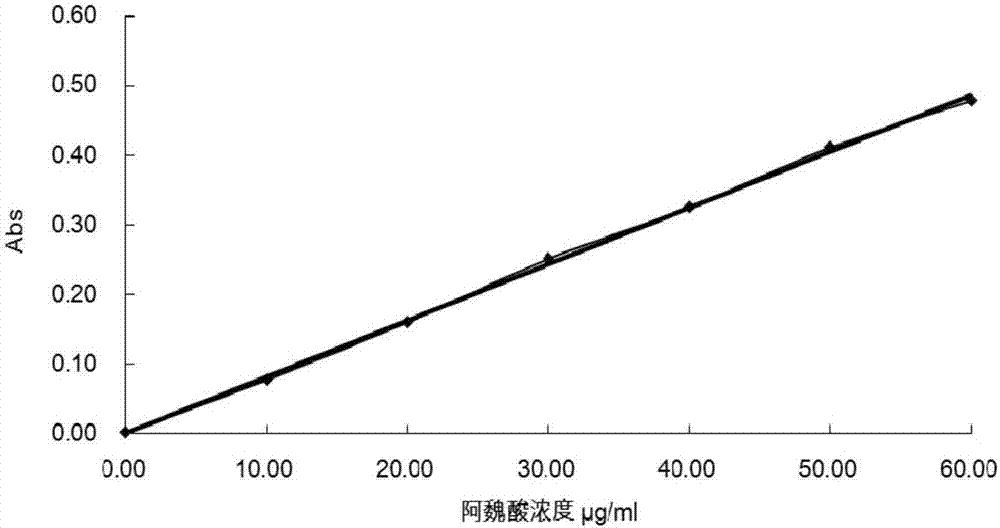
图2是阿魏酸标准曲线;
图3是粉碎粒度对多酚提取得率的影响;
图4是料液比对多酚提取得率的影响;
图5是naoh溶液浓度对多酚提取得率的影响;
图6是水解时间对多酚提取得率的影响;
图7是超声作用时间对多酚提取得率的影响;
图8是乙醇浓度对多酚提取得率的影响;
图9是ph值对多酚提取得率的影响;
图10是时间与浓度对提取得率影响等高线;
图11是时间与浓度对提取得率影响三维图;
图12是时间与ph值对提取得率影响等高线;
图13是时间与ph值对提取得率影响三维图;
图14是浓度与ph值对提取得率影响等高线;
图15是浓度与ph值对提取得率影响三维图。
具体实施方式
下面结合附图对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
实施例一
一种脱脂米糠中多酚物质的提取方法,包括以下步骤:
步骤一,预处理:取新鲜米糠放入100℃烘箱中,15min后取出晾干,晾干后用万能粉碎机粉碎,20目过筛后-20℃冷冻存储;
步骤二,脱脂:准确称取10g粉碎后的米糠粉样品,放入200ml己烷中浸泡60min,抽滤后再加入200ml己烷浸泡60min,重复3次以去除米糠中的脂肪,抽滤完成后将滤渣后放于70℃恒温烘箱干燥4h;
步骤三,碱水解:称取干燥后的脱脂米糠粉,按照料液比为1:5放入浓度为0.5mol/l的naoh溶液中进行结合酚类物质的水解,水解1h后hcl调节ph至3.0;
步骤四,提取:将步骤三获得的水解液与50%的乙醇混合后,放入超声仪中超声处理6min,然后再采用离心分离的方法取上清液,重复3次,混合提取液真空浓缩后,用乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml。
优选地,步骤一中所述米糠的粉碎粒度为60目,步骤三中所述料液比为1:8,naoh浓度为2.5mol/l、水解时间为2.0h。
优选地,步骤四中所述超声处理时间为11.72min、乙醇浓度为71.56%,步骤三中所述ph调节至4.56。
实施例二
一种脱脂米糠中多酚物质的提取方法,包括以下步骤:
步骤一,预处理:取新鲜米糠放入100℃烘箱中,15min后取出晾干,晾干后用万能粉碎机粉碎,60目过筛后-20℃冷冻存储;
步骤二,脱脂:准确称取10g粉碎后的米糠粉样品,放入200ml己烷中浸泡60min,抽滤后再加入200ml己烷浸泡60min,重复3次以去除米糠中的脂肪,抽滤完成后将滤渣后放于70℃恒温烘箱干燥4h;
步骤三,碱水解:称取干燥后的脱脂米糠粉,按照料液比为1:9放入浓度为3.0mol/l的naoh溶液中进行结合酚类物质的水解,水解4h后hcl调节ph至5.0;
步骤四,提取:将步骤三获得的水解液与100%的乙醇混合后,放入超声仪中超声处理12min,然后再采用离心分离的方法取上清液,重复3次,混合提取液真空浓缩后,用乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml。
实施例三
一种脱脂米糠中多酚物质的提取方法,包括以下步骤:
步骤一,预处理:取新鲜米糠放入100℃烘箱中,15min后取出晾干,晾干后用万能粉碎机粉碎,60目过筛后-20℃冷冻存储;
步骤二,脱脂:准确称取10g粉碎后的米糠粉样品,放入200ml己烷中浸泡60min,抽滤后再加入200ml己烷浸泡60min,重复3次以去除米糠中的脂肪,抽滤完成后将滤渣后放于70℃恒温烘箱干燥4h;
步骤三,碱水解:称取干燥后的脱脂米糠粉,按照料液比为1:8放入浓度为2.5mol/l的naoh溶液中进行结合酚类物质的水解,水解2h后hcl调节ph至4.56;
步骤四,提取:将步骤三获得的水解液与71.56%的乙醇混合后,放入超声仪中超声处理11.72min,然后再采用离心分离的方法取上清液,重复3次,混合提取液真空浓缩后,用乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml。
提取工艺的优化
1材料与仪器
1.1实验材料
新鲜米糠由江苏淮安禾香源米厂提供;
阿魏酸(ferulicacid)、folin-ciocalteu试剂:中国医药(集团)上海化学试剂公司;
无水乙醇、乙酸乙酯、己烷等试剂均为国产分析纯。
1.2实验仪器
wf180万能粉碎机:上海光学仪器厂;
re-2000a旋转蒸发器:上海亚荣生化仪器厂;
bs-1e振荡培养箱:苏州威尔实验用品有限公司;
tu-1900紫外可见分光光度计:北京普析通用仪器有限责任公司;
vf203真空抽滤装置:北京桑翌实验仪器研究所;
ja1003a电子精密天平:上海伦捷机电仪表有限公司;
phs-3c酸度计:上海仪电科学仪器股份有限公司;
se-2334恒温水浴锅:上海亚荣生化仪器厂;
jy92–dn超声波细胞粉碎机:宁波新芝生物科技股份有限公司。
2实验方法
2.1样品处理
2.1.1预处理
为避免新鲜米糠因组织破坏而游离出来的脂肪酶水解脂肪产生恶臭的游离脂肪酸,米糠自工厂取样后迅速放入100℃烘箱中以消除内源脂肪酶活性,15min后取出晾干,万能粉碎机粉碎,过筛后置于-20℃条件下冷冻储存。
2.1.2脱脂
准确称取10.00g粉碎后的米糠粉样品,放入200ml己烷中浸泡60min,抽虑后再加入200ml己烷浸泡60min,重复3次以去除米糠中的脂肪,抽滤完成后将滤渣后放于70℃恒温烘箱干燥4h。
2.2碱水解工艺条件的研究
准确称取10.00g干燥后的脱脂米糠粉样品,放入一定浓度的naoh溶液中进行结合酚类物质的水解,水解结束后hcl调节ph,用足量75%乙醇提取3次。混合提取液真空浓缩后,用足量乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml,采用folin-ciocalteu法进行多酚提取得率测定。以多酚提取得率为指标,采用单因素和正交试验设计考察颗粒度、料液比、naoh溶液和水解时间对水解效果的影响。
2.3超声波提取工艺条件的研究
在最佳水解工艺条件下获取水解液,hcl调节ph后,加入100ml一定浓度的乙醇溶液浸泡并放于超声细胞粉碎机中超声处理,离心机分离取上清液,重复3次。混合提取液真空浓缩后,用足量乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml,采用folin-ciocalteu法进行多酚提取得率测定。以多酚提取得率为指标,采用单因素和box-benhnken响应面设计考察超声波处理时间、乙醇浓度和溶液ph溶液和水解时间对萃取效果的影响。
2.4多酚物质含量的测定
2.4.1测定波长的确定
准确量取阿魏酸标准溶液、米糠多酚甲醇溶解液各1.0ml于50ml比色管中,分别加入20%的folin-ciocalteu试剂各1ml,混匀后静置5min,再分别加入7.5%na2co3溶液4ml,振摇1min后,用纯水定容至50ml,然后用锡纸包裹,在30℃下静置30min。以纯水做基线,用紫外-可见分光光度计在600~850nm范围内进行扫描,得到阿魏酸标准品与folin-ciocalteu试剂显色反应后的吸收光谱,与米糠多酚溶液吸收光谱进行比较,确定最大吸收波长。
2.4.2标准曲线的绘制
准确量取0、0.5、1.0、1.5、2.0、2.5、3.0ml1.00mg/ml阿魏酸标准溶液于50ml比色管中,分别加入20%folin-ciocalteu试剂1ml,混匀后静置5min,再分别加入7.5%na2co3溶液4ml,振摇1min后,用纯水定容至50ml,然后用锡纸包裹,在30℃下静置30min。以纯水做基线,在768nm波长下测吸光度。以阿魏酸标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2.4.3多酚物质含量测定方法
精确量取多酚提取液1.0ml于50ml比色管中,按照2.3.1方法进行吸光度值测定,根据标准曲线和计算提取液中多酚物质浓度,然后根据公式计算样品中多酚提取得率。
式中:c-提取液多酚浓度(mg/ml);v-提取液体积(ml);m-样品质量(g)。
3结果与分析
3.1波长的确定
由图1所示的紫外扫描光谱图可知,阿魏酸(光谱图a)和米糠提取物(光谱图b)均能与folin-ciocalteu试剂反应,这主要是因为阿魏酸和米糠中的多酚物质均含有酚羟基基团,能与folin-ciocalteu试剂中的钨钼酸相互反应,生成蓝色络合物。由图1可知,阿魏酸和米糠提取物在600-850nm范围内光谱图趋势基本一致,两者的最大吸收波长也非常相近,其中阿魏酸为768nm,而米糠提取物为755nm。这说明用阿魏酸作为参比对米糠中多酚物质进行测定的选择是正确的,这一结果与廖律所得结论相一致。同时一定程度上说明了阿魏酸可能是米糠多酚物质中最主要的组成部分。因此本实验选择阿魏酸作为标准品在768nm条件下进行吸光度测定。
3.2标准曲线的绘制
由图2可知,在0-70μg/mla范围内,阿魏酸标准溶液浓度和吸光度的关系符合线性回归方程y=0.0082x-0.0015,线性相关度较高(r2=0.9991),符合朗伯比尔定律,可用于多酚含量测定。
3.3碱水解工艺条件的确定
3.3.1粉碎粒度对水解效果的影响
准确称取粒度分别为20目、30目、40目、50目、60目、70目的干燥脱脂米糠粉样品各10.00g,分别放入100ml浓度为2.0mol/l的naoh溶液水解4.0h。按照操作步骤2.3进行多酚物质的萃取,以多酚提取得率为评价指标,考察粉碎粒度对多酚提取效果的影响,结果如图3所示。
由图3可知,随着目数的逐渐增大,多酚提取得率先增加后降低。这主要是因为目数越大,米糠粒度越小,单位重量的比表面积越大,与碱性na+离子接触的面积越大,酯键、糖苷键、醚苷键等越有机会接触na+离子而被分解,因此在20-50目时分解速度逐渐加快。但当目数超过50后,提取得率反而下降,这可能是因为米糠粉碎过细,容易在水溶液中沉积形成大的絮状团,进而产生沉淀,阻碍了碱液与不溶性多酚的接触。另外,米糠中残留的淀粉类物质也会增加溶液的粘度,造成乙酸乙酯萃取困难。因此粉碎粒度以50左右为宜。
3.3.2料液比对水解效果的影响
准确称取粒度为50目的干燥脱脂米糠粉样品各10.00g,分别放入50、60、70、80、90、100、110、120ml(料液比分别为1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12)浓度为2.0mol/l的naoh溶液水解4.0h。按照操作步骤2.3进行多酚物质的萃取,以多酚提取得率为评价指标,考察料液比对多酚提取效果的影响,结果见图4。
由图4可知,当料液比为1:5时,多酚提取得率最低(19.12mg/100g),这主要是因为1:5的情况下,米糠粉末溶液呈粘稠状态,每个米糠小颗粒周围碱离子的浓度过低,因此分解速度很慢。同时米糠中少量的淀粉也使得溶液粘度增大,阻碍了分子的运动速度,降低了反应速度。随着料液比的逐渐增大,多酚提取得率逐渐增大,当料液比为1:8时,提取得率达到最高值(145.35mg/100g)。当料液比超过1:8时,多酚提取得率逐渐下降。这可能是因为过多的水造成多酚溶液浓度降低,即降低了乙醇溶液与乙酸乙酯两相中多酚浓度差,动态平和点增加,萃取变得不彻底。因此选择料液比为1:8为宜,即naoh的添加量为80ml。
3.3.3naoh溶液浓度对水解效果的影响
准确称取粒度为50目的干燥脱脂米糠粉样品各10.00g,分别放入80ml浓度分别为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5mol/l的naoh溶液水解4.0h。按照操作步骤2.3进行多酚物质的萃取,以多酚提取得率为评价指标,考察naoh溶液浓度对多酚提取效果的影响,结果见图5。
由图5可知,当不加入naoh(cnaoh=0)时,米糠中多酚物质提取得率非常低(仅为19.13mg/100g),这主要是因为谷物中多酚物质主要以结合形式存在,游离的只有15-20%。随着naoh浓度的不断增加,多酚提取得率先快速增加后缓慢降低。这主要是因为naoh是解离复合键最主要的物质,只有足够多的naoh分子,才能与结合键相互反应生产游离的多酚。当naoh浓度达到2.0mol/l时,多酚提取得率达到最高点(179.52mg/100g),之后,随naoh浓度的逐渐增加,多酚提取得率反而下降,这主要是因为酚类物质在酸性条件下比较稳定,而在强碱作用下会因分子断裂而分解成其他物质。同时强碱也加速了淀粉、纤维素等物质的水解,使溶液粘稠度增加,增加了萃取的难度。因此naoh浓度为2.0mol/l比较适合实验需要。
3.3.4碱水解时间对水解效果的影响
准确称取粒度为50目的干燥脱脂米糠粉样品各10.00g,分别放入80ml浓度分别为0、0.5、1.0、1.5、2.0、2.5、3.0mol/l的naoh溶液水解4.0h。按照操作步骤2.3进行多酚物质的萃取,以多酚提取得率为评价指标,考察naoh溶液浓度对多酚提取效果的影响,结果见图6。
由图6可知,多酚提取得率受水解时间的影响较大,在开始的0.5h,水解效果很差。随着时间的延长,提取得率快速上升,并在2h时达到最高点(提取得率达到190.54mg/100g)。但超过2h后提取得率又出现较大幅度的下降。这可能是因为碱液长时间与多酚物质接触会致其分解导致的。因此选择2h的水解时间较好。
3.3.5最佳碱水解条件的确定
在单因素的基础上,以多酚提取得率为评价指标,以粉碎粒度、料液比、naoh浓度和水解时间为因素,采用l9(34)四因素三水平正交试验确定碱水解的最佳条件。因素水平见表1。正交试验结果见表2。
表1碱水解因素水平表
表2碱水解正交实验结果
由表2中极差r值可以看出各因素对提取得率的影响次序为:c>b>d>a,即naoh浓度对提取得率的影响最大,料液比次之,粉碎粒度对提取得率的影响最小。由表2中提取得率水平对应的k值可以看出,本实验的最佳组合a3b2c3d2,即预估最佳碱水解条件为:粉碎粒度60目、料液比1:8、naoh浓度2.5mol/l、水解时间2.0h。
正交试验推算最佳水解条件不在9个实验序列表中,为验证结果正确性,按推算提取条件补做3次验证实验,结果见表3。
由表3可知,在预估的提取条件下,多酚的提取得率均高于正交试验和前期单因素实验结果(208.73mg/100g),且数据相对稳定,因此此条件可以作为水解的最佳条件。
表3验证实验结果
3.4提取工艺条件的确定
3.4.1超声波作用时间对提取效果的影响
准确称取10.00g干燥脱脂米糠粉样品各7份,在最佳水解工艺条件下获取水解液,hcl调节ph至3.0,加入100ml浓度为70%的乙醇溶液,分别置于超声细胞粉碎机中处理1、3、5、7、9、11、13、15min,重复3次。浓缩后用足量乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml,采用folin-ciocalteu法进行多酚提取得率测定。以多酚提取得率为指标,考察超声波处理时间对萃取效果的影响,实验结果见图7。
由图7可知,多酚提取得率随着超声波作用时间的延长先快速增加,后缓慢降低。快速增加的原因主要是:超声波处理时产生的声场会在极短的时间内在乙醇溶液和细胞内部形成空化泡,并瞬间胀大随后破裂,释放出巨大能量,提高乙醇溶液温度,加快分子运动速度;在释放能量的同时也会产生强大的冲击波和微声流,造成细胞内部压力瞬间提升,局部细胞壁快速破裂,加快多酚物质的溶出。同时超声波通过独特的机械振动作用使得多酚等有效成分和乙醇溶液分子快速进入振动状态,增加分子动态能量,进而提高提取得率,缩短提取时间。但由图也可以看出,当超声波作用时间超过10min后,多酚提取得率略有下降,这主要是因为超声波可以产生较高的热效应,溶液温度增加,部分不稳定多酚出现转化或分解。因此选择超声波作用时间为10min为宜。
3.4.2乙醇浓度对提取效果的影响
准确称取10.00g干燥脱脂米糠粉样品各6份,在最佳水解工艺条件下获取水解液,hcl调节ph至3.0,加入100ml浓度分别为40、50、60、70、80、90、100%的乙醇溶液,置于超声细胞粉碎机中超声处理5min,重复3次。浓缩后用足量乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml,采用folin-ciocalteu法进行多酚提取得率测定。以多酚提取得率为指标,考察乙醇浓度对萃取效果的影响,实验结果见图8。
根据相似相溶原理可知,溶质和提取剂极性越相近,提取效果越好。但米糠中多酚是以环木菠萝醇类为主体阿魏酸酯与甾醇类阿魏酸酯组成一种天然混合物,包含阿魏酸、对香豆酸、原儿茶酸、没食子酸、咖啡酸,芥子酸单体及其结合酚酸等,极性各不相同,因此提取过程中应尽量选择与混合多酚极性最相近的提取溶剂。
由图8可知,在较低的乙醇浓度(40%)时,米糠中多酚物质的提取得率很低(仅为110.76mg/100g),随着乙醇浓度的加大,提取得率逐渐增大,这主要是因为米糠中的多酚主要以阿魏酸、咖啡酸等极性较弱的物质组成,增加极性较小的乙醇比例势必降低极性,与多酚的极性越接近,因此提取效果较好。当乙醇浓度大于70%以后,溶液极性变得很小,部分水溶性的极性酚酸反而析出。因此确定乙醇浓度为70%进行提取处理。
3.4.3溶液ph值对提取效果的影响
准确称取10.00g干燥脱脂米糠粉样品各7份,在最佳水解工艺条件下获取水解液,分别用hcl调节ph至2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5,然后分别加入100ml浓度为70%的乙醇溶液,置于超声细胞粉碎机中超声处理3次。
浓缩后用足量乙酸乙酯萃取完全,硫酸钠脱水后再次浓缩,用甲醇溶解并定容至10ml,采用folin-ciocalteu法进行多酚提取得率测定。以多酚提取得率为指标,考察溶液ph溶液对萃取效果的影响,实验结果见图9。
由图9可知,当溶液ph值逐渐增加时,多酚物质提取得率逐渐增加,这主要是因为ph值能够酚类物质的极性,ph值越高,多酚极性越低,从强极性水溶液中越容易被弱极性乙醇溶液提取出来。当溶液ph值达到4.5时,多酚提取得率达到最大(223.08mg/100g)。当溶液ph值大于4.5时,多酚提取得率略有下降。因此选择ph值为4.5进行下一步试验。
3.4.4最佳提取条件的确定
3.4.4.1设计方案及实验结果
表4box-benhnken实验设计因素水平编码表
表5box-benhnken实验设计方案与结果
在前期单因素实验的基础上,以超声波作用时间、乙醇浓度和溶液ph值为自变量,多酚提取得率为评价指标,采用box-benhnken中心组合设计原理设计三因素三水平共15个实验点的响应面分析实验,其中12个为析因实验,最后三个为中心实验。因素水平分见表4,实验方案与结果见表5。
3.4.4.2回归方程结果与分析
采用sas8.01软件对box-benhnken实验结果(表5)进行二次多项回归分析和响应面分析,并建立二次响应面回归方程。
表6方差分析表
注:*p<0.05显著差异;**p值<0.01极显著差异。
表7回归方程二次回归方程参数
注:*p<0.05显著差异;**p值<0.01极显著差异。
从相应面方程模型的方差分析(表6)可知,回归方程的一次项、二次项和总和的f值均极显著(p值<0.01),失拟项对应的p值为0.0446<0.05,净sas计算得到方程的总决定系数r2=0.9541,表明此模型拟合度良好,能较好的超声波提取条件对提取得率影响的规律。
由各项决定系数数据(表6)可知,一次项的决定系数(0.4477)和二次项的决定系数(33.8925)均大于交互项决定系数(0.0364),说明响应面分析所选用的这三个因素的交互效应较小。
由表7可知,sas拟合得到的二次多项回归方程为:提取得率=222.84+33.8925×时间+1.2325×浓度-8.5525×ph-31.8225×时间×时间-1.915×时间×浓度-36.9525×时间×ph-2.025×浓度×浓度+13.82×浓度×ph-28.6925×ph×ph。
根据表7中超声波处理时间、乙醇浓度和ph值对应的参数估计(依次分别为222.84、1.2325和-8.5525)可知,三因素对多酚提取得率影响到次序超声波处理时间>ph值>乙醇浓度,且超声波处理时间、乙醇浓度对提取得率为正效应影响,而ph值是负效应影响。
3.4.4.3响应面分析及提取工艺优化
为了考察超声波作用时间、乙醇浓度和ph值这三个因素的协同作用对脱脂米糠中多酚物质提取得率的影响,对所得二次回归方程进行降维分析。即固定其中一个变量在“0”水平,用sas软件,根据回归方程作响应面图。
(1)超声作用时间与乙醇浓度协同作用分析
固定ph值为4.5,采用sasadx程序绘制超声作用时间与乙醇浓度对提取得率影响的响应面图,结果见图10、11。
由等高线图(图10)可以看出多酚提取得率等高线以弧形分布,而不是线形分布,这说明超声波作用时间和乙醇浓度之间有一定的相互作用。由三维立体图(图11)可知,图形上凸,证明超声波作用时间和乙醇浓度对多酚提取得率具有较高的协同作用,即乙醇浓度的增加有利于超声波处理效果。另外由图11立面可知,随着乙醇浓度的增大,提取得率先增加后降低,超声波作用时间对提取得率的影响趋势同于乙醇浓度。
(2)超声时间与ph值协同作用分析
固定乙醇浓度为80%,采用sasadx程序绘制超声作用时间与ph值对提取得率影响的响应面图,结果见图12、13。
由等高线图(图12)可以看出多酚提取得率等高线以弧形分布,而不是线形分布,这说明超声波作用时间和乙醇浓度之间有一定的相互作用。由三维立体图(图13)可知,图形上凸,证明超声波作用时间和ph值对多酚提取得率具有较高的协同作用,即ph值的增加有利于超声波处理效果。另外由图13立面可知,随着乙醇浓度的增大,提取得率先增加后降低,ph值时间对提取得率的影响趋势同于乙醇浓度。
(3)乙醇浓度与ph值协同作用分析
固定超声波处理时间为10min,采用sasadx程序绘制超声作用时间与料液比对提取得率影响的响应面图,结果见图14、15。
由等高线图(图14)可以看出多酚提取得率等高线以弧形分布,而不是线形分布,这说明ph值和乙醇浓度之间有一定的相互作用。由三维立体图(图15)可知,图形上凸,证明ph值和乙醇浓度对多酚提取得率具有较高的协同作用,即ph值的增加有利于乙醇提取效果。另外由图15立面可知,随着乙醇浓度的增大,提取得率先增加后降低,ph值时间对提取得率的影响趋势同于乙醇浓度。
(4)最佳提取条件的确定
由sas软件拟合二次回归模型得出最优条件和最优值,见表8。
表8提取条件、最优结果及验证试验结果
分析方程模拟最优值(表8)可知,当提取得率最大时,x1、x2、x3的最优编码值为0.548632、-0.03026、-0.127493,经编码换算后预计最佳提取条件为:超声波作用时间11.72min、乙醇浓度71.56%、ph为4.56,预计最大提取得率为232.705mg/100g。
为验证方程与实际情况的吻合程度,进行最佳提取条件验证实验,验证实验结果230.64mg/100g,与模拟结果基本符合。因此确定最佳提取条件为超声波作用时间11.72min、乙醇浓度71.56%、ph为4.56,此条件下预计最大提取得率为232.705mg/100g。
4小结
以粉碎后的脱脂米糠为原料,采用碱水解的方法使得结合酚类物质分解为游离多酚,然后以乙醇水溶液为提取剂,采用超声波辅助的方法对脱脂米糠中多酚物质进行提取。以多酚提取得率为评价指标,重点考察了颗粒度、料液比、naoh溶液和水解时间对碱水解效果的影响和超声波处理时间、乙醇浓度和溶液ph溶液和水解时间对提取效果的影响。通过单因素试验、正交试验和box-benhnken响应面分析法得到碱水解的最佳条件为:粉碎粒度60目、料液比1:8、naoh浓度2.5mol/l、水解时间2.0h;超声波提取最佳工艺条件为:超声波作用时间11.72min、乙醇浓度71.56%、ph为4.56。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!