一种利用miR‑143抑制剂延缓小鼠失神经后肌肉萎缩的方法与流程
本发明属于生物技术领域的细胞及组织工程技术,具体涉及一种利用mir-143抑制剂延缓小鼠失神经后肌肉萎缩的方法。
背景技术:
骨骼肌是周围神经系统的靶器官,周围神经具有支配肌肉运动收缩的功能,肌肉的生长、发育及正常的功能维持都有依赖于运动神经的支配和调节。周围神经系统受到损伤后,因为神经元不再通过轴浆运输营养给相应骨骼肌纤维,从而使骨骼肌失去神经的支配作用,失去运动收缩功能,逐渐发生萎缩。失神经肌肉萎缩是一个复杂的过程,神经受到损伤后会有多种蛋白和基因的表达发生改变。周围神经损伤后,骨骼肌会出现肌肉质量下降、肌纤维直径减小等变化,发生萎缩,进而丧失运动能力。骨骼肌失神经性萎缩是因为肌肉失神经支配后,神经元无法为骨骼肌提供营养因子,导致骨骼肌废用、萎缩,因此骨骼肌失神经性萎缩也称为失营养性萎缩或废用性萎缩,只有使神经重新获得再支配能力,才能有效防止肌肉萎缩。神经的再生速度缓慢,而骨骼肌再生依赖于支配它的运动神经纤维的存在,所以失神经肌肉的再生比较困难,因此,如何延缓和防止失神经后肌肉萎缩,并尽量保持肌肉正常功能成为目前肌肉功能和损伤修复研究的难题。
微小rna(microrna,mirna)是一类长度为22nt、可以抑制mrna翻译的非编码小分子rna,具有重要的生物学功能。其作为一类重要的基因表达调控因子,在细胞分裂、增殖、分化和死亡过程中起着重要的调控作用。mirna在肌肉的发生、发育和损伤修复中都发挥着重要的作用。有研究发现,抑制mir-351的表达可以促进成肌前体细胞的凋亡,抑制增殖,过表达mir-351可以促进肌前体细胞进入分化状态,抑制凋亡,这说明mir-351对肌细胞的增殖与分化发挥着重要作用。有研究显示,骨骼肌特异性mirna(mir-1、mir-133、mir-206等)与失神经后骨骼肌萎缩的调控密切相关,大鼠失神经后,随着时间的延长,mir-1和mir-133的表达先下降,之后逐渐升高。也有研究表明,在注射细胞毒素造成的肌肉损伤模型中,注射mir-675-3p和mir-675-5p可促进肌损伤的修复。mirna在神经损伤修复过程中起着重要作用,有报道称,切断鼠脊神经后,mir-21表达水平升高,而mir-21可促进轴突的生长,表明某些mirna可能对神经损伤具有修复作用。此外,mirnas可通过对靶基因的调控作用参与到特定的信号通路中,促进受损神经的修复与再生,研究表明mir-206可通过对fgfbp1(fgfbindingprotein1)蛋白表达的调控作用,影响神经肌肉接头的神经再支配。由此可见,mirnas在成肌分化和神经形成过程中发挥着重要的调控作用。而失神经肌肉萎缩的修复与再生机制与神经形成和肌细胞的自我更新有着密切的联系,建立延缓小鼠失神经支配肌肉萎缩过程的方法就成了本领域技术人员亟待解决的课题。
目前已有采用调控mirna表达来治疗肌损伤的研究报道,但数量不多,针对的mirna种类和具体的损伤类型也各不相同,通过检索,我们检索到授权公告号为:101448942b,名称为:调节肌细胞增殖和分化的microrna的相关发明专利,该专利根据细胞增殖分化的相关研究结果提出了在体内调控mirna表达水平来治疗肌损伤的方法,在实施方案中该专利将mir-133和mir-1或者它们的抑制剂的组合给予肌损伤部位以改善肌损伤的康复,该专利虽然在靶向mirna的选择上提到了mir-143,但并未对mir-143的使用方法和效果进行验证,另外,该专利针对的肌损伤类型为机械性肌损伤及肌组织退行性疾病(肌营养不良或神经元病变等),并未对失神经肌肉萎缩的案例进行分析。本发明专利前期研究中,我们发现mir-143对骨骼肌卫星细胞的体外增殖分化过程具有调控作用(前述专利并没有mir-143对骨骼肌卫星细胞具有调控作用的研究基础),mir-143在体内对肌损伤修复是否具有一定的调节作用还不清楚。
技术实现要素:
鉴于目前mir-143在体内对肌损伤修复是否具有一定的调节作用,且作用是否具有良好的效果还不清楚,本发明构建小鼠腓肠肌失神经萎缩模型,通过在肌萎缩部位注射microrna-143(mir-143)抑制剂,从而延缓失神经肌肉萎缩过程。本发明的目的在于提供一种通过抑制mir-143表达来延缓小鼠失神经支配肌肉萎缩过程的方法,借助此方法可以为失神经肌肉损伤修复中mirnas的利用提供一定的借鉴,并为失神经肌萎缩机制及其临床诊治的深入研究提供新的思路和参考。
本发明的技术方案如下:
一种利用mir-143抑制剂延缓小鼠失神经后肌肉萎缩的方法,方法步骤包括:在小鼠切除坐骨神经后的后肢腓肠肌内注射混有10nmolmir-143抑制剂的100μlopti-mem培养基,注射在小鼠失神经术后分多次进行。
而且,所述mir-143抑制剂在术后分多次进行注射的具体方法是:术后分三次分别于术后1d、5d、9d进行注射。
本发明的优点及效果:
1、本发明小鼠腓肠肌失神经萎缩模型的建立是通过坐骨神经切除术建立的,而失神经肌肉萎缩模型可以不破坏萎缩部位的肌肉形态,能更好地观察mirnas的作用。
2、本发明通过构建小鼠腓肠肌失神经萎缩模型,进一步研究mir-143在体内对小鼠失神经肌肉萎缩的影响,并最终通过实验研究证明利用混有10nmolmir-143抑制剂的100μlopti-mem培养基进行失神经腓肠肌部位注射可以有效延缓小鼠失神经支配肌肉萎缩过程。
3、本发明利用混有10nmolmir-143抑制剂的100μlopti-mem培养基,并分3次在术后1d、5d、9d进行失神经腓肠肌部位注射。10nmolmir-143抑制剂为经过实验摸索筛选出的可有效发挥作用的抑制剂的量;在不同时间点分三次注射的方法可以有效减缓mir-143抑制剂注射对小鼠的刺激,并同时有助于在失神经部位维持较为稳定的mir-143抑制剂浓度。
4、利用本发明建立的通过抑制mir-143表达来延缓小鼠失神经支配肌肉萎缩过程的方法,可以有效地延缓失神经肌肉萎缩过程,借助此方法可以为失神经肌肉损伤修复中mirnas的利用提供一定的借鉴,并为失神经肌萎缩机制及其临床诊治的深入研究提供新的思路和参考。
附图说明
图1是失神经小鼠模型腓肠肌mir-143表达及相关指标检测结果图片;
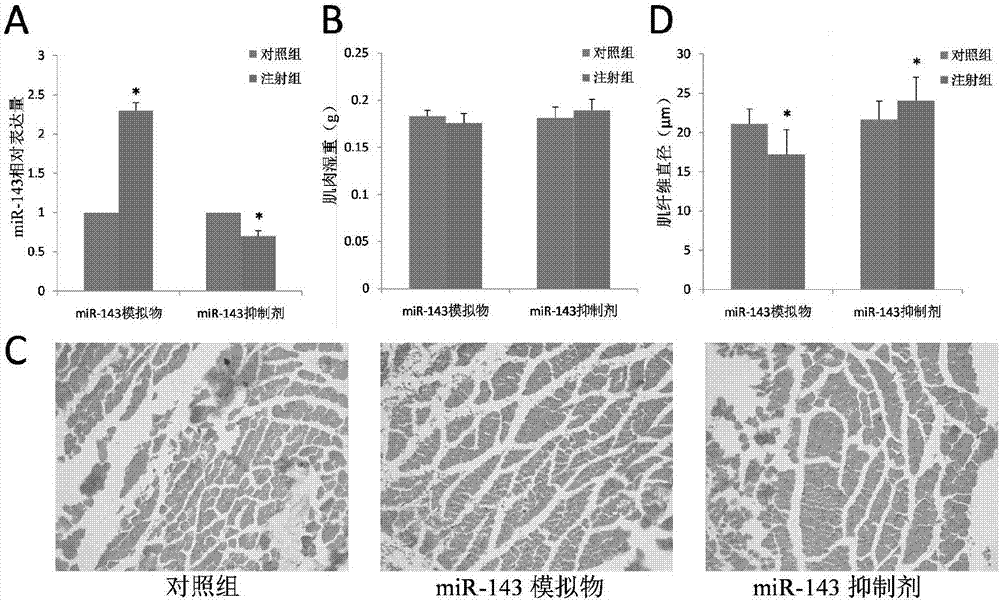
图2是mir-143模拟物和mir-143抑制剂注射对失神经小鼠模型腓肠肌的影响结果图片。
具体实施方式
下面结合具体实施方案对本发明进一步说明,其具体实施方案应该理解为仅为举例说明,不是限定性的,不能以下述举例说明来限定本发明的保护范围。
本发明的设计思路是:
构建小鼠腓肠肌失神经萎缩模型,通过在肌萎缩部位注射microrna-143(mir-143)抑制剂,从而延缓失神经肌肉萎缩过程。首先通过对小鼠进行坐骨神经切断术,构建小鼠腓肠肌失神经萎缩模型,通过实时定量pcr检测mir-143的表达量,比较腓肠肌肌肉湿重和肌纤维直径,然后在肌萎缩部位注射10nmolmir-143抑制剂,显著降低了小鼠腓肠肌中mir-143的表达量,注射mir-143抑制剂后小鼠失神经腓肠肌组织肌纤维的直径明显高于对照组,本发明提供一种通过抑制mir-143表达来延缓小鼠失神经支配肌肉萎缩过程的方法,借助此方法可以为失神经肌肉损伤修复中mirnas的利用提供一定的借鉴。
下面结合附图和具体实施例对本发明作进一步的详细说明:
一种由mir-143抑制剂延缓小鼠失神经后肌肉萎缩的方法,包括以下步骤:
第一步、包含小鼠腓肠肌失神经萎缩模型的建立:
将小鼠从右后肢大腿背侧部平行于股骨切口,钝性分离股二头肌与股外侧肌,进行坐骨神经探查术,暴露坐骨神经,切除距离梨状肌下缘长约3-5mm的坐骨神经,两断端翻转180°,防止断端发生接触,然后按照常规外科手术进行分层缝合,左后肢进行坐骨神经探查术后不做手术处理,建立小鼠失神经腓肠肌萎缩模型,术后观察切除坐骨神经侧的后肢运动能力,检测mir-143表达量、肌肉湿重和肌纤维直径等指标;
具体步骤是:
(1)小鼠腓肠肌失神经萎缩模型的建立。
健康小鼠6只,清洁级,体重30±1g,均为6周龄,小鼠饲养时保证充足饲料,每天换水,每周更换清洁的垫料,术前禁食12h。
术前先对小鼠进行消毒,然后腹腔注射5%的水合氯醛200mg/kg,待小鼠麻醉后将其固定在手术台上,在无菌环境下进行操作。第一组小鼠从右后肢大腿背侧部平行于股骨切口,钝性分离股二头肌与股外侧肌,进行坐骨神经探查术,暴露坐骨神经,切除距离梨状肌下缘长约3-5mm的坐骨神经,两断端翻转180°,防止断端发生接触,然后按照常规外科手术进行分层缝合,左后肢进行坐骨神经探查术后不做手术处理,术后观察发现切除坐骨神经相应侧的后肢丧失运动能力,呈跛行状,小鼠失神经腓肠肌萎缩模型建立成功。
(2)小鼠腓肠肌标本的提取及rna提取。
在术后14d将实验小鼠进行断颈处死,将其双侧后肢皮肤切开暴露皮下组织,剥离腓肠肌肌膜,取出小鼠完整腓肠肌,然后迅速用电子天平称重,再将腓肠肌分成两份,一份用于组织切片染色,一份用于rna提取。
rna提取时,事先准备好用液氮预冷的研钵,然后将取下的腓肠肌快速转移至研钵中,用研杵快速研磨肌肉组织,边研磨边加入适量液氮,直至研磨成粉末状,加入1mltrizolreagent,使粉末被覆盖,之后继续研磨至结晶状,将得到的rna样品室温静置,直至样品完全融化,然后将样品转移至ep管中,进行总rna提取,所有操作按照invitrogentrizol说明书进行。
(3)qrt-pcr检测mir-143在腓肠肌组织中的表达变化。
提取的rna根据反转录试剂盒操作说明进行反转录,获得第一链cdna后,采用light
表1实时定量pcr检测引物序列
(4)石蜡切片制作及he染色
①固定、水洗。将采集的腓肠肌放入足量的4%多聚甲醛溶液中固定24h,保证组织的完整性,水洗过夜。
②脱水、透明。将组织块标记并依次放入70%乙醇、80%乙醇、90%乙醇、95%乙醇、无水乙醇中15min,进行脱水,然后迅速将组织块取出块放入二甲苯中,进行透明处理。
③浸蜡、包埋。将透明后的组织块放入融化的石蜡中,充分浸蜡2h,将浸蜡后的组织块置于包埋盒中,将融化的石蜡注入包埋盒中,待石蜡完全凝固,对蜡块进行修整。
④切片、展片。将蜡块固定在金属持蜡器上,切片机的厚度调至6μm。选择腓肠肌肌腹部的位置进行连续切片,速度要均匀,力度要相同;将切好的蜡片轻轻平铺在45℃的水面上,待蜡片充分展平后,将蜡片捞到载玻片的中部,沥去水分,置于60℃的烤片机上烘烤2h。
⑤he染色。将载玻片放入二甲苯(ⅰ)、二甲苯(ⅱ)中各3min透明,然后迅速取出并依次放入无水乙醇、90%乙醇、80%乙醇、70%乙醇中各30s进行梯度复水,之后用蒸馏水冲洗3min;苏木素液染色10min,流水清洗,然后用1%盐酸乙醇分色3s,pbs缓冲液清洗10min,伊红水溶液染色10min,蒸馏水清洗;置于95%乙醇(ⅰ)、95%乙醇(ⅱ)中2s,无水乙醇(ⅰ)、无水乙醇(ⅱ)中各30s梯度脱水,最后置于二甲苯(ⅰ)、二甲苯(ⅱ)中各30s透明,中性树胶封片。
(5)肌肉相关指标检测
腓肠肌湿重:将腓肠肌取下后立即用电子分析天平称量肌肉湿重。
形态观察:将实验组与对照组he染色的切片分别置于显微镜下观察,观察不同处理下肌纤维形态和肌纤维直径等之间是否存在差异。
腓肠肌肌纤维直径的测量:使用olympuscellsensstandard1.6图像采集系统随机测量实验组与对照组经he染色后在5个不同视野中共60根肌纤维直径,计算平均值。
实验结果表明,失神经腓肠肌与对照组相比,失神经腓肠肌湿重极显著降低(p<0.01,图1-b);失神经腓肠肌与对照组相比,腓肠肌组织颜色较暗,肌纤维明显萎缩,肌纤维直径极显著低于对照组(p<0.01,图1-c,图1-d)。结果表明随着坐骨神经的切断,小鼠腓肠肌出现了明显萎缩。
第二步、小鼠失神经萎缩腓肠肌的mir-143抑制剂处理:
将小鼠按第一步的方法切断两侧后肢坐骨神经,失神经手术后对小鼠的创口进行消毒,小鼠左后肢注射100μlopti-mem培养基。右后肢注射混有10nmolmir-143抑制剂的100μlopti-mem培养基,分3次在术后1d、5d、9d进行注射,抑制mir-143的表达;
具体步骤是:
(1)小鼠失神经萎缩腓肠肌的mir-143表达干预处理。
健康小鼠12只,清洁级,体重30±1g,均为6周龄,随机分为两组,每组6只小鼠,进行失神经后的mir-143表达干预实验,小鼠饲养时保证充足饲料,每天换水,每周更换清洁的垫料。术前禁食12h。两组小鼠根据第一步中的方法切断两侧后肢坐骨神经,失神经手术后对小鼠的创口进行消毒,第一组小鼠右后肢腓肠肌内注射混有10nmolmir-143模拟物的opti-mem培养基,第二组右后肢腓肠肌内注射混有10nmolmir-143抑制剂的opti-mem培养基,均为分3次在术后1d、5d、9d进行注射。两组小鼠左后肢为各自的对照,注射等量opti-mem培养基。
(2)小鼠腓肠肌标本的提取及rna提取。
操作方法同第一步中(2)。
(3)qrt-pcr检测mir-143在腓肠肌组织中的表达变化。
操作方法同第一步中(3)。
(4)石蜡切片制作及he染色
操作方法同第一步中(4)。实验结果见图2-a,双侧坐骨神经均被切断,注射了mir-143模拟物的小鼠腓肠肌中mir-143的表达量极显著高于对照组(p<0.01),而注射了mir-143抑制剂的小鼠腓肠肌中mir-143的表达量极显著低于对照组(p<0.01)。
(5)肌肉相关指标检测。
操作方法同第一步中(5)。
实验结果表明,双侧坐骨神经均被切断,注射了mir-143模拟物的小鼠腓肠肌肌肉湿重略低于对照组,而注射了mir-143抑制剂的小鼠腓肠肌肌肉湿重略高于对照组,但差异不显著(图2-b)。注射了mir-143模拟物的小鼠腓肠肌失神经部位肌纤维直径极显著低于对照组(p<0.01,图2-c,图2-d),而注射了mir-143抑制剂的小鼠腓肠肌失神经部位肌纤维直径极显著高于对照组(p<0.01,图2-c,图2-d)。结果表明小鼠腓肠肌失神经部位抑制mir-143的表达可以减缓失神经肌肉的萎缩过程。说明了mir-143在体内对肌肉的分化发育具有一定的调控作用,抑制mir-143表达可减缓由失神经造成的肌肉萎缩,对肌损伤也有一定程度的修复作用。
- 还没有人留言评论。精彩留言会获得点赞!