车叶草苷酸在制备治疗肾纤维化药物中的应用的制作方法
本发明涉及化合物车叶草苷酸的特定治疗活性,具体涉及含化合物车叶草苷酸的治疗肾脏的药物。
背景技术:
肾纤维化(包括肾小球硬化和肾间质纤维化)是各种原因引起的慢性肾病的主要病理特征之一,以过量细胞外基质在肾间质积聚、肾脏组织结构破坏及肾功能进行性下降为特征,是多种慢性肾脏疾病最终导致肾功能衰竭的主要病理基础和共同途径(姜汉杰,李婉,王辰.丹参粉针剂对单侧输尿管结扎大鼠肾纤维化的保护作用.中国新药杂志.2015,24(22),2606-2611.)。肾间质纤维化程度与肾功能损伤程度关系密切,而肾间质纤维化一旦出现,往往预示着预后不良,有效地防治肾间质纤维化成为减缓慢性肾脏病发展的一个契机。但目前针对肾纤维化的治疗措施却十分有限,主要是积极治疗原发疾病和继发因素(如糖尿病,高血压,高尿酸血症等),临床口服的药物有acei,tgf-β抗体,干扰素等,但其疗效并不显著。因此寻找对肾纤维化具有明确治疗效果的药物具有重要的临床意义。
白花蛇舌草(hedyotisdiffusawilld)系茜草科植物,始载于《广西中药志》,收载于2015年版《中国人民共和国》(一部)附录,为中成药的原料药。其性甘、寒,味苦,归胃、大肠、小肠经,具有清热解毒、利湿消肿、活血定痛的功效,应用广泛,用于抗肿瘤、调节免疫、抗氧化、抗炎等病症,具有清热解毒及利湿消痈之功效。车叶草苷酸(asperulosidicacid)是从白花蛇舌草中提取的一种有效单体,但未见将其应用于治疗肾纤维化的研究报道。
技术实现要素:
本发明所要解决的技术问题是提供车叶草苷酸的新用途,该新用途是车叶草苷酸制药中的应用。
上述应用具体是,车叶草苷酸在制备治疗肾纤维化药物中的应用,其中所述的车叶草苷酸(asperulosideacid)的化学结构如下式所示:
上述应用中,所述的车叶草苷酸由以下方法制得:取白花蛇舌草加入体积浓度为75%的乙醇回流提取2次,每次1h,合并提取液减压浓缩,活性炭脱色,高速离心,取上清,真空干燥,得白花蛇舌草粗提物;将粗提物采用体积浓度为30%的甲醇溶解,以ods柱为固定相,体积浓度为30%的甲醇洗脱,回收甲醇后,真空干燥;然后,以体积浓度为5%的甲醇为流动相,采用制备色谱法分离获得车叶草苷酸。
上述应用中,所述的治疗肾纤维化药物可以是常规的口服制剂或注射剂。
本发明所述应用中的药物可抑制lps诱导的raw264.7细胞tnf-α、il-6、no水平的升高和炎症因子的表达,治疗各种原因引起的肾炎及继发肾纤维化的效果显著。
附图说明
图1为各组动物肾功能指标的柱状图。
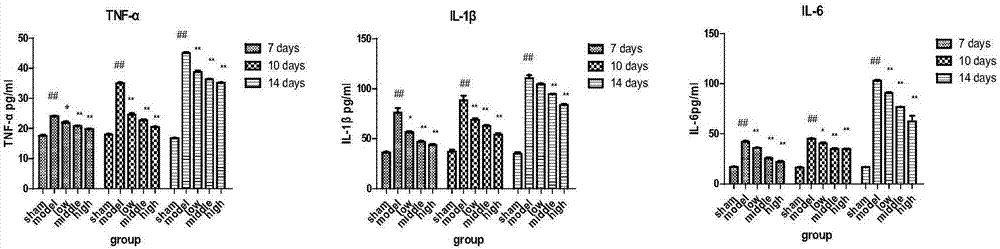
图2为各组动物血清中7天,10天,14天tnf-α、il-1β、il-6表达量的柱状图。
图3为各组动物的肾组织he染色切片的显微照片,其中,a为空白组,b为模型组,c为低剂量组,d为中剂量组,e为高剂量组。
图4为各组动物的肾组织masson染色切片的显微照片,a为空白组,b为模型组,c为低剂量组,d为中剂量组,e为高剂量组。
图5为lps诱导的raw264.7cells细胞il-6、tnf-α、no表达水平的柱状图。
具体实施方式
实施例1(制备车叶草苷酸)
取10kg白花蛇舌草加入10倍量体积浓度为75%乙醇回流提取2次,每次1h,60℃减压浓缩至相对密度为1.10-1.20;往浓缩液中加入重量百分比为0.5%的活性炭脱色,高速离心,取上清,真空干燥,得白花蛇舌草粗提物;将粗提物采用30%甲醇溶解,以ods开口柱为固定相,30%甲醇水溶液洗脱,回收甲醇后,真空干燥。干燥后样品采用5%甲醇溶解,采用高速逆流色谱法分离获得车叶草苷酸。制备条件:ymc-packods-a色谱柱(20×250mm,5μm)为色谱柱,以体积浓度为5%的甲醇为流动相,等梯度洗脱60min;检测波长235nm;进样体积100μl。
实施例2(片剂)
采用湿法制粒的工艺,称量实施例1制备的车叶草苷酸粉末10mg,一水乳糖50-100g和微晶纤维素25-50mg,内加羧甲基纤维素钠1.2mg,过60目筛,混合,再次过筛分散,混合,配制6%的羟丙甲纤维素e5溶液,加入6%的羟丙甲纤维素e5溶液制粒,过20目筛,置于烘箱60℃干燥3h,再加入羧甲基纤维素钠1.2mg,胶体二氧化硅1.2mg和硬脂酸镁1-3mg,混合,使用6.5mm直径的浅弧圆形冲压片,即得。
实施例3(丸剂)
筛选的处方为:药物︰基质质量比为1︰150,peg4000:peg6000质量比为2︰1,料温85℃,滴距5cm,冷却温度10℃,冷凝液为植物油。按处方量精密称取实施例1制备的车叶草苷酸粉末于适量纯化水中,溶解后,加入peg4000和peg6000的混合物,置于80℃以上的磁力搅拌器水浴锅中,加热搅拌至全部熔融后,两者混合均匀。用滴管滴入滴丸装置中,控制合适的滴速,使其沉降于冷凝液中,待其冷却成型,取出滴丸,用滤纸除去冷却剂,自然晾干,选丸。即得。
实施例4(胶囊剂)
称量实施例1制备的车叶草苷酸粉末10mg,一水乳糖50-100g和微晶纤维素25-50g,内加羧甲基纤维素钠1.2mg,过60目筛,混合,再次过筛分散,混合,配制6%的羟丙甲纤维素e5溶液,加入6%的羟丙甲纤维素e5溶液制粒,过20目筛,置于烘箱60℃干燥3h,再加入羧甲基纤维素钠1.2mg,胶体二氧化硅1.2mg和硬脂酸镁1-3mg,混合,填充于羟丙甲纤维素透明胶囊中,即得。
实施例5(注射剂)
处方为:车叶草苷酸1.04g,依地酸二钠0.0005g,碳酸氢钠0.49g,注射用水加至10ml,亚硫酸氢钠0.02g。在配置的容器中,加处方量80%的注射用水,通氮气饱和,加车叶草苷酸溶解后,分次缓慢加入碳酸氢钠,搅拌使其完全溶解,加入预先配置好的依地酸二钠和亚硫酸氢二钠溶液,搅拌均匀,调节药液ph6.0-6.2,添加氮气饱和的注射用水至足量。用微孔滤膜过滤,溶液中通氮气,并在氮气流下灌封,最后煮沸15min灭菌,即得。
实施例6(效果实验)
一、uuo肾纤维化动物的建立
雄性sd大鼠30只,200-250g,随机分为空白对照组,模型组,低剂量组,中剂量组,高剂量组,每组均6只大鼠。除空白对照组外,其余四组行左侧输尿管结扎术(uuo)构造肾纤维化模型。术前禁食不禁水12h,术前称重,uuo组以10%的水合氯醛(0.3ml/100g)腹腔注射麻醉后,俯卧位固定、局部剪毛、常规皮肤消毒,行左侧耻骨上切口,沿左肾下极寻找到左输尿管,用5-0号丝线上下结扎2处,从中剪断输尿管以防逆行感染,术后把肠胃置于原位,分层缝合关闭腹腔。缝合结束后,先用碘伏消毒,后用75%乙醇擦拭伤口。
造模后,待老鼠清醒,腹腔内注射青霉素(160万单位8ml的生理盐水溶解,每次用0.25ml/只的剂量,皮下注射),连续两天,预防感染。术后第二天,模型组按0.5ml/100g/d的剂量腹腔注射0.9%nacl溶液,低、中、高剂量组分别按10mg/kg/d、20mg/kg/d和40mg/kg/d的剂量腹腔注射车叶草苷酸溶液,连续14天,每天1次。各组大鼠分别于术后7天,10天,14天眼眶取血,收集全血后静置30分钟,3500r/min离心15分钟,转移血清至离心管,置于-20℃冰箱,备用;在第13天收集给药后0-6小时时间段尿液,置于-20℃冰箱,备用。
二、车叶草苷酸对uuo大鼠肾纤维化的肾功能影响
取各组大鼠的血清样品,根据尿素氮、尿酸试剂盒说明书检测大鼠血清中各指标含量(试剂盒购买于南京建成生物工程研究所)。取各组大鼠尿液,按照尿蛋白试剂盒(购于南京建成生物工程研究所)说明书操作,测定尿蛋白含量。结果(表1-3,图1)表明:模型组较空白组有显著性差异(p<0.01),低、中、高剂量给药组能显著降低uuo大鼠肾纤维化尿酸、尿素氮、尿蛋白的表达(p<0.01),表明车叶草苷酸对损伤肾脏具有一定的保护作用。
表1各组大鼠血清尿酸(ua)含量
注:##与空白组比较p<0.01,*与模型组比较p<0.05,**与模型组比较p<0.01.
表2各组大鼠血清尿素氮(bun)含量
注:##与空白组比较p<0.01,*与模型组比较p<0.05,**与模型组比较p<0.01.
表3各组大鼠尿蛋白(upro)含量
注:##与空白组比较p<0.01,*与模型组比较p<0.05,**与模型组比较p<0.01.
三、车叶草苷酸对uuo大鼠肾纤维化肾脏指数的影响
各组大鼠腹腔注射10%水合氯醛麻醉,取出已分离的大鼠肾脏组织称重,计算肾脏左右肾与体重比。结果(表4)表明:结扎侧肾脏明显增大;模型组较空白组的肾脏指数差异显著(p<0.05);低、中、高剂量给药组均能显著降低左侧肾脏指数(p<0.05);提示车叶草苷酸对uuo模型引起的肾纤维化具有一定抑制作用。
表4uuo大鼠14天肾脏指数
注:*与模型组比较p<0.05。
四、车叶草苷酸对uuo大鼠炎症反应的影响
取各组大鼠的血清样品,根据tnf-α、il-1β、il-6试剂盒说明书检测大鼠血清中各指标含量(试剂盒均购买于欣博盛生物科技有限公司),结果(表5-7,图2)表明:模型组与空白组比较,tnf-α,il-1β,il-6显著提高(p<0.01),且随着时间延长,表达量升高,梗阻程度严重。车叶草苷酸低、中、高剂量组能够显著降低uuo大鼠肾纤维化的tnf-α,il-1β,il-6表达,能缓解uuo大鼠肾纤维化的梗阻程度,且成剂量依赖性(p<0.05)。
表5各组动物血清中tnf-α测定结果
注:##与空白组比较p<0.01,*与模型组比较p<0.05,**与模型组比较p<0.01.
表6各组动物血清中il-1β测定结果
注:##与空白组比较p<0.01,*与模型组比较p<0.05,**与模型组比较p<0.01.
表7各组动物血清中il-6测定结果
注:##与空白组比较p<0.01,*与模型组比较p<0.05,**与模型组比较p<0.01.
五、车叶草苷酸对肾组织梗阻后产生的炎症反应及继发性肾纤维化的影响。
另取各组大鼠的梗阻侧肾组织,横切一半置于10%福尔马林溶液固定,分别采用he染色法和masson染色法,结果(图3-4)表明:在he染色切片中,各uuo组可见肾小球纤维化伴囊性变,肾小球体积增大,系膜细胞增生,肾小管间质水肿,肾小管上皮细胞变性、肿胀并有明显炎症细胞浸润,肾间质间隙变宽,肾小管扩张,细胞外基质增多。给予车叶草苷酸不同剂量治疗后可改善uuo大鼠肾组织损伤程度,以高剂量最为明显。在masson染色中,模型组可见肾小管扩张,肾间质间隙变宽,胶原纤维在肾间质中明显增加,给予车叶草苷酸不同剂量治疗后,uuo大鼠肾组织肾纤维化程度减轻,提示车叶草苷酸可有效改善肾组织梗阻后产生的炎症反应及继发的肾纤维化。
六、车叶草苷酸对lps诱导的raw264.7cells炎性因子表达的影响
raw264.7细胞弃去细胞培养基,用coldpbs漂洗一次。胰酶消化液37℃1-2min。加完全培养基中和胰酶,1000rpm6min,弃上清。血细胞计数板计数,铺96孔板(多聚赖氨酸处理),每孔1x104个细胞。之后置于37℃,5%co2细胞培养箱中培养24h。分别用40,80和160μg/ml的车叶草苷酸溶液预处理细胞1h。然后用lps(50ng/ml)处理24h,收集细胞培养液上清。采用tnf-α试剂盒(购买于欣博盛生物科技有限公司)、il-6试剂盒(购买于欣博盛生物科技有限公司)和no试剂盒(购买于上海碧云天生物技术有限公司)分别检测细胞液中tnf-α、il-6和no的浓度。结果(表8-10、图5)表明:模型组中tnf-α,il-6,no显著升高(p<0.01),车叶草苷酸低、中、高剂量组可以显著抑制lps诱导的raw264.7细胞tnf-α、il-6、no水平的升高(p<0.01),对正常细胞无影响,表明车叶草苷酸能有效抑制炎症因子的表达。
表8lps诱导的raw264.7细胞tnf-α的含量
注:##与空白组比较p<0.01,**与模型组比较p<0.01.
表9lps诱导的raw264.7细胞il-6的含量
注:##与空白组比较p<0.01,**与模型组比较p<0.01.
表10lps诱导的raw264.7细胞no的含量
注:##与空白组比较p<0.01,**与模型组比较p<0.01.
结论:车叶草苷酸腹腔注射于uuo大鼠肾纤维化模型后,能够改善梗阻侧肾功能,显著减轻肾组织的炎症浸润,减少胶原纤维在肾间质中过度沉积,抑制tnf-α、il-1β、il-6的表达,具有显著的抗炎、保护肾损伤的作用,可以用来制备各种剂型治疗各种原因引起的肾炎及继发的肾纤维化疾病。
- 还没有人留言评论。精彩留言会获得点赞!