一种谷氨酸多肽-雌激素/抗雌激素缀合物、合成方法、组合物及试剂盒与流程
本发明涉及一种用于分子成像和治疗的缀合物(conjugate)及其合成的新方法,以及利用该缀合物形成的组合物及其试剂盒。该缀合物基于与各个病人的疾病相关的个体基因组成、生化和分子设计,可用于个性化治疗,属于化学合成、标记、成像、药物治疗、er-阳性疾病的治疗以及癌症的治疗领域。
背景技术:
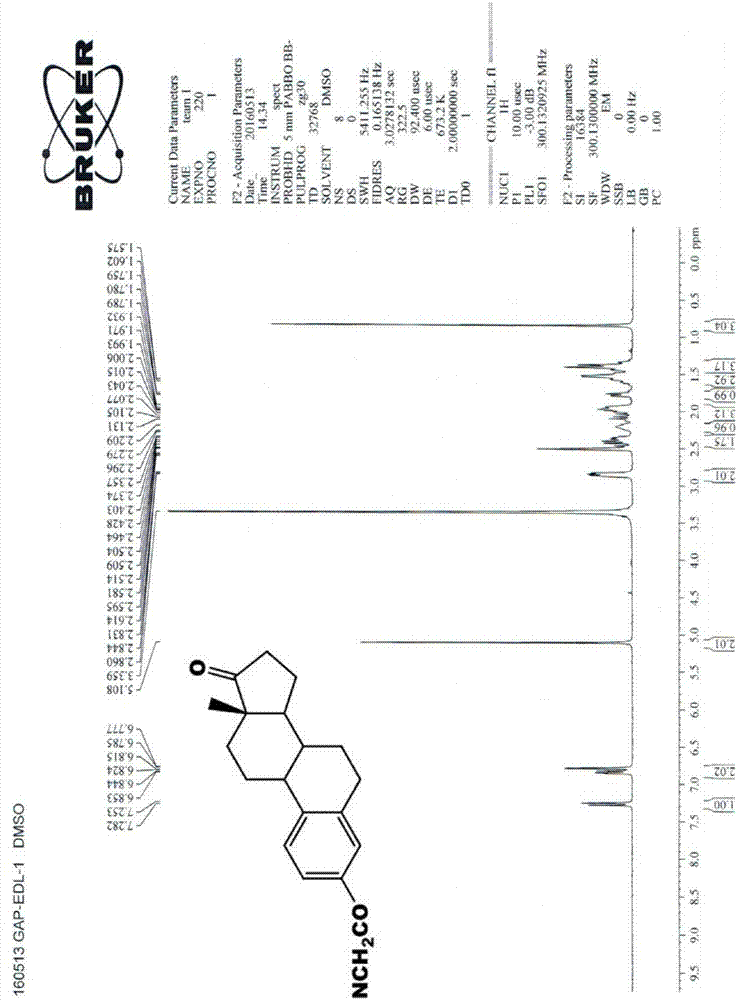
:活性氧(reactiveoxygenspecies,ros)的过量存在导致氧化应激。ros引起dna损伤,导致聚腺苷二磷酸-核糖聚合酶(poly-adpribosepolymerase-1,parp-1)的过度激活,从而引起细胞内nad+的耗尽。ros还激活促炎转录因子nf-kb,从而引起神经炎症。nad+的耗尽引起糖酵解抑制,丙酮酸酯产出不足以及线粒体atp产出降低。还有,nad+的耗尽使乳酸酯转化成丙酮酸酯效率低下,而乳酸酯不再能够用作能量基质,从而引起细胞凋亡。主要有三条路径用于消除活性氧,而这些路径涉及降低的谷胱甘肽(gsh)、硫氧还蛋白(txn)和过氧化氢酶。所有这三条路径都包含在癌细胞内抑制抗氧化响应的关键酶。在这些路径中,gsh受到升高的谷氨酸盐和半胱氨酸转运子系统以及nadph的影响。gsh衍生自代谢物谷氨酸盐和半胱氨酸。谷氨酰胺酶1(gls1)和gls2产生谷氨酸盐,而胱氨酸/谷氨酸盐转运子xct通过谷氨酸盐-半胱氨酸连接酶修饰物亚基(glutamate–cysteineligasemodifiersubunit,gclm)和gcl催化亚基(gclcatalyticsubunit,gclc)提供生成gsh的半胱氨酸。gsh通过谷胱甘肽过氧化物酶和谷胱甘肽s-转移酶的作用直接作用于消除ros[参见:chenh,tangx,zhoub,zhouz,xun,wangy.aros-mediatedmitochondrialpathwayandnrf2pathwayactivationareinvolvedinbde-47inducedapoptosisinneuro-2acells.chemosphere.2017;184:679-686.doi:10.1016/j.chemosphere.2017.06.006.;akandamr,kimmj,kimis,ahnd,taehj,rahmanmm,parkyg,seoljw,namhh,choobk,parkby.neuroprotectiveeffectsofsigesbeckiapubescensextractonglutamate-inducedoxidativestressinht22cellsviadownregulationofmapk/caspase-3pathways.cellmolneurobiol.2017.doi:10.1007/s10571-017-0496-y.;habibe,linher-melvillek,linhx,singhg.expressionofxctandactivityofsystemxc(-)areregulatedbynrf2inhumanbreastcancercellsinresponsetooxidativestress.redoxbiol.2015;5:33-42.doi:10.1016/j.redox.2015.03.003.]。谷氨酸盐在ros期间引起ca2+过载,从而导致gsh的生成。因此,谷氨酸盐受体/转运子系统与细胞内gsh生成有关。聚左旋谷氨酸(pg)已用作多种疏水性癌症化学治疗剂的肿瘤靶向药物载体[参见:batzhg,ringsdorfh,ritterh.pharmacologicallyactivepolymers,7.cyclophosphamide-andsteroidhormonecontainingpolymersaspotentialanticancercompounds.diemakromolekularechemie.1974;175(8):2229–2239.;hurwitze,wilchekm,pithaj.solublemacromoleculesascarriersfordaunorubicin.japplbiochem.1980;2(1):25–35.;katoy,saitom,fukushimah,takeday,harat.antitumoractivityof1-beta-d-arabinofuranosylcytosineconjugatedwithpolyglutamicacidanditsderivative.cancerres.1984;44(1):25–30.;morimotoy,sugibayashik,sugiharas.antitumoragentpoly(aminoacid)conjugatesasadrugcarrierincancerchemotherapy.jpharmacobiodyn.1984;7(9):688–698.;hoescjt,potmanw,vanheeswijkwar,etal.optimizationofmacromolecularprodrugsoftheantitumorantibioticadriamycin.jcontrolrelease.1985;2:205–213.;mochizukie,inakiy,takemotok.synthesisofpoly-l-glutamatescontaining5-substituteduracilmoieties.nucleicacidssympser.1985;16(16):121–124.;zuninof,pratesig,michelonia.poly(carboxylicacid)polymersascarriersforanthracyclines.jcontrolrelease.1989;10(1):65–73.;hoescjt,grootoonkj,duncanr,etal.biologicalpropertiesofadriamycinboundtobiodegradablepolymericcarriers.jcontrolrelease.1993;23(1):37–53.;kiewlv,cheongsk,ramlie,sidikk,limtm,chungly.efficacyofapoly-l-glutamicacid-gemcitabineconjugateintumor-bearingmice.drugdevres.2012;73(3):120–129.]。pg具有额外的优点,诸如优异的水溶性、生物相容性、非免疫原性、可生物降解至谷氨酸盐以及由于它的多个羧基导致的高药物装载能力[参见:mccormick-thomsonla,sgourasd,duncanr.poly(aminoacid)copolymersasapotentialsolubledrugdeliverysystem.2.bodydistributionandpreliminarybiocompatibilitytestinginvitroandinvivo.jbioactcompatpolym.1989;4(3):252–268.;sumih,kawabek,nakajiman.effectofvariouspolyaminoacidsandd-andl-aminoacidsonthebloodfibrinolyticsystem.compbiochemphysiolb.1992;102(1):159–162.;lic.poly(l-glutamicacid)–anticancerdrugconjugates.advdrugdelivrev.2002;54(5):695–713.;kennyad.evaluationofsodiumpoly-alpha,l-glutamateasaplasmaexpander.procsocexpbiolmed.1959;100(4):778–780.]。具有这些特点,pg-药物缀合物能够靶向细胞内基因。pg是具有相同重复单元的聚合物基材料。因此,在,pg-药物结合期间,一致性和纯度并不优化。在基于受体的成像中,试剂需要达成高比活度(ci/umol)。如果被标记的试剂由不同的分子量污染,则成像质量保证会有问题。此外,不知道在哪个位点药物被结合至pg。合规性通常需要该详细的gmc信息。本发明公开了分子首先与谷氨酸盐反应,随后是谷氨酸肽。最终的结构是使该结合的分子设置至谷氨酸肽的第一谷氨酸盐。兴奋性氨基酸谷氨酸盐经由多种谷氨酸盐受体发挥其作用。代谢性谷氨酸盐受体据报道与膜雌激素受体(er),更具体地与mglu5受体亚型相互作用。17β-雌二醇和mglu5拮抗剂在患有帕金森病的1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,mptp)小鼠模型中具有神经保护效果[参见:al-sweidis,morissettem,dipaolot.estrogenreceptorsmodulatestriatalmetabotropicreceptortype5inintactandmptpmalemicemodelofparkinson'sdisease.jsteroidbiochemmolbiol.2016;161:84-91.doi:10.1016/j.jsbmb.2016.02.004]。因此,雌二醇(一种雌激素受体配体)被选作结合至谷氨酸肽的分子。已知谷氨酸肽在体外刺激骨吸收且特异性作用于谷氨酸受体[参见:chenuc,serrecm,raynalc,burt-pichatb,delmaspd.glutamatereceptorsareexpressedbybonecellsandareinvolvedinboneresorption.bone.1998;22(4):295-9.]。谷氨酸肽已证明其靶向肾组织的能力[参见:chaihj,kiewlv,chiny,etal.renaltargetingpotentialofapolymericdrugcarrier,poly-l-glutamicacid,innormalanddiabeticrats.jnanomedicine.2017;12:577-591.doi:10.2147/ijn.s111284.]。将雌二醇(edl)结合至gap是合适的,且gap-edl可增强细胞内er的结合功效。采用来自gap的酸残基,gap可螯合放射性金属同位素(radiometallicisotopes),以用于成像和放射治疗应用。先前已经报道过99mtc-gap-edl和68ga-gap-edl都是断层扫描中有用的化合物[参见:takahashin,yangdj,kohanims,ohc-s,yud-f,azhdariniaa,zhangx-c,changjy,kimee.targetedfunctionalimagingofestrogenreceptorswith99mtc-gap-edl.eurjnuclmedmolimaging.2007;34:354-362.;takahashin,yangdj,kuriharah,bornea,kohanims,ohc-s,mawlawio,kimee.functionalimagingofestrogenreceptorswithradiolabeledgap-edlinrabbitsendometriosismodel.academicradiology2007;14(9):1050-7.]。雌激素经由主要位于细胞核内的α和β雌激素受体引起基因组效应。erα在介导基因转录中的作用在文献中有据可查,并且采用小鼠模型和人乳腺(癌)细胞系的研究已证明erα在细胞增生方面所起的作用。相比之下,erβ作为转录调控子的作用并不清晰。研究揭示erβ可能通过异源二聚化可降低erα的活性[参见:speirsv,carderpj,lanes,dodwelld,lansdownmr,hanbyam:oestrogenreceptorbeta:whatitmeansforpatientswithbreastcancer.lancetoncol.2004,5:174-181.10.1016/s1470-2045(04)01413-5.;hayashisi,eguchih,tanimotok,yoshidat,omotoy,inouea,yoshidan,yamaguchiy:theexpressionandfunctionofestrogenreceptoralphaandbetainhumanbreastcanceranditsclinicalapplication.endocrrelatcancer.2003,10:193-202.10.1677/erc.0.0100193.]。最近,处于膜上的雌激素受体已被认为是通过雌激素对若干细胞过程引起快速“非基因”作用。er调节子,例如三苯氧胺是研究雌激素的作用机制以及临床实践中的重要工具。er在若干水平介导nf-κb活性的抑制。在这些激素和免疫系统之间的这些重要调节子之间的交互作用可被用来治疗癌症、炎性和自身免疫性疾病[参见:sasl,lardonf,vermeulenpb,hauspyj,etal.theinteractionbetweenerandnfκbinresistancetoendocrinetherapy.breastcancerresearch2012,14:212]。在现有技术中,雌二醇采用水纯化(aqueouspurification)结合至pg(yangdj,ohcs,kohanims,yudf,azhdariniaa,kimee.poly(peptide)asachelator:methodsofmanufactureanduses.u.s.patentapplication20060246005,wo2006107794a2.),但是细胞摄取低,这可能是由于其纯度问题。因而,谷氨酸肽-雌二醇(gap-edl)采用改进的有机合成方法进行结合。雌激素受体在结合以及对各个荷尔蒙路径的响应方面的发现在治疗氧化应激引起的ros、炎症和癌症方面使患者受益。在病态期间,由于gsh的高需求,谷氨酸盐受体被过表达。已知谷氨酸肽(gap)结合至谷氨酸盐受体/转运体(yangdj等人,u.s.专利申请us20060246005a1;wo2006107794a2)。过表达的谷氨酸盐系统可增强标记的gap-edl的细胞摄取。一旦gap-edl进入细胞,gap-edl可靶向er基因。为了增进对雌激素受体(er)相关疾病的理解,本发明描述了采用谷氨酸肽-雌激素缀合物进行精密er阳性(er+)成像和治疗。er+路径激活系统的分子成像用作荷尔蒙依赖型疾病(如癌症和子宫内膜异位)管理的基础。er+病人对内分泌治疗反应更好,且生存期是er-病人的两倍长。然而,临床采用的芳香化酶抑制剂和抗雌激素的肿瘤抵抗性结果是不可预知的。放射性标记的er+配体能够定量化er+组织摄取,从而有助于对癌症和子宫内膜异位进行分期和再分期。通过采用标记配体的er+损伤的鉴别诊断有助于选择对内分泌治疗有最佳反应的病人,以及当耐药性发生时中断治疗。此外,放射性标记的er+配体用作成像导向的响应跟进的基础。现有文献报告已显示采用聚谷氨酸盐作为药物载体的策略可改变药物溶解性并强化雌激素受体-配体结合袋。该技术有助于通过谷氨酸盐受体介导的过程靶向细胞内基因。但是,所描述的聚谷氨酸盐为混合的聚合物的共混物,具有宽广范围的分子量。因而,产品的纯度是未被优化的。相关技术描述:关于用于金属标记的分子制剂的合成制备,当此类制剂在水性(湿)条件下制备时,制剂的纯化有时可能存在问题。在水性条件下,纯化可采用例如尺寸排阻层析(sizeexclusionchromatography)或用特定分子量筛截的膜透析来实现。例如,当分离分子量为1000g/mol或更高的物质时,透析通常是最有效的。然而,该纯化方法通常不仅仅分离所需的试剂,也分离可通过膜的任何其它物质。基于受体的成像剂需要高的比活度(>0.1ci/umol)以克服非特异性蛋白质结合。因此,在基于受体的成像剂中引入杂质在它们的临床应用中可能是有问题的。例如,如果含有放射性核素的成像剂被认为是纯的,而实际上含有也包含放射性核素的杂质,则成像剂的测量检测可能会由于杂质的存在而出现错误。当采用多肽如聚谷氨酸盐作为药物载体时,情况尤其如此。商购的聚谷氨酸盐具有宽范围的分子量,其包含多种聚谷氨酸盐的混合物。这使得在分子中的药物位置的质量保证困难。此外,结合反应在水性条件下频繁进行,从而纯度得不到优化。在有机溶剂中合成有机化合物的方法以及采用保护基通常相比水性纯化更有利于获得较纯的化合物。保护基需利于中间体的纯化。采用有机溶剂的各种纯化方法更加容易获得高纯度化合物。考虑到有机合成和纯化提供的相比水性纯化的益处,有机合成和纯化显影剂的方法将可能产出相比经由水性纯化获得的那些试剂纯度更高的试剂。因此,有必要开发有机合成技术能够以更有效的方式获得更高纯度的位点特异性缀合物。这种显影剂与分子成像整合起来,可以更准确地理解导致组织恶化、发炎和增生病症的路径激活细胞受体的动态变化,并改进患者诊断、治疗和预后。技术实现要素:本发明的目的是提供一种用于治疗和诊断应用的谷氨酸肽-雌激素/抗雌激素缀合物以及其有效合成方法,该改进的合成方法制备纯的gap-edl,并在细胞摄取实验中具有大大增加的敏感性和特异性。本发明还提供了包括采用本发明中制备的缀合物的组合物在受试者中的成像和治疗疾病的方法。为了达到上述技术目的,本发明的技术方案是:一种谷氨酸多肽-雌激素/抗雌激素缀合物,其包括具有3~20个重复氨基酸的多肽和雌激素或抗雌激素,所述雌激素或抗雌激素结合至上述多肽的第一谷氨酸盐处。作为优选,所述多肽为谷氨酸肽、天冬氨酸肽,或为谷氨酸肽、天冬氨酸肽混合的多肽。所述多肽为3~6个重复氨基酸的多肽,作为进一步的优选,所述多肽为6个重复氨基酸的多肽。作为优选,所述多肽的分子量为500到9000。作为优选,所述雌激素为雌二醇、雌素酮、雌三醇或克罗米酚,作为进一步优选,所述雌激素为雌二醇。作为优选,所述抗雌激素为非类固醇三苯氧胺、托瑞米芬(toremiphene)、他莫昔芬、雷洛昔芬或氨鲁米特。上述缀合物结构:氨化的雌激素采用氨基和1-羧酸保护的谷氨酸两者结合至5-谷氨酸末端,制成谷氨二酰基-雌激素,所述谷氨二酰基-雌激素结合至全部酸保护的谷氨酸肽的氨基末端。作为一个实施例,上述缀合物结构为:一种谷氨酸多肽-雌激素/抗雌激素缀合物的合成方法:将氨基雌激素或氨基抗雌激素与羧酸保护的谷氨酸盐(单谷氨酸盐)在有机溶剂中混合,制备谷氨酸盐-雌激素缀合物或谷氨酸盐-抗雌激素缀合物;将谷氨酸盐-雌激素缀合物或谷氨酸盐-抗雌激素缀合物与包含偶联剂的全部羧酸保护的多肽进行反应,相应制得谷氨酸多肽-雌激素缀合物或谷氨酸多肽-抗雌激素缀合物。根据选择的雌激素或抗雌激素的不同,分别获得谷氨酸多肽-雌激素或谷氨酸多肽-抗雌激素,此时所述雌激素位于谷氨酸多肽-雌激素的第一谷氨酸盐处,所述抗雌激素位于谷氨酸多肽-抗雌激素的第一谷氨酸盐处。作为进一步限定,所述氨基雌激素为氨基位于雌激素的3’、5’、17’位的雌激素。所述氨基雌激素具有位于甾体环的3’位处的氨基。具体地,所述氨基雌激素为氨基雌二醇、氨基雌三醇或氨基雌素酮。作为进一步限定,所述抗雌激素为非类固醇三苯氧胺、托瑞米芬(toremiphene)、他莫昔芬、雷洛昔芬或氨鲁米特。具体地,上述缀合物优选的合成方法:将氨基雌二醇和1-羧酸保护的谷氨酸盐在有机溶剂中混合,制备γ谷氨二酰基-雌二醇缀合物;将所述γ谷氨二酰基-雌二醇缀合物与包含偶联剂的全部羧酸保护的谷氨酸五肽(谷氨酸肽)进行反应制得谷氨酸多肽-雌二醇,雌二醇位于谷氨酸多肽-雌二醇的第一谷氨酸盐处。或如谷氨酸肽(gap)-雌二醇缀合物的有效合成方法:受保护的单谷氨酸盐用作前体来制备5-谷氨二酰基-雌二醇缀合物。5-谷氨二酰基-雌二醇然后在n端结合至谷氨酸肽(gap)以形成gap-雌二醇(gap-edl),edl在gap的第一谷氨酸盐处位点特异性地结合。上述混合方法可在有机溶剂如二甲基甲酰胺、二甲亚砜、二氧六环(dioxane)、甲醇、乙醇、己烷、二氯甲烷、氯化物、乙腈、四氢呋喃,或它们的混合物中实现。在其它方面,该混合方法可在水性溶剂中实现。氨基酸的一个、两个、三个、四个、五个或所有的羧酸基团或多肽可例如被叔丁基或苄基保护,或未被保护。在一个具体的例子中,该氨基酸为由n-叔丁氧羰基和1-苄基羧基保护的谷氨酸,例如1-苄基-n-叔丁氧羰基-l-谷氨酸酯。保护基通常用于有机合成而不用于水性合成。本发明的方法可进一步包括至少一个纯化步骤。本发明的任何化合物可通过本领域的技术人员已知的任何方法纯化。当那些方法可采用时,本领域的技术人员熟悉该方法。例如,在一个目的在于获得一特定化合物的多步骤合成中,可在每一个合成步骤后、每几个步骤后、合成期间的不同点处、和/或在合成的末尾处进行纯化步骤。在一些方法中,一个或多个纯化步骤包括选自以下的技术:硅胶柱色谱法、高效液相层析(hplc)和液相层析(lc)。在某些实施方式中,纯化方法明确不包括尺寸排阻色谱法和/或透析。纯化方法将在下面更详细描述。在一个特定方面,该方法可包括在与谷氨酸肽偶合反应之前纯化所述谷氨盐酸-雌二醇缀合物。为了制备谷氨酸肽-雌二醇缀合物,谷氨酸酸-雌二醇缀合物的受保护的羧酸被选择性地解保护并采用偶联化学品(如1-羟基苯并三唑和苯并三唑-1-基氧基-三(二甲氨基)-磷六氟磷酸盐(benzotriazol-1-yloxy-tris(dimethylamino)-phosphoniumhexafluorophosphate,bop))与全部酸保护的谷氨酸五肽(glutamatepentapeptide,谷氨酸肽)酯反应。一种用于个人诊断或精确医疗的组合物,其包括上述谷氨酸多肽-雌激素/抗雌激素缀合物和用于标记的金属离子。作为优选,所述金属离子是放射性核素。例如,所述金属离子是tc-99m、ga-68、cu-60、cu-64、in-111、ho-166、re-186、re-188、y-90、lu-177、ra-223、ac-225,或在疾病治疗中用于诊疗的金属。所述组合物优选为99mtc-谷氨酸肽-雌二醇或68ga-谷氨酸肽-雌二醇。本发明精确地提供了在给定受试对象中的疾病部位成像的方法以进行预治疗/后治疗评估并能够监控该受试对象,只要受试对象正采用雌激素进行治疗或在治疗中。在某些方面,该方法包括检测由在个体受试对象中的疾病部位处的放射性核素标记的螯合剂缀合物产生的信号,其中疾病部位,如果存在的话,产生比该组织周围更强烈的信号。为了生成金属离子标记的谷氨酸肽-雌二醇缀合物,所述金属离子选自锝离子、锡离子、铜离子、铟离子、铊离子、镓离子、砷离子、铼离子、钬离子、钇离子、钐离子、硒离子、锶离子、钆离子、铋离子、铁离子、锰离子、镥离子、钴离子、铂离子、钙离子、铹离子。在一些方面,金属离子为一种放射性核素,以及任何本领域的技术人员已知的放射性核素。非限制性的放射性核素的例子包括:99mtc、117msn、177lu、188re、186re、153sm、166ho、90y、89sr、67ga、68ga、111in、183gd、59fe、225ac、212bi、211at、45ti、60cu、61cu、67cu、64cu以及62cu。在其它方面,金属离子为非放射性金属,例如187re。将要成像的位点可为肿瘤或富集er的组织,诸如卵巢和子宫组织。该方法还可限定为治疗患有癌症或子宫内膜异位的受试个体的方法。在具体的方面,所述癌症为乳腺癌、肺癌、前列腺癌、卵巢癌、子宫癌、宫颈癌或子宫内膜癌。在其它方面,该方法可被进一步限定为成像受试个体内的位点的方法,包括检测来自于位于所述位点处的金属离子标记的谷氨酸肽-雌激素缀合物的信号。该信号可采用选自以下的技术检测:pet、pet/ct、spect、spect/ct、pet/mri、spect/mri、结合核成像装置的光学成像。本发明提供一种试剂盒,其包括上述的一种用于个人诊断或精确医疗的组合物。本发明还提供一种缀合物组合物或试剂盒,缀合物组合物或试剂盒包括本发明的缀合物,例如包含约1mg的谷氨酸肽-雌二醇缀合物。缀合物组合物或试剂盒还可包含抗氧化剂、稳定剂、防腐剂或盐。例如,缀合物组合物或试剂盒可额外地包含抗坏血酸、甘露醇和/或氯化锡(ii)。例如包含:a)每1mg谷氨酸肽-雌二醇缀合物约0.5至2.0mg的抗坏血酸;b)每1mg谷氨酸肽-雌二醇缀合物约10至20mg的甘露醇;和/或c)每1mg谷氨酸肽-雌二醇缀合物约0.05至0.1mg的氯化锡(ii)。在一些方面中,所述组合物为水性溶液或已冰冻和/或冻干的溶液。在再一个实施例中,提供了一种对一部位进行成像、诊断或治疗在受试个体内的疾病的方法,包括向患者施用金属离子标记的谷氨酸肽-雌二醇缀合物。例如,该方法可包括a)获得包含68ga标记的谷氨酸肽-雌二醇缀合物的组合物;b)向受试个体施用药学上或诊断上有效量的所述组合物,其中所述部位被成像,所述疾病被诊断,或所述疾病被治疗。要成像的位点可为肿瘤、心脏、子宫内膜组织。该方法还可限定为对患有心血管疾病的受试对象的成像、诊断或治疗的方法。所述心血管疾病可为心肌梗死、充血性心力衰竭、心肌病、心脏瓣膜病、心律不齐、先天性心脏病、心绞痛、非心脏性循环充血、收缩性心力衰竭、具有正常功能的心力衰竭或右侧心力衰竭。本发明专利文件中,谷氨酸多肽-雌激素/抗雌激素缀合物指的是谷氨酸多肽-雌激素缀合物或谷氨酸多肽-抗雌激素缀合物,雌激素或抗雌激素为受体配体,当受体配体选择雌激素时,缀合物即为谷氨酸多肽-雌激素缀合物,而当受体配体选择抗雌激素时,缀合物即为谷氨酸多肽-抗雌激素缀合物。本发明改进的合成方法制备纯的gap-edl并在细胞摄取实验中具有大大增加的敏感性和特异性。本发明的缀合物与金属离子结合(标记)形成组合物,如68ga-gap-edl,该改进的合成的组合物的平均细胞摄取为以前报道的合成的5倍高,能够有效地成像和治疗相关疾病,例如对受试者内的er富集组织进行成像的方法以及对子宫内膜异位进行诊断的方法。本发明技术平台采用结合拮抗剂和激动剂且在多种疾病形式中看到其效果。本发明公开的技术和制造方法还可采用本领域的技术人员已知的化学工艺制备为药剂剂型和试剂盒。本发明合成方法可避免向谷氨酸盐和谷氨酸五肽(谷氨酸肽)添加保护剂相比于美国专利申请us20060246005a1和wo2006107794a2(在此以引用方式并入)中描述的其它方法提高工艺效率和最终产物的纯度。附图说明图1为gap-edl合成路线图。图2为gap-edl-1的合成获得产物光谱图。图3为gap-edl-2的合成获得产物光谱图。图4为gap-edl-3的合成获得产物光谱图。图5为gap-edl-4的合成获得产物光谱图。图6为gap-edl-5的合成获得产物光谱图。图7为1,5-二-叔丁基gap酯的1h-nmr。图8为gap-edl-5的1h-nmr。图9为gap-edl的合成。图10为gap-edl的质谱。图11为gap-edl的1h-nmr。图12为gap-edl-4的1h-nmr。图13为gap-edl-4的hplc。图14为gap-edl的hplc。图15为68gacl3的itlc分析(聚酰胺,洗脱剂:生理盐水)。图16为68ga-gap的itlc分析(聚酰胺,洗脱剂:生理盐水)。图17为68ga-gap-edl的itlc分析(聚酰胺,洗脱剂:生理盐水)。具体实施方式下面结合附图和具体实施方式对本发明作进一步详细的说明。本发明gap-edl的合成方案示于图1中。(1)(8r,9s,13s,14s)-3-氰基甲氧基-13-甲基-7,8,9,11,12,14,15,16-八氢-6h-环戊醇[a]菲-17-酮((8r,9s,13s,14s)-3-cyanomethoxy-13-methyl-7,8,9,11,12,14,15,16-octahydro-6h-cyclopenta[a]phenanthren-17-one)(gap-edl-1))的合成(8r,9s,13s,14s)-3-羟基-13-甲基-7,8,9,11,12,14,15,16-八氢-6h-环-五[a]菲-17-酮(雌素酮,2.00g,7.40mmol)在氮气氛下溶解在无水四氢呋喃(thf,25ml)中。然后加入甲醇钠(0.80g,14.82mmol)。将溶解在12mlthf中的溴乙腈(1.78g,14.84mmol)逐滴加入。在室温下搅拌混合物1小时。加入另外的甲醇钠(0.60g,11.11mmol)和在4mlthf中的溴乙腈(1.21g,10.89mmol)。将反应混合物在室温下继续搅拌0.5小时。将饱和的氯化铵溶液(100ml)和乙酸乙酯(100ml)加入到反应混合物中。收集有机层。用另外的乙酸乙酯(2×50ml)提取水相。合并有机层并用饱和氯化钠溶液清洗。将有机提取物在硫酸镁上干燥并过滤。在降低的压力下将溶剂蒸发。将粗固体产物用二乙醚洗涤并获得2.11g(6.82mmol)固体产物,产率为92.2%。1h-nmr(300mhz,dmso):7.27(d,j=8.6hz,1h),6.83(dd,j=8.8hz,2.6hz,1h),6.78(d,j=2.5hz,1h),5.11(s,2h),2.80-2.86(m,2h),2.36-2.50(m,2h),2.16-2.26(m,1h),1.84-2.15(m,3h),1.74-1.80(m,1h),1.33-1.46(m,3h),1.46-1.60(m,3h),0.84(s,3h)。lc-ms:针对c20h23no2计算,309.2;发现[m+h]为310.1。光谱示于图2中。其中光谱图右侧的参数的含义罗列如下:currentdataparameters…………………当前数据参数name…………………………………………名称team……………………………………………队expno…………………………………………实验号procno………………………………………处理号f2-acquisitionparameters……………获得参数date_..............................日期time…………………………………………时间instrumspect…………………………….仪器spectprobhd5mmpabbobb-………………bb-5毫米宽带探头pulprogzg……………………………..预饱和水峰压制脉冲序列td……………………………………………原始数据点数solvent……………………………………溶剂ns…………………………………………….采样次数ds…………………………………………….采样前扫描次数swh………………………………………….谱宽fidres……………………………………….fid分辨率aq…………………………………………….取得时间(s)rg……………………………………………..接收增益dw……………………………………两次连续数据点之间的间隔时间de……………………………………………..扫描前延迟te………………………………………………温度channelf1………………………………..通道f1nuc1…………………………………………频率通道f1-f8用核p1……………………………………………..90度高功率脉冲pl1…………………………………………...脉冲功率水平(默认)sf01…………………………………………..共振频率01f2-processingparameters……………………..f2-处理参数si……………………………………………….数据点个数sf……………………………………………….使用的共振频率wdwem…………………………………....fid窗口倍压模式ssb…………………………………………….正弦贝尔移位lb………………………………………………洛伦兹扩展系数gb………………………………………………高斯扩展系数pc……………………………………………….峰值检出敏感度对于其它实例中光谱图右侧的参数的含义与如上所列相同。(2)(8r,9s,13s,14s,17s)-3-氨基乙氧基-13-甲基-6,7,8,9,11,12,14,15,16,17-十氢环戊二烯[a]菲-17-开环((8r,9s,13s,14s,17s)-3-aminoethoxy-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthrene-17-ol(gap-edl-2))的合成在氮气氛下将gap-edl-1(2.10g,6.79mmol)溶解在无水thf(90ml)中。将混合物冷却至0-5℃并将氢化铝锂(1.70g,44.80mmol)逐份加入。将反应混合物在0-5℃搅拌5-10分钟,然后在室温下搅拌2小时。在反应结束后,将混合物再冷却至0-5℃并用水淬火。将悬浮液过滤并用thf进行清洗。蒸发滤液并在降低的压力下浓缩。将粗化合物采用由甲醇/二氯化物(meoh/dcm;1/30)洗脱的硅凝胶填充的柱层析进行纯化以提供为灰白(off-white)固体(1.22g,3.87mmol,产率57.0%)的3-氨基乙氧基雌二醇(gap-edl-2)。1h-nmr(300mhz,cdcl3):7.20(d,j=8.6hz,1h),6.71(dd,j=8.6hz,2.7hz,1h),6.64(d,j=2.7hz,1h),3.98(t.j=5.2hz,2h),3.73(t.j=8.4hz1h),3.06(t.j=5.2hz,2h),2.80-2.85(m,2h),2.26-2.36(m,1h),2.06-2.23(m,2h),1.83-1.98(m,2h),1.65-1.76(m,2h),1.65-1.76(m,1h),1.14-1.48(m,7h),0.78(s,3h)。lc-ms:针对c20h29no2计算,315.2;发现[m+h]为316.1。光谱示于图3中。(3)5-n-[氨基-3-乙氧基雌二醇]-1-苄基-n-叔-丁氧基羰基-l-谷氨酸盐5-酰胺(5-n-[amino-3-ethoxyestradiol]-1-benzyl-n-tert-butoxycarbonyl-l-glutamate5-amide(gap-edl-3))的合成将1-苄基-n-叔-丁氧基羰基-l-谷氨酸酯(0.50g,1.48mmol)、1,2,3-苯并三氮唑-1-醇(0.215g,1.59mmoml)和苯并三氮唑-1-氧基-三(二甲氨基)磷六氟磷酸盐(bop,0.700g,1.58mmol)在氮气氛下溶解在无水二甲基甲酰胺(dmf,15ml)中。然后加入n,n-二异丙基乙胺(dipea,0.205g,1.59mmol)。将反应混合物在0-5℃下搅拌,然后加入gap-edl-2(0.50g,1.585mmol)。将反应混合物在0-5℃下搅拌10分钟并在室温下搅拌1小时。待反应完成后,在降低的压力下移除dmf并加入乙酸乙酯(250ml)。用4%的碳酸氢钠溶液(200ml)清洗有机相,在硫酸镁上干燥,过滤并在降低的压力下进行浓缩。通过柱层析在用乙酸乙酯/二氯甲烷(etoac/dcm,5/1)洗脱的硅凝胶上纯化粗化合物,以提供呈白色固体的gap-edl-3(0.40g,0.63mmol,产率42.5%)。1h-nmr(300mhz,cdcl3):7.31-7.38(m,5h),7.19(d,j=8.7hz,1h),6.69(dd,j=8.6hz,2.7hz,1h),6.61(d,j=2.6hz,1h),6.27(br,1h),5.27-5.34(m,1h),5.19(d,j=12.2hz,1h),5.11(d,j=12.2hz,1h),4.28-4.47(m,1h),3.99(t,j=5.1hz,2h),3.73(t,j=8.5hz,1h),3.62(q,j=5.7hz,2h),2.78-2.88(m,2h),2.06-2.34(m,6h),1.84-1.98(m,3h),1.65-1.76(m,1h),1.14-1.54(m,16h),0.77(s,3h)。lc-ms:针对c37h50n2o7计算,634.4;发现[m+h]为635.2。光谱示于图4中。(4)5-n-[氨基-3-乙氧基雌二醇]-n-叔-丁基羰基-l-谷氨酸5-酰胺(5-n-[amino-3-ethoxyestradiol]-n-tert-butoxycarbonyl-l-glutamicacid5-amide(gap-edl-4))的合成在氮气氛下向gap-edl-3(0.39g,0.61mmmol)的thf(40ml)和甲醇(8ml)溶液中加入0.080g5%的pd/c。在氮气氛下将反应混合物在室温下搅拌1小时。然后将悬浮液在硅藻土上过滤并在降低的压力下浓缩。获得呈白色固体的脱酯(de-ester)产物(0.30g,0.55mmol,产率89.7%)。1h-nmr(300mhz,cdcl3):7.19(d,j=8.7hz,1h),6.69(dd,j=8.6hz,2.7hz,1h),6.61(d,j=2.6hz,1h),6.49(br,1h),5.64-5.66(m,1h),4.26(q,j=6.6hz1h),4.02(t,j=5.1hz,2h),3.73(t,j=8.4hz,1h),3.62-3.70(m,2h),2.81-2.86(m,2h),2.38-2.60(m,2h),2.26-2.36(m,1h),2.06-2.22(m,3h),1.82-2.04(m,3h),1.64-1.76(m,1h),1.17-1.55(m,16h),0.77(s,3h)。lc-ms:针对c30h44n2o7计算,544.3;发现[m+h]为545.2。光谱示于图5中。(5)5-n-[氨基-3-乙氧基雌二醇]-n-叔-丁基羰基-谷氨二酰基-1,5-二-叔丁基-l-谷氨酸五肽酯(5-n-[amino-3-ethoxyestradiol]-n-tert-butoxycarbonyl-glutamoyl-1,5-di-t-butyl-l-glutamatepentapeptideester(gap-edl-5))的合成将gap-edl-4(0.580g,1.06mmol)、1-羟基苯并三唑(0.146g,1.08moml)和bop(0.470g,1.06mmol)溶解在无水dmf(10ml)中。在氮气氛下将混合物搅拌,使温度冷却至0℃。然后加入n,n-二异丙基乙胺(dipea,0.140g,1.08mmol)和1,5-二-叔丁基-l-谷氨酸五肽酯(gap酯,1.260g,1.06mmmol)(中国浙江省杭州市的浙江鸿拓生物技术有限公司)将反应混合物在50℃继续搅拌16-18小时,并用tlc进行监控。当tlc分析显示反应完成时,在降低的压力下去除dmf并添加dcm(250ml)。将有机相用饱和氯化钠溶液(200ml)进行清洗,在硫酸镁上干燥、过滤并在降低的压力下进行浓缩。通过采用梯度dcm和dcm/meoh(100:0-100:1)洗脱的硅凝胶填充柱纯化粗化合物,以提供呈泡沫状白色固体的gap-edl-5(0.96g,0.56mmol,产率52.8%)。1h-nmr(300mhz,dmso+d2o):7.80-8.20(m,7h),7.12(d,j=8.6hz,1h),7.03(brs,1h),6.64(d,j=8.6hz,1h),6.58(s,1h),4.04-4.28(m,6h),3.77-3.93(m,3h),3.45-3.54(m,1h),3.30-3.44(m,2h),2.66-2.78(m,2h),2.00-2.32(m,16h),1.50-2.00(m18h),1.35(s,72h),1.05-1.28(m,7h),0.63(s,3h)。光谱示于图6中。为了确定gap-edl-5的结构,对1,5-二-叔丁基-l-谷氨酸五肽酯(gap酯)进行了质子nmr(核磁共振波谱法)(示于图7中)。将gap-edl-5的质子nmr与gap酯进行了比较(分别详见图8、图7)。发现在gap-edl-5中7ppm处有化学位移,但在gap酯中未发现。该化学位移为来自gap-edl-5的芳族质子。(6)5-n-[氨基-3-乙氧基雌二醇]-谷氨二酰基-l-谷氨酸五肽(gap-edl)在氮气氛下于0-5℃将gap-edl-5(0.560g,0.327mmol)溶解于无水dcm(11ml)中。加入三氟乙酸(2.8ml,37.702mmol)。将混合物在室温下搅拌16-18小时。在降低的压力下去除溶剂并用乙醚清洗残留物以得到粗产物。采用梯度洗脱va:vb=95:5-70:30(a相:0.1%的tfa水溶液;b相:0.1%的在乙腈中的tfa)通过制备型高效液相色谱(prep-hplc)进行纯化。在冻干后,得到呈白色固体的gap-edl(0.214g,0.176mmol,产率53.7%)。1h-nmr(300mhz,dmso+d2o):7.12(d,j=8.6hz,1h),6.64(d,j=8.6hz,1h),6.57(s,1h),4.10-4.26(m,6h),3.85-3.94(m,2h),3.76-3.80(m,1h),3.47-3.53(m,1h),3.32-3.41(m,2h),2.66-2.76(m,2h),2.00-2.34(m,16h),1.48-1.98(m,18h),1.00-1.40(m,7h),0.61(s,3h);lc-ms:针对c55h78n8o23计算,1218.5;发现[m+h]为1219.7。质子nmr和质谱示于图9、图10(c55h78n8o23,1218.5;发现[m+h]为1219.7)中。为了确定gap-edl的结构,将gap-edl-4(单体)的质子nmr与gap-del进行了比较(图11、图12)。发现在gap-edl-4和gap-edl中7ppm处都有来自芳族质子的化学位移。高效液相色谱(hplc)分析表明gap-edl和gap-edl-4具有不同的吸收(210nm对239nm)和保留时间(图13、图14)。(7)68ga-gap-edl的合成68gacl3得自由hcl(范围为0.01n-1n)洗脱的68ge/68ga发生装置。例如,68gacl3从68ge/68ga发生装置采用0.3n和0.6n的hcl(10ml)洗脱。在第二天,洗脱体积(0.3n或0.6n的hcl,6ml)被分配在12管中(0.5ml/管)。每个管计算其放射性。将在4和6之间部分中的最高活性进行组合。在连续的循环中,采用6mlhcl再次洗脱发生装置并根据前面的洗脱情况在这些特定的部分收集。将一小份68gacl3(在0.6nhcl中,0.5ml,6.70mci)加入至gap-edl(0.1mg)于0.8mlnaoac(2.5m)的溶液中,且ph值为4-5。将溶液在70℃加热10分钟。冷却后,通过用盐水洗脱的itlc(聚酰胺-6-层片材,cat.30149864,中国上海国药化学试剂公司),美国密苏里州圣路易斯的奥德里奇-西格玛公司)测定放射化学纯度。放射化学纯度为100%,其中rf值为0.01。在相同的itlc条件下,68ga和68ga-gap的rf值都大于68ga-gap-edl的(分别示于图15、图16、图17)。(8)体外细胞摄取实验在乳腺肿瘤细胞中进行了68ga-gap-edl的体外细胞摄取实验。采用了具有高(mcf7)和低(sk-br-3)雌激素受体浓度的乳腺癌细胞系来确定对细胞摄取分析的敏感性和特异性。简要地,对于敏感性分析,乳腺肿瘤细胞(50000个细胞/孔,12孔)添加有68gacl3、68ga-gap和68ga-gap-edl(4μci/80μl/孔,4μg/孔)。将所述孔温育0.5-2小时。为了证明68ga-gap-edl的细胞摄取是经由er-介导的过程(特异性分析),乳腺肿瘤细胞(50000个细胞/孔)用0、15、150、300μmol/l的冷雌素酮(在dmso中)处理30分钟,随后添加68ga-gap-edl(4μg/孔,4μci/孔)并温育达90分钟。温育后,收集细胞上清液。用冰冷pbs(1ml)作为清洗液清洗细胞后收集清洗液与细胞上清液合并为a管,细胞培养孔中加入胰蛋白酶-edta(0.1ml/孔)消化细胞。两分钟后,收集细胞。每孔用冷pbs(0.5ml)清洗两次和收集的细胞合并为b管。分别测定a管和b管的放射性计数。每个数据代表三次测量的平均值。计算摄取百分比(%)=b管放射性计数/(a管放射性计数+b管放射性计数)×100%。在敏感性分析中,在乳腺癌细胞摄取方面,相比68gacl3和68ga–gap的摄取,68ga-gap-edl的摄取有显著提高(如表1)。所述改进的合成方法制备纯的gap-edl并在细胞摄取研究中具有大大增强的敏感性。所述改进的合成方法的68ga-gap-edl的平均细胞摄取(如表1)至少为先前报道的合成方法(takahashin等人,academicradiology,2007)的5倍高。较高的er(+)密度mcf-7相比较低的er(+)skbr-3具有更多的摄取。在特异性分析中,细胞摄取可能被雌素酮竞争性抑制,特别是在15、150、300μmol/l处。再有,尤其在15μmol/l的雌素酮处,相比于较低的er(+)skbr-3,mcf-7具有更加降低的摄取(如表2)。降低的摄取证明了68ga-gap-edl的细胞摄取经由er-介导的过程。表1.体外细胞摄取实验(三个测量结果的平均值)表2.体外细胞摄取特异性实验(三个测量结果的平均值)雌素酮(umol/l)mcf-7sk-br-3014.78±3.109.38±1.95157.96±2.098.55±3.551502.95±0.562.68±1.003002.95±0.432.84±1.00上述实施例不以任何方式限制本发明,凡是采用等同替换或等效变换的方式获得的技术方案均落在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1