一种虎杖苷在制备治疗及延缓椎间盘退行性病变药物中的应用的制作方法
本发明涉及一种虎杖苷的应用,特别涉及虎杖苷用于制备治疗及延缓椎间盘退变药物中的应用。
背景技术:
腰痛及其相关疾病是临床的常见病和多发病,因其长期慢性的、进行性加重的腰腿部疼痛症状,不仅给患者带来巨大的痛苦,严重影响其生活质量及生存能力,还对社会和家庭造成了沉重的经济负担。椎间盘退变(intervertebral disc degeneration,IVDD)是腰腿痛的最主要始动因素,研究表明40%以上的腰腿痛由椎间盘退变引起。然而,目前临床上尚无针对椎间盘退变的治疗药物。
椎间盘由髓核,纤维环和软骨终板组成。椎间盘退变是一种多因素过程,其中炎症是椎间盘退变最重要的致病机制之一,由炎症因子介导的髓核细胞过度凋亡被认为是椎间盘退变进程中重要的一环。因此,近年来针对炎症诱导的髓核细胞凋亡的研究已成为治疗椎间盘退变的重要途径,其相关的生物分子治疗方法也受到了广泛关注,以期从根本上解决椎间盘退变的问题
前期大量研究表明,白藜芦醇是一种有益的天然抗炎物质,能在人椎间盘细胞体外培养模型中显著降低炎症因子水平,并具有抗基质分解代谢等功能。然而,由于其快速清除率和较差的口服生物利用度,白藜芦醇被认为无法在体内产生理想的药理学作用。因此,目前急需一种可以代替白藜芦醇的类似物质。虎杖苷(Polydatin,PD,一种白藜芦醇的前体物质)是从虎杖中提取的天然单晶成分,并且在红葡萄酒,葡萄和可可等日常营养物中广泛存在。与白藜芦醇结构相似,虎杖苷亦具有抗氧化,抗炎和抗肿瘤等多种药理特性。然而,虎杖苷对椎间盘退变疾病是否具有治疗作用尚不清楚。
技术实现要素:
本发明目的是提供一种虎杖苷在制备用于治疗抑制椎间盘炎症的药物中的应用,所述药物用于治疗及延缓椎间盘退行性病变。相比西药较大的副作用,虎杖苷作为一种中药,可以更加温和地缓解椎间盘退变。。
本发明采用的技术方案是:
本发明提供一种虎杖苷在制备用于治疗抑制椎间盘炎症的药物中的应用,所述虎杖苷分子结构式为式(I)所示:
进一步,所述药物用于治疗及延缓椎间盘退行性病变。
进一步,所述药物还包括药用载体,所述药用载体选自微乳和纳米脂质体。
进一步,所述药物的剂型为片剂、乳剂或胶囊。
进一步,所述药用载体为油酸乙酯微乳时,所述药物中虎杖苷的含量为0.213g/g;所述药用载体为纳米脂质体时,所述药物中虎杖苷的含量为4mg/kg。所述虎杖苷的用量为50mg/kg体重。
与现有技术相比,本发明有益效果主要体现在:虎杖苷作为一种具有良好的生物活性的植物提取物,其在抑制椎间盘炎症方面的功效尚未得到验证。虎杖苷具有毒性低,抗炎效果明显的特点。同时,相比西药,虎杖苷作为一种中药,其抗炎作用比较缓和;相比白藜芦醇,虎杖苷又能在椎间盘退变体内模型中发挥治疗作用,具有更佳的生物利用度,可以为椎间盘退变疾病的综合治疗提供一种替代治疗药物。
附图说明:
图1为虎杖苷的CCK8药物毒性试验对照图(A为细胞活性图)和不同药物浓度下虎杖苷抗炎效果试验的对照图(B为细胞活性图)。
图2为虎杖苷作用后,凋亡相关蛋白印迹试验的对照图(A为免疫印迹条带图,B,C为各蛋白的定量图)和Tunel法检测细胞凋亡试验的对照图(D为荧光染色图,E为定量统计图)。
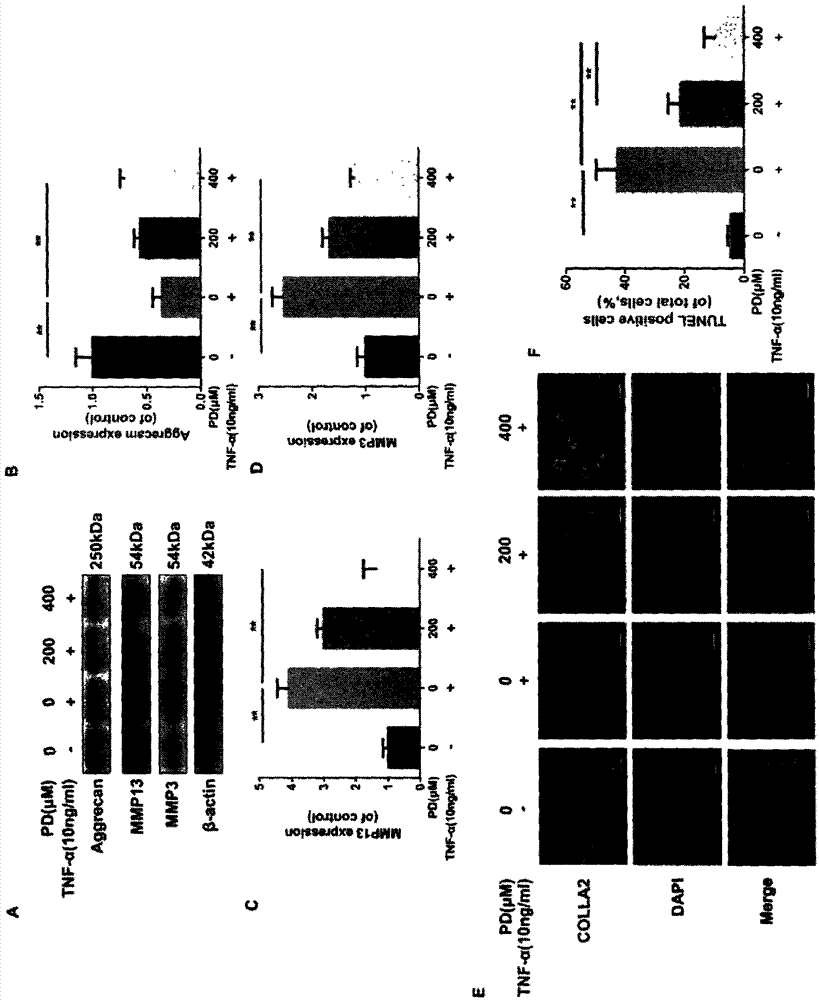
图3为虎杖苷作用后,细胞外基质合成/分解相关蛋白印迹试验的对照图(A为免疫印迹条带图,B,C,D为各蛋白的定量图)和免疫荧光检测II型胶原水平的试验对照图(E为荧光染色图,F为定量统计图)。
图4为虎杖苷作用后,MitoTracker探针检测线粒体膜电位的试验对照图(A为MitoTracker染色图,B为定量统计图)和细胞内ATP含量检测的试验对照图(C)。
图5为虎杖苷作用后,线粒体功能相关蛋白印迹试验的对照图(A为免疫印迹条带图,B,C,D,E为各蛋白的定量图),免疫荧光检测NIX与LC3共定位情况的试验对照图(F为荧光染色图,G为共定位点的定量统计图)和LC3蛋白印迹试验的对照图(H为免疫印迹条带图,I为LC3-II与LC3-I灰度值比值的定量统计图)。
图6为损伤后第4周大鼠尾椎磁共振T2像对照图(A),priffmann分级评分对照图(B),阿利新蓝染色试验对照图(C)和组织免疫荧光检测cleaved caspase-3水平的试验对照图(D为荧光染色图,E为定量统计图)。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1
1、实验步骤:
(1)取4周龄成年SD大鼠尾巴,去皮。用无菌器械切开椎间隙并且用无菌镊子去除髓核,放在PBS中保存。每条尾巴约取7个节段的髓核,一共取3条。先用无菌PBS将髓核洗2次,除去杂质与血迹。再用无菌器械将其剪碎成1mm×1mm×1mm大小,转移到15ml离心管。再次用无菌的PBS洗一次,离心。弃去上清液,往髓核碎片内加入0.2%II型胶原酶(Vetec)20ml,放置在37℃细胞培养箱内消化5个小时,每隔1小时摇晃试管一次,以便充分消化。随后离心,用10ml的PBS清洗髓核细胞一遍。再离心,加入含体积浓度15%FBS的DMEM/F12培养基混悬细胞,接种到2个底面积为25cm2的培养瓶内。7天后可见髓核细胞基本贴壁,即可更换培养基。随后2-3天换一次培养基。DMEM/F12培养基组成为84%的DMEM/F12基础培养基(GIBCO)+15%的FBS(Hyclone)+1%的青霉素链霉素混合液(索莱宝)。
(2)CCK8法测定药物细胞毒性以及药物抗炎效果:取选取步骤(1)中前3代髓核细胞以5~6×103个/孔的量播种在96孔板内,待其贴壁后,分成组1至组7共7个组,其中组1为对照组(以100μL基础培养基为对照),组2添加用基础培养基配制的虎杖苷100μL(虎杖苷添加量为50μM),组3添加用基础培养基配制的虎杖苷100μL(虎杖苷添加量为100μM),组4添加用基础培养基配制的虎杖苷μL(虎杖苷添加量为200μM),组5添加用基础培养基配制的虎杖苷100μL(虎杖苷添加量为400μM),组6添加用基础培养基配制的虎杖苷100μL(虎杖苷添加量为600μM),组7添加用基础培养基配制的虎杖苷100μL(虎杖苷添加量为800μM)。培养24h后在每孔加入用DMEM/F12基础培养基配置(基础培养基:CCK8工作液=9∶1)的CCK8(DOJINDO)工作稀释液100μL。在37℃培养箱内孵育2h,其各孔吸光度由酶标仪测得。
(3)取部分步骤(1)的髓核细胞,制成细胞悬液,调整细胞密度为2×105个/mL,接种细胞到6孔板内,每孔1ml,放入37℃,5%CO2培养箱培养过夜,待细胞密度达80%,换成基础培养基培养18h使细胞同步化。取出6孔板,放在超净工作台上,吸尽培养液,进一步分成4组,组1加入100%的基础培养基作为对照组,组2加入用基础培养基配置的10ng/ml的TNF-α体外模拟椎间盘退变,组3添加用基础培养基配制的10ng/ml TNF-α+7.81×10-5mg/ml虎杖苷(虎杖苷添加量为200μM),组4添加用基础培养基配制的10ng/ml TNF-α+1.56×10-4mg/ml虎杖苷(虎杖苷添加量为400μM)。作用24小时后,用RIPA法提取全细胞蛋白进行后续Western blot,以检测髓核细胞在炎症刺激和虎杖苷作用下其细胞内具有代表性的凋亡相关蛋白、细胞外基质合成/分解相关蛋白、线粒体功能相关蛋白等的表达变化情况。
Western blot步骤:用BCA法测定上述蛋白的浓度,根据测定结果取适量上清加入5×Loading buffer与水,使蛋白量定量为30μg/20μL,且5×Loading buffer稀释至1×,并以100℃加热10min使蛋白变性。在SDS-PAGE凝胶的每个孔内加入20μl变性后的蛋白液,电泳后转膜至PVDF膜,5%脱脂奶粉室温封闭2h,TBST洗涤5min×4次后,孵MCL-1抗体(1∶1000,Abcam)、cleaved capase-3抗体(1∶1000,Abcam)、Aggrecan抗体(1∶1000,Abcam)、MMP13抗体(1∶1000,Abcam)、MMP3抗体(1∶1000,Abcam)、BNIP3抗体(1∶1000,Abcam)、NIX抗体(1∶1000,Abcam)、PINK1抗体(1∶1000,Abcam)、FUNDC1抗体(1∶1000,Sigma-Aldrich)、LC3抗体(1∶1000,CST)和β-actin抗体(1∶1000,CST)作为一抗,4℃孵育过夜。次日,TBST洗涤PVDF膜5min×4次,辣根过氧化酶标记的二抗(二抗:TBST=1:1000,Bioworld)室温孵育2h,TBST洗涤5min×4次,ECL系统显影。β-actin作为内参,Image Iab 3.0采集条带灰度值,取目的条带吸光度与内参条带比值作为相对表达量。
(4)细胞免疫荧光:将步骤(1)得到的髓核细胞播种于6孔板玻片,分组同步骤(3),通过细胞免疫荧光检测各组collagen II、LC3、NIX等蛋白的表达情况。用PBS洗涤5分钟×3次,再用4%多聚甲醛固定10min。用PBS洗涤5min×3次后加入0.5%的TRITON X-100处理10min。用PBS洗涤5min×3次,再用5%的BSA封闭30min。吸干封闭液,滴加collagen II抗体(1∶100,Abcam)、LC3抗体(1∶100,CST)或NIX抗体(1∶100,Abcam),4℃过夜。次日,PBS洗涤5min×3次后,用细胞用绿色荧光二抗(1∶400,Bioworld)室温避光孵育1h。用PBS洗涤后,再用DAPI染核。再用PBS洗涤5min×3次后,滴加抗荧光淬灭剂,封片。取玻片于荧光显微镜下观察并拍摄。
(5)TUNEL法检测细胞凋亡:将步骤(1)得到的髓核细胞播种于6孔板载玻片上,分组同步骤(3),TUNEL法检测步骤按照DeadEndTM荧光测定TUNEL系统(Promega)说明书进行:用PBS洗涤5分钟×3次后,加入4%多聚甲醛浸没玻片室温固定10min。用PBS洗涤5min×3次后加入0.5%的TRITON X-100处理10min.再用PBS洗涤5min×3次,滴加平衡缓冲液,布满玻片,室温预平衡10min,用PBS洗涤5min×3次。避光滴加孵育缓冲液(内含平衡缓冲液,核苷混合物和rTdT酶),布满拨片,并在37℃孵育1小时,避免光照。弃掉孵育缓冲液,将载玻片浸入2X SSC溶液终止反应,再用PBS洗涤5min×3次。滴加DAPI核染液,反应5min,用PBS洗涤5min×3次,滴加抗荧光淬灭剂,封片。取玻片于荧光显微镜下观察并拍摄。
(6)其他线粒体指标检测:将步骤(1)得到的髓核细胞播种于6孔板载玻片上,分组同步骤(3),用胞内ATP含量检测线粒体膜通透性、MitoTracker检测线粒体膜电位变化。线粒体膜电位检测步骤按照MitoTrackerred CMXRos(Thermo Fisher Scientific Inc)说明书操作进行:用PBS洗涤5分钟×3次后,避光加入预先用基础培养基稀释至200nM的MitoTracker red染液,每孔1ml,在37℃避光孵育30min,再加入HoChest核染液每孔100μL,继续在37℃避光孵育20min。用PBS洗涤5分钟×3次,加抗荧光淬灭剂,封片。取玻片于荧光显微镜下观察并拍摄。
(7)体内实验造模方法:取4周龄SD大鼠(约200-220g),10%水合氯醛麻醉后(3.5ml/kg),碘伏消毒,取大鼠7、8节尾椎(Co7/8),27g穿刺针刺入,刺入长度为4mm,刺入后旋转360°并留置1min后拔出,即获得大鼠尾椎椎间盘退变模型。
将21只SD大鼠随机分成3组:组1(载体对照组,图6A中Vehicle),组2(单纯椎间盘退变组,图6A中IVDD),组3(椎间盘退变后虎杖苷治疗组,图6A中虎杖苷),造模成功后组3每天行虎杖苷(用0.5%CMC溶液配制)50mg/kg/d灌胃治疗,组1、组2每天予等体积的0.5%CMC溶液灌胃。
分别在损伤后第2及第4周,以大鼠7、8节尾椎为中心,包括与其相邻的椎间盘,进行大鼠尾椎磁共振检测,比较正常椎间盘与退变椎间盘磁共振信号的差异。磁共振检测完成后,处死全部大鼠,获取鼠尾,将新鲜的椎间盘组织用4%多聚甲醛固定,10%EDTA溶液脱钙,石蜡包埋后切片,切片厚5μm,用于后续阿利新蓝和组织免疫荧光染色。
阿利新蓝(Sigma)染色步骤:石蜡切片置二甲苯脱蜡,梯度乙醇水化,入去离子水再水化,1%阿利新蓝染液(以3%冰醋酸为溶剂)37℃染色30min,流水冲洗5min,然后用0.1%核固红染液(以5%硫酸铝溶液为溶剂)室温染色10min,流水冲洗1min后,梯度乙醇脱水,二甲苯透明,中性树脂封片后,显微镜下观察细胞外基质中蛋白聚糖变化(阿利新蓝染液可以将蛋白聚糖染成蓝色)。
组织免疫荧光染色:石蜡切片置二甲苯脱蜡,梯度乙醇水化,入去离子水再水化,3%双氧水室温孵育10min灭活内源性酶,用PBS洗涤5分钟×3次,再用胰蛋酶37℃孵育30min修复抗原,用PBS洗涤5分钟×3次,然后10%山羊血清室温下封闭60min,滴加用PBS 1∶100稀释的cleaved capase-3抗体、BNIP3抗体或LC3抗体(均购自Abcam),4℃孵育过夜。次日,置37℃复温30min,PBS洗涤3次后,用1∶400稀释的带Alexa标签的绿色荧光二抗(Jackson ImmunoResearch)室温避光孵育1h。用PBS洗涤后,再用DAPI染液(碧云天)染核5min。再用PBS洗涤5min×3次后,滴加抗荧光淬灭剂,封片,于荧光显微镜下观察并拍摄。
2、实验结果:
(1)我们收集临床上由于症状强烈而影像学情况较轻的,希望通过手术缓解症状的患者的髓核进行培养。选取前3代髓核细胞,用含不同浓度虎杖苷(0,1,100,200,400,600,800μM)的培养基进行培养,通过CCK8试验检测细胞活性,我们确定了虎杖苷对髓核细胞的安全浓度为400μM(图1A)。因此,0、200、400μM的虎杖苷浓度被用于我们的后续实验。此外,我们用10ng/ml的TNF-α体外模拟椎间盘退变,同时再加入不同浓度的虎杖苷(0,1,100,200,300,400μM),通过CCK8试验检测细胞活性,发现虎杖苷能够以剂量依赖的方式显著改善TNF-α导致的髓核细胞活性下降(图1B)。
(2)接下来我们通过蛋白质印迹法确定虎杖苷对凋亡标记物cleaved caspase-3和抗凋亡标记物MCL-1的影响,结果显示虎杖苷(0,200,400μM)可以剂量依赖性的方式抑制TNF-α(10ng/ml)诱导的cleaved caspase-3上调和MCL-1下调(图2A,B,C)。同时,细胞TUNEL结果显示,虎杖苷作用下TNF-α诱导的髓核细胞中凋亡阳性细胞的百分比显著下降(图2D,E)。这些数据表明,虎杖苷对TNF-α作用下的髓核细胞具有显著的抗凋亡作用。
(3)为了检测髓核细胞的退变程度和虎杖苷对细胞外基质的保护作用,通过蛋白质印迹试验分析,我们发现TNF-α作用下髓核细胞中Aggrecan的水平降低,MMP3和MMP13的水平升高,提示TNF-α诱导了髓核细胞的体外退变,并使细胞外基质的分解增多,而虎杖苷的施用却能部分逆转TNF-α的这种作用(图3A,3B,3C和3D)。同样地,细胞免疫荧光结果显示了TNF-α诱导的II型胶原(collagen II)水平降低,而虎杖苷则能以剂量依赖性方式抑制髓核细胞中II型胶原的丧失(图3E和3F)。
(4)以线粒体膜电位(MMP)降低和细胞内ATP生成减少作为线粒体功能障碍的两个指标,我们进一步观察虎杖苷能否预防TNF-α诱导的髓核细胞线粒体功能障碍。如图4A和4B所示,TNF-α处理组的髓核细胞中MitoTracker Green(一种线粒体膜电位依赖性探针)的荧光强度相对于未处理组显著下降,而用虎杖苷预处理24小时能够明显抑制TNF-α诱导的膜电位荧光强度损失。在细胞内ATP水平方面,我们发现TNF-α暴露降低细胞内ATP水平,且TNF-α的这种作用能被虎杖苷预处理24小时显著逆转,提示了虎杖苷对线粒体的类似保护作用(图4C)。
(5)通过进一步蛋白印记和细胞免疫荧光试验分析,我们发现虎杖苷可以促进髓核细胞中BNIP3-/NIX-依赖性的线粒体自噬。如图5A,5B,5C,5D和5E所示,虎杖苷处理24h不能促进PINK1和FUNDC1的水平,但能以剂量依赖性方式上调NIX和BNIP3的表达。类似地,虎杖苷以剂量依赖性方式增加微管相关蛋白1轻链3(LC3)的水平,表明虎杖苷促进了髓核细胞中自噬体的产生(图5H和5I)。此外,免疫荧光分析发现,TNF-α和虎杖苷分别不同程度地促进了LC3和NIX的共定位,且与单纯TNF-α组或单纯虎杖苷组相比,TNF-α+虎杖苷组中出现了更多的共定位点(图5F和5G)。数据表明虎杖苷可以促进髓核细胞中BNIP3-/NIX-依赖性的线粒体自噬。
(6)使用SD大鼠建立椎间盘退变模型进行体内实验,单纯椎间盘退变组(图6A中IVDD)的磁共振T2加权像显示,退变的椎间盘呈现明显的低信号。而虎杖苷治疗后(图6A中PD),椎间盘的信号相对于单纯椎间盘退变组(图6A中IVDD)有明显的提升,同时虎杖苷治疗组(图6B中PD)的Pfirrmann等级评分(IVDD评估方法)也比单纯椎间盘退变组(图6B中IVDD)显著降低,证明了虎杖苷能显著延缓椎间盘退变的程度(图6A,B)。进一步使用对蛋白多糖和透明质酸敏感的阿利新蓝染色来评估大鼠椎间盘的形态和细胞外基质产生的程度,发现退变后,椎间盘的组织结构紊乱,髓核细胞分布零散,混乱,纤维环排列紊乱,细胞外基质胶原流失严重(图6C中IVDD)。而虎杖苷治疗后的模型动物的椎间盘,组织结构更加接近正常,髓核细胞分布相对规则,纤维环结构仍相对完整,细胞外基质保留更多(图6C中PD)。另外,我们研究了椎间盘中cleaved capase-3蛋白的表达,以评估虎杖苷对髓核细胞凋亡的影响。组织免疫荧光和相应定量图像显示虎杖苷可以抑制大鼠椎间盘中cleaved capase-3蛋白的水平(图6D和6E),提示虎杖苷治疗可以显著抑制髓核细胞凋亡。因此,虎杖苷能够在体外和体内实验中显著改善IVDD的进程。
- 还没有人留言评论。精彩留言会获得点赞!