一种可注射的舒尼替尼纳米颗粒的制备方法与流程
本发明属于药物制备领域,特别涉及一种舒尼替尼纳米药物颗粒的制备方法。
背景技术:
舒尼替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,能够阻断血管内皮生长因子受体(vegfr-1、vegfr-2和vegfr-3)、血小板衍生生长因子受体(pdgfr-α和pdgfr-β)、干细胞因子受体(c-kitr)、fms样酪氨酸激酶-3(fms-liketyrosinekinase-3,flt-3)、ι型集落刺激因子受体(colony-stimulatingfactor,csf-1r)和神经胶质细胞系衍生的神经营养因子受体等的功能,具有很强的抑制肿瘤细胞增殖和抗血管生成的双重作用。舒尼替尼分子式为c22h27fn4o2,其结构如下:
纳米医药技术是制药行业的一项新兴技术,是目前药物研究的一个热点。在纳米尺度下,药物和药物载体会表现出新的特性。将水溶性差的药物制备成纳米颗粒,可以增加颗粒的比表面积,提高其溶解性,还可以降低助溶剂的用量,提高其载药量。纳米药物载体可以实现组织的靶向给药,借助纳米载体将药物定位于病变组织,可以达到药剂用量少和药物利用率高的效果,从而减少药物的副作用。
两亲性二嵌段(亲水-疏水)或三嵌段(疏水-亲水-疏水)共聚物最常作为药物表面修饰剂来制备可静脉注射给药的药物纳米颗粒。作为药物的表面修饰剂,共聚物的每个单聚体应该是生物可降解的,相对分子质量应足够小(<40000)以便被肾脏清除,从而避免聚合物在体内蓄积引发潜在的毒性。采用物理包载法,聚合物的疏水性嵌段包载在疏水性药物上,亲水嵌段会分布在药物周围,与周围的水分子间形成氢键而向水中舒展,形成有一定厚度的壳层。亲水段彼此之间的排斥作用可以保证药物纳米颗粒在一定浓度范围内稳定存在。最常用于形成亲水嵌段是fda批准的辅料聚乙二醇(polyethyleneglycol,peg)或聚氧乙烯(polyethyleneoxide,peo)。peg/peo嵌段的分子量通常在1~15000。除了已被fda批准外,peg水溶性非常好,而且排除体积大,这使它能防止纳米颗粒相互作用而聚集。而用于形成疏水嵌段是聚乳酸(poly(d,l)lactide,pdlla)由于具有良好的生物相容性,可降解性,其最终降解产物为二氧化碳和水,有机体正常的新陈代谢排除体外,因此被广泛应用于手术缝合线、烧伤覆盖物、骨折内固定材料以及用于合成嵌段共聚物。
技术实现要素:
本发明的目的是建立一种舒尼替尼纳米药物颗粒的制备方法,该方法具有工艺简单、操作安全、节能、成本低、在生产中易于实现等优点。不仅可以实现对舒尼替尼药物的高效纳米化,还能提高舒尼替尼在体内的生物利用度。
为实现上述目的,本发明采用的技术方案为一种制备舒尼替尼纳米药物颗粒的方法,该方法的实施步骤包括如下,
s1将适量的舒尼替尼在室温下溶解于二甲基亚砜(dmso)中,配制成浓度为20mg/ml的药物溶液;
s2提供舒尼替尼的表面修饰剂聚乳酸-聚乙二醇-聚乳酸即pdlla-peg-pdlla;
s3将适量的s2中的聚乳酸-聚乙二醇-聚乳酸在室温下溶解于磷酸缓冲盐溶液作为反溶剂,配制得到的反溶剂中聚乳酸-聚乙二醇-聚乳酸的浓度为10-50mg/ml;
s4按照药物溶液与反溶剂体积比1/20的比例,将s1中的药物溶液加入到s3中的反溶剂中充分混合搅拌反应,从而通过反溶剂沉淀结晶的方法使舒尼替尼重结晶出来,在舒尼替尼重结晶的过程中聚乳酸-聚乙二醇-聚乳酸会包载在舒尼替尼药物上,在舒尼替尼药物周围形成一层聚合物壳层,从而得到舒尼替尼药物纳米颗粒悬浮液;
s5收集s4中制得的舒尼替尼药物纳米颗粒悬浮液,经过透析、冷冻干燥得到舒尼替尼药物纳米颗粒。
磷酸缓冲盐溶液为150mm,ph7.4。
pdlla-peg-pdlla的分子结构如下:
peg的分子量范围是4-20kda。
步骤s3所述的反溶剂中聚乳酸-聚乙二醇-聚乳酸的浓度为50mg/ml。
舒尼替尼的表面修饰剂pdlla-peg-pdlla是通过如下步骤合成的:
s1.1将聚乙二醇和d、l-丙交酯按质量比3:1加入到圆底烧瓶中,将圆底烧瓶置于油浴中加热至110℃并保持圆底烧瓶中真空6h除去反应物中的水分,用电磁搅拌器搅拌;
s1.2向圆底烧瓶中通入氩气排出氧气,在氩气氛围保护下加入一定质量的催化剂辛酸亚锡到圆底烧瓶中,待搅拌均匀后,将圆底烧瓶升温至135℃反应聚合24h,制得产物;
s1.3收集s1.2中的产物,用二氯甲烷溶解后,加入正戊烷作为沉淀剂进行纯化,以除去未反应的单体和催化剂;
s1.4收集s1.3中的产物,抽滤后真空干燥至恒重,即得到pdlla-peg-pdlla三嵌段共聚物。反溶剂为包含表面修饰剂pdlla-peg-pdlla的磷酸缓冲盐溶液时,pdlla-peg-pdlla和舒尼替尼的质量比分别为50/1、20/1、10/1。
将舒尼替尼溶解于二甲基亚砜配制得到的药物溶液和反溶剂的体积比是1/20。
由该制备方法制得的舒尼替尼药物纳米颗粒,舒尼替尼(1)的表面有一层嵌段聚合物载体(2);嵌段聚合物的疏水段pdlla中丙交酯单元的数目范围是20-60;舒尼替尼纳米药物颗粒的平均粒径在200nm~500nm,分散性好;溶出速率和溶出度大。
与现有技术相比,本发明具有如下有益效果。
采用本发明的方法,可通过改变表面修饰剂的用量及表面修饰剂与舒尼替尼的质量比,能够得到平均粒径较小、分散均匀、溶出速率较快和溶出度较大等性能更优的舒尼替尼纳米药物颗粒。
该药物颗粒的结构式舒尼替尼的表面有一层聚合物载体;舒尼替尼纳米药物颗粒的平均粒径在200nm~500nm、分散性较好,溶出速率和溶出度大。
附图说明
图1是实施例1中制得的pdlla-peg-pdlla的核磁氢谱图。
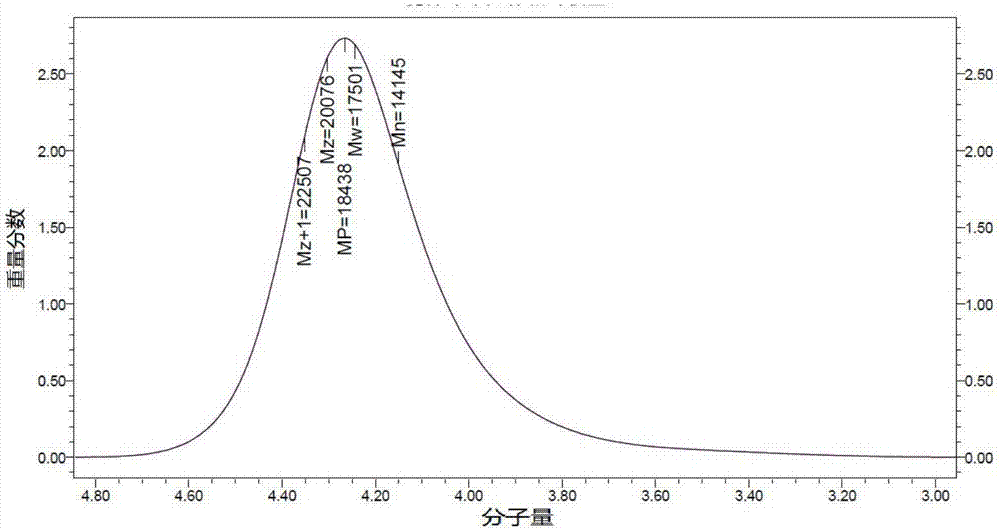
图2是实施例1中制得的pdlla-peg-pdlla的凝胶渗透色谱分子量积分分布图。
图3是实施例2中制得的舒尼替尼纳米药物颗粒的透射电镜照片。
图4是实施例3中制得的舒尼替尼纳米药物颗粒的透射电镜照片。
图5是实施例4中制得的舒尼替尼纳米药物颗粒的透射电镜照片。
图6是实施例5中制得的舒尼替尼纳米药物颗粒的透射电镜照片。
图7是实施例2、实施例3、实施例4、实施例5中制得的舒尼替尼药物颗粒溶液稳定性测试的数码照片。
图8是实施例5中制得的舒尼替尼纳米药物颗粒溶液通过dls测试测得的颗粒粒径稳定性图。
图9是实施例2、实施例3、实施例4、实施例5中制得的舒尼替尼药物颗粒在ph=7.4的磷酸缓冲盐溶液中的溶出曲线。
具体实施方式
实施例1
将30g聚乙二醇(分子量9-10kda)与10gd,l-丙交酯(分子量144da)加入到圆底烧瓶中,将圆底烧瓶置于油浴中加热至110℃并保持圆底烧瓶中真空6h除去反应物中的水分,用电磁搅拌器搅拌;然后向圆底烧瓶中通入氩气排出氧气,并在氩气保护下加入一定质量的催化剂辛酸亚锡到圆底烧瓶中,待搅拌均匀后,将圆底烧瓶升温至135℃反应聚合24小时;将反应产物用二氯甲烷全部溶解后,用正戊烷沉降,反复进行3次,对聚合物进行纯化,除去未反应的单体和催化剂;最终产品放入真空干燥箱干燥至恒重,得到pdlla-peg-pdlla三嵌段共聚物。
如图1所示,该图是pdlla-peg-pdlla的核磁氢谱图,通过积分计算得到嵌段聚合物的疏水段pdlla中丙交酯单元的数目范围是30-50。
如图2所示,该图是pdlla-peg-pdlla的凝胶渗透色谱分子量积分分布图,通过计算得到嵌段聚合物的疏水段pdlla中丙交酯单元的数目范围是40-60。
实施例2
称取10mg舒尼替尼,在室温下溶解于0.5ml二甲基亚砜中,记为药物溶液。反溶剂为磷酸缓冲盐溶液时,二甲基亚砜和反溶剂的体积比是1/20,量取10ml磷酸缓冲盐溶液(pbs,150mm,ph7.4),记为反溶剂。将药物溶液加入到反溶剂中,搅拌反应30min,记为混合液。将混合液装入透析袋(mw3500)中,用超纯水透析,4℃下避光储存,每隔2h换一次超纯水,重复三次。透析后冷冻干燥即得到舒尼替尼药物颗粒。
从图3所示的透射电镜照片中可以看出,舒尼替尼药物颗粒团聚在一起,粒径较大,没有形成规则的球形颗粒,分散性差,易团聚,粒度分布不均匀。
从图7所示的编号a的小瓶的数码照片可以看出,制备得到的舒尼替尼药物颗粒溶液稳定性差,在24h的时候就可以看出很明显的团聚。
从图9所示的溶出曲线可以看出,经过49h后,舒尼替尼药物只溶出约28%,而按照本发明所述的制备方法制得的舒尼替尼纳米颗粒的溶出速率和溶出度都比原料药的高。
实施例3
称取10mg舒尼替尼,在室温下溶解于0.5ml二甲基亚砜中,记为药物溶液。按照反溶剂中pdlla-peg-pdlla和舒尼替尼质量比是10/1,二甲基亚砜和反溶剂的体积比是1/20,将100mgpdlla-peg-pdlla充分溶解于10ml磷酸缓冲盐溶液(pbs,150mm,ph7.4),记为反溶剂。将药物溶液加入到反溶剂中,搅拌反应30min,记为混合液。将混合液装入透析袋(mw3500)中,用超纯水透析,4℃下避光储存,每隔2h换一次超纯水,重复三次。透析后冷冻干燥即得到舒尼替尼药物颗粒。
从图4所示的透射电镜照片中可以看出,聚合物和舒尼替尼药物颗粒团聚在一起,颗粒的粒径较大,没有形成规则的球形颗粒,分散性差,易团聚,粒度分布不均匀。
从图7所示的编号b的小瓶的数码照片可以看出,制备得到的舒尼替尼药物颗粒溶液稳定性较差,在48h的时候就可以看出明显的团聚。
从图9所示的溶出曲线可以看出,经过49h后,舒尼替尼药物颗粒溶出约55%。
实施例4
称取10mg舒尼替尼,在室温下溶解于0.5ml二甲基亚砜中,记为药物溶液。按照反溶剂中pdlla-peg-pdlla和舒尼替尼质量比是20/1,二甲基亚砜和反溶剂的体积比是1/20,将200mgpdlla-peg-pdlla充分溶解于10ml磷酸缓冲盐溶液(pbs,150mm,ph7.4),记为反溶剂。将药物溶液加入到反溶剂中,搅拌反应30min,记为混合液。将混合液装入透析袋(mw3500)中,用超纯水透析,4℃下避光储存,每隔2h换一次超纯水,重复三次。透析后冷冻干燥即得到舒尼替尼药物颗粒。
从图5所示的透射电镜照片中可以看出,舒尼替尼药物颗粒为平均粒径500nm、形貌较规则的球形颗粒,分散性较好,粒度分布不均匀。
从图7所示的编号c的小瓶的数码照片可以看出,制备得到的舒尼替尼药物颗粒溶液稳定性较好,在168h的时间内没有看到明显的团聚现象。
从图9所示的溶出曲线可以看出,经过49h后,舒尼替尼药颗粒溶出约60%。
实施例5
称取10mg舒尼替尼,在室温下溶解于0.5ml二甲基亚砜中,记为药物溶液。按照反溶剂中pdlla-peg-pdlla和舒尼替尼质量比是50/1,二甲基亚砜和反溶剂的体积比是1/20,将500mgpdlla-peg-pdlla充分溶解于10ml磷酸缓冲盐溶液(pbs,150mm,ph7.4),记为反溶剂。将药物溶液加入到反溶剂中,搅拌反应30min,记为混合液。将混合液装入透析袋(mw3500)中,用超纯水透析,4℃下避光储存,每隔2h换一次超纯水,重复三次。透析后冷冻干燥即得到舒尼替尼药物颗粒。
从图5所示的透射电镜照片中可以看出,舒尼替尼药物颗粒为平均粒径400nm、形貌规则的球形颗粒,分散性较好,粒度分布较均匀。
从图7所示的编号d的小瓶的数码照片可以看出,制备得到的舒尼替尼药物颗粒溶液稳定性较好,分散性好,在168h的时间内没有看到明显的团聚现象。
从图9所示的溶出曲线可以看出,经过49h后,舒尼替尼药物颗粒溶出约58%。
- 还没有人留言评论。精彩留言会获得点赞!