使用抗硬化蛋白抗体改善结缔组织附着的方法与流程
本发明根据美国国立卫生研究院(nih)授予的批准号f31-ar066452和r01-ar057836在政府支持下完成。政府拥有本发明的某些权利。
本公开涉及抗硬化蛋白抗体用于增强结缔组织-骨(connectivetissue-to-bone)愈合的用途。
电子提交材料以引用方式并入
计算机可读的核苷酸/氨基酸序列表整体以引用方式并入,该序列表与本文同时提交并如下标识:名为“50928a_seqlisting.txt”的ascii(文本)文件,806,135字节,创建于2017年8月7日。
以引用方式并入
以下申请据此整体以引用方式并入:2012年8月2日提交的国际专利申请号pct/us2012/049331,其要求2011年8月4日提交的美国临时专利申请号61/515,191的优先权;2006年4月25日提交的美国专利申请号11/410,540,其要求2006年4月17日提交的美国临时专利申请号60/792,645、2006年3月13日提交的美国临时专利申请号60/782,244、2006年2月24日提交的美国临时专利申请号60/776,847和2005年5月3日提交的美国临时专利申请号60/677,583的优先权;以及2006年4月25日提交的美国专利申请号11/411,003(作为美国专利号7,592,429颁发),其要求2006年4月17日提交的美国临时专利申请号60/792,645、2006年3月13日提交的美国临时专利申请号60/782,244、2006年2月24日提交的美国临时专利申请号60/776,847和2005年5月3日提交的美国临时专利申请号60/677,583的优先权。以下申请据此也以引用方式并入:2008年9月17日提交的美国专利申请号12/212,327,其要求2007年9月17日提交的美国临时专利申请号60/973,024的优先权;以及2010年6月29日提交的美国专利申请号12/811,171,其依照35u.s.c.§371是2008年12月15日提交的国际专利申请号pct/us08/86864的美国国家阶段申请,pct/us08/86864要求2007年12月14日提交的美国临时专利申请号61/013,917的优先权。
背景技术:
肩袖撕裂是上肢最常见的损伤之一;全层撕裂在60岁以上人群中的发生率约为25%,在80岁以上的人群中为50%[1,2]。撕裂使人衰弱且不会自发愈合,通常在损伤后的几年内变大[3]。这导致美国每年有超过250,000例肩袖手术修复。不幸的是,修复后腱-骨(tendon-to-bone)愈合不良导致再撕裂的发生率高得惊人,范围从具有小撕裂的年轻健康患者中的20%到具有大撕裂的老年患者中的94%不等[4,5]。愈合不良的特征在于愈合界面处的骨丢失以及在健康附着中发现的功能性分级矿化纤维软骨的再生的缺乏[6]。因此,存在对改善腱-骨愈合的治疗和疗法的需要。本发明满足了这种需要并提供了相关的优点。
技术实现要素:
在一个方面,本文描述了用于增强有需要的受试者中的结缔组织-骨愈合的方法,包括向受试者施用有效增强受试者中的结缔组织-骨愈合的量的抗硬化蛋白抗体。示例性结缔组织包括但不限于韧带、肌腱、半月板或盂唇。
在一些或任何实施方案中,抗硬化蛋白抗体与第二骨增强治疗剂一起施用,以用于治疗骨矿物质密度降低或骨折。许多这种类型的治疗剂在本领域中是已知的。在一些实施方案中,骨增强治疗剂选自抗再吸收药物、骨形成剂、雌激素受体拮抗剂(包括但不限于雷洛昔芬、巴多昔芬和拉索昔芬)和对破骨细胞有抑制作用的药物。在一些实施方案中,抗再吸收药物包括但不限于甲状旁腺激素、双膦酸盐(包括但不限于阿仑膦酸盐、利塞膦酸盐、伊班膦酸盐和唑来膦酸盐)、雌激素或雌激素类似物、选择性雌激素受体调节剂(serm)和钙源、替勃龙(tibolone)、降钙素、骨化三醇以及激素替代疗法。在一些实施方案中,骨增强剂包括但不限于甲状旁腺激素(pth)或其肽片段、pth相关蛋白(pthrp)、骨形态发生蛋白、成骨素、naf、pge2激动剂、他汀类、抗dkk1抗体或抑制剂、抗rank配体(rankl)抗体或rankl抑制剂、雷奈酸锶、维生素d、或维生素d衍生物或其模拟物。在一些实施方案中,骨增强剂是
具体设想了美国专利公布号20070110747中公开的抗硬化蛋白抗体(其公开内容整体以引用方式并入本文)在本文公开的任何方法中的用途或用于制备根据本文公开的任何方法施用的药物的用途。以一定的量和时间施用一个或多个剂量的抗硬化蛋白抗体,该量和时间有效增强结缔组织-骨愈合或改善受试者中结缔组织再附着手术的结果。一个或多个剂量的抗硬化蛋白抗体可包含约70mg至约300mg或约90mg至约270mg。例如,抗硬化蛋白抗体的剂量可以在至少约70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79mg、80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg、91mg、92mg、93mg、94mg、95mg、96mg、97mg、98mg、99mg、100mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、210mg、220mg、230mg、240mg、250mg、260mg、270mg、280mg或300mg的范围内。还考虑了任何和所有这些端点之间的范围,例如,约90mg至约270mg、约70mg至约210mg、约100mg至约210mg、约90mg至约250mg、约110mg至约210mg、约70mg至约300mg、或约175至约270mg。
本文还描述了使用有效量的抗硬化蛋白抗体来改善有需要的哺乳动物受试者中的结缔组织再附着手术的结果。示例性结缔组织再附着手术包括但不限于肩袖修复、跟腱修复、髌骨-髌腱修复、内侧十字韧带(mcl)重建、前十字韧带(acl)重建、尺侧副韧带(ucl)重建、半月板修复和盂唇修复。
在一些实施方案中,该手术包括移植物附着,并且将抗硬化蛋白抗体离体施用于移植物。
在本文所述的任何方法或用途中,在一些实施方案中,(例如通过皮下注射而全身施用抗硬化蛋白抗体。在其他实施方案中,将抗硬化蛋白抗体掺入到凝胶、海绵或基质中并局部植入。
在一些实施方案中,本文所述方法中使用的抗硬化蛋白抗体结合到seqidno:1的硬化蛋白,其亲和力(kd)小于或等于1x107m(或小于或等于1x108m、或小于或等于1x109m、或小于或等于1x1010m、或小于或等于1x1011m、或小于或等于1x1012m)。
在各种实施方案中,抗硬化蛋白抗体结合到包含seqidno:1中所示的氨基酸序列的硬化蛋白多肽,并且结合seqidno:6(cgparllpnaigrgkwwrpsgpdfrc;对应于seqidno:1的氨基酸86-111)的序列。另选地或除此之外,抗硬化蛋白抗体结合到包含seqidno:1中所示的氨基酸序列的硬化蛋白多肽,并且结合seqidno:1内的以下各者中至少一者的序列:seqidno:2(dvseyscrelhftr;对应于seqidno:1的氨基酸51-64)、seqidno:3(sakpvtelvcsgqcgpar;对应于seqidno:1的氨基酸73-90)、seqidno:4(wwrpsgpdfrcipdryr;对应于seqidno:1的氨基酸101-117)、seqidno:5(lvasckckrltr;对应于seqidno:1的氨基酸138-149)、seqidno:70(sakpvtelvcsgqc;对应于seqidno:1的氨基酸73-86)、seqidno:71(lvasckc;对应于seqidno:1的氨基酸138-144)、seqidno:72(crelhftr;对应于seqidno:1的氨基酸57-64)、或seqidno:73(cipdryr;对应于seqidno:1的氨基酸111-117)。例如,在一个方面,抗硬化蛋白抗体任选地以其天然三维构象结合seqidno:1的硬化蛋白的亚区域,该亚区域包含seqidno:2-5(和/或seqidno:70-73)。任选地,抗硬化蛋白抗体结合由seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:70、seqidno:71、seqidno:72或seqidno:73中的一者或多者组成的肽(例如,由seqidno:2、seqidno:3、seqidno:4和seqidno:5组成的肽,或由seqidno:70、seqidno:71、seqidno:72和seqidno:73组成的肽)。
在各个方面,在基于mc3t3细胞的矿化测定中,当每个孔的硬化蛋白结合位点的摩尔数与每个孔的硬化蛋白的摩尔数相比低于6倍过量时,抗硬化蛋白抗体能够中和人硬化蛋白。
在基于细胞的测定(诸如骨特异性碱性磷酸酶测定)中,用于中和人硬化蛋白的抗硬化蛋白抗体的ic50任选地为100nm或更低、或75nm或更低、或50nm或更低、或25nm或更低。另选地或除此之外,在hek293细胞系的基于细胞的wnt信号传导测定(诸如涉及wnt1介导的stf报告基因诱导的wnt测定)中,用于中和人硬化蛋白的抗硬化蛋白抗体的ic50为100nm或更低(例如,75nm或更低、或50nm或更低)。另选地或除此之外,在mc3t3细胞的bmp2诱导的矿化测定中,用于中和人硬化蛋白的抗硬化蛋白抗体的ic50为500nm或更低(例如,250nm或更低、150nm或更低、100nm或更低、或50nm或更低)。
在一个实施方案中,抗硬化蛋白抗体交叉阻断抗体ab-a、ab-b、ab-c、ab-d、ab-1、ab-2、ab-3、ab-4、ab-5、ab-6、ab-7、ab-8、ab-9、ab-10、ab-11、ab-12、ab-13、ab-14、ab-15、ab-16、ab-17、ab-18、ab-19、ab-20、ab-21、ab-22、ab-23和ab-24中的至少一者与硬化蛋白的结合,和/或被抗体ab-a、ab-b、ab-c、ab-d、ab-1、ab-2、ab-3、ab-4、ab-5、ab-6、ab-7、ab-8、ab-9、ab-10、ab-11、ab-12、ab-13、ab-14、ab-15、ab-16、ab-17、ab-18、ab-19、ab-20、ab-21、ab-22、ab-23和ab-24中的至少一者交叉阻断与硬化蛋白的结合。
在一些实施方案中,抗硬化蛋白抗体包含seqidno:245的cdr-h1、seqidno:246的cdr-h2、seqidno:247的cdr-h3、seqidno:78的cdr-l1、seqidno:79的cdr-l2和seqidno:80的cdr-l3。
在一个实施方案中,抗硬化蛋白抗体包含重链和轻链,该重链包含seqidno:378,该轻链包含seqidno:376。在另一个实施方案中,抗硬化蛋白抗体具有seqidno:145或seqidno:392的重链和seqidno:141的轻链。
在另一个实施方案中,抗硬化蛋白抗体包含国际专利公布号wo2008/115732的seqidno:20-25的cdr(seqidno:416-421)、国际专利公布号wo2008/115732的seqidno:26-31的cdr(seqidno:422-427)、国际专利公布号wo2008/115732的seqidno:32-37的cdr(seqidno:428-433)、或国际专利公布号wo2009/047356的seqidno:4、15、26、37、48和59的cdr(分别为seqidno:443、454、465、476、487和498)。在又一个实施方案中,抗硬化蛋白抗体包含国际专利公布号wo2010/130830的seqidno:135-143、153-161或171-179中的至少一者的氨基酸序列(分别为seqidno:745-753、763-771、781-789)。
在一些实施方案中,将抗硬化蛋白抗体在ph5.2下配制成包含55mm乙酸盐、13mm钙、6.0%(w/v)蔗糖、0.006%(w/v)聚山梨醇酯20的药物组合物。在一些实施方案中,该药物组合物包含90mg/ml的抗硬化蛋白抗体。
本文使用的章节标题仅用于组织性目的,而不应解释为限制所述的主题。在本说明书正文中引用的所有参考文献整体以引用方式明确并入。
可将标准技术用于重组dna、寡核苷酸合成、组织培养与转化、蛋白纯化等。酶促反应和纯化技术可根据制造商的技术规范或如本领域常规实行或如本文所述的那样进行。以下程序和技术通常可以根据本领域熟知的常规方法并如在整个说明书中引用和讨论的各种一般和更具体的参考文献中所述的那样进行。参见例如sambrook等人,2001,molecularcloning:alaboratorymanuel,第3版,coldspringharborlaboratorypress,coldspringharbor,n.y.,该文献以引用方式并入本文以用于所有目的。除非提供明确的定义,否则本文所述的与分析化学、有机化学和医药化学相关地使用的术语以及实验室程序和技术是本领域熟知和常用的那些。可使用标准技术进行化学合成、化学分析、药物制备、配制以及向患者的递送和患者的治疗。
附图说明
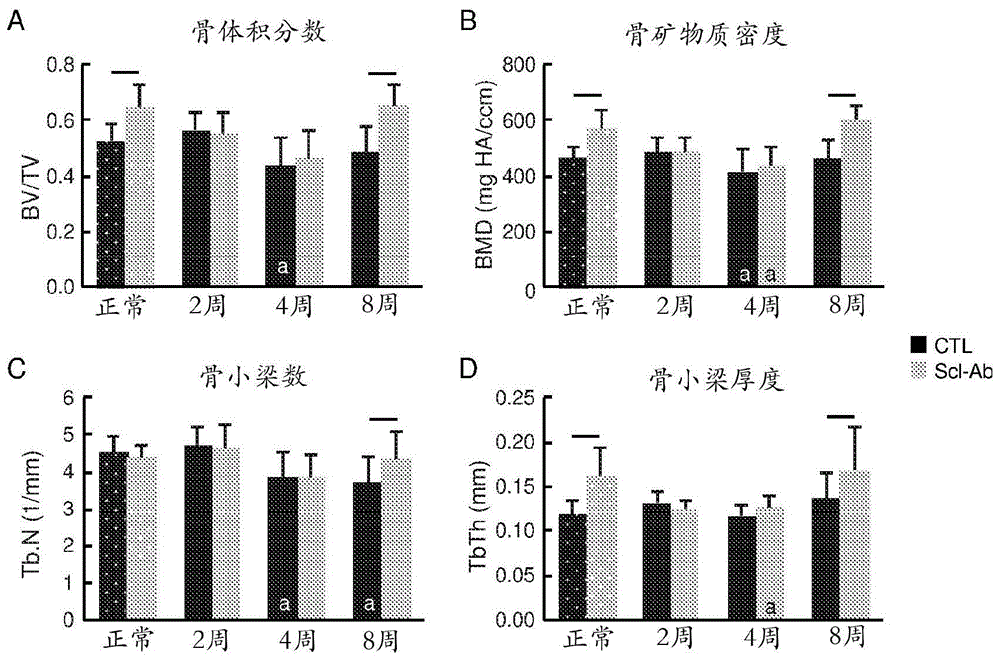
图1a至图1d显示,在肩袖动物模型中,用scl-ab治疗增加了正常(未损伤)组和8周愈合组中腱-骨插入部位周围区域的骨量指数:(图1a)骨体积/总体积(bv/tv)、(图1b)骨矿物质密度(bmd)、(图1c)骨小梁数(tbn)和(图1d)骨小梁厚度(tbth)。scl-ab的显著效果由条上方的直线指示(p<0.05;与组内的ctl相比进行anova,之后进行tukey事后检验)。与正常相比的显著差异由条内的“a”指示(p<0.05;与特定治疗组中的正常相比进行anova,之后进行tukey事后检验)。
图2a至图2d显示,在肩袖动物模型中,用scl-ab治疗在愈合8周后导致附着部位的(图2a)破坏载荷、(图2b)强度和(图2c)刚度增加,其中相对于对照,破坏载荷和刚度恢复到与正常(未损伤)附着类似的水平。经scl-ab治疗的正常(未损伤)附着中的刚度和(图2d)模量降低。scl-ab的显著效果由条上方的直线指示(p<0.05;与组内的ctl相比进行anova,之后进行tukey事后检验)。与正常相比的显著差异由条内的“a”指示(p<0.05;与特定治疗组中的正常相比进行anova,之后进行tukey事后检验)。
图3a至图3d显示,在愈合8周后,与ctl(图3a和图3c)相比,scl-ab治疗改善了插入连续性、完整性和纤维排列(图3b和图3d)。起止点(enthesis)区域用白色虚线框划出,并在图3c和图3d中放大。对于图3a和图3b,比例尺=1mm;对于图3c和图3d,比例尺=250μm。
图4a示出了与肌腱起止点相邻的矿化组织中硬化蛋白、dkk1、lrp5、ocn、pth1r、rankl、opg、dmp1、osterix、runx2、ctsk和col2a1相对于管家基因rpl13a的基因表达。图4b示出了与肌腱起止点相邻的矿化组织中acan、tfgβ1、tgfβ3、mmp2、sox9、smo和notch1相对于管家基因rpl13a的基因表达。scl-ab的显著效果由条上方的直线指示(p<0.05;与组内的ctl相比进行anova,之后进行tukey事后检验)。与正常相比的显著差异由条内的“a”指示(p<0.05;与特定治疗组中的正常相比进行anova,之后进行tukey事后检验)。与ctl组中的正常相比的scl-ab的显著效果由条内的“b”指示(p<0.05,anova,之后进行tukey事后检验)。
图5a示出了肌腱中sderaxis、腱调蛋白(tenomodulin)、col1a1、聚集蛋白聚糖(aggrecan)、mmp2和smp相对于管家基因rpl13a的基因表达。图5b示出了肌腱中col1a2、col2a1、col3a1、sox9、tgfβ1、tgfβ3和notch1相对于管家基因rpl13a的基因表达。与正常相比的显著差异由条内的“a”指示(p<0.05;与特定治疗组中的正常相比进行anova,之后进行tukey事后检验)。
图6是列出本文所述的各种抗硬化蛋白抗体的氨基酸序列和氨基酸序列的序列标识符的图表。序列标识符是指与此一并提交的序列表中提供的氨基酸序列。这些氨基酸序列也在美国专利公布号2007/0110747或国际专利公布号wo2008/115732、wo2009/047356或wo2010/130830中示出,这些专利据此以引用方式并入。
具体实施方式
肩袖撕裂是常见的,并且会导致疼痛和残疾。手术修复后的愈合不良(包括界面处的显著骨丢失)导致较高的再撕裂率。如实施例中所述,在动物模型中用抗硬化蛋白抗体治疗防止骨丢失并增强肩袖愈合。如本文所证实的,在愈合8周后,接受抗硬化蛋白抗体(scl-ab)治疗的动物的骨矿物质密度比相匹配的对照高30%。相比于健康的腱-骨附着,在愈合2周和4周后两组中均观察到生物力学特性的降低。在愈合8周后,与对照动物相比,经scl-ab治疗的动物具有改善的强度(38%)和刚度(43%)。组织学评估显示,到愈合8周时,scl-ab促进了肌腱和骨更好地整合。scl-ab对骨中的成骨细胞、破骨细胞和骨祖细胞的基因表达也有显著影响,指示骨形成增强。scl-ab治疗对肌腱中基因的表达没有影响。
在一个方面,本文描述了用于增强有需要的受试者中的结缔组织-骨愈合的方法,包括向受试者施用一定量的抗硬化蛋白抗体,该量有效地增强受试者中的结缔组织-骨愈合。在一些实施方案中,结缔组织是韧带、肌腱、半月板或盂唇。在其他实施方案中,结缔组织是肌腱。在更进一步的实施方案中,结缔组织是韧带和肌腱。如本文所用,短语“增强结缔组织-骨愈合”是指结缔组织与骨之间更早、更强的附着。
抗体
术语“抗体”是指完整的抗体。抗体可包含整个抗体(免疫球蛋白)分子(包括具有全长重链和/或轻链的多克隆、单克隆、嵌合、人源化和/或人类型式)。
如本文所用,术语“抗体片段”是指抗体的抗原结合部分。抗体片段包括f(ab')2、fab、fab’、fv、fc和fd片段,并且可结合到单结构域抗体(例如,纳米抗体)、单链抗体、巨型抗体、微型抗体、细胞内抗体、双抗体、三抗体、四抗体、v-nar和bis-scfv(参见例如hollinger和hudson,naturebiotechnology,23(9):1126-1136(2005))。抗体多肽(包括纤连蛋白多肽单体)也在美国专利号6,703,199中有所公开。其他抗体多肽在美国专利公布号20050238646中有所公开。本文所述的方法和抗体链可用于产生异二聚体抗体,如例如美国专利申请公布号us2014/154254中所述,该专利的公开内容整体以引用方式并入本文。本文描述的抗体的特征以及施用时间和途径的讨论也适用于抗体片段。
抗体片段可以是合成或遗传工程蛋白。例如,抗体片段包括由轻链可变区组成的分离片段、由重链和轻链可变区组成的“fv”片段以及其中轻和重可变区通过肽接头(scfv蛋白)连接的重组单链多肽分子。
另一种形式的抗体片段是包含抗体的一个或多个互补决定区(cdr)的肽。如本文所用,术语“cdr”是指抗体可变序列内的互补决定区。在重链和轻链的每个可变区中存在三个cdr,对于每个可变区其被称为cdr1、cdr2和cdr3。如本文所用,术语“cdr组”是指在能够结合抗原的单个可变区中出现的一组共三个cdr。根据不同的系统,对这些cdr的确切边界有不同的定义。kabat所述的系统(kabat等人,sequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.(1987)和(1991))不仅提供了适用于抗体任何可变区的明确残基编号系统,而且还提供了定义三个cdr的精确残基边界。这些cdr可被称为kabatcdr。chothia及其同事(chothia&lesk,j.mol.biol.196:901-917(1987)以及chothia等人,nature342:877-883(1989))发现,kabatcdr中的某些子部分尽管在氨基酸序列水平上具有很大的多样性,但都采用几乎相同的肽骨架构象。这些子部分被指定为l1、l2和l3或h1、h2和h3,其中“l”和“h”分别指示轻链和重链区域。这些区域可被称为chothiacdr,其具有与kabatcdr重叠的边界。padlan(fasebj.9:133-139(1995))和maccallum(jmolbiol262(5):73245(1996))描述了定义与kabatcdr重叠的cdr的其他边界。另外其他cdr边界定义可能不严格遵循上述系统之一,但仍会与kabatcdr重叠,尽管根据以下预测或实验结果它们可能会缩短或延长:特定残基或残基组或甚至整个cdr不会显著影响抗原结合。本文使用的方法可以利用根据任何这些系统而定义的cdr,但优选的实施方案使用kabat或chothia定义的cdr。
cdr(也称为“最小识别单位”或“高变区”)通过例如构建编码所关注cdr的多核苷酸来获得。例如,此类多核苷酸通过如下方式制备:使用聚合酶链反应以抗体生成细胞的mrna作为模板合成可变区(参见例如larrick等人,methods:acompaniontomethodsinenzymology,2:106(1991);courtenay-luck,“geneticmanipulationofmonoclonalantibodies”,monoclonalantibodiesproduction,engineeringandclinicalapplication,ritter等人(编辑),第166页,cambridgeuniversitypress(1995);以及ward等人,“geneticmanipulationandexpressionofantibodies”,monoclonalantibodies:principlesandapplications,birch等人(编辑),第137页,wiley-liss,inc.(1995))。
“抗硬化蛋白抗体”结合硬化蛋白或其部分以阻断或削弱人硬化蛋白与一种或多种配体的结合。硬化蛋白作为sost基因的产物在硬化性狭窄病中是不存在的,硬化性狭窄病是一种以骨过度生长和骨结实致密为特征的骨骼疾病(brunkow等人,am.j.hum.genet.,68:577-589(2001);balemans等人,hum.mol.genet.,10:537-543(2001))。人硬化蛋白的氨基酸序列由brunkow等人进行了报道,并在美国专利公布号20070110747中公开为seqidno:1(该专利公布对硬化蛋白结合剂和序列表的描述整体以引用方式并入)。重组人硬化蛋白/sost可从r&dsystems(minneapolis,minn.,usa;2006目录号1406-st-025)商购获得。另外,重组小鼠硬化蛋白/sost可从r&dsystems(minneapolis,minn.,usa;2006目录号1589-st-025)商购获得。研究级硬化蛋白结合单克隆抗体可从r&dsystems(minneapolis,minn.,usa;小鼠单克隆:2006目录号mab1406;大鼠单克隆:2006目录号mab1589)商购获得。美国专利号6,395,511和6,803,453以及美国专利公布号2004/0009535和2005/0106683整体涉及抗硬化蛋白抗体。适用于本发明上下文的硬化蛋白抗体或其片段的实例还在美国专利公布号2007/0110747和2007/0072797中有所描述,这些专利据此以引用方式并入。关于产生硬化蛋白结合剂的材料和方法的其他信息可见于美国专利公布号20040158045(据此以引用方式并入)。
抗硬化蛋白抗体或其片段可以与seqidno:1的硬化蛋白或其天然存在的变体结合,其亲和力(kd)小于或等于1x10-7m、小于或等于1x10-8m、小于或等于1x10-9m、小于或等于1x10-10m、小于或等于1x10-11m、或小于或等于1x10-12m。例如,抗硬化蛋白抗体结合硬化蛋白的结合亲和力小于或等于1x10-7m、小于或等于2x10-7m、小于或等于3x10-7m、小于或等于4x10-7m、小于或等于5x10-7m、小于或等于6x10-7m、小于或等于7x10-7m、小于或等于8x10-7m、小于或等于9x10-7m、小于或等于1x10-8m、小于或等于2x10-8m、小于或等于3x10-8m、小于或等于4x10-8m、小于或等于5x10-8m、小于或等于6x10-8m、小于或等于7x10-8m、小于或等于8x10-8m、小于或等于9x10-8m、小于或等于1x10-9m、小于或等于2x10-9m、小于或等于3x10-9m、小于或等于4x10-9m、小于或等于5x10-9m、小于或等于6x10-9m、小于或等于7x10-9m、小于或等于8x10-9m、小于或等于9x10-9m、小于或等于1x10-10m、小于或等于2x10-10m、小于或等于3x10-10m、小于或等于4x10-10m、小于或等于5x10-10m、小于或等于6x10-10m、小于或等于7x10-10m、小于或等于8x10-10m、小于或等于9x10-10m、小于或等于1x10-11m、小于或等于2x10-11m、小于或等于3x10-11m、小于或等于4x10-11m、小于或等于5x10-11m、小于或等于6x10-11m、小于或等于7x10-11m、小于或等于8x10-11m、小于或等于9x10-11m、小于或等于1x10-12m、小于或等于2x10-12m、小于或等于3x10-12m、小于或等于4x10-12m、小于或等于5x10-12m、小于或等于6x10-12m、小于或等于7x10-12m、小于或等于8x10-12m、或小于或等于9x10-12m。如本文所用,“特异性结合”意指抗体或其片段相比其他蛋白优先结合硬化蛋白。在一些实施方案中,“特异性结合”意指抗体或其片段对硬化蛋白的亲和力高于对其他蛋白的亲和力。亲和力可使用多种技术来确定,其中一个实例是亲和力elisa测定。在各种实施方案中,亲和力通过biacore测定来确定。在各种实施方案中,亲和力通过动力学方法来确定。在各种实施方案中,亲和力通过平衡/溶液方法来确定。美国专利公布号2007/0110747包括适用于确定抗体对硬化蛋白的亲和力(kd)的亲和力测定的另外描述。示例性亲和力测定在美国专利公布号2008/0110747的实施例10和11中有所描述,该专利的公开内容整体以引用方式并入。
在一些或任何实施方案中,抗硬化蛋白抗体或抗体片段结合到包含seqidno:1中所示氨基酸序列的硬化蛋白多肽,并且结合到包含seqidno:6(cgparllpnaigrgkwwrpsgpdfrc;对应于seqidno:1的氨基酸86-111)的序列的硬化蛋白的区域。该区域在本文中也被称为硬化蛋白的“环2”区域。环2区域之外的硬化蛋白区域在本文中被定义为“非环2区域”。另选地或除此之外,抗硬化蛋白抗体结合包含seqidno:1的氨基酸57-146的硬化蛋白多肽。另选地或除此之外,抗硬化蛋白抗体结合包含seqidno:1的氨基酸89-103和/或seqidno:1的氨基酸137-151的硬化蛋白多肽。另选地或除此之外,抗硬化蛋白抗体结合到包含seqidno:1中所示的氨基酸序列的硬化蛋白多肽,并且结合seqidno:1内的以下各者中至少一者的序列:seqidno:2(dvseyscrelhftr;对应于seqidno:1的氨基酸51-64)、seqidno:3(sakpvtelvcsgqcgpar;对应于seqidno:1的氨基酸73-90)、seqidno:4(wwrpsgpdfrcipdryr;对应于seqidno:1的氨基酸101-117)、seqidno:5(lvasckckrltr;对应于seqidno:1的氨基酸138-149)、seqidno:70(sakpvtelvcsgqc;对应于seqidno:1的氨基酸73-86)、seqidno:71(lvasckc;对应于seqidno:1的氨基酸138-144)、seqidno:72(c1relhftr;对应于seqidno:1的氨基酸57-64)、或seqidno:73(cipdryr;对应于seqidno:1的氨基酸111-117)。例如,在一个方面,抗硬化蛋白抗体任选地以其天然三维构象结合seqidno:1的硬化蛋白的亚区域,该亚区域包含seqidno:2-5(和/或seqidno:70-73)。任选地,抗硬化蛋白抗体结合由seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:70、seqidno:71、seqidno:72或seqidno:73中的一者或多者组成的肽(例如,由seqidno:2、seqidno:3、seqidno:4和seqidno:5组成的肽,或由seqidno:70、seqidno:71、seqidno:72和seqidno:73组成的肽)。
在一些或任何实施方案中,抗硬化蛋白抗体结合到包含seqidno:1的氨基酸89-103和137-151的硬化蛋白多肽。
在一些或任何实施方案中,抗硬化蛋白抗体结合到具有seqidno:2、seqidno:3、seqidno:4和seqidno:5的氨基酸序列的硬化蛋白多肽,其中seqidno:2和seqidno:4在关于seqidno:1的氨基酸位置57和111处通过二硫键连接,并且seqidno:3和seqidno:5通过以下各者中的至少一者连接:(a)在关于seqidno:1的氨基酸位置82和142处的二硫键,以及(b)在关于seqidno:1的氨基酸位置86和144处的二硫键;该多肽可以保留seqidno:1的人硬化蛋白的对应多肽区域的三级结构。另选地或除此之外,抗硬化蛋白抗体结合具有seqidno:70、seqidno:71、seqidno:72和seqidno:73的氨基酸序列的多肽,其中seqidno:72和seqidno:73在关于seqidno:1的氨基酸位置57和111处通过二硫键连接,并且seqidno:70和seqidno:71通过以下各者中的至少一者连接:(a)在关于seqidno:1的氨基酸位置82和142处的二硫键,以及(b)在关于seqidno:1的氨基酸位置86和144处的二硫键。
任选地,抗硬化蛋白抗体结合基本上由seqidno:2、seqidno:3、seqidno:4和seqidno:5的氨基酸序列组成的肽,其中seqidno:2和seqidno:4在关于seqidno:1的氨基酸位置57和111处通过二硫键连接,并且seqidno:3和seqidno:5通过以下各者中的至少一者连接:(a)在关于seqidno:1的氨基酸位置82和142处的二硫键,以及(b)在关于seqidno:1的氨基酸位置86和144处的二硫键。
任选地,抗硬化蛋白抗体结合到基本上由seqidno:1的多重截短人硬化蛋白组成的多肽,其中(a)所述多肽中不存在seqidno:1的氨基酸1-50、65-72、91-100、118-137和150-190,或(b)所述多肽中不存在seqidno:1的氨基酸1-56、65-72、87-110、118-137和145-190。
在一些或任何实施方案中,抗硬化蛋白抗体结合到具有seqidno:70、seqidno:71、seqidno:72和seqidno:73的氨基酸序列的多肽,其中seqidno:72和seqidno:73在关于seqidno:1的氨基酸位置57和111处通过二硫键连接,并且seqidno:70和seqidno:71通过以下各者中的至少一者连接:(a)在关于seqidno:1的氨基酸位置82和142处的二硫键,以及(b)在关于seqidno:1的氨基酸位置86和144处的二硫键。
在一些或任何实施方案中,硬化蛋白多肽保留seqidno:1的人硬化蛋白的对应多肽区域的三级结构。
在一些或任何实施方案中,抗硬化蛋白抗体结合到:(i)包含seqidno:1的氨基酸51-64、73-90、101-117和138-149的人硬化蛋白的部分,其中所述部分具有以下各者中的至少一者、至少两者或所有三者:(a)氨基酸57和111之间的二硫键;(b)氨基酸82和142之间的二硫键;(c)氨基酸86和144之间的二硫键;或(ii)包含seqidno:1的氨基酸57-64、73-86、111-117和138-144的人硬化蛋白的部分,其中所述部分具有以下各者中的至少一者、至少两者或所有三者:(a)氨基酸57和111之间的二硫键;(b)氨基酸82和142之间的二硫键;以及(c)氨基酸86和144之间的二硫键。
在一些或任何实施方案中,抗硬化蛋白抗体还结合到seqidno:6的表位。
抗硬化蛋白抗体优选地在美国专利公布号2007/0110747所述的基于细胞的测定中和/或在美国专利公布号2007/0110747所述的体内测定中调节硬化蛋白功能,和/或与美国专利公布号2007/0110747所述的一个或多个表位结合,和/或交叉阻断美国专利公布号2007/0110747所述的一种或多种抗体的结合,和/或交叉阻断通过美国专利公布号2007/0110747所述的一种或多种抗体与硬化蛋白的结合(其对用于表征抗硬化蛋白抗体的测定的描述整体以引用方式并入)。
在各个方面,在基于mc3t3细胞的矿化测定中,当每个孔的硬化蛋白结合位点的摩尔数与每个孔的硬化蛋白的摩尔数相比低于6倍过量时,抗硬化蛋白抗体也能够中和人硬化蛋白。使用培养物中成骨细胞谱系细胞(原代细胞或细胞系)的矿化作为骨形成的体外模型。示例性的基于细胞的矿化测定在美国专利公布号20070110747的例如实施例8中有所描述(该专利据此以引用方式并入)。mc3t3-e1细胞(sudo等人,j.cellbiol.,96:191-198(1983))和原始细胞系的亚克隆在分化剂存在下生长时可在培养物中形成矿物质。这些亚克隆包括mc3t3-e1-bf(smith等人,j.biol.chem.,275:19992-20001(2000))。对于mc3t3-e1-bf亚克隆以及原始mc3t3-e1细胞两者而言,硬化蛋白可以抑制导致矿物质沉积和包括矿物质沉积的一系列事件中的一者或多者(即,硬化蛋白抑制矿化)。能够中和硬化蛋白抑制活性的抗硬化蛋白抗体允许培养物在硬化蛋白存在下矿化,使得例如磷酸钙的沉积量(以钙测量)与仅硬化蛋白(即无抗体)治疗组中测得的钙量相比,在统计学上显著增加。
当以确定特定的抗硬化蛋白抗体(或其他硬化蛋白抑制剂)是否能够中和硬化蛋白为目标进行测定时,测定中所用的硬化蛋白的量有利地是硬化蛋白的最小量,该最小量导致仅硬化蛋白组中的磷酸钙沉积量(以钙测量)与无硬化蛋白组中测得的钙量相比在统计学上显著降低至少70%。抗硬化蛋白中和抗体被定义为引起的磷酸钙沉积量(以钙测量)与在仅硬化蛋白(即无抗体)治疗组中测得的钙量相比在统计学上显著增加的抗体。为了确定抗硬化蛋白抗体是否被中和,测定中所使用的抗硬化蛋白抗体的量使得每个孔的硬化蛋白结合位点的摩尔数超过每个孔的硬化蛋白的摩尔数。取决于抗体的效力,可能需要的过量倍数可以是24、18、12、6、3或1.5倍,并且技术人员熟悉测试一种以上浓度的结合剂(抗体)的常规实践。例如,当每个孔的硬化蛋白结合位点的摩尔数与每个孔的硬化蛋白的摩尔数相比低于6倍过量时,非常高效的抗硬化蛋白中和抗体才会中和硬化蛋白。效力较低的抗硬化蛋白中和抗体仅在过量12、18或24倍时才会中和硬化蛋白。
在基于细胞的测定中,诸如骨特异性碱性磷酸酶测定,例如国际专利公布号wo2008/115732和美国专利号7,744,874(其对基于细胞的测定和抗硬化蛋白抗体的描述整体以引用方式并入本文)中所述的骨特异性碱性磷酸酶测定中,用于中和人硬化蛋白的抗硬化蛋白抗体的ic50任选地为100nm或更低、或75nm或更低、或50nm或更低、或25nm或更低。该骨特异性碱性磷酸酶测定基于硬化蛋白降低多能小鼠细胞系c2c12中bmp-4和wnt3a刺激的碱性磷酸酶水平的能力。根据wo2008/115732,在该测定中,中和抗硬化蛋白抗体介导碱性磷酸酶活性的剂量依赖性增加。
另选地或除此之外,在hek293细胞系的基于细胞的wnt信号传导测定中,诸如例如国际专利公布号wo2009/047356(其对抗硬化蛋白抗体和基于细胞的测定的讨论以引用方式并入)所述的涉及wnt1介导的stf报告基因诱导的wnt测定中,用于中和人硬化蛋白的抗硬化蛋白抗体的ic50为100nm或更低(例如,75nm或更低、或50nm或更低)。另选地或除此之外,在mc3t3细胞的bmp2诱导的矿化测定中,诸如例如国际专利公布号wo2009/047356所述的矿化测定中,用于中和人硬化蛋白的抗硬化蛋白抗体的ic50为500nm或更低(例如,250nm或更低、150nm或更低、100nm或更低、或50nm或更低)。
适用于本发明上下文的抗硬化蛋白抗体的实例在美国专利公布号2007/0110747和2007/0072797中有所描述,这些专利据此以引用方式并入。在一些实施方案中,抗硬化蛋白抗体交叉阻断抗体ab-a、ab-b、ab-c、ab-d、ab-1、ab-2、ab-3、ab-4、ab-5、ab-6、ab-7、ab-8、ab-9、ab-10、ab-11、ab-12、ab-13、ab-14、ab-15、ab-16、ab-17、ab-18、ab-19、ab-20、ab-21、ab-22、ab-23和ab-24(所有这些抗体均在美国专利公布号20070110747中有所描述)中的至少一者与硬化蛋白的结合。另选地或除此之外,抗硬化蛋白抗体被抗体ab-a、ab-b、ab-c、ab-d、ab-1、ab-2、ab-3、ab-4、ab-5、ab-6、ab-7、ab-8、ab-9、ab-10、ab-11、ab-12、ab-13、ab-14、ab-15、ab-16、ab-17、ab-18、ab-19、ab-20、ab-21、ab-22、ab-23和ab-24(所有这些抗体均在美国专利公布号20070110747中有所描述)中的至少一者交叉阻断与硬化蛋白的结合。术语“交叉阻断”在本文中用于意指抗体干扰其他抗体与硬化蛋白结合的能力。可以使用竞争结合测定来确定一种抗体能够干扰另一种抗体与硬化蛋白结合的程度,并因此确定是否可以说是交叉阻断。在本发明的一些方面,交叉阻断抗体或其片段使参考抗体与硬化蛋白的结合减少约40%至约100%,诸如约60%至约100%,具体地70%至100%,以及更具体地80%至100%。用于检测交叉阻断的特别合适的定量测定使用biacore仪器,该仪器使用表面等离子体共振技术测量相互作用的程度。另一种合适的定量交叉阻断测定使用基于elisa的方法来测量不同抗体之间在与硬化蛋白结合方面的竞争。
在一些实施方案中,抗硬化蛋白抗体交叉阻断包含全长重链和轻链的免疫球蛋白与seqidno:1的硬化蛋白的结合,和/或被包含全长重链和轻链的免疫球蛋白交叉阻断与seqidno:1的硬化蛋白的结合,其中该包含全长重链和轻链的免疫球蛋白包含本文公开的cdr序列,诸如以下三组cdr序列中的一者:a)seqidno:284的cdr-l1、seqidno:285的cdr-l2、seqidno:286的cdr-l3、seqidno:296的cdr-h1、seqidno:297的cdr-h2和seqidno:298的cdr-h3;b)seqidno:48的cdr-l1、seqidno:49的cdr-l2、seqidno:50的cdr-l3、seqidno:45的cdr-h1、seqidno:46的cdr-h2和seqidno:47的cdr-h3;或c)seqidno:42的cdr-l1、seqidno:43的cdr-l2、seqidno:44的cdr-l3、seqidno:39的cdr-h1、seqidno:40的cdr-h2和seqidno:41的cdr-h3。另选地或除此之外,抗硬化蛋白抗体交叉阻断包含全长重链和轻链的免疫球蛋白与seqidno:1的硬化蛋白的结合,和/或被包含全长重链和轻链的免疫球蛋白交叉阻断与seqidno:1的硬化蛋白的结合,其中该包含全长重链和轻链的免疫球蛋白包含以下cdr:seqidno:245的cdr-h1、seqidno:246的cdr-h2、seqidno:247的cdr-h3、seqidno:78的cdr-l1、seqidno:79的cdr-l2和seqidno:80的cdr-l3。
另选地或除此之外,抗硬化蛋白抗体交叉阻断包含全长重链和轻链的免疫球蛋白与seqidno:1的硬化蛋白的结合,和/或被包含全长重链和轻链的免疫球蛋白交叉阻断与seqidno:1的硬化蛋白的结合,其中该包含全长重链和轻链的免疫球蛋白包含以下cdr:seqidno:269的cdr-h1、seqidno:270的cdr-h2、seqidno:271的cdr-h3、seqidno:239的cdr-l1、seqidno:240的cdr-l2和seqidno:241的cdr-l3。
合适的抗硬化蛋白抗体及其片段的实例包括具有本文具体公开和美国专利公布号2007/0110747中公开的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3中的一者或多者的抗体和抗体片段。区域cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3中的至少一者可以具有至少一个氨基酸取代,前提条件是该抗体保留未取代cdr的结合特异性。示例性抗硬化蛋白抗体包括但不限于美国专利公布号2007/0110747中的ab-a、ab-b、ab-c、ab-d、ab-1、ab-2、ab-3、ab-4、ab-5、ab-6、ab-7、ab-8、ab-9、ab-10、ab-11、ab-12、ab-13、ab-14、ab-15、ab-16、ab-17、ab-18、ab-19、ab-20、ab-21、ab-22、ab-23和ab-24。其他示例性抗硬化蛋白抗体包括但不限于27h6、19d11和20c3。
此外,抗硬化蛋白抗体可包含至少一个与选自seqidno:39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、78、79、80、81、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278、279、280、281、282、283、284、285、286、287、288、289、290、291、292、293、294、295、296、297、298、351、352、353、358、359和360的cdr具有至少75%同一性(例如,100%同一性)的cdr序列。此外,抗硬化蛋白抗体可包含至少一个与选自序列表中提供的seqidno:417-422、425-430和433-438的cdr具有至少75%同一性(例如,100%同一性)的cdr序列。优选地,抗硬化蛋白抗体包含至少一个与选自seqidno:245、246、247、78、79、80、269、270、271、239、240和241的cdr具有至少75%同一性的cdr序列。抗硬化蛋白抗体可以包含:a)seqidno:54、55和56的cdr序列和seqidno:51、52和53的cdr序列;b)seqidno:60、61和62的cdr序列和seqidno:57、58和59的cdr序列;c)seqidno:48、49和50的cdr序列和seqidno:45、46和47的cdr序列;d)seqidno:42、43和44的cdr序列和seqidno:39、40和41的cdr序列;e)seqidno:275、276和277的cdr序列和seqidno:287、288和289的cdr序列;f)seqidno:278、279和280的cdr序列和seqidno:290、291和292的cdr序列;g)seqidno:78、79和80的cdr序列和seqidno:245、246和247的cdr序列;h)seqidno:81、99和100的cdr序列和seqidno:248、249和250的cdr序列;i)seqidno:101、102和103的cdr序列和seqidno:251、252和253的cdr序列;j)seqidno:104、105和106的cdr序列和seqidno:254、255和256的cdr序列;k)seqidno:107、108和109的cdr序列和seqidno:257、258和259的cdr序列;l)seqidno:110、111和112的cdr序列和seqidno:260、261和262的cdr序列;m)seqidno:281、282和283的cdr序列和seqidno:293、294和295的cdr序列;n)seqidno:113、114和115的cdr序列和seqidno:263、264和265的cdr序列;o)seqidno:284、285和286的cdr序列和seqidno:296、297和298的cdr序列;p)seqidno:116、237和238的cdr序列和seqidno:266、267和268的cdr序列;q)seqidno:239、240和241的cdr序列和seqidno:269、270和271的cdr序列)seqidno:242、243和244的cdr序列和seqidno:272、273和274的cdr序列;或s)seqidno:351、352和353的cdr序列和seqidno:358、359和360的cdr序列。
抗硬化蛋白抗体可包含至少一个与选自cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3的cdr具有至少75%同一性(例如,100%同一性)的cdr序列,其中cdr-h1具有seqidno:245给出的序列,cdr-h2具有seqidno:246给出的序列,cdr-h3具有seqidno:247给出的序列,cdr-l1具有seqidno:78给出的序列,cdr-l2具有seqidno:79给出的序列并且cdr-l3具有seqidno:80给出的序列。在各个方面,抗硬化蛋白抗体包含这些cdr中的两个或这些cdr中的六个。任选地,抗硬化蛋白抗体包含重链(例如,两条重链)的全部或部分和轻链(例如,两条轻链)的全部或部分,该重链包含seqidno:378,该轻链包含seqidno376。
抗硬化蛋白抗体可包含至少一个与选自cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3的cdr具有至少75%同一性(例如,100%同一性)的cdr序列,其中cdr-h1具有seqidno:269给出的序列,cdr-h2具有seqidno:270给出的序列,cdr-h3具有seqidno:271给出的序列,cdr-l1具有seqidno:239给出的序列,cdr-l2具有seqidno:240给出的序列并且cdr-l3具有seqidno:241给出的序列。在各个方面,抗硬化蛋白抗体至少包含这些cdr中的两个或这些cdr中的六个。任选地,抗硬化蛋白抗体包含重链(例如,两条重链)的全部或部分和轻链(例如,两条轻链)的全部或部分,该重链包含seqidno:366,该轻链包含seqidno364。
另选地,抗硬化蛋白抗体可以具有重链和轻链,该重链包含cdr的h1、h2和h3并且包含具有seqidno:137、145或392中提供的序列的多肽或其变体,在所述变体中cdr分别与seqidno:245、246和247具有至少75%同一性(例如,100%同一性),所述轻链包含cdr的l1、l2和l3并且包含具有seqidno:133或141中提供的序列的多肽或其变体,在所述变体中cdr分别与seqidno:78、79和80具有至少75%同一性(例如,100%同一性)。
抗硬化蛋白抗体可以具有重链和轻链,所述重链包含cdr的h1、h2和h3并且包含具有seqidno:335、331、345或396中提供的序列的多肽或前述中任一者的变体,在所述变体中cdr分别与seqidno:269、270和271具有至少75%同一性(例如,100%同一性),所述轻链包含cdr的l1、l2和l3并且包含具有seqidno:334或341中提供的序列的多肽或前述中任一者的变体,在所述变体中cdr分别与seqidno:239、240和241具有至少75%同一性(例如,100%同一性)。设想了重链和轻链序列的所有组合(例如,包含seqidno:335的重链和包含seqidno:334的轻链;包含seqidno:331的重链和包含seqidno:334或341的轻链;以及包含seqidno:345或396的重链和包含seqidno:341的轻链)。
另选地,抗硬化蛋白抗体具有:包含具有seqidno:137中提供的序列的多肽的重链,和包含具有seqidno:133中提供的序列的多肽的轻链;包含具有seqidno:145或392中提供的序列的多肽的重链,和包含具有seqidno:141中提供的序列的多肽的轻链;包含具有seqidno:335中提供的序列的多肽的重链,和包含具有seqidno:334中提供的序列的多肽的轻链;包含具有seqidno:331中提供的序列的多肽的重链,和包含具有seqidno:341中提供的序列的多肽的轻链;或者包含具有seqidno:345或396中提供的序列的多肽的重链,和包含具有seqidno:341中提供的序列的多肽的轻链。另选地,抗硬化蛋白抗体交叉阻断上述抗体中的任一者(或被其交叉阻断)与硬化蛋白的结合。
在一些实施方案中,抗硬化蛋白抗体包含重链,该重链包含选自seqidno:1038、seqidno:1046、seqidno:1040和seqidno:1048的氨基酸序列;任选地还包含选自seqidno:1039、seqidno:1047、seqidno:1041和seqidno:1049的轻链氨基酸序列。
抗硬化蛋白抗体的实例还包括但不限于:国际专利公布号wo2008/092894、wo2008/115732、wo2009/056634、wo2009/047356、wo2010/100200、wo2010/100179、wo2010/115932和wo2010/130830中公开的抗硬化蛋白抗体(这些专利各自整体以引用方式并入本文),诸如包含国际专利公布号wo2008/115732的seqidno:20-25(本文为seqidno:416-421)的cdr的抗硬化蛋白抗体,包含国际专利公布号wo2008/115732的seqidno:26-31(本文为seqidno:422-427)的cdr的抗硬化蛋白抗体,包含国际专利公布号wo2008/115732的seqidno:32-37(本文为seqidno:428-433)的cdr的抗硬化蛋白抗体,包含国际专利公布号wo2009/047356的seqidno:4、15、26、37、48和59(本文分别为seqidno:443、454、465、476、487和498)的cdr的抗硬化蛋白抗体,或包含国际专利公布号wo2010/130830的seqidno:135-143、153-161或171-179(本文分别为seqidno:745-753、763-771、781-789)中至少一者的氨基酸序列的抗硬化蛋白抗体。
施用时间和剂量
在一些实施方案中,在例如约1周至约18个月(例如,约1个月至约12个月、约1个月至约9个月、或约1个月至约6个月、或约1个月至约3个月)的治疗期内进行本文所述的抗硬化蛋白抗体的一次或多次施用。在一些实施方案中,在例如约1个月至约12个月(52周)(例如,约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月或约11个月)的治疗期内向受试者施用一个或多个剂量的本文所述的抗硬化蛋白抗体。在一些实施方案中,向受试者施用一个或多个剂量的抗硬化蛋白抗体以维持骨矿物质密度和/或增强结缔组织-骨附着。如本文所用,术语“维持骨矿物质密度”意指由抗硬化蛋白抗体的初始剂量引起的骨矿物质密度增加在约6个月、约9个月、约1年、约18个月、约2年的过程中或在患者的生命过程中)下降不超过约1%至约5%。应当理解,患者可能需要交替的治疗阶段以增加骨密度和维持骨密度。可以按多种方式评估接受抗硬化蛋白抗体的受试者中增强的结缔组织-骨附着,包括但不限于感知的疼痛减轻、受试者在愈合过程中较早利用受影响肌肉的能力、射线检测或mri参数的改善和/或肌肉力量的加强。
此外,取决于针对特定受试者所选的治疗方案,施用多个剂量的抗硬化蛋白抗体或间隔开各剂量的施用可能是有利的。在一些实施方案中,抗硬化蛋白抗体或其片段在一年(12个月、52周)或更短(例如,9个月或更短、6个月或更短、或3个月或更短)的时间段内定期施用。就这一点而言,每约3天、或约7天、或2周、或3周、或4周、或5周、或6周、或7周、或8周、或9周、或10周、或11周、或12周、或13周、或14周、或15周、或16周、或17周、或18周、或19周、或20周、或21周、或22周、或23周、或6个月、或12个月向人类施用一次抗硬化蛋白抗体或其片段。
在一些实施方案中,在检测到结缔组织与骨的附着缺损后不久(或在将结缔组织手术再附着到骨后不久),例如在缺损后30分钟内、1小时内、2小时内、6小时内、12小时内或24小时内,开始治疗期。在其他实施方案中,抑制剂在缺损后1天内、缺损后3天内、缺损后5天内、缺损后7天内或缺损后2周内施用,其中施用抗硬化蛋白抗体或其片段持续一段时间,该段时间为缺损后的至少4周(例如,4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周、31周或更长(例如,8个月、9个月、10个月、11个月、1年、18个月或更长))。在其他实施方案中,抑制剂在手术再附着后1天内、手术再附着后3天内、手术再附着后5天内、手术再附着后7天内、或手术再附着后2周内施用,其中施用抗硬化蛋白抗体或其片段持续一段时间,该段时间为手术再附着后的至少4周(例如,4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周、31周或更长(例如,8个月、9个月、10个月、11个月、1年、18个月或更长))。
在一些实施方案中,以一定的量和时间施用一个或多个剂量的抗硬化蛋白抗体或其片段,该量和时间有效增强结缔组织-骨愈合和/或改善结缔组织再附着手术的结果。在各种实施方案中,每周向受试者(例如,人类受试者)施用包含约50毫克至约1,000毫克抗硬化蛋白抗体的一个或多个剂量。例如,一个剂量的抗硬化蛋白抗体可包含至少约5mg、15mg、25mg、50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约120mg、约150mg、约200mg、约240mg、约250mg、约280mg、约300mg、约350mg、约400mg、约420mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg或至多约1,000mg的抗硬化蛋白抗体。还设想了任何和所有这些端点之间的范围,例如,约50mg至约80mg、约70mg至约140mg、约70mg至约270mg、约75mg至约100mg、约100mg至约150mg、约140mg至约210mg、或约150mg至约200mg、或约180mg至约270mg、或约280至约410mg。剂量以任何间隔施用,诸如一周多次(例如,每周两次或三次)、每周一次、每两周一次、每三周一次或每四周一次。在一些或任何实施方案中,每周两次施用范围从约120mg至约210mg的抗硬化蛋白抗体剂量。在一些或任何实施方案中,每周两次施用约140mg的抗硬化蛋白抗体剂量。
在一些实施方案中,一个或多个剂量的抗硬化蛋白抗体可包含约0.1至约50毫克(例如,约5至约50毫克)、或约1至约100毫克的抗硬化蛋白抗体/千克体重(mg/kg)。例如,该抗硬化蛋白抗体剂量可包括至少约0.1mg/kg、0.5mg/kg、1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约20mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、或约49mg/kg、或约50mg/kg、约55mg/kg、约60mg/kg、约65mg/kg、约70mg/kg、约75mg/kg、约80mg/kg、约85mg/kg、约90mg/kg、约95mg/kg、或最高约100mg/kg。还设想了任何和所有这些端点之间的范围,例如,约1mg/kg至约3mg/kg、约1mg/kg至约5mg/kg、约1mg/kg至约8mg/kgkb、约3mg/kg至约8mg/kg、约1mg/kg至约10mg/kg、约1mg/kg至约20mg/kg、约1mg/kg至约40mg/kg、约5mg/kg至约30mg/kg、或约5mg/kg至约20mg/kg。
组合疗法
相对于单独使用治疗相关剂量的每种药剂,通过组合一种或多种靶向同一病原体或生物化学途径或生物过程的药剂进行病变治疗,有时导致更大的功效和减少的副作用。在一些情况下,药物组合的功效是相加的(该组合的功效大约等于每种单独药物的作用的总和),但在其他情况下,该作用是协同的(该组合的功效大于单独给予的每种药物的作用的总和)。如本文所用,术语“组合疗法”意指两种或更多种药剂以同步的方式递送,例如同时递送,或者其中首先施用一种药剂然后施用第二药剂,例如依次施用。
在一些实施方案中,抗硬化蛋白抗体与标准护理治疗剂一起施用,以用于治疗结缔组织与骨的附着缺损(即,抗硬化蛋白抗体和标准护理治疗剂是同一治疗计划的一部分)。如本文所用,术语“标准护理”是指临床医生普遍接受的用于诊断出患有某种疾病的某类患者的治疗。在一些实施方案中,抗硬化蛋白抗体与第二骨增强剂一起施用,该第二骨增强剂可用于治疗骨矿物质密度降低或骨缺损。在一些实施方案中,骨增强剂选自抗再吸收剂、骨形成剂(即同化剂)、雌激素受体调节剂(包括但不限于雷洛昔芬、巴多昔芬和拉索昔芬)和对破骨细胞有抑制作用的药物。在一些实施方案中,第二骨增强剂选自双膦酸盐(包括但不限于阿仑膦酸钠
还设想将抗硬化蛋白抗体治疗与标准护理治疗方案结合用于结缔组织与骨的损伤。用于结缔组织与骨的损伤的示例性标准护理治疗剂或治疗方案包括但不限于:骨髓穿刺液、富血小板血浆、基因疗法(例如,bfgf、bmp12-14、pdgf、igf、tgfβ、ctgf和vegf)、生长因子疗法(例如,bmp2/smad8、bmp12/tgfβ1)、干细胞疗法(例如,骨髓间充质基质细胞、脂肪间充质基质细胞、胚胎干细胞衍生的间充质基质细胞、肌腱衍生的细胞)和使用天然生物材料(例如,基于胶原的支架、对齐的胶原线(alignedcollagenthread)、脱细胞的肌腱移植物和真皮移植物)。
在一些实施方案中,采用了本文所述的抗硬化蛋白抗体的组合疗法可以在施用另外的一种或多种治疗剂(例如,第二骨增强剂)之前或之后间隔数分钟至数周至数月。例如,在彼此间隔约24小时内,例如彼此间隔约6-12小时内、或彼此间隔约1-2小时内、或彼此间隔约10-30分钟内施用单独的模式。在一些情况下,可能需要显著延长治疗时间段,其中在不同模式的相应施用之间间隔数天(2、3、4、5、6或7天)至数周(1、2、3、4、5、6、7或8周)。具体设想了采用组合疗法的一种或两种药剂/疗法进行的重复治疗。
维持治疗方案
还设想了在维持方案中使用本文所述的第二骨增强剂和/或抗硬化蛋白抗体,以例如维持改善的结缔组织-骨附着和/或防止减负(unloading)引起的骨丢失。就这一点而言,本文所述的方法或用途任选地包括在抗硬化蛋白抗体治疗期结束后施用有效维持改善的结缔组织-骨附着的一种或多种量的第二骨增强剂,持续约1周至约5年的维持期。例如,在一些实施方案中,本文所述的方法或用途包括向受试者施用第二骨增强剂持续约至少约1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、3个月、13周、14周、15周、16周、4个月、17周、18周、19周、20周、5个月、21周、22周、23周、24周、6个月、25周、26周、27周、28周、7个月、29周、30周、31周或更长(例如,8个月、9个月、10个月、11个月、1年、15个月、18个月、2年、3年、4年、5年或更长(例如,受试者的一生)的维持期。在一些实施方案中,维持期为约6-12周。在一些实施方案中,维持期为约4-12周、或约1-3个月。在一些实施方案中,维持期为约12-20周、或约3-5个月。在一些实施方案中,维持期为约20-32周、或约5-8个月。在一些实施方案中,维持期为约24-36周、或约6-9个月。在一些实施方案中,维持期为约1年、约2年、约3年、约4年、约5年或更长。“维持”改善的结缔组织-骨附着包括维持接受抗硬化蛋白抗体治疗的受试者所经历的相似水平的射线检测或mri参数和/或肌肉力量测量结果。
类似地,本文所述的方法或用途任选地包括在治疗期结束后随后施用有效维持改善的结缔组织-骨附着的一种或多种量的抗硬化蛋白抗体,持续至少约1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、3个月、13周、14周、15周、16周、4个月、17周、18周、19周、20周、5个月、21周、22周、23周、24周、6个月、1年、2年、3年、4年、5年或更长(例如,受试者的一生)的维持期。在一些实施方案中,维持期为约6-12周。在一些实施方案中,维持期为约4-12周、或约1-3个月。在一些实施方案中,维持期为约12-20周、或约3-5个月。在一些实施方案中,维持期为约20-32周、或约5-8个月。在一些实施方案中,维持期为约24-36周、或约6-9个月。在一些实施方案中,维持期为约1年、约2年、约3年、约4年、约5年或更长。
药物组合物
在一些实施方案中,所述抗硬化蛋白与药学上有效的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂配制在一起。药物组合物包括但不限于液体、冷冻和冻干组合物。
优选地,制剂材料在所用剂量和浓度下对接受者无毒。在具体实施方案中,提供了包含治疗有效量的抗硬化蛋白抗体或其片段的药物组合物。
在一些实施方案中,药物组合物可含有用于改变、维持或保留组合物的例如ph、渗透压、粘度、澄明度、颜色、等渗性、气味、无菌性、稳定性、溶出或释放速率、吸附或渗透的制剂材料。在此类实施方案中,合适的制剂材料包括但不限于:氨基酸(诸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸、脯氨酸或赖氨酸);抗微生物剂;抗氧化剂(诸如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(诸如硼酸盐、碳酸氢盐、tris-hcl、柠檬酸盐、磷酸盐或其他有机酸);膨松剂(诸如甘露醇或甘氨酸);螯合剂(诸如乙二胺四乙酸(edta));络合剂(诸如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精);填充剂;单糖;二糖;和其他碳水化合物(诸如葡萄糖、甘露糖或糊精);蛋白(诸如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂和稀释剂;乳化剂;亲水性聚合物(诸如聚乙烯吡咯烷酮);低分子量多肽;成盐抗衡离子(诸如钠);防腐剂(诸如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(诸如甘油、丙二醇或聚乙二醇);糖醇(诸如甘露醇或山梨糖醇);助悬剂;表面活性剂或润湿剂(诸如pluronics、peg、脱水山梨糖醇酯、聚山梨醇酯诸如聚山梨醇酯20、聚山梨醇酯、triton、氨基丁三醇、卵磷脂、胆固醇、泰洛沙泊(tyloxapal));稳定性增强剂(诸如蔗糖或山梨糖醇);张力增强剂(诸如碱金属卤化物,优选氯化钠或氯化钾、甘露醇山梨糖醇);递送媒介物;稀释剂;赋形剂和/或药物佐剂。参见remington'spharmaceuticalsciences,第18版,(a.r.genrmo编辑),1990,mackpublishingcompany。
在一些实施方案中,本领域技术人员将根据例如预期的施用途径、递送形式和所需剂量确定最佳药物组合物。参见例如remington'spharmaceuticalsciences,同上。在某些实施方案中,此类组合物可影响抗硬化蛋白抗体或片段的物理状态、稳定性、体内释放速率和体内清除速率。在某些实施方案中,药物组合物中的主要媒介物或载体可以是水性或非水性的。例如,合适的媒介物或载体可以是注射用水、生理盐水溶液或人工脑脊液,它们可能补充有用于肠胃外施用的组合物中常见的其他物质。另外的示例性媒介物为中性缓冲盐水或与血清白蛋白混合的盐水。在具体实施方案中,药物组合物包含ph约7.0-8.5的tris缓冲液,或ph约4.0-5.5的乙酸盐缓冲液,并且还可包含山梨糖醇或其合适的替代物。在本发明的某些实施方案中,组合物可以通过将所选的具有所需纯度的组合物与任选的配制剂(remington'spharmaceuticalsciences,同上)以冻干饼或水溶液的形式混合来制备,以供储存。此外,在一些实施方案中,可以使用合适的赋形剂(诸如蔗糖)将抗硬化蛋白抗体或片段配制成冻干物。
在一些实施方案中,药物制剂在ph5.2下包含55mm乙酸盐、13mm钙、6.0%(w/v)蔗糖、0.006%(w/v)聚山梨醇酯20。在一些实施方案中,该药物组合物包含90mg/ml的抗硬化蛋白抗体。
本发明的药物组合物可以选择用于肠胃外递送。另选地,组合物可以选择用于吸入或通过消化道递送(诸如口服)。此类药学上可接受的组合物的制备在本领域的技术范围内。制剂组分优选地以施用部位可接受的浓度存在。在某些实施方案中,使用缓冲剂将组合物维持在生理ph或略低的ph,通常在约5至约8的ph范围内。
当设想肠胃外施用时,用于本发明的治疗组合物可以按无热原、肠胃外可接受的水溶液的形式提供,该水溶液包含在药学上可接受的媒介物中的所需抗硬化蛋白抗体或片段。用于肠胃外注射的特别合适的媒介物是无菌蒸馏水,在其中抗硬化蛋白抗体或片段被配制成适当保存的无菌等渗溶液。在某些实施方案中,制备涉及用可提供能经由积存注射(depotinjection)实现产品受控或持续释放的物质如可注射微球、生物可侵蚀颗粒、聚合化合物(诸如聚乳酸或聚乙醇酸)、珠粒或脂质体来配制所需分子。在某些实施方案中,还可以使用透明质酸,其具有延长循环中的持续时间的作用。在某些实施方案中,可使用可植入药物递送装置引入所需的抗硬化蛋白抗体或其片段。
另外的药物组合物对于本领域技术人员来说将是显而易见的,包括在持续或受控递送制剂中含有抗原结合蛋白的制剂。用于配制各种其他持续或受控递送手段(诸如脂质体载体、生物可侵蚀微粒或多孔珠粒和积存注射)的技术对于本领域技术人员来说也是已知的。参见例如国际专利申请号pct/us93/00829,该专利以引用方式并入并描述了用于递送药物组合物的多孔聚合物微粒的受控释放。持续释放制剂可包括呈成形制品形式的半透性聚合物基质,例如薄膜或微囊。持续释放基质可包括聚酯、水凝胶、聚交酯(如美国专利号3773919和欧洲专利申请公布号ep058481中所公开的,这些专利各自以引用方式并入)、l-谷氨酸和l-谷氨酸γ-乙酯的共聚物(sidman等人,1983,biopolymers2:547-556)、聚(甲基丙烯酸-2-羟乙酯)(langer等人,1981,j.biomed.mater.res.15:167-277和langer,1982,chem.tech.12:98-105)、乙烯醋酸乙烯酯(langer等人,1981年,同上)或聚-d(-)-3-羟基丁酸(欧洲专利申请公布号ep133988)。持续释放组合物还可包含可通过本领域已知的多种方法中的任一种制备的脂质体。参见例如eppstein等人,1985,proc.natl.acad.sci.u.s.a.82:3688-3692;欧洲专利申请公布号ep036676、ep088046和ep143949,它们以引用方式并入。
用于体内施用的药物组合物通常以无菌制剂提供。灭菌可以通过无菌过滤膜过滤来完成。当组合物被冻干时,可以在冻干和复原之前或之后使用该方法进行灭菌。用于肠胃外施用的组合物可以冻干形式或溶液形式储存。肠胃外组合物通常置于具有无菌进入口的容器中,例如,具有可被皮下注射针穿透的塞子的静脉输液袋或小瓶。
本发明的多个方面包括自缓冲抗硬化蛋白抗体或片段制剂,其可用作药物组合物,如国际专利申请公布wo2006/138181a2(pct/us2006/022599)中所述,该专利整体以引用方式并入本文。
如上所述,某些实施方案提供了抗硬化蛋白抗体或片段组合物,特别是抗硬化蛋白抗体或片段药物组合物,这些组合物除抗硬化蛋白抗体或片段外还包含一种或多种赋形剂,诸如本节和本文其他地方说明性描述的那些。就这一点而言,赋形剂可在本发明中用于多种目的,诸如调节制剂的物理、化学或生物学性质,诸如调节粘度,和/或用于本发明的过程以提高有效性,和/或用于稳定这些制剂和过程,防止由于例如在制造、运输、储存、使用前准备、施用期间及之后发生的应力引起的降解和变质。
药盒
包含一种或多种本文所述的抗硬化蛋白抗体的药物组合物可以与包装材料一起置于容器(例如,小瓶或注射器)内,该包装材料提供关于此类药物组合物的使用的说明。一般来讲,此类说明将包括描述抗硬化蛋白抗体浓度以及在某些实施方案中复原该药物组合物可能需要的赋形剂成分或稀释剂(例如,水、盐水或pbs)的相对量的明确表述。
实施例
材料和方法
动物和手术:经华盛顿大学动物研究委员会(washingtonuniversity'sanimalstudiescommittee)批准,本研究中使用成年雄性sprague-dawley大鼠。手术时,大鼠约四个月大,体重为至少350g。将冈上(ss)肌腱从肱骨头急剧抬高,并如前所述在双肩修复[25]。总共48只大鼠进行了手术,另外34只大鼠用作健康正常对照(n)。动物或不进行治疗(ctl组),或在损伤并修复时以及每两周通过皮下注射(25mg/kg)施用具有seqidno:245的cdr-h1、seqidno:246的cdr-h2、seqidno:247的cdr-h3、seqidno:78的cdr-l1、seqidno:79的cdr-l2和seqidno:80的cdr-l3的硬化蛋白抗体(scl-abvi,amgen,thousandoaks,ca)直至处死(scl-ab组)。允许所有动物在笼中自由活动,并在愈合2、4或8周后处死。未损伤的动物在均龄5个月时处死,这相当于损伤后愈合约4周。
骨形态计量学:处死后,从一个肩部小心地解剖附着有冈上肌腱和肌肉的肱骨。对于骨形态计量学(未损伤n=17,2周愈合n=5,4周愈合n=20,8周愈合n=23),如前所述[15,26],使用微计算机断层扫描术(显微ct)以20μm的分辨率、45kvp和177μa(μct40,scancomedical,switzerland)扫描肱骨头和肌腱起止点区域(~5mm)。所关注区域包括肌腱附着附近并在生长板近侧的肱骨头内的骨小梁。计算所关注区域中的骨量以确定骨体积分数(bv/tv)。还测定了骨矿物质密度(bmd)、骨小梁数(tb.n)和骨小梁厚度(tb.th)。
生物力学:如前所述[15],在处死、解剖和显微ct扫描后,将冈上肌肉轻轻从肌腱移除以备测试。在破坏载荷拉伸试验(load-to-failuretensiletest)期间,释放修复部位缝合线以移除其机械作用。通过在肱骨头周围缠绕4/0外科钢丝来固定生长板。然后将肱骨在聚甲基丙烯酸甲酯中灌封。样本在37℃下于0.9%盐水浴中进行测试。使用单轴测试框架(instron5866,instroncorporation,norwood,ma)和薄膜肌腱夹(imada,northbrook,il)进行生物力学测试。单轴破坏载荷拉伸试验由以下项的5个循环组成:以0.2%/s预处理至5%应变,随后恢复300s,然后以0.2%/s拉伸至破坏。应变测量为相对于每个肌腱的初始测量标距长度的夹之间的位移。通过上述μct扫描测量附着部位附近的冈上肌腱的横截面积(csa)。将测得的力除以csa,以计算应力。使用载荷-变形曲线确定最大载荷和刚度(曲线线性部分的斜率)。使用应力-应变曲线确定强度(最大应力)、模量(曲线线性部分的斜率)和弹性。在试验期间在视觉上确定了破坏机制,并在试验完成后通过大体观察来验证。
组织学:对于组织学,首先将解剖的肱骨-冈上肌构造物在4%多聚甲醛中固定24小时。将一些样品(24个中的18个)于14%乙二胺四乙酸中脱钙、梯度乙醇中脱水并包埋在石蜡中。用苏木精和伊红、甲苯胺蓝或goldner三色染液对5μm厚的冠状切片染色。将剩余的样品(24个中的6个)于4%多聚甲醛中固定24小时,包埋在塑料中,并用vonkossa法对5μm厚的冠状切片染色。使用改编自ide等人[26,27]的腱-骨成熟评分,由设盲观察者(nh)对这些切片进行半定量分析。插入连续性、骨吸收、基质质量、细胞和纤维排列以及细胞性(cellularity)是以1-4的量表评估的九个因素中的一部分(表1)。评分越低表示腱-骨愈合得到改善,评分为9相当于健康的附着[26,27]。
表1.改良的腱-骨成熟评分涉及以1-4的量表评估九个单独的结果。健康(未损伤)的起止点的综合评分为9分。c-连续性r-规律性f-纤维软骨。
基因表达:对于基因表达研究,将解剖的肱骨-冈上肌样品在液氮中快速冷冻。分别从冈上肌腱以及从肱骨头的靠近肌腱附着处的在生长板近侧的部分分离了rna(rnaeasy试剂盒,qiagenvalencia,ca)。使用nanodrop2000(thermoscientific,waltham,ma)进行rna定量。使用biomarkhd系统(fluidigm,sanfrancisco,ca),关于与骨、肌腱和纤维软骨相关的一组25个基因,对肌腱和骨rna进行实时定量pcr(qrt-pcr)(表2)。使用taqman基因表达测定(lifetechnologies,carlsbad,ca)进行分析。使用rpl13a作为管家基因,因为rpl13a的表达在各组之间的变化不超过±0.5ct值。结果表示为相比于rpl13a表达的相对表达(2-δct)。
表2.所评估的基因名称和相关类别及taqman测定id。
统计学:使用双因素方差分析(anova;因素:治疗和愈合时间),之后进行tukey事后检验,以确定治疗效果和愈合持续时间。通过双尾学生t检验与未损伤组进行另外的统计学比较。p<0.05被视为具有显著性。
结果
骨形态计量学:到愈合4周时,ctl组和scl-ab组中存在显著的骨丢失,其中到愈合8周时scl-ab组恢复(图1)。具体地讲,在第4周时,与未损伤组相比,ctl组和scl-ab组中的bv/tv、bmd和tbn显著降低。然而,在愈合8周后,将scl-ab治疗与ctl进行比较时,bv/tv增加了34%,bmd增加了30%,tbn增加了17%,tbth增加了24%,tbsp减少了21%(图1a至图1d),达到了与未损伤对照组相当的水平。用scl-ab治疗也导致未损伤组中bv/tv、bmd和tbth的增加。当使用anova评估scl-ab治疗的总体效果时,用scl-ab治疗的动物与ctl动物相比具有显著更高的bv/tv、bmd和tbth,分别高19%、18%和20%。
生物力学:损伤导致csa显著增大(15.9±3.9mm2比6.6±1.9mm2;注意,csa测量包括起止点附近的所有软组织,包括肌腱和瘢痕)。到愈合4周时,ctl组和scl-ab组的机械特性显著降低,其中到愈合8周时scl-ab组恢复(图2)。具体地讲,在第4周时,与未损伤组相比,ctl组和scl-ab组的破坏载荷、硬度和模量显著降低。然而,在愈合8周后,将scl-ab治疗与ctl进行比较时,破坏载荷增加了48%,强度增加了38%,并且刚度增加了43%。令人惊讶的是,用scl-ab治疗也导致未损伤组的硬度和模量显著降低。
组织学:在解剖和样品制备时未发现修复部位有破坏或缺口。组织学切片显示,冈上肌腱通过纤维血管瘢痕愈合至肱骨头骨,其中ctl组的肱骨头中的骨丢失明显(图3)。在愈合2周和4周时,ctl组和scl-ab组的愈合附着看起来相似。然而,在愈合8周后,相比于ctl,scl-ab治疗使得插入连续性、完整性和纤维排列得到改善。半定量盲法分析支持这些观察结果,表明在第8周时,scl-ab组与ctl组相比,腱-骨附着更成熟并且有新骨形成(表3)。
表3.在scl-ab治疗的所有组中,改良的腱-骨成熟评分随时间改善,导致总成熟度评分较低,反映了在愈合8周时相比于对照动物更成熟的附着。结果显示为中位数(最小值,最大值)。
矿化组织(骨和纤维软骨)中的基因表达:scl-ab治疗对肌腱起止点附近的矿化组织中的许多基因的表达具有显著影响,包括硬化蛋白、dkk1、rankl、dmp1和runx2(图4)。在愈合8周后,scl-ab组中硬化蛋白和dkk1的表达分别是ctl的3.3倍和2.5倍。lrp5的表达不受治疗或愈合时间的影响。在所有组中,骨钙素(ocn)(成骨细胞活性的标志物)在损伤后显著增加,而护骨素(osteoprotogerin,opg)(破骨细胞抑制的标志物)在损伤后显著降低。经scl-ab治疗,rankl和dmp1的表达均增加(图4)。scl-ab治疗对纤维软骨相关基因tgfβ1、tgfβ3、mmp2、col2a1和sox9没有影响(图4)。刺猬信号通路(hedgehogsignalingpathway)成员smo和notch1的表达不受治疗的影响。
肌腱中的基因表达:scl-ab治疗对肌腱基因表达没有显著影响(图5)。然而,愈合时间显著影响了所有肌腱相关基因:scleraxis、腱调蛋白、col1a1、col1a2、col3a1。在2周的愈合时间点改变最为明显,并且到8周的治疗时间点时趋向于正常。另外,在愈合2周后,聚集蛋白聚糖的表达在ctl组中增大20倍,在scl-ab治疗组中增大17倍。类似地,在愈合2周后,在ctl组和scl-ab治疗组中mmp2的表达均增大4.1倍。
讨论:
肩袖损伤和修复导致腱-骨界面处的骨丢失。愈合界面处骨量和骨质量的降低导致手术修复后较高的再撕裂率[5]。本文提供的实施例通过证明增强肌腱附着处的骨结构会使得肩袖损伤和修复后的愈合得到改善,利用硬化蛋白抗体治疗解决了腱-骨愈合期间的骨丢失。硬化蛋白抗体治疗增加了最接近愈合肌腱附着处的肱骨头中的骨小梁质量指数。尽管在愈合8周后对照组中仍存在损伤相关的骨丢失,但在接受治疗的动物中到愈合8周时观察到朝正常骨的快速恢复。愈合界面处骨形态的改善具有功能性后果,如通过附着强度改善所证实的。重要的是,组织学评估进一步证实了硬化蛋白抗体治疗的益处,其中与对照相比,接受治疗的动物在愈合8周后具有更成熟的腱-骨界面。
将骨形态发生蛋白2(bmp-2)等骨同化剂递送到损伤部位以借此改善损伤后的骨矿物质密度和破坏载荷,这在腱-骨修复的犬和啮齿动物模型中无效[26,28]。然而,先前已证实双膦酸盐通过减少骨吸收成功地改善了腱-骨愈合[18,29]。在屈肌腱-骨愈合的犬模型中,21天后肌腱损伤导致腱-骨界面附近的骨矿物质密度与正常相比降低了29%[18]。口服剂量的阿仑膦酸盐有效预防骨吸收,导致骨矿物质密度与正常相比仅降低6%。预防骨丢失导致愈合21天后修复部位的破坏载荷得到显著改善。在单独的研究中,向切除了卵巢的大鼠皮下注射唑来膦酸导致了冈上肌腱插入处附近的肱骨头骨矿物质密度与对照组相比增加23%[29]。增加的骨矿物质密度与治疗后界面处破坏载荷增大24%相关,但是与scl-ab不同,没有观察到施用双膦酸盐的肌腱组织学评分变化。在本研究中,在愈合8周后,与对照相比scl-ab治疗导致骨矿物质密度增加了30%、破坏载荷增大了48%。
本研究中使用的硬化蛋白抗体通过防止硬化蛋白与lrp5受体结合而中和硬化蛋白[30]。为了确定通过该机制是否实现了腱-骨愈合期间骨形态的改善,测量了wnt信号传导相关性基因表达。尽管lrp5的表达并未因scl-ab治疗而在统计学上有显著变化,但是在腱-骨愈合期间,经治疗的骨中硬化蛋白和dkk1的表达增加。与此相反的是,特别是在较晚的时间点,对照骨中这两个基因的表达水平相比于健康骨有所下降。在scl-ab组中观察到的变化表明,在启动wnt信号传导的尝试失败时,存在对被中和的硬化蛋白的补偿性细胞反应。
对愈合附着处矿化组织中的基因表达的进一步分析表明破骨细胞抑制增加(如通过opg表达增加所证实的)和成骨细胞活性增加(如通过骨钙素表达增加所证实的),这与观察到的骨形态改善一致。在损伤和修复后,治疗组和对照组中的骨祖细胞标志物(osterix和runx2)的基因表达与正常相比也都显著增加。此外,在正常的未损伤骨中,scl-ab治疗导致runx2基因表达增加。这些因子的表达增加(也与间充质细胞向成骨细胞分化有关[31,32])表明通过scl-ab整体诱导了经由祖细胞和成熟成骨细胞的骨形成。
肌腱附着的强度在很大程度上取决于界面处矿化组织的质量[33,34]。健康的腱-骨附着具有跨越纤维软骨插入点到进入骨小梁的梯度矿物质含量[35]。scl-ab治疗导致附着处的机械强度增加,这可能不仅是骨小梁附近矿化改善的结果(如通过显微ct测量的),还是愈合界面处纤维软骨矿化改善的结果。在愈合8周后,用scl-ab治疗的与起止点相邻的矿化组织中聚集蛋白聚糖(细胞外基质标志物或软骨和纤维软骨)的表达明显更高图6)。此外,组织切片的半定量评估显示,与对照相比,经scl-ab治疗愈合4周和8周后腱-骨附着成熟度(包括插入完整性)得到改善。
通过皮下注射全身施用scl-ab治疗。因此,所有组织,包括与愈合界面相邻的肌腱以及其他关节中的组织,也接受了scl-ab治疗。为了评估scl-ab对非矿化组织的可能影响,检测了与愈合界面相邻的冈上肌腱中的基因表达。scl-ab治疗对肌腱组织中的基因表达没有显著影响(图5),这减轻了治疗可能对非靶组织产生影响的担忧。然而,scl-ab治疗确实导致了健康腱-骨附着的模量和硬度降低(图2)。这一结果与先前的发现一致,即在腱-骨愈合期间,双膦酸盐治疗可导致刚度下降[18]。由于肌腱和韧带具有用于典型生理活动的内在机械安全系数[36],因此刚度和模量的小幅下降不应使健康的肌腱易于受损。
总之,本文提供的数据表明,在测试的动物模型中,与对照相比,用硬化蛋白抗体治疗导致了腱-骨附着得到改善。正如预期的那样,硬化蛋白抗体增强了与起止点相邻的骨小梁区域。令人惊讶的是,组织学评估显示,到愈合8周时,硬化蛋白抗体治疗促进了肌腱和骨更好地整合。因此,用本文所述的硬化蛋白抗体进行治疗,不仅可以通过增加相邻插入部位中的骨量还可以通过改善受损肌腱的组织学来改善腱-骨附着。此外,可以考虑使用硬化蛋白抗体治疗来防止在肌腱撕裂手术修复之前的一段时间与减负相关的骨丢失。
参考文献:
[1]tashjianrz.epidemiology,naturalhistory,andindicationsfortreatmentofrotatorcufftcars.clinicsinsportsmcdicinc2012;31:589-604.
[2]lehmanc,cuomof,kummerfj,zuckermanjd.theincidenceoffullthicknessrotatorcufftearsinalargecadavericpopulation.bullhospjtdis1995;54:30-1.
[3]keenerjd,galatzlm,teefeysa,middletonwd,steger-mayk,stobbs-cucchig,pattonr,yamaguchik.aprospectiveevaluationofsurvivorshipofasymptomaticdegenerativerotatorcufftears;2015.
[4]colvinac,egorovan,harrisonak,moskowitza,flatowel.nationaltrendsinrotatorcuffrepair.jbonejointsurgam2012;94:227-33.
[5]galatzlm,ballcm,teefeysa,middletonwd,yamaguchik.theoutcomeandrcpairintcgrityofcomplctclyarthroscopicallyrcpaircdlargcandmassivcrotatorcufftears.jboncjointsurgam2004;86-a:219-24.
[6]thomopouloss,birmanv,gcningm.structuralintcrfaccsandattachmcntsinbiology:springerscience&businessmedia;2012.
[7]galatzlm,charltonn,dasr,kimhm,havlioglun,thomopouloss.completeremovalofloadisdetrimentaltorotatorcuffhealing.jshoulderelbowsurg2009;18:669-75.
[8]galatzlm,rothcrmichsy,zacgclm,silvamj,havlioglun,thomopouloss.delayedrepairoftendontoboneinjuriesleadstodecreasedbiomechanicalpropertiesandboneloss.jorthopres2005;23:1441-7.
[9]gimbelja,vankleunenjp,lakesp,williamsgr,soslowskylj.theroleofrepairtensionontendontobonehealinginananimalmodelofchronicrotatorcufftears.journalofbiomechanics2007;40:561-568.
[10]thomopouloss,kimhm,rothermichsy,biederstadtc,dasr,galatzlm,decreasedmuscleloadingdelaysmaturationofthetendonenthesisduringpostnataldevelopment.jorthopres2007;25:1154-63.
[11]thomopouloss,zampiakise,dasr,silvamj,gclbcrmanrh.thceffectofmuscleloadingonflexortendon-to-bonehealinginacaninemodel.journaloforthopaedicresearch2008;26:1611-1617.
[12]
[13]alfredsonh,
[14]silvamj,rittytm,ditsiosk,burnsme,boyermi,gelbermanrh.tendoninjuryresponse:assessmentofbiomechanicalproperties,tissuemorphologyandviabilityfollowingflexordigitorumprofundustendontransection.journaloforthopaedicrcscarch2004;22:990-997.
[15]kilianml,cavinattol,shahsa,satoej,wardsr,havlioglun,galatzlm,thomopouloss.theeffectsofchronicunloadingandgapformationontendon-to-bonehealinginaratmodelofmassiverotatorcufftears.journaloforthopaedicresearch2014;32:439-447.
[16]killianml,cavinattolm,wardsr,havlioglun,thomopouloss,galatzlm.chronicdcgencrationlcadstopoorhcalingofrcpaircdmassivcrotatorcufftearsinrats.theamericanjournalofsportsmedicine2015;43:2401-2410.
[17]ditsiosk,boycrmi,kusanon,gclbcrmanrh,silvamj.bonclossfollowingtcndonlaccration,rcpairandpassivcmobilization.journaloforthopacdicrcscarch2003;21:990-996.
[18]thomopouloss,matsuzakih,zaegelm,gelbermanrh,silvamj.alendronatepreventsbonelossandimprovestendon-to-bonerepairstrengthinacaninemodel.journaloforthopaedicresearch2007;25:473-479.
[19]kennelka,drakemt.adverseeffectsofbisphosphonates:implicationsforosteoporosismanagement.mayoclinicproceedings2009;84:632-638.
[20]bonehg,hoskingd,devogelaerj-p,tuccijr,emkeyrd,toninorp,rodriguez-portalesja,downsrw,guptaj,santoraac,libermanua.tenyears′experiencewithalendronateforosteoporosisinpostmenopausalwomen.newenglandjournalofmedicine2004;350:1189-1199.
[21]blackdm,schwartzav,ensrudke,etal.effectsofcontinuingorstoppingalcndronatcaftcr5ycarsoftrcatmcnt:thcfracturcintcrvcntiontriallong-tcrmextension(flex):arandomizedtrial.jama2006;296:2927-2938.
[22]lix,ominskyms,warmingtonks,moronys,gongj,caoj,gaoy,shalhoubv,tiptonb,haldankarr,chenq,wintersa,boonet,gengz,niuq-t,kehz,kostenuikpj,simonetws,laceydl,pasztyc.sclerostinantibodytreatmentincreasesboneformation,bonemass,andbonestrengthinaratmodelofpostmenopausalosteoporosis.journalofboneandmineralresearch2009;24:578-588.
[23]mcclungmr,grauera,boonens,bolognesema,brownjp,diez-pcrcza,langdahlbl,rcginstcrj-y,zanchcttajr,wasscrmansm,katzl,maddoxj,yangy-c,libanatic,bonehg.romosozumabinpostmenopausalwomenwithlowbonemincraldcnsity.ncwenglandjonrnalofmcdicinc2014;370:412-420.
[24]padhid,jangg,stouchb,fangl,posvare.single-dose,placebo-controlled,randomizedstudyofamg785,asclerostinmonoclonalantibody.journalofboneandmineralresearch2011;26:19-26.
[25]manningcn,kimhm,sakiyama-elberts,galatzlm,havlioglun,thomopouloss.sustaincddclivcryoftransforminggrowthfactorbctathrcccnhanccstcndon-to-bonchcalinginaratmodcl.jorthoprcs2011;29:1099-105.
[26]lipnerj,shenh,cavinattol,liuw,havlioglun,xiay,galatzlm,thomopouloss.invivoevaluationofadipose-derivedstromalcellsdeliveredwithananofiberscaffoldfortendon-to-bonerepair.tissueengineeringparta2015;21:2766-2774.
[27]idej,kikukawak,hirosej,iyamak-i,sakamotoh,fujimotot,mizutah.thccffcctofalocalapplicationoffibroblastgrowthfactor-2ontcndon-to-boncrcmodclinginratswithacutcinjuryandrcpairofthcsupraspinatustcndon.journalofshouldcrandelbowsurgcry2009;18:391-398.
[28]thomopouloss,kimhm,silvamj,ntouvalie,manningcn,potterr,seehermanh,gelbermanrh.theeffectofbonemorphogeneticprotein2ontendon-to-bonehealinginacanineflexortendonmodel.journaloforthopaedicresearch:officialpublicationoftheorthopaedicresearchsociety2012;30:1702-1709.
[29]cadeter,vorysgc,rahmanrk,parks-h,gardnertr,leefy,levinewn,biglianilu,ahmadcs.improvingbonedensityattherotatorcufffootprintincreasessupraspinatustendonfailurestressinaratmodel.joumaloforthopaedicresearch2010;28:308-314.
[30]sinderbp,salemijd,ominskyms,cairdms,marinijc,kozloffkm.rapidlygrowingbrtl/+mousemodelofosteogenesisimperfectaimprovesbonemassandstrcngthwithsclcrostinantibodytrcatmcnt.bonc2015;71:115-123.
[31]komorit.rcgulationofostcoblastdiffcrcntiationbytranscriptionfactors.journalofccllularbiochcmistry2006;99:1233-1239.
[32]nakashimak,zhoux,kunkclg,zhangz,dcngjm,bchringcrrr,decrombruggheb.thenovelzincfinger-containingtranscriptionfactorosterixisrequiredforosteoblastdifferentiationandboneformation.cell2002;108:17-29.
[33]geningm,kenta,birmanv,wopenkab,pasterisjd,marquezpj,thomopouloss.functionalgradingofmineralandcollagenintheattachmentoftendontobone.biophysj2009;97:976-85.
[34]schwartzag,lipnerjh,pasterisjd,geningm,thomopouloss.muscleloadingisnecessaryfortheformationofafunctionaltendonenthesis.bone2013;55:44-51.
[35]schwartzag,pasterisjd,geningm,daultontl,thomopouloss.mincraldistributionsatthcdcvclopingtcndoncnthcsis.plosonc2012;7:c48630.
[36]westjr,juncosan,gallowaymt,boivingp,butlerdl.charactetizationofinvivoachillestendonforcesinrabbitsduringtreadmilllocomotionatvaryingspeedsandinclinations.jbiomech2004;37:1647-53.
[37]sharmap,maffullin.tendoninjuryandtendinopathy:healingandrepair;2005.
- 还没有人留言评论。精彩留言会获得点赞!