胆甾-3,6-二酮用于神经元损伤的治疗的制作方法
本发明涉及胆甾-3,6-二酮的医药新用途,具体涉及胆甾-3,6-二酮在神经元损伤治疗中的应用。
背景技术
胆甾-3,6-二酮是一种胆固醇衍生物,已知的合成方法以胆固醇为原料,可通过多种合成方法获得(zhangweietal,2014;rmartinez-pascualetal,2017;jgscbuchananetal,1969)。原料价格低廉,合成简单方便,成药性良好。
目前该化合物的活性研究主要有:(1)akr1b10酶抑制剂作用;(2)抗细菌活性;(3)降低心率活性;(4)抗肿瘤活性(zhangweietal,2014;zakariaetal,2011;zhangzhaohuietal,1999;shidayongetal,2011)。迄今为止尚未有关于该化合物在神经保护领域的报道。目前未见该化合物授权专利的报道。此外,该化合物在平滑肌细胞上进行实验,发现没有细胞毒性(pengshikaung,1979)。可以预测,一旦开发成药,毒副作用相对较少。
神经元保护剂的研发一直是临床和基础研究的重点,制备神经保护细胞模型上通常依据不同的目的选用不同的原代培养神经元损伤模型。
ht-22细胞株是小鼠海马原代神经元经过改造而得,能表达胆碱能神经元标记物,具有与正常海马神经元相似的形态和生理功能、培养过程简单、可以传代等优点。谷氨酸诱导的ht-22细胞损伤包括细胞坏死、凋亡和死亡等,分子机制上存在多种解释(fukuimetal,2009),目前该模型是一种公认的神经元氧化应激损伤模型(breyeraetal,2007)。同时,氧化应激损伤贯穿着脑卒中的缺血和再灌注全过程,氧化应激是研发多靶点神经保护剂重要靶点,该模型已被广泛用于抗氧化损伤神经保护剂研究。
正常情况下神经元胞内外离子维持一定浓度梯度,是维持神经元去极化和复极化所必须的。缺血时,大量梗死灶周围的神经元凋亡,造成了半影区不断变成梗死区。神经元凋亡是研究脑卒中神经保护剂的重要靶点(alhadidiqetal,2016)。用含25mmkcl的bme培养基培养大鼠小脑颗粒神经元,经过5mmkcl的bme处理24小时,可以建立稳定的小脑颗粒神经元凋亡模型,该模型已被广泛用于抗凋亡神经保护剂研究(dragottojetal,2015)。
兴奋性毒性是脑卒中重要病理机制之一,在缺血性脑卒中,神经元释放过量谷氨酸,同时由于供能障碍,胶质细胞重吸收谷氨酸的功能受阻,导致谷氨酸浓度过高,造成神经兴奋性毒性(kritisaaetal,2015)。谷氨酸介导的神经兴奋性是脑卒中神经保护的重要靶点(chamorroáetal,2016)。神经元兴奋性毒性模型已被广泛用于神经保护剂研究,我们在大鼠大脑皮质神经元上进行药物神经保护活性研究。
技术实现要素:
本发明的发明人意外发现,胆甾-3,6-二酮能够减轻由谷氨酸引起的海马神经细胞氧化应激损伤、能够减轻钾剥夺引起的小脑颗粒神经元凋亡损伤、能够减轻谷氨酸引起的皮层神经元神经兴奋性损伤,从而能够用于治疗神经元损伤,具有用于开发成多种作用机制的神经保护剂的潜能。
本发明的一方面提供胆甾-3,6-二酮、其氘代物或其药学上可接受的盐在制备治疗患者的神经元损伤的药物中的应用。在一些实施方式中,所述神经元损伤是由氧化应激损伤、神经元凋亡或神经元兴奋性毒性介导的损伤。在一些实施方式中,所述神经元损伤药物为退行性疾病。优选地,所述退行性疾病包括帕金森病、阿尔兹海默症、tau蛋白病或肌萎缩侧索硬化症。在一些实施方式中,所述神经元损伤为脑中风或脑损伤。在一些实施方式中,所述药物还包含另一治疗剂。在一些实施方式中,所述患者是人。
本发明的另一方面提供一种治疗患者的神经元损伤的方法,该方法包括向该患者施用有效量的胆甾-3,6-二酮、其氘代物或其药学上可接受的盐、或包含胆甾-3,6-二酮、其氘代物或其药学上可接受的盐的药物组合物。在一些实施方式中,所述神经元损伤是由氧化应激损伤、神经元凋亡或神经元兴奋性毒性介导的损伤。在一些实施方式中,所述神经元损伤为退行性疾病。优选地,所述退行性疾病包括帕金森病、阿尔兹海默症、tau蛋白病或肌萎缩侧索硬化症。在一些实施方式中,所述神经元损伤为脑中风或脑损伤。在一些实施方式中,所述患者是人。
本发明的再一方面提供胆甾-3,6-二酮、其氘代物或其药学上可接受的盐用于患者的神经元损伤的治疗。在一些实施方式中,所述神经元损伤是由氧化应激损伤、神经元凋亡或神经元兴奋性毒性介导的损伤。在一些实施方式中,所述神经元损伤为退行性疾病。优选地,所述退行性疾病包括帕金森病、阿尔兹海默症、tau蛋白病或肌萎缩侧索硬化症。在一些实施方式中,所述神经元损伤为脑中风或脑损伤。在一些实施方式中,所述患者是人。
本发明的又一方面提供一种减轻或消除患者的神经元损伤的方法,所述方法包括向该患者施用有效量的胆甾-3,6-二酮、其氘代物或其药学上可接受的盐、或包含胆甾-3,6-二酮、其氘代物或其药学上可接受的盐的药物组合物。在一些实施方式中,所述神经元损伤是由氧化应激损伤、神经元凋亡或神经元兴奋性毒性介导引起的。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定。
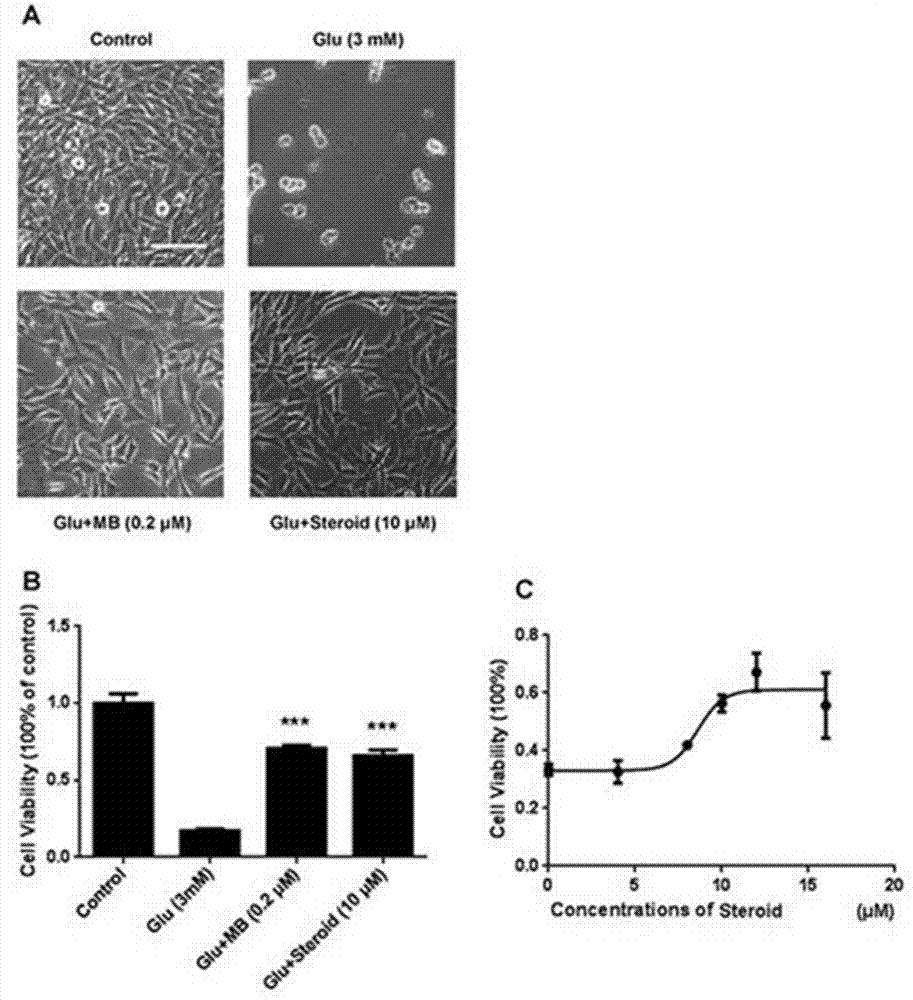
图1:胆甾-3,6-二酮对l-谷氨酸诱导ht-22细胞氧化应激损伤的神经保护作用。(a)细胞形态图,scalebar=100μm;(b)mtt法测得的细胞存活率柱状图(glu:0.171±0.014;mb:0.708±0.020;甾体:0.660±0.036;n=4;p<0.001vs.glu);(c)胆甾-3,6-二酮的ec50图。
图2:胆甾-3,6-二酮对钾剥夺引起的小脑颗粒神经元凋亡损伤的神经保护作用。(a)细胞形态图,scalebar100μm;(b)mtt法测得的细胞存活率柱状图(5k:0.326±0.010,steroid:0.449±0.017,***p<0.001vs.5k,n=3);(c)hoechst33342染色图,scalebar50μm;(d)凋亡细胞百分数柱状图(5k:0.545±0.036,steroid:0.314±0.040,***p<0.001vs.5k,n=5)。
图3:胆甾-3,6-二酮对谷氨酸造成的皮质神经元兴奋性毒性的神经保护作用。(a)细胞形态图,scalebar100μm;(b)mtt法测得的细胞存活率柱状图(glu:0.338±0.022,mk801:0.930±0.068,steroid:0.862±0.047,***p<0.001vs.glu,n=5)。
具体实施方式
如本文所用,术语“组合物”指适于给预期动物对象施用以达到治疗目的的制剂,其含有至少一种药物活性组分,例如化合物。任选地,所述组合物还含有至少一种药物学上可接受的载体或赋形剂。
术语“药学上可接受的”表示所述物质不具有这样的特性,即考虑到将被治疗的疾病或病症以及各自的施用途径,该特性将会使理性谨慎的医学从业者避免给患者服用该物质。例如,对于可注射物来说,通常要求这样的物质是基本无菌的。
在本文中,术语“治疗有效量”和“有效量”表示所述物质和物质的量对于预防、减轻或改善疾病或病症的一种或多种症状,和/或延长接受治疗的对象的存活是有效的。
本文使用的“治疗”包括给予本申请的化合物或其药学上可接受的盐,以减轻疾病或病症的症状或并发症,或消除疾病或病症。本文使用的术语“减轻”用于描述病症的迹象或症状的严重性降低的过程。症状可减轻而没有消除。在一种实施方案中,给予本申请的药物组合物导致消除迹象或症状。
胆甾-3,6-二酮、其氘代物及药学上可接受的盐
胆甾-3,6-二酮在本文也称为“甾体”、“steroid”或“本发明的化合物”,结构式如式(i)所示。
本发明的化合物可以被配制为药学上可接受盐的形式或者为药学上可接受盐的形式。预期的药学上可接受的盐形式包括,但不限于,单、双、三、四等盐。药学上可接受盐在它们被施用的量和浓度下是无毒的。在不阻止其发挥生理效应的情况下,通过改变化合物的物理特性,这样的盐的制备可以便于药理学应用。在物理性质上有用的改变包括降低熔点以便经粘膜给药,以及增加溶解度以便施用更高浓度的药物。
药学上可接受的盐包括酸加成盐,例如那些含硫酸盐、氯化物、氢氯化物、延胡索酸盐、马来酸盐、磷酸盐、氨基磺酸盐、乙酸盐、柠檬酸盐、乳酸盐、酒石酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、环己氨基磺酸盐和奎尼酸盐的盐。药学上可接受的盐可以从酸获得,所述酸例如盐酸、马来酸、硫酸、磷酸、氨基磺酸、乙酸、柠檬酸、乳酸、酒石酸、丙二酸、甲磺酸、乙磺酸、苯磺酸、对甲苯磺酸、环己氨基磺酸、延胡索酸和奎尼酸。
当酸性官能团例如羧酸或酚存在时,药学上可接受的盐也包括碱加成盐,例如那些含有苄星青霉素、氯普鲁卡因、胆碱、二乙醇胺、乙醇胺、叔丁胺、乙二胺、葡甲胺、普鲁卡因、铝、钙、锂、镁、钾、钠、铵、烷基胺和锌的盐。使用合适的相应的碱可以制备此类盐。
通过标准技术,可以制备药学上可接受的盐。例如,将游离碱形式的化合物溶解在合适的溶剂中,例如含有适宜酸的水性溶液或水-醇溶液中,然后蒸发溶液进行分离。在另一个实例中,通过使游离碱和酸在有机溶剂中反应来制备盐。
因此,例如,如果特定化合物是碱,则可以通过本领域可得的任何合适方法制备所需的药学上可接受的盐,例如,用无机酸或有机酸处理游离碱,所述无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸和类似酸,所述有机酸如乙酸、马来酸、琥珀酸、扁桃酸、富马酸、丙二酸、丙酮酸、草酸、乙醇酸、水杨酸、吡喃糖苷酸(pyranosidylacid)如葡糖醛酸或半乳糖醛酸、α-羟基酸如柠檬酸或酒石酸、氨基酸如天冬氨酸或谷氨酸、芳香酸如苯甲酸或肉桂酸、磺酸如对甲苯磺酸或乙磺酸或类似物。
同样,如果特定化合物是酸,则可以通过任何合适方法制备所需的药学上可接受的盐,例如,用无机碱或有机碱处理游离酸,所述无机碱或有机碱例如胺(伯胺、仲胺或叔胺)、碱金属氢氧化物或碱土金属氢氧化物或类似物。合适的盐的示范性例子包括有机盐,其衍生自氨基酸(如l-甘氨酸、l-赖氨酸和l-精氨酸)、氨、伯胺、仲胺和叔胺,以及环胺(如羟乙基吡咯烷、哌啶、吗啉和哌嗪),以及无机盐,其衍生自钠、钙、钾、镁、锰、铁、铜、锌、铝和锂。
化合物的药学上可接受的盐可以作为络合物存在。络合物的例子包括8-氯茶碱络合物(类似于,例如,茶苯海明:苯海拉明8-氯茶碱(1:1)络合物;晕海宁)和各种包含环糊精的络合物。
本发明还预期包括使用该化合物的药学上可接受的氘代化合物或其他非放射性取代化合物。氘代是将药物活性分子基团中的一个或多个或全部氢替换成同位素氘,因其无毒无放射性,又比碳氢键稳定约6~9倍,可以封闭代谢位点而延长药物的半衰期,从而降低治疗剂量,同时又不影响药物的药理活性,而被认为是一种优良的修饰方法。
药物组合物
在本发明中,“药物组合物”是指包含胆甾-3,6-二酮和药学上可接受的载体的组合物,其中化合物和药学上可接受的载体以混合形式存在于组合物中。所述组合物一般将被用于人类对象的治疗。然而,它们也可以被用于治疗在其它动物对象中的相似的或相同的病症。在本文中,术语“对象”、“动物对象”和类似术语指人和非人类脊椎动物,例如哺乳动物,如非人类灵长类,竞技动物和商业动物,例如马、牛、猪、绵羊、啮齿类动物,和宠物(如狗和猫)。
合适的剂型,部分地取决于用途或给药的途径,例如经口、经皮、经粘膜、吸入或通过注射(肠胃外)。此类剂型应当使该化合物能够到达靶细胞。其它因素在本领域中是熟知的,包括需要考虑的事项,诸如毒性和延迟化合物或组合物发挥其效应的剂型。
载体或赋形剂可以被用于生产组合物。所述载体或赋形剂可以被选择为促进化合物的给药。载体的例子包括碳酸钙、磷酸钙、各种糖(例如乳糖、葡萄糖或蔗糖)、或淀粉类型、纤维素衍生物、明胶、植物油、聚乙二醇和生理相容性溶剂。生理上相容性溶剂的例子包括注射用水(wfi)无菌溶液、盐溶液和葡萄糖。
可以通过不同的路径施用组合物或组合物的组分,包括静脉内、腹膜内、皮下、肌内、经口、经粘膜、直肠、经皮或吸入。在一些实施方式中,优选注射剂或冻干粉针剂。对口服而言,例如,化合物可以被配制为常规口服剂型,例如胶囊、片剂,以及液体制剂,例如糖浆、酏剂和浓缩滴剂。
可以获得口服用途的药物制剂,例如通过将组合物或其组分与固体赋形剂组合,任选研磨所形成的混合物,以及在加入合适的辅剂之后(如需要)加工颗粒的混合物,从而获得片剂或糖衣丸。合适的赋形剂特别是,填料例如糖,包括乳糖、蔗糖、甘露糖醇或山梨醇;纤维素制剂,例如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍树胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠(cmc)和/或聚乙烯吡咯烷酮(pvp:聚维酮(povidone))。如果需要,可以加入崩解剂,例如交联的聚乙烯吡咯烷酮、琼脂或藻酸或它们的盐,例如藻酸钠。
作为选择,可以使用注射(肠胃外给药),例如肌内的、静脉内的、腹膜内的和/或皮下的。对于注射而言,本发明的组合物或其组分被配制为无菌液体溶液,优选在生理相容的缓冲液或溶液中,例如盐水溶液、hank溶液或ringer溶液。另外,组合物或其组分可以被配制为固体形式,并在使用之前一刻被再溶解或悬浮。也可以生产冻干粉形式。
给药也可以通过经粘膜、局部或经皮方式。对于经粘膜、局部或经皮给药,在配方中使用适合待穿透的屏障的穿透剂。这样的穿透剂在本领域中是普遍已知的,包括,例如,对于经粘膜给药,胆汁盐和梭链孢酸衍生物。另外,去垢剂可以用于促进穿透。经粘膜给药,例如,可以通过鼻喷雾或栓剂(经直肠或阴道)。
通过标准程序可以确定待施用的各种组分的有效量,考虑的因素例如所述化合物ic50、所述化合物的生物半衰期、对象的年龄、大小和体重以及与对象有关的病症。这些因素和其它因素的重要性对本领域普通技术人员而言是熟知的。一般而言,剂量将在被治疗的对象的大约0.01mg/kg至50mg/kg之间,优选在0.lmg/kg至20mg/kg之间。可以使用多次剂量。
本发明的组合物或其组分还可以与治疗相同疾病的其他治疗剂结合使用。这种结合使用包括在不同时间施用这些化合物以及一种或多种其他治疗剂,或同时使用这种化合物和一种或多种其他治疗剂。在一些实施方式中,可对本发明的一种或多种化合物或结合使用的其他治疗剂的剂量进行修改,例如,通过本领域技术人员已知的方法降低相对于单独使用的化合物或治疗剂的剂量。
要理解的是,结合使用或联用包括与其他疗法、药物、医学程序等一起使用,其中该其他疗法或程序可在不同于本发明的组合物或其组分的时间(例如,在短期内(如几个小时,如1、2、3、4-24小时)或在较长时间内(如1-2天、2-4天、4-7天、1-4周)或在与本发明的组合物或其组分相同的时间被施用。结合使用还包括与一次或不频繁施用的疗法或医学程序(如手术)一起使用,并伴随本发明的组合物或其组分在该其他疗法或程序之前或之后的短期或较长时间段内的施用。在一些实施方式中,本发明用于递送本发明的组合物或其组分和一种或多种其他药物治疗剂,它们通过相同或不同给药途径递送。
任何给药途径的结合施用包括通过相同给药途径将本发明的组合物或其组分和一种或多种其他药物治疗剂以任何制剂形式一起递送,包括两种化合物化学地相连且它们在施用时保持各自治疗活性的制剂。在一个方面,该其他药物疗法可与本发明的组合物或其组分共同施用。通过共同施用的结合使用包括施用共制剂(co-formulation)或化学上连接的化合物的制剂,或在短期内(例如,一个小时内、2小时内、3小时内、直至24小时内)施用两种或多种独立制剂形式的化合物,它们以相同或不同的途径给药。
独立制剂的共同施用包括经由一个装置的递送的共同施用,例如相同吸入装置、相同注射器等,或相对彼此短期内由不同装置施用。通过相同给药途径递送的本发明的化合物和一种或多种额外的药物疗法的共制剂包括将材料一起制备从而它们可通过一个装置被施用,包括不同化合物组合在一种制剂中,或化合物被修饰从而使得它们在化学上连接在一起但仍保持各自的生物学活性。这种化学上连接的化合物可包括将两个活性成分分开的连接体,该连接体在体内基本维持,或在体内可能降解。
实施例
实施例1.胆甾-3,6-二酮在谷氨酸诱导ht-22氧化应激损伤模型中的保护作用
取液氮复苏后中皿传代3次的ht-22细胞,使用前观察细胞状态。如果胞体圆润饱满,突触完整,几乎没死细胞,则用0.5ml浓度为0.25%的胰酶消化半分钟,吹散成单细胞悬液,收集到15ml离心管,加完全培养基至3ml,1000rpm离心3min,去上清,将沉淀均匀分散在4ml完全dmem培养基(dmem+10%fbs+1%p/s),取0.8ml细胞悬液用于传代,再取适量悬液加入到完全dmem培养基中,稀释至4*104cells/ml,种植在48孔板中(200μl/孔),24小时后用于实验。
首先将胆甾-3,6-二酮溶解于dmso中,使其终浓度为10mm作为药物储备液,将该药物储备液用完全dmem培养基稀释1000倍,使药物测试浓度为10μm。做如下分组处理:a)control组:细胞全量换完全dmem培养基;b)模型组(glu):细胞全量换带有溶剂(dmso)的完全dmem培养基;c)药物组(steroid):细胞全量换带有10μm甾体的完全dmem培养基;d)阳性药物组(亚甲蓝mb):细胞全量换带有0.2μm阳性药物(mb)的完全dmem培养基。
全量换上述4组溶液,孵育半小时后,加入谷氨酸(glu)使终浓度为3mm。随后,在5%co2浓度,37℃恒温下培养24小时,在相差显微镜下观察细胞形态,拍照(图1a)。接着,每孔加入20μl浓度为5mg/ml的mtt溶液(pbs配制),孵育3小时,去上清,每孔加200μl的dmso,轻轻震荡5min至固体完全溶解,然后用酶标仪在490nm波长下测各孔的吸光值,取三个孔的平均值进行细胞存活率计算,细胞存活率=od各浓度/odcontrol*100%,取四批细胞数据用于统计分析(如图1b所示)。以及求出胆甾-3,6-二酮的ec50(图1c)。
结果表明,药物组以及阳性药物组与对照组相比,细胞形态学差异不大,并且形态学观察结果与mtt试验结果一致。mtt试验结果表明,模型组的细胞存活率明显降低,而胆甾-3,6-二酮明显改善了由氧化应激造成的细胞损伤,并提高了ht-22细胞的存活率。
实施例2.胆甾-3,6-二酮在钾剥夺引起的小脑颗粒神经元凋亡损伤模型中的保护作用
取出生7天的大鼠,用大手术剪断头后,用眼科小剪从椎孔往左右耳朵上缘剪开,然后用镊子弄开上面大脑上层,暴露出脑组织,取出小脑组织放入装有无酚红dmem(当解剖液用)的置于冰袋上的中皿里。
用眼科镊去除小脑上的脑膜和血管后,用组织剪剪碎小脑组织。将组织转移入浓度为0.25%的胰酶中,37℃消化15分钟,往里加完全bme培养基至15ml,紧接着加入100μl的dnasei(8mg/ml),用滴管吹散组织团,随后1000rpm离心三秒,转移上层悬液至另一离心管,1000rpm离心5分钟,去除上清得到细胞,往里加5ml完全bme培养基,轻轻吹打细胞至均匀(约30次)。用细胞计数器计数,调整细胞浓度至5*105个/ml。
将细胞种植到pll(l-多聚赖氨酸)包被过的培养板上,周围一圈加灭菌过的水液封,置于37℃、5%co2、95%湿度的培养箱中培养,24小时后加入ara-c使其终浓度为10μm。
神经元培养至第7天加葡萄糖至5mm,第8天用于实验,做如下分组处理:25k组:细胞全量换含25mmkcl的完全bme培养基;5k组:细胞全量换含5mmkcl的完全bme培养基;甾体组(steroid):细胞全量换含5mmkcl的完全bme培养基+10μm甾体。
上述处理24小时后,在相差显微镜观察细胞形态(图2a),用mtt法测细胞存活率来评价药物促进神经元存活的能力(图2b),用hoechst33342染色来评价药物对抗钾剥夺诱导小脑颗粒神经元凋亡的能力(图2c及2d)。
mtt法测细胞存活率:经过上述处理24小时,在相差显微镜下拍照后,加入5mg/ml的mtt使终浓度为0.5g/l,37℃下孵育3小时,随后用多功能酶标仪在490nm下测定各组的od值。细胞存活率的计算方法如下:细胞存活率(%)=各处理组od值/25k组od值*100%。用五批细胞数据做统计学分析,初步评价药物的神经保护活性。结果表明,胆甾-3,6-二酮可以明显提高小脑颗粒神经元细胞的存活率(图2b)。
hoechst33342染色:经过上述处理24小时,在在相差显微镜下拍取荧光照片后,加入hoechst33342使终浓度为2μg/ml,37℃染色15分钟后在相差荧光显微镜350nm波长下拍照,计算细胞凋亡率=白色凋亡信号个数/总细胞个数*100%。用三批细胞数据做统计学分析,初步评价药物的神经保护活性。结果表明,胆甾-3,6-二酮可以明显抑制小脑颗粒神经元细胞的凋亡(图2c及2d)。
实施例3.胆甾-3,6-二酮在谷氨酸引起的大脑皮质神经元兴奋性毒性模型中的保护作用
实验前,将完全dmem培养基、5ml0.25%胰酶放于37℃水浴锅加热,将手术器械用75%乙醇消毒,吹干包被的孔板或皿,将无酚红dmem放于冰袋上降温。
取出生12小时内的大鼠,用大手术剪断头后,用眼科小剪从椎孔往左右耳朵上缘剪开,同时沿着颅骨中缝剪开,然后用镊子翻开颅骨,暴露出脑组织,取出大脑组织放入装有无酚红dmem(当解剖液用)的置于冰袋上的中皿里。
用眼科镊去除大脑上的脑膜、血管、海马等组织,剥离出大脑皮层后,用组织剪剪碎皮层组织为1mm3大小。然后移到5ml胰酶消化液(0.25%)中于37℃消化15min,随后加入含有fbs(10%)和dnasei(8mg/ml,100μl)的解剖液终止消化并轻轻吹散为单细胞悬液。用1000rpm离心3s,弃沉淀,悬液1200rpm离心5min。弃上清,沉淀分散于10%fbs的dmem培养基中轻柔吹打混匀,1000rpm离心3s后,在完全dmem培养基中稀释细胞数目为3*e5左右细胞悬液。悬液种植于多聚赖氨酸(5mg/l)包被的48孔板中。置于含37℃、5%co2、湿度为95%的细胞培养箱中培养,4小时后,培养基全部换成不含血清的neurobasala培养基(2%b27,1%glutamax,1%p/s),接种24小时后加入10μmol/l的阿糖胞苷(ara-c)抑制非神经元细胞生长,每隔3天进行半量换液。培养至第八天进行试验。
取培养7天的大脑皮质神经元,在显微镜下观察,细胞圆润,突触明显,分布均匀,即可用于实验。做如下分组处理:a)control组:预敷无mg2+的locke,sbuffer液;b)谷氨酸组glu:预敷无mg2+的locke,sbuffer液+200μmglu;c)mk801(dizocilpine)组:预敷含10μm的mk801且无mg2+的locke,sbuffer+200μmglu;d)甾体组:预敷含10μm的甾体且无mg2+的locke,sbuffer+200μmglu。
取培养7天的大脑皮质神经元,收集各孔条件培养基,用无mg2+的locke,sbuffer液洗涤细胞三次,然后用无mg2+的locke,sbuffer液配置的药物溶液37℃预敷20分钟,之后加入200μm的谷氨酸,10μm甘氨酸,置于37℃培养箱处理30分钟,随后换回原来的条件培养基继续培养24小时,显微镜下观察细胞形态(图3a),用mtt法测定各组细胞存活率(图3b),用五批细胞数据做统计学分析,初步评价药物的神经保护活性。
结果表明,胆甾-3,6-二酮可以保持大脑皮质神经元细胞的完整性,增加大脑皮质神经元细胞存活率,相比于谷氨酸组差异明显。证明了胆甾-3,6-二酮对谷氨酸造成的大脑皮质神经元兴奋性毒性模型中的神经保护作用。
参考文献
zhangwei,etal,steroids,2014,86,39-44;
rmartinez-pascual,etal,steroids,2017,122,24-33;
jgscbuchanan,etal,quarterlyreviewschemicalsociety,1969,23(4):522-536
zhangwei,etal,steroids,2014,86,39-44
zakaria,etal,worldappliedsciencesjournal,2011,15(4):496-501
zhangzhaohui,etal,zhongguohaiyangyaowu,1999,18(4):11-13
shidayong,etal,chinesejournalofoceanologyandlimnology,2011,29(3):674-678
pengshikaung,americanjournalofclinicalnutrition,1979,32(5):1033-1042
fukuim,etal..europeanjournalofpharmacology,2009,617(1):1-11.
breyera,etal.phytomedicine,2007,14(4):250-255
alhadidiq,etal.translationalstrokeresearch,2016,7(1):33-41
dragottoj,etal.springerinternationalpublishing,2015:513-523
kritisaa,etal.frontiersincellularneuroscience,2015,9:91
chamorroá,etal.thelancetneurology,2016,15(8):869-881
- 还没有人留言评论。精彩留言会获得点赞!