一种利用无血清培养基生产PEDV灭活疫苗的方法与流程
本发明涉及生物技术领域,具体涉及一种利用无血清培养基生产pedv灭活疫苗的方法。
背景技术:
猪流行性腹泻(ped)是由猪流行性腹泻病毒(pedv)引起的急性和高度传染性的肠道病毒性疾病,其症状包括腹泻,呕吐,厌食,脱水和仔猪体重减轻。虽然不同年龄段的猪都可能受到不同程度的感染并出现症状,但仔猪的病情特别严重,其中死亡率高达100%,pedv主要通过小猪的肠粘膜表面进入宿主,主要导致肠上皮细胞损伤。虽然不同年龄段的猪都可能受到不同程度的感染并出现症状,但仔猪的病情特别严重,其中死亡率高达100%,pedv主要通过小猪的肠粘膜表面进入宿主,主要导致肠上皮细胞损伤。针对pedv的大爆发,我们通常可以采用疫苗策略来控制pedv,并且在中国已经广泛开展了用杀死或减毒的pedv疫苗进行疫苗接种,在一定程度上控制了pedv的大规模爆发。但随着中国pedv灭活或减毒二联疫苗的广泛使用,ped在全国范围内持续蔓延至2010年10月,当时出现变异株,pedv感染急剧增加,严重危害养猪业。虽然国内用于流行性腹泻的疫苗(包括二联灭活苗及二联活疫苗)得到了广泛的推广和应用,并且在一定范围和程度上减少了猪流行性腹泻的发病率,但是该病仍然未能得到完全控制,尤其在2010年10月至今,该病呈持续性,爆发性增长趋势。
通常,pedv采用vero细胞进行培养和增殖,进而灭活制备得到pedv灭活疫苗。目前,基于vero细胞培养pedv疫苗的生产过程多采用两阶段操作工艺,即:前期在有血清的培养基中使细胞增殖至所需密度;后期通过洗涤去除血清成分及代谢废物,更换为低血清或无血清培养基以支持病毒在细胞中感染和复制。然而,现有疫苗生产中,前期vero细胞的培养液以商业化的培养基配合小牛或者马血清进行培养和生产。血清组分的复杂性和不确定性及批次间的差异增加了疫苗等细胞产品生产及质量控制的难度,同时血清易引起细菌、真菌、病毒及支原体的污染,增加了疫苗生产的安全性隐患。并且血清本身价格也比较昂贵,这些均使得血清在pedv疫苗的生产和研究中的应用存在诸多不利。实践已证明无血清培养基不仅能在很大程度上避免或改善含血清培养基所带来的上述缺陷,也能取得较好的培养效果。并且由于其明确的成分组成,可避免血清的不同批次或不明组分对细胞培养及试验研究的影响,从而提高结果的可重复性。因此,基于pedv疫苗生产中血清使用所存在的诸多问题以及生产成本高昂,因此,尽量减少血清的用量一直是疫苗生产中研究的课题,低血清以及无血清培养基的开发和应用势在必行。
技术实现要素:
为解决以上技术问题,及现有技术中血清使用所存在的诸多问题以及生产成本高昂,本发明旨在提供一种利用无血清培养基生产pedv灭活疫苗的方法,该培养基不添加动物血清,极大地降低了生产成本,提高了生产的经济效益,并且还避免了血清使用所带来的诸多问题。
为解决以上技术问题,本发明采用如下技术手段:
一种利用无血清培养基生产pedv灭活疫苗的方法,所述方法包括如下步骤:
步骤(1),vero细胞的复苏;
步骤(2),vero细胞的传代扩增;
步骤(3),在vero细胞上接种pedv病毒毒株;
步骤(4),收获感染细胞培养上清液,病毒液进行澄清过滤;
步骤(5),灭活,即制备得到pedv灭活疫苗;
其中步骤(2)中的传代扩增和步骤(3)中病毒的增殖过程均采用本发明的无血清培养基。
所述无血清培养基由基础培养基,牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠组成,其中牛磺酸和亚硒酸钠的重量份配比比例为2-3:1。
所述的无血清培养基中:
所述的基础培养基imdm(giboc)或者是rpmi-1640,或者是二者的混合物;
所述的牛血清白蛋白的含量为8-15mg/ml;
所述的皮质醇的含量为15-25μg/ml;
所述的胰岛素的含量为10-20μg/ml;
所述的转铁蛋白的含量为10-15μg/ml;
所述的谷胱甘肽的含量为2-3mm;
所述的胰蛋白酶的含量为3-5μg/ml;
所述的牛磺酸的含量为20-30μg/ml;
所述的亚硒酸钠的含量为10-12μg/ml。
优选的,所述的无血清培养基中:
所述的基础培养基imdm(giboc)或者是rpmi-1640,或者是二者的混合物;
所述的牛血清白蛋白的含量为10mg/ml;
所述的皮质醇的含量为20μg/ml;
所述的胰岛素的含量为20μg/ml;
所述的转铁蛋白的含量为15μg/ml;
所述的谷胱甘肽的含量为3mm;
所述的胰蛋白酶的含量为4μg/ml;
所述的牛磺酸的含量为20μg/ml;
所述的亚硒酸钠的含量为10μg/ml。
所述的无血清培养基的制作方法是:步骤一,按重量份称取基础培养基干粉、牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠;步骤二,将称取的以上物质混合后,加超纯水至1000ml,搅拌溶解,调节ph值至7.0-7.2,而后采用0.22μm滤膜过滤除菌,4℃保藏。
本发明还涉及利用本发明所述的无血清培养基培养pedv病毒的方法,所述方法包括如下步骤:
步骤(1),vero细胞的复苏;
步骤(2),vero细胞的传代扩增;
步骤(3),在vero细胞上接种pedv病毒毒株;
步骤(4),收获感染细胞培养上清液,病毒液进行澄清过滤,即得到所述的pedv病毒液;
其中步骤(2)中的传代扩增和步骤(3)中病毒的增殖过程均采用本发明的无血清培养基。
基于以上技术方案,本发明具有如下优点和有益效果:
本发明的实施例1和实施例2的培养基均对pedv的增殖具有较好的增殖效果,其相比现有常用的小牛血清加dmem培养基,更能促进pedv的增殖,其增殖的病毒滴度明显升高,表明本发明的培养基可以替代传统的含血清培养基用于pedv的增殖和疫苗的制备,从而避免了疫苗生产过程中血清的使用所导致的免疫问题;其与本发明设置的对照实验组相比,进一步验证了谷胱甘肽的添加以及牛磺酸与亚硒酸钠的比例对于pedv细胞增殖的重要性,对比试验例1中未添加谷胱甘肽,且牛磺酸与亚硒酸钠的比例也存在差异,高于本发明,则其病毒增殖效果较本发明差;对比试验例2中牛磺酸与亚硒酸钠的比例为1:1,即牛磺酸使用不足,则导致病毒增殖不及预期,虽然其在0-12h阶段增殖较快,但是在病毒增殖后期的滴度上升较慢;对比试验例3中未添加谷胱甘肽,则病毒增殖不及预期,其早期增殖相对较慢,后期增殖也略显不足。以上试验结果表明,本发明的培养基中,谷胱甘肽的添加以及牛磺酸与亚硒酸钠的比例对于pedv细胞增殖的具有重要的意义,两者在病毒增殖培养中协同增效,取得了预料不到的培养效果。
附图说明:
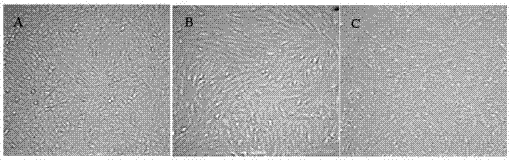
图1:pedv病毒培养的情况。a,对照组,正常的vero细胞;b,接毒24小时后,与对照组的正常细胞相比,出现较为明显的cpe;c,接毒48小时后,细胞变圆,有部分细胞漂浮脱落,出现拉网状等病理变化。
图2:ifa检测结果:a是正常的vero细胞对照;b是采用本发明实施例1培养基进行培养后的ifa检测结果;c是采用10%fbsdmem细胞培养液进行培养后的ifa检测结果,d是采用以下对照试验例所展示的培养基进行培养的ifa检测结果。
具体实施方式:
实施例1:一种适合大规模生产pedv疫苗的无血清培养基,其特征在于,所述无血清培养基由基础培养基,牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠组成,其中牛磺酸和亚硒酸钠的重量份配比比例为2:1。
所述的基础培养基imdm(giboc);
所述的牛血清白蛋白的含量为10mg/ml。
所述的皮质醇的含量为20μg/ml。
所述的胰岛素的含量为20μg/ml。
所述的转铁蛋白的含量为15μg/ml。
所述的谷胱甘肽的含量为3mm。
所述的胰蛋白酶的含量为4μg/ml。
所述的牛磺酸的含量为20μg/ml。
所述的亚硒酸钠的含量为10μg/ml。
本发明所述的适合大规模生产pedv疫苗的无血清培养基的制作方法是:步骤一,按重量份称取基础培养基干粉、牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠;步骤二,将称取的以上物质混合后,加超纯水至1000ml,搅拌溶解,调节ph值至7.0-7.2,而后采用0.22μm滤膜过滤除菌,4℃保藏。
实施例2:一种适合大规模生产pedv疫苗的无血清培养基,其特征在于,所述无血清培养基由基础培养基,牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠组成,其中牛磺酸和亚硒酸钠的重量份配比比例为3:1。
所述的基础培养基imdm(giboc);
所述的牛血清白蛋白的含量为10mg/ml。
所述的皮质醇的含量为20μg/ml。
所述的胰岛素的含量为20μg/ml。
所述的转铁蛋白的含量为15μg/ml。
所述的谷胱甘肽的含量为3mm。
所述的胰蛋白酶的含量为4μg/ml。
所述的牛磺酸的含量为30μg/ml。
所述的亚硒酸钠的含量为10μg/ml。
本发明所述的适合大规模生产pedv疫苗的无血清培养基的制作方法是:步骤一,按重量份称取基础培养基干粉、牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠;步骤二,将称取的以上物质混合后,加超纯水至1000ml,搅拌溶解,调节ph值至7.0-7.2,而后采用0.22μm滤膜过滤除菌,4℃保藏。
实施例3:pedv小规模增殖试验
试验毒株:pedvsx-yl株,获取自西北农林科技大学,该毒株分离自陕西杨凌某规模化养殖场。
试验细胞:vero细胞株,西北农林科技大学动物医学院兽医免疫实验室馈赠。
试验方法:
(一)vero细胞株的复苏:
(1)将从液氮中取出的vero细胞快速放入37℃水浴中,轻轻摇动使其快速解冻;
(2)300rpm离心10min;
(3)弃上清,加入37℃预温的细胞培养液(含5%fbsdmem),轻轻吹散vero细胞;
(4)将混匀后的细胞悬液加入到含有5ml5%fbsdmem细胞培养液的无菌t25瓶中,放于条件适宜的细胞培养箱中培养;
(5)传代两次后,将vero细胞悬液加于24孔板中,置于培养箱中培养至其细胞长成单层,采用本发明实施例1的培养基冲洗2次后,倒入本发明的实施例1的培养基进行培养。
(二)病毒的接种、培养和ifa检测:
将pedvsx-yl株病毒液采用本发明实施例1的培养基进行稀释,将vero细胞培养于24孔培养板,待细胞长成单层后,接种pedv,同时设不接毒的正常细胞对照,待细胞出现轻微病变后用乙醇(-20℃预冷)固定20min,然后用pbs洗涤3次,每次5min。加入pedvn蛋白单抗(西北农林科技大学馈赠),37℃温育60min,pbs洗三次,加入fitc标记的羊抗鼠igg。在倒置荧光显微镜下观察结果。具体结果参见附图1和2。
其中附图1展示了采用本发明实施例1培养基进行pedv病毒培养的情况,接毒24小时后,与对照组的正常细胞相比,出现较为明显的cpe,接毒48小时后,细胞变圆,有部分细胞漂浮脱落,出现拉网状等病理变化。
图2展示了ifa检测情况,其中a是正常的vero细胞对照;b是采用本发明实施例1培养基进行培养后的ifa检测结果;c是采用10%fbsdmem细胞培养液进行培养后的ifa检测结果,d是采用以下对照试验例所展示的培养基进行培养的ifa检测结果。以上结果对照表明,本发明实施例1的培养基进行培养后,其荧光强度和密度均明显高于现有技术中的血清培养基和对照试验例1的培养基,说明了:一方面,本发明实施例1的培养基,其在pedv增殖效果方面优于含血清的培养基,本发明的培养基完全能够替换现有的含血清培养基用于pedv病毒的培养和增殖,以及疫苗的制备。另一方面,本发明实施例1相对对照试验例1,其区别牛磺酸和亚硒酸钠的比例差异以及谷胱甘肽的添加,其结果的差异表明,本发明实施例1中牛磺酸和亚硒酸钠的比例以及谷胱甘肽的添加对于pedv病毒的增殖具有重要的影响,两者之间的恰当比例和谷胱甘肽的添加对于pedv病毒的增殖具有协同增效的作用,也证明了本发明的培养基在pedv病毒增殖方面取得了本领域技术人员所预料不到的技术效果。
以下阐述对照试验例1:一种无血清培养基,其特征在于,所述无血清培养基由基础培养基,牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,胰蛋白酶,牛磺酸和亚硒酸钠组成,其中牛磺酸和亚硒酸钠的重量份配比比例为4:1。
所述的基础培养基imdm(giboc);
所述的牛血清白蛋白的含量为10mg/ml。
所述的皮质醇的含量为20μg/ml。
所述的胰岛素的含量为20μg/ml。
所述的转铁蛋白的含量为15μg/ml。
所述的胰蛋白酶的含量为4μg/ml。
所述的牛磺酸的含量为40μg/ml。
所述的亚硒酸钠的含量为10μg/ml。
所述无血清培养基的制作方法是:步骤一,按重量份称取基础培养基干粉、牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,胰蛋白酶,牛磺酸和亚硒酸钠;步骤二,将称取的以上物质混合后,加超纯水至1000ml,搅拌溶解,调节ph值至7.0-7.2,而后采用0.22μm滤膜过滤除菌,4℃保藏。
实施例4:pedv灭活苗大规模生产试验
试验毒株:pedvsx-yl株,获取自西北农林科技大学,该毒株分离自陕西杨凌某规模化养殖场。
试验细胞:vero细胞株,西北农林科技大学动物医学院兽医免疫实验室馈赠。
试验方法:
(一)vero细胞株的复苏:
(1)将从液氮中取出的vero细胞快速放入37℃水浴中,轻轻摇动使其快速解冻;
(2)300rpm离心10min;
(3)弃上清,加入37℃预温的细胞培养液(含5%fbsdmem),轻轻吹散vero细胞;
(4)将混匀后的细胞悬液加入到含有5ml5%fbsdmem细胞培养液的无菌t25瓶中,放于条件适宜的细胞培养箱中培养;
(5)传代两次后,置于培养箱中培养至其细胞长成单层,采用本发明实施例1的培养基冲洗2次后,细胞贴壁后采用本发明实施例1的培养基更换瓶内培养液继续培养至细胞长成致密单层,然后消化,制成细胞悬液,将4个t125方瓶内3/4的细胞悬液注入1l本发明实施例1的培养基瓶内充分摇匀,最后将1l细胞悬液倒入10l转瓶中,塞好瓶塞放入转瓶机进行培养。
(二)vero细胞在生物反应器中的培养
称取适量cytodexⅰ型微载体(购自ge)置反应器罐内,并加入1l酸碱缓冲液(pbs),校准溶氧、ph值电极,制备碱瓶(7.5%的碳酸氢钠溶液),罐体安装完毕后在121℃高压锅内灭菌,30mim后取出进行无菌测试(加入500ml培养基进行预培养,搅拌速度为50r/h、溶氧浓度为50%、ph值为7.20、温度为37℃,10h后不见污染情况),然后排出罐内pbs,再将转瓶中消化下来的细胞悬液混匀后注入到配制的实施例1的培养基中,利用管道将其注入反应器中,调节气体(压缩空气、o2、n2、co2)并改为自动,碱瓶调至自动添加,调节好转速即可进行微载体悬浮培养,每隔15分钟监测一次细胞密度。
(三)pedv的接种和培养
待生物反应器中的培养vero细胞增殖至60细胞/球的细胞密度时,向生物反应器中加入采用本发明实施例1的培养基进行稀释的pedvsx-yl株病毒液,稀释后病毒液的滴度为105.5tcid50,稀释后的病毒液与生物反应器中的细胞培养物的体积比为1:50。加入稀释病毒液后,调节好转速进行病毒培养,培养24-26小时,收获病毒培养液。
(四)pedv灭活疫苗的制备
将收获的病毒培养液在-80℃,反复冻融三次,6000rpm离心20min,收集上清液,即为病毒液;病毒液经20倍浓缩后,加入0.2%甲醛37℃灭活24小时得到pedv疫苗原液;将制得的pedv疫苗原液和佐剂montanideisa206佐剂按1.5:1的体积比,无菌环境中,搅拌混合均匀,即制得猪流行性腹泻灭活疫苗。
(五)疫苗检验方法及结果
5.1性状检验灭活疫苗外观呈粉红色乳胶状。
5.2无菌检验灭活疫苗按照现《中华人民共和国兽药典》2010年版第三部附录进行检验,t.g、g.p管和g.a斜面培养基均未观察到菌落。
5.3支原体检验灭活疫苗按照《中华人民共和国兽药典》2010年版第三部附录进行检验,未发现小瓶和小管培养物颜色出现明显变化,移植的液体培养物在固体培养基上无“煎蛋”状支原体菌落。
5.4外源病毒检验灭活疫苗按照《中华人民共和国兽药典》2010年版第三部附录进行检验,均无猪瘟病毒、牛病毒性腹泻病毒、猪细小病毒、猪伪狂犬病毒、轮状病毒、猪传染性胃肠炎病毒等污染。证明毒种是纯净的。
5.5安全检验取猪流行性腹泻中和抗体、抗原均为阴性的3日龄猪24头,随机分成4组,每组6头,肌注10头份疫苗,临床观察14日,均100%健活,未见不良反应发生。
实施例5:pedv弱毒疫苗大规模制备试验
试验毒株:pedvcv777株,获取陕西诺威利华生物科技有限公司保藏的毒株。
试验细胞:vero细胞株,西北农林科技大学动物医学院兽医免疫实验室馈赠。
试验方法:
(一)vero细胞株的复苏:
(1)将从液氮中取出的vero细胞快速放入37℃水浴中,轻轻摇动使其快速解冻;
(2)300rpm离心10min;
(3)弃上清,加入37℃预温的细胞培养液(含5%fbsdmem),轻轻吹散vero细胞;
(4)将混匀后的细胞悬液加入到含有5ml5%fbsdmem细胞培养液的无菌t25瓶中,放于条件适宜的细胞培养箱中培养;
(5)传代两次后,置于培养箱中培养至其细胞长成单层,采用本发明实施例1的培养基冲洗2次后,细胞贴壁后采用本发明实施例1的培养基更换瓶内培养液继续培养至细胞长成致密单层,然后消化,制成细胞悬液,将4个t125方瓶内3/4的细胞悬液注入1l本发明实施例1的培养基瓶内充分摇匀,最后将1l细胞悬液倒入10l转瓶中,塞好瓶塞放入转瓶机进行培养。
(二)vero细胞在生物反应器中的培养
称取适量cytodexⅰ型微载体(购自ge)置反应器罐内,并加入1l酸碱缓冲液(pbs),校准溶氧、ph值电极,制备碱瓶(7.5%的碳酸氢钠溶液),罐体安装完毕后在121℃高压锅内灭菌,30mim后取出进行无菌测试(加入500ml培养基进行预培养,搅拌速度为50r/h、溶氧浓度为50%、ph值为7.20、温度为37℃,10h后不见污染情况),然后排出罐内pbs,再将转瓶中消化下来的细胞悬液混匀后注入到配制的实施例1的培养基中,利用管道将其注入反应器中,调节气体(压缩空气、o2、n2、co2)并改为自动,碱瓶调至自动添加,调节好转速即可进行微载体悬浮培养,每隔15分钟监测一次细胞密度。
(三)pedv的接种和培养
待生物反应器中的培养vero细胞增殖至60细胞/球的细胞密度时,向生物反应器中加入采用本发明实施例1的培养基进行稀释的pedvcv777株病毒液,稀释后病毒液的滴度为105.5tcid50,稀释后的病毒液与生物反应器中的细胞培养物的体积比为1:50。加入稀释病毒液后,调节好转速进行病毒培养,培养24-26小时,收获病毒培养液,收获的病毒液用0.45/1.0微米的滤膜过滤澄清。
(四)pedv弱毒疫苗的制备
取过滤后的病毒液,添加2%(w/w)甘露醇,3%(w/w)右旋糖酐,2%(w/w)谷氨酸钠,1%(w/w)尿素,0.2%(w/w)盐酸精氨酸,0.2%(w/w)牛血清白蛋白等保护剂成分,制成冻干半成品,该半成品不含有血清。分装至西林瓶中进行冻干,每西林瓶分装0.5ml,经以下程序进行冻干:预冻:-45℃,3h;干燥温度:-45℃~30℃;干燥过程:维持-45℃,0.01mpa3h,然后每小时升高2℃。
使用时,采用灭菌注射用水进行复溶。(六)疫苗检验方法及结果
6.1无菌检验弱毒疫苗按照现《中华人民共和国兽药典》2010年版进行检验,t.g、g.p管和g.a斜面培养基均未观察到菌落。
6.2支原体检验弱毒疫苗按照《中华人民共和国兽药典》2010年版进行检验,未发现小瓶和小管培养物颜色出现明显变化,移植的液体培养物在固体培养基上无“煎蛋”状支原体菌落。
6.3外源病毒检验弱毒疫苗按照《中华人民共和国兽药典》2010年版进行检验,均无猪瘟病毒、牛病毒性腹泻病毒、猪细小病毒、猪伪狂犬病毒、轮状病毒、猪传染性胃肠炎病毒等污染。证明毒种是纯净的。
6.4安全检验取猪流行性腹泻中和抗体、抗原均为阴性的3日龄猪24头,随机分成4组,每组6头,肌注10头份疫苗,临床观察14日,均100%健活,未见不良反应发生。
实施例7:不同培养基培养vero细胞生产pedvcv777病毒的比较
试验毒株:pedvcv777株,获取陕西诺威利华生物科技有限公司保藏的毒株。
试验细胞:vero细胞株,西北农林科技大学动物医学院兽医免疫实验室馈赠。
试验方法:在96孔板使用本发明实施例1-2,10%新生牛血清+dmem,对照试验例1,对照试验例2和对照试验例3的培养基培养vero细胞,每孔接种50μlpedvcv777病毒,密封后培养板置于37℃、5%二氧化碳培养箱中培养,每隔12小时测定细胞上清液中的病毒滴度。
设置对比试验例:
对比试验例1:参见实施例3中的对比试验例1。
对比试验例2:一种无血清培养基,其特征在于,所述无血清培养基由基础培养基,牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠组成,其中牛磺酸和亚硒酸钠的重量份配比比例为1:1。
所述的基础培养基imdm(giboc);
所述的牛血清白蛋白的含量为10mg/ml。
所述的皮质醇的含量为20μg/ml。
所述的胰岛素的含量为20μg/ml。
所述的转铁蛋白的含量为15μg/ml。
所述的谷胱甘肽的含量为3mm。
所述的胰蛋白酶的含量为4μg/ml。
所述的牛磺酸的含量为10μg/ml。
所述的亚硒酸钠的含量为10μg/ml。
所述的无血清培养基的制作方法是:步骤一,按重量份称取基础培养基干粉、牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,谷胱甘肽,胰蛋白酶,牛磺酸和亚硒酸钠;步骤二,将称取的以上物质混合后,加超纯水至1000ml,搅拌溶解,调节ph值至7.0-7.2,而后采用0.22μm滤膜过滤除菌,4℃保藏。
对比试验例3:一种无血清培养基,其特征在于,所述无血清培养基由基础培养基,牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,胰蛋白酶,牛磺酸和亚硒酸钠组成,其中牛磺酸和亚硒酸钠的重量份配比比例为2:1。
所述的基础培养基imdm(giboc);
所述的牛血清白蛋白的含量为10mg/ml。
所述的皮质醇的含量为20μg/ml。
所述的胰岛素的含量为20μg/ml。
所述的转铁蛋白的含量为15μg/ml。
所述的胰蛋白酶的含量为4μg/ml。
所述的牛磺酸的含量为20μg/ml。
所述的亚硒酸钠的含量为10μg/ml。
所述的无血清培养基的制作方法是:步骤一,按重量份称取基础培养基干粉、牛血清白蛋白,皮质醇,胰岛素,转铁蛋白,胰蛋白酶,牛磺酸和亚硒酸钠;步骤二,将称取的以上物质混合后,加超纯水至1000ml,搅拌溶解,调节ph值至7.0-7.2,而后采用0.22μm滤膜过滤除菌,4℃保藏。
试验结果:参加下表1,由表1的结果可知,pedvcv777病毒接种在不同的培养基中国,在接种12-48小时,均以本发明实施例1和2制备得到的培养基的病毒滴度最高,为6.5-7.2,本发明实施例1和2的病毒滴度均高于10%新生牛血清+dmem,对照试验例1,对照试验例2和对照试验例3的培养基。
表1pedvcv777病毒接种在vero细胞后不同培养基培养液上清中的病毒滴度(log2)
由以上表1的结果可知,本发明的实施例1和实施例2的培养基均对pedv的增殖具有较好的增殖效果,其相比现有常用的小牛血清加dmem培养基,更能促进pedv的增殖,其增殖的病毒滴度明显升高,表明本发明的培养基可以替代传统的含血清培养基用于pedv的增殖和疫苗的制备,从而避免了疫苗生产过程中血清的使用所导致的免疫问题;其与本发明设置的对照实验组相比,进一步验证了谷胱甘肽的添加以及牛磺酸与亚硒酸钠的比例对于pedv细胞增殖的重要性,对比试验例1中未添加谷胱甘肽,且牛磺酸与亚硒酸钠的比例也存在差异,高于本发明,则其病毒增殖效果较本发明差;对比试验例2中牛磺酸与亚硒酸钠的比例为1:1,即牛磺酸使用不足,则导致病毒增殖不及预期,虽然其在0-12h阶段增殖较快,但是在病毒增殖后期的滴度上升较慢;对比试验例3中未添加谷胱甘肽,则病毒增殖不及预期,其早期增殖相对较慢,后期增殖也略显不足。以上试验结果表明,本发明的培养基中,谷胱甘肽的添加以及牛磺酸与亚硒酸钠的比例对于pedv细胞增殖的具有重要的意义,两者在病毒增殖培养中协同增效,取得了预料不到的培养效果。
由于已经通过以上较佳实施例描述了本发明,在本发明的精神和/或范围内,任何针对本发明的替换/或组合来实施本发明,对于本领域的技术人员来说都是显而易见的,且包含在本发明之中。
- 还没有人留言评论。精彩留言会获得点赞!