一种靶向纳米药物载体及其制备方法和应用与流程
本发明涉及纳米药物技术领域,特别是涉及一种靶向纳米药物载体及其制备方法和应用。
背景技术:
肺癌是目前发病及致死率最高的癌症,尽管最近几年肺癌的早期诊断及治疗已经取得了一些进展,但仍然还存在很多没有解决的问题。目前临床上应用的抗肿瘤药物主要是细胞毒类化疗药物,该类药物选择性差,毒副作用大,容易引起不良反应。而抗体等蛋白类药物虽然特异性高、毒副作用小,但由于其分子质量大、结构复杂、容易引起免疫反应和产生耐药性等,且其制备工艺复杂以至于价格比较昂贵,难以被普通肿瘤患者所承受。
如何治疗肺癌已经成为人们迫切需要解决的问题。
技术实现要素:
本发明提供一种靶向纳米药物载体及其制备方法和应用,以解决现有技术中治疗肺癌的过程中毒副作用大、容易引起免疫反应和产生耐药性,或价格比较昂贵的问题。
为了解决上述问题,本发明公开了一种靶向纳米药物载体,包括:聚酰胺-胺型树枝状大分子、聚乙二醇和多肽探针;所述聚酰胺-胺型树枝状大分子外围的部分或全部氨基连接一个聚乙二醇分子,所述聚乙二醇的另一端连接所述多肽探针;所述多肽探针可与egfr高表达肺癌细胞或肺癌组织靶向结合。
优选地,所述多肽探针与所述聚酰胺-胺型树枝状大分子的摩尔比为1:4,所述聚乙二醇与所述聚酰胺-胺型树枝状大分子的摩尔比为1:30;
优选地,所述多肽探针包括:酪氨酸、谷氨酸、精氨酸、缬氨酸、苯丙氨酸、苯丙氨酸单元;
优选地,所述多肽探针中各氨酸的排列顺序依次为酪氨酸、谷氨酸、精氨酸、缬氨酸、苯丙氨酸、苯丙氨酸单元。
优选地,所述聚乙二醇的另一端与所述多肽探针化学键连接。
优选地,所述聚酰胺-胺型树枝状大分子为第3-6代聚酰胺-胺型树枝状大分子。
本发明实施例还公开了一种制备方法,应用于上述任一项所述的靶向纳米药物载体,包括:合成pamam-peg;其中,pamam为聚酰胺-胺型树枝状大分子,peg为聚乙二醇;合成多肽探针;使用马来酰胺活化所述pamam-peg,并与所述多肽探针按第一设定配比在室温下反应,以得到所述靶向纳米药物载体。
优选地,所述合成pamam-peg的步骤,包括:在甲醇和二甲基亚砜的混合溶剂中,所述pamam与经n-羟基琥珀酰亚胺活化的所述peg按第二设定配比在室温下反应,纯化,以得到所述pamam-peg。
优选地,所述合成多肽探针的步骤,包括:1)将树脂浸泡于二甲基甲酰胺溶液中溶胀若干分钟后排出所述二甲基甲酰胺溶液;2)将溶胀后的所述树脂放置于六氢吡啶占比20%的二甲基甲酰胺溶液中反应若干分钟,以去除氨基酸的保护基团,露出游离的氨基;3)使用二氯甲烷溶液和二甲基甲酰胺溶液交替清洗经步骤2)反应后的所述树脂各若干次;4)将脱离保护基团的氨基酸与苯并三氮唑-n,n,n’,n’-四甲基脲六氟磷酸盐(hbtu)等摩尔比混合,并在混合溶液中加入活化试剂与经步骤3)经过清洗后的所述树脂室温反应若干分钟;5)使用二氯甲烷溶液和二甲基甲酰胺溶液交替清洗经步骤4)反应后的所述树脂各若干次;6)重复执行上述步骤2)~步骤5),直至得到所述多肽探针。
本发明实施还公开了上述任一项所述的靶向纳米药物载体或上述任一项所述的制备方法在制备治疗肺癌药物放射靶向标记物中的应用。
与现有技术相比,本发明包括以下优点:
本发明实施例提供了一种靶向纳米药物载体及其制备方法和应用,靶向纳米药物载体包括聚酰胺-胺型树枝状大分子、聚乙二醇和多肽探针,聚酰胺-胺型树枝状大分子外围的部分或全部nh2基各自连接一个聚乙二醇分子,部分聚乙二醇的另一端连接多肽探针,多肽探针与聚酰胺-胺型树枝状大分子的摩尔比为1:4,聚乙二醇与聚酰胺-胺型树枝状大分子的摩尔比为1:30,多肽探针是能够与egfr高表达肺癌细胞或肺癌组织靶向结合的多肽。本发明实施例的靶向纳米药物载体具有靶向egfr高表达肺癌细胞或肺癌组织的作用,可以作为靶头增加药物载体如纳米材料、脂质体等egfr高表达肺癌细胞中的含量,再添加化学上可接受的辅料或佐剂制成新型的更有效的靶向抗癌药物。且本发明实施例的靶向纳米药物载体可以采用化学合成的方法制备得到,纯度高,分子量小,特异性强,无免疫原形,安全可靠。本发明的靶向药物纳米载体对肿瘤标志物egfr蛋白的靶向作用明显,选择性强,同时具有高的药物包载效率,而且几乎没有毒性,极大的提高了药物载体的安全性,为肺癌和其它egfr阳性肿瘤的诊断和治疗提供了新的选择。
附图说明
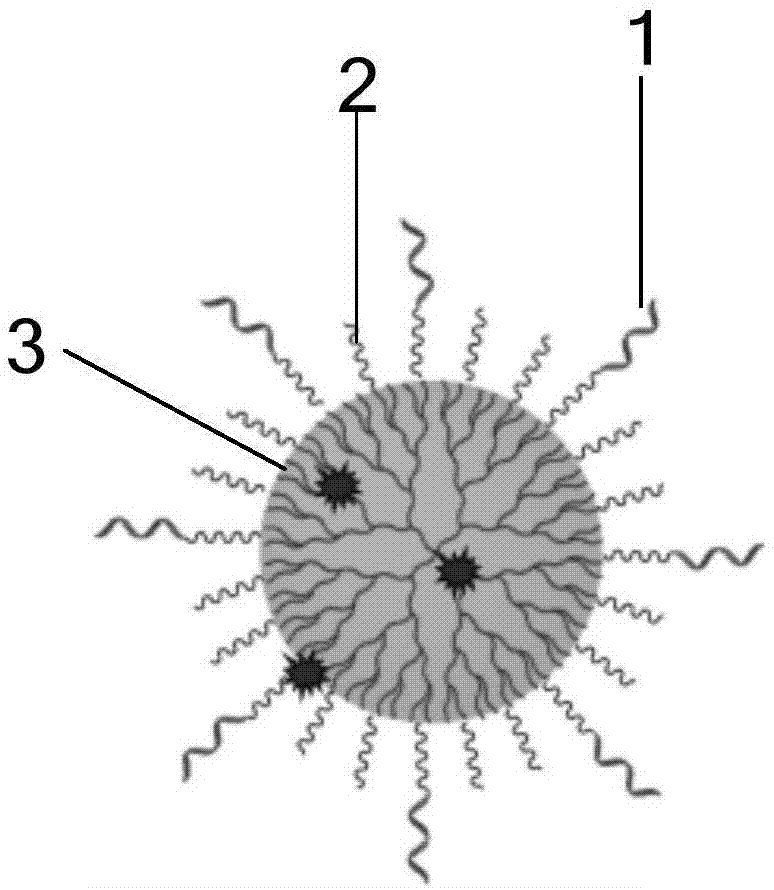
图1示出了本发明实施例提供的一种靶向药物纳米载体的结构示意图;
图2示出了本发明实施例提供的一种制备方法的步骤流程图;
图3示出了本发明实施例提供的一种测试结果示意图;
图4示出了本发明实施例提供的一种测试结果示意图;
图5示出了本发明实施例提供的一种靶向药物纳米载体与egfr蛋白结合能力的检测结果示意图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
实施例一
参照图1,示出了本发明实施例提供的一种靶向药物纳米载体的结构示意图,该靶向药物纳米载体可以包括:聚酰胺-胺型树枝状大分子3(pamam)、聚乙二醇2(peg)和多肽探针1,其中,pamam外围的部分或全部氨基各自连接一个peg分子,部分peg的另一端连接多肽探针。
在该靶向药物纳米载体中多肽探针1与pamam3的摩尔比为1:4,peg2与pamam3的摩尔比为1:30。
多肽探针1是能够与egfr高表达肺癌细胞或肺癌组织靶向结合的多肽,通过多肽探针1与egfr高表达肺癌细胞或肺癌组织靶向结合,从而可以将该靶向药物纳米载体作为靶头增加药物载体如纳米材料、脂质体等egfr高表达肺癌细胞中的含量,再添加化学上可接受的辅料或佐剂制成新型的更有效的靶向抗癌药物。
在本发明实施例的一种优选实施例中,多肽探针1可以包括酪氨酸、谷氨酸、精氨酸、缬氨酸、苯丙氨酸、苯丙氨酸单元,且上述各氨酸的排列顺序依次为酪氨酸、谷氨酸、精氨酸、缬氨酸、苯丙氨酸、苯丙氨酸单元,通过设定各氨酸如上述的排列顺序,从而可以实现多肽探针1靶向egfr蛋白,从而可以起到肺癌细胞或肺癌组织的靶向作用。
在本发明实施例的一种优选实施例中,靶向药物纳米载体还可以包括检测剂,检测剂可以包括赋形剂、稀释剂、载体、调味剂、粘合剂和填充剂中的任意一种,也可以为任意多种的组合,本发明实施例对此不加以限制。
赋形剂、稀释剂、载体、调味剂、粘合剂和填充剂可以作为药学上的辅料,与靶向药物纳米载体共同组成新型的更有效的靶向抗癌药物。
在本发明实施例的另一种优选实施例中,peg2的另一端可以与多肽探针1的化学键连接,pamam3可以为第3-6代pamam,优选为第4代pamam。
本发明实施例提供的靶向纳米药物载体具有靶向egfr高表达肺癌细胞或肺癌组织的作用,可以作为靶头增加药物载体如纳米材料、脂质体等egfr高表达肺癌细胞中的含量,再添加化学上可接受的辅料或佐剂制成新型的更有效的靶向抗癌药物,对肿瘤标志物egfr蛋白的靶向作用明显,选择性强,同时具有高的药物包载效率,而且几乎没有毒性,极大的提高了药物载体的安全性,为肺癌和其它egfr阳性肿瘤的诊断和治疗提供了新的选择。
实施例二
参照图2,示出了本发明实施例提供的一种制备方法的步骤流程图,该制备方法可以应用于上述实施例一中任一项所述的靶向药物纳米载体,具体可以包括如下步骤:
步骤201:合成pamam-peg;其中,pamam为聚酰胺-胺型树枝状大分子,peg为聚乙二醇。
在本发明实施例中,以第四代聚酰胺-胺型(g4pamam)树枝状大分子使用发散方法通过重复迈克尔反应加入氨基与丙烯酸甲脂合成,其次通过透析后1h-nmr光谱法进行了pamamg4的结构鉴定。
在甲醇(meoh)和二甲基亚砜(dmso)(1:1)的溶剂混合物中,pamam树枝状聚合物的外围氨基基团与n-羟基琥珀酰亚胺(nhs)活化的peg第二设定配比在室温反应15分钟合成pamam-peg。并用sephadexg-50柱纯化以除去未反应的peg。
可以理解地,第二设定配比可以为1:64,只需按配比反应合成pamam-peg,本发明实施例对于第二设定配比的具体值不加以限定。
进而执行步骤202。
步骤202:合成多肽探针。
在发明实施例中,通过以下方式合成多肽探针:
1)将树脂浸泡于二甲基甲酰胺(dmf)溶液中充分溶胀若干分钟(本发明实施例优选15分钟)后排出dmf溶液;
2)将溶胀后的树脂放置于六氢吡啶占比20%的dmf溶液中反应10分钟,以去除氨基酸的保护基团,露出游离的氨基;
3)使用二氯甲烷(dcm)溶液和dmf溶液交替清洗经步骤2)反应后的树脂各若干次(本发明实施例优选3次);
4)将脱离保护基团的氨基酸与苯并三氮唑-n,n,n’,n’-四甲基脲六氟磷酸盐(hbtu)等摩尔比混合,并在混合溶液中加入活化试剂与经步骤3)经过清洗后的所述树脂室温反应若干分钟(本发明实施例优选50分钟);
5)使用dcm溶液和dmf胺溶液交替清洗经步骤4)反应后的树脂各若干次(本发明实施例优选3次);
6)重复执行上述步骤2)-步骤5),直至合成多肽探针。
待合成完毕后,侧链保护基团被除去,并用95%三氟乙酸,2.5%超纯水,2.5%三异丙基硅烷将多肽从树脂上裂解下来备用,并执行步骤203。
步骤203:使用马来酰胺活化所述pamam-peg,并与所述多肽探针按第一设定配比在室温下反应,以得到所述靶向纳米药物载体。
为了合成靶向药物纳米载体,通过马来酰胺(mal)活化pamam-peg,并与多肽探针按设定第一设定配比在室温下连续搅拌下反应30小时,将反应混合物透析并冻干,得到靶向药物纳米载体树枝状聚合物,为白色固体。
可以理解地,第一设定配比可以为1:16,只需按配比反应合成靶向药物纳米载体即可,本发明实施例对于第一设定配比的具体值不加以限定。
靶向药物纳米载体的测试过程如下:
参照图3和4,示出了本发明实施例提供的一种测试结果示意图,通过控制环境ph调节带有多肽探针的纳米载体的药物释放能力,其具体步骤如下:
1)将修饰了多肽探针的pamam分别用sem和动态光散射表征,保证其尺寸结构;
2)将包载了广谱药物dox的纳米载体分别浸入ph值为5.5和ph值为7.4的缓冲液中24h;
3)测定dox的释放量,并统计曲线,比较两种环境下的药物释放能力。
测试结果可以如图3、图4所示,靶向药物纳米载体在酸性条件下,靶向药物纳米载体上包载的dox释放速率明显比ph值为7.4更快,ph值可能是带正电的dox分子在pamam树枝在酸性环境中,通过质子化排斥加速dox从疏水树枝状大分子的释放提高药效。
参照图5,示出了本发明实施例提供的一种靶向药物纳米载体与egfr蛋白结合能力的检测结果示意图,利用表面等离子体共振成像技术测试带有多肽探针的靶向药物纳米载体与egfr蛋白间结合能力的具体步骤如下:
a)将纳米载体溶解到ddh2o中,浓度为1-1000μm;
b)将样品点在一张3d芯片表面上,每种样品重复3个点,4℃孵育12小时后,用10xpbs,1xpbs,超纯水清洗。然后将芯片用1m盐酸氨基乙醇封闭30分钟,然后用超纯水清洗5次,最后用干净氮气吹干;
c)将芯片安装在spri仪器上,测定spri角并调节至最佳光学位置,在检测区域选取相关检测点,包括样品点与空白点,设置实验流速为2μl/s;
d)选择pbs为缓冲液通入流通池至基线稳定后依次通过浓度为55.6nm、22.8nm、11.4nm、5.70nm和2.85nm的egfr蛋白进行检测,结合时间为300秒,解离时间为300秒,每个浓度间通入磷酸进行重生。
检测结果如图5所示,靶向药物纳米载体的spri信号随着人egfr蛋白浓度的增加逐渐增强,平衡解离常数kd为7.48×10-10摩尔/升,说明本发明实施例的靶向药物纳米载体对egfr蛋白是强结合能力的,可以作为靶向egfr肿瘤的药物载体用于相关的研究应用。
本发明实施例提供的制备方法,靶向纳米药物载体可以采用化学合成的方法制备得到,纯度高,分子量小,特异性强,无免疫原形,安全可靠。
对于前述的各方法实施例,为了简单描述,故将其都表述为一系列的动作组合,但是本领域技术人员应该知悉,本发明并不受所描述的动作顺序的限制,因为依据本发明,某些步骤可以采用其他顺序或者同时进行。其次,本领域技术人员也应该知悉,说明书中所描述的实施例均属于优选实施例,所涉及的动作和模块并不一定是本发明所必须的。
本说明书中的各个实施例均采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似的部分互相参见即可。
最后,还需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、商品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、商品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、商品或者设备中还存在另外的相同要素。
以上对本发明所提供的一种一种靶向纳米药物载体、一种制备方法及一种靶向纳米药物载体应用,进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!