一种抗癌药物纳米粒的制备方法与流程
本发明涉及抗癌药物领域。
背景技术:
肿瘤一直是严重威胁人类生命的重大疾病。目前的抗肿瘤药物存在靶向性差、疗效差和治疗不可视的问题,影响着抗癌治疗的效果和发展。
已有研究表明,肿瘤部位与正常组织相比,在解剖学和病理学上存在很大差异。当肿瘤直径增长至1.0~2.0mm时,为了获得足够的营养物质和氧气,肿瘤血管快速无序增殖,在肿瘤组织中形成大量内皮间隙较大、结构不完整的血管;此外,肿瘤组织中淋巴管缺乏致使淋巴液回流受阻,两者结合使得血液循环中的大分子物质容易渗透进入肿瘤组织并长期滞留,此现象称为增强渗透和滞留效应。
氧化锌作为纳米材料重要组成部分,因其具有优良理化、生物和光电、催化等优异性能在多个领域具有广泛应用潜力。氧化锌是被美国食品药品监督管理局认证的可安全应用于食品药品的五种金属氧化物之一,这为zno作为药物载体材料扫除了生物安全性的障碍。此外,良好的生物可降解性、高载药量、各种纳米形态以及合成的便捷性使其在作为药物载体的应用中的研究越来越深入。
技术实现要素:
本发明要解决现有抗癌药物在临床应用上存在靶向性差、疗效差和治疗不可视的的技术问题,而提供一种抗癌药物纳米粒的制备方法。
一种抗癌药物纳米粒的制备方法,具体按以下步骤进行:
一、将锌源化合物溶解在无水乙醇与水的混合溶液中,加入表面活性剂和封端剂,然后采用碱性溶液调整溶液至碱性,加热回流,得到封端的纳米粒,然后离心,收集沉淀,洗涤,晾干;其中封端剂为l-半胱氨酸或n-乙酰-l-半胱氨酸;锌源化合物与封端剂的摩尔比为(1~10)∶1;
二、将步骤一晾干后的纳米粒超声分散到乙腈溶液中,加入乙酸酐和缚酸剂,在室温条件下搅拌反应,然后离心,收集沉淀,再用乙腈洗涤两次,室温下自然干燥;
三、将步骤二处理后的纳米粒分散在无水二甲基亚砜中,加入n,n-羰基二咪唑,加热回流;再冷却至室温,加入带羟基的抗癌药物,水浴条件下搅拌反应,然后离心得到沉淀物,采用乙醇洗涤三次,室温干燥,得到所述抗癌药物纳米粒。
本发明首先采用n-乙酰-l-半胱氨酸或l-半胱氨酸通过其上的巯基与氧化锌发生配位结合对其进行封端,然后为了防止接下来的反应中l-半胱氨酸分子上的氨基与羧基发生分子内成环,使得对合成反应起关键作用的羧基消失,影响药物结合的产率,需要将l-半胱氨酸上的氨基进行保护,方法是通过乙酸酐引入乙酰基取代氨基上的氢,形成n-乙酰-l-半胱氨酸。接下来使用n,n-羰基二咪唑将氨基酸上的羧基活化后与带有羟基的药物发生酯化反应链接在一起制成复合纳米粒。
本发明的有益效果是:
本发明的目的是提供一种由氧化锌-n-乙酰-l-半胱氨酸-药物纳米粒的制备方法和在癌症治疗方面的应用。本发明提出的氧化锌-n-乙酰-l-半胱氨酸-药物纳米粒是采用n-乙酰-l-半胱氨酸作为封端剂,其中n-乙酰-l-半胱氨酸的巯基一端与氧化锌以配位键结合,而羧基一端与药物的羟基以酯键结合。
本发明制备的载药纳米粒具有以下优点:1)本发明使用的氧化锌、n-乙酰-l-半胱氨酸均为美国食品药品监督管理局认证的可安全应用于食品药品的材料。2)本发明制备的载药纳米粒的粒径为50-500nm。现代研究表明,肿瘤部位新生血管的内皮不完整,所以粒径处于该范围的纳米粒能通过增强渗透效应进入肿瘤部位,而不能进入正常组织。此外,该粒径的纳米粒很难被淋巴系统清除,故能长期滞留在肿瘤部位。纳米粒能通过增强渗透和滞留效应被动靶向于肿瘤部位,从而增强对肿瘤部位的选择性和疗效,降低对正常组织的副作用。3)研究表明,氧化锌纳米粒具有良好的抗癌、抗菌活性。本发明制得的载药纳米粒进入肿瘤组织后,在酯酶的作用下,酯键断裂释放药物。此时,氧化锌纳米粒与药物能发挥协同抗癌作用,从而产生更好的抗癌疗效。4)氧化锌纳米粒能发出蓝色荧光,故可以体外监测药物的体内分布和治疗效果,使抗癌治疗可视化。5)本发明将药物制成纳米粒,能通过该效应达到被动靶向于肿瘤的目的,从而改变药物在体内的分布,降低抗癌药物的不良反应发率,提高患者用药的顺应性。
本发明制备纳米粒用于癌症治疗领域。
附图说明
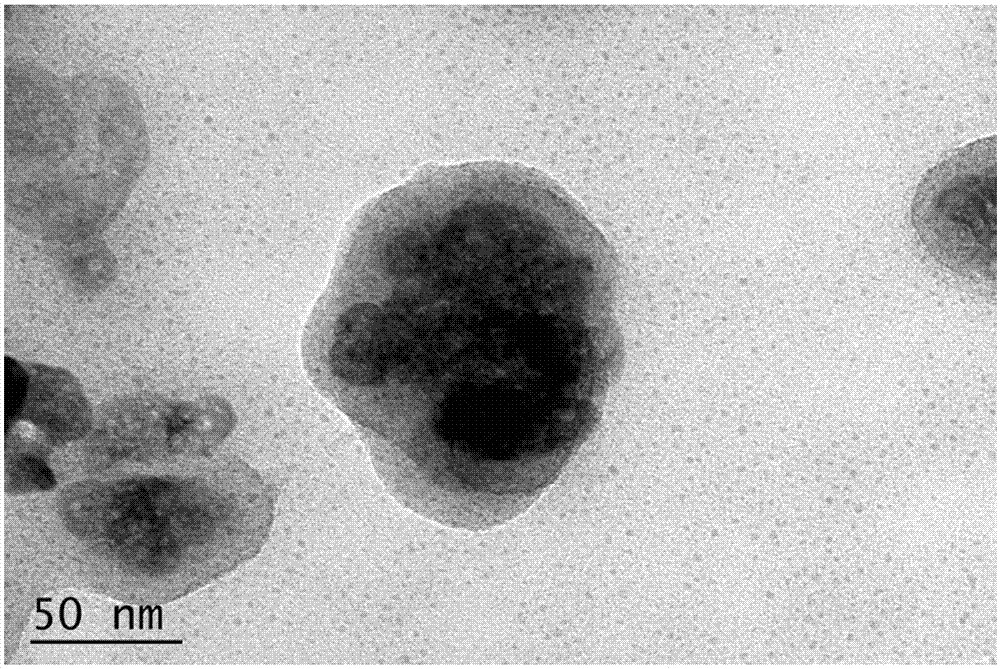
图1为实施例一制备的抗癌药物纳米粒的透射电镜图;
图2为实施例一制备的抗癌药物纳米粒的扫描电镜图;
图3为实施例一制备的抗癌药物纳米粒的红外谱图,其中zno为空白氧化锌红外图谱,zno-nac为n-乙酰-l半胱氨酸封端氧化锌纳米粒的红外图谱,zno-nac-cpt为喜树碱纳米粒的红外图谱,cpt为喜树碱原药的红外图谱。
具体实施方式
本发明技术方案不局限于以下所列举的具体实施方式,还包括各具体实施方式之间的任意组合。
具体实施方式一:本实施方式一种抗癌药物纳米粒的制备方法,具体按以下步骤进行:
一、将锌源化合物溶解在无水乙醇与水的混合溶液中,加入表面活性剂和封端剂,然后采用碱性溶液调整溶液至碱性,加热回流,得到封端的纳米粒,然后离心,收集沉淀,洗涤,晾干;其中封端剂为l-半胱氨酸或n-乙酰-l-半胱氨酸;锌源化合物与封端剂的摩尔比为(1~10)∶1;
二、将步骤一晾干后的纳米粒超声分散到乙腈溶液中,加入乙酸酐和缚酸剂,在室温条件下搅拌反应,然后离心,收集沉淀,再用乙腈洗涤两次,室温下自然干燥;
三、将步骤二处理后的纳米粒分散在无水二甲基亚砜中,加入n,n-羰基二咪唑,加热回流;再冷却至室温,加入带羟基的抗癌药物,水浴条件下搅拌反应,然后离心得到沉淀物,采用乙醇洗涤三次,室温干燥,得到所述抗癌药物纳米粒。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一中锌源化合物为氯化锌、硫酸锌、硝酸锌或醋酸锌。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二不同的是:步骤一中无水乙醇与水的摩尔比为(0.1~10)∶1。其它与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤一中表面活性剂为非离子表面活性剂,表面活性剂与锌源化合物的质量比为1~2%。其它与具体实施方式一至三之一相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤一中表面活性剂为吐温类表面活性剂。其它与具体实施方式一至四之一相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤一中表面活性剂为吐温80。其它与具体实施方式一至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤一中碱性溶液为氢氧化钠溶液。其它与具体实施方式一至六之一相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤一中加热回流12~24h。其它与具体实施方式一至七之一相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:步骤二中缚酸剂为三乙胺或三乙醇胺,纳米粒与缚酸剂的质量比为1∶(1~50)。其它与具体实施方式一至八之一相同。
具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:步骤二中纳米粒与乙酸酐的质量比为1∶(1~50)。其它与具体实施方式一至九之一相同。
具体实施方式十一:本实施方式与具体实施方式一至十之一不同的是:步骤三中纳米粒与n,n-羰基二咪唑的质量比为(20~1)∶1。其它与具体实施方式一至十之一相同。
具体实施方式十二:本实施方式与具体实施方式一至十一之一不同的是:步骤三中带羟基的抗癌药物为喜树碱和羟基喜树碱,纳米粒与抗癌药物的质量比为(50~1)∶1。其它与具体实施方式一至十一之一相同。
具体实施方式十三:本实施方式与具体实施方式一至十二之一不同的是:步骤三加热回流2~5h。其它与具体实施方式一至十二之一相同。
具体实施方式十四:本实施方式与具体实施方式一至十三之一不同的是:步骤三中水浴条件的温度为10~70℃。其它与具体实施方式一至十三之一相同。
具体实施方式十五:本实施方式与具体实施方式一至十四之一不同的是:步骤三制备的抗癌药物纳米粒的平均粒径为5~500nm。其它与具体实施方式一至十四之一相同。
采用以下实施例验证本发明的有益效果:
实施例一:
本实施例一种抗癌药物纳米粒的制备方法,具体按以下步骤进行:
一、将20g氯化锌溶解在300ml质量浓度为50%的乙醇溶液中,加入0.25ml表面活性剂吐温80和8g封端剂n-乙酰-l-半胱氨酸,然后采用浓度为2mol/l的氢氧化钠溶液调整溶液至ph=11,加热回流12h,得到封端的纳米粒,然后控制转速为5000rpm离心10min,收集沉淀,采用质量浓度为50%的乙醇溶液洗涤2次,晾干;
二、将步骤一晾干后的纳米粒超声分散到150ml乙腈溶液中,加入20ml乙酸酐和20ml缚酸剂,在室温条件下搅拌反应0.5h,然后控制转速为5000rpm离心10min,收集沉淀,再用乙腈洗涤两次,室温下自然干燥;
三、将步骤二处理后的纳米粒分散在15ml无水二甲基亚砜中,加入5gn,n-羰基二咪唑,加热回流2h;再冷却至室温,加入1g喜树碱,70℃水浴条件下搅拌反应,然后控制转速为5000rpm离心10min得到沉淀物,采用乙醇洗涤三次,室温干燥,得到所述抗癌药物纳米粒。
本实施例制备的抗癌药物纳米粒的透射电镜图如图1所示,由图中可以看出中心黑色为氧化锌无机物,四周为连接的有机物;
本实施例制备的抗癌药物纳米粒的扫描电镜图如图2所示,由图可以看出制备的纳米粒粒径均匀,粒径约60nm;
本实施例制备的抗癌药物纳米粒的红外谱图如图3所示,其中zno为空白氧化锌红外图谱,zno-nac为n-乙酰-l半胱氨酸封端氧化锌纳米粒的红外图谱,zno-nac-cpt为喜树碱纳米粒的红外图谱,cpt为喜树碱原药的红外图谱;由图可以看出在峰值为1089cm-1处有酯键峰出现,说明喜树碱与封端后的纳米粒以酯键结合。
采用本发明制备的抗癌药物纳米粒进行的体外细胞毒研究表明,喜树碱原药和本实施例制备的喜树碱纳米粒对a549肺癌细胞均能产生剂量依赖性抑制作用,它们的半数抑制浓度分别为1.77μg/ml和0.66μg/ml。这表明,本发明制备的载药纳米粒中的氧化锌与药物产生协同作用,抗癌作用高于原药。
本发明采用n-乙酰-l-半胱氨酸作为封端剂,其中n-乙酰-l-半胱氨酸的巯基一端与氧化锌以配位键结合,而羧基一端与药物的羟基以酯键结合。本发明制备的载药纳米粒具有以下优点:1)本发明使用的氧化锌、n-乙酰-l-半胱氨酸均为美国食品药品监督管理局认证的可安全应用于食品药品的材料。2)本发明制备的载药纳米粒的粒径为50-500nm。现代研究表明,肿瘤部位新生血管的内皮不完整,所以粒径处于该范围的纳米粒能通过增强渗透效应进入肿瘤部位,而不能进入正常组织。此外,该粒径的纳米粒很难被淋巴系统清除,故能长期滞留在肿瘤部位。纳米粒能通过增强渗透和滞留效应被动靶向于肿瘤部位,从而增强对肿瘤部位的选择性和疗效,降低对正常组织的副作用。3)研究表明,氧化锌纳米粒具有良好的抗癌、抗菌活性。本发明制得的载药纳米粒进入肿瘤组织后,在酯酶的作用下,酯键断裂释放药物。此时,氧化锌纳米粒与药物能发挥协同抗癌作用,从而产生更好的抗癌疗效。4)氧化锌纳米粒能发出蓝色荧光,故可以体外监测药物的体内分布和治疗效果,使抗癌治疗可视化。5)本发明将药物制成纳米粒,能通过该效应达到被动靶向于肿瘤的目的,从而改变药物在体内的分布,降低抗癌药物的不良反应发率,提高患者用药的顺应性。
- 还没有人留言评论。精彩留言会获得点赞!