纳米组成物、其制造方法及其用途与流程
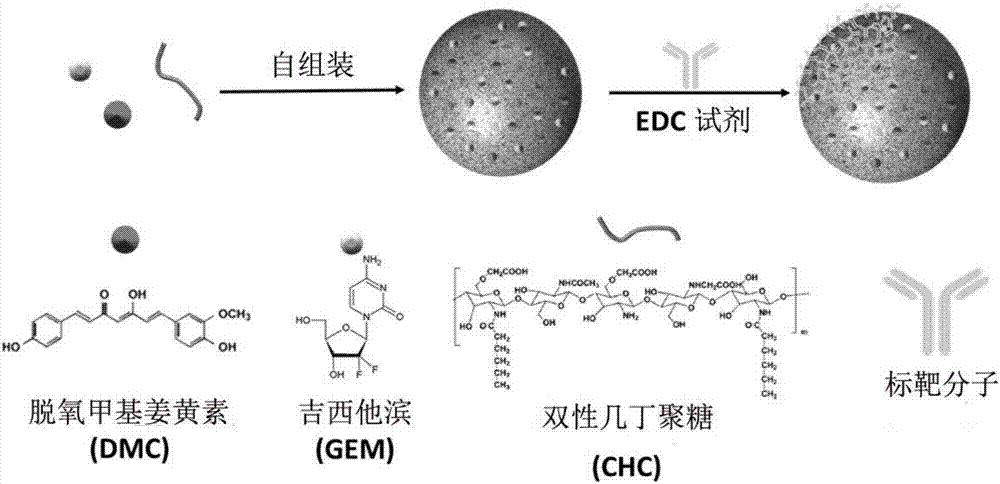
本发明关于纳米组成物、其制造方法及其用途。具体而言,本发明提供通过选用较佳比例的双药组合制备对特定癌症具有专一性的纳米组成物、其制造方法及其用于制备治疗癌症的药物的用途。
背景技术:
:癌症,又称恶性肿瘤,为生物体内控制细胞分裂的机制失常所引起的疾病。近代由于物质及生活习惯的改变,以及辐射或环境污染因子的存在,使得全球整体的患癌率较过去大幅提高。在2012年,全球约有1410万人患癌,并造成其中820万人死亡(相当于全年总死亡人数的14.6%)(参照:worldcancerreport2014,worldhealthorganization,2014,chapter1.1,isbn9283204298),可见即便是在医疗技术逐渐发达的现在,癌症的治疗仍为急需解决的问题。现今,癌症可以通过手术切除、化学治疗、放射线治疗、单株抗体治疗、标靶治疗等方式进行治疗,其中标靶治疗又属其中副作用最低又具有疗效的方案,为本领域中的热门研究项目。标靶治疗多使用具有专一性的小分子药物或结合专一性分子的纳米粒子作为主要方法,其中又因纳米粒子通常具有可携带大量抗癌药物的特性,使其除了具有比单独使用小分子药物更高的疗效,更能在特定位置释放抗癌药物,具有不逊于化学治疗的治疗效果且仅有低副作用。纳米粒子虽具有上述的优点,然而其长期保存方法仍为需要解决的问题。纳米粒子通常以胶体溶液的形式保存(如:中国台湾发明专利第i458833号、中国台湾发明专利第i482782号、中国台湾发明专利第i399214号等),且需在其表面上修饰保护剂或在溶液中添加保护剂以避免聚集现象。此外,纳米粒子的胶体溶液对于温度的变化较为敏感,因此在保存及运送上较为不易。虽可将纳米粒子干燥成为粉末状保存,但是将粉末回溶至水相以便于施用至病患时,在多数情况纳米粒子较难以回复成原本的粒径,而是发生聚集的现象以致于无法施用。另外,在上述纳米粒子搭配的药物选用方面,近年来,热门的研究对象转为多种药物的合并疗法,例如:美国食品药物管理局(fda)在2005年11月核准使用标靶药物厄洛替尼(erlotinib)与吉西他滨合并治疗晚期胰脏癌;2007年的美国临床肿瘤学会会议(ascoannualmeeting)上也公开了伊立替康(irinotecan)/欧洲紫杉醇(docetaxel)及贝伐单抗(bevacizumab)/西妥昔单抗(cetuximab)的合并疗法;而在2012年也有文献提供了厄洛替尼与吉西他滨合并治疗非小细胞肺癌的临床三期研究(参照:doi:10.1200/jco.2011.39.9782journalofclinicaloncology30,no.28(october2012)3516-3524),虽有治疗效果,但皆无法在临床上显示可增加五年内存活率。综上所述,目前确有针对特定癌症的有效药物组合、可供长期保存且便于运输的纳米粒子标靶药物的需求或两者的组合的需求。技术实现要素:鉴于以上现有技术的问题,本发明的目的是提供一种纳米组成物、其制造方法及其用途。在本发明其中一个目的中,提供纳米组成物的制造方法,其包含:混合双性几丁聚糖的第一溶液及含有抗癌成分的第二溶液,其中抗癌成分包含吉西他滨、姜黄素、其衍生物或其组合;使双性几丁聚糖通过自组装而包覆抗癌成分,以形成纳米粒子;以及将对癌症具有专一性的标靶分子与纳米粒子进行嫁接,以得到纳米组成物。优选地,双性几丁聚糖包含具有钆元素的亲水端。优选地,相对于第一溶液总重计,双性几丁聚糖的浓度介于0.001%~10%(w/w)之间。优选地,相对于第二溶液总体积计,抗癌成分的浓度介于1mg/ml~1000mg/ml之间。优选地,姜黄素及其衍生物:吉西他滨及其衍生物的重量比介于1:1~1:60之间。本发明的另一目的是提供由上述制造方法所制得的纳米组成物。优选地,当纳米组成物溶于水相时,纳米组成物的粒径介于5纳米~500纳米之间。优选地,纳米组成物进一步通过包含冷冻干燥、减压浓缩、真空干燥、喷雾干燥或其组合的方式去除其溶剂,以形成粒径为0.5微米~20微米的干燥微米粉体。优选地,当干燥微米粉体回溶于水相时,干燥微米粉体分散为粒径介于5纳米~500纳米之间的纳米组成物。本发明的另一目的是提供一种纳米组成物用于制备治疗癌症的药物的用途,包含通过所述的制造方法所制得的纳米组成物制备治疗癌症的药物,以及施予药物至个体。附图说明本发明的特征仅通过参照附图的实施例结果使本发明更易于本领域的技术人员理解,而非限定本发明。图1为本发明的纳米组成物的制造步骤的示意图。图2为本发明的纳米组成物的型态的tem图。图3的(a)部分及(b)部分为吉西他滨(gem)的释放百分比对时间的关系图。图4的(a)部分及(b)部分为脱氧甲基姜黄素(dmc)的释放百分比对时间的关系图。图5为以a549-on细胞株的细胞存活率计算而得到的药物联合作用指数(combinationindex,ci)对致效率(fa)的对比图。图6为肿瘤大小对施予后天数的关系图。图7为呈现以a549细胞株的细胞存活率计算而得到的ci对fa的对比图。图8为a549异位肿瘤大小对施予后天数的关系图,图中箭头代表施予时点。图9为a549异位肿瘤的抑制效率比较图。图10的(a)部分为本发明的干燥微米粉体在肉眼所见下的型态;(b)部分为干燥微米粉体的粒子型态;(c)部分为干燥微米粉体回溶于水相后的型态。具体实施方式为使上述目的、技术特征及实际实施后的效果更易于使本领域的技术人员理解,将于下文中的实施例来进行更详细的说明。本发明说明书中的用语缩写及中文的对照列于下表1:表1本文中“双性几丁聚糖(chc)”是指经化学方法将几丁聚糖改质使其具有疏水基团,并保有部分原始亲水端及部分功能性改质的亲水端以形成同时具有亲水端及疏水端的改质几丁聚糖。本文中“包覆”是指利用纳米粒子内部的空间携载添加的内容物,例如:包覆gem的chc纳米粒子是指在内部空间携载gem的chc纳米粒子。本文中“释放”是指纳米粒子包覆的药物移动到纳米粒子外部的过程,此过程中纳米粒子可被破坏或可不被破坏。本文中“药物联合作用指数(ci)”是指通过药物联合作用指数定理(thecombinationindextheorem)计算而得到的数值。依照药物联合作用指数所得到的值可推知复方药物中药物之间的互相影响,例如药物之间具有协同作用(ci<1)、相加作用(ci=1),或拮抗作用(ci>1)。本文中“致效率(fa)”是指质量作用中效定理(median-effectprinciple)中的药物致效程度,可与ci做成对比图以定义不同药物间的协同或拮抗关系。本文中提及的dmc与gem之间的比例为重量比。在本发明的一个态样中,纳米组成物以一锅合成方式制备,其步骤如图1所示。在一实施例中,一锅合成所加入的双性几丁聚糖于合成前以双性几丁聚糖粉末及二次水预先配制成第一溶液,其中相对于第一溶液总重计,双性几丁聚糖可为介于0.001%~10%(w/w)之间、优选地介于0.005%~7.5%(w/w)之间、更优选地介于0.01%~5%(w/w)之间、再更优选地介于0.025%~2.5%(w/w)之间、最优选为0.05%(w/w)的浓度。在一实施例中,抗癌成分可包含吉西他滨、姜黄素、两者的衍生物及两者及其衍生物的组合,优选地为吉西他滨(gem)及脱氧甲基姜黄素(dmc)。在一实施例中,脱氧甲基姜黄素粉末及吉西他滨粉末可预先以介于1:1~1:500之间、优选地为1:5、优选地为1:10、优选地为1:20、优选地为1:25、优选地为1:50、优选地为1:100、优选地为1:150、优选地为1:200的比例混合,并优选地以二甲基亚砜或醇类溶解以配制成第二溶液,其中相对于第二溶液总体积计,抗癌成分的总浓度介于1mg/ml~1000mg/ml之间,优选地介于100mg/ml~900mg/ml之间、优选地介于300mg/ml~700mg/ml之间、优选地介于400mg/ml~600mg/ml之间。在一优选实施例中,gem及dmc溶于二甲基亚砜或醇类。在一实施例中,混合0.05%(w/w)的第一溶液及dmc:gem=1:5的第二溶液后,在4℃搅拌24小时后以形成chc/dmc-gem。在一实施例中,混合chc/dmc-gem、交联剂及标靶分子以结合标靶分子与chc/dmc-gem并得到chc/dmc-gem/标靶分子,其中交联剂优选地可为1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(3-(ethyliminomethyleneamino)-n,n-dimethyl-propan-1-amine,edc),标靶分子优选地可为anti-egfr、anti-cd133、anti-cd166或anti-pd-l1。在一优选实施例中,chc/dmc-gem/标靶分子可为chc/dmc-gem/anti-cd133。在本发明的实施例中,纳米组成物的粒径介于5纳米~500纳米之间、优选地介于50纳米~400纳米之间、更优选地介于100~250纳米之间、最优选地介于150纳米到200纳米之间,且表面电位优选地为负电位。在一实施例中,chc/dmc-gem/标靶分子可以动态光散射(dls)测量粒径及表面电位,并以穿透式电子显微镜观测其形态。在一优选实施例中,发明人分别以动态光散射测量未包覆抗癌成分的chc纳米粒子、chc/dmc-gem及chc/dmc-gem/anti-cd133,并将结果列于以下表2。在一优选实施例中,chc/dmc-gem/anti-cd133的型态可以穿透式电子显微镜(tem)观察,其照片呈现于图2。表2:动态光散射测量结果在一实施例中,发明人比较chc/dmc、chc/gem、chc/dmc-gem及其结合抗体后的样本在不同酸碱值的缓冲溶液下内含的gem及dmc的释放情形。图3的(a)部分及(b)部分为上述样本释放gem的累积释放量与时间的关系图;图4的(a)部分及(b)部分为上述样本释放dmc的累积释放量与时间的关系图(累积释放率=累积释放量/原始包覆量×100%)。由图3及图4可知,抗癌成分dmc及gem在前10小时的释放速率皆较高,但在10小时后的释放速率趋缓,且在40小时后累积释放率仍未超过40%。而在上述样本中,又属chc/gem-dmc/anti-cd133的累积释放量最低,因而较适合作为药物载体于体内循环。在本发明的实施例中,本发明的纳米组成物可对应需求个体的癌症种类选择不同的标靶分子,其中癌症种类可包含非小细胞肺癌、小细胞肺癌、卵巢癌、胰腺癌、膀胱癌、乳癌及脑癌。在一优选实施例中,发明人选用a549-on作为癌症细胞模型,并将dmc、gem、chc/dmc以及chc/gem与a549-on共培养,观察a549-on在共培养后的细胞存活率,其结果列于以下表3。由表3可得知dmc及gem通过chc包覆之后其ic50皆小于单独使用的ic50,证实抗癌成分经chc包覆之后可具有较佳的细胞毒杀效果。表3样本a549-on,ic50(μg/ml)dmc10gem116.6chc/dmc8.37chc/gem73.94在一实施例中,加入dmc:gem=1:1.2、1:5、1:12及1:25的chc/dmc-gem至a549-on并共培养,以找出dmc及gem具有较佳协同效应(synergisticeffect)的药物比例。所计算出的ci及fa对比图呈现于图5。由图5的结果可得知,当chc/dmc-gem中的dmc:gem=1:5时,其ci值小于1,亦即以dmc:gem=1:5比例制备的chc/dmc-gem中的两种药物具有协同效应,可使治疗效果提升。在一实施例中,发明人在小鼠体内种殖a549-on的极恶性异位肿瘤并施予pbs、dmc及gem的混合物、本发明的chc/dmc-gem及chc/dmc-gem/anti-cd133的样品至小鼠体内,记录施予药物后11天内的肿瘤大小变化,其结果如图6所示。由图6可知,经chc/dmc-gem/anti-cd133施予的小鼠体内肿瘤体积与仅施予pbs的控制组在11天时相差约7倍,显示在上述各样品中chc/dmc-gem/anti-cd133对于小鼠体内的a549-on及恶性异位肿瘤具有较佳的抑制效果。在另一优选实施例中,发明人选用a549作为癌症细胞模型,将dmc、gem、chc/dmc以及chc/gem与a549共培养,并观察a549在共培养后的细胞存活率,其结果列于以下表4。由表4可得知dmc及gem通过chc包覆之后其ic50皆小于单独使用的ic50,证实抗癌成分经chc包覆之后可具有较佳的细胞毒杀效果。表4样本a549,ic50(μg/ml)dmc10.3gem116.6chc/dmc8.37chc/gem70.3在一实施例中,加入dmc:gem=1:2.5、1:5、1:10及1:20的chc/dmc-gem至a549并共培养,以找出dmc及gem具有较佳协同效应(synergisticeffect)的药物比例。通过a549细胞在共培养后的存活率所计算出的ci及fa对比图呈现于图7。由图7可得知,当chc/dmc-gem中的dmc:gem=1:5时,其ci值小于1,亦即dmc:gem=1:5时制备的chc/dmc-gem中的两种药物具有协同效应,可使治疗效果提升。在一实施例中,发明人在小鼠体内种殖a549的异位肿瘤并施予生理食盐水、chc/anti-egfr以及chc/dmc-gem/anti-egfr的样品至小鼠体内以观察肿瘤治疗效果。在一优选实施例中,chc/dmc-gem/anti-egfr选用1:5的dmc:gem比例,以dmc的量作为剂量指标施予小鼠5mg/kg、10mg/kg、20mg/kg、30mg/kg及40mg/kg的剂量。此外,由第一次施予上述样本起算,又于第8天、第15天及第22天再次施予相同样本至小鼠体内,并于29天内观察a549异位肿瘤的体积变化,其结果如图8所示,图中箭头代表样本施予时点。接着,经上述各样本施予的小鼠在第29天时的肿瘤体积相对于施予生理食盐水的小鼠肿瘤体积差计算出肿瘤抑制率,并以柱状图呈现,如图9所示。由图9可得知,当以dmc量作为剂量指标时,施予40mg/kg、30mg/kg、20mg/kg剂量的组别的肿瘤抑制率与施予生理食盐水组别的肿瘤抑制率有显著差异。另外,藉由上述肿瘤抑制率可计算出chc/dmc-gem/anti-egfr对a549的ed50为gem=98.98mg/kg及dmc=19.67mg/kg。在一实施例中,本发明的纳米组成物可经由冷冻干燥、减压浓缩、真空干燥、喷雾干燥或其组合的方式去除其溶剂,制成介于0.5微米~20微米、优选地介于0.5微米~10微米、更优选地介于0.5微米~5微米、最优选地介于0.5微米~2微米的干燥微米粉体。在一优选实施例中,本发明的纳米组成物可经由喷雾造粒的方式制成干燥微米粉体,其外观如图10的(a)部分所示;干燥微米粉体的颗粒型态及粒径可由扫描式电子显微镜测得,直径约为1微米,其照片如图10的(b)部分所示。另外,当干燥微米粉体回溶于水相时,可快速恢复成干燥前的纳米组成物型态,由扫描式电子显微镜可测得回溶后的纳米组成物粒径约100纳米,其照片如图10的(c)部分所示。可见本发明的纳米组成物不需以胶体溶液形式保存,而可经干燥后以粉末形式保存,便于长期储藏及运送且不易受保存温度影响。在一实施例中,纳米组成物为水溶液针剂、口服锭剂,以及吸剂的形式。在另一实施例中,本发明的纳米组成物也可通过其包含的双性几丁聚糖所改质修饰的钆元素发挥作为t1磁振造影显影剂的用途。虽然本发明已以实施例具体描述本发明的纳米组成物用于制备治疗癌症的药物的用途,然而具本发明所属
技术领域:
的技术人员应理解,可在不违背本发明的技术原理及精神下,对实施例作修改与变化。因此本发明的权利保护范围应如权利要求书所述。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1