一种无封堵可降解的纳米载药释药系统及其制备方法与流程
本发明属于纳米功能材料技术领域,具体为一种无封堵可降解的纳米载药释药系统及其制备方法。
背景技术
癌症是威胁人类健康与生命的问题之一,因此对癌症治疗方法的研究一直是一个热点。随着纳米技术的飞速发展,一系列基于纳米材料的智能药物控释体系应运而生,并用于癌症的联合治疗。由于不同模式的抗癌机制不完全相同,所以联合治疗往往能够提高治疗效果,降低治疗过程中出现副反应的几率。近年来,光热治疗的理念逐渐深入人心,因其穿透力强、对周围正常组织副作用小、治疗效果明显。
介孔二氧化硅纳米粒子具有优异的生物相容性、高负载能力和容易官能化等优点被广泛应用于药物递送领域。但载药纳米材料较长的降解期会影响体内细胞的代谢,为了促进生物体中纳米材料的降解,努力致力于开发具有可生物降解的药物递送材料是非常重要的。
另外,在纳米颗粒外表面上构建物理阻塞单元,特别是用于药物递送的物理阻塞单元存在很多问题。首先,阻塞单元和纳米孔之间的不匹配可能会导致药物过早泄漏。另外,接枝到纳米粒子上的大量阻塞单元分子可能会导致生物体系的不稳定和较差的生物相容性。因此,开发光热与化疗联合应用的、可生物降解的、响应性按需释放药物的系统是至关重要的。
技术实现要素:
针对上述问题,本发明提供一种无封堵可降解的纳米载药释药系统及其制备方法,纳米载药释药系统是一种具有化疗、光热治疗以及智能响应性的按需释放药物的体系。其中,该纳米载药释药系统中的硫化铜是一种很好的光热材料,它可以在700-1000nm的近红外激光激发下产生过高热,一方面直接杀死癌细胞,另一方面可以促进抗癌药的释放,增强药物对肿瘤细胞的毒性。另外,介孔二氧化硅壳层孔道中的抗癌药可实现化疗作用,二者协同作用可提高癌症的治疗效果。
二氧化硅中嵌入的二硫桥骨架结构在癌细胞中含量丰富的谷胱甘肽的刺激下可生物降解,孔道内修饰的疏水性苯胺基团在中性条件下可阻止水的进入,在药物运输过程中达到封堵孔道的目的。在酸性条件下可以转化为亲水性结构促进药物释放,这样实现了ph和谷胱甘肽双响应刺激下的选择性释放抗癌药,并且可以避免运输过程中的泄漏而导致的副作用。
本发明是通过以下技术方案实现的:
一种无封堵可降解的纳米载药释药系统,包括硫化铜纳米颗粒、含有二硫桥骨架结构的二氧化硅壳层;所述二氧化硅壳层包裹所述硫化铜纳米颗粒,形成核壳包裹的结构,所述二氧化硅壳层内设有具疏水性、用于负载及密封药物的纳米孔道;所述纳米载药释药系统能够在ph和谷胱甘肽双响应刺激下选择性释放药物。
进一步的,所述纳米载药释药系统在ph和谷胱甘肽双响应刺激下的选择性释放药物,具体是指:
所述纳米孔道内修饰有疏水的苯胺基团,能够实现在中性环境中阻止液体的进入,进而实现在运输过程中密封药物;在癌细胞的微酸性环境中所述苯胺基团被质子化,由疏水性转化为亲水性,液体逐渐浸润所述纳米孔道,实现药物释放;并且二硫桥骨架结构在癌细胞中谷胱甘肽的刺激下生物降解,进而能够实现药物的释放;实现了所述纳米载药释药系统在ph和谷胱甘肽双响应刺激下的选择性释药过程。
进一步的,所述纳米孔道负载的药物为抗癌药,所述抗癌药包括阿霉素或紫杉醇。
一种无封堵可降解的纳米载药释药系统的制备方法,所述方法包括以下步骤:
步骤一:制备光热材料硫化铜纳米颗粒;
步骤二:在步骤一合成的硫化铜纳米颗粒外面包裹嵌入了二硫桥骨架结构的介孔二氧化硅壳层,所述二氧化硅壳层内设有具疏水性、用于负载及密封药物的纳米孔道,在所述纳米孔道内修饰疏水的苯胺基团;
步骤三:对步骤二得到的纳米材料进行载药处理,得到具有光热治疗-化疗效果的纳米载药释药系统。
进一步的,所述步骤一具体为:配置质量浓度为5-20%的十六烷基三甲基溴化铵水溶液、摩尔浓度为50~100mm的氯化铜溶液以及摩尔浓度为50~100mm的硫化钠溶液,按照十六烷基三甲基溴化铵水溶液:氯化铜溶液:硫化钠溶液=(50~100):(1~3):(1~3)的体积比将三者混合,通氮气,在磁力搅拌器上搅拌15~30分钟后,置于70~90℃水浴锅中,在氮气流下继续搅拌1~3小时。进一步的,所述加入的氯化铜溶液和硫化钠溶液体积比为1:1。
所述步骤二具体为:将含有硫化铜纳米颗粒的溶液的水浴温度冷却至50~70℃,加入正硅酸乙酯、苯基氨丙基三甲氧基硅烷和含二硫键的硅烷偶联剂的混合物,随后将乙酸乙酯快速注入到混合物中并搅拌2~6小时;
将制得的产物用乙醇和水各洗涤3~5次,并用回流法去除十六烷基三甲基溴化铵模板;将去除十六烷基三甲基溴化铵模板后的产物超声分散在乙醇中,加热回流1~2天,再用乙醇洗涤3~5次并通过离心收集产物,最后在真空烘箱中干燥过夜,得到二氧化硅壳层包裹硫化铜纳米颗粒的核壳结构。
进一步的,所述含二硫键的硅烷偶联剂包括:双-[3-(三乙氧基硅)丙基]-二硫化物或双-[3-(三乙氧基硅)丙基]-四硫化物。
进一步的,步骤二中,所述洗涤为:离心去除上清液,然后加入洗涤液超声分散,再离心去除上清液,称为一次洗涤。
进一步的,所述步骤三具体为:将步骤二中得到的产物超声分散到甲苯/乙醇混合溶液中,加入抗癌药超声处理后,离心收集,最后在真空烘箱中干燥过夜,获得具有光热治疗-化疗效果的纳米载药释药系统。进一步的,所述甲苯/乙醇混合溶液中甲苯和乙醇的体积比为(3~5):(1~2)。
本发明的有益技术效果:
(1)本发明所提供的一种无封堵可降解的纳米载药释药系统,是一种具有光热治疗效果的、可生物降解的纳米材料,能够在ph和谷胱甘肽双响应刺激下选择性地释放抗癌药、达到化疗和光热联合治疗的效果;
(2)本发明所述方法,在合成过程中同时引入三种不同的硅烷偶联剂(正硅酸乙酯、苯基氨丙基三甲氧基硅烷和双-[3-(三乙氧基硅)丙基]-二硫化物/双-[3-(三乙氧基硅)丙基]-四硫化物),有别于传统的制备方法,得到了无封堵的、可快速生物降解的纳米载体。在合成过程中直接加入苯基氨丙基三甲氧基硅烷,得到的是孔道内修饰的的苯胺基团,其在中性水溶液中是疏水的,可以有效地密封抗癌药并且在载药过程中并不会发生脱落而产生副反应。若在材料合成后进行再修饰,得到的是生长在纳米载体外表面的苯胺基团,这样会影响材料的生物相容性。如果使用封堵剂,一旦其与纳米孔的尺寸不匹配,在运输过程中发生脱落,将产生难以预料的副作用,并且封堵剂同样会会大大影响纳米载体的生物相容性。
合成过程中加入了双-[3-(三乙氧基硅)丙基]-二硫化物/双-[3-(三乙氧基硅)丙基]-四硫化物),其可以与正硅酸乙酯形成同时含有si-s-s-si(si-s-s-s-s-si)和si-o-si这两种结构的材料,而si-s-s-si(si-s-s-s-s-si)结构可以在谷胱甘肽的刺激下发生氧化还原反应从而断裂,加速材料降解,从而减少了释药后在生物体内的存留时间,如果没有这两种硅烷偶联剂,形成的只是si-o-si结构,该结构比较稳定,在谷胱甘肽的刺激下不会发生降解,释药后材料在生物体内会停留较长时间,产生一定的不良反应。
(3)本发明所提供的一种无封堵可降解的纳米载药释药系统,具有较高的近红外光转换效率,与化疗联合作用可实现超加和效应。光热治疗除了直接杀死癌细胞还能靠其产生的过高热促进抗癌药的释放,加上ph和谷胱甘肽刺激响应下释放的抗癌药,增大了抗癌药对癌细胞的毒性。即实现“1+1>2”的效果。
(4)本发明所提供的一种无封堵可降解的纳米载药释药系统张工的纳米孔道内修饰的疏水的苯胺基团在中性环境中可以阻止液体的进入,从而在运输过程中达到密封药物的效果,而在癌细胞的微酸性环境中可以被质子化,由疏水性转化为亲水性,液体逐渐浸润孔道帮助抗癌药释放,达到治疗癌症的效果。
(5)本发明所提供的一种无封堵可降解的纳米载药释药系统既巧妙地避开了“阻塞单元”,又能在谷胱甘肽的刺激下快速生物降解,最大限度地减少了运输过程以及治疗过程中的副反应,实现了在ph和谷胱甘肽双响应刺激下的选择性释药过程。
附图说明
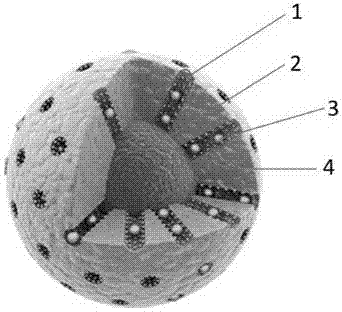
图1为本发明实施例中纳米载药释药系统的示意图;
图2a和图2b为本发明实施例中纳米载药释药系统的tem图(即本发明实施例中载药粒子tem图);
图3a和图3b为本发明实施例中纳米载药释药系统的sem图(即本发明实施例中载药粒子sem图);
附图标记:1为修饰在孔道中的苯胺基团;2为硫化铜纳米颗粒;3为载入孔道内的抗癌药物;4为嵌入了二硫桥骨架的二氧化硅壳层。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细描述。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
相反,本发明涵盖任何由权利要求定义的在本发明的精髓和范围上做的替代、修改、等效方法以及方案。进一步,为了使公众对本发明有更好的了解,在下文对本发明的细节描述中,详尽描述了一些特定的细节部分。对本领域技术人员来说没有这些细节部分的描述也可以完全理解本发明。
实施例1
本实施例提供一种无封堵可降解的纳米载药释药系统的制备方法,所述方法包括以下步骤:
(1)硫化铜核的制备
称取6mg十六烷基三甲基溴化铵,超声分散在50ml水中,配制2ml氯化铜溶液(100mm)和2ml硫化钠(100mm)溶液,将它们混合在三颈烧瓶中,通氮气,在磁力搅拌器上搅拌15分钟后,将三颈烧瓶置于90℃水浴锅中,在氮气流下继续搅拌1.5小时。
(2)介孔二氧化硅壳层的形成。
将水浴温度冷却至70℃,向溶液中加入900μl正硅酸乙酯、45μl苯基氨丙基三甲氧基硅烷和600μl双-[3-(三乙氧基硅)丙基]-四硫化物的混合物,随后将1ml乙酸乙酯快速注入到混合物中并搅拌3小时。将制得的产物用乙醇和水各洗涤三次,烘干。用回流法去除模板:将产物溶解在50ml乙醇中,加热回流1天,再用乙醇洗涤三次并通过离心收集产物,最后在真空烘箱中干燥过夜,得到具有疏水纳米孔道的、二硫桥骨架结构包裹硫化铜的纳米材料。
(3)将抗癌药阿霉素载入步骤(2)合成的纳米材料中
将(2)中制备的纳米材料分散到5ml甲苯/乙醇(4:1)中,加入2mg抗癌药阿霉素超声处理4小时后,离心收集,用乙醇洗涤三次,最后在真空烘箱中干燥过夜,制备获得无封堵可降解的纳米载药释药系统(如图1所示)。
采用上述方法制备获得的无封堵可降解的纳米载药释药系统包括:硫化铜纳米颗粒、含有二硫桥骨架结构的二氧化硅壳层;所述二氧化硅壳层包裹所述硫化铜纳米颗粒,形成核壳包裹的结构,所述二氧化硅壳层内设有具疏水性、用于负载及密封药物的纳米孔道;所述纳米载药释药系统能够在ph和谷胱甘肽双响应刺激下选择性释放药物。
所述纳米载药释药系统在ph和谷胱甘肽双响应刺激下的选择性释放药物,具体是指:
所述纳米孔道内修饰有疏水的苯胺基团,能够实现在中性环境中阻止液体的进入,进而实现在运输过程中密封药物;在癌细胞的微酸性环境中所述苯胺基团被质子化,由疏水性转化为亲水性,液体逐渐浸润所述纳米孔道,实现药物释放;并且二硫桥骨架结构在癌细胞中谷胱甘肽的刺激下生物降解,进而能够实现药物的释放;实现了所述纳米载药释药系统在ph和谷胱甘肽双响应刺激下的选择性释药过程。
所述纳米孔道负载的药物为阿霉素,在其他实施例中,负载的抗癌药可以选择或紫杉醇。
实施例2
本实施例提供一种无封堵可降解的纳米载药释药系统的制备方法,所述方法包括以下步骤:
(1)硫化铜核的制备
称取8mg十六烷基三甲基溴化铵,超声分散在50ml水中,配制3ml氯化铜溶液(100mm)和3ml硫化钠(100mm)溶液,将它们混合在三颈烧瓶中,通氮气,在磁力搅拌器上搅拌15分钟后,将三颈烧瓶置于90℃水浴锅中,在氮气流下继续搅拌2小时。
(2)介孔二氧化硅壳层的形成。
将水浴温度冷却至70℃,向溶液中加入1000μl正硅酸乙酯、50μl苯基氨丙基三甲氧基硅烷和700μl双-[3-(三乙氧基硅)丙基]-四硫化物的混合物,随后将2ml乙酸乙酯快速注入到混合物中并搅拌5小时。将制得的产物用乙醇和水各洗涤三次,烘干。用回流法去除模板:将产物溶解在50ml乙醇中,加热回流1天,再用乙醇洗涤三次并通过离心收集产物,最后在真空烘箱中干燥过夜,得到具有疏水纳米孔道的、二硫桥骨架结构包裹硫化铜的纳米材料。
(3)将抗癌药紫杉醇载入步骤(2)合成的纳米材料中
将(2)中制备的纳米材料分散到5ml甲苯/乙醇(4:1)中,加入0.5mg抗癌药紫杉醇超声处理5小时后,离心收集,用乙醇洗涤三次,最后在真空烘箱中干燥过夜,制备获得无封堵可降解的纳米载药释药系统。
实施例3
本实施例提供一种无封堵可降解的纳米载药释药系统的制备方法,所述方法包括以下步骤:
(1)硫化铜核的制备
称取10mg十六烷基三甲基溴化铵,超声分散在80ml水中,配制3ml氯化铜溶液(100mm)和3ml硫化钠(100mm)溶液,将它们混合在三颈烧瓶中,通氮气,在磁力搅拌器上搅拌20分钟后,将三颈烧瓶置于90℃水浴锅中,在氮气流下继续搅拌3小时。
(2)介孔二氧化硅壳层的形成。
将水浴温度冷却至70℃,向溶液中加入1000μl正硅酸乙酯、50μl苯基氨丙基三甲氧基硅烷和700μl双-[3-(三乙氧基硅)丙基]-二硫化物的混合物,随后将2ml乙酸乙酯快速注入到混合物中并搅拌5小时。将制得的产物用乙醇和水各洗涤三次,烘干。用回流法去除模板:将产物溶解在80ml乙醇中,加热回流2天,再用乙醇洗涤三次并通过离心收集产物,最后在真空烘箱中干燥过夜,得到具有疏水纳米孔道的、二硫桥骨架结构包裹硫化铜的纳米材料。
(3)将抗癌药阿霉素载入步骤(2)合成的纳米材料中
将(2)中制备的纳米材料分散到6ml甲苯/乙醇(5:1)中,加入3mg抗癌药阿霉素超声处理6小时后,离心收集,用乙醇洗涤三次,最后在真空烘箱中干燥过夜,制备获得无封堵可降解的纳米载药释药系统。
(4)材料性能测试
a.谷胱甘肽响应实验
称取两份2mg载药纳米粒子分别分散到5mm的谷胱甘肽溶液和5μm的谷胱甘肽溶液中,间隔1小时、2小时、4小时、6小时、8小时、12小时、24小时等用紫外分光光度计分别测出该载药纳米粒子在两种浓度的谷胱甘肽溶液中的释放曲线。结果显示:该载药纳米粒子在5mm的谷胱甘肽溶液中释放阿霉素的量要远远多于在5μm的谷胱甘肽溶液中的释放量。表明二硫桥连结构能够在高浓度的谷胱甘肽溶液中发生氧化还原反应,使二硫桥结构断裂,进而促进阿霉素的释放。
b.ph响应实验
称取两份2mg该载药纳米粒子分别分散到ph=5.2的pbs溶液和ph=7.4的pbs溶液中,间隔1小时、2小时、4小时、6小时、8小时、12小时、24小时等用紫外分光光度计分别测出该载药纳米粒子在两种pbs溶液中的释放曲线。结果显示:该载药纳米粒子在ph=5.2的pbs溶液中释放阿霉素的量要远远多于在ph=7.4的pbs溶液中的释放量。表明该载药纳米粒子在运输过程中几乎不释放药物,而在癌细胞内有大量药物释放,表明孔道内的疏水苯胺基团能有效地阻止水进入孔道,当药物到达肺癌细胞(a549细胞)后苯胺基团被质子化,由疏水状态转变为亲水状态,水进入孔道促进阿霉素的释放。
c.细胞毒性和光毒性实验
配制浓度浓度为0、25μg/ml、50μg/ml、80μg/ml、100μg/ml的未载药纳米粒子(步骤(2)中合成的材料)溶液,分别取1ml加入到盛有a549细胞的培养皿中共孵育24小时,分别取100μl滴加到96孔板中,再向每个孔中加入10μlcck-8试剂,2小时后用酶标仪检测细胞活性。结果显示:细胞几乎没有毒性(小于10%),即使在最高浓度100μg/ml时,细胞活力仍为90%左右,这表明该载药纳米材料具有良好的生物相容性,对细胞损害程度极小。
分别向四个盛有a549细胞的培养皿中滴加1ml浓度为100μg/ml未载药纳米粒子溶液,共孵育24小时,用钙黄绿素双染试剂盒进行染色,再分别用近红外激光(980nm,0.7w/cm2)照射0,2,4,6,分钟。在激光共聚焦显微镜下观察得出结果:用激光处理0分钟对a549细胞几乎不产生毒性,用激光处理2分钟对a549细胞产生轻微毒性,用激光处理4分钟和6分钟对a549细胞产生较强的毒性,随着激光处理时间的增多细胞被杀死的数目增多,表明该纳米材料具有良好的光热效应。
从图2可以看出,在透射电镜下该材料呈现明显的核壳结构,并且其通道结构清晰可见。图3的扫描电镜图可以看出该材料的粒径在50~70nm之间。
本发明提供一种采用核壳包裹的方式制备智能载药释药系统,通过在硫化铜纳米颗粒上包裹含有二硫桥骨架结构的二氧化硅壳层,并同时引入疏水纳米孔道密封抗癌药,来合成无封堵的、ph和谷胱甘肽双响应的可降解的药物递送纳米体系。硫化铜作为一种优良的光热材料,具有较高的光热转换效率,优异的生物相容性和光热稳定性。二氧化硅壳层上的疏水性的纳米孔道可以选择性地在酸性环境中释放密封的抗癌药,而在中性条件下不释放。二硫桥骨架结构在癌细胞(如肺癌细胞)中含量丰富的谷胱甘肽的刺激下可逐渐生物降解,有效增加抗癌药在细胞内的累积量,产生高细胞毒性。该体系巧妙地避开了“门”,实现了无封堵的载药释药过程,而在谷胱甘肽刺激下的可降解性大大缩短了材料在生物体内的存留时间,最大限度地减少了运输过程以及治疗过程中的副反应,最后通过体外治疗结果成功证实化疗-光热联合治疗的效果远大于其中任何一种单一治疗的效果。
- 还没有人留言评论。精彩留言会获得点赞!