一种二膦酸盐纳米材料及其制备方法以及应用与流程
本发明属于纳米材料技术领域,具体涉及一种二膦酸盐纳米材料及其制备方法以及应用。
背景技术
癌症是21世纪威胁人类健康的几种重大恶性疾病之一,每年造成全球数以百万计的死亡。放疗是目前治疗癌症的主要方法之一,可以通过外部射线或者体内输送核素到肿瘤部位,利用x射线或者核素发射的α和β射线有效的杀伤肿瘤细胞。在肿瘤治疗过程,发现肿瘤内大量的肿瘤相关巨噬细胞与较差的术后密切相关。主要极化为m2型的肿瘤相关巨噬细胞有效的促进了肿瘤的生长、转移、浸润和免疫逃逸,加重了肿瘤的乏氧,而且放疗还有诱导骨髓来源的肿瘤相关巨噬细胞在肿瘤的大量募集。因此,有效的清除肿瘤相关巨噬细胞对提升放疗效果具有重大的意义。
二膦酸盐是目前临床使用的抗骨质疏松,抗骨转移药物,对单核细胞,破骨细胞和巨噬细胞有较强的选择性毒性。但是带负电荷的二膦酸盐难以穿透细胞膜,对肿瘤相关巨噬细胞的选择性杀伤较弱。传统的将二膦酸盐载入脂质体的方法较为复杂,稳定性较差,而且效率低下。采用简单的方法利用二膦酸盐合成稳定的纳米颗粒,并进一步的标记多种放射性核素,实现成像引导下的肿瘤相关巨噬细胞清除和肿瘤核素治疗还没有报道过。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种二膦酸盐纳米材料及其制备方法以及应用,本发明提供的二膦酸盐纳米材料可标记多种核素。
本发明提供了一种二膦酸盐纳米材料的制备方法,包括以下步骤:
a)采用反相微乳法将可溶性钙盐与二磷酸盐混合搅拌,得到混合液;
b)将所述混合液与极性有机溶剂混合,得到纳米颗粒;
c)采用聚乙二醇将所述纳米颗粒进行修饰,得到二膦酸盐纳米材料。
优选的,所述步骤a)具体为:
a1)将二磷酸盐溶液和多巴溶液分散于微乳液中,得到磷相微乳液;
a2)将可溶性钙盐的水溶液分散于微乳液中,得到钙相微乳液;
a3)将所述磷相微乳液滴加至所述钙相微乳液中,混合搅拌,得到混合液。
优选的,所述微乳液由co-520、tritonx-100、正己醇以及环己烷混合而成,所述二磷酸盐选自氯膦酸二钠或唑来膦酸,所述可溶性钙盐选自氯化钙或硝酸钙。
优选的,所述步骤c)具体为:
将所述纳米颗粒分散于非极性有机溶剂中,用二棕榈酰磷脂酰胆碱,胆固醇和1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-n-氨基-聚乙二醇修饰纳米颗粒。
本发明还提供了一种上述制备方法制备得到的二膦酸盐纳米材料。
本发明还提供了一种上述二膦酸盐纳米材料在制备用于检测并治疗癌症的治疗剂中的应用。
本发明还提供了一种放射性核素标记的二膦酸盐纳米材料,由放射性核素与上述二膦酸盐纳米材料制备而成。
本发明还提供了一种上述放射性核素标记的二膦酸盐纳米材料在肿瘤成像中的应用,所述放射性核素为阳离子核素。
本发明还提供了一种上述放射性核素标记的二膦酸盐纳米材料在制备用于肿瘤治疗的药物中的应用,所述放射性核素为阴离子核素。
与现有技术相比,本发明提供了一种二膦酸盐纳米材料的制备方法,包括以下步骤:a)采用反相微乳法将可溶性钙盐与二磷酸盐混合搅拌,得到混合液;b)将所述混合液与极性有机溶剂混合,得到纳米颗粒;c)采用聚乙二醇将所述纳米颗粒进行修饰,得到二膦酸盐纳米材料。本发明所合成的纳米材料cabp-peg具有良好的水溶性,单分散性,而且具有酸响应生物可降解功能。应用本发明所合成的成纳米材料cabp-peg可以选择的杀伤肿瘤相关巨噬细胞,调节肿瘤微环境,使肿瘤血管正常化,增强肿瘤内的灌注和改善肿瘤的乏氧状态。应用本发明所纳米材料cabp-peg能够标记多种放射性核素实现肿瘤的显像和治疗。
附图说明
图1为本发明合成纳米材料cabp-peg合成示意图;
图2为实施例1中合成纳米材料电子显微镜图像;
图3为实施例1中纳米材料的动态光散射图;
图4为实施例2中纳米材料在不同酸度下透射电镜图像;
图5为实施例2中纳米材料在不同酸度下释放二膦酸盐药物;
图6为实施例3中纳米材料被raw细胞摄取;
图7为实施例4中纳米材料对不同细胞的杀伤能力;
图8为实施例5中纳米材料cabp-peg标记放射性核素99mtc示意图;
图9为实施例6中cabp(99mtc)-peg纳米材料通过尾静脉注射到活体内对肿瘤的单光子发射计算机化断层显像;
图10为实施例7中cabp(99mtc)-peg纳米材料在生物体内血液循环;
图11为实施例7中cabp(99mtc)-peg纳米材料在生物体内24小时后分布;
图12为实施例8中cabp-peg纳米材料处理后小鼠肿瘤内单核细胞比例;
图13为实施例8中cabp-peg纳米材料处理后小鼠肿瘤内m2型巨噬细胞比例;
图14为实施例8中cabp-peg纳米材料处理后小鼠肿瘤内肿瘤相关巨噬细胞的免疫荧光图像;
图15为实施例8中cabp-peg纳米材料处理后小鼠血清白介素10水平;
图16为实施例8中cabp-peg纳米材料处理后小鼠血清白介素12水平;
图17为实施例8中cabp-peg纳米材料处理后小鼠血清肿瘤坏死因子α水平;
图18为实施例8中cabp-peg纳米材料处理后小鼠血清干扰素γ水平;
图19为实施例9中cabp-peg纳米材料处理后小鼠肿瘤内灌注伊文思蓝图像;
图20为实施例9中cabp-peg纳米材料处理后小鼠肿瘤内灌注伊文思蓝相对含量;
图21为实施例10中cabp-peg纳米材料处理后小鼠肿瘤内饱和氧的光声图像;
图22为实施例10中cabp-peg纳米材料处理后小鼠肿瘤内饱和氧含量;
图23为实施例10中cabp-peg纳米材料处理后小鼠肿瘤内平均血红蛋白的灌注量;
图24为实施例11中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧和血管免疫荧光图像;
图25为实施例11中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧和血管免疫荧光信号强度;
图26为实施例11中cabp-peg纳米材料处理后,小鼠肿瘤内有效扩张的血管数目;
图27为实施例12中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧诱导因子的免疫荧光图像;
图28为实施例12中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧诱导因子的免疫荧光信号的强度;
图29为实施例13中纳米材料cabp-peg标记放射性治疗核素32p过程示意图;
图30为实施例13中纳米材料cabp-peg标记放射性治疗核素32p标记稳定性;
图31为实施例14中纳米材料cabp(32p)-peg对4t1癌细胞毒性;
图32为实施例15中不同处理后荷瘤小鼠肿瘤生长曲线;
图33为实施例15中不同处理后13天后荷瘤小鼠肿瘤照片;
图34为实施例15中不同处理后小鼠肿瘤切片he和tunel染色。
具体实施方式
本发明提供了一种二膦酸盐纳米材料的制备方法,包括以下步骤:
a)采用反相微乳法将可溶性钙盐与二磷酸盐混合搅拌,得到混合液;
b)将所述混合液与极性有机溶剂混合,得到纳米颗粒;
c)采用聚乙二醇将所述纳米颗粒进行修饰,得到二膦酸盐纳米材料。
本发明采用反相微乳法将可溶性钙盐与二磷酸盐混合搅拌,得到混合液。
本发明首先配置微乳液,在本发明中,所述微乳液由co-520、tritonx-100、正己醇以及环己烷混合而成。其中,所述co-520、tritonx-100、正己醇以及环己烷的体积比优选为4.35:2.25:1.5:21.9。
接着,配置磷相微乳液与钙相微乳液。然后将磷相微乳液滴加至钙相微乳液中,混合搅拌,得到混合液。
具体的,所述磷相微乳液的制备方法为:
将二磷酸盐溶液和多巴溶液分散于微乳液中,得到磷相微乳液。
其中,所述二磷酸盐选自一线骨转移药物二膦酸盐,优选为氯膦酸二钠或唑来膦酸。
所述二磷酸盐溶液优选为二磷酸盐的水溶液,浓度优选为25毫摩尔/升,所述1,2-二(顺-9-十八碳烯酰)-sn-甘油3-磷酸钠盐(dopa)溶液优选为三氯甲烷溶液浓度优选为20毫克/毫升。所述二磷酸盐溶液、多巴溶液和微乳液的体积比优选为0.3:0.4:15。
所述钙相微乳液的制备方法为:
将可溶性钙盐的水溶液分散于微乳液中,得到钙相微乳液;
在本发明中,所述可溶性钙盐优选为氯化钙或硝酸钙。所述可溶性钙盐的水溶液的浓度为500毫摩尔/升,所述可溶性钙盐的水溶液与微乳液的体积比为0.3:15。
接着,将所述磷相微乳液滴加至所述钙相微乳液中,混合搅拌,得到混合液。
为保证二膦酸盐纳米材料的收率,二膦酸盐与钙离子的摩尔比小于0.1,混合搅拌至少30分钟。
接着,将得到的混合溶液与极性有机溶剂混合,所述极性有机溶剂选自乙醇或丙酮。混合后,离心沉淀,得到纳米颗粒,将得到的纳米颗粒用乙醇洗涤。
将得到的纳米颗粒超声分散至非极性有机溶剂中,所述非极性有机溶剂选自三氯甲烷或环己烷。
最后,采用聚乙二醇将所述纳米颗粒进行修饰,得到二膦酸盐纳米材料。
具体的,将所述纳米颗粒分散于非极性有机溶剂中,用二棕榈酰磷脂酰胆碱,胆固醇和1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-n-氨基-聚乙二醇修饰纳米颗粒。
其中,所述二棕榈酰磷脂酰胆碱,胆固醇和1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-n-氨基-聚乙二醇的摩尔比为4:4:2。
所述1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-n-氨基-聚乙二醇的分子量优选为2000~5000。
以下结合附图对本发明提供的二膦酸盐纳米材料的制备方法进行说明,参见图1,图1为本发明合成纳米材料cabp-peg合成示意图。
本发明将磷相微乳液与钙相微乳液混合后,得到混合溶液,将所述混合溶液与极性有机溶剂(例如乙醇)混合进行沉淀,得到纳米颗粒,将所述纳米颗粒分散于非极性有机溶剂(例如氯仿)中,得到cabp-dopa,将cabp-dopa经过聚乙二醇修饰,得到纳米材料cabp-peg。
本发明还提供了一种采用上述制备方法制备得到的二膦酸盐纳米材料。
本发明还提供了一种二膦酸盐纳米材料在制备用于检测并治疗癌症的治疗剂中的应用。所述二膦酸盐纳米材料可以选择性的清除肿瘤相关巨噬细胞,并调控肿瘤微环境(血管,灌注,乏氧)。
本发明还提供了一种放射性核素标记的二膦酸盐纳米材料,由放射性核素与上述二膦酸盐纳米材料制备而成。
本发明还提供了一种上述放射性核素标记的二膦酸盐纳米材料在肿瘤成像中的应用,所述放射性核素为阳离子核素,所述阳离子核素优选为金属阳离子放射性核素99mtc。
本发明还提供了一种上述放射性核素标记的二膦酸盐纳米材料在制备用于肿瘤治疗的药物中的应用,所述放射性核素为阴离子核素,所述阴离子核素优选为阴离子放射性核素32p。
本发明提供的纳米材料cabp-peg,不仅可以标记放射性核素99mtc用于单光子发射计算机化断层显像,还可以标记放射性核素32p用于肿瘤的治疗。该纳米材料具有良好的水溶性,单分散性,而且具有酸响应生物可降解功能。该纳米材料自身可以选择的杀伤肿瘤相关巨噬细胞,调节肿瘤微环境,使肿瘤血管正常化,增强肿瘤内的灌注和改善肿瘤的乏氧状态。
本发明所合成的纳米材料cabp-peg具有良好的水溶性,单分散性,而且具有酸响应生物可降解功能。应用本发明所合成的成纳米材料cabp-peg可以选择的杀伤肿瘤相关巨噬细胞,调节肿瘤微环境,使肿瘤血管正常化,增强肿瘤内的灌注和改善肿瘤的乏氧状态。应用本发明所纳米材料cabp-peg能够标记多种放射性核素实现肿瘤的显像和治疗。
为了进一步理解本发明,下面结合实施例对本发明提供的二膦酸盐纳米材料及其制备方法以及应用进行说明,本发明的保护范围不受以下实施例的限制。
实施例1
合成和修饰纳米材料cabp-peg:
第一步,配制30毫升微乳液,将4.35毫升co-520,2.25毫升tritonx-100,1.5毫升正己醇和21.9毫升环己烷均匀混合,均分为两份。
第二步,p相由300微升25毫摩尔/升氯膦酸二钠溶液和400微升10毫克/毫升dopa均匀分散在15毫升的微乳液中,ca相由300微升的500毫摩尔/升的氯化钙)溶液分散在15毫升的微乳液中,将p相逐步滴加到ca相,为保证二膦酸盐的收率,二膦酸盐与钙离子的摩尔比小于0.1,混合搅拌30分钟。
第三步,向混合液中加入等体积的乙醇,离心沉淀出纳米颗粒,再用乙醇多次洗涤纳米颗粒。
第四步,将纳米颗粒超声分散在三氯甲烷中。
第五步,用二棕榈酰磷脂酰胆碱,胆固醇和1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-n-氨基-聚乙二醇-5000修饰纳米颗粒,得到cabp-peg纳米材料。
然后对纳米材料进行表征,电子显微镜图像如图2显示,图2为实施例1制备的纳米材料的电子显微镜图像。所述纳米材料的直径约为50纳米,激光动态光散射结果如图3所示,图3为实施例1制备的纳米材料的动态光散射图。该纳米材料的水合粒径也为20纳米。
实施例2
材料的酸响应性能:
将实施例1制备的纳米材料置于不同ph条件下,间隔时间点取样进行电子显微镜和电感耦合等离子体发射光谱法分析。结果如图4~5所示,图4为纳米材料在不同酸度下的稳定性透射电镜图,图5为纳米材料在不同酸度下释放二膦酸盐药物。纳米材料在生理条件ph=7.4时,保持良好的稳定;在弱酸性条件下ph=6.5,5.5时,纳米材料会逐渐降解。
实施例3
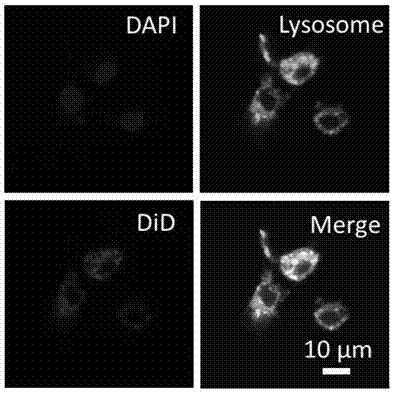
材料cabp-peg被细胞摄取水平:
将纳米材料cabp-peg标记荧光染料后与raw细胞培养12小时,固定后用激光共聚焦显微镜观察细胞。结果如图6所示,图6为纳米材料被raw细胞内吞,纳米材料cabp-peg被raw细胞有效的吞噬。
实施例4
纳米材料对不同细胞的杀伤:
将不同浓度游离二膦酸盐,空白纳米颗粒cap-peg,二膦酸盐纳米材料cabp-peg与不同细胞系孵育,24小时后测量细胞存活率。结果如图7所示,图7为游离的二膦酸盐,空白的纳米材料和二膦酸盐纳米材料对t41,ct26,3t3和raw细胞水平的杀伤效果。空白纳米材料和游离二膦酸盐的细胞毒性较低,而二膦酸盐纳米材料cabp-peg具有较强的细胞杀伤效果,而且对raw巨噬细胞的杀伤更为显著。
实施例5
纳米材料cabp-peg标记放射性核素99mtc
如图8所示,图8为纳米材料标记放射性核素99mtc流程示意图。将1毫居99mtco4-与100微升10毫克每毫升的硼氢化钠混合后加入到任意比例的纳米材料cabp-peg溶液中,搅拌一小时后,超滤出去游离的99mtc,得到cabp(99mtc)-peg纳米材料。
实施例6
cabp(99mtc)-peg纳米材料通过尾静脉注射到活体内对肿瘤的单光子发射计算机化断层显像:
尾静脉注射cabp(99mtc)-peg纳米材料后,间隔时间点对小鼠进行单光子发射计算机化断层显像扫描,图像处理后结果如图9所示,图9为实施例6中,cabp(99mtc)-peg纳米材料通过尾静脉注射到活体内对肿瘤的单光子发射计算机化断层显像,由图9可知,6小时后,在肿瘤部位有很强的扫描信号。
实施例7
cabp(99mtc)-peg纳米材料在生物体内的循环和分布实验
将cabp(99mtc)-peg纳米材料通过尾静脉注射到小鼠体内,间隔时间点眼眶去小鼠血样,24后,实验将小鼠牺牲,取出重要的器官和肿瘤称重后,然后将所有的样品置于伽马计数器中测量放射性活度。
结果如图10和11所示,图10为实施例7中cabp(99mtc)-peg纳米材料在生物体内血液循环,图11是实施例7中cabp(99mtc)-peg纳米材料在生物体内24小时后分布。由图10和图11可知,cabp(99mtc)-peg纳米材料在血液中有较长的循环时间,24小时后,材料在肿瘤组织有较强的富集。
实施例8
cabp-peg纳米材料选择性的清除肿瘤相关巨噬细胞
将pbs缓冲液,空白纳米颗粒cap-peg,二膦酸盐纳米材料cabp-peg分别尾静脉注射到皮下接种4t1肿瘤模型的小鼠,四天后再次注射,三天后将老鼠牺牲,取老鼠肿瘤,匀浆、过滤后,anti-cd11b,anti-cd206抗体染色,流式细胞仪分析细胞群体。用胶将肿瘤包埋后,冷冻切片,anti-f4/80抗体免疫荧光染色,观察小鼠肿瘤巨噬细胞的变化。取小鼠的血液,离心得到血清,酶联免疫吸附测定血清中白介素10(il-10),白介素12(il-12),肿瘤坏死因子α(tnf-α)和干扰素γ(ifn-γ)的水平。
结果图12所示,图12为实施例8中,cabp-peg纳米材料处理后小鼠肿瘤内单核细胞比例。流式细胞仪分析结果显示通过纳米材料cabp-peg处理后,肿瘤组织内单核细胞比例明显降低。
如图13所示,图13为实施例8中cabp-peg纳米材料处理后小鼠肿瘤内m2型巨噬细胞比例。纳米材料cabp-peg处理后,m2型肿瘤相关巨噬细胞占总细胞的比例和单核细胞的比例都明显降低。
如图14所示,图14为实施例8中cabp-peg纳米材料处理后小鼠肿瘤内肿瘤相关巨噬细胞的免疫荧光图像。纳米材料cabp-peg处理后,肿瘤相关巨噬细胞总量也显著下降。
如图15~18所示,图15为实施例8中cabp-peg纳米材料处理后小鼠血清白介素10水平。图16为实施例8中cabp-peg纳米材料处理后小鼠血清白介素12水平。图17为实施例8中cabp-peg纳米材料处理后小鼠血清肿瘤坏死因子α水平。图18为实施例8中cabp-peg纳米材料处理后小鼠血清干扰素γ水平纳米材料。由此可知,cabp-peg处理后,小鼠血清中促进肿瘤的白介素10降低,抗肿瘤的白介素12、肿瘤坏死因子α和干扰素γ信号水平升高。
实施例9
纳米材料对小鼠肿瘤内伊文思蓝灌注的增强
将pbs缓冲液,空白纳米颗粒cap-peg,二膦酸盐纳米材料cabp-peg分别尾静脉注射到皮下接种4t1肿瘤模型的小鼠,四天后再次注射。第二次注射24小时后,尾静脉注射伊文思蓝溶液,三小时后将老鼠牺牲,取肿瘤,拍照,然后用n,n-二甲基甲酰胺萃取出肿瘤内的伊文思蓝。
结果如图19~20所示,图19为实施例9中cabp-peg纳米材料处理后小鼠肿瘤内灌注伊文思蓝图像。图20为实施例9中cabp-peg纳米材料处理后小鼠肿瘤内灌注伊文思蓝相对含量。纳米材料cabp-peg处理后,小鼠肿瘤内伊文思蓝的灌注量明显上升,肿瘤灌注能力显著增强。
实施例10
纳米材料对肿瘤内氧气灌注的增强
将pbs缓冲液,空白纳米颗粒cap-peg,二膦酸盐纳米材料cabp-peg分别尾静脉注射到皮下接种4t1肿瘤模型的小鼠,四天后再次注射。第二次注射0,24小时,光声成像观察肿瘤内饱和氧的含量。结果如图21~23所示,图21为实施例10中,cabp-peg纳米材料处理后小鼠肿瘤内饱和氧的光声图像.图22是实施例10中cabp-peg纳米材料处理后小鼠肿瘤内饱和氧含量。图23是实施例10中cabp-peg纳米材料处理后小鼠肿瘤内平均血红蛋白的灌注量。纳米材料cabp-peg处理后,小鼠肿瘤内饱和氧的含量明显升高,血红蛋白的灌注也明显增强。
实施例11
纳米材料对肿瘤内乏氧状态的改善
将pbs缓冲液,空白纳米颗粒cap-peg,二膦酸盐纳米材料cabp-peg分别尾静脉注射到皮下接种4t1肿瘤模型的小鼠,四天后再次注射。第二次注射24小时后腹腔注射派嗼硝唑,90分钟后将老鼠牺牲,取肿瘤,用胶包埋后冷冻切片,免疫荧光染色。结果如图24~26所示,图24是实施例11中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧和血管免疫荧光图像。图25是实施例11中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧和血管免疫荧光信号强度。图26是实施例11中cabp-peg纳米材料处理后,小鼠肿瘤内有效扩张的血管数目。纳米材料cabp-peg处理后,小鼠乏氧信号明显降低;小鼠血管信号总强度减弱,但是扩张的血管数目显著上升,肿瘤扭曲的血管变得平滑。
实施例12
纳米材料对肿瘤内乏氧诱导因子表达的抑制
将pbs缓冲液,空白纳米颗粒cap-peg,二膦酸盐纳米材料cabp-peg分别尾静脉注射到皮下接种4t1肿瘤模型的小鼠,四天后再次注射。第二次注射24小时后将老鼠牺牲,取肿瘤,用胶包埋后冷冻切片,免疫荧光染色。结果如图27-28所示,图27是实施例12中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧诱导因子的免疫荧光图像。图28是实施例12中cabp-peg纳米材料处理后,小鼠肿瘤内乏氧诱导因子的免疫荧光信号的强度。纳米材料cabp-peg处理后,小鼠肿瘤内乏氧诱导因子信号的表达水平明显被抑制。
实施例13
纳米材料cabp-peg标记放射性治疗核素32p
将1毫居32po43-溶液与任意比例的纳米材料cabp-peg溶液混合,60℃下震荡过夜后,超滤出去游离的32p,得到纳米材料cabp(32p)-peg,过程如图29所示,图29是实施例13中纳米材料cabp-peg标记放射性治疗核素32p过程示意图。如图30所示,图30是实施例13中纳米材料cabp-peg标记放射性治疗核素32p标记稳定性。由图30可知,放射性标记具有很强的稳定性。
实施例14
纳米材料cabp(32p)-peg对4t1癌细胞毒性
将不同浓度游离32p,空白纳米颗粒cabp-peg,二膦酸盐纳米材料cabp-peg,纳米材料cabp(32p)-peg与4t1细胞孵育,72小时后测量细胞存活率。结果如图31所示,图31为实施例14中纳米材料cabp(32p)-peg对4t1癌细胞毒性。由图31可知,cabp(32p)-peg纳米材料对4t1细胞具有最强的细胞毒性。
实施例15
纳米材料cabp(32p)-peg对荷瘤小鼠肿瘤生长的抑制
选取25只背部带有4t1肿瘤的小鼠,随机分为五组,每组五只。将pbs,游离32p,空白纳米颗粒cabp-peg,二膦酸盐纳米材料cabp-peg,纳米材料cabp(32p)-peg分别尾静脉注射到小鼠,四天后再次注射。注射剂量为32p每只100微居,二膦酸盐每只200微克。测量小鼠肿瘤的大小,13天将小鼠牺牲。
结果如图32-33所示,图32是实施例15中不同处理后荷瘤小鼠肿瘤生长曲线。图33是实施例15中不同处理后13天后荷瘤小鼠肿瘤照片。由此可知,纳米材料cabp(32p)-peg能更加显著地抑制小鼠肿瘤的生长。如图34所示,图34为实施例15中,不同处理后小鼠肿瘤切片he和tunel染色。由图34可知,纳米材料cabp(32p)-peg对肿瘤细胞的杀伤效果最显著。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!