一种PEG/g-C3N4量子点复合荧光纳米微球及其应用的制作方法
本发明属于纳米生物医药领域,具体涉及一种peg/g-c3n4量子点复合荧光纳米微球及其应用。
背景技术
癌症,又称恶性肿瘤,严重威胁着人类健康和生命。传统的癌症治疗手段主要包括手术、化疗和放疗。目前,化疗已经被广泛用于癌症治疗,并通过与手术或放疗的联合使用,有效提高了癌症治疗效果。但是,常用的化疗药物对癌细胞和正常组织细胞的杀伤没有明显的选择性,过程中对患者造成严重的毒副作用,使人体免疫力下降,严重影响了患者的生存质量。此外,多次化疗往往会诱导癌细胞对化疗药物产生严重的多耐药性,最终导致治疗的失败。
近几十年来,随着纳米技术的发展,多种纳米材料如碳纳米管,氧化石墨烯和富勒烯等已经发展为药物载体用于抗肿瘤药物的输送。这些纳米载体可提高药物的水溶性和生物利用度,并利用肿瘤组织的高通透性和滞留效应(epr效应)将药物被动地富集到肿瘤组织,进而提高疗效同时降低全身毒性。此外,纳米药物载体有望通过主动运输的方式将药物输送到肿瘤细胞,从而阻断多耐药性肿瘤细胞的外排途径,从而有效地克服肿瘤的多耐药性。但是,大多数纳米药物载体自身不具有示踪功能,只有借助与荧光标记物或造影剂的复合才能实现其在细胞中的定位。因此,亟待开发一种集抗肿瘤药物输送和示踪功能为一体的纳米药物载体。
氮化碳量子点作为一种非金属高分子材料,具有荧光强、稳定性好、水溶性好、生物相容性好、无毒等优点,可替代传统量子点应用于生物医学领域。目前,氮化碳量子点在在癌症治疗方面的应用仍处于早期发展研究阶段,尚未见氮化碳量子点应用于抗肿瘤药物输送和示踪功能为一体的纳米药物载体的报道。
技术实现要素:
针对现有技术中存在的上述问题,本发明的目的在于提供一种peg/g-c3n4量子点复合荧光纳米微球(g-cnqds-peg)及应用,以peg/g-c3n4量子点复合荧光纳米微球为载体输送抗肿瘤药物,并借助其自身的荧光,实现同步示踪功能,同时该peg/g-c3n4量子点复合荧光纳米微球制备方法简单,原料较为廉价易得,因此极具工业化生产及实际应用之价值。
本发明的目的之一在于提供一种peg/g-c3n4量子点复合荧光纳米微球的制备方法。
本发明的目的之二在于提供上述制备方法得到的peg/g-c3n4量子点复合荧光纳米微球。
本发明的目的之三在于提供上述peg/g-c3n4量子点复合荧光纳米微球在制备纳米药物载体中的应用。
为实现上述目的,本发明涉及以下技术方案:
本发明的第一个方面,提供一种peg/g-c3n4量子点复合荧光纳米微球的制备方法,所述方法包括:
s1.将g-c3n4置于硝酸中加热回流,纯化后得硝酸氧化的g-c3n4;
s2.将硝酸氧化的g-c3n4与聚乙二醇(peg)加入水中经水热法处理经纯化后得peg/g-c3n4量子点复合荧光纳米微球。
优选的,所述步骤s1中,
g-c3n4与硝酸的质量体积比为1g:70~130ml(优选为1g:100ml);硝酸的摩尔浓度为5~7m(优选为6m);
加热回流时间控制为20~28h(优选为24h);
所述纯化步骤包括:将溶液蒸干后得到的粉末水洗至中性,干燥后即得硝酸氧化的g-c3n4;
进一步的,所述干燥控制温度为50~80℃(优选为60℃),控制时间为0.1~1h(优选为0.5h);
优选的,所述步骤s2中,
硝酸氧化的g-c3n4与聚乙二醇的质量比为1:1~3(优选为1:1.5);
聚乙二醇优选为氨基封端的聚乙二醇,进一步优选为peg1500n;
硝酸氧化的g-c3n4与水(优选为去离子水)的质量体积比为1mg:0.1~1ml(优选为1mg:0.3ml);
水热法具体条件为:在160~200℃(优选为180℃)反应10~15h(优选为12h);
所述纯化步骤包括:待反应液冷却至室温,经过滤、透析、冷冻干燥后即得g-cnqds-peg。
本发明的第二个方面,提供上述方法制备得到的peg/g-c3n4量子点复合荧光纳米微球。
本发明的第三个方面,提供上述peg/g-c3n4量子点复合荧光纳米微球在制备纳米药物载体中的应用。
优选的,所述应用包括一种载药系统,所述载药系统由纳米药物载体负载抗肿瘤药物而成;
其中,所述纳米药物载体即g-cnqds-peg,所述抗肿瘤药物包括但不限于阿霉素(dox)。
本发明的有益效果:
本发明首次以g-c3n4为原料,其经硝酸氧化后与氨基封端的聚乙二醇(peg)混合,然后进行水热处理,成功制备得到一种peg功能化的g-cnqds即peg/g-c3n4量子点复合荧光纳米微球(g-cnqds-peg),以peg/g-c3n4量子点复合荧光纳米微球为载体输送抗肿瘤药物,并借助其自身的荧光,实现同步示踪功能,且该载体系统具有良好的生物相容性、生物稳定性和低细胞毒性,同时兼具ph响应性,因此在细胞成像和药物传输领域具有良好的应用前景。
附图说明
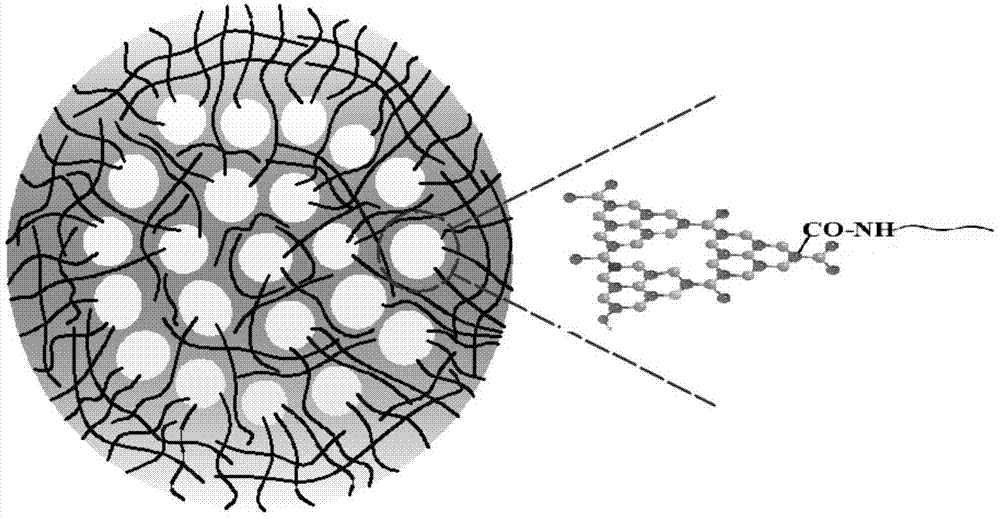
图1为g-cnqds-peg的结构示意图;
图2(a)为g-cnqds-peg的tem图,内插为粒径分布图;图2(b)单个g-cnqds-peg的tem图,内插为hrtem图;
图3(a)为g-cnqds-peg的荧光光谱图;图3(b)g-cnqds-peg在不同ph下的荧光强度图;
图4为g-cnqds-peg在水溶液、pbs溶液以及细胞培养液中的稳定性图(放置30天后未出现聚集现象);
图5为g-cnqds-peg与g-cnqds的细胞毒性比较图;
图6为g-cnqds-peg负载dox在不同ph条件下的体外释放行为图;
图7为g-cnqds-peg-dox孵育u251细胞2h、8h和16h的激光共聚焦照片,其中图7(a)dox由488nm激光激发,在595±50nm范围内收集信号;图7(b)g-cnqds-peg由405nm激光激发,在525±50nm范围内收集信号;图7(c)g-cnqds-peg和dox的融合图像。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
本发明的一种具体实施方式中,提供一种peg/g-c3n4量子点复合荧光纳米微球的制备方法,所述方法包括:
s1.将g-c3n4置于硝酸中加热回流,纯化后得硝酸氧化的g-c3n4;
s2.将硝酸氧化的g-c3n4与聚乙二醇(peg)加入水中经水热法处理经纯化后得peg/g-c3n4量子点复合荧光纳米微球。
本发明的又一具体实施方式中,所述步骤s1中,
g-c3n4与硝酸的质量体积比为1g:70~130ml(优选为1g:100ml);硝酸的摩尔浓度为5~7m(优选为6m);
加热回流时间控制为20~28h(优选为24h);
所述纯化步骤包括:将溶液蒸干后得到的粉末水洗至中性,干燥后即得硝酸氧化的g-c3n4;
所述干燥控制温度为50~80℃(优选为60℃),控制时间为0.1~1h(优选为0.5h)。
本发明的又一具体实施方式中,提供一种g-c3n4的制备方法,具体的,以尿素为原料,500℃下煅烧3h(升温速度为5℃/min),冷却至室温得淡黄色的g-c3n4粉末。
本发明的又一具体实施方式中,所述步骤s2中,
硝酸氧化的g-c3n4与聚乙二醇的质量比为1:1~3(优选为1:1.5);
聚乙二醇优选为氨基封端的聚乙二醇,进一步优选为peg1500n;
硝酸氧化的g-c3n4与水(优选为去离子水)的质量体积比为1mg:0.1~1ml(优选为1mg:0.3ml);
水热法具体条件为:在160~200℃(优选为180℃)反应10~15h(优选为12h);
所述纯化步骤包括:待反应液冷却至室温,经过滤、透析、冷冻干燥后即得g-cnqds-peg。
g-cnqds-peg的形成机理分析:g-c3n4-hno3在水热过程中原位生成g-c3n4量子点(g-cnqds)镶嵌于peg基质中,且g-cnqds上的羧基与peg上的氨基发生反应,形成酰胺键。
本发明的又一具体实施方式中,提供上述方法制备得到的peg/g-c3n4量子点复合荧光纳米微球。所述g-cnqds-peg尺寸均一,分布均匀,平均粒径为57nm,由多个粒径约6nm的g-c3n4量子点(g-cnqds)嵌入peg基质构成;经试验验证,g-cnqds-peg最佳激发波长为340nm,当激发波长由300至480nm变化时,其表现出明显的激发波长依赖性,其量子产率为9.3%,在ph=3-12范围内具有稳定的荧光性质。g-cnqds-peg具有良好的水溶性及生理环境下的稳定性;且细胞毒性较小,当g-cnqds-peg的浓度低于0.6mg/ml时无明显毒性,当其浓度高达1.5mg/ml时,细胞存活率仍高达85%,从而保证荧光成像及载药的安全性。
本发明的又一具体实施方式中,提供上述peg/g-c3n4量子点复合荧光纳米微球在制备纳米药物载体中的应用。
本发明的又一具体实施方式中,提供一种载药系统,所述载药系统由纳米药物载体负载抗肿瘤药物而成;
其中,所述纳米药物载体即g-cnqds-peg,所述抗肿瘤药物包括但不限于阿霉素(dox)。试验验证,以g-cnqds-peg为载体,利用氢键和疏水相互作用负载抗肿瘤药物阿霉素(dox),形成载药系统(g-cnqds-peg-dox),其dox的负载量可达56.6%;同时,g-cnqds-peg-dox的体外药物释放实验结果表明:在酸性条件下(ph=4.0,5.0和6.0),dox释放率(83.1%,73.2%和48.0%)明显高于ph=7.4环境下的释放率(19.2%)。即g-cnqds-peg可作为ph敏感型药物载体;因此基于g-cnqds-peg自身固有的荧光,以其为药物载体,可在输送药物的同时,实现同步示踪功能。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件进行。需要说明的是,本申请各实施例中g-c3n4粉末按如下方法制备得到:以尿素为原料,将装满尿素的有盖坩埚置于马弗炉中,500℃下煅烧3h(升温速度为5℃/min),冷却至室温得淡黄色的g-c3n4粉末。
实施例1peg/g-c3n4量子点复合荧光纳米微球(g-cnqds-peg)的制备
(1)将1gg-c3n4粉末加入有100ml6mhno3的蒸馏烧瓶中回流24h,将溶液蒸干后得到的白色粉末水洗至中性,然后置于60℃的真空干燥箱中干燥30min,得到硝酸氧化的g-c3n4(g-c3n4-hno3)。
(2)取100mgg-c3n4-hno3和150mgpeg1500n加入30ml去离子水中,超声30min,将混合液置于50ml的高压反应釜中,在180℃下水热反应12h,冷却至室温,用0.22μm滤膜过滤后取溶液,经透析、冷冻干燥后得到g-cnqds-peg。
经试验验证,g-cnqds-peg的平均粒径为57nm,由多个粒径约6nm的g-c3n4量子点(g-cnqds)嵌入peg基质构成,其结构、微观形貌及粒径分布如图1和图2所示。
同时,g-cnqds-peg最佳激发波长为340nm,当激发波长由300至480nm变化时,其表现出明显的激发波长依赖性,其量子产率为9.3%,在ph=3-12范围内具有稳定的荧光性质(如图3所示)。
g-cnqds-peg具有良好的水溶性及生理环境下的稳定性(如图4所示);细胞毒性较g-cnqds明显降低,当g-cnqds-peg的浓度低于0.6mg/ml时无明显毒性,当其浓度高达1.5mg/ml时,细胞存活率仍高达85%,可保证荧光成像及载药的安全性(如图5所示)。
实施例2peg/g-c3n4量子点复合荧光纳米微球(g-cnqds-peg)的制备
(1)将1gg-c3n4粉末加入有80ml5mhno3的蒸馏烧瓶中回流26h,将溶液蒸干后得到的白色粉末水洗至中性,然后置于70℃的真空干燥箱中干燥20min,得到硝酸氧化的g-c3n4(g-c3n4-hno3)。
(2)取100mgg-c3n4-hno3和200mgpeg1500n加入50ml去离子水中,超声30min,将混合液置于100ml的高压反应釜中,在200℃下水热反应10h,冷却至室温,用0.22μm滤膜过滤后取溶液,经透析、冷冻干燥后得到g-cnqds-peg。
实施例3peg/g-c3n4量子点复合荧光纳米微球(g-cnqds-peg)的制备
(1)将1gg-c3n4粉末加入有100ml7mhno3的蒸馏烧瓶中回流20h,将溶液蒸干后得到的白色粉末水洗至中性,然后置于50℃的真空干燥箱中干燥50min,得到硝酸氧化的g-c3n4(g-c3n4-hno3)。
(2)取100mgg-c3n4-hno3和120mgpeg1500n加入70ml去离子水中,超声30min,将混合液置于100ml的高压反应釜中,在160℃下水热反应14h,冷却至室温,用0.22μm滤膜过滤后取溶液,经透析、冷冻干燥后得到g-cnqds-peg。
实施例4g-cnqds-peg-dox的制备
分别取8ml的dox溶液(1mg/ml)加入8ml的g-cnqds-peg溶液(5mg/ml)中,室温下避光搅拌24h。将g-cnqds-peg-dox溶液置于截留分子量为mw=3500的透析袋中,在pbs溶液中透析48h,每4h更换一次pbs溶液,冷冻干燥得g-cnqds-peg-dox固体。
本实施例中,以g-cnqds-peg为载体,利用氢键和疏水相互作用负载抗肿瘤药物阿霉素(dox),形成载药系统(g-cnqds-peg-dox),经试验验证,dox的负载量可达56.6%。
g-cnqds-peg-dox的体外药物释放实验结果表明:在酸性条件下(ph=4.0,5.0和6.0),dox释放率(83.1%,73.2%和48.0%)明显高于ph=7.4环境下的释放率(19.2%)。即g-cnqds-peg可作为ph敏感型药物载体(如图6所示)。
因此基于g-cnqds-peg自身固有的荧光,以其为药物载体,可在输送药物的同时,实现同步示踪功能(如图7所示)。
实验例1g-cnqds的制备
(1)以尿素为原料,将装满尿素的有盖坩埚置于马弗炉中,500℃下煅烧3h(升温速度为5℃/min),冷却至室温得淡黄色的g-c3n4粉末。
(2)将1gg-c3n4粉末加入有100ml6mhno3的蒸馏烧瓶中回流24h,将溶液蒸干后得到的白色粉末水洗至中性,然后置于60℃的真空干燥箱中干燥30min,得到硝酸氧化的g-c3n4(g-c3n4-hno3)。
(3)取100mgg-c3n4-hno3加入30ml去离子水中,超声30min,将混合液置于50ml的高压反应釜中,在180℃下水热反应12h,冷却至室温,用0.22m微孔膜过滤溶液,并以5000rpm离心,冷冻干燥得到g-cnqds。
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!