TTD核杂化纳米颗粒、其制备方法及应用与流程
本发明属于材料领域,具体涉及一种杂化纳米颗粒,及其制备方法和应用。
背景技术
肿瘤mri成像局部组织成像分辨率高,但是整个机体灵敏度低,不容易快速找到肿瘤部位;肿瘤荧光成像灵敏度高,但是局部组织分辨率低。因此对实体肿瘤进行荧光/mri双模式成像能够实现快速精准的肿瘤诊断。临床上使用的实体肿瘤核磁共振成像(mri)造影剂钆喷酸葡胺(gd-dtpa)和钆特酸葡胺(gd-dota)因为分子量小,所以半衰期短,肿瘤部位蓄积少。大量研究采用将gd载入纳米颗粒提高颗粒大小,延长其半衰期;通过纳米颗粒在实体瘤的高通透性和滞留效应(epr效应),增强造影剂gd在肿瘤的局部浓度。小于20nm的颗粒进入肿瘤快,但是代谢也快,在肿瘤成像时间往往在3个小时之内。大颗粒在肿瘤部位停留的时间比较长,但是进肿瘤慢,有效肿瘤成像时间往往在3个小时以后。而且,所有目前工作开发的纳米颗粒不能提供长时间稳定的肿瘤t1信号。这些纳米颗粒在肿瘤部位提供的t1信号往往在某个时间点降低到峰值,然后迅速回升。因为不稳定的t1信号,所以人们只能在特定的短时间内观测肿瘤。要想长时间范围内都可以观测肿瘤,人们只能提高造影剂剂量,而高的造影剂剂量可能加大药物的毒副作用。本申请人早先通过微流控芯片合成了2小时内即能在肿瘤部位实现明显降低的t1信号并能稳定持续8个小时的纳米颗粒。
传统的荧光团稳定性差,半衰期短,强度低。aie荧光团溶解在溶液中是单分子分散状态,激发后通过分子间内转释放能量,但一旦聚集就因为分子间旋转的限制,能量耗散全部用于发射荧光,所以荧光稳定,半衰期长,强度高。
技术实现要素:
因此,本发明的目的在于克服现有技术中的缺陷,提供一种杂化纳米颗粒、其制备方法及应用。本申请中,本发明人通过微流控合成aie荧光团核/含gd磷脂壳的杂化纳米颗粒用于肿瘤荧光/mri双模式成像。
在阐述本发明内容之前,定义本文中所使用的术语如下:
术语“mri”是指:核磁共振成像。
术语“aie”是指:聚集发光。
术语“ttd”是指:2-(2,6-双((e)-4-(苯基(4’-(1,2,2-三苯基乙烯基)-[1,1’-联苯基]-4-基)氨基)苯乙烯基)-4h-吡喃4-亚甲基)丙二腈,是聚集发光荧光团的单个分子,英文标准命名为:
2-(2,6-bis((e)-4-(phenyl(4′-(1,2,2-triphenylvinyl)-[1,1′-biphenyl]-4-yl)amino)styryl)-4h-pyran-4-ylidene)malononitrile。
术语“dspe-peg2k-dota”是指:功能化磷脂。
术语“dspe”是指:二硬脂酰基磷脂酰乙醇胺。
术语“peg2k”是指:平均分子量为2000的聚乙二醇。
术语“gd-dtpa”是指:钆喷酸葡胺。
术语“gd-dota”是指:钆特酸葡胺。
术语“dota”是指:1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸。
术语“dipea”是指:n,n-二异丙基乙胺。
术语“dspe-peg2k-nh2”是指:二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-氨基交连物。
为实现上述目的,本发明的第一方面提供了一种杂化纳米颗粒,所述杂化纳米颗粒具有ttd核和dspe-peg2k-dota壳,表面鳌合gd。
本发明的第二方面提供了第一方面所述的纳米颗粒制备方法,所述纳米颗粒通过微流控方法合成;优选地,所述微流控方法包括以下步骤:
(1)通过dspe-peg2k-nh2和dota-nhs之间的酰胺化反应合成dspe-peg2k-dota;
(2)制备ttd溶液;
(3)通过微流控芯片将步骤(1)制得的dspe-peg2k-dota和步骤(2)制得的ttd溶液混合反应得到纳米颗粒溶液;
(4)将步骤(3)制得的纳米颗粒溶液与gdcl3·6h2o反应,超纯水透析得到所述杂化纳米颗粒。
根据本发明第二方面的制备方法,其中,所述微流控芯片包括两个部分:第一部分包含3个入口和一个混合直管道;第二部分包含一个中间入口和一个双螺旋混合管道。
优选地,所述微流控芯片第一部分3个入口管道宽度是100μm,其他部分管道宽度均为300μm;
更优选地,所有管道高度为60μm;
进一步优选地,双螺旋管道先逆时针转3圈,经过一个s管道后,再顺时针转3圈。
优选地,所述微流控芯片通过以下方法制备:
(i)su8-2100光刻胶先在4英寸硅片上以转速500rpm旋转10s,然后以转速3400rpm旋转60s;
(ii)65℃烘烤5min,95℃烘烤10min;
(iii)单面激光对准光刻机上放置印有管道的掩模板,对涂匀的光刻胶进行曝光,曝光条件150mj/cm2;
(iv)曝光的光刻胶60℃烘烤6min,110℃烘烤8min;
(v)用su-8显影液洗掉未曝光部分的光刻胶,即得到成型的光刻胶模板;
(vi)聚甲基硅氧烷浇筑在光刻胶模板上得到微流控芯片。
根据本发明第二方面的制备方法,其中,所述步骤(1)中,所述酰胺化反应包括以下步骤:
(a)dota-nhs溶于n,n-二甲基酰胺中制得dota-nhs溶液;优选地,dota-nhs溶液浓度为20mg/ml;
(b)向步骤(a)所得dota-nhs溶液中加入4倍摩尔数的有机碱n,n-二异丙基乙胺;
(c)向步骤(b)所得的溶液中加入dspe-peg2k-nh2,所述dota-nhs与所述dspe-peg2k-nh2摩尔比1~2:1,优选为1~1.5:1,最优选为1.2:1;
(d)将步骤(c)所得混合溶液室温下振荡反应,乙醇透析得到dspe-peg2k-dota。
根据本发明第二方面的制备方法,其中,所述步骤(2)中,所述ttd溶液的溶剂为三氟乙醇和n,n-二甲基酰胺的混合溶液,其中三氟乙醇和n,n-二甲基酰胺的体积比为7:3;
优选地,所述ttd溶液的浓度为0.5~2.0mg/ml;优选为0.9~1.2mg/ml;最优选为1.0mg/ml。
根据本发明第二方面的制备方法,其中,所述步骤(3)中,将所述ttd溶液由所述微流控芯片第一部分中间的入口经注射泵恒速推入,所述速率为3ml/h;
超纯水由所述微流控芯片第一部分两边的入口恒速推入,所述速率为240ml/h;
所述dspe-peg2k-dota的乙醇溶液由微流控芯片第二部分中间的入口恒速推入,所述速率为3ml/h。
根据本发明第二方面的制备方法,其中,其特征在于,所述步骤(4)中,所述gdcl3·6h2o的加入量与dspe-peg2k-dota的摩尔比为5:1。
本发明的第三方面提供了一种用于实体肿瘤核磁共振成像的造影剂,所述造影剂包含:
第一方面所述的杂化纳米颗粒,或
根据第二方面所述的制备方法而制得的杂化纳米颗粒。
本发明的目的在于:结合荧光成像和mri成像的优势于一种纳米颗粒上,实现快速精准的实体肿瘤诊断。
本发明人通过微流控芯片合成了聚集发光荧光团ttd和功能化磷脂dspe-peg2k-dota的杂化纳米颗粒,本发明人把gd螯合在纳米颗粒表面。小鼠实体肿瘤模型中,在这种杂化纳米颗粒尾静脉给药2小时后,小鼠肿瘤部位即出现了显著降低的t1信号。这个t1信号很稳定,一直到给药16小时都没有出现明显的回升。而且这个t1信号所显示的gd含量是对照组(同剂量gd的临床使用的gd-dtpa)肿瘤部位最高gd含量的3倍。虽然这种杂化颗粒只在肿瘤与正常组织的边界大量蓄积,但是一个明显的肿瘤边界线足以在动物体内区分一个肿瘤块。这种颗粒之所以不能在肿瘤部位大量蓄积,很可能是因为它相对较大的粒径(70nm)使得它不容易通过组织间隙渗入肿瘤内部。
本发明的杂化纳米颗粒可以具有但不限于以下有益效果:
1.弥补临床实体肿瘤mri造影剂的半衰期短,肿瘤蓄积少的问题。
2.结合荧光成像的高灵敏度和mri成像的高分辨率实现实体肿瘤快速精准的诊断;
3.与其他纳米颗粒mri造影剂研究相比,本专利设计的mri造影剂在肿瘤部位出现明显降低t1信号时间合适(小鼠尾静脉注射后2h),降低的t1信号稳定持续到给药后16h。
4.本发明设计的mri造影剂所用材料均通过fda认证,生物相容性和安全性均有保障。体内代谢实验显示颗粒1个月可以基本代谢掉,毒性实验显示毒性低于临床造影剂gd-dtpa。所以本发明设计的mri造影剂有很大的临床应用开发前景。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
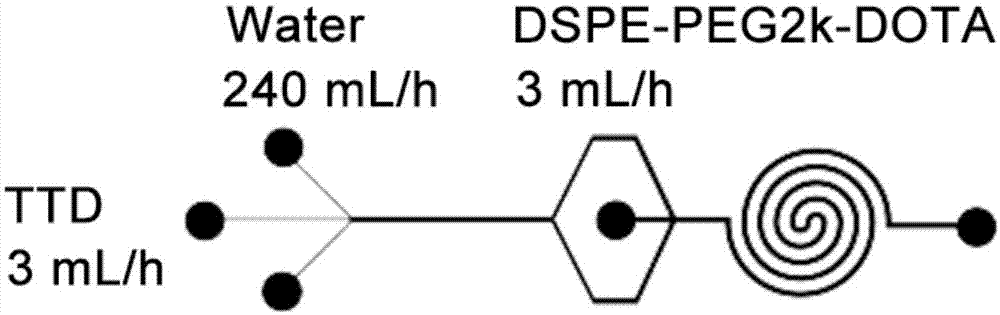
图1示出了本发明实施例1微流控芯片用于合成ttd核/dspe-peg2k-dota壳的杂化纳米颗粒。
图2示出了本发明实施例1制备的杂化纳米颗粒的粒径分布;其中图2a示出了动态光散射表征gdnp粒径分布;图2b示出了tem表征gdnp粒径分布,标尺200nm。
图3示出了本发明实施例1制备的gdnp元素含量分析;其中图3a示出了tem拍摄的gdnp上,沿着白线均匀设置50个点做元素分析;图3b示出了沿着a中白线所测得的碳元素分布;图3c示出了沿着a中白线所测得的氮和钆元素分布。b、c横坐标距离与a中白线距离上下一一对应。
图4示出了空载的超薄碳膜铜网上碳膜碳元素分析结果。
图5示出了示出了试验例1中裸鼠在注射nps后t1信号分布。
图6示出了nps和gd-dtpa的体内体外毒性结果;其中图6a示出了nps、gd-dtpa、gdcl3对人脐静脉细胞(huvec)的毒性评估。1np是刚合成的纳米颗粒,6np是浓缩6倍的纳米颗粒。浓缩6倍的纳米颗粒用于肿瘤成像。给药一个月后,小鼠取血进行进行肝肾生化指标分析,取各心肝脾肺肾进行组织切片毒性分析;图6b示出了nps、gd-dtpa、生理盐水组肝指标比对分析,含碱性磷酸酶(alp),天冬氨酸转氨酶(ast),丙氨酸转氨酶(alt),白蛋白/球蛋白(a/g),白蛋白(alb);图6c示出了nps、gd-dtpa、生理盐水组肾指标比对分析,含肌酐(crea),尿酸(ua),血尿素氮(bun)。生理盐水组的肝肾指标设置为100%;图6d示出了小鼠心肝脾肺肾部分苏木精-伊红染色(h&e染色),刻度100μm。
具体实施方式
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细具体地说明之用,而不应理解为用于以任何形式限制本发明。
本部分对本发明试验中所使用到的材料以及试验方法进行一般性的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。本领域技术人员清楚,在上下文中,如果未特别说明,本发明所用材料和操作方法是本领域公知的。
以下实施例中使用的试剂和仪器如下:试剂:
dota-nhs购自西安瑞禧生物科技有限公司;
ttd由香港科技大学唐本忠组捐赠;
dspe-peg2k-nh2购自avanti(美国);
dipea,gdcl3·6h2o,dmf,乙醇购自sigma-aldrich(美国);
pdms购自sylgard184,dowcorninginc.(美国);
su8-2100光刻胶购自microchem(美国);
透析袋购自北京索莱宝科技有限公司。
仪器:
mri,购自bruker公司(德国),型号biospec70/20usr。
实施例1
本实施例用于说明杂化纳米颗粒的制备方法。
dspe-peg2k-dota通过dspe-peg2k-nh2和dota-nhs之间的酰胺化反应获得。
20mgdota-nhs溶于1mln,n-二甲基酰胺(dmf)中,制得20mg/mldota-nhs溶液。加入4倍摩尔数(18.3μl)的有机碱n,n-二异丙基乙胺(dipea)提供edc/nhs酰胺反应的最适ph8。再加入60mgdspe-peg2k-nh2,dota-nhs与dspe-peg2k-nh2摩尔比1.2:1。混合溶液室温下振荡反应12h,未反应的dota-nhs、dipea和dmf在大量乙醇中透析除去,透析4次,透析袋3500dalton。最终得到的dspe-peg2k-dota溶于乙醇中,-20℃保存。
图1示出了本发明微流控芯片用于合成ttd核/dspe-peg2k-dota壳的杂化纳米颗粒。这个微流控芯片分为两部分:i)第一部分包含3个入口和一个混合直管道;ii)第二部分包含一个中间入口和一个双螺旋混合管道。第一部分3个入口管道宽度是100μm,其他部分管道宽度均为300μm。所有管道高度为60μm。双螺旋管道先逆时针转3圈,经过一个s管道后,再顺时针转3圈。
这个芯片是在一个su8-2100光刻胶制备的模板上做出来的。su8-2100光刻胶先在4英寸硅片上以转速500rpm旋转10s,然后以转速3400rpm旋转60s。65℃烘烤5min,95℃烘烤10min。单面激光对准光刻机上放置印有管道的掩模板,对涂匀的光刻胶进行曝光,150mj/cm2。曝光的光刻胶60℃烘烤6min,110℃烘烤8min。用su-8显影液洗掉未曝光部分的光刻胶,即得到成型的光刻胶模板。
聚甲基硅氧烷(pdms)浇筑在光刻胶模板上得到微流控芯片的工艺如下:
将未固化的pdms按照单体和固化剂10:1(v:v)的比例配成混合溶液,浇注到模板中,在80℃下固化2h,形成厚度约为4~6mm的微流控芯片,其中一面是有通道面。
ttd溶于四氢呋喃(thf),浓度1.0mg/ml,由微流控芯片第一部分中间的入口经注射泵恒速推入(7.4ml/h)。超纯水由微流控芯片第一部分两边的入口恒速推入(222ml/h)。dspe-peg2k-dota乙醇溶液(7.2mm)由微流控芯片第二部分中间的入口恒速推入(7.4ml/h)。制得的纳米颗粒溶液中加入5倍摩尔量于dspe-peg2k-dota的gdcl3·6h2o,振荡反应1h。大体积超纯水(4.5l)透析(3500dalton)除去多余的gd3+和cl-,重复2次,得到ttd核/dspe-peg2k-dota-gd纳米颗粒。
本申请人的颗粒虽然是核壳结构,但是壳很薄,电镜拍不出来(图2)。本申请人通过纳米颗粒元素分析表征颗粒的核壳结构(图3)。因为ttd核含有c、h、o、n三种元素,dspe-peg2000-dotagd含有c、h、o、n、p、gd五种元素,而颗粒是用磷钨酸(含h、p、o、w元素)负染的,为了避免染色剂元素的干扰,本申请人分析了纳米颗粒沿直径方向的c、n、gd元素含量。理论上,如果ttd是核,dspe-peg2000-dotagd在表面,那么c元素在颗粒内外都有,其含量沿纳米颗粒直径方向从边缘到中心应该是逐渐增加的;gd元素含量只分布在颗粒表面,其含量沿直径方向应该基本无变化。图2所示结果与理论结果相符,证实了颗粒的核壳结构。虽然本申请人使用的超薄碳膜铜网自身含碳元素,但是通过对铜网碳膜的元素含量分析可知其含量极低(图4),不足以影响纳米颗粒c元素含量的测定。超出纳米颗粒的位置仍然能检测到c、gd、n元素是因为纳米颗粒粒径分布广,虽然平均粒径在70nm左右,但是依然会有一些粒径很小的颗粒。
试验例1
本试验例用于说明本发明杂化纳米颗粒的效果。
得到的ttd核/dspe-peg2k-dota-gd纳米颗粒通过氮气浓缩6倍,加入5%葡萄糖配成等渗溶液,用于荷瘤小鼠尾静脉推注。荷瘤小鼠尾静脉推注200μl浓缩6倍的纳米颗粒,mri7t磁场下,2小时后可在实体肿瘤外周观测到一圈明显降低的t1信号,这种明显降低的t1信号稳定持续到给药10小时(图5)。
细胞毒性试验表明,ttd核/dspe-peg2k-dota-gd纳米颗粒未见细胞增殖毒性。
给药一个月后,检测小鼠血液的五种肝指标碱性磷酸酶、天冬氨酸转氨酶、丙氨酸转氨酶、白蛋白/球蛋白、白蛋白,三种肾指标肌酐、尿酸、尿素氮。与对照组(注射等量生理盐水)相比,误差范围内,肝肾指标均不高于对照组小鼠的肝肾指标,说明实验组小鼠肝肾并未发生损伤。给药一个月后,小鼠组织切片未见任何异于对照组的病变。检测结果如图6所示。
尽管本发明已进行了一定程度的描述,明显地,在不脱离本发明的精神和范围的条件下,可进行各个条件的适当变化。可以理解,本发明不限于所述实施方案,而归于权利要求的范围,其包括所述每个因素的等同替换。
- 还没有人留言评论。精彩留言会获得点赞!