G蛋白偶联受体109A抑制剂在药物制备中的应用的制作方法
本发明属于生物医药领域,具体涉及苯甲酰甘氨酸和间羟基苯丙酸通过抑制g蛋白偶联受体109a在相关疾病治疗中的应用。
背景技术:
g蛋白偶联受体(gpcr)是最通用的受体家族,因为它们具有与不同的化学配体响应的能力。尽管在过去几十年中研究者付出了大量努力,但仍有超过100个单独的gpcr其内源性配体未知。最近,形成gpcr亚家族的gpr109a,gpr109b和gpr81的配体被发现。这些受体的生理配体是酮体3-羟基丁酸盐,代谢产物2-羟基丙酸盐(乳酸盐)以及β-氧化中间体3-羟基辛酸酯。因此,该受体亚家族被作为能量代谢中间体的羟基羧酸配体活化。研究者提出其内源配体的羟基羧酸结构是该受体亚家族的特殊性质,并且羟基羧酸受体起代谢传感器的作用,其微调代谢途径的调节。
苯甲酰甘氨酸和间羟基苯丙酸是源自蓝莓色素多酚的代谢物,具有羟基羧酸的结构。研究发现这两种活性分子具有一定的生物活性,但对于g蛋白偶联受体109a的作用及g蛋白偶联受体109a介导疾病的作用尚不清楚。
技术实现要素:
本发明提供了一种新型的g蛋白偶联受体109a抑制剂在药物制备中的应用,以两种活性分子作为新型的g蛋白偶联受体109a抑制剂,可以用于制备治疗各种与g蛋白偶联受体109a有关的药物。
一种g蛋白偶联受体109a抑制剂在药物制备中的应用,所述的g蛋白偶联受体109a抑制剂为苯甲酰甘氨酸(hippuricacid/ha)或/和间羟基苯丙酸(3-(3-hydroxyphenyl)propionicacid/ppa),结构如式(i)所示:
作为优选,所述药物用于抑制gpr109a表达,逆转核因子κ-κb配体受体激活剂(rankl)对于gpr109a表达的促进作用。
作为优选,所述药物用于与gpr109a特异性的结合,几乎不与gpr109b结合。
作为优选,所述药物用于抑制骨髓间质细胞衰老。
作为优选,所述药物用于抑制破骨细胞增殖和骨吸收。
作为优选,所述药物用于在体内那促进骨形成,提升骨量。
作为优选,所述的药物还可以用于治疗心血管疾病等相关疾病如炎症性心血管疾病、外周心血管疾病、中风。
作为优选,所述的药物用于治疗肥胖等相关疾病如肥胖引起的慢性炎症、脂肪细胞分化。
作为优选,所述的药物用于其它可能受益于抑制gpr109a的疾病或病症。
作为优选,所述的药物含有治疗有效量的苯甲酰甘氨酸或/和间羟基苯丙酸及其可药用盐和药用辅料。
同现有技术相比,本发明的有益效果体现在:
本发明采用苯甲酰甘氨酸和间羟基苯丙酸作为新型的g蛋白偶联受体109a的抑制剂,可以针对各种与g蛋白偶联受体109a有关的各种疾病进行治疗,尤其对骨质疏松类、心脑血管类以及肥胖等相关疾病具有一定的疗效。
附图说明
图1在raw264.7细胞中,ha和ppa抑制gpr109a表达。
图2两种活性分子ha和ppa用于与gpr109a特异性的结合,几乎不与gpr109b结合。
图3两种活性分子ha和ppa用于抑制骨髓间质细胞的衰老。
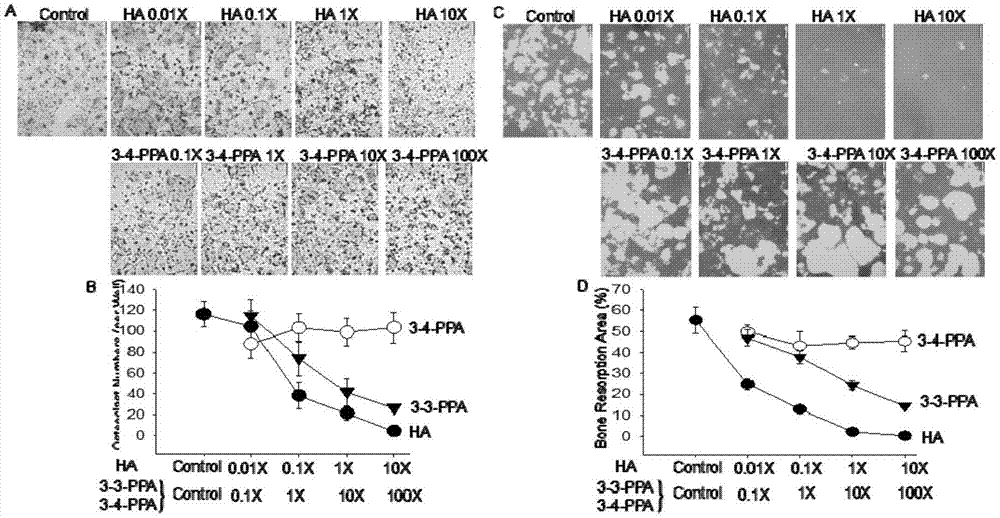
图4两种活性分子ha和ppa用于抑制破骨细胞增殖和骨吸收。
图5两种活性分子ha和ppa在体内刺激骨形成,增加骨量。
具体实施方式
下面结合具体实施例对本发明作进一步的说明。
实施例1
用四种不同浓度的ha或3-3-ppa(1xha=60μg/dl,1x3-3-ppa=10μg/dl)处理raw264.7细胞,使用细胞分离rna和实时pcr技术,ha和3-3-ppa均剂量依赖性地抑制gpr109a基因表达(图1a,1b)。使用western印迹分析,研究gpr109a蛋白质表达水平,结果表明ha和3-3-ppa均抑制gpr109a蛋白质表达水平(图1c)。破骨细胞生理活化剂rankl(核因子κ-b配体的受体激活剂)强烈激活gpr109a(图1c),与ha和3-3-ppa对破骨细胞生成标志物的抑制作用一致,ha和3-3-ppa显著抑制raw264.7细胞中rankl诱导的gpr109a蛋白表达(图1c)。
实施例2
ha和3-3-ppa是酚酸并且在结构上类似于烟酸。进行ha和3-3-ppa与g蛋白偶联受体109a(gpr109a,hm74a/puma-g)(烟酸受体)结合的测定。使用35s-gtpγs结合测定分析配体刺激的鸟嘌呤核苷酸交换,用从表达gpr109a或gpr109b的载体转染的小鼠颅盖细胞制备膜组分。gpr109b是gpr109a的紧密同源物,具有95%的氨基酸序列同一性。与烟酸相似,ha和3-3-ppa与来自用gpr109a转染的细胞的膜结合(图2a)。作为阳性对照,我们使用acifran,一种已知对gpr109a和gpr109b都有活性的烟酸类似物。与acifran不同,我们观察到ha和3-3-ppa与gpr109b的结合非常弱(图2b)。这些结果表明ha和3-3-ppa直接且特异性地与gpr109a相互作用。
实施例3
测试ha和3-3-ppa是否可以抑制骨髓基质细胞衰老。通过传代小鼠st2间充质干细胞30次建立了复制衰老细胞模型。细胞用1xha或3-3-ppa(1xha=60μg/dl,1x3-3-ppa=10μg/dl)处理24小时,提取细胞rna和蛋白质用于实时pcr和衰老相关的β-半乳糖苷酶(β-gal)活性分析,在第一次和最后一次(30次)后测定。ha和3-3-ppa显著抑制第一代细胞中的β-gal活性,并且在连续处理ha和ppa的情况下基本上抑制细胞中的β-gal活性传代30次(图3a)。根据这些数据,与未处理的那些相比,在用ha或3-3-ppa处理后,在第一和第30传代细胞中均发现p53基因的表达显著下调(图3b)。
实施例4
在50ng/mlrankl存在下,用四种不同浓度的ha,3-3-ppa或3-4-ppa处理raw264.7细胞5天。图4a中的显微照片是trapase染色后的代表性破骨细胞形态(未显示3-3-ppa数据,因为与ha相似)(1xha=60μg/dl,1x3-3-ppa或3-4-ppa=10μg/dl)。每孔的破骨细胞数和每次处理的一式三份,结果显示ha-和3-3-ppa-处理的细胞中破骨细胞的数量剂量依赖性地降低,但在3-4-ppa处理的细胞中无明显效果(图4b)。培养raw264.7细胞用于评估破骨细胞再吸收活性。图4c显示在50ng/mlrankl(3-3-ppa数据)存在下用四种不同浓度的ha,3-3-ppa或3-4-ppa处理后,在vonkossa染色上的白色代表性破骨细胞再吸收凹坑,一式三份(没有显示3-3-ppa数据,因为和ha结果类似)。每孔的骨吸收坑的百分比结果显示ha-和3-3-ppa处理的孔中破骨细胞骨吸收的剂量依赖性的降低,但在3-4-ppa处理的孔中没有效果(图4d)。我们在离体非贴壁骨髓细胞培养物中实验得出了上述结果。总之,结果证实ha-和3-3-ppa特异性地抑制破骨细胞活性和骨吸收。
实施例5
为了更好地了解不同剂量的ha和3-3-ppa如何对体内骨形成起作用,我们给予了四种剂量ha或3-3-ppa(小鼠腹腔注射0.1,0.5,1和5mg/kg/d)对一个月大的雌性c57bl6/j小鼠进行30天。micro-ct扫描显示ha和3-3-ppa,特别是剂量为0.1至1mg/kg/d时,显著增加小梁骨采集(我们提供数据为1mg/kg/d的ha和0.5mg/kg/d的3-3-ppa的剂量在图5和表1中)。在6周龄时,小鼠仍处于快速生长阶段,此时骨小梁骨积聚接近最大水平。用0.1,0.5和1mg/kg/天ha或ppa处理小鼠与盐水处理的对照饮食相比显著增加小梁骨体积(bv/tv)和结缔密度。与对照相比,这些骨吸收的增加的特征在于小梁厚度(tb.th)显着升高,并且ha或ppa处理的小鼠中的小梁间距(tb.sp)显着降低。在有或没有3-3-ppa处理的所有组中皮质参数没有显着差异(表1)。
表1.小鼠经3-3-ppa治疗后胫骨松质骨和皮质骨的微米ct扫描结果
注:用scancomicroctscanner扫描机(ct-40;scancomedicalag,bassersdorf,switzerland)对小鼠的胫骨进行微米ct扫描(micro-computedtomography)及对胫骨松质骨和皮质骨的评价(at6misotropicvoxelsizewithanx-raysourcepowerof55kvand145aandintegrationtimeof300ms)。*p<0.05针对0mg/kg/d,n=10.
- 还没有人留言评论。精彩留言会获得点赞!
- 5‑HT2B拮抗剂的制造方法与工艺
- 1‑(噻唑‑2‑基)哌啶‑4‑醇的合成方法与制造工艺
- 一种大麻酚类化合物的合成方法与制造工艺
- 一类对GPR84具有激动作用的化合物及其制备方法和用途与制造工艺
- eGFP标记GPR120阳性细胞的小鼠模型构建方法
- 靶向生长抑素受体的Al<sup>18</sup>F?NOTA?PEG<sub>6</sub>?TATE及其制备方法和应用
- 吡咯烷衍生物的口服制剂的制作方法
- 胰高血糖素样肽-1受体激动剂制备治疗肺动脉高压药物的应用
- 一种armc5基因检测试剂盒及突变位点的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法