使用阻抗检测来检测切除组织的样品中的癌细胞的技术的制作方法
本申请要求于2017年1月23日提交的并且序列号为62/499,222的题为“用于在莫氏显微外科手术(mms)中检测非黑色素瘤皮肤癌的快速方法和装置;边缘扫描”的美国临时专利申请的优先权。本申请还要求于2017年5月16日提交的并且序列号为62/603,081的题为“cole弛豫频率检测癌症并测量从正常(良性)到癌症的组织进化”的美国临时专利申请的优先权。本申请还要求于2018年1月12日提交的并且序列号为15/870,804的题为“使用阻抗检测来检测切除组织的样品中的癌细胞的技术”的美国专利申请的优先权。这些相关申请的主题通过引用结合在此。
背景技术:
本发明的实施方案总体上涉及医学诊断技术,并且更具体地,涉及使用阻抗检测来检测切除组织的样品中的癌细胞的技术。
相关技术的说明
莫氏显微外科手术(mms)是一种在去除基底细胞癌(bcc)和鳞状上皮细胞癌(scc)时使用的皮肤癌疗法。在mms期间,外科医生从怀疑包括一些癌细胞的患者的目标区域去除一层皮肤。在去除切除层之后,立即制备冷冻切片,外科医生在显微镜下检查载玻片以确定癌细胞的存在。根据该程序,外科医生从患者连续地去除并检查皮肤层,直到冷冻切片令人满意地被去除患病组织。mms有利地使外科医生能够从患者去除最少量的组织并在目标切除周围保留最大量的健康细胞。
mms的缺点之一是切除、检查和评估怀疑含有癌细胞的不同组织层对于外科医生而言非常耗时。特别地,如上所述,对于组织的每个切除层,外科医生必须手动制备冷冻切片,然后在显微镜下检查冷冻切片并评估样品是否含有任何癌细胞。由于mms的耗时性质,该特定程序被认为是昂贵形式的癌症疗法。
如前所述,本领域需要的是用于在莫氏显微外科手术期间分析和评估切除的组织层的更有效的技术。
技术实现要素:
本申请的一个实施方案提出了用于检测切除组织的样品中的癌细胞的方法。所述方法包括通过包括在电极阵列中的第一电极子集在第一操作频率下测量样品的第一切片的第一阻抗。所述方法还包括基于所述第一阻抗计算所述样品的第一切片的第一cole弛豫频率。该方法还包括基于第一cole弛豫频率确定样品的第一切片包含癌细胞。
所公开的组织测量系统的主要优点在于系统在不涉及外科医生的情况下快速且准确地检测从患者切除的组织内的癌细胞的存在和位置。因为所公开的系统能够在制备冷冻切片之前在mms程序中自动分析和评估连续切除的组织层,所以执行mms所需的时间显著减少,从而使mms成为更具成本效益的癌症治疗形式。
附图说明
因此,可以详细地理解本发明的上述特征的方式,可以通过参考实施方案获得上面简要概述的本发明的更具体的描述,附图中示出了其中一些实施方案。然而,应注意,附图仅示出了本发明的典型实施方案,因此不应被视为限制本发明的范围,因为本发明可允许其他同等有效的实施方案。
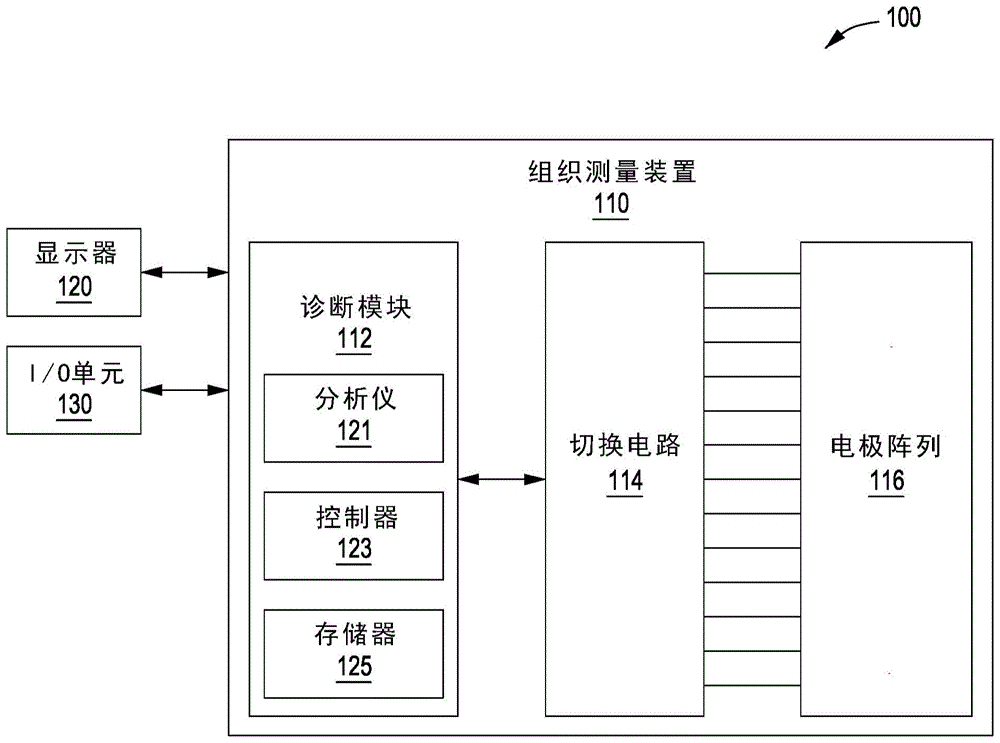
图1示出了被配置成实施本发明的一个或多个方面的组织测量系统。
图2是根据本发明的各种实施方案的图1的电极阵列的更详细的图示;
图3是根据本发明的各种实施方案的图1的切换电路的更详细的图示;
图4示出了根据本发明的各种实施方案的切除组织的多个切片的计算的cole弛豫频率;
图5示出了根据本发明的各种实施方案的表示基于各种计算的cole弛豫频率的患者样品组中癌症检测的准确度的表格;
图6是根据本发明的各种实施方案的用于自动分析和评估癌细胞的切除组织的样品的方法步骤的流程图;并且
图7是根据本发明的各种实施方案的用于检测切除组织的切片的阻抗的方法步骤的流程图。
具体实施方案
在以下描述中,阐述了许多具体细节以提供对本发明的更透彻的理解。然而,对于本领域技术人员显而易见的是,可以在没有这些具体细节中的一个或多个的情况下实践本发明。
如上所述,用于莫氏显微外科手术(mms)的常规技术需要外科医生切除并手动制备冷冻切片以用于切除组织的显微镜评估,以确定切除组织是否包含任何癌细胞。这种技术耗时且昂贵,因为漫长的过程需要外科医生或第三方在外科手术期间对每个切除层的若干个冷冻切片进行评估。
为了解决该问题,本发明的实施方案包括组织测量系统,该组织测量系统将电流发送到切除组织的样品的切片。连接到电极阵列的诊断模块接收电测量并基于电测量计算电特性(包括阻抗和cole弛豫频率)。诊断模块将计算的cole弛豫频率与癌症检测阈值进行比较以确定癌细胞是否存在于切除组织的样品的相应切片中。在一些实施方案中,诊断模块可以确定切除组织的样品中检测到的癌细胞的位置。
尽管该描述讨论了在mohs显微外科手术期间切除组织的样品,但是可以对其他类型的切除的组织细胞执行所公开的技术。此外,所公开的技术可以独立于mms过程来执行。
图1示出了被配置成实施本发明的一个或多个方面的组织测量系统。组织测量系统100包括组织测量装置110、显示器120和输入/输出(i/o)单元130。组织测量装置110包括诊断模块112、切换电路114和电极阵列116。诊断模块112包括分析仪121、控制器123和存储器125。
组织测量装置110自动测量切除组织的样品的切片的阻抗。诊断模块112使切换电路114选择电极阵列116的不同测量子集,这些测量子集测量切除组织的样品的不同切片的电特性。在一些实施方案中,当对切除组织的样品的切片执行测量时,诊断模块112可以在操作频率范围内执行测量的扫描。例如,电极阵列116的测量子集可以最初以1khz和25mhz之间的初始操作频率注入电流,然后测量并记录切除组织的样品的切片的电特性。然后,组织测量装置110可以扫过操作频率范围。例如,组织测量装置110可以以1khz的步长增加注入电流的操作频率。
组织测量装置110计算电特性的阻抗,并随后根据计算的阻抗计算cole弛豫频率(fcole)。切除组织的样品的切片的cole弛豫频率反映了细胞膜释放储存的电荷的速率。在一些实施方案中,组织测量装置110计算cole弛豫频率,作为切除组织的样品的切片中包括的多个细胞的放电速率的平均值。在一些实施方案中,组织测量装置100可以基于计算切除组织的样品的一个或多个切片的cole弛豫频率来确定癌细胞的存在和/或位置。在一些实施方案中,组织测量装置110可将测量数据输出到显示器120和/或i/o单元130。
在一些实施方案中,组织测量装置110可包括诊断模块112、切换电路114和电极阵列116作为单独的物理组件。在替代实施方案中,诊断模块112、切换电路114和/或电极阵列116可以共享共同的壳体。在一些实施方案中,组织测量装置110可以与显示器120和/或i/o单元130无线通信。
电极阵列116包括通过中间通道彼此电隔离的多个电极。在一些实施方案中,电极阵列116是平面的,从而允许切除组织的样品直接放置在电极阵列116的一个或多个电极上。在一些实施方案中,包括在电极阵列116中的一个或多个电极是非侵入性的并且可以具有配置成减小电极阵列116的各个电极与切除组织的样品之间的电极化的表面。例如,电极阵列116中的一个或多个电极可具有黑化铂(bpt)表面,该黑化铂表面与切除组织的样品的一部分物理接触,从而减小电极阵列116与切除组织的样品之间的电极化。
切换电路114连接电极阵列116和诊断模块112之间的电信号。在一些实施方案中,切换电路114还包括测量电路的组件,包括电压表和电流表。在这种情况下,切换电路114分别将来自电极阵列116的电极的测量子集连接到电压表和电流表,以测量切除组织的样品的切片的电压和电流。如下面将进一步详细讨论的,切换电路114包括各个开关的阵列,诸如微型继电器电路,每个开关连接到电极阵列116中的单独电极。在一些实施方案中,各个开关由诊断模块112中的控制器123控制,以将相应的电极连接到电流感测电路或电压感测电路。电流感测电路和电压感测电路中的每一个可以是单个测量电路的组件。在一些实施方案中,切换电路114可以保持微型继电器电路中包括的一个或多个微型继电器断开,其中连接的电极保持浮动并且在注入电流时提供高阻抗。
诊断模块112通过切换电路114连接到电极阵列116。在一些实施方案中,诊断模块112可以使用控制器123来执行存储在存储器125中的程序,以使用电极阵列116的多个测量子集对切除组织的样品进行多个电测量。在一些实施方案中,诊断模块112可以经由i/o单元130从用户接收指令以存储数据或经由电极阵列116执行特定的电测量。在一些实施方案中,诊断模块112可以存储由测量电路确定的测量的电特性,诸如在特定操作频率下的输入信号的测量电压和测量电流。在一些实施方案中,诊断模块112可包括处理单元。处理单元可以是单个中央处理单元(cpu)或处理单元的组合。处理单元可以是能够处理数据和/或执行软件代码的任何技术上可行的硬件单元。在一些实施方案中,诊断模块112的处理单元可以从用户或从存储器125接收指令并且可以执行指令。在一些实施方案中,处理单元可以实现由分析仪121和/或控制器123执行的一种或多种技术。
诊断模块112的分析仪121基于测量的电特性计算切除组织的样品的切片的实部和虚部阻抗。在一些实施方案中,诊断模块112将计算的阻抗存储在存储器125中。分析仪121基于对应于操作频率的计算阻抗计算切除组织的样品的切片的cole弛豫频率。切除组织的样品的切片的cole弛豫频率反映了细胞膜释放储存的电荷的速率。在一些实施方案中,分析仪121确定切除组织的样品的切片是否包括癌细胞。由于恶性细胞和非恶性细胞的对比电特性,恶性细胞的cole弛豫频率比非恶性细胞的cole弛豫频率小超过一千倍。分析仪121将计算的cole弛豫频率与预定的癌症检测阈值进行比较,以确定切除组织的样品的切片是否包含癌细胞。
在一些实施方案中,分析仪121可基于高于癌症检测阈值的一个或多个频率范围确定恶性癌细胞的概率。在这种情况下,每个频率范围可以指示癌细胞更危险并且可以指示需要更积极的治疗。例如,乳腺癌细胞的初始癌症检测阈值可以是100khz。在100khz至600khz的第一临界范围内发生的cole弛豫频率可指示乳腺癌会在治疗后复发。在600khz以上的第二临界范围内发生的cole弛豫频率可指示治疗后癌细胞转移的可能性高。癌症检测阈值以及每个临界范围的数量和阈值可以针对每种类型的癌症而变化。
在一些实施方案中,分析仪121可以针对一组计算的阻抗生成阻抗谱,该阻抗谱指示作为测量期间使用的操作频率的函数的阻抗的大小。在这种情况下,分析仪121可以通过执行回归分析来计算该组阻抗的cole弛豫频率,以找到存储在存储器125中的预定阻抗谱的最佳拟合。分析仪121可以通过确定与阻抗谱的峰值阻抗相对应的频率来从阻抗谱确定cole弛豫频率。
诊断模块112的控制器123使切换电路114选择电极阵列116的不同测量子集,这些测量子集测量切除组织的样品的不同切片的电特性。当使用电极阵列116的测量子集开始测量时,控制器123还设置注入电流的操作频率和幅度。在一些实施方案中,控制器123可以加载存储在存储器125中的指令并使用电极阵列116的一个或多个测量子集执行测量程序。在一些实施方案中,控制器123可以生成一个或多个控制信号并将其发送到切换电路114,以打开和/或关闭对应于电极阵列116的不同测量子集的开关。控制器123可以通过将控制信号发送到切换电路114来改变到不同的测量子集,该切换电路将测量子集的电极电气地连接到测量电路,同时断开电极阵列116中的所有剩余电极。
存储器125被配置成存储数据和/或软件应用程序。存储器125可以包括随机存取存储器(ram)模块、硬盘、闪存单元或任何其他类型的存储器单元或其组合。诊断模块112和i/o单元130被配置成从存储器125读取数据。诊断模块112和i/o单元130还被配置成将数据写入存储器125。
显示器120显示从组织测量装置110发送的数据。在一个实施方案中,显示器120显示计算的cole弛豫频率、癌细胞区域的位置和切除组织的样品中癌症的概率中的一个或多个。在一些实施方案中,显示器120可刷新从组织测量装置110接收的数据,同时组织测量装置110对切除组织的样品执行测量。在一些实施方案中,显示器120可以显示切除组织的样品的具有可能的癌细胞的位置指示的图像。
i/o单元130从组织测量装置110接收输出信号,并将来自用户的输入信号传输到组织测量装置110。在一些实施方案中,i/o单元130将程序输入信号发送到控制器诊断模块112,其中诊断模块112将程序存储在存储器125中。在一些实施方案中,i/o单元130可以包括能够接收一个或多个输入的设备,包括键盘、鼠标、输入平板电脑、相机和/或三维(3d)扫描仪。在一些实施方案中,i/o单元130还可以包括能够提供一个或多个输出的设备,诸如扬声器或打印机。i/o单元130还可以包括能够接收输入并提供输出的设备,诸如触摸屏和通用串行总线(usb)端口。
图2是根据本发明的各种实施方案的图1的电极阵列的更详细的图示。电极阵列116包括第一列电极202a-1和第二列电极204a-i。在一些实施方案中,电极列202a-1、204a-1中的每个电极之间的物理距离是恒定的。在一些实施方案中,不同电极对的电路径是恒定的。例如,电极202a和电极202b之间的物理距离可以具有1mm的物理距离,该物理距离可以等于电极204j和204k之间的1mm物理距离。类似地,通过将电极202a、202b连接到切换电路114形成的电路径等于通过将电极204j、204k连接到切换电路114而形成的电路径。在一些实施方案中,控制器124通过切换电路114选择电极206a-c的测量子集,其中测量电路包括具有相同路径长度的电极。选择这种测量子集提供了通过在执行多次测量时避免反射和相移来避免同步问题的优点。在一些实施方案中,电极202a-1、204a-1的物理路径长度和/或电路径长度可以不相等,但可以在时间上固定。在这种情况下,可以调整随后的信号处理步骤以补偿不相等的物理路径长度和/或不相等的电路径长度。
在操作期间,控制器123可以通过选择包括电极202a-d的电极阵列116的测量子集206a来测量位于切片208a处的切除组织的样品的切片的电特性。类似地,控制器123可以通过选择包括电极204d-g的测量子集206b来测量切片208b。控制器123可以通过选择包括电极202f-i、204f-i的测量子集206a来测量切片208c。在一些实施方案中,控制器123可以通过选择具有远离该切片的电极的测量子集来测量切除组织的样品的变化深度。例如,当测量切片208c时,控制器123可以通过选择包括电极202c-1、204c-1中的每一个的测量子集来测量不同深度的切片208c。当切换电路114将测量子集206a连接到测量电路时,电极202a-d中的一个或多个可以连接到电压感测装置,电极202a-d中的一个或多个可以连接到电流感测装置,而电极202e-1、204a-1的其余部分与测量电路断开。
在一些实施方案中,测量子集206a中的电极对202a、202d形成电流感测电路。在这种情况下,电极202a用作从电流发生器接收电流的注入电极。注入电极202a接收交流电,该交流电的频率对应于由控制器123指定的操作频率。电极202d用作返回电极,该返回电极通过连接到电极202a来完成电流路径。在一些实施方案中,返回电极202d连接到电流感测电路或电流感测设备,诸如电流表。诊断模块112可以接收由电流感测电路或电流感测设备提供的电流测量值,并将测量的电流与初始电流的操作频率相关联。
在一些实施方案中,形成电流感测电路的电极之间的一个或多个电极可以是电压感测电路的一部分。例如,测量子集206a的电极202b、202c可以用作电压感测电极并且连接到电压感测电路或电压感测设备,诸如电压表。电压感测电极202b、202c可以具有高阻抗,以避免将杂散电流添加到测量电路中。诊断模块112可以接收由电压感测电路或电压感测设备提供的电压测量值,并将测量的电流与初始电流的操作频率相关联。
控制器123可以通过切换到不同的测量子集206a、206b、206c来测量切除组织的样品的不同切片。例如,通过使测量子集206a与测量电路断开并将测量子集206b连接到测量电路,控制器123可以使切换电路114从测量切片208a切换到切片208b。在一些实施方案中,控制器123可以以预定义的模式在切片208a、208b、208c之间切换。例如,控制器123可以对切片208a执行一系列电测量10至60秒。然后,控制器123可以使切换电路114选择不同的测量子集,以对位于电极202c和202d之间的切除组织的样品的切片执行一系列电测量10至60秒。在一些实施方案中,控制器123可以对电极阵列116内的所有切片执行电测量60至120秒。
图3是根据本发明的各种实施方案的图1的切换电路的更详细的图示。切换电路144包括连接到继电器驱动器304的微型继电器电路302a-d。在一些实施方案中,继电器驱动器304可以从控制器123接收一个或多个控制信号,并将一个或多个电极连接到测量电路的电压感测电路,并将一个或多个电极连接到测量电路的电流感测电路。
继电器驱动器304可以是控制一个或多个微型继电器电路302a-d的微控制器或其他电子电路。在一些实施方案中,一个或多个继电器驱动器304可以控制连接到电极阵列116中的对应电极的每个微型继电器电路。在一些实施方案中,继电器驱动器304可以从控制器123接收控制信号以将电极连接到测量电路。继电器驱动器304可以通过将一个或多个驱动信号发送到包括在每个微型继电器电路302a-d中的微型继电器部件来响应所接收的控制信号。驱动信号可以关闭一对微型继电器部件中的一个或打开每个微型继电器部件。在一些实施方案中,通过将驱动信号发送到对应于测量子集206a、206b中包括的电极的每个微型继电器电路302a-d,继电器驱动器304将电极206a的测量子集切换到电极206b的单独的测量子集。
每个微型继电器电路302a-d连接到电极阵列116中的单独电极。在一些实施方案中,微型继电器电路302a-d包括放大器和放大器输入端处的两个单独的微型继电器部件。在一些实施方案中,继电器驱动器304可以打开两个微型继电器部件,从而配置电路以在电极阵列116中的相应电极处执行电压感测。继电器驱动器304可以闭合两个微型继电器部件中的第一个,以将微型继电器电路302a-d和相应的电极连接到电流注入源。在一些实施方案中,继电器驱动器304可以闭合两个微型继电器部件中的第二个,以将微型继电器电路302a-d和相应的电极连接到电流感测电路。在一些实施方案中,不在测量子集206a中的一个或多个剩余电极可以与地短接。
在一些实施方案中,双电极配置可以感测电流和电压。在双电极配置中,配置用于电压感测的电极阵列116中的一个电极也可以同时被配置用于电流注入,而配置用于电压感测的第二电极也可以同时被配置用于电流感测。
微型继电器电路302a-d使用一个或多个微型继电器部件执行切换。微型继电器部件有利地在电流注入和/或电流感测电路与电极的连接和断开之间切换,其中最小的寄生阻抗或电容(1-2pf)被添加到测量电路。通过避免添加这种寄生阻抗和电容,切换电路114可以快速地在测量子集206a-c之间切换,而不会牺牲所收集的电测量的精度。微型继电器电路302a-d还提供使用电气开关而不是较慢的机械旋转开关的优点。
在一些实施方案中,微型继电器电路302a-d可以包括一种或多种校正技术,以在测量子集206a正在执行电测量时最小化由电极阵列116中的一个或多个电极引起的串扰。例如,电极阵列116的一个或多个电极可以连接到reed继电器,诸如1pf电容器(未示出),以限制电极阵列116中不包括在测量子集206a中的电极的串扰。在一些实施方案中,微型继电器电路302a-d可以匹配阻抗。
图4示出了根据本发明的各种实施方案的切除组织的多个切片的计算的cole弛豫频率。曲线图400示出了阻抗谱,该阻抗谱指示基于由电极阵列116测量的电压和电流的一系列操作频率的计算阻抗。曲线图410示出了可能包括恶性细胞的切除组织的样品的切片的阻抗谱412。曲线图420示出了可能不包括任何恶性细胞的切除组织的样品的切片的阻抗谱423。
图表410包括癌症检测阈值416和临界阶段阈值418。阻抗谱412包括对应于阻抗谱412的峰值的cole弛豫频率414。在一些实施方案中,分析仪121通过生成阻抗谱412并确定与曲线的峰值对应的频率来计算cole弛豫频率414。在一些实施方案中,分析仪121可以将cole弛豫频率与癌症检测阈值416和/或临界阶段阈值418进行比较。
例如,分析仪121可以将cole弛豫频率414与癌症检测阈值416进行比较。在一些实施方案中,癌症检测阈值416的范围可以从100khz到600khz。分析仪121可以确定切除组织的样品的切片可能包含恶性细胞,因为cole弛豫频率414超过癌症检测阈值416。相比之下,分析仪121可以确定比较阻抗谱422的cole弛豫频率424与癌症检测阈值426。分析仪121可以确定切除组织的样品的切片可能不包含恶性细胞,因为cole弛豫频率424小于癌症检测阈值426。在一些情况下,含有恶性癌细胞的组织样品的cole弛豫频率414比不含任何恶性癌细胞的组织样品的cole弛豫频率424大约1000倍。
在一些实施方案中,分析仪121可以将cole弛豫频率414与临界阶段阈值418进行比较。在一些实施方案中,临界阶段阈值428的范围可以从1mhz到2mhz。分析仪121可以确定切除组织的样品的切片不包含可能接近指示更危险的癌细胞浓度的临界阶段的细胞,因为cole弛豫频率414低于临界阶段阈值418。类似地,分析仪121可以确定比较cole弛豫频率424与临界阶段阈值428。分析仪121可以确定切除组织的样品的切片可能不包含可能接近指示更危险的癌细胞浓度的临界阶段的细胞,因为cole弛豫频率424小于临界阶段阈值428。在一些实施方案中,分析仪121可以将cole弛豫频率424与多个临界阶段阈值进行比较,其中每个关键阶段阈值指示更高的癌症概率和/或更危险的诊断。
图5示出了根据本发明的各种实施方案的表示基于各种计算的cole弛豫频率的患者样品组中癌症检测的准确度的表格。表500示出了使用组织测量系统100对于一组患者的鳞状细胞癌(scc)520、基底细胞癌(bcc)530和组合结果510的列表诊断结果。
表530示出了来自177个基底细胞癌测试的样品,组织测量系统100准确地分类超过97%的切除组织的样品。组织测量系统的准确度包括高灵敏度率,反映了组织测量系统100正确检测实际包含恶性细胞的切除组织中的恶性细胞的比率。组织测量系统的准确度还包括高特异性率,反映了组织测量系统100未正确检测实际不包含恶性细胞的切除组织中的恶性细胞的比率。
表520示出了来自29个鳞状细胞癌测试的样品,组织测量系统100准确地分类每个切除组织的样品。表510示出了组织测量系统100在超过98%的切除组织的样品中准确地检测到bcc或scc的存在或不存在。组织测量系统100提供了在快速且高精度地自动检测切除组织的样品中的癌细胞方面优于现有装置的技术改进。
图6是根据本发明的各种实施方案的用于自动分析和评估癌细胞的切除组织样品的方法步骤的流程图。尽管结合图1-4的系统描述了方法步骤,但是本领域技术人员将理解,被配置成以任何顺序执行方法步骤的任何系统都在本发明的范围内。
如图所示,用于自动分析和评估切除组织的样品的方法600始于步骤601,其中组织测量装置110的诊断模块112选择切除组织的样品的切片进行测量。包括在诊断模块112中的控制器123将控制信号发送到切换电路114,以连接围绕所选切片的电极阵列116的测量子集206a。在一些实施方案中,控制器123基于来自从存储器125加载的程序的指令选择切除组织的样品的切片。在一些实施方案中,控制器123基于经由i/o单元130接收的用户输入来选择切除组织的样品的切片。
在步骤603,组织测量装置110测量切除组织的样品的切片的至少一个阻抗。在一些实施方案中,控制器123可以使切换电路114扫过测量电路的操作频率,以便测量切除组织的样品的切片的电压和电流。在一些实施方案中,诊断模块112可以将在每个操作频率下测量的电压和电流存储在存储器125中。在一些实施方案中,诊断模块112中的分析仪121可以将给定操作频率的阻抗计算为测量电压和测量电流的比率。
在步骤605,组织测量装置110的诊断模块112计算切除组织的样品的切片的cole弛豫频率414、424。在一些实施方案中,诊断模块112的分析仪121可基于针对切除组织的样品的切片计算的一个或多个阻抗来计算cole弛豫频率414、424。在一些实施方案中,分析仪121可基于单个操作频率下的阻抗来计算cole弛豫频率414、422。在一些实施方案中,分析仪121可以从在多个操作频率下计算的一组阻抗生成阻抗谱。然后,分析仪121可以通过确定阻抗谱412、422的峰值并确定峰值出现的频率来计算cole弛豫频率414、424。
在步骤607,组织测量装置110的诊断模块112发送一个或多个计算结果以进行显示。在一些实施方案中,分析仪121可基于cole弛豫频率414、424确定癌细胞的存在或不存在。分析仪121将切除组织的样品的切片的cole弛豫频率414、424与癌症检测阈值418、428进行比较,并且当cole弛豫频率414、424超过癌症检测阈值418、428时生成该切片包含癌细胞的指示。在一些实施方案中,分析仪121可以生成识别癌细胞位置的映射图像,癌细胞位置对应于分析仪121确定包含癌细胞的切除组织的样品的切片。分析仪121可将癌症检测指示符和/或映射图像发送到显示器120。
在步骤609,组织测量装置110的诊断模块112确定是否测量切除组织的样品的另一个切片。当执行指令以预定义的序列测量切除组织的样品的多个切片时,控制器123可以确定测量切除组织的样品的另一个切片。例如,控制器123可以使用电极阵列116中的单列电极202a-1执行指令以测量切除组织的样品的连续切片。当控制器123确定测量另一个切片时,诊断模块112进行到步骤611,否则,方法600在步骤613结束。
在步骤613,组织测量装置110的诊断模块112选择电极阵列116的不同测量子集206b以测量切除组织的样品的不同切片。在一些实施方案中,控制器123使切换电路114将一个或多个电极与先前的测量子集206a断开,并将测量子集206b中的电极连接到测量电路。在切换到新的测量子集206b之后,组织测量装置110返回到步骤601。
图7是根据本发明的各种实施方案的用于检测切除组织的切片的阻抗的方法步骤的流程图。尽管结合图1-4的系统描述了方法步骤,但是本领域技术人员将理解,被配置成以任何顺序执行方法步骤的任何系统都在本发明的范围内。
方法603发生在方法600的步骤601和步骤605之间。如图所示,方法603始于步骤701,其中诊断模块112的控制器123选择一组电极以测量切除组织的样品的选择切片。控制器123使切换电路114将测量子集206a连接到测量电路。在一些实施方案中,控制器123使切换电路114将电极阵列116中的所有剩余电极与地短接。
在步骤703,控制器123选择用于测量交流电的操作频率。在一些实施方案中,控制器123将控制信号发送到包括信号发生器的切换电路114。控制器123使切换电路114中的信号发生器产生具有交流电的测量信号,其中交流电的频率是操作频率。
在步骤705,切换电路114以操作频率注入测量信号。在一些实施方案中,切换电路114通过将测量子集206中的电极对连接到信号发生器以关闭电流路径来注入测量信号。在一些实施方案中,电流路径可以包括电流感测电路或测量测量信号的电流的电流感测设备。
在步骤707,切换电路114感测切除组织的样品的切片的电压。在一些实施方案中,切换电路114将一个或多个电极202b-c连接到电压感测电路或装置。一个或多个电极202b-c物理地位于形成电流路径的电极对之间。一个或多个电极202b-c提供高阻抗电压感测电路,该高阻抗电压感测电路不将杂散电流引入到承载测量信号的电流路径中。在一些实施方案中,电压感测电路测量位于电压感测电路中包括的一个或多个电极202b-c之间的切除组织的样品的切片的电压。
在步骤709,诊断模块112中的控制器121确定是否以另一频率测量切除组织的切片的电特性。在一些实施方案中,控制器123可以将测量信号的操作频率改变为频率扫描的一部分,以使用多个操作频率测量切除组织的样品的相同切片。在一些实施方案中,控制器123可以在指定的频率范围内以恒定速率增加操作频率。例如,控制器123可以设置1khz的初始操作频率并且使操作频率增加50khz直到达到1mhz的最终操作频率。当控制器123确定测量电路要以另一频率执行测量时,控制器123返回到步骤703,否则,控制器123进行到方法600的步骤605。
总之,本文公开的组织测量系统使得能够基于切除组织的切片的所测量的阻抗在切除组织的样品内自动检测癌细胞。组织测量系统中的控制器使用切换电路来选择电极阵列中的第一电极子集,其中第一电极子集通过切除组织的给定切片传输电流。当电流通过切除组织的给定切片传输时,包括在组织测量系统中的分析仪测量切除组织的给定切片的电阻抗。然后,分析仪基于测量的电阻抗计算切除组织的给定切片的cole弛豫频率。切除组织的给定切片的cole弛豫频率反映了细胞膜释放存储的电荷的速率。分析仪将针对切除组织的切片的计算的cole弛豫频率与阈值进行比较。如果针对给定切除组织的切片的计算的cole弛豫频率超过阈值,则认为癌细胞存在于切除组织的给定切片中。
在一些实施方案中,切换电路包括连接到电极阵列中的每个电极的单独的微型继电器,以便防止电极阵列将串扰信号、杂散阻抗或其他寄生电荷引入到切除组织的不同切片的测量阻抗中。在一些实施方案中,控制器使切换电路选择电极阵列中的不同子集电极以确定切除组织的不同切片的阻抗。因此,分析仪可以基于针对那些切片测量的相应阻抗来确定切除组织的每个切片的癌细胞的存在。分析仪还基于确定包括癌细胞的不同切片的位置指示检测到的癌细胞的每个位置。
所公开的技术的主要优点在于组织测量系统使用户能够基于计算的cole弛豫频率以高精度快速检测组织中癌细胞的存在和位置。基于cole弛豫频率检测癌细胞使得外科医生能够在mms期间评估切除的组织时保持高准确度,而不需要每个切除的组织层的冷冻切片制备和显微镜评估,从而大大减少mms的程序时间。mms的时间减少也大大降低了执行mms作为皮肤癌疗法的成本。
所公开的技术的另一个优点是组织测量系统包括微型继电器部件,该微型继电器部件有利地在连接和断开电极之间切换,以测量切除组织的样品的电特性,而不引入寄生阻抗或电容。避免寄生阻抗和电容的增加使得组织测量系统能够快速切换到不同电极的连接,而不会牺牲所收集的电测量的准确性。
1.在一些实施方案中,用于检测切除组织的样品中的癌细胞的方法包括:通过包括在电极阵列中的第一电极子集,在第一操作频率下测量所述样品的第一切片的第一阻抗;基于所述第一阻抗计算所述样品的第一切片的第一cole弛豫频率;以及基于该第一cole弛豫频率确定所述样品的第一切片包含癌细胞。
2.根据条款1所述的方法,所述方法还包括:通过包括在所述电极阵列中的第二电极子集,在第一操作频率下测量所述样品的第二切片的第二阻抗。
3.根据条款1或2所述的方法,所述方法还包括:基于第二阻抗计算样品的第二部分的第二cole弛豫频率;基于该第二cole弛豫频率确定所述组织的第二切片包含癌细胞;以及基于所述第一切片在所述样品内的位置和所述第二切片在所述样品内的位置确定癌细胞在所述样品中的位置。
4.根据条款1-3中任一项所述的方法,所述方法还包括:通过包括在电极阵列中的第二电极子集,在第一操作频率下测量所述样品的第一切片的第二阻抗;基于所述第二阻抗计算所述样品的第一切片的第二cole弛豫频率;基于该第二cole弛豫频率确定所述组织的第二切片包含癌细胞;以及基于所述第一切片在所述样品内的位置确定癌细胞在所述样品中的位置。
5.根据条款1-4中任一项所述的方法,其中,所述第一cole弛豫频率包括与包括在所述样品的第一切片中的多个细胞膜相关联的平均放电速率。
6.根据条款1-5中任一项所述的方法,其中,确定所述组织的第一切片包含癌细胞包括确定所述第一cole弛豫频率超过第一阈值。
7.根据条款1-6中任一项所述的方法,其中,测量所述样品的第一切片的第一阻抗包括:在包括在所述第一电极子集中的第一电极处,在所述第一操作频率下注入第一交流电流;在包括在所述第一电极子集中的第二电极处,返回所述第一交流电流;以及在位于所述第一电极和所述第二电极之间的一个或多个电极处测量当交流电流通过所述样品的第一切片时与所述样品的第一切片相关联的电压。
8.在一些实施方案中,一种检测切除组织的样品中的癌细胞的设备,所述设备包括:包括在电极阵列中的第一电极子集,所述第一电极子集被配置成在第一操作频率下测量所述样品的第一切片的第一阻抗;以及分析仪,所述分析仪被配置成基于所述第一阻抗确定所述样品的第一切片的第一cole弛豫频率;并且基于所述第一cole弛豫频率确定所述样品的第一切片包含癌细胞。
9.根据条款8所述的设备,其中,所述第一电极子集包括:第一电极;平行于所述第一电极的第二电极;以及平行于所述第一和第二电极的第三电极,其中,所述第一电极和所述第二电极之间的第一距离等于所述第二电极和所述第三电极之间的第二距离。
10.根据条款8-9所述的设备,其中,所述第一电极子集包括第一电极,所述第一电极被配置成在所述第一操作频率下注入第一交流电流;第二电极,所述第二电极被配置成返回所述第一交流电流;以及位于所述第一电极和所述第二电极之间的至少一个第三电极,其中所述至少一个第三电极被配置成当交流电流通过所述样品的第一切片时测量与所述样品的第一切片相关联的电压。
11.根据条款8-10中任一项所述的设备,所述设备还包括连接到所述电极阵列的切换电路,其中,当所述第一电极子集测量所述第一阻抗时,所述切换电路被配置成电气地连接所述第一电极子集并且电气地断开所述电极阵列中的所有剩余电极。
12.根据条款8-11中任一项所述的设备,其中,所述切换电路包括多个微型继电器,其中,所述多个微型继电器中的每个微型继电器连接到所述电极阵列中的单独电极。
13.根据条款8-12中任一项所述的设备,所述设备进一步包括:包括在所述电极阵列中的第二电极子集,所述第二电极子集被配置成在所述第一操作频率下测量所述样品的第二切片的第二阻抗;以及控制器,所述控制器被配置成当测量所述第一阻抗时,通过所述切换电路电气地连接所述第一电极子集,并且当测量所述第二阻抗时,通过所述切换电路电气地连接所述第二电极子集。
14.根据条款8-13中任一项所述的设备,其中,所述第一电极子集的第一电路径长度等于所述第二电极子集的第二电路径长度。
15.根据条款8-14中任一项所述的设备,其中,所述第一操作频率是1khz和25mhz之间的频率。
16.根据条款8-15中任一项所述的设备,其中,所述电极阵列中的至少一个电极包括铂电极。
17.根据条款8-16中任一项所述的设备,其中,所述电极阵列中的每个电极包括非侵入性电极,所述非侵入性电极在接触所述样品时大体上是平坦的。
18.在一些实施方案中,一种非暂时性计算机可读介质,所述非暂时性计算机可读介质包括当由处理器执行时使所述处理器执行以下步骤的指令:从包括在电极阵列中的第一电极子集接收在第一操作频率下测量的切除组织的样品的第一切片的第一阻抗;基于所述第一阻抗计算所述样品的第一切片的第一cole弛豫频率;并且基于该第一cole弛豫频率确定所述样品的第一切片包含癌细胞。
19.根据条款17所述的非暂时性计算机可读介质,其中,所述指令还使所述处理器执行以下步骤:从包括在电极阵列中的第二电极子集接收在所述第一操作频率下测量的所述样品的第二切片的第二阻抗;基于所述第二阻抗计算所述样品的第二切片的第二cole弛豫频率;基于该第二cole弛豫频率确定所述组织的第二切片包含癌细胞;并且基于所述第一切片在所述样品内的位置和所述第二切片在所述样品内的位置确定癌细胞在所述样品中的位置。
20.根据条款17所述的非暂时性计算机可读介质,其中,所述指令还使所述处理器执行以下步骤:通过包括在电极阵列中的第二电极子集在第一操作频率下测量所述样品的第一切片的第二阻抗;基于所述第二阻抗计算所述样品的第一切片的第二cole弛豫频率;基于所述第二cole弛豫频率确定所述组织的第二切片包含癌细胞;并且基于所述第一切片在所述样品内的位置确定癌细胞在所述样品中的位置。
任何权利要求中阐述的权利要求要素和/或本申请中描述的任何要素的任何和所有组合以任何方式落入本发明和保护的预期范围内。
已经出于说明的目的给出了对各种实施方案的描述,但是并不旨在穷举或限制于所公开的实施方案。在不脱离所描述的实施方案的范围和精神的情况下,许多修改和变化对于本领域普通技术人员来说是显而易见的。
本实施方案的各方面可以具体体现为系统、方法或计算机程序产品。因此,本公开的各方面可以采用以下形式:完全硬件实施方案、完全软件实施方案(包括固件、常驻软件、微代码等)或组合软件和硬件(在本文中全部统称为“模块”或“系统”)方面的实施方案。此外,本公开的各方面可以采取具体体现在一个或多个计算机可读介质中的计算机程序产品的形式,该计算机可读介质具有在上面具体体现的计算机可读程序代码。
可以使用一个或多个计算机可读介质的任何组合。计算机可读介质可以是计算机可读信号介质或计算机可读存储介质。计算机可读存储介质可以是例如但不限于电子、磁性、光学、电磁、红外或半导体系统、设备或装置或者前述的任何合适的组合。计算机可读存储介质的更具体示例(非详尽列表)将包括以下内容:具有一个或多个电线的电气地连接、便携式计算机磁盘、硬盘、随机存取存储器(ram)、只读存储器(rom)、可擦除可编程只读存储器(eprom或闪存)、光纤、便携式光盘只读存储器(cd-rom)、光学存储设备、磁存储设备或前述的任何合适的组合。在本文件的上下文中,计算机可读存储介质可以是任何有形介质,有形介质可以包含或存储程序以供指令执行系统、装置或设备使用或与其结合使用。
以上参考根据本公开实施方案的方法、设备(系统)和计算机程序产品的流程图和/或框图描述了本公开的各方面。应当理解,流程图图示和/或框图的每个框以及流程图图示和/或框图中的框的组合可以由计算机程序指令实现。可以将这些计算机程序指令提供给通用计算机、专用计算机或其他可编程数据处理设备的处理器以产生机器。当通过计算机的处理器或其他可编程数据处理设备执行时,指令使得能够实现流程图和/或一个或多个框图框中指定的功能/动作。这样的处理器可以是但不限于通用处理器、专用处理器、专用处理器或现场可编程门阵列。
附图中的流程图和框图示出了根据本公开的各种实施方案的系统、方法和计算机程序产品的可能实施方式的架构、功能和操作。在这方面,流程图或框图中的每个框可以表示包括用于实现指定的逻辑功能的一个或多个可执行指令的代码的模块、片段或部分。还应注意,在一些替代实施方式中,框中提到的功能可以不按图中所示的顺序发生。例如,连续示出的两个框实际上可以基本上同时执行,或者框有时可以以相反的顺序执行,这取决于所涉及的功能。还将注意到框图和/或流程图的每个框以及框图和/或流程图中的框的组合可以由执行特定功能或动作的专用的基于硬件的系统或专用硬件和计算机指令的组合来实现。
虽然前述内容针对本公开的实施方案,但是可以在不脱离本公开的基本范围的情况下设计本公开的其他和进一步的实施方案,并且本公开的范围由所附权利要求确定。
- 还没有人留言评论。精彩留言会获得点赞!