治疗骨髓增生性肿瘤相关的骨髓纤维化和贫血的方法与流程
本申请要求2017年6月14日提交的美国临时申请号62/519,725和2018年6月1日提交的美国临时申请号62/679,210的权益,其各自通过引用的方式整体并入本文。
本申请通过引用并入了与本申请一起提交的序列表,其文本文件名称为“14247-306-228_seq_listing.txt”,于2018年6月6日创建,大小为81kb。
1.技术领域
本文提供了用于治疗对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其包括向所述对象施用actriib信号传导抑制剂。本文还提供了用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,且其中所述治疗减轻或缓解所述对象中的所述骨髓增生性肿瘤相关的骨髓纤维化的一种或多种症状。本文还提供了一种用于治疗有需要的对象中的贫血的方法,所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,其中所述对象患有骨髓增生性肿瘤相关的骨髓纤维化。
2.
背景技术:
贫血是红细胞数量的减少或血液中的血红蛋白量低于正常水平。贫血也可能是由于血红蛋白的氧结合能力下降所致。贫血是最常见的血液病症。贫血可由无效的红细胞生成引起。如果发生活动性红细胞生成,但成熟红细胞无法以适当的速率发育,就会出现无效的红细胞生成。祖细胞在达到成熟红细胞阶段之前经历凋亡。
骨髓增生性肿瘤-(mpn-)相关的骨髓纤维化是一个总括性术语,用于描述可直接发生的克隆性髓系肿瘤(原发性骨髓纤维化(也称为原因不明的髓样化生、慢性特发性骨髓纤维化、伴有髓样化生的骨髓硬化和特发性骨髓纤维化))或从其它髓系肿瘤(真性红细胞增多症和原发性血小板增多症)演变而来,且其特征是骨髓功能障碍和纤维化、髓外造血和炎症状态增加。mpn相关的骨髓纤维化会造成骨髓中过多的纤维组织形成,从而导致严重的贫血、疲劳、虚弱及脾脏和肝脏肿大。mpn相关的骨髓纤维化的当前治疗包括羟基脲、脾切除术和同种异体造血干细胞移植。然而,羟基脲治疗会加重贫血,且长期使用可能存在诱变问题,脾切除术具有较短的反应介质持续时间,可能缩短脾切除术后生存期,且术后发病率较高,并且同种异体造血干细胞移植可能导致白血病转化(sochacki等人,2016,therapeuticapproachesinmyelofibrosisandmyelodysplastic/myeloproliferativeoverlapsyndromes,oncotargetsther,2016(9):2273-286)。因此,仍然需要用于治疗mpn相关的骨髓纤维化的疗法。
两种相关的ii型受体actriia和actriib被鉴定为激活素的ii型受体(mathews和vale,1991,cell65:973-982;attisano等人,1992,cell68:97-108)。除激活素外,actriia和actriib还可与其它几种tgf-β家族蛋白(包括bmp7、nodal、gdf8和gdf11)发生生化相互作用(yamashita等人,1995,j.cellbiol.130:217-226;lee和mcpherron,2001,proc.natl.acad.sci.98:9306-9311;yeo和whitman,2001,mol.cell7:949-957;oh等人,2002,genesdev.16:2749-54)。alk4是激活素(尤其是激活素a)的主要i型受体,而alk-7也可用作激活素(尤其是激活素b)的受体。已经描述了actriib信号传导抑制剂用于治疗无效的红细胞生成和骨髓增生异常综合征(参见,例如,国际专利申请公布号wo2013/059347、wo2011/020045和wo2016/090077)。
3.
技术实现要素:
本文提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg。在特定的实施方案中,药学有效量为1mg/kg。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在特定的实施方案中,药学有效量为1mg/kg,并且每21天一次向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是由actriib的胞外结构域和人igg1fc结构域组成的人源化融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含actriib的胞外结构域和人igg1fc结构域的融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:4具有90%同一性;(b)与seqidno:4具有95%同一性;(c)与seqidno:4具有98%同一性;(d)seqidno:4;(e)与seqidno:7具有90%同一性;(f)与seqidno:7具有95%同一性;(g)与seqidno:7具有98%同一性;(h)seqidno:7;(i)与seqidno:8具有90%同一性;(j)与seqidno:8具有95%同一性;(k)与seqidno:8具有98%同一性;(l)seqidno:8;(m)与seqidno:11具有90%同一性;(n)与seqidno:11具有95%同一性;(o)与seqidno:11具有98%同一性;及(p)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:11具有90%同一性;(b)与seqidno:11具有95%同一性;(c)与seqidno:11具有98%同一性;及(d)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,并且其中所述治疗减轻或缓解所述患者中的所述骨髓增生性肿瘤相关的骨髓纤维化的一种或多种症状。在特定的实施方案中,症状是疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱或骨痛中的一种或多种。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg。在特定的实施方案中,药学有效量为1mg/kg。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在特定的实施方案中,向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,药学有效量为1mg/kg,并且每21天一次向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是由actriib的胞外结构域和人igg1fc结构域组成的人源化融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含actriib的胞外结构域和人igg1fc结构域的融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:4具有90%同一性;(b)与seqidno:4具有95%同一性;(c)与seqidno:4具有98%同一性;(d)seqidno:4;(e)与seqidno:7具有90%同一性;(f)与seqidno:7具有95%同一性;(g)与seqidno:7具有98%同一性;(h)seqidno:7;(i)与seqidno:8具有90%同一性;(j)与seqidno:8具有95%同一性;(k)与seqidno:8具有98%同一性;(l)seqidno:8;(m)与seqidno:11具有90%同一性;(n)与seqidno:11具有95%同一性;(o)与seqidno:11具有98%同一性;及(p)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:11具有90%同一性;(b)与seqidno:11具有95%同一性;(c)与seqidno:11具有98%同一性;及(d)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的贫血的方法,所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,其中所述对象患有骨髓增生性肿瘤相关的骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg。在特定的实施方案中,药学有效量为1mg/kg。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在特定的实施方案中,向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,药学有效量为1mg/kg,并且每21天一次向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是由actriib的胞外结构域和人igg1fc结构域组成的人源化融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含actriib的胞外结构域和人igg1fc结构域的融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:4具有90%同一性;(b)与seqidno:4具有95%同一性;(c)与seqidno:4具有98%同一性;(d)seqidno:4;(e)与seqidno:7具有90%同一性;(f)与seqidno:7具有95%同一性;(g)与seqidno:7具有98%同一性;(h)seqidno:7;(i)与seqidno:8具有90%同一性;(j)与seqidno:8具有95%同一性;(k)与seqidno:8具有98%同一性;(l)seqidno:8;(m)与seqidno:11具有90%同一性;(n)与seqidno:11具有95%同一性;(o)与seqidno:11具有98%同一性;及(p)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:11具有90%同一性;(b)与seqidno:11具有95%同一性;(c)与seqidno:11具有98%同一性;及(d)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的包含seqidno:11氨基酸序列的多肽,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的多肽,所述多肽包含由seqidno:11的氨基酸序列组成的氨基酸序列,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,剂量是1mg/kg。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的由seqidno:11的氨基酸序列组成的多肽,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,剂量是1mg/kg。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,对象是人。
4.术语和缩写
如本文所用,“actrii”是指ii型激活素受体。如本文所用,“actriia”是指iia型激活素受体。参见,例如,mathews和vale,1991,cell65:973-982。genbanktm登录号nm_001278579.1提供了示例性的人actriia核酸序列。genbanktm登录号np_001265508.1提供了示例性的人actriia氨基酸序列。如本文所用,“actriib”是指iib型激活素受体。参见,例如,attisano等人,1992,cell68:97-108。genbanktm登录号nm_001106.3提供了示例性的人actriib核酸序列。genbanktm登录号np_001097.2提供了示例性的人actriib氨基酸序列。
如本文所用,“hb”和“hgb”是指血红蛋白。
如本文所用,在actriib信号传导抑制剂的剂量的上下文中,“mg/kg”是指每公斤待施用actriib信号传导抑制剂的对象的体重的actriib信号传导抑制剂的毫克数。
如本文所用,“mf”是指骨髓纤维化。
如本文所用,“pmf”是指原发性骨髓纤维化。
如本文所用,“pv后mf”是指真性红细胞增多症后骨髓纤维化。
如本文所用,“et后mf”是指原发性血小板增多症后骨髓纤维化。
如本文所用,“mpn”是指骨髓增生性肿瘤。
如本文所用,“rbc”是指红细胞。
如本文所用,“rbc-ti”是指红细胞输注非依赖性。
4.1附图说明
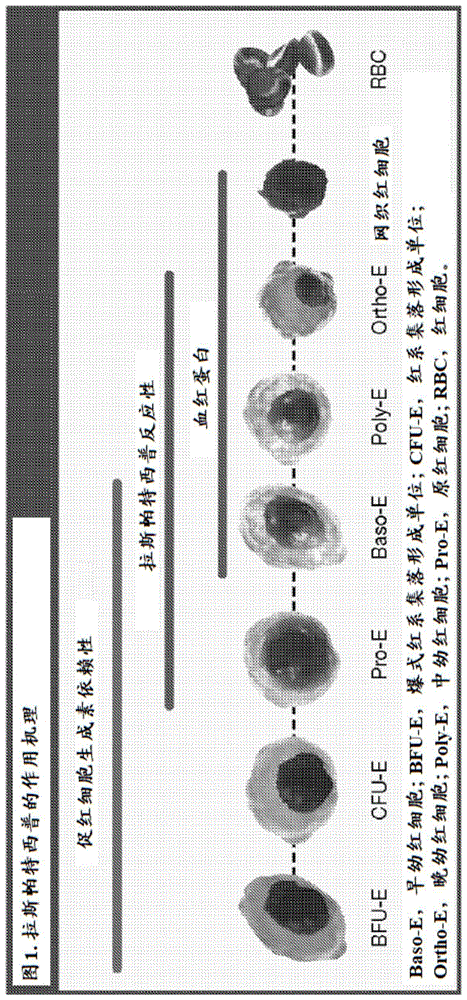
图1:拉斯帕特西普(luspatercept)的作用机理。
图2:研究设计
5.具体实施方式
5.1概述
本文提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在特定的实施方案中,向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是由actriib的胞外结构域和人igg1fc结构域组成的人源化融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:4具有90%同一性;(b)与seqidno:4具有95%同一性;(c)与seqidno:4具有98%同一性;(d)seqidno:4;(e)与seqidno:7具有90%同一性;(f)与seqidno:7具有95%同一性;(g)与seqidno:7具有98%同一性;(h)seqidno:7;(i)与seqidno:8具有90%同一性;(j)与seqidno:8具有95%同一性;(k)与seqidno:8具有98%同一性;(l)seqidno:8;(m)与seqidno:11具有90%同一性;(n)与seqidno:11具有95%同一性;(o)与seqidno:11具有98%同一性;及(p)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:11具有90%同一性;(b)与seqidno:11具有95%同一性;(c)与seqidno:11具有98%同一性;及(d)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,并且其中所述治疗减轻或缓解所述患者中的所述骨髓增生性肿瘤相关的骨髓纤维化的一种或多种症状。在特定的实施方案中,症状是疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱或骨痛中的一种或多种。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在特定的实施方案中,向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是由actriib的胞外结构域和人igg1fc结构域组成的人源化融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:4具有90%同一性;(b)与seqidno:4具有95%同一性;(c)与seqidno:4具有98%同一性;(d)seqidno:4;(e)与seqidno:7具有90%同一性;(f)与seqidno:7具有95%同一性;(g)与seqidno:7具有98%同一性;(h)seqidno:7;(i)与seqidno:8具有90%同一性;(j)与seqidno:8具有95%同一性;(k)与seqidno:8具有98%同一性;(l)seqidno:8;(m)与seqidno:11具有90%同一性;(n)与seqidno:11具有95%同一性;(o)与seqidno:11具有98%同一性;及(p)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:11具有90%同一性;(b)与seqidno:11具有95%同一性;(c)与seqidno:11具有98%同一性;及(d)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的贫血的方法,所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,其中所述对象患有骨髓增生性肿瘤相关的骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在特定的实施方案中,向对象皮下施用actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是由actriib的胞外结构域和人igg1fc结构域组成的人源化融合蛋白。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:4具有90%同一性;(b)与seqidno:4具有95%同一性;(c)与seqidno:4具有98%同一性;(d)seqidno:4;(e)与seqidno:7具有90%同一性;(f)与seqidno:7具有95%同一性;(g)与seqidno:7具有98%同一性;(h)seqidno:7;(i)与seqidno:8具有90%同一性;(j)与seqidno:8具有95%同一性;(k)与seqidno:8具有98%同一性;(l)seqidno:8;(m)与seqidno:11具有90%同一性;(n)与seqidno:11具有95%同一性;(o)与seqidno:11具有98%同一性;及(p)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含选自由以下的氨基酸序列组成的组的氨基酸序列的多肽:(a)与seqidno:11具有90%同一性;(b)与seqidno:11具有95%同一性;(c)与seqidno:11具有98%同一性;及(d)seqidno:11。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的由seqidno:11的氨基酸序列组成的多肽,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,对象患有贫血。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象每天接受2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。在特定的实施方案中,对象是人。
5.2治疗方法
本文提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在特定的实施方案中,对象是在部分5.3中描述的对象。在特定的实施方案中,对象是人。在特定的实施方案中,对象患有贫血。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
在特定的实施方案中,actriib信号传导抑制剂作为组合物的一部分向对象施用。在特定的实施方案中,所述组合物是在部分5.5中描述的组合物。
在特定的实施方案中,药学上有效剂量是在部分5.6中描述的剂量。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂以部分5.6中所述的频率施用于对象。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在优选的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。
在特定的实施方案中,actriib信号传导抑制剂通过部分5.6中描述的施用途径施用于对象。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在优选的实施方案中,向对象皮下施用actriib信号传导抑制剂。
在特定的实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,并且其中所述治疗减轻或缓解所述患者中的所述骨髓增生性肿瘤相关的骨髓纤维化的一种或多种症状。在特定的实施方案中,症状是疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱或骨痛中的一种或多种。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在特定的实施方案中,对象是在部分5.3中描述的对象。在特定的实施方案中,对象是人。在特定的实施方案中,对象患有贫血。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
在特定的实施方案中,actriib信号传导抑制剂作为组合物的一部分向对象施用。在特定的实施方案中,所述组合物是在部分5.5中描述的组合物。
在特定的实施方案中,药学上有效剂量是在部分5.6中描述的剂量。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂以部分5.6中所述的频率施用于对象。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在优选的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。
在特定的实施方案中,actriib信号传导抑制剂通过部分5.6中描述的施用途径施用于对象。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在优选的实施方案中,向对象皮下施用actriib信号传导抑制剂。
在特定的实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。在特定的实施方案中,对象是人。
本文提供了一种在有此需要的对象中治疗贫血的方法,所述方法包括向所述对象施用药学有效量的actriib信号传导抑制剂,其中所述对象患有骨髓增生性肿瘤相关的骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在特定的实施方案中,对象是在部分5.3中描述的对象。在特定的实施方案中,对象是人。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
在特定的实施方案中,actriib信号传导抑制剂作为组合物的一部分向对象施用。在特定的实施方案中,所述组合物是在部分5.5中描述的组合物。
在特定的实施方案中,药学上有效剂量是在部分5.6中描述的剂量。在特定的实施方案中,药学有效量为0.3mg/kg至2.0mg.kg,例如0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂以部分5.6中所述的频率施用于对象。在特定的实施方案中,每21天一次、每28天一次或每48天一次向对象施用actriib信号传导抑制剂。在优选的实施方案中,每21天一次向对象施用actriib信号传导抑制剂。
在特定的实施方案中,actriib信号传导抑制剂通过部分5.6中描述的施用途径施用于对象。在特定的实施方案中,向对象静脉内或皮下施用actriib信号传导抑制剂。在优选的实施方案中,向对象皮下施用actriib信号传导抑制剂。
在特定的实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。在特定的实施方案中,对象是人。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的包含seqidno:11氨基酸序列的多肽,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在特定的实施方案中,对象是在部分5.3中描述的对象。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
在特定的实施方案中,actriib信号传导抑制剂作为组合物的一部分向对象施用。在特定的实施方案中,所述组合物是在部分5.5中描述的组合物。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的多肽,所述多肽包含由seqidno:11的氨基酸序列组成的氨基酸序列,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在特定的实施方案中,对象是在部分5.3中描述的对象。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
在特定的实施方案中,actriib信号传导抑制剂作为组合物的一部分向对象施用。在特定的实施方案中,所述组合物是在部分5.5中描述的组合物。
本文还提供了一种用于治疗有需要的对象中的骨髓增生性肿瘤相关的骨髓纤维化的方法,其中所述方法包括向所述对象施用0.33mg/kg、0.45mg/kg、0.6mg/kg、0.8mg/kg、1mg/kg、1.33mg/kg、1.75mg/kg或2.0mg/kg的剂量的由seqidno:11的氨基酸序列组成的多肽,其中每21天一次向对象皮下施用所述多肽。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在特定的实施方案中,对象是在部分5.3中描述的对象。在特定的实施方案中,对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。在特定的实施方案中,对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
在特定的实施方案中,actriib信号传导抑制剂作为组合物的一部分向对象施用。在特定的实施方案中,所述组合物是在部分5.5中描述的组合物。
5.3患者群体
根据本文所述的方法治疗的对象可以是任何哺乳动物,如啮齿动物和灵长类动物,并且在一个优选的实施方案中,是人。在某些实施方案中,对象是人。在某些实施方案中,本文所述的方法可用于治疗任何哺乳动物(如啮齿动物和灵长类动物)并且在优选的实施方案中人对象中的骨髓增生性肿瘤相关的骨髓纤维化和/或贫血。
在某些实施方案中,根据本文所述的方法治疗的对象可以是任何年龄。在某些实施方案中,根据本文所述的方法治疗的对象小于18岁。在一个特定的实施方案中,根据本文所述的方法治疗的对象小于13岁。在另一个特定的实施方案中,根据本文所述的方法治疗的对象小于12岁、小于11岁、小于10岁、小于9岁、小于8岁、小于7岁、小于6岁或小于5岁。在另一个特定的实施方案中,根据本文所述的方法治疗的对象是1-3岁、3-5岁、5-7岁、7-9岁、9-11岁、11-13岁、13-15岁、15-20岁、20-25岁、25-30岁或大于30岁。在另一个特定的实施方案中,根据本文所述的方法治疗的对象是30-35岁、35-40岁、40-45岁、45-50岁、50-55岁、55-60岁或大于60岁。在另一个特定的实施方案中,根据本文所述的方法治疗的对象是60-65岁、65-70岁、70-75岁、75-80岁或大于80岁。
在某些实施方案中,根据本文提供的方法治疗的对象患有骨髓增生性肿瘤相关的骨髓纤维化。在某些实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在某些实施方案中,根据本文提供的方法治疗的对象患有贫血。在某些实施方案中,根据本文提供的方法治疗的对象患有骨髓增生性肿瘤相关的骨髓纤维化和贫血。在某些实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性骨髓纤维化。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症骨髓纤维化。在更特定的实施方案中,真性红细胞增多症骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变或jak2外显子12突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是真性红细胞增多症后骨髓纤维化。在更特定的实施方案中,真性红细胞增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在特定的实施方案中,骨髓增生性肿瘤相关的骨髓纤维化是原发性血小板减少症或原发性血小板增多症后骨髓纤维化。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化与以下有关或由以下引起:jak2突变,例如,jak2v617f突变;或血小板生成素受体(mpl)突变。在更特定的实施方案中,原发性血小板减少症或原发性血小板增多症后骨髓纤维化包括网状纤维化或三色性纤维化。
在某些实施方案中,根据本文提供的方法治疗的对象先前已用鲁索替尼治疗。在一个特定的实施方案中,根据本文提供的方法治疗的对象在治疗前即刻接受稳定剂量的鲁索替尼至少112天。
在某些实施方案中,根据本文提供的方法治疗的对象先前未曾用鲁索替尼治疗。
稳定剂量的鲁索替尼治疗至少112天
在某些实施方案中,根据本文提供的方法治疗的对象是红细胞输注非依赖性的。在特定的实施方案中,如果在向对象首次施用actriib信号传导抑制剂之前60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象没有(0)接受红细胞单位,那么所述对象是红细胞输注非依赖性的。
在某些实施方案中,根据本文提供的方法治疗的对象是红细胞输注依赖性的。在特定的实施方案中,如果在向对象首次施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天时期内对象已经接受每28天2至4个红细胞单位的平均红细胞输注频率,那么所述对象是红细胞输注依赖性的。
5.4actriib信号传导抑制剂
如本文所用,术语“actriib”是指通过诱变或其它修饰衍生自此类actriib蛋白的任何物种和变体的iib型激活素受体(actriib)蛋白家族。本文中对actriib的提及应理解为对受体的任一当前鉴定形式的提及。actriib家族的成员通常是跨膜蛋白,其由具有半胱氨酸富集区的配体结合胞外结构域、跨膜结构域和具有预测的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
用于本文所述的组合物和方法中的actriib信号传导抑制剂包括但不限于结合激活素的可溶性actriib多肽;结合激活素(特别是激活素a或b亚基,也称为βa或βb)并破坏actriib结合的抗体;与actriib结合并破坏激活素结合的抗体;为激活素或actriib结合而选择的非抗体蛋白;以及为激活素或actriib结合而选择的随机肽,其可与fc结构域缀合。
在某些实施方案中,具有激活素或actriib结合活性的两种或更多种不同的蛋白质(或其它部分),特别是分别阻断i型(例如,可溶性i型激活素受体)和ii型(例如,可溶性ii型激活素受体)结合位点的激活素结合剂可连接在一起以生成抑制actriib的双功能或多功能结合分子,且因此可用于本文所述的组合物和方法中。在某些实施方案中,抑制actriib的激活素-actriib信号传导轴拮抗剂包括核酸适体、小分子和用于本文所述的组合物和方法中的其它剂。
5.4.1包含actriib多肽的actriib信号传导抑制剂
如本文所用,术语“actriib多肽”是指包含actriib家族成员的任何天然存在的多肽及其保留有用活性的任何变体(包括突变体、片段、融合体和拟肽形式)的多肽。例如,actriib多肽包括衍生自任何已知actriib受体的序列的多肽,所述多肽具有与actriib多肽的序列至少约80%同一的序列,且任选至少85%、90%、95%、96%、97%、98%、99%或更大的同一性。例如,actriib多肽可结合并抑制actriib蛋白和/或激活素的功能。actriib多肽的一个实例包括人actriib前体多肽(seqidno:3或seqidno:14)。对于其氨基酸序列描述为seqidno:3或seqidno:14的actriib前体多肽(即人actriib前体多肽),actriib前体多肽的信号肽位于氨基酸1至18处;胞外结构域位于氨基酸19至134处,且潜在的n-连接的糖基化位点位于胺基酸位置42和65处。编码seqidno:3的人actriib前体多肽的核酸序列公开为seqidno:6(seqidno:6在对应于氨基酸位置64的密码子处提供了丙氨酸,但可容易被本领域技术人员使用本领域已知的方法进行修饰以在对应于氨基酸位置64的密码子处提供精氨酸)。参见表2,其给出了序列说明。
除非另外特别说明,否则本文所述的所有actriib相关多肽的氨基酸编号均基于seqidno:3或seqidno:14的氨基酸编号(区别仅在于在位置64处表达的氨基酸)。例如,如果actriib多肽被描述为在氨基酸位置79处具有取代/突变,那么应理解位置79是指actriib多肽所衍生自的seqidno:3或seqidno:14中的第79个氨基酸。同样,如果actriib多肽被描述为在氨基酸位置64处具有丙氨酸或精氨酸,那么应理解位置64是指actriib多肽所衍生自的seqidno:3或seqidno:14中的第64个氨基酸。
在某些实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含含有actriib的激活素结合结构域的多肽。在一些实施方案中,actriib的激活素结合结构域包含actriib的胞外结构域或其一部分。在特定的实施方案中,actriib的胞外结构域或其部分是可溶的。actriib多肽的示例性修饰形式公开于美国专利申请公布号20090005308和20100068215中,其公开内容通过引用的方式整体并入本文。actriib多肽的示例性修饰形式还公开于国际专利申请公布号wo2008/097541和wo2010/019261中,其公开内容通过引用方式整体并入本文。
在特定的实施方案中,在本文所述的组合物和方法中使用的actriib多肽是可溶性actriib多肽。术语“可溶性actriib多肽”通常是指包含actriib蛋白的胞外结构域的多肽,包括actriib蛋白的任何天然存在的胞外结构域以及其任何变体(包括突变体、片段和拟肽形式)。可溶性actriib多肽可结合激活素;然而,与gdf8/11相比,野生型actriib蛋白在结合激活素方面没有表现出明显的选择性。在某些实施方案中,可在本文提供的方法中使用具有不同结合特性的actriib的改变形式。各种改变的形式公开于例如国际专利申请公布号wo2006/012627和wo2010/019261中,其公开内容通过引用的方式整体并入本文。天然或改变的actriib蛋白可通过与第二激活素选择性结合剂偶联来赋予激活素以附加的特异性。示例性可溶性actriib多肽包括人actriib多肽的胞外结构域(例如,seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29)。
hilden等人所公开的具有actriib胞外序列的fc融合蛋白(blood,1994,83(8):2163-70)在与actriib前体氨基酸序列即seqidno:3的氨基酸64相对应的位置处具有丙氨酸(在本文中称为“a64”),已证明所述fc融合蛋白对激活素和gdf-11的亲和力相对较低。相比之下,在actriib前体氨基酸序列的位置64处具有精氨酸(在本文中称为“r64”)的fc融合蛋白在低纳摩尔至高皮摩尔范围内对激活素和gdf-11具有亲和力(参见,例如美国专利申请公布号20100068215,其公开内容整体并入本文)。还参见国际公布号wo2010/019261,其公开内容整体并入本文。在位置64处具有精氨酸的actriib前体氨基酸序列示于seqidno:14中。因此,在某些实施方案中,根据本文所述的组合物和方法使用的actriib多肽可:(i)在对应于actriib前体氨基酸序列即seqidno:3的氨基酸64的位置处包含丙氨酸;或(ii)在actriib前体氨基酸序列即seqidno:14的位置64处包含精氨酸。在其它实施方案中,根据本文所述的组合物和方法使用的actriib多肽可在对应于actriib前体氨基酸序列即seqidno:3或seqidno:14的氨基酸64的位置处包含不是丙氨酸或精氨酸的氨基酸。
已显示在actriib的胞外结构域的c端缺失脯氨酸结降低了受体对激活素的亲和力(参见,例如,attisano等人,cell,1992,68(1):97-108)。含有seqidno:14的氨基酸20-119(即seqidno:18)的actriib-fc融合蛋白“actriib(20-119)-fc”与含有seqidno:14的氨基酸20-134(即seqidno:17)的actriib-fc融合蛋白“actriib(20-134)-fc”相比对gdf-11和激活素具有减少的结合,所述actriib(20-134)-fc包括脯氨酸结区和完整的近膜结构域。然而,相对于actriib的非截短的胞外结构域,含有seqidno:14的氨基酸20-129的actriib-fc融合蛋白“actriib(20-129)-fc”保持相似但稍微降低的活性,即使脯氨酸结区被破坏。因此,预期包含在seqidno:14(或seqidno:3)的氨基酸134、133、132、131、130和129处终止的胞外结构域的actriib多肽都具有活性,但在氨基酸134或133处终止的构建体可最具活性。类似地,预期在残基129-134的任一个处的突变都不会大幅度改变配体结合亲和力,这是由以下事实表明的,即seqidno:14的p129和p130的突变大体上不会降低配体结合。因此,根据本文所述的方法和组合物使用的actriib多肽可尽早终止于seqidno:14(或seqidno:3)的氨基酸109(即最终的半胱氨酸),但是预期在seqidno:14(或seqidno:3)的氨基酸位置109和119处或之间形成终止具有降低的配体结合能力。
seqidno:3和seqidno:14的氨基酸29代表actriib前体序列中的初始半胱氨酸。预期起始于seqidno:3或seqidno:14的n端的氨基酸29处或在这些氨基酸位置之前的actriib多肽将保留配体结合活性。在seqidno:3或seqidno:14的位置24处的丙氨酸向天冬酰胺的突变引入了n-连接的糖基化序列,而大体上不会影响配体结合。这证实了对应于seqidno:3或seqidno:14的氨基酸20-29介于信号裂解肽与半胱氨酸交联区之间的区域中的突变被很好地耐受。具体来说,从seqidno:3或seqidno:14的氨基酸位置20、21、22、23和24处开始的actriib多肽将保留活性,而从seqidno:3或seqidno:14的氨基酸位置25、26、27、28和29处开始的actriib多肽也预期保留活性。从seqidno:3或seqidno:14的氨基酸位置22、23、24或25处开始的actriib多肽将具有最大的活性。
综上所述,根据本文所述的方法和组合物使用的actriib前体蛋白(即seqidno:3或seqidno:14)的活性部分(即actriib多肽)通常将包含seqidno:3或seqidno:14的氨基酸29-109,并且这种actriib多肽可例如起始于对应于seqidno:3或seqidno:14的氨基酸19-29中任一个的残基且终止于对应于seqidno:3或seqidno:14的氨基酸109-134中任一个的位置。本文所涵盖的actriib多肽的特定实例包括那些从seqidno:3或seqidno:14的19-29、20-29或21-29的氨基酸位置处开始并在seqidno:3或seqidno:14的119-134、119-133或129-134、129-133的氨基酸位置处终止的多肽。本文所涵盖的actriib多肽的其它特定实例包括那些从seqidno:3或seqidno:14的20-24(或21-24或22-25)的氨基酸位置处开始并在seqidno:3或seqidno:14的109-134(或109-133),119-134(或119-133)或129-134(或129-133)的氨基酸位置处终止的多肽。还考虑落入这些范围内的变体actriib多肽,特别是与seqidno:3或seqidno:14的相应部分具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性或序列同源性的那些。
在某些实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含actriib的胞外结构域的截短形式。截短可在actriib多肽的羧基末端和/或氨基末端处。在某些实施方案中,相对于成熟的actriib多肽胞外结构域,截短可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸长。在某些实施方案中,截短可以是成熟的actriib多肽胞外结构域的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个n端氨基酸。在某些实施方案中,截短可以是成熟的actriib多肽胞外结构域的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个c端氨基酸。例如,actriib的截短形式包括具有氨基酸20-119;20-128;20-129;20-130;20-131;20-132;20-133;20-134;20-131;21-131;22-131;23-131;24-131;和25-131的多肽,其中氨基酸位置是指seqidno:3或seqidno:14中的氨基酸位置。
actriib的额外示例性截短形式包括:(i)在seqidno:3或seqidno:14的氨基酸21-29中任一个的氨基酸处开始(任选地在seqidno:3或seqidno:14的22-25处开始)并在seqidno:3或seqidno:14的氨基酸109-134中任一个处终止的多肽;(ii)在seqidno:3或seqidno:14的氨基酸20-29中任一个处开始(任选地在seqidno:3或seqidno:14的22-25处开始)并在seqidno:3或seqidno:14的氨基酸109-133中任一个处终止的多肽;(iii)在seqidno:3或seqidno:14的氨基酸20-24中任一个处开始(任选地在seqidno:3或seqidno:14的22-25处开始)并在seqidno:3或seqidno:14的氨基酸109-133中任一个处终止的多肽;(iv)在seqidno:3或seqidno:14的氨基酸21-24中任一个处开始并在seqidno:3或seqidno:14的氨基酸109-134中任一个处终止的多肽;(v)在seqidno:3或seqidno:14的氨基酸20-24中任一个处开始并在seqidno:3或seqidno:14的氨基酸118-133中任一个处终止的多肽;(vi)在seqidno:3或seqidno:14的氨基酸21-24中任一个处开始并在seqidno:3或seqidno:14的氨基酸118-134中任一个处终止的多肽;(vii)在seqidno:3或seqidno:14的氨基酸20-24中任一个处开始并在seqidno:3或seqidno:14的氨基酸128-133中任一个处终止的多肽;(viii)在seqidno:3或seqidno:14的氨基酸20-24中任一个处开始并在seqidno:3或seqidno:14的氨基酸128-133中任一个处终止的多肽;(ix)在seqidno:3或seqidno:14的氨基酸21-29中任一个处开始并在seqidno:3或seqidno:14的氨基酸118-134中任一个处终止的多肽;(x)在seqidno:3或seqidno:14的氨基酸20-29中任一个处开始并在seqidno:3或seqidno:14的氨基酸118-133中任一个处终止的多肽;(xi)在seqidno:3或seqidno:14的氨基酸21-29中任一个处开始并在seqidno:3或seqidno:14的氨基酸128-134中任一个处终止的多肽;以及(xii)在seqidno:3或seqidno:14的氨基酸20-29中任一个处开始并在seqidno:3或seqidno:14的氨基酸128-133中任一个处终止的多肽。在一个特定的实施方案中,actriib多肽包含从seqidno:3或seqidno:14的氨基酸位置25处开始并在seqidno:3或seqidno:14的氨基酸位置131处终止的氨基酸序列,基本上所述氨基酸序列或由所述氨基酸序列组成。在另一个特定的实施方案中,actriib多肽由seqidno:4、18、23、26、27、29、30、31、32或33的氨基酸序列组成或基本上由seqidno:4、18、23、26、27、29、30、31、32或33的氨基酸序列组成。
本文所述的组合物和方法中使用的任何actriib多肽都可作为同型二聚体产生。可将本文所述的组合物和方法中使用的任何actriib多肽都配制成具有异源部分的融合蛋白,所述异源部分包含来自igg重链的恒定区,如fc结构域。在本文所述的组合物和方法中使用的任何actriib多肽都可包含在与seqidno:3或seqidno:14的位置79对应的位置处的酸性氨基酸,任选地与相对于seqidno:3或seqidno:14的一个或多个额外的氨基酸取代、缺失或插入组合。
在特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含具有一个或多个氨基酸取代/突变的actriib的胞外结构域。这样的氨基酸取代/突变可以是例如从seqidno:3或seqidno:14的氨基酸位置79处的亮氨酸交换为酸性氨基酸,如天冬氨酸或谷氨酸。例如,可在actriib胞外结构域多肽中改变seqidno:3或seqidno:14的位置l79,以赋予改变的激活素-肌肉生长抑制素(gdf-11)结合特性。与激活素结合相比,l79a和l79p突变以更大的程度减少gdf-11结合。l79e和l79d突变保留了gdf-11结合,同时表现出激活素结合大大降低。
在某些实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含actriib胞外结构域的截短形式,其还携带氨基酸取代,例如,从seqidno:3或seqidno:14的氨基酸位置79处的亮氨酸交换为酸性氨基酸,如天冬氨酸或谷氨酸。在一个特定的实施方案中,还携带本文所述的组合物和方法中使用的氨基酸取代的actriib多肽的胞外结构域的截短形式是seqidno:9。截短的和/或携带一个或多个氨基酸取代的actriib形式可连接至如上所述的抗体的fc结构域。
可例如通过筛选由编码actriib多肽的核酸的相应片段重组产生的多肽来获得actriib多肽的功能活性片段。另外,片段可使用本领域中已知的技术如传统的merrifield固相f-moc或t-boc化学来化学合成。可(重组地或通过化学合成)产生这些片段,并进行测试以鉴定那些可充当actriib蛋白的拮抗剂(抑制剂)或由激活素介导进行信号传导的肽基片段。
另外,可例如通过筛选由编码actriib多肽的相应诱变的核酸重组产生的修饰的多肽的文库来获得actriib多肽的功能活性变体。可产生并测试变体以鉴定那些可充当actriib蛋白的拮抗剂(抑制剂)或由激活素介导进行信号传导的变体。在某些实施方案中,actriib多肽的功能变体包含与选自seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的氨基酸序列具有至少75%同一性的氨基酸序列。在某些实施方案中,功能变体具有与选自seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列。
为了例如增强治疗功效或稳定性(例如,离体保存期和对体内蛋白水解降解的抗性),可例如通过修饰actriib多肽的结构来产生功能变体。当被选择以保留激活素结合时,这种修饰的actriib多肽被认为是天然存在的actriib多肽的功能等同物。修饰的actriib多肽还可例如通过氨基酸取代、缺失或添加产生。例如,合理地预期到,用异亮氨酸或缬氨酸单独置换亮氨酸、用谷氨酸单独置换天冬氨酸、用丝氨酸单独置换苏氨酸或用结构相关的氨基酸(例如,保守突变)类似置换氨基酸不会对所得分子的生物活性产生重大影响。保守置换是侧链相关的氨基酸家族内发生的那些置换。通过评估变体actriib多肽以类似于野生型actriib多肽的方式在细胞中产生响应的能力,可容易地确定actriib多肽的氨基酸序列的改变是否产生功能同源物。
actriib多肽突变体,特别是actriib多肽的组合突变体集合以及截短突变体;组合突变体库,对于鉴定可用于本文所述的方法和组合物中的功能变体序列特别有用。筛选此类组合文库的目的可以是产生例如actriib多肽变体,其可充当激动剂或拮抗剂,或者替代地,在一起具有新颖的活性。
已证明actriib的配体结合袋是由seqidno:3或seqidno:14的残基y31、n33、n35、l38至t41、e47、e50、q53至k55、l57、h58、y60、s62、k74、w78至n83、y85、r87、a92和e94至f101定义。在这些位置处,预期到保守突变将得以耐受,尽管k74a突变被充分耐受,且r40a、k55a、f82a和位置l79处的突变也可被耐受。r40是非洲爪蟾中的k,表明在此位置处的碱性氨基酸将被耐受。q53是牛actriib中的r和非洲爪蟾actriib中的k,且因此在此位置处将耐受包括r、k、q、n和h的氨基酸。因此,用于本文所述的方法和组合物中的actriib多肽的通式为包含seqidno:3或seqidno:14的氨基酸29-109的通式,但任选地从seqidno:3或seqidno:14的20-24或22-25范围内的氨基酸位置开始且终止于seqidno:3或seqidno:14的129-134范围内的氨基酸位置,并且在配体结合袋中包含不超过1、2、5或15个保守氨基酸变化,以及在配体结合袋中包含seqidno:3或seqidno:14的氨基酸位置40、53、55、74、79和/或82处的零个、一个或多个非保守改变。这样的actriib多肽可与seqidno:3或seqidno:14的氨基酸29-109的序列保留大于80%、90%、95%或99%的序列同一性或序列同源性。结合袋外部的变异性可被特别好地耐受的位点包括actriib的胞外结构域的氨基和羧基末端,以及位置42-46和65-73。在seqidno:3或seqidno:14的位置65处的天冬酰胺向丙氨酸的改变(n65a)实际上改善了a64背景中的配体结合,且因此预期对r64背景中的配体结合没有有害影响。此变化可能消除了a64背景中n65处的糖基化,因此表明此区域中的显著变化可能是得以耐受的。尽管r64a变化的耐受不良,但r64k的耐受良好,且因此在位置64处可以耐受另一个碱性残基,如h。
作为在配体结合结构域中具有突变的actriib多肽的一个特定实例,可使actriib的配体结合结构域的带正电的氨基酸残基asp(d80)突变为不同的氨基酸残基,从而使变体actriib多肽优先结合gdf8,但不结合激活素。在一个特定的实施方案中,d80残基改变为选自由以下组成的组的氨基酸残基:不带电的氨基酸残基、带负电的氨基酸残基和疏水性氨基酸残基。作为另一个特定的实例,可将疏水性残基l79改变为酸性氨基酸天冬氨酸或谷氨酸,以在保持gdf11结合的同时大大降低激活素结合。如本领域技术人员将认识到,所描述的大多数突变、变体或修饰可在核酸水平上进行,或者在某些情况下,可通过翻译后修饰或化学合成来进行。此类技术在本领域是公知的。
在特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含缀合物/融合蛋白,所述缀合物/融合蛋白包含与抗体的fc部分连接的actriib受体的胞外结构域(例如,激活素结合结构域)。此类缀合物/融合蛋白可包含本文所公开的任何actriib多肽(例如seqidno:17、18、23、26、27、29、30、31、32、33中的任一个)、本领域中已知的任何actriib多肽或使用本领域中已知和/或本文提供的方法产生的任何actriib多肽。
在某些实施方案中,胞外结构域经由接头例如肽接头连接到抗体的fc部分上。示例性接头包括短多肽序列,如2-10、2-5、2-4、2-3个氨基酸残基(例如,甘氨酸残基),例如像gly-gly-gly接头。在一个特定的实施方案中,接头包含氨基酸序列gly-gly-gly(ggg)。在另一个特定的实施方案中,接头包含氨基酸序列thr-gly-gly-gly(tggg)。任选地,fc结构域在如asp-265、赖氨酸322和asn-434的残基处具有一个或多个突变。在某些情况下,相对于野生型fc结构域,具有一个或多个这些突变(例如,asp-265突变)的突变fc结构域具有降低的结合fcγ受体的能力。在其它情况下,相对于野生型fc结构域,具有一个或多个这些突变(例如,asn-434突变)的突变fc结构域具有增强的结合mhci类相关fc受体(fcrn)的能力。包含与fc结构域融合的actriib的可溶性胞外结构域的示例性融合蛋白示于seqidno:20、21、24、25或34中。
在一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含与抗体的fc部分连接的actriib胞外结构域或其一部分,其中所述actriib信号传导抑制剂包含与选自seqidno:20、21、24、25、34的氨基酸序列具有至少75%同一性的氨基酸序列。在另一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂包含与抗体的fc部分连接的actriib胞外结构域或其一部分,其中所述actriib信号传导抑制剂包含与选自seqidno:20、21、24、25和34的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列。
在一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂是介于人actriib受体的胞外结构域与igg1的fc部分之间的融合蛋白。在另一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂是介于人actriib受体的截短的胞外结构域与igg1的fc部分之间的融合蛋白。在另一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂是介于人actriib受体的截短的胞外结构域与igg1的fc部分之间的融合蛋白,其中人actriib受体的截短的胞外结构域在与seqidno:3或seqidno:14的氨基酸79相对应的氨基酸位置处具有氨基酸取代。在一个实施方案中,在与seqidno:3或seqidno:14的氨基酸79相对应的氨基酸位置处的氨基酸取代是亮氨酸对天冬氨酸的取代(即,l79d突变)。
在一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂是seqidno:10或11,其代表介于人actriib受体的胞外结构域与igg1的fc部分之间的融合蛋白,其中所述actriib胞外结构域包含具有l79d突变的seqidno:14的氨基酸25-131。编码seqidno:10的actriib-fc融合蛋白的核酸序列示于seqidno:31中。
在另一个特定的实施方案中,在本文所述的组合物和方法中使用的actriib信号传导抑制剂是seqidno:20或21,其代表介于人actriib受体的胞外结构域与igg1的fc部分之间的融合蛋白,其中所述actriib胞外结构域包含具有l79d突变的seqidno:3的氨基酸25-131。
天冬酰胺连接的糖基化识别位点通常包含由适当的细胞糖基化酶特异性识别的三肽序列,即天冬酰胺-x-苏氨酸(或天冬酰胺-x-丝氨酸)(其中“x”是任何氨基酸)。所述改变也可通过向野生型actriib多肽序列(对于o-连接的糖基化位点)添加一个或多个丝氨酸或苏氨酸残基或由一个或多个丝氨酸或苏氨酸残基进行取代而做出。在糖基化识别位点的第一或第三氨基酸位置中的一个或两个处的多种氨基酸取代或缺失(和/或在第二位置处的氨基酸缺失)导致在修饰的三肽序列上的非糖基化。增加actriib多肽上的碳水化合物部分的数目的另一手段是糖苷至actriib多肽上的化学或酶促偶联。取决于所用的偶联方式,糖可连接到(a)精胺酸和组胺酸;(b)游离羧基;(c)游离巯基,如半胱氨酸的那些;(d)游离羟基,如丝氨酸、苏氨酸或羟脯氨酸的那些;(e)芳族残基,如苯丙胺酸、酪氨酸或色氨酸的那些;或(f)谷氨酰胺的酰胺基。这些方法描述于1987年9月11日公开的国际专利申请号wo87/05330及aplin和wriston(1981)crccrit.rev.biochem.,第259-306页中,它们以引用的方式并入本文。可以化学和/或酶促方式去除actriib多肽上存在的一个或多个碳水化合物部分。化学去糖基化可包括,例如,使actriib多肽暴露于化合物三氟甲磺酸或等效化合物。此处理造成大部分或全部糖的裂解,除了连接糖(n-乙酰氨基葡萄糖或n-乙酰半乳糖胺)之外,同时保留氨基酸序列完整。化学去糖基化进一步由hakimuddin等人(1987)arch.biochem.biophys.259:52及edge等人(1981)anal.biochem.118:131描述。actriib多肽上的碳水化合物部分的酶促裂解可通过使用如由以下文献所述的多种内切糖苷酶和外切糖苷酶来实现:thotakura等人(1987)meth.enzymol.138:350。取决于所使用的表达系统的类型,actriib多肽的序列可视情况为后续的,因为哺乳动物、酵母、昆虫和植物细胞都可引入不同的糖基化模式,这些模式可能受到所述肽的氨基酸序列的影响。通常,用于人中的actriib蛋白将在提供适当糖基化的哺乳动物细胞系(如hek293或cho细胞系)中表达,尽管其它表达系统如其它哺乳动物表达细胞系、具有工程化的糖基化酶的酵母细胞系和昆虫细胞也有望发挥作用。
在特定的实施方案中,包括增加另一个n-连接糖基化位点(n-x-s/t)的突变的actriib多肽可用于本文所述的方法和组合物中,这另一个糖基化位点相对于actriib(r64)-fc形式增加了actriib-fc融合蛋白的血清半衰期。在一个特定的实施方案中,在seqidno:3或seqidno:14的位置24处引入天冬酰胺(a24n)导致产生赋予更长半衰期的nxt序列。可在42-44(nqs)和65-67(nss)处找到其它nx(t/s)序列,尽管后者可能无法在位置64(即在r64多肽中)被r有效地糖基化。n-x-s/t序列通常可被引入actriib的配体结合袋之外的位置处,如上文所详述。用于引入非内源性n-x-s/t序列的特别合适的位点包括seqidno:3或seqidno:14的氨基酸20-29、20-24、22-25、109-134、120-134或129-134。n-x-s/t序列也可被引入介于actriib序列与fc或其它融合组分之间的接头中。通过在相对于预先存在的s或t的正确位置处引入n,或通过在相对于预先存在的n的位置处引入s或t,可以毫不费力地引入这样的位点。因此,将产生n-连接的糖基化位点的理想改变是:a24n、r64n、s67n(可能与n65a改变组合)、e106n、r112n、g120n、e123n、p129n、a132n、r112s和r112t(具有对应于可在seqidno:3或seqidno:14中找到的位置的所有氨基酸位置)。由于糖基化可提供保护作用,因此预计被糖基化的任何s均可更改为t,而不会产生免疫原性位点。同样,预计被糖基化的任何t均可更改为s。因此,改变s67t和s44t被包括在本文中。同样,在a24n变体中,可使用s26t改变。因此,actriib多肽可包括一个或多个另外的非内源性n-连接的糖基化共有序列。
多种筛选测定法可用于评估actriib多肽变体。例如,可筛选actriib多肽变体与actriib配体结合、防止actriib配体与actriib多肽结合或干扰由actriib配体引起的信号传导的能力。actriib多肽或其变体的活性也可在基于细胞或体内的测定中进行测试。
可产生与天然存在的actriib多肽相比具有选择性或一般增强的效力的组合衍生的变体。同样,诱变可产生与相应的野生型actriib多肽相比有显著不同的胞内半衰期的变体。例如,改变的蛋白质可变得对蛋白质降解或其它导致天然actriib多肽破坏或另外失活的细胞过程更稳定或更不稳定。可利用此类变体和编码它们的基因,通过调节actriib多肽的半衰期来改变actriib多肽的水平。例如,半衰期短可引起更多的瞬时生物效应,并且可允许在对象内更严格地控制重组actriib多肽水平。在fc融合蛋白中,可在接头(如果有的话)和/或fc部分中进行突变以改变所述蛋白质的半衰期。
组合文库可借助于简并基因文库产生,所述简并基因编码多肽文库,每个多肽文库包括潜在的actriib多肽序列的至少一部分。例如,可将合成寡核苷酸的混合物酶促连接到基因序列中,使得潜在的actriib多肽核苷酸序列的简并组可表达为单独的多肽,或替代地可表达为一组较大的融合蛋白(例如,用于噬菌体展示)。
存在许多可藉以例如从简并寡核苷酸序列生成潜在的同源物的文库的方法。可在dna自动合成仪中进行简并基因序列的化学合成,然后将合成基因连接到适合的载体中以用于表达。简并寡核苷酸的合成是本领域中公知的(参见,例如narang,sa(1983)tetrahedron39:3;itakura等人,(1981)recombinantdna,proc.3rdclevelandsympos.macromolecules编著agwalton,amsterdam:elsevier第273-289页;itakura等人,(1984)annu.rev.biochem.53:323;itakura等人,(1984)science198:1056;ike等人,(1983)nucleicacidres.11:477)。此类技术已用于其它蛋白质的定向进化(参见,例如scott等人,(1990)science249:386-390;roberts等人,(1992)pnasusa89:2429-2433;devlin等人,(1990)science249:404-406;cwirla等人,(1990)pnasusa87:6378-6382;以及美国专利号5,223,409、5,198,346和5,096,815)。
或者,可使用其它诱变形式来产生组合文库。例如,可通过使用例如以下方法进行筛选来从文库中生成并分离actriib多肽变体:丙氨酸扫描诱变等(ruf等人,(1994)biochemistry33:1565-1572;wang等人,(1994)j.biol.chem.269:3095-3099;balint等人,(1993)gene137:109-118;grodberg等人,(1993)eur.j.biochem.218:597-601;nagashima等人,(1993)j.biol.chem.268:2888-2892;lowman等人,(1991)biochemistry30:10832-10838;及cunningham等人,(1989)science244:1081-1085);通过接头扫描诱变(gustin等人,(1993)virology193:653-660;brown等人,(1992)mol.cellbiol.12:2644-2652;mcknight等人,(1982)science232:316);通过饱和诱变(meyers等人,(1986)science232:613);通过pcr诱变(leung等人,(1989)methodcellmolbiol1:11-19);或通过随机诱变,包括化学诱变等(miller等人,(1992)ashortcourseinbacterialgenetics,cshlpress,coldspringharbor,n.y.;及greener等人,(1994)strategiesinmolbiol7:32-34)。接头扫描诱变(特别是在组合环境中)是一种用于鉴定actriib多肽的截短(生物活性)形式的有吸引力的方法。
本领域中已知广泛多种用于筛选通过点突变和截短产生的组合文库的基因产物,且就此而言,用于筛选具有某种特性的基因产物的cdna文库的技术。这种技术一般将适用于快速筛选通过actriib多肽的组合诱变产生的基因文库。用于筛选大基因文库的最广泛使用的技术通常包括将基因文库克隆到可复制的表达载体中;用所得的载体文库转化合适的细胞;及在其中所需活性的检测有利于相对容易地分离载体的条件下表达组合基因,所述载体编码检测到其产物的基因。优选的测定包括激活素结合测定和激活素介导的细胞信号传导测定。
在某些实施方案中,除了actriib多肽中天然存在的任一种以外,在本文所述的方法和组合物中使用的actriib多肽还可还包含翻译后修饰。此类修饰包括但不限于乙酰化、羧化、糖基化、磷酸化、脂化和酰化。结果,修饰的actriib多肽可含有非氨基酸元件,如聚乙二醇、脂质、多糖或单糖和磷酸盐。此类非氨基酸元件对actriib多肽的功能的影响可通过熟练技术人员已知的任何方法来测试。当通过裂解新生形式的actriib多肽在细胞中产生actriib多肽时,翻译后加工对于蛋白质的正确折叠和/或功能也可能是重要的。不同的细胞(如cho、hela、mdck、293、w138、nih-3t3或hek293)具有针对此类翻译后活性的特定细胞机构和特征性机制,并且可选择这些细胞以确保actriib多肽的正确修饰和加工。
在某些方面,actriib多肽的功能变体或修饰形式包括具有actriib多肽的至少一部分和一个或多个融合结构域的融合蛋白。这种融合结构域的公知实例包括但不限于多组氨酸、glu-glu、谷胱甘肽s转移酶(gst)、硫氧还蛋白、蛋白a、蛋白g、免疫球蛋白重链恒定区(fc)、麦芽糖结合蛋白(mbp)或人血清白蛋白。可选择融合结构域以赋予期望的性质。例如,一些融合结构域对于通过亲和色谱法分离融合蛋白特别有用。为了亲和纯化的目的,亲和色谱法使用相关的基质,如谷胱甘肽-、淀粉酶-及镍-或钴-缀合的树脂。许多此类基质均以“试剂盒”形式(如pharmaciagst纯化系统和与(his6)融合配偶体一起使用的qiaexpresstm系统(qiagen))提供。作为另一个实例,可选择融合结构域以便于actriib多肽的检测。这种检测结构域的实例包括各种荧光蛋白(例如,gfp)以及“表位标签”,其通常是短肽序列,可获得针对其的特异性抗体。可容易获得针对其的特异性单克隆抗体的公知的表位标签包括flag、流感病毒血凝素(ha)和c-myc标签。在一些情况下,融合结构域具有蛋白酶切割位点,如因子xa或凝血酶的切割位点,其允许相关蛋白酶部分消化融合蛋白,由此从其释放重组蛋白。然后可通过随后的色谱分离从融合结构域中分离释放的蛋白质。在某些优选的实施方案中,actriib多肽与在体内使actriib多肽稳定的结构域(“稳定剂”结构域)融合。“稳定”意指增加血清半衰期的任何操作,无论这是由于破坏减少、肾脏清除率降低还是其它药代动力学作用所致。已知与免疫球蛋白的fc部分的融合可赋予多种蛋白质以所需的药代动力学特性。同样,与人血清白蛋白的融合可以赋予所需的特性。可以选择的其它类型的融合结构域包括多聚化(例如,二聚化、四聚化)结构域和功能性结构域(根据需要赋予附加的生物学功能,如进一步刺激骨生长或肌肉生长)。
应当理解,融合蛋白的不同元件可以与所需功能一致的任何方式排列。例如,可将actriib多肽放置在异源结构域的c端,或替代地,可将异源结构域放置在actriib多肽的c端。actriib多肽结构域和异源结构域不必在融合蛋白中相邻,并且可在结构域的c端或n端或在这些结构域之间包括另外的结构域或氨基酸序列。
在某些实施方案中,在本文所述的方法和组合物中使用的actriib多肽含有一种或多种能够使actriib多肽稳定的修饰。例如,这种修饰提高actriib多肽的体外半衰期、提高actriib多肽的循环半衰期或减少actriib多肽的蛋白质降解。这种稳定修饰包括但不限于融合蛋白(包括例如包含actriib多肽和稳定剂结构域的融合蛋白)、糖基化位点的修饰(包括例如向actriib多肽中添加糖基化位点)及碳水化合物部分的修饰(包括例如从actriib多肽中去除碳水化合物部分)。在融合蛋白的情况下,actriib多肽与稳定剂结构域如igg分子(例如,fc结构域)融合。如本文所用,术语“稳定剂结构域”不仅是指融合蛋白的情况下的融合结构域(例如,fc),而且还包括非蛋白质修饰如碳水化合物部分或非蛋白质聚合物如聚乙二醇。
在某些实施方案中,本文所述的方法和组合物使用分离的或纯化的actriib多肽,即与其它蛋白质分离或另外大体上不含其它蛋白质的actriib多肽可与本文所述的方法和组合物一起使用。actriib多肽通常将通过由重组核酸的表达而产生。
在某些方面,在本文所述的方法和组合物中使用的actriib多肽由分离的和/或重组的核酸编码,包括本文所公开的片段、功能变体和融合蛋白。例如,seqidno:6编码天然存在的人actriib前体多肽。本发明核酸可以是单链或双链的。这种核酸可以是dna或rna分子。这些核酸可例如用于制备actriib多肽的方法中或用作直接治疗剂(例如,在基因疗法方法中)。
在某些方面,可用于产生适用于本文所述的方法和组合物中的actriib多肽的核酸进一步被理解为包括作为seqidno:6的变体的核酸以及那些核酸序列的变体,所述核酸序列编码可溶性actriib多肽(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)。变体核苷酸序列包括因一个或多个核苷酸取代、添加或缺失而不同的序列,如等位基因变体。
在某些实施方案中,可用于产生适用于本文所述的方法和组合物中的actriib多肽的分离的或重组的核酸序列为与seqidno:6或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)具有至少80%、85%、90%、95%、97%、98%、99%或100%同一性。本领域普通技术人员将理解,与seqidno:6或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)和seqidno:6或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)的变体互补的核酸序列可与本文所述的方法和组合物一起使用。在进一步的实施方案中,核酸序列可被分离、重组和/或与异源核苷酸序列融合,或在dna文库中。
在其它实施方案中,可用于产生适用于本文所述的方法和组合物中的actriib多肽的核酸包括在高度严格条件下与以下杂交的核苷酸序列:seqidno:6中指定的核苷酸序列或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)、seqidno:6或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)的互补序列或其片段。本领域普通技术人员将理解,可改变促进dna杂交的适当严格条件。例如,可在约45℃下以6.0倍氯化钠/柠檬酸钠(ssc)进行杂交,然后在50℃下进行2.0倍ssc的洗涤。例如,洗涤步骤中的盐浓度可选自50℃下约2.0倍ssc的低严格度至50℃下约0.2倍ssc的高严格度。另外,洗涤步骤中的温度可从室温约22℃下的低严格度条件升至约65℃下的高严格度条件。温度和盐都可改变,或者温度或盐可在其它变量变化的情况下保持恒定。在一个实施方案中,在室温下6倍ssc的低严格度条件下杂交然后在室温下以2倍ssc进行洗涤的核酸可与本文所述的方法和组合物一起使用。
由于遗传密码的简并性而与seqidno:6中所列的核酸或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸)不同的分离的核酸也可用于产生适用于本文所述的方法和组合物中的actriib多肽。例如,许多氨基酸由多于一个的三联体表示。指定相同氨基酸的密码子或同义词(例如,cau和cac是组氨酸的同义词)可能导致“沉默”突变,而这些突变不会影响蛋白质的氨基酸序列。然而,预期在哺乳动物细胞中存在确实引起本发明蛋白质的氨基酸序列变化的dna序列多态性。本领域技术人员将理解,由于天然等位基因变异,编码特定蛋白质的核酸的一个或多个核苷酸(高达约3-5%的核苷酸)中的这些变异可存在于给定物种的个体间。任何和所有此类核苷酸变异及所得氨基酸的多态性均可与本文所述的方法和组合物一起使用。
在某些实施方案中,可用于产生适用于本文所述的方法和组合物中的actriib多肽的重组核酸可与表达构建体中的一个或多个调控核苷酸序列可操作地连接。调控核苷酸序列将通常适用于用于表达的宿主细胞。本领域中已知用于多种宿主细胞的许多类型的合适的表达载体和合适的调控序列。通常,所述一种或多种调控核苷酸序列可包括但不限于启动子序列、前导序列或信号序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列及增强子或激活子序列。本领域中已知的组成型或诱导型启动子可与本文所述的方法和组合物一起使用。启动子可以是天然存在的启动子或将一个以上启动子的元件组合在一起的杂合启动子。表达构建体可存在于细胞中的附加体如质粒上,或者表达构建体可被插入染色体中。在一个优选实施方案中,表达载体含有选择标记基因以允许选择转化的宿主细胞。选择标记基因是本领域中公知的,并且将随使用的宿主细胞而变化。
在某些方面,在表达载体中提供了可用于产生适用于本文所述的方法和组合物中的actriib多肽的核酸,所述表达载体包含编码actriib多肽并且可操作地连接到至少一个调控序列的核苷酸序列。调控序列是本领域中认可的并且被选择以指导actriib多肽的表达。因此,术语调控序列包括启动子、增强子和其它表达控制元件。示例性调控序列描述于以下文献中:goeddel;geneexpressiontechnology:methodsinenzymology,academicpress,sandiego,calif.(1990)。例如,当与dna序列可操作地连接时,控制所述dna序列表达的各种各样的表达控制序列中的任一个均可用于这些载体中以表达编码actriib多肽的dna序列。这种有用的表达控制序列包括例如sv40的早期和晚期启动子、tet启动子、腺病毒或巨细胞病毒的直接早期启动子、rsv启动子、lac系统、trp系统、tac或trc系统、t7启动子(其表达由t7rna聚合酶指导)、噬菌体λ的主要操作子和启动子区域、fd衣壳蛋白的控制区、3-磷酸甘油酸激酶或其它糖酵解酶的启动子、酸性磷酸酶的启动子(例如pho5)、酵母.α.交配因子的启动子、杆状病毒系统的多面体启动子及已知控制原核或真核细胞或病毒的基因表达的其它序列及其各种组合。应理解,表达载体的设计可取决于以下因素:如有待转化的宿主细胞的选择和/或希望表达的蛋白质的类型。此外,还应考虑载体的拷贝数、控制该拷贝数的能力以及由载体编码的任何其它蛋白质(如抗生素标记物)的表达。
可通过将克隆的基因或其一部分连接到适于在原核细胞、真核细胞(酵母、禽类、昆虫或哺乳动物)或这两者中表达的载体中来产生重组核酸。用于产生重组actriib多肽的表达载体包括质粒和其它载体。例如,合适的载体包括以下类型的质粒:用于在原核细胞如大肠杆菌中表达的pbr322衍生的质粒、pembl衍生的质粒、pex衍生的质粒、pbtac衍生的质粒和puc衍生的质粒。
一些哺乳动物表达载体含有原核序列以促进载体在细菌中的繁殖及在真核细胞中表达的一个或多个真核转录单元。pcdnai/amp、pcdnai/neo、prc/cmv、psv2gpt、psv2neo、psv2-dhfr、ptk2、prsvneo、pmsg、psvt7、pko-neo和phyg衍生的载体是适于转染真核细胞的哺乳动物表达载体的实例。这些载体中的一些用来自细菌质粒(如pbr322)的序列进行修饰,以促进原核和真核细胞中的复制和药物抗性选择。或者,病毒如牛乳头状瘤病毒(bpv-1)或爱泼斯坦-巴尔病毒(phebo、prep衍生的和p205)的衍生物可用于在真核细胞中瞬时表达蛋白质。其它病毒(包括逆转录病毒)表达系统的实例可见于以下基因疗法传递系统的说明中。用于制备质粒和转化宿主生物体的各种方法是本领域中公知的。关于用于原核和真核细胞的其它合适的表达系统以及一般重组方法,参见molecularcloningalaboratorymanual,第3版,由sambrook、fritsch和maniatis编著(coldspringharborlaboratorypress,2001)。在一些情况下,可能需要使用杆状病毒表达系统来表达重组多肽。这种杆状病毒表达系统的实例包括pvl衍生的载体(如pvl1392、pvl1393和pvl941)、pacuw衍生的载体(如pacuw1)及pbluebac衍生的载体(如含有.β.-gal的pbluebaciii)。
在一个实施方案中,可设计载体以在cho细胞中产生用于本文所述的方法和组合物中的actriib多肽,如pcmv-script载体(stratagene,lajolla,calif.)、pcdna4载体(invitrogen,carlsbad,calif.)和pci-neo载体(promega,madison,wis.)。显而易见的是,本发明的基因构建体可用于引起本发明的actriib多肽在培养物中增殖的细胞中表达,例如以产生用于纯化的蛋白质,包括融合蛋白或变体蛋白。
用重组基因转染的宿主细胞可用于产生适用于本文所述的方法和组合物中的actriib多肽,所述重组基因包括一种或多种本发明actriib多肽的编码序列(例如,seqidno:6或编码可溶性actriib多肽的那些核酸序列(例如,编码seqidno:4、5、9、12、13、15、16、17、18、19、22、23、28和29的核酸))。宿主细胞可以是任何原核或真核细胞。例如,actriib多肽可在细菌细胞如大肠杆菌、昆虫细胞(例如使用杆状病毒表达系统)、酵母或哺乳动物细胞中表达。其它合适的宿主细胞为本领域技术人员已知的。
因此,本文提供了产生用于本文所述的方法和组合物中的actriib多肽的方法。例如,用编码actriib多肽的表达载体转染的宿主细胞可在适当的条件下培养以使actriib多肽得以表达。actriib多肽可被分泌并从含有actriib多肽的细胞和培养基的混合物中分离。或者,actriib多肽可被保留在细胞质中或膜部分中,并且收获细胞,裂解并分离蛋白质。细胞培养物包括宿主细胞、培养基和其它副产物。细胞培养物的合适的培养基是本领域中公知的。本发明的actriib多肽可使用本领域中已知用于纯化蛋白质的技术从细胞培养基、宿主细胞或这两者中分离,这些技术包括离子交换色谱、凝胶过滤色谱、超滤、电泳、用对actriib多肽的特定表位有特异性的抗体进行的免疫亲和纯化及用结合至与actriib多肽融合的结构域的剂进行的亲和纯化(例如,蛋白a柱可用于纯化actriib-fc融合物)。在一个优选的实施方案中,actriib多肽是含有促进其纯化的结构域的融合蛋白。在一个优选的实施方案中,纯化通过一系列柱色谱步骤实现,以任何顺序包括例如以下三个或更多个:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、尺寸排阻色谱和阳离子交换色谱。纯化可通过病毒过滤和缓冲液交换来完成。如本文所证明,actriib-hfc蛋白被纯化至以下纯度:如通过尺寸排阻色谱法所测定的>98%,及通过sdspage所测定的>95%。此纯度水平足以对小鼠的骨骼产生期望的效果,并在小鼠、大鼠和非人灵长类动物中获得可接受的安全概况。
在另一个实施方案中,编码纯化前导序列如在重组actriib多肽的期望部分的n端处的聚(his)/肠激酶切割位点序列的融合基因可允许通过使用ni2+金属树脂的亲和色谱法对所表达的融合蛋白进行纯化。然后可通过用肠激酶处理除去纯化前导序列,以提供纯化的actriib多肽(例如,参见hochuli等人,(1987)j.chromatography411:177;及janknecht等人,pnasusa88:8972)。
用于产生融合基因的技术是公知的。基本上,编码不同多肽序列的各种dna片段的连接是根据常规技术进行的,所述技术采用平端或交错末端进行连接、限制性酶消化以提供适当的末端、适当时填充粘性末端、碱性磷酸酶处理以避免不希望的连接、以及酶促连接。在另一个实施方案中,融合基因可通过常规技术(包括自动dna合成仪)合成。或者,基因片段的pcr扩增可使用锚定引物进行,所述锚定引物在两个连续基因片段之间产生互补悬突,随后可将所述互补悬突退火以产生嵌合基因序列(参见,例如currentprotocolsinmolecularbiology,编者ausubel等人,johnwiley&sons:1992)。
可使用组织纤溶酶原前导序列seqidno:2,从paid4载体(sv40ori/增强子,cmv启动子)在稳定转染的cho-dukxbl1细胞中表达actriib-fc融合蛋白。fc部分可包含人igglfc序列,如seqidno:1所示。在某些实施方案中,表达后,每分子actriib-fc融合蛋白平均含有约1.5至2.5摩尔的唾液酸。
在某些实施方案中,actriib-fc融合体的长血清半衰期在人对象中可以是25-32天。另外,与针对在人293细胞中表达的actriib-hfc融合蛋白所报道的相比,cho细胞表达的材料对激活素b配体的亲和力更高(delre等人,jbiolchem.2004年12月17日;279(51):53126-35)。另外,不受理论的束缚,tpa前导序列的使用提供了比其它前导序列更大的产量,并且与用天然前导表达的actriib-fc不同,它可提供高纯度的n端序列。使用天然的前导序列可产生actriib-fc的两个主要种类,其各自具有不同的n端序列。
在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普(参见internationalnonproprietarynamesforpharmaceuticalsubstances(inn),whodruginformation,第27卷,第4期,2013,proposedinn:list110-458,422)。
5.5组合物
在某些实施方案中,将actriib信号传导抑制剂与药学上可接受的载剂一起配制以用于本文所述的方法。例如,actriib信号传导抑制剂可单独施用或作为药物制剂(治疗组合物)的组分施用。本发明化合物可被配制以便以用于人或兽医学的任何方便的方式施用。
在一个优选的实施方案中,actrii信号传导抑制剂被配制用于皮下施用。
在另一个优选的实施方案中,actriib信号传导抑制剂以无菌、无防腐剂的冻干粉或饼的形式包装在容器中。在某些实施方案中,所述容器包含25mg的actriib信号传导抑制剂。在某些实施方案中,包含25mg的actriib信号传导抑制剂的容器包含总共37.5mg的蛋白质。在某些实施方案中,将包含25mgactriib信号传导抑制剂的容器中的actriib信号传导抑制剂用0.68ml注射用水复原。在某些实施方案中,所述容器包含75mg的actriib信号传导抑制剂。在某些实施方案中,包含75mg的actriib信号传导抑制剂的容器包含总共87.5mg的蛋白质。在某些实施方案中,将包含75mgactriib信号传导抑制剂的容器中的actriib信号传导抑制剂用1.6ml注射用水复原。在某些实施方案中,用一定体积的注射用水复原容器中的actriib信号传导抑制剂,使得注射用水中复原的actriib信号传导抑制剂的最终浓度为50mg/ml,ph为约6.5。在某些实施方案中,在复原的10小时内将actriib信号传导抑制剂施用于对象。在某些实施方案中,所述容器在10mm基于柠檬酸盐缓冲液的溶液中包含浓度为50mg/ml的actriib信号传导抑制剂,其中所述10mm基于柠檬酸盐缓冲液的溶液包含10mm柠檬酸盐ph6.5、9%蔗糖和0.02%聚山梨酯80。在某些实施方案中,容器被储存在2℃与8℃之间。在某些实施方案中,容器在2℃与8℃之间储存18个月。在某些实施方案中,容器是配有涂有灰色丁基的塞子的3ml玻璃小瓶。在某些实施方案中,容器是配有灰色橡胶塞的3ml玻璃小瓶。在某些实施方案中,橡胶塞通过带有彩色塑料按钮的卷曲铝盖固定在适当的位置。在某些实施方案中,3ml玻璃小瓶包含25mg的actriib信号传导抑制剂,并且彩色塑料按钮是红色的。在某些实施方案中,3ml玻璃小瓶包含75mg的actriib信号传导抑制剂,并且彩色塑料按钮是白色的。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。
在一个特定的实施方案中,actriib信号传导抑制剂以无菌、无防腐剂的冻干粉或饼包装在容器中。在一个特定的实施方案中,所述容器在10mm柠檬酸盐缓冲液(ph6.5)中包含50mg/ml的actriib信号传导抑制剂。在一个特定的实施方案中,所述容器包含56mg的actriib信号传导抑制剂、0.19mg的柠檬酸一水合物、3.03mg的柠檬酸三钠脱水物、0.24mg的聚山梨酸酯80和100.80mg的蔗糖。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。
在某些实施方案中,本文提供的治疗方法包括全身或局部作为植入物或装置施用所述组合物(包含actriib信号传导抑制剂)。当施用时,本文提供的用途的治疗组合物呈无热原的、生理学上可接受的形式。除也可视情况包括在上述组合物中的actriib信号传导抑制剂以外的治疗上有用的剂可与本发明化合物(例如,actrii多肽,如actriia和/或actriib多肽)同时或依次施用。
通常,actriib信号传导抑制剂将肠胃外施用。在一个优选的实施方案中,actriib信号传导抑制剂将皮下施用。适于肠胃外施用的药物组合物可包含一种或多种actriib多肽与一种或多种药学上可接受的无菌等渗水溶液或非水溶液、分散体、混悬液或乳液或无菌粉末的组合,可在即将使用时将所述无菌粉末复原成无菌可注射溶液或分散液,所述注射液或分散液可含有抗氧化剂、缓冲剂、抑菌剂、使制剂与预期受者的血液等渗的溶质或助悬剂或增稠剂。可用于本文所述的方法的药物组合物中的合适的水和非水载剂的实例包括水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)及其合适的混合物、植物油如橄榄油、以及可注射的有机酯如油酸乙酯。例如,可通过使用包衣材料(如卵磷脂)、通过维持所需的粒度(在分散体的情况下)以及通过使用表面活性剂来维持适当的流动性。
本文所述的组合物还可含有佐剂,如防腐剂、湿润剂、乳化剂和分散剂。通过包含各种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚山梨酸等),可确保防止微生物的作用。也可取的是,在组合物中包含等渗剂如糖、氯化钠等。另外,通过包含延迟吸收的剂如单硬脂酸铝和明胶,可延长可注射药物形式的吸收。
在某些实施方案中,actriib信号传导抑制剂在药物组合物中是大体上纯的。具体来说,药物组合物中有至多20%、10%、5%、2.5%、1%、0.1%或至多0.05%的化合物是除actriib信号传导抑制剂和药学上可接受的载剂以外的化合物。
在某些实施方案中,根据本文提供的方法,在室温下将actriib信号传导抑制剂施用于患者。
5.6施用剂量和途径
本文还提供了与本文所述的治疗方法有关的用于向对象施用的actriib信号传导抑制剂的剂量(参见,例如,部分5.2)。在某些实施方案中,所述剂量是药学有效剂量。
在某些实施方案中,actrii信号传导抑制剂的药学有效剂量是足以减轻或缓解骨髓增生性肿瘤相关的骨髓纤维化的一种或多种症状的剂量。在某些实施方案中,actrii信号传导抑制剂的药学有效剂量是足以防止骨髓增生性肿瘤相关的骨髓纤维化的至少一种症状恶化的剂量。骨髓增生性肿瘤相关的骨髓纤维化的非限制性实例包括疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱或骨痛。
在某些实施方案中,actrii信号传导抑制剂的药学有效剂量是足以减轻或缓解由骨髓增生性肿瘤相关的骨髓纤维化引起或与之相关的贫血的一种或多种症状的剂量。在某些实施方案中,actrii信号传导抑制剂的药学有效剂量是足以防止贫血的至少一种症状恶化的剂量。贫血的非限制性实例包括疲劳、乏力、心跳加快、气短、头痛、难以集中注意力、头晕、皮肤苍白、腿抽筋和失眠。
在某些实施方案中,actrii信号传导抑制剂的药学有效剂量是足以减轻或缓解贫血的一种或多种症状和骨髓增生性肿瘤相关的骨髓纤维化的一种或多种症状的剂量。在某些实施方案中,actrii信号传导抑制剂的药学有效剂量是足以防止贫血的至少一种症状恶化和骨髓增生性肿瘤相关的骨髓纤维化的至少一种症状恶化的剂量。贫血的非限制性实例包括疲劳、乏力、心跳加快、气短、头痛、难以集中注意力、头晕、皮肤苍白、腿抽筋和失眠。骨髓增生性肿瘤相关的骨髓纤维化的非限制性实例包括疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱或骨痛。
在某些实施方案中,actriib信号传导抑制剂以足以达到0.2mg/kg或更高的血清浓度、例如1mg/kg或2mg/kg或更高的血清水平的间隔和量给药。可设计给药方案以达到介于0.2与15mg/kg之间且任选介于1与5mg/kg之间的血清浓度。在人中,单剂量为0.1mg/kg或更高时,血清水平可达到0.2mg/kg,且单剂量为0.3mg/kg或更高时,血清水平可达到1mg/kg。观察到的分子的血清半衰期介于约20与30天之间,比大多数fc融合蛋白要长得多,因此,例如,通过以0.2-0.4mg/kg的剂量每周或每两周一次给药,可获得持续的有效血清水平,或者也可在更长的给药间隔下使用更高剂量。例如,可能每月或每两月使用1-3mg/kg的剂量,并且对骨骼的作用可能足够持久,每3、4、5、6、9、12个月或更长时间才需给药一次。actriib信号传导抑制剂的血清水平可通过熟练技术人员已知的任何方法来测量。例如,针对actriib信号传导抑制剂的抗体可用于通过例如elisa来测定actriib信号传导抑制剂的血清水平。在一个特定的实施方案中,本文提供的方法对骨密度和强度也实现显著影响。
在某些实施方案中,actriib信号传导抑制剂的剂量为约0.1mg/kg、约0.3mg/kg、约0.45mg/kg、约0.5mg/kg、约0.6mg/kg、0.75mg/kg、约0.8mg/kg、约1.0mg/kg、约1.25mg/kg、约1.33mg/kg、约1.5mg/kg、约1.75mg/kg、约2.0mg/kg或约2.25mg/kg。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.1mg/kg与2.25mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.1mg/kg与1mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.3mg/kg与1.25mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.5mg/kg与1.5mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.1mg/kg与2.0mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.33mg/kg与2.0mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.75mg/kg与1.0mg/kg之间、介于1.0mg/kg与1.25mg/kg之间、介于1.25mg/kg与1.5mg/kg之间、介于1.5mg/kg与1.75mg/kg之间或介于1.75mg/kg与2.0mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的剂量是药学有效剂量。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.45mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.6mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.8mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.0mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.75mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为2.00mg/kg。当与本文提供的剂量(例如,actriib信号传导抑制剂的剂量或第二活性剂的剂量)结合使用时,词语“约”是指在参考数字的1、5%或10%内的任何数字。
在某些实施方案中,actriib信号传导抑制剂的剂量是药学有效剂量。在某些实施方案中,actriib信号抑制剂的药学有效剂量为约0.1mg/kg、约0.3mg/kg、约0.45mg/kg、约0.5mg/kg、约0.6mg/kg、0.75mg/kg、约0.8mg/kg、约1.0mg/kg、约1.25mg/kg、约1.33mg/kg、约1.5mg/kg、约1.75mg/kg、约2.0mg/kg或约2.25mg/kg。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.1mg/kg与2.25mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.1mg/kg与1mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.3mg/kg与1.25mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.5mg/kg与1.5mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.1mg/kg与2.0mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.33mg/kg与2.0mg/kg之间。在某些实施方案中,actriib信号传导抑制剂的药学有效剂量介于0.75mg/kg与1.0mg/kg之间、介于1.0mg/kg与1.25mg/kg之间、介于1.25mg/kg与1.5mg/kg之间、介于1.5mg/kg与1.75mg/kg之间或介于1.75mg/kg与2.0mg/kg之间。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.45mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.6mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.8mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.0mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.75mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为2.00mg/kg。
在某些实施方案中,与基线时对象中的血红蛋白水平相比,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以增加对象中的血红蛋白水平。在评估对象中血红蛋白水平的增加的情形下,“基线”是指紧接在向对象首次施用actriib信号传导抑制剂之前的时间。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号传导抑制剂之后的任何连续84天期间使对象中的血红蛋白水平增加至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%,其中与基线时对象的血红蛋白水平相比,对象在连续的84天期间输注了0单位的红细胞单位。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号传导抑制剂之后的任何连续84天期间使对象中的血红蛋白水平增加至多5%、至多10%、至多15%、至多20%、至多25%、至多30%、至多35%、至多40%、至多45%、至多50%、至多55%、至多60%、至多65%、至多70%、至多75%、至多80%、至多85%、至多90%、至多95%或至多100%,其中与基线时对象的血红蛋白水平相比,对象在连续的84天期间输注了0单位的红细胞单位。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号传导抑制剂之后的任何连续84天期间使血红蛋白水平增加至少1.5g/dl、至少1.8gg/dl、至少2.0g/dl、至少2.2g/dl、至少2.4g/dl、至少2.6g/dl、至少2.8g/dl、至少3.0g/dl、至少3.2g/dl、至少3.4g/dl、至少3.6g/dl、至少3.8g/dl、至少4.0g/dl、至少5.0g/dl或至少6.0g/dl,其中与基线时对象的血红蛋白水平相比,对象在连续的84天期间输注了0单位的红细胞单位。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号传导抑制剂之后的任何连续84天期间使血红蛋白水平增加至多1.5g/dl、至多1.8gg/dl、至多2.0g/dl、至多2.2g/dl、至多2.4g/dl、至多2.6g/dl、至多2.8g/dl、至多3.0g/dl、至多3.2g/dl、至多3.4g/dl、至多3.6g/dl、至多3.8g/dl、至多4.0g/dl、至多5.0g/dl或至多6.0g/dl,其中与基线时对象的血红蛋白水平相比,对象在连续的84天期间输注了0单位的红细胞单位。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以使对象中的血红蛋白水平在施用actriib信号传导抑制剂之后增加至少3个月、至少4个月、至少5个月、至少6个月、至少12个月、至少18个月、至少24个月或至少48个月。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以使对象中的血红蛋白水平在施用actriib信号传导抑制剂之后无限期地增加。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.33mg/kg与2.0mg/kg之间。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.45mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.6mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.8mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.0mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.75mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为2.00mg/kg。在某些实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。
在其中对象是红细胞输注依赖性的某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号传导抑制剂之后的任何连续84天期间导致对象中的红细胞输注非依赖性。在某些实施方案中,如果对象在任何连续的60天、61天、62天、63天、64天、65天、66天、67天、68天、69天、70天、71天、72天、73天、74天、75天、76天、77天、78天、79天、80天、81天、82天、83天、84天、85天、86天、87天、88天、89天或90天期间接受了0个红细胞单位,那么所述对象是红细胞输注非依赖性的。在某些实施方案中,如果对象在向对象首次施用actriib信号传导抑制剂之前至少60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89或90天期间已经接受每28天2至4个红细胞单位,那么所述对象是红细胞输注依赖性的。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在对象中造成红细胞输注非依赖性持续施用actriib信号传导抑制剂之后至少3个月、至少4个月、至少5个月、至少6个月、至少12个月、至少18个月、至少24个月或至少48个月。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在施用actriib信号传导抑制剂之后无限期地在对象中造成红细胞输注非依赖性。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.33mg/kg与2.0mg/kg之间。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.45mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.6mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.8mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.0mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.75mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为2.00mg/kg。在某些实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。
在某些实施方案中,与基线时对象中的红细胞输注频率相比,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以降低对象中的红细胞输注频率。在评估对象中红细胞输注频率降低的情形下,“基线”是指紧接在向对象首次施用actriib信号传导抑制剂之前的时间。为了评估与基线时对象中红细胞输注频率相比的对象中红细胞输注频率的降低,已将在向对象施用第一剂的actriib信号传导抑制剂之后每四周在对象中输注的红细胞单位的平均数量与基线时每四周在对象中输注的红细胞单位的平均数量进行比较。在某些实施方案中,与基线时每四周在对象中输注的红细胞单位的平均数量相比,向根据本文提供的方法治疗的对象施用的actriib信号传导抑制剂的剂量足以使在向对象施用第一剂的actriib信号传导抑制剂之后每四周在对象中输注的红细胞单位的平均数量减少至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%。在某些实施方案中,与基线时每四周在对象中输注的红细胞单位的平均数量相比,向根据本文提供的方法治疗的对象施用的actriib信号传导抑制剂的剂量足以使在向对象施用第一剂的actriib信号传导抑制剂之后每四周在对象中输注的红细胞单位的平均数量减少至多10%、至多20%、至多30%、至多40%、至多50%、至多60%、至多70%、至多80%、至多90%或至多100%。在某些实施方案中,与基线时每四周在对象中输注的红细胞单位的平均数量相比,向根据本文提供的方法治疗的对象施用的actriib信号传导抑制剂的剂量足以使在向对象施用第一剂的actriib信号传导抑制剂之后每四周在对象中输注的红细胞单位的平均数量减少至少1个单位、至少2个单位、至少3个单位、至少4个单位、至少5个单位、至少6个单位、至少7个单位或至少8个单位。在某些实施方案中,与基线时每四周在对象中输注的红细胞单位的平均数量相比,向根据本文提供的方法治疗的对象施用的actriib信号传导抑制剂的剂量足以使在向对象施用第一剂的actriib信号传导抑制剂之后每四周在对象中输注的红细胞单位的平均数量减少至多1个单位、至多2个单位、至多3个单位、至多4个单位、至多5个单位、至多6个单位、至多7个单位或至多8个单位。在某些实施方案中,一个rbc单位是指约150ml、200ml、250ml、300ml、350ml、100-200ml、150-250ml、200-300ml、250-300ml或250-350ml的rbc。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.33mg/kg与2.0mg/kg之间。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.45mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.6mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.8mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.0mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.75mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为2.00mg/kg。在某些实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。
在某些实施方案中,与基线时对象中的输注负荷相比,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号抑制剂后的任何时期内使对象中的输注负荷降低至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。在评估对象中输注负荷降低的情形下,“基线”是指紧接在向对象首次施用actriib信号传导抑制剂之前的时间。在某些实施方案中,与基线时对象中的输注负荷相比,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号抑制剂后的任何时期内使对象中的输注负荷降低至多5%、至多10%、至多15%、至多20%、至多25%、至多30%、至多35%、至多40%、至多45%、至多50%、至多55%、至多60%、至多65%、至多70%、至多75%、至多80%、至多85%、至多90%、至多95%或至多100%。在某些实施方案中,在对象中减小输注负荷的时期为至少4周、至少5周、至少6周、至少7周、至少8周、至少9周、至少10周、至少11周或至少12周。在某些实施方案中,在对象中减小输注负荷的时期是12周(即84天)。在某些实施方案中,与基线时对象中的输注负荷相比,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在向对象施用第一剂的actriib信号抑制剂之后任何连续的84天时期内使对象中的输注负荷降低至少50%。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在施用actriib信号传导抑制剂之后至少3个月、至少4个月、至少5个月、至少6个月、至少12个月、至少18个月、至少24个月或至少48个月使对象中的输注负荷降低。在某些实施方案中,根据本文提供的方法向对象施用的actriib信号传导抑制剂的剂量足以在施用actriib信号传导抑制剂之后无限期地使对象中的输注负荷降低。在某些实施方案中,actriib信号传导抑制剂的剂量介于0.33mg/kg与2.0mg/kg之间。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.45mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.6mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为0.8mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.0mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.33mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为1.75mg/kg。在一个特定的实施方案中,actriib信号传导抑制剂的剂量为2.00mg/kg。在某些实施方案中,actriib信号传导抑制剂是部分5.4中描述的actriib信号传导抑制剂。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。
在某些实施方案中,测量贫血反应。在一些实施方案中,测量贫血反应,因为它与血红蛋白(hgb)增加有关,例如,在无rbc输注的任何连续84天时期内,达到与基线相比≥1.5g/dl血红蛋白增加的对象的比例(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与提高的红细胞(rbc)-输注非依赖性有关,例如,在任何连续84天时期内变得无rbc输注的对象的比例(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与达到贫血反应的时间有关,例如,从第一剂拉斯帕特西普至首次出现贫血反应的时间(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与贫血反应的持续时间有关,例如,对象中贫血反应的最长持续时间(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与rbc输注的频率有关,例如,每四周每位对象输注的rbc单位的平均数量(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为其与rbc输注依赖性的频率有关,例如,在任何连续的84天时期内,其输注负荷比基线降低了≥50%的rbc输注依赖性对象的比例(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与通过修改版骨髓增生性肿瘤症状评估表(mpn-saf)所记录和评估达到疲劳症状减轻的对象的比例有关(参见emanual等人.,“myeloproliferativeneoplasm(mpn)symptomassessmentformtotalsymptomscore:prospectiveinternationalassessmentofanabbreviatedsymptomburdenscoringsystemamongpatientswithmpns,”j.clin.oncol.30(33):4098-4103(2012)),例如,测量疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱和骨痛(例如,在接受拉斯帕特西普的对象中;例如,在根据mpn-saf所测量达到疲劳症状减轻≥50%的对象中。在一些实施方案中,测量贫血反应,因为它与通过修改版骨髓增生性肿瘤症状评估表(mpn-saf)所记录和评估达到总症状评分(tss)降低≥50%的对象的比例有关(参见emanual等人,“myeloproliferativeneoplasm(mpn)symptomassessmentformtotalsymptomscore:prospectiveinternationalassessmentofanabbreviatedsymptomburdenscoringsystemamongpatientswithmpns,”j.clin.oncol.30(33):4098-4103(2012),例如,测量疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱和骨痛(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与健康相关的生活质量(hrqol)测评有关,例如,测量hrqol问卷领域评分与基线评分相比的平均变化(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与eq-5d-5l问卷评分(euroqol,rotterdam,thenetherlands)有关,例如,测量eq-5d-5l问卷领域评分与基线评分相比的平均变化(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,测量贫血反应,因为它与不良事件(ae)有关,例如,不良事件的类型、发生频率和严重程度(例如,在接受拉斯帕特西普的对象中)。在一些实施方案中,贫血反应是使用抗药物抗体(ada)来测量(例如,在接受拉斯帕特西普的对象中抗药物抗体的频率以及对功效、安全性或药代动力学的影响)。在一些实施方案中,贫血反应是使用药代动力学参数来测量,例如,血浆浓度-时间曲线、曲线下面积(auc)、cmax(例如,对于接受拉斯帕特西普的对象)。
在某些实施方案中,actriib信号传导抑制剂的剂量通过注射施用。在某些实施方案中,actriib信号传导抑制剂的剂量是皮下施用。在某些实施方案中,actriib信号传导抑制剂的剂量每3周施用一次。在特定的实施方案中,actriib信号传导抑制剂是包含seqidno:11的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是包含由seqidno:11的氨基酸序列组成的氨基酸序列的多肽。在特定的实施方案中,actriib信号传导抑制剂是由seqidno:11所示的氨基酸序列组成的多肽。在一个优选的实施方案中,actriib信号传导抑制剂是拉斯帕特西普。
测定
可测试各种actriib多肽变体或可溶性actriib多肽变体抑制actriib信号传导的能力。另外,可测试化合物抑制actriib信号传导的能力。一旦证实了actriib信号传导抑制剂的活性,这些化合物便可与本文提供的方法一起使用。下文描述了针对actriia的测定,但可针对actriib类似地执行。
例如,可评估actriia多肽变体对涉及骨产生或骨破坏的基因表达的影响。可根据需要在一种或多种重组actriia配体蛋白(例如,激活素)存在下进行此操作,且细胞可被转染,以产生actriia多肽和/或其变体,及任选地,actriia配体。同样,可将actriia多肽施用于小鼠或其它动物,并且可评估一种或多种骨骼特性,如密度或体积。还可评估骨折的愈合率。双能x射线骨密度仪(dexa)是一种用于评估动物骨密度的已确立的、非侵入性的定量技术。在人中,中枢dexa系统可用于评价脊柱和骨盆的骨密度。这些是预测总体骨密度的最佳指标。外周dexa系统可用于评价外周骨(包括例如手、腕、踝和脚的骨)的骨密度。传统的x射线成像系统(包括cat扫描)可用于评价骨骼生长和骨折愈合。此外,可使用定量计算机断层扫描(qct)来测量骨密度。还可评价骨骼的机械强度。
在某些方面,本文提供了actriia多肽(例如,可溶性actriia多肽)和激活素多肽鉴定作为激活素-actriia信号传导途径的激动剂或拮抗剂的化合物(剂)的用途。可测试通过此筛选鉴定出的化合物,以评估其在体外调节骨骼生长或矿化的能力。任选地,可在动物模型中进一步测试这些化合物,以评估其在体内调节组织生长的能力。
通过靶向激活素和actriia多肽来筛选用于调节组织生长的治疗剂的方法有很多种。在某些实施方案中,可进行化合物的高通量筛选以鉴定干扰激活素或actriia介导的对骨的作用的剂。在某些实施方案中,进行测定以筛选和鉴定特异性地抑制或减少actriia多肽与激活素的结合的化合物。或者,所述测定可用于鉴定增加actriia多肽与激活素的结合的化合物。在另一个实施方案中,化合物可通过它们与激活素或actriia多肽相互作用的能力来鉴定。
多种测定形式将足够,且不过根据本公开,本领域普通技术人员将理解本文未明确描述的那些测定形式。如本文所述,本文中使用的测试化合物(剂)可通过任何组合化学方法产生。或者,本发明化合物可以是体内或体外合成的天然存在的生物分子。有待测试其作为组织生长调节剂的能力的化合物(剂)可例如由细菌、酵母、植物或其它生物体(例如,天然产物)产生;以化学方式产生(例如,小分子,包括拟肽);或重组产生。本文考虑的测试化合物包括非肽基有机分子、肽、多肽、拟肽、糖、激素和核酸分子。在一个特定的实施方案中,测试剂是分子量小于约2,000道尔顿的有机小分子。
可将测试化合物作为单一、离散实体来提供,或者以更复杂的文库来提供,如通过组合化学制备。这些文库可包含例如醇、卤代烷、胺、酰胺、酯、醛、醚和其它种类的有机化合物。测试化合物向测试系统的呈递可呈分离形式,也可呈化合物的混合物,特别是在初始筛选步骤中。任选地,化合物可与其它化合物一起衍生,并且具有促进化合物分离的衍生基团。衍生基团的非限制性实例包括生物素、荧光素、地高辛配基、绿色荧光蛋白、同位素、多组氨酸、磁珠、谷胱甘肽s转移酶(gst)、光活化性交联剂或其任何组合。
在测试化合物和天然提取物的文库的许多药物筛选程序中,需要高通量测定,以便在给定的时间内最大化所检测的化合物的数量。在无细胞的系统(如可用纯化或半纯化的蛋白质衍生而来)中进行的测定通常优选作为“主要”筛选,因为它们可以生成以允许快速发展并相对容易地检测到由测试化合物所介导的分子靶标中的改变。此外,通常在体外系统中可以忽略测试化合物的细胞毒性或生物利用度的影响,相反,所述测定主要集中于药物对分子靶标的作用,这可能表现为actriia多肽与激活素之间的结合亲和力的改变。
仅为了说明,在示例性筛选测定中,将目标化合物与通常能够结合激活素的分离的和纯化的actriia多肽接触。然后向化合物与actriia多肽的混合物中加入含有actriia配体的组合物。actriia/激活素复合物的检测和定量为确定化合物抑制(或增强)actriia多肽与激活素之间的复合物形成的效力提供了一种手段。可通过从使用各种浓度的测试化合物获得的数据生成剂量响应曲线来评估化合物的功效。此外,还可进行对照测定以提供用于比较的基线。例如,在对照测定中,将分离和纯化的激活素添加到含有actriia多肽的组合物中,并且在不存在测试化合物的情况下量化actriia/激活素复合物的形成。应当理解,通常,反应物可混合的顺序可以改变,并且可同时混合。而且,可使用细胞提取物和裂解物来代替纯化的蛋白质,以便提供合适的无细胞的测定系统。
可以通过多种技术检测actriia多肽与激活素之间的复合物形成。例如,可使用例如可检测标记的蛋白质如放射性标记的(例如,32p、35s、14c或3h)、荧光标记的(例如,fitc)或酶标记的actriia多肽或激活素通过免疫测定或色谱检测来量化复合物形成的调节。
在某些实施方案中,本文考虑了荧光偏振测定和荧光共振能量转移(fret)测定在直接或间接地测量actriia多肽与其结合蛋白之间的相互作用程度中的用途。此外,如基于光波导的检测模式(pct公布wo96/26432和美国专利号5,677,196)、表面等离子体共振(spr)、表面电荷传感器和表面力传感器的其它检测模式与本文所述的许多实施方案相容。
此外,相互作用陷阱测定,也称为“双重杂交测定”,可用于鉴定破坏或增强actriia多肽与其结合蛋白之间的相互作用的剂。参见,例如美国专利号5,283,317;zervos等人(1993)cell72:223-232;madura等人(1993)jbiolchem268:12046-12054;bartel等人(1993)biotechniques14:920-924;及iwabuchi等人(1993)oncogene8:1693-1696)。在一个特定的实施方案中,本文考虑了两个反向杂合系统鉴定解离actriia多肽与其结合蛋白之间的相互作用的化合物(例如,小分子或肽)的用途。参见,例如vidal和legrain,(1999)nucleicacidsres27:919-29;vidal和legrain,(1999)trendsbiotechnol17:374-81;及美国专利号5,525,490;5,955,280;和5,965,368。
在某些实施方案中,本发明化合物通过其与actriia或激活素多肽相互作用的能力来鉴定。化合物与actriia或激活素多肽之间的相互作用可以是共价或非共价的。例如,可使用体外生化方法(包括光交联、放射性标记的配体结合及亲和色谱法),在蛋白质水平上鉴定这种相互作用(jakobywb等人,1974,methodsinenzymology46:1)。在某些情况下,可在基于机理的测定中,如在检测结合激活素或actriia多肽的化合物的测定中,筛选化合物。这可包括固相或液相结合事件。或者,编码激活素或actriia多肽的基因可用报告系统(例如,β-半乳糖苷酶、萤光素酶或绿色荧光蛋白)转染到细胞中,并优选通过高通量筛选针对文库进行筛选或与文库的各个成员一起筛选。可使用其它基于机理的结合测定,例如,检测自由能的变化的结合测定。可将靶标固定在孔、珠子或芯片上,或通过固定的抗体捕获或通过毛细管电泳分离,进行结合测定。通常可使用比色或荧光或表面等离子体共振来检测结合的化合物。
6.实施例
6.1实施例1:2期、多中心、开放标签研究被用于评价拉斯帕特西普在患有骨髓增生性肿瘤相关的骨髓纤维化和贫血(伴有和不伴有红细胞输注依赖性)的对象中的功效和安全性
此实施例涉及一项2期、多中心、开放标签的研究,以评价在患有骨髓增生性肿瘤相关的骨髓纤维化的对象中的拉斯帕特西普(actriib信号传导抑制剂),所述对象患有伴有或不伴有红细胞输注依赖性的贫血。这项研究分为筛选期、治疗期(由初级阶段、第169天的疾病反应评估和扩展阶段组成)、然后是治疗后的随访期。这项2期研究的目的是通过纠正无效性红细胞生成且由此减轻贫血(即在几乎所有mpn相关的mf患者中发生的病况(疲劳是其症状))来评估拉斯帕特西普在患有贫血且可能有或可能没有rbc输注依赖性的mpn相关的mf患者中是否有功效信号。
符合资格标准的对象根据他们的资格被分配到以下队列中的1个(并行招募):(i)队列1:包含多达20名贫血对象,只是目前没有接受rbc输注(这些对象在整个此实施例中称为“仅贫血”,定义为接受0个rbc单位/在紧接第1周期第1天(c1d1)日期之前的84天);(ii)队列2:包含多达20名rbc输注依赖性对象(这些对象在整个实施例中被称为“rbc输注依赖性”,定义为在紧接c1d1日期之前的至少84天内接受2至4个rbc单位/28天的平均rbc输注频率);(iii)队列3a:包含≥10名对象(队列3包含总计30名对象),他们符合队列1的资格标准(仅贫血),同时在紧接招募日期前的至少112天接受稳定剂量的鲁索替尼;以及(iv)队列3b:包含≥10名对象(队列3包含总计30名对象),他们符合队列2的资格标准(rbc输注依赖性),同时在紧接招募日期前的至少112天接受稳定剂量的鲁索替尼。总体而言,该研究将在全球范围内招募约70名对象。
6.1.1主要结果指标
以下是2期试验的主要结果指标:(i)与血红蛋白(hgb)增加有关的贫血反应(在任何连续的84天时期内,队列1和3a对象在无rbc输注下血红蛋白与基线相比增加≥1.5g/dl的比例;测量的时间范围大约是168天);(ii)与红细胞(rbc)输注非依赖性提高相关的贫血反应(在任何连续的84天时期内,队列2和3b对象在变得无rbc输注后的比例;测量的时间范围大约是168天);(iii)发生贫血反应的时间(在每个队列中从首次接受拉斯帕特西普剂量到首次出现贫血反应的时间;测量的时间范围大约达2年)。(iv)贫血反应的持续时间(在每个队列中贫血反应的最长持续时间;测量的时间范围大约达2年);(v)rbc输注的频率(每位对象每四周输注的rbc单位的平均数量;测量的时间范围大约达2年);(vi)rbc输注依赖性的频率(在任何连续的84天时期内,其输注负荷比基线降低了≥50%的rbc输注依赖性对象的比例;测量的时间范围大约达2年);(vii)通过修改版骨髓增生性肿瘤症状评估表(mpn-saf)所记录和评估,疲劳症状减轻≥50%的对象的比例,疲劳是患有骨髓增生性肿瘤相关的骨髓纤维化的贫血患者的常见症状(参见emanual等人,“myeloproliferativeneoplasm(mpn)symptomassessmentformtotalsymptomscore:prospectiveinternationalassessmentofanabbreviatedsymptomburdenscoringsystemamongpatientswithmpns,”j.clin.oncol.30(33):4098-4103(2012);测量的时间范围大约达2年);(viii)总症状评分(tss)降低≥50%的对象的比例。通过修改版骨髓增生性肿瘤症状评估表(mpn-saf)所记录和评估的骨髓增生性肿瘤(mpn)相关的骨髓纤维化相关症状(疲劳、盗汗、瘙痒、腹部不适、左侧肋骨下疼痛、早饱和骨痛),(参见emanual等人,“myeloproliferativeneoplasm(mpn)symptomassessmentformtotalsymptomscore:prospectiveinternationalassessmentofanabbreviatedsymptomburdenscoringsystemamongpatientswithmpns,”j.clin.oncol.30(33):4098-4103(2012);(ix)与健康有关的生活质量(hrqol):将研究中的hrqol问卷领域评分的平均变化的测量值与基线评分进行比较(测量的时间范围大约达2年);(x)eq-5d-5l问卷(euroqol,rotterdam,thenetherlands):将研究中的eq-5d-5l问卷领域评分的平均变化的测量值与基线评分进行比较(测量的时间范围大约达2年);(xi)不良事件(ae)(包括类型、频率和严重性,应进行评估;测量的时间范围大约达2年);(xii)抗药物抗体(ada)(抗药物抗体的频率及其对功效、安全性或药代动力学的影响;测量的时间范围大约达2年);(xiii)药代动力学(曲线下面积(auc)和cmax;测量的时间范围大约达2年);以及(xiv)癌症疗法-贫血的功能评估(fact-an):将研究中的fact-an问卷领域评分的平均变化的测量值与基线评分进行比较(研究的时间范围大约达2年)。
6.1.2纳入标准
对象必须满足本部分中的标准才被招募到本研究中(招募日期被定义为该对象在综合反应技术[irt]中被指派队列的日期)并接受他们第一剂的拉斯帕特西普。
对象在签署知情同意书(icf)时必须≥18岁。
经当地病理报告所证实,对象患有mpn相关的骨髓纤维化(pmf、pv后mf和/或et后mf)。
对象患有如下定义的贫血:(i)队列1和3a:(a)对象在紧接c1d1日期之前的84天时期内,在≥3个不同之日(包括给药日)记录到≥3hgb水平≤9.5g/dl;两次血红蛋白测量之间的间隔≥42天的对象未被招募;及(b)在紧接c1d1日期之前的84天时期内,不得有任何rbc输注;以及(ii)队列2和3b:(a)对象在紧接c1d1日期之前的至少84天时期内,平均rbc输注频率为2至4个rbc单位/28天;间隔必须>42天且rbc输注小于一次;(b)在施用拉斯帕特西普之前的c1d1时,对象的hgb值必须<13g/dl;(c)仅在hgb≤9.5g/dl时给予rbc输注才可在确定资格时评分;以及(d)由于出血、感染或化疗引起的贫血而进行的rbc输注在确定资格时未进行评分。
对象的东部肿瘤协作组(ecog)的表现评分≤2。有关ecog表现评分,参见,例如oken等人(1982)."toxicityandresponsecriteriaoftheeasterncooperativeoncologygroup".am.j.clin.oncol.5(6):649–55,其通过引用的方式整体并入本文。ecog表现评分为0的对象无症状(即完全活跃,能够不受限制地进行所有疾病前活动)。ecog表现评分为1的对象是有症状的,但完全能走动(即,耗费体力的活动受限,但能走动且能够进行轻度或久坐性质的工作,例如轻松的家务、办公室工作)。ecog表现评分为2的对象是有症状的,白天在床上<50%(即,能走动且能够进行所有自我护理,但无法进行任何工作活动;起床和大约50%以上的清醒时间)。ecog表现评分为3的对象是有症状的,在床上但不是卧床不起>50%(即,只能进行有限的自我护理,50%以上的清醒时间被限制在床上或椅子上)。ecog表现评分为4的对象卧床不起(即,完全残疾;不能进行任何自我护理;完全限制于床或椅子上)。ecog表现评分为5的对象死亡。
预计对象在从c1d1日期开始的6个月期间不接受造血细胞移植。
本研究中具有生育潜力的女性(fcbp)被如下定义的女性:(1)已在某个时候达到了月经初潮;及(2)至少连续24个月(即曾在过去的连续24个月内的任何时候有过月经)未进行子宫切除术或双侧疗法(不排除生育可能性)。参与研究的fcbp必须:(a)在开始研究治疗之前,由研究者证实有2次阴性妊娠测试;她必须同意在研究过程中及研究治疗结束后进行妊娠测试,这适用于即使对象真正禁欲而不与异性有接触;及(b)承诺要真正禁欲而不与异性有接触(必须每月进行审核并备案),或者同意在开始研究产品使用前28天、在研究治疗期间(包括剂量中断)、以及在停止研究治疗后的12周内(基于多剂量药代动力学[pk]数据,为拉斯帕特西普平均终末半衰期的约5倍)使用并且能够不间断地有效避孕。
男性对象必须:(a)进行真正的禁欲(必须每月审核一次)或同意在参与研究时、剂量中断期间以及停止研究产品后至少12周(基于多剂量pk数据,为拉斯帕特西普的平均终末半衰期的约5倍)内在与怀孕女性或有生育潜力的女性进行性接触期间使用避孕套,即使他已成功进行了输精管切除术。
对象必须在进行任何与研究相关的评估/程序之前了解并自愿签署知情同意书。
对象愿意并能够遵守研究访问计划和其它协议要求。
6.1.3治疗方法
拉斯帕特西普的剂量是1.75mg/kg。
每21天一次向对象皮下施用拉斯帕特西普,持续长达2年。
6.2实施例2
6.2.1背景
骨髓增生性肿瘤(mpn)相关的骨髓纤维化(mf)是一种克隆性髓系肿瘤,其特征是骨髓纤维化、骨髓功能缺陷、髓外造血、向胚泡期转化的倾向和炎症(mesara等人leukres.2011;35(1):12-13)。贫血和红细胞(rbc)输注依赖性(td)是这些患者的独立的不良预后和生存预测变量(passamontif等人blood.2010;115(9):1703-1708;elenac等人haematologica.2011;96(1):167-170)。
拉斯帕特西普是一种重组融合蛋白,由与人免疫球蛋白g1(igg1)的fc结构域连接的修饰的iib型激活素受体组成(图1)(attiekm等人amjhematol.2014;89(7):766-770;suraganirn等人natmed.2014;20(4):408-414)。拉斯帕特西普通过结合特定的转化生长因子-β(tgf-β)超家族配体(如生长分化因子11(gdf11)),阻断其抑制作用并导致rbc产生增加来充当红细胞成熟剂(suraganirn等人natmed.2014;20(4):408-414)。在最近的2期研究中,显示拉斯帕特西普对于低风险骨髓增生异常综合征患者的贫血治疗是有效且充分耐受的(platzbeckeru等人lancetoncol.2017;18(10):1338-1347)。
这项临床试验的目的是评价拉斯帕特西普在治疗伴有或不伴rbc-td的mpn相关的mf患者中的贫血的功效和安全性。
6.2.2研究详情
此实施例涉及一项正在进行的、多中心、开放标签2期研究。
6.2.3研究群体
这项研究的纳入标准是:(i)年龄≥18岁;(ii)mpn相关的mf(原发性mf、真性红细胞增多症后mf或原发性血小板增多症后mf);(iii)贫血,定义为:(a)队列1和3a:在第1周期第1天前(c1d1)之前的84天内,在无rbc输注下,在≥3天(包括给药日),有≥3次血红蛋白(hb)水平≤9.5g/dl;测量之间≥42天将被排除;(b)队列2和3b:在c1d1之前≥84天内,平均rbc输注频率为2-4个rbc单位/28天,间隔不>42天且无≥1rbc输注;在施用拉斯帕特西普之前的c1d1时,hb<13g/dl;以及(iv)东部肿瘤协作组的表现状况≤2。
6.2.4研究设计和治疗:
该研究包括3个时期(图2):(i)筛选期;(ii)治疗期(初级阶段、第169天的疾病反应评估和扩展阶段);及(iii)治疗后的随访期。
(a)筛选期
所有筛选程序均在招募前≤28天进行。
(b)治疗期
所有患者将在每个21天周期的第1天皮下接受1mg/kg拉斯帕特西普。根据rbc输注要求,患者将被招募到队列中:(i)队列1和3a(仅贫血);及(ii)队列2和3b(rbc-td)。最佳支持性护理可与研究治疗组合使用。在第一剂研究治疗后第169天应完成疾病反应评估。反应者可继续治疗长达额外1.5年。无反应者将终止治疗。
(c)治疗后的随访期
终止治疗后,将在最后一剂研究治疗后长达42天收集随访安全性数据。在最后一剂研究治疗之后长达3年或直至死亡、同意退出或失去随访,每3个月收集安全性数据。
6.2.5终点
主要终点和次要终点列于表1(以下)中。探索性终点包括治疗暴露-反应、生物标记物和突变分析。所有功效分析将主要对意向治疗群体(定义为所有招募的患者)进行。将对可评估功效的群体进行确认性功效分析,这些群体被定义为以下所有患者:(i)接受≥3个周期的研究治疗,并在第三研究剂量后继续接受研究≥21天;或(ii)在<3个周期中达到hb>13g/dl。将对所有接受≥1研究治疗剂量的患者进行安全性分析。不良事件和实验室异常根据nci-ctcae4.03版进行分类。药代动力学分析将基于所有具有可评估浓度数据以确定药代动力学参数的患者。
6.2.6统计分析
将主要使用描述性统计分析。kaplan-meier方法可用于估计贫血反应的持续时间。将不进行队列之间的推论比较。
6.2.7研究状况
招募开始于2017年11月。目标招募为70名mpn相关的mf和贫血(伴有或不伴有rbc-td)患者。截至2018年4月9日,在24个临床站点中,已有12名患者被招募到该研究中。
表1.研究终点
7.序列信息
表2.
序列表
<110>细胞基因公司
<120>治疗骨髓增生性肿瘤相关的骨髓纤维化和贫血的方法
<130>14247-306-228
<140>有待分配
<141>随同
<150>62/679,210
<151>2018-06-01
<150>62/519,725
<151>2017-06-14
<160>34
<170>patentinversion3.5
<210>1
<211>344
<212>prt
<213>智人(homosapiens)
<220>
<223>与人fc结构域融合的人actriia的胞外结构域
<400>1
ileleuglyargsergluthrglnglucysleuphepheasnalaasn
151015
trpglulysaspargthrasnglnthrglyvalgluprocystyrgly
202530
asplysasplysargarghiscysphealathrtrplysasnileser
354045
glyserilegluilevallysglnglycystrpleuaspaspileasn
505560
cystyraspargthraspcysvalglulyslysaspserprogluval
65707580
tyrphecyscyscysgluglyasnmetcysasnglulysphesertyr
859095
pheproglumetgluvalthrglnprothrserasnprovalthrpro
100105110
lysproprothrglyglyglythrhisthrcysproprocysproala
115120125
progluleuleuglyglyproservalpheleupheproprolyspro
130135140
lysaspthrleumetileserargthrprogluvalthrcysvalval
145150155160
valaspvalserhisgluaspprogluvallyspheasntrptyrval
165170175
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
180185190
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
195200205
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
210215220
leuprovalproileglulysthrileserlysalalysglyglnpro
225230235240
arggluproglnvaltyrthrleuproproserarggluglumetthr
245250255
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
260265270
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
275280285
lysthrthrproprovalleuaspseraspglyserphepheleutyr
290295300
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
305310315320
sercysservalmethisglualaleuhisasnhistyrthrglnlys
325330335
serleuserleuserproglylys
340
<210>2
<211>21
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>蜜蜂蜂毒肽(hbml)的前导序列
<400>2
metlyspheleuvalasnvalalaleuvalphemetvalvaltyrile
151015
sertyriletyrala
20
<210>3
<211>512
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib前体蛋白序列(a64)
<400>3
metthralaprotrpvalalaleualaleuleutrpglyserleutrp
151015
proglyserglyargglyglualagluthrargglucysiletyrtyr
202530
asnalaasntrpgluleugluargthrasnglnserglyleugluarg
354045
cysgluglygluglnasplysargleuhiscystyralasertrpala
505560
asnserserglythrilegluleuvallyslysglycystrpleuasp
65707580
asppheasncystyraspargglnglucysvalalathrglugluasn
859095
proglnvaltyrphecyscyscysgluglyasnphecysasngluarg
100105110
phethrhisleuproglualaglyglyprogluvalthrtyrglupro
115120125
proprothralaprothrleuleuthrvalleualatyrserleuleu
130135140
proileglyglyleuserleuilevalleuleualaphetrpmettyr
145150155160
arghisarglysproprotyrglyhisvalaspilehisgluasppro
165170175
glyproproproproserproleuvalglyleulysproleuglnleu
180185190
leugluilelysalaargglyargpheglycysvaltrplysalagln
195200205
leumetasnaspphevalalavallysilepheproleuglnasplys
210215220
glnsertrpglnsergluarggluilepheserthrproglymetlys
225230235240
hisgluasnleuleuglnpheilealaalaglulysargglyserasn
245250255
leugluvalgluleutrpleuilethralaphehisasplysglyser
260265270
leuthrasptyrleulysglyasnileilethrtrpasngluleucys
275280285
hisvalalagluthrmetserargglyleusertyrleuhisgluasp
290295300
valprotrpcysargglygluglyhislysproserilealahisarg
305310315320
aspphelysserlysasnvalleuleulysseraspleuthralaval
325330335
leualaasppheglyleualavalargphegluproglylyspropro
340345350
glyaspthrhisglyglnvalglythrargargtyrmetalaproglu
355360365
valleugluglyalaileasnpheglnargaspalapheleuargile
370375380
aspmettyralametglyleuvalleutrpgluleuvalserargcys
385390395400
lysalaalaaspglyprovalaspglutyrmetleuprophegluglu
405410415
gluileglyglnhisproserleuglugluleuglngluvalvalval
420425430
hislyslysmetargprothrilelysasphistrpleulyshispro
435440445
glyleualaglnleucysvalthrilegluglucystrpasphisasp
450455460
alaglualaargleuseralaglycysvalglugluargvalserleu
465470475480
ileargargservalasnglythrthrseraspcysleuvalserleu
485490495
valthrservalthrasnvalaspleuproprolysgluserserile
500505510
<210>4
<211>116
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列(seqidno:3的氨基酸19-134)
<400>4
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpalaasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuproglualaglyglyprogluvalthrtyrglupropropro
100105110
thralaprothr
115
<210>5
<211>101
<212>prt
<213>智人(homosapiens)
<220>
<223>c端缺失15个氨基酸的人actriib可溶性(胞外)、加工过的多肽序列(seqidno:3的氨基酸19-119)
<400>5
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpalaasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuprogluala
100
<210>6
<211>1539
<212>dna
<213>智人(homosapiens)
<220>
<223>人actriib(a64)前体蛋白
<400>6
atgacggcgccctgggtggccctcgccctcctctggggatcgctgtggcccggctctggg60
cgtggggaggctgagacacgggagtgcatctactacaacgccaactgggagctggagcgc120
accaaccagagcggcctggagcgctgcgaaggcgagcaggacaagcggctgcactgctac180
gcctcctgggccaacagctctggcaccatcgagctcgtgaagaagggctgctggctagat240
gacttcaactgctacgataggcaggagtgtgtggccactgaggagaacccccaggtgtac300
ttctgctgctgtgaaggcaacttctgcaacgagcgcttcactcatttgccagaggctggg360
ggcccggaagtcacgtacgagccacccccgacagcccccaccctgctcacggtgctggcc420
tactcactgctgcccatcgggggcctttccctcatcgtcctgctggccttttggatgtac480
cggcatcgcaagcccccctacggtcatgtggacatccatgaggaccctgggcctccacca540
ccatcccctctggtgggcctgaagccactgcagctgctggagatcaaggctcgggggcgc600
tttggctgtgtctggaaggcccagctcatgaatgactttgtagctgtcaagatcttccca660
ctccaggacaagcagtcgtggcagagtgaacgggagatcttcagcacacctggcatgaag720
cacgagaacctgctacagttcattgctgccgagaagcgaggctccaacctcgaagtagag780
ctgtggctcatcacggccttccatgacaagggctccctcacggattacctcaaggggaac840
atcatcacatggaacgaactgtgtcatgtagcagagacgatgtcacgaggcctctcatac900
ctgcatgaggatgtgccctggtgccgtggcgagggccacaagccgtctattgcccacagg960
gactttaaaagtaagaatgtattgctgaagagcgacctcacagccgtgctggctgacttt1020
ggcttggctgttcgatttgagccagggaaacctccaggggacacccacggacaggtaggc1080
acgagacggtacatggctcctgaggtgctcgagggagccatcaacttccagagagatgcc1140
ttcctgcgcattgacatgtatgccatggggttggtgctgtgggagcttgtgtctcgctgc1200
aaggctgcagacggacccgtggatgagtacatgctgccctttgaggaagagattggccag1260
cacccttcgttggaggagctgcaggaggtggtggtgcacaagaagatgaggcccaccatt1320
aaagatcactggttgaaacacccgggcctggcccagctttgtgtgaccatcgaggagtgc1380
tgggaccatgatgcagaggctcgcttgtccgcgggctgtgtggaggagcgggtgtccctg1440
attcggaggtcggtcaacggcactacctcggactgtctcgtttccctggtgacctctgtc1500
accaatgtggacctgccccctaaagagtcaagcatctaa1539
<210>7
<211>344
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>融合蛋白,包含与fc结构域融合的actriib(a64;seqidno:17)的可溶性胞外结构域
<400>7
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpalaasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuproglualaglyglyprogluvalthrtyrglupropropro
100105110
thralaprothrglyglyglythrhisthrcysproprocysproala
115120125
progluleuleuglyglyproservalpheleupheproprolyspro
130135140
lysaspthrleumetileserargthrprogluvalthrcysvalval
145150155160
valaspvalserhisgluaspprogluvallyspheasntrptyrval
165170175
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
180185190
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
195200205
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
210215220
leuprovalproileglulysthrileserlysalalysglyglnpro
225230235240
arggluproglnvaltyrthrleuproproserarggluglumetthr
245250255
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
260265270
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
275280285
lysthrthrproprovalleuaspseraspglyserphepheleutyr
290295300
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
305310315320
sercysservalmethisglualaleuhisasnhistyrthrglnlys
325330335
serleuserleuserproglylys
340
<210>8
<211>329
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>融合蛋白,包含actriib的可溶性胞外结构域(a64)
,其c端缺失15个氨基酸(seqidno:5),与fc结构域融合
<400>8
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpalaasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuproglualaglyglyglythrhisthrcysproprocyspro
100105110
alaprogluleuleuglyglyproservalpheleupheproprolys
115120125
prolysaspthrleumetileserargthrprogluvalthrcysval
130135140
valvalaspvalserhisgluaspprogluvallyspheasntrptyr
145150155160
valaspglyvalgluvalhisasnalalysthrlysproarggluglu
165170175
glntyrasnserthrtyrargvalvalservalleuthrvalleuhis
180185190
glnasptrpleuasnglylysglutyrlyscyslysvalserasnlys
195200205
alaleuprovalproileglulysthrileserlysalalysglygln
210215220
proarggluproglnvaltyrthrleuproproserarggluglumet
225230235240
thrlysasnglnvalserleuthrcysleuvallysglyphetyrpro
245250255
seraspilealavalglutrpgluserasnglyglnprogluasnasn
260265270
tyrlysthrthrproprovalleuaspseraspglyserphepheleu
275280285
tyrserlysleuthrvalasplysserargtrpglnglnglyasnval
290295300
phesercysservalmethisglualaleuhisasnhistyrthrgln
305310315320
lysserleuserleuserproglylys
325
<210>9
<211>107
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列,
其中ec结构域的n端有6个氨基酸缺失,且ec结构域的c端有3个氨基酸缺失
(seqidno:14的氨基酸25-131),并且具有l79d突变
<400>9
gluthrargglucysiletyrtyrasnalaasntrpgluleugluarg
151015
thrasnglnserglyleugluargcysgluglygluglnasplysarg
202530
leuhiscystyralasertrpargasnserserglythrilegluleu
354045
vallyslysglycystrpaspaspasppheasncystyrasparggln
505560
glucysvalalathrglugluasnproglnvaltyrphecyscyscys
65707580
gluglyasnphecysasngluargphethrhisleuproglualagly
859095
glyprogluvalthrtyrgluproproprothr
100105
<210>10
<211>360
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>未加工的actriib-fc融合蛋白,其中ec结构域的n端有6个氨基酸缺失,
且ec结构域的c端有3个氨基酸缺失(seqidno:14的氨基酸25-131),
并且具有l79d突变和tpa前导序列
<400>10
metaspalametlysargglyleucyscysvalleuleuleucysgly
151015
alavalphevalserproglyalaalagluthrargglucysiletyr
202530
tyrasnalaasntrpgluleugluargthrasnglnserglyleuglu
354045
argcysgluglygluglnasplysargleuhiscystyralasertrp
505560
argasnserserglythrilegluleuvallyslysglycystrpasp
65707580
aspasppheasncystyraspargglnglucysvalalathrgluglu
859095
asnproglnvaltyrphecyscyscysgluglyasnphecysasnglu
100105110
argphethrhisleuproglualaglyglyprogluvalthrtyrglu
115120125
proproprothrglyglyglythrhisthrcysproprocysproala
130135140
progluleuleuglyglyproservalpheleupheproprolyspro
145150155160
lysaspthrleumetileserargthrprogluvalthrcysvalval
165170175
valaspvalserhisgluaspprogluvallyspheasntrptyrval
180185190
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
195200205
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
210215220
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
225230235240
leuproalaproileglulysthrileserlysalalysglyglnpro
245250255
arggluproglnvaltyrthrleuproproserarggluglumetthr
260265270
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
275280285
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
290295300
lysthrthrproprovalleuaspseraspglyserphepheleutyr
305310315320
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
325330335
sercysservalmethisglualaleuhisasnhistyrthrglnlys
340345350
serleuserleuserproglylys
355360
<210>11
<211>335
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>加工过的actriib-fc融合蛋白,其中ec结构域的n端有6个氨基酸缺失,
且ec结构域的c端有3个氨基酸缺失(seqidno:14的氨基酸25-131),
并且具有l79d突变(即拉斯帕西普)
<400>11
gluthrargglucysiletyrtyrasnalaasntrpgluleugluarg
151015
thrasnglnserglyleugluargcysgluglygluglnasplysarg
202530
leuhiscystyralasertrpargasnserserglythrilegluleu
354045
vallyslysglycystrpaspaspasppheasncystyrasparggln
505560
glucysvalalathrglugluasnproglnvaltyrphecyscyscys
65707580
gluglyasnphecysasngluargphethrhisleuproglualagly
859095
glyprogluvalthrtyrgluproproprothrglyglyglythrhis
100105110
thrcysproprocysproalaprogluleuleuglyglyproserval
115120125
pheleupheproprolysprolysaspthrleumetileserargthr
130135140
progluvalthrcysvalvalvalaspvalserhisgluaspproglu
145150155160
vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys
165170175
thrlysproargglugluglntyrasnserthrtyrargvalvalser
180185190
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
195200205
cyslysvalserasnlysalaleuproalaproileglulysthrile
210215220
serlysalalysglyglnproarggluproglnvaltyrthrleupro
225230235240
proserarggluglumetthrlysasnglnvalserleuthrcysleu
245250255
vallysglyphetyrproseraspilealavalglutrpgluserasn
260265270
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
275280285
aspglyserphepheleutyrserlysleuthrvalasplysserarg
290295300
trpglnglnglyasnvalphesercysservalmethisglualaleu
305310315320
hisasnhistyrthrglnlysserleuserleuserproglylys
325330335
<210>12
<211>115
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列(seqidno:3的氨基酸20-134)
<400>12
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpalaasnserser
354045
glythrilegluleuvallyslysglycystrpleuaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluvalthrtyrgluproproprothr
100105110
alaprothr
115
<210>13
<211>100
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、c端缺失15个氨基酸的
加工过的多肽序列(seqidno:3的氨基酸20-119)
<400>13
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpalaasnserser
354045
glythrilegluleuvallyslysglycystrpleuaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuprogluala
100
<210>14
<211>512
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib前体蛋白序列(r64)
<400>14
metthralaprotrpvalalaleualaleuleutrpglyserleutrp
151015
proglyserglyargglyglualagluthrargglucysiletyrtyr
202530
asnalaasntrpgluleugluargthrasnglnserglyleugluarg
354045
cysgluglygluglnasplysargleuhiscystyralasertrparg
505560
asnserserglythrilegluleuvallyslysglycystrpleuasp
65707580
asppheasncystyraspargglnglucysvalalathrglugluasn
859095
proglnvaltyrphecyscyscysgluglyasnphecysasngluarg
100105110
phethrhisleuproglualaglyglyprogluvalthrtyrglupro
115120125
proprothralaprothrleuleuthrvalleualatyrserleuleu
130135140
proileglyglyleuserleuilevalleuleualaphetrpmettyr
145150155160
arghisarglysproprotyrglyhisvalaspilehisgluasppro
165170175
glyproproproproserproleuvalglyleulysproleuglnleu
180185190
leugluilelysalaargglyargpheglycysvaltrplysalagln
195200205
leumetasnaspphevalalavallysilepheproleuglnasplys
210215220
glnsertrpglnsergluarggluilepheserthrproglymetlys
225230235240
hisgluasnleuleuglnpheilealaalaglulysargglyserasn
245250255
leugluvalgluleutrpleuilethralaphehisasplysglyser
260265270
leuthrasptyrleulysglyasnileilethrtrpasngluleucys
275280285
hisvalalagluthrmetserargglyleusertyrleuhisgluasp
290295300
valprotrpcysargglygluglyhislysproserilealahisarg
305310315320
aspphelysserlysasnvalleuleulysseraspleuthralaval
325330335
leualaasppheglyleualavalargphegluproglylyspropro
340345350
glyaspthrhisglyglnvalglythrargargtyrmetalaproglu
355360365
valleugluglyalaileasnpheglnargaspalapheleuargile
370375380
aspmettyralametglyleuvalleutrpgluleuvalserargcys
385390395400
lysalaalaaspglyprovalaspglutyrmetleuprophegluglu
405410415
gluileglyglnhisproserleuglugluleuglngluvalvalval
420425430
hislyslysmetargprothrilelysasphistrpleulyshispro
435440445
glyleualaglnleucysvalthrilegluglucystrpasphisasp
450455460
alaglualaargleuseralaglycysvalglugluargvalserleu
465470475480
ileargargservalasnglythrthrseraspcysleuvalserleu
485490495
valthrservalthrasnvalaspleuproprolysgluserserile
500505510
<210>15
<211>116
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列
(seqidno:14的氨基酸19-134)
<400>15
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpargasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuproglualaglyglyprogluvalthrtyrglupropropro
100105110
thralaprothr
115
<210>16
<211>101
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、c端缺失15个氨基酸的加工过的多肽序列
(seqidno:14的氨基酸19-119)
<400>16
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpargasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuprogluala
100
<210>17
<211>115
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽
序列(seqidno:14的氨基酸20-134)
<400>17
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpleuaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluvalthrtyrgluproproprothr
100105110
alaprothr
115
<210>18
<211>100
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、c端缺失15个氨基酸的加工过的多肽
序列(seqidno:14的氨基酸20-119)
<400>18
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpleuaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuprogluala
100
<210>19
<211>107
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列,
其中ec结构域的n端有6个氨基酸缺失,且ec结构域的c端有3个氨基酸缺失
(seqidno:3的氨基酸25-131),并且具有l79d突变
<400>19
gluthrargglucysiletyrtyrasnalaasntrpgluleugluarg
151015
thrasnglnserglyleugluargcysgluglygluglnasplysarg
202530
leuhiscystyralasertrpalaasnserserglythrilegluleu
354045
vallyslysglycystrpaspaspasppheasncystyrasparggln
505560
glucysvalalathrglugluasnproglnvaltyrphecyscyscys
65707580
gluglyasnphecysasngluargphethrhisleuproglualagly
859095
glyprogluvalthrtyrgluproproprothr
100105
<210>20
<211>360
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>未加工的actriib-fc融合蛋白,
其中ec结构域的n端有6个氨基酸缺失,且ec结构域的c端有3个氨基酸缺失
(seqidno:3的氨基酸25-131),并且具有l79d突变和tpa前导序列
<400>20
metaspalametlysargglyleucyscysvalleuleuleucysgly
151015
alavalphevalserproglyalaalagluthrargglucysiletyr
202530
tyrasnalaasntrpgluleugluargthrasnglnserglyleuglu
354045
argcysgluglygluglnasplysargleuhiscystyralasertrp
505560
alaasnserserglythrilegluleuvallyslysglycystrpasp
65707580
aspasppheasncystyraspargglnglucysvalalathrgluglu
859095
asnproglnvaltyrphecyscyscysgluglyasnphecysasnglu
100105110
argphethrhisleuproglualaglyglyprogluvalthrtyrglu
115120125
proproprothrglyglyglythrhisthrcysproprocysproala
130135140
progluleuleuglyglyproservalpheleupheproprolyspro
145150155160
lysaspthrleumetileserargthrprogluvalthrcysvalval
165170175
valaspvalserhisgluaspprogluvallyspheasntrptyrval
180185190
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
195200205
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
210215220
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
225230235240
leuproalaproileglulysthrileserlysalalysglyglnpro
245250255
arggluproglnvaltyrthrleuproproserarggluglumetthr
260265270
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
275280285
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
290295300
lysthrthrproprovalleuaspseraspglyserphepheleutyr
305310315320
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
325330335
sercysservalmethisglualaleuhisasnhistyrthrglnlys
340345350
serleuserleuserproglylys
355360
<210>21
<211>335
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>加工过的actriib-fc融合蛋白,
其中ec结构域的n端有6个氨基酸缺失,且ec结构域的c端有3个氨基酸缺失
(seqidno:3的氨基酸25-131),并且具有l79d突变
<400>21
gluthrargglucysiletyrtyrasnalaasntrpgluleugluarg
151015
thrasnglnserglyleugluargcysgluglygluglnasplysarg
202530
leuhiscystyralasertrpalaasnserserglythrilegluleu
354045
vallyslysglycystrpaspaspasppheasncystyrasparggln
505560
glucysvalalathrglugluasnproglnvaltyrphecyscyscys
65707580
gluglyasnphecysasngluargphethrhisleuproglualagly
859095
glyprogluvalthrtyrgluproproprothrglyglyglythrhis
100105110
thrcysproprocysproalaprogluleuleuglyglyproserval
115120125
pheleupheproprolysprolysaspthrleumetileserargthr
130135140
progluvalthrcysvalvalvalaspvalserhisgluaspproglu
145150155160
vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys
165170175
thrlysproargglugluglntyrasnserthrtyrargvalvalser
180185190
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
195200205
cyslysvalserasnlysalaleuproalaproileglulysthrile
210215220
serlysalalysglyglnproarggluproglnvaltyrthrleupro
225230235240
proserarggluglumetthrlysasnglnvalserleuthrcysleu
245250255
vallysglyphetyrproseraspilealavalglutrpgluserasn
260265270
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
275280285
aspglyserphepheleutyrserlysleuthrvalasplysserarg
290295300
trpglnglnglyasnvalphesercysservalmethisglualaleu
305310315320
hisasnhistyrthrglnlysserleuserleuserproglylys
325330335
<210>22
<211>115
<212>prt
<213>智人(homosapiens)
<220>
<223>具有l79d突变的人actriib可溶性(胞外)加工过的多肽
序列(seqidno:14的氨基酸20-134)
<400>22
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpaspaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluvalthrtyrgluproproprothr
100105110
alaprothr
115
<210>23
<211>115
<212>prt
<213>智人(homosapiens)
<220>
<223>具有l79d突变的人actriib可溶性(胞外)加工过的多肽
序列(seqidno:3的氨基酸20-134)
<400>23
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpalaasnserser
354045
glythrilegluleuvallyslysglycystrpaspaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluvalthrtyrgluproproprothr
100105110
alaprothr
115
<210>24
<211>343
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)加工过的多肽序列
(seqidno:14的氨基酸20-134),具有以ggg接头与fc结构域融合的l79d突变
<400>24
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpaspaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluvalthrtyrgluproproprothr
100105110
alaprothrglyglyglythrhisthrcysproprocysproalapro
115120125
gluleuleuglyglyproservalpheleupheproprolysprolys
130135140
aspthrleumetileserargthrprogluvalthrcysvalvalval
145150155160
aspvalserhisgluaspprogluvallyspheasntrptyrvalasp
165170175
glyvalgluvalhisasnalalysthrlysproargglugluglntyr
180185190
asnserthrtyrargvalvalservalleuthrvalleuhisglnasp
195200205
trpleuasnglylysglutyrlyscyslysvalserasnlysalaleu
210215220
proalaproileglulysthrileserlysalalysglyglnproarg
225230235240
gluproglnvaltyrthrleuproproserarggluglumetthrlys
245250255
asnglnvalserleuthrcysleuvallysglyphetyrproserasp
260265270
ilealavalglutrpgluserasnglyglnprogluasnasntyrlys
275280285
thrthrproprovalleuaspseraspglyserphepheleutyrser
290295300
lysleuthrvalasplysserargtrpglnglnglyasnvalpheser
305310315320
cysservalmethisglualaleuhisasnhistyrthrglnlysser
325330335
leuserleuserproglylys
340
<210>25
<211>343
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列
(seqidno:3的氨基酸20-134),具有与fc结构域融合的l79d突变
<400>25
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpalaasnserser
354045
glythrilegluleuvallyslysglycystrpaspaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluvalthrtyrgluproproprothr
100105110
alaprothrglyglyglythrhisthrcysproprocysproalapro
115120125
gluleuleuglyglyproservalpheleupheproprolysprolys
130135140
aspthrleumetileserargthrprogluvalthrcysvalvalval
145150155160
aspvalserhisgluaspprogluvallyspheasntrptyrvalasp
165170175
glyvalgluvalhisasnalalysthrlysproargglugluglntyr
180185190
asnserthrtyrargvalvalservalleuthrvalleuhisglnasp
195200205
trpleuasnglylysglutyrlyscyslysvalserasnlysalaleu
210215220
proalaproileglulysthrileserlysalalysglyglnproarg
225230235240
gluproglnvaltyrthrleuproproserarggluglumetthrlys
245250255
asnglnvalserleuthrcysleuvallysglyphetyrproserasp
260265270
ilealavalglutrpgluserasnglyglnprogluasnasntyrlys
275280285
thrthrproprovalleuaspseraspglyserphepheleutyrser
290295300
lysleuthrvalasplysserargtrpglnglnglyasnvalpheser
305310315320
cysservalmethisglualaleuhisasnhistyrthrglnlysser
325330335
leuserleuserproglylys
340
<210>26
<211>368
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列
(seqidno:14的氨基酸20-134),具有与fc结构域融合的l79d突变和tpa前导序列
<400>26
metaspalametlysargglyleucyscysvalleuleuleucysgly
151015
alavalphevalserproglyalaserglyargglyglualagluthr
202530
argglucysiletyrtyrasnalaasntrpgluleugluargthrasn
354045
glnserglyleugluargcysgluglygluglnasplysargleuhis
505560
cystyralasertrpargasnserserglythrilegluleuvallys
65707580
lysglycystrpaspaspasppheasncystyraspargglnglucys
859095
valalathrglugluasnproglnvaltyrphecyscyscysglugly
100105110
asnphecysasngluargphethrhisleuproglualaglyglypro
115120125
gluvalthrtyrgluproproprothralaprothrglyglyglythr
130135140
histhrcysproprocysproalaprogluleuleuglyglyproser
145150155160
valpheleupheproprolysprolysaspthrleumetileserarg
165170175
thrprogluvalthrcysvalvalvalaspvalserhisgluasppro
180185190
gluvallyspheasntrptyrvalaspglyvalgluvalhisasnala
195200205
lysthrlysproargglugluglntyrasnserthrtyrargvalval
210215220
servalleuthrvalleuhisglnasptrpleuasnglylysglutyr
225230235240
lyscyslysvalserasnlysalaleuproalaproileglulysthr
245250255
ileserlysalalysglyglnproarggluproglnvaltyrthrleu
260265270
proproserarggluglumetthrlysasnglnvalserleuthrcys
275280285
leuvallysglyphetyrproseraspilealavalglutrpgluser
290295300
asnglyglnprogluasnasntyrlysthrthrproprovalleuasp
305310315320
seraspglyserphepheleutyrserlysleuthrvalasplysser
325330335
argtrpglnglnglyasnvalphesercysservalmethisgluala
340345350
leuhisasnhistyrthrglnlysserleuserleuserproglylys
355360365
<210>27
<211>368
<212>prt
<213>智人(homosapiens)
<220>
<223>人actriib可溶性(胞外)、加工过的多肽序列
(seqidno:3的氨基酸20-134),具有与fc结构域融合的l79d突变和tpa前导序列
<400>27
metaspalametlysargglyleucyscysvalleuleuleucysgly
151015
alavalphevalserproglyalaserglyargglyglualagluthr
202530
argglucysiletyrtyrasnalaasntrpgluleugluargthrasn
354045
glnserglyleugluargcysgluglygluglnasplysargleuhis
505560
cystyralasertrpalaasnserserglythrilegluleuvallys
65707580
lysglycystrpaspaspasppheasncystyraspargglnglucys
859095
valalathrglugluasnproglnvaltyrphecyscyscysglugly
100105110
asnphecysasngluargphethrhisleuproglualaglyglypro
115120125
gluvalthrtyrgluproproprothralaprothrglyglyglythr
130135140
histhrcysproprocysproalaprogluleuleuglyglyproser
145150155160
valpheleupheproprolysprolysaspthrleumetileserarg
165170175
thrprogluvalthrcysvalvalvalaspvalserhisgluasppro
180185190
gluvallyspheasntrptyrvalaspglyvalgluvalhisasnala
195200205
lysthrlysproargglugluglntyrasnserthrtyrargvalval
210215220
servalleuthrvalleuhisglnasptrpleuasnglylysglutyr
225230235240
lyscyslysvalserasnlysalaleuproalaproileglulysthr
245250255
ileserlysalalysglyglnproarggluproglnvaltyrthrleu
260265270
proproserarggluglumetthrlysasnglnvalserleuthrcys
275280285
leuvallysglyphetyrproseraspilealavalglutrpgluser
290295300
asnglyglnprogluasnasntyrlysthrthrproprovalleuasp
305310315320
seraspglyserphepheleutyrserlysleuthrvalasplysser
325330335
argtrpglnglnglyasnvalphesercysservalmethisgluala
340345350
leuhisasnhistyrthrglnlysserleuserleuserproglylys
355360365
<210>28
<211>141
<212>prt
<213>智人(homosapiens)
<220>
<223>具有变异c端序列的人actriib可溶性(胞外)、加工过的多肽
序列(在wo2007/053775中公开)
<400>28
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpleuaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluglyprotrpalaserthrthrile
100105110
proserglyglyproglualathralaalaalaglyaspglnglyser
115120125
glyalaleutrpleucysleugluglyproalahisglu
130135140
<210>29
<211>141
<212>prt
<213>智人(homosapiens)
<220>
<223>具有变异c端序列的人actriib可溶性(胞外)、加工过的多肽
序列(在wo2007/053775中公开),具有l79d突变
<400>29
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpaspaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluglyprotrpalaserthrthrile
100105110
proserglyglyproglualathralaalaalaglyaspglnglyser
115120125
glyalaleutrpleucysleugluglyproalahisglu
130135140
<210>30
<211>370
<212>prt
<213>智人(homosapiens)
<220>
<223>具有变异c端序列的人actriib可溶性(胞外)、加工过的多肽序列
(在wo2007/053775中公开),其具有以tggg接头与fc结构域融合的l79d突变
<400>30
glyargglyglualagluthrargglucysiletyrtyrasnalaasn
151015
trpgluleugluargthrasnglnserglyleugluargcysglugly
202530
gluglnasplysargleuhiscystyralasertrpargasnserser
354045
glythrilegluleuvallyslysglycystrpaspaspasppheasn
505560
cystyraspargglnglucysvalalathrglugluasnproglnval
65707580
tyrphecyscyscysgluglyasnphecysasngluargphethrhis
859095
leuproglualaglyglyprogluglyprotrpalaserthrthrile
100105110
proserglyglyproglualathralaalaalaglyaspglnglyser
115120125
glyalaleutrpleucysleugluglyproalahisgluthrglygly
130135140
glythrhisthrcysproprocysproalaprogluleuleuglygly
145150155160
proservalpheleupheproprolysprolysaspthrleumetile
165170175
serargthrprogluvalthrcysvalvalvalaspvalserhisglu
180185190
aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis
195200205
asnalalysthrlysproargglugluglntyrasnserthrtyrarg
210215220
valvalservalleuthrvalleuhisglnasptrpleuasnglylys
225230235240
glutyrlyscyslysvalserasnlysalaleuproalaproileglu
245250255
lysthrileserlysalalysglyglnproarggluproglnvaltyr
260265270
thrleuproproserarggluglumetthrlysasnglnvalserleu
275280285
thrcysleuvallysglyphetyrproseraspilealavalglutrp
290295300
gluserasnglyglnprogluasnasntyrlysthrthrproproval
305310315320
leuaspseraspglyserphepheleutyrserlysleuthrvalasp
325330335
lysserargtrpglnglnglyasnvalphesercysservalmethis
340345350
glualaleuhisasnhistyrthrglnlysserleuserleuserpro
355360365
glylys
370
<210>31
<211>1083
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>编码seqidno:10的核酸序列
<400>31
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtt60
tcgcccggcgccgccgaaacccgcgaatgtatttattacaatgctaattgggaactcgaa120
cggacgaaccaatccgggctcgaacggtgtgagggggaacaggataaacgcctccattgc180
tatgcgtcgtggaggaactcctccgggacgattgaactggtcaagaaagggtgctgggac240
gacgatttcaattgttatgaccgccaggaatgtgtcgcgaccgaagagaatccgcaggtc300
tatttctgttgttgcgaggggaatttctgtaatgaacggtttacccacctccccgaagcc360
ggcgggcccgaggtgacctatgaacccccgcccaccggtggtggaactcacacatgccca420
ccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaaccc480
aaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagc540
cacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgcc600
aagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcacc660
gtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagcc720
ctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacag780
gtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgc840
ctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccg900
gagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctat960
agcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtg1020
atgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtccccgggtaaa1080
tga1083
<210>32
<211>344
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>融合蛋白,包含与fc结构域融合的actriib的可溶性胞外结构域
(r64;seqidno:15)
<400>32
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpargasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuproglualaglyglyprogluvalthrtyrglupropropro
100105110
thralaprothrglyglyglythrhisthrcysproprocysproala
115120125
progluleuleuglyglyproservalpheleupheproprolyspro
130135140
lysaspthrleumetileserargthrprogluvalthrcysvalval
145150155160
valaspvalserhisgluaspprogluvallyspheasntrptyrval
165170175
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
180185190
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
195200205
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
210215220
leuprovalproileglulysthrileserlysalalysglyglnpro
225230235240
arggluproglnvaltyrthrleuproproserarggluglumetthr
245250255
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
260265270
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
275280285
lysthrthrproprovalleuaspseraspglyserphepheleutyr
290295300
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
305310315320
sercysservalmethisglualaleuhisasnhistyrthrglnlys
325330335
serleuserleuserproglylys
340
<210>33
<211>329
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>融合蛋白,包含actriib(r64)的可溶性胞外结构域,
其c端缺失15个氨基酸(seqidno:16),与fc结构域融合
<400>33
serglyargglyglualagluthrargglucysiletyrtyrasnala
151015
asntrpgluleugluargthrasnglnserglyleugluargcysglu
202530
glygluglnasplysargleuhiscystyralasertrpargasnser
354045
serglythrilegluleuvallyslysglycystrpleuaspaspphe
505560
asncystyraspargglnglucysvalalathrglugluasnprogln
65707580
valtyrphecyscyscysgluglyasnphecysasngluargphethr
859095
hisleuproglualaglyglyglythrhisthrcysproprocyspro
100105110
alaprogluleuleuglyglyproservalpheleupheproprolys
115120125
prolysaspthrleumetileserargthrprogluvalthrcysval
130135140
valvalaspvalserhisgluaspprogluvallyspheasntrptyr
145150155160
valaspglyvalgluvalhisasnalalysthrlysproarggluglu
165170175
glntyrasnserthrtyrargvalvalservalleuthrvalleuhis
180185190
glnasptrpleuasnglylysglutyrlyscyslysvalserasnlys
195200205
alaleuprovalproileglulysthrileserlysalalysglygln
210215220
proarggluproglnvaltyrthrleuproproserarggluglumet
225230235240
thrlysasnglnvalserleuthrcysleuvallysglyphetyrpro
245250255
seraspilealavalglutrpgluserasnglyglnprogluasnasn
260265270
tyrlysthrthrproprovalleuaspseraspglyserphepheleu
275280285
tyrserlysleuthrvalasplysserargtrpglnglnglyasnval
290295300
phesercysservalmethisglualaleuhisasnhistyrthrgln
305310315320
lysserleuserleuserproglylys
325
<210>34
<211>344
<212>prt
<213>智人(homosapiens)
<220>
<223>与人fc结构域融合的人actriia的胞外结构域
<400>34
ileleuglyargsergluthrglnglucysleuphepheasnalaasn
151015
trpglulysaspargthrasnglnthrglyvalgluprocystyrgly
202530
asplysasplysargarghiscysphealathrtrplysasnileser
354045
glyserilegluilevallysglnglycystrpleuaspaspileasn
505560
cystyraspargthraspcysvalglulyslysaspserprogluval
65707580
tyrphecyscyscysgluglyasnmetcysasnglulysphesertyr
859095
pheproglumetgluvalthrglnprothrserasnprovalthrpro
100105110
lysproprothrglyglyglythrhisthrcysproprocysproala
115120125
progluleuleuglyglyproservalpheleupheproprolyspro
130135140
lysaspthrleumetileserargthrprogluvalthrcysvalval
145150155160
valaspvalserhisgluaspprogluvallyspheasntrptyrval
165170175
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
180185190
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
195200205
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
210215220
leuprovalproileglulysthrileserlysalalysglyglnpro
225230235240
arggluproglnvaltyrthrleuproproserarggluglumetthr
245250255
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
260265270
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
275280285
lysthrthrproprovalleuaspseraspglyserphepheleutyr
290295300
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
305310315320
sercysservalmethisglualaleuhisasnhistyrthrglnlys
325330335
serleuserleuserproglylys
340
- 还没有人留言评论。精彩留言会获得点赞!