雷公藤甲素在诱导癌细胞自噬以及协同HDAC抑制剂治疗肿瘤中的应用的制作方法
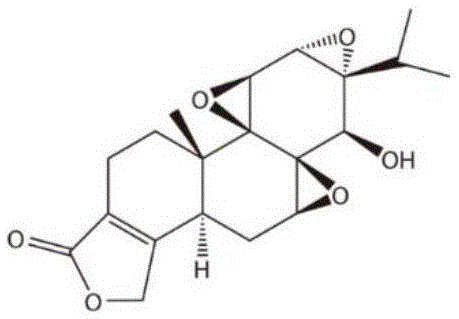
本发明涉及细胞自噬和凋亡领域,更具体地,涉及雷公藤甲素在诱导癌细胞自噬上的作用。
背景技术:
:脑胶质瘤(glioma)是最常见,最致命的原发性恶性脑肿瘤之一,具有侵袭性强、进展迅速和易复发等特点。目前临床上脑胶质瘤的标准治疗方法是外科手术为主,辅以放疗和一线化疗药替莫唑胺(tmz)的综合治疗方法。然而,其疗效受到tmz的固有和获得性耐药限制,并且总体反应差。因此,迫切需要一种替代治疗药物来有效地治疗胶质瘤。雷公藤甲素(triptolide)是从雷公藤中分离得到的第一个环氧二萜内酯,是雷公藤生物活性的主要成分。triptolide具有广泛的生物活性,如抗炎,免疫抑制,避孕,抗血管生成和抗癌等。目前的研究表明,triptolide在治疗某些炎症性疾病和肿瘤方面有潜在的优势,许多相应的分子靶点已被报道。2007年,天然化合物triptolide,雷同藤甲素,辣椒素,姜黄素和青蒿素被cell杂志称为最有可能发展成现代药物的典范。越来越多的研究表明,triptolide是一个具有强烈活性的广谱抗癌药,triptolide几乎能杀死来源于前列腺,结肠,乳腺,血液和肾脏等的所有癌细胞,目前,triptolide的一些衍生物已经进入临床评价阶段。先前有研究表明,triptolide在体内外均能抑制脑胶质瘤的增殖,但其分子机制尚不清楚。细胞凋亡(apoptosis),又称为i型程序性细胞死亡(pcd),是一种进化中高度保守的高度调节细胞死亡的方式。细胞凋亡对包括肿瘤在内的多细胞生物的发育和稳态至关重要。虽然凋亡是癌症化疗过程中的主要机制,但最近出现了另一种称为自噬的调节机制。自噬是通过一种称为双层膜的自噬体结构将细胞内容物传递到溶酶体进行降解的过程。然而,自噬在肿瘤发展的不同阶段以及在单个细胞和癌组织之间的作用是不同的。目前,由于自噬在细胞存活和细胞死亡之间的双重作用,自噬在抗肿瘤中的作用仍然是令研究者感到困惑和矛盾的。另外,自噬和凋亡之间的关系也不甚清楚。在肿瘤细胞,自噬可以抑制凋亡引起的细胞死亡,也可以和凋亡协同作用,共同促进癌细胞的死亡。因此,更多的了解自噬在肿瘤细胞中的功能是非常重要和必要的。活性氧(ros)是氧的活性形式,当处于较低水平时,ros对细胞是有益的,然而,ros的过度积累可以促进肿瘤的发生。线粒体是产生ros的主要场所。jnk信号通路是ros信号通路的众多下游级联之一,与细胞增殖、分化、有丝分裂、细胞存活和死亡密切相关。akt/mtor信号通路是正常细胞和肿瘤细胞存活、生长、增殖和蛋白质合成的主要调节途径之一。之前的研究表明akt/mtor通路参与细胞自噬和凋亡的过程。联合用药是肿瘤治疗尤其是化疗中的热点,用于克服肿瘤的耐药性,降低毒副作用。本领域中,hdac的抑制剂saha已经是fda批准上市的用于治疗实体瘤的药物,但是其治疗效果欠佳。技术实现要素:本发明提供一种可促进脑胶质瘤细胞凋亡和自噬发生的药物:triptolide。该药物通过影响ros/jnk和akt/mtor信号通路相关蛋白的表达,从而引起脑胶质瘤细胞凋亡和自噬的发生。为实现上述目的,雷公藤甲素在制备诱导癌细胞自噬上的药物中的应用。所述药物对癌细胞自噬的诱导作用是通过增强ros的产生和jnk蛋白的磷酸化水平,抑制p-akt和p-mtor蛋白的表达发挥作用的。所述癌细胞为脑胶质瘤细胞。所述癌细胞自噬过程中的诱导因素为增强癌细胞中ros的产生和p-jnk蛋白的表达,抑制p-akt和p-mtor蛋白的表达。根据需求再提供一种雷公藤甲素在制备ros或p-jnk蛋白激活剂,p-akt或p-mtor抑制剂中的应用。根据需求再提供一种雷公藤甲素在ros、p-jnk、p-akt、或p-mtor蛋白的研究制剂上的应用根据需求再提供一种雷公藤甲素在研究ros、p-jnk、p-akt、或p-mtor蛋白,以及它们的底物蛋白的生物学功能上的应用。根据需求再提供一种雷公藤甲素在制备自噬启动剂或/和诱导剂上的应用。所述的癌细胞为脑胶质瘤细胞。根据需求,本发明还提供雷公藤甲素与hdac的抑制剂组成的药物组合物,用于制备治疗肿瘤的药物,其中所述的hdac抑制剂优选为saha;所述的肿瘤优选为脑胶质瘤。其中,雷公藤甲素与hdac的抑制剂的重量比为1:1-100,优选1:1-10。本发明的优点在于,1、本发明首次公开了triptolide在诱导癌细胞凋亡和自噬方面的作用以及两者之间的关系,通过诱导自噬作用,帮助癌细胞回归其正常状态,抑制凋亡的发生。triptolide和凋亡抑制剂合用可以促进癌细胞的死亡。2、triptolide可以通过促进ros/jnk和抑制akt/mtor信号通路实现其对凋亡和自噬的作用。具体来说,triptolide可以促进ros的产生进而活化jnk蛋白,促进ros/jnk信号通路,同时可以抑制p-akt和p-mtor蛋白的表达,负作用于akt/mtor信号通路,进一步影响凋亡和自噬。3、作为一种药物,triptolide可以靶向性地作用于癌细胞,有效控制癌细胞并诱导癌细胞的凋亡,而对正常细胞无影响。4、作为一种协同药物,本发明发现雷同藤甲素可以协同saha,提高脑胶质瘤细胞对于saha的敏感性。附图说明图1:triptolide的化学结构式图2:不同浓度的triptolide作用于脑胶质瘤细胞系u251,u87-mg和c6和正常的星形胶质细胞astrocyte不同时间后,cck8检测细胞活性的变化。图3:不同浓度的triptolide作用于脑胶质瘤细胞系u251,u87-mg和c624h后,光学显微镜观察细胞数量和形态的变化。图4:不同浓度的triptolide作用于脑胶质瘤细胞系u251,u87-mg和c624h,hoechst33242染细胞核后,荧光显微镜观察细胞核的形态,检测凋亡的发生。图5:不同浓度的triptolide作用于脑胶质瘤细胞系u251,u87-mg和c624h,fitcannexinv/pi双染法检测细胞外在途径的凋亡。图6:不同浓度的triptolide作用于脑胶质瘤细胞系u251,u87-mg和c624h,jc-1试剂盒检测细胞内在途径凋亡的发生。图7:不同浓度triptolide作用于脑胶质瘤细胞系u251,u87-mg和c624h或300nm的triptolide作用于三种细胞系不同时间后,westernblotting检测凋亡相关蛋白cleavedparp和cleaved-caspase3,8,9的变化。图8:u251细胞瞬时转染mrfp-egfp-lc3b质粒,triptolide单独或triptolide和自噬抑制剂3-ma共同作用转染细胞后,共聚焦显微镜观察自噬体的形成。图9:不同浓度triptolide作用于脑胶质瘤细胞系u251,u87-mg和c624h或300nm的triptolide作用于三种细胞系不同时间后,自噬相关蛋白lc3ⅱ,p62和beclin-1变化的westernblotting结果。图10:自噬抑制剂3-ma或凋亡抑制剂z-vad和triptolide共同处理细胞后,cck8检测细胞活性的变化。图11:triptolide和自噬抑制剂3-ma共同处理细胞后,流式细胞术检测细胞凋亡的变化。图12:triptolide和自噬抑制剂3-ma或凋亡抑制剂z-vad合用后,自噬和凋亡相关蛋白lc3ⅱ,p62,beclin-1,cleaved-parp,cleaved-caspase3,8和9变化的westernblotting结果.图13:用nac(ros抑制剂)提前处理三种细胞系2h,再用300nm的triptolide作用于细胞12h后,用dcfh-da探针通过荧光显微镜检测ros的产生。图14:用nac(ros抑制剂)提前处理三种细胞系2h,再用300nm的triptolide作用于细胞12h后,用dcfh-da探针通过流式细胞仪检测ros的产生。图15:用nac(ros抑制剂)提前处理三种细胞系2h,再用300nm的triptolide作用于细胞24h后,cck8检测细胞的活性。图16;triptolide和ros抑制剂nac合用后,自噬和凋亡相关蛋白表达的westernblotting结果。图17:用sp(jnk抑制剂)提前处理u251细胞2h,再用300nm的triptolide作用于细胞12h后,流式细胞术检测ros的产生。图18:不同浓度triptolide作用于u251细胞24h和300nm的triptolide作用于细胞不同时间后,细胞中jnk,akt,mtor蛋白及其磷酸化蛋白含量变化的westernblotting结果。图19:triptolide和jnk抑制剂sp或akt抑制剂mk或mtor抑制剂ra合用后,自噬相关蛋白和凋亡相关蛋白变化的westernblotting结果。图20:triptolide和jnk抑制剂sp或akt抑制剂mk或mtor抑制剂ra合用后,cck8检测细胞活性的变化。图21:在裸鼠脑胶质瘤细胞模型中,不同浓度triptolide对肿瘤体积的影响。图22:triptolide对小鼠体内的相关蛋白的westernblotting结果。图23:triptolide对肿瘤组织相关指标的免疫组化和免疫荧光结果。图24:triptolide对脑胶质瘤细胞的作用机制图。具体实施方式以下结合附图和具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1triptolide在体外抑制脑胶质瘤细胞生长的作用一、脑胶质瘤细胞株体外培养本实验所用细胞为人脑胶质瘤细胞u251,u87-mg和鼠脑胶质细胞c6,使用添加10%胎牛血清的mem培养基,在37℃,5%co2培养箱中进行细胞培养,待细胞生长至占培养皿底部70~80%时,使用0.1%胰酶-edta消化并传代。二、细胞活性的检测本实验使用cck8法和荧光显微镜观察对triptolide(图1)抑制脑胶质瘤细胞生长的作用进行检测。将triptolide溶解于dmso中配成100μm浓缩液,-20℃保存,使用时分别稀释为30,100,300,1000nm。细胞铺96孔板(2500-5000个细胞/孔)24后,加入不同浓度的triptolide不同时间后,用cck8法检测细胞活性。作用24h后,用光学显微镜观察细胞形态和数量的变化。实验结果:结果显示,triptolide可以有效的抑制脑胶质瘤细胞的生长,对正常星形胶质的活性差。(图2和图3)实施例2triptolide可以引起脑胶质瘤细胞内在和外在途径凋亡的发生。本实验使用荧光显微镜,流式细胞仪和westernblotting法检测细胞内在和外在凋亡的发生。一、荧光显微镜观察细胞核形态的变化实验方法:细胞铺96孔板(2500-5000个细胞/孔),第二天用300nm的triptolide处理细胞24h后,用hoechst33242染细胞核,通过荧光显微镜观察细胞核形态的变化。实验结果:结果显示,随着triptolide浓度的增高,三种细胞出现了不同程度的染色质浓缩、边缘化,核膜裂解和凋亡小体等典型的凋亡形态(图4)。二、流式细胞仪检测凋亡的发生实验方法:将细胞消化,离心并重悬浮于相应培养液中,以2.5x105/孔的密度种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,用不同浓度的triptolide处理细胞24h后,分别用fitcannexinv/pi双染法和jc-1试剂盒检测细胞凋亡的发生。实验结果:fitcannexinv/pi双染法显示,随着triptolide浓度的升高,细胞的凋亡比例增高(图5)。表明细胞外在途径凋亡的发生。jc-1结果显示,triptolide可以引起jc-1红色荧光/绿色荧光比值的下降(图6),表明线粒体膜电位的下降,是内在途径凋亡早期的一个指标。三、westernblotting法检测细胞凋亡的发生细胞铺6孔板24h后,用不同浓度的triptolide处理细胞24h或用300nmtriptolide处理细胞不同时间后,收集细胞,提取蛋白,用westernblotting法检测凋亡相关蛋白的变化。实验结果:结果显示,triptoldie可以引起内在途径和外在途径凋亡相关蛋白表达的变化。实施例3共聚焦显微镜检测triptolide对脑胶质瘤细胞自噬的诱导作用实验方法:本实验使用共聚焦显微镜对triptolide诱导的脑胶质瘤细胞的自噬进行检测。用脂质体lip20002.0ul将0.8ugmrfp-egfp-lc3双荧光质粒瞬时转染入u251细胞中,用于标记及追踪lc3以及自噬流的变化。其中gfp是酸敏感型gfp蛋白,而mrfp是稳定的荧光表达基团,不受外界影响。由于自噬小体进入第二阶段后,与溶酶体进行融合,形成自噬溶酶体。自噬溶酶体由于溶酶体内部的酸性环境,可以导致ph下降,gfp淬灭,因此,gfp的减弱可指示自噬溶酶体形成的顺利程度,gfp越少,则从自噬小体到自噬溶酶体阶段流通得越顺畅。反之,自噬小体和溶酶体融合被抑制,自噬溶酶体进程受阻。mrfp是一直稳定表达的,因而可以通过gfp与mrfp的亮点比例来评价自噬流进程。转染24h后,用3-ma预处理细胞2h,再用300nm的triptolide处理细胞24h,置于共聚焦显微镜下观察并拍照。实验结果:通过共聚焦显微镜拍摄到的结果可以看到,triptolide可有效诱导细胞自噬的发生,红色荧光和绿色荧光的亮点均增多。当triptolide和3-ma合用时,这种效应减弱。(图8)说明,triptolide可有效促进自噬体的产生。实施例4lc3蛋白标记法检测triptolide对脑胶质瘤细胞自噬的诱导作用:lc3是细胞自噬形成的一个标志蛋白,具有lc3i和lc3ii两种形式。无自噬发生时,该蛋白在胞质中以lc3i形式存在,自噬形成时,胞浆型lc3(即lc3-i)会酶解掉一小段多肽,转变为(自噬体)膜型(即lc3-ii),lc3-ii/i比值的大小可估计自噬水平的高低。beclin-1是细胞发生自噬时的一个起始蛋白,p62是自噬溶酶体降解自噬底物的一个关键性蛋白。实验方法:将细胞种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,将细胞分为三组,第一组移除原培养基,加入新鲜配置的,含有30,100,300,1000nmtriptolide的培养基中继续培养24h;第二组移除培养基后加入新鲜配置的,含有300nm的培养基中继续培养,分别于培养的6,12,24,36h终止培养。细胞终止培养后立即提取细胞总蛋白,westernblotting法检测上述自噬相关蛋白的表达量的变化。实验结果:westernblotting结果显示,在三种细胞系中,beclin-1和lc3ii的表达随着triptolide作用浓度的增高和时间的延长而有升高趋势。同时,p62的表达随着triptolide作用浓度的增高而降低(图9)。说明triptolide可以引起脑胶质瘤自噬的发生。实施例5triptolide引起的自噬对脑胶质瘤细胞生长的影响实验方法:将细胞种植于96孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,用3mm的3-ma预处理u251细胞后,用300nm的triptolide处理细胞24h,用cck8法检测细胞的存活率。实验结果:结果显示,当使用自噬抑制剂3-ma后,细胞的存活率明显下降。说明triptolide引起的细胞自噬可能起着细胞促存活的作用。(图10)实施例6triptolide引起的自噬与凋亡的关系。实验方法:将细胞种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,移除原培养基,用3mm的3-ma或30μm的z-vad预处理细胞2h后,用300nm的triptolide处理细胞24h。细胞终止培养后,分为两组。第一组收集细胞,用流式细胞仪检测细胞自噬的变化。第二组立即提取细胞总蛋白,westernblotting法检测自噬相关蛋白和凋亡相关蛋白的表达量的变化。实验结果:流式检测的结果显示,当使用3-ma抑制自噬后,细胞的凋亡率明显增加(图11);westernblotting结果显示,使用3-ma抑制自噬后,凋亡相关蛋白的表达量升高,当使用z-vad抑制凋亡后,自噬相关蛋白的表达同样升高(图12)。综上结果表明,triptolide引起的凋亡和自噬可以相互抑制。实施例7ros的产生是triptolide引起凋亡和自噬必须的。一、triptolide可以引起ros的产生实验方法:将细胞种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,用nac(ros抑制剂)预处理细胞2h后,加入300nmtriptolide继续培养12h后,用dcfh-da探针分别通过荧光显微镜和流式细胞仪检测ros的产生。实验结果:荧光显微镜和流式细胞术的结果显示triptolide可以促进ros的产生,nac可以抑制triptolide的这种效应。(图13和图14)二、ros可以调节triptolide所引起的细胞死亡和凋亡和自噬的发生。实验方法:u251细胞用nac预处理2h,再用triptolide处理24h后,分别用cck8检测细胞的活性,用westernblotting检测自噬和凋亡相关蛋白的变化。实验结果:结果显示,nac和triptolide合用后,相较于单用triptolide,细胞的活性升高(图15),自噬和凋亡相关蛋白的表达下降(图16)。实施例8ros的产生可以引起jnk的活化,triptolide引起jnk的活化和akt和mtor的抑制。一、ros的产生可以引起jnk的活化实验方法:将细胞种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,用sp(jnk抑制剂)预处理细胞2h后,加入300nmtriptolide继续培养12h后,用dcfh-da探针通过流式细胞仪检测ros的产生。实验结果:当triptolide和sp共同处理细胞时,ros的产生增多的更明显(图17),且nac可以抑制jnk的磷酸化水平(图16),表明jnk可能是ros的下游分子,ros可能促进jnk的活化。二、triptolide引起jnk的活化和akt和mtor的抑制。实验方法:将细胞种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,移除培养基后加入新鲜配置的,含有30,100,300,1000nm的triptolide培养24h,或移除培养基后加入新鲜配置的含有300nm的培养基,分别继续培养3,6,12,24h后终止培养。细胞终止培养后,收集细胞,用westernblotting检测相关通路jnk,akt和mtor指标表达的变化。实验结果:westernblotting结果显示,随着雷公藤甲素作用浓度的增高和时间的延长,jnk的磷酸化水平升高,而akt和mtor的磷酸化水平则被抑制(图18)。这些结果表明triptolide可能激活了ros/jnk信号通路,抑制了akt/mtor信号通路。实施例9jnk和akt/mtor信号通路可以调节triptolide引起的细胞死亡和凋亡和自噬的发生。实验方法:将细胞种植于6孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,移除原培养基,用sp,mk(akt抑制剂)或ra(mtor抑制剂)预处理2h后,加入300nm的triptolide的继续培养24h。细胞终止培养后,分别用westernblotting检测自噬相关指标lc3ⅱ,beclin1和p62表达的变化,用cck8检测细胞活性的变化。实验结果:sp可以抑制triptolide引起的凋亡和自噬的发生,抑制triptolide引起的细胞死亡。mk和ra则有相反的效应(图19)。进一步表明,triptolide是通过激活ros/jnk信号通路,抑制akt/mtor信号通路引起胶质瘤细胞的自噬的。实施例10triptolide作用的体内验证。实验方法:将3.5x105u251细胞通过立体定位仪注入balb/c裸鼠的尾状核,造成裸鼠的脑胶质瘤模型。7天模型成功后,分别腹腔注射大(0.4mg/kg)、中(0.2mg/kg)、小(0.1mg/kg)剂量的triptolide和替莫唑胺(20mg/kg)。隔天一次,共注射7次。给药后第14天取材,通过核磁计算肿瘤的体积,用westernblotting、免疫荧光和免疫组化检测自噬、凋亡相关蛋白和相关通路蛋白的表达。实验结果:结果显示,triptolide可以抑制体内脑胶质瘤细胞的生长(图21),可以引起凋亡和自噬相关指标的变化,引起凋亡和自噬的发生,jnk的磷酸化水平升高,akt和mtor的磷酸化水平降低(图22和图23)。表明triptolide可以引起脑胶质瘤细胞的自噬,主要是通过活化jnk信号通路,抑制akt/mtor信号通路实现的。与体外实验结果相符。实施例11雷同藤甲素与saha协同治疗脑胶质瘤基于实施例1-10的发现,雷公藤甲素具有通过促进ros/jnk和抑制akt/mtor信号通路实现其对凋亡和自噬的作用;进一步地,雷公藤甲素对人胶质瘤细胞系u251和u87均具有明显的诱导凋亡作用;因此我们进一步地考察了雷公藤甲素与本领域已知的胶质瘤药物的联合用药。基于细胞机制实验的研究结果,我们采用雷公藤甲素0.2ug/ml作为基础浓度进行联合用药研究。实验方法:将u251细胞消化,离心并重悬浮于相应培养液中,以1x105/孔的密度种植于96孔板中,置于37℃,5%co2培养箱中过夜培养。第二天,将细胞分组,第一组移除原培养基,加入新鲜配置的作为对照组,其他各组添加含有不同浓度药物的培养基继续培养24h。各组给药浓度如下:细胞终止培养后,收集细胞,采用mtt法测定各组细胞活性并计算抑制率(抑制率=(对照组od值-给药组od值)/对照组od值×100%)。协同作用计算方法:采用金正均q值法进行判定(参见非专利文献:戴体俊.合并用药的定量分析[j].中国药理学通报,1998(5):479-480.),q值由以下的公式求得:q=pa+b/(pa+pb-pa×pb)。式中pa、pb和pa+b分别为a药组、b药组和两药联用组治疗率。q<1说明两药合用后产生拮抗作用;q>1,说明两药合用后产生协同作用,q=1说明两药合用后产生相加作用。实验结果:抑制率(%)q值组141.3±2.9-组21.2±0.6-组36.9±1.8-组429.7±3.1-组548.4±3.5-组642.7±3.31.02组766.8±4.11.48组884.3±3.71.43组988.1±4.21.26从上述结果可以看出,雷公藤甲素与伏立诺他比例在1:0.1时两者仅是表现简单的相加作用,而比例在1:1-100时表现为明显协同抑制作用,其中以1:1和1:10效果最佳。提示雷公藤甲素与伏立诺他联合用药在治疗脑胶质瘤方面产生了明显的协同作用,最佳比例在1:1-10之间。类似的结果在u87细胞系上,我们同样观察到了类似的结果。另外,我们采用同样的方法在u251细胞系上考察了雷公藤甲素与替莫唑胺、氯乙基亚硝基脲、依托泊苷、长春新碱或贝伐单抗的联合用药效果,替莫唑胺、氯乙基亚硝基脲、依托泊苷、贝伐单抗和长春新碱均未发现与雷公藤甲素产生协同作用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1