一种基于脱细胞真皮基质的生物海绵及其制备方法与流程
本发明涉及生物材料技术领域,更具体的说是涉及一种基于脱细胞真皮基质的生物海绵及其制备方法。
背景技术:
烧伤、创伤、糖尿病、慢性溃疡等常导致皮肤的缺损。难治性、慢性创伤及组织缺损导致的疼痛、生理功能缺失、容貌的改变严重影响着病人的行动自由和生活质量,并进一步导致心理和社会问题。皮肤移植作为组织缺损及皮肤色素性疾病最有效的治疗手段,在临床中却受到来源的限制而影响治疗进程。组织工程皮肤则是最具潜力的治疗方法。目前的组织工程皮肤支架材料主要有化学合成类材料如:聚乳酸(pla)、聚左乳酸(plla)等。材料性质稳定、结构均一、机械性能良好,但生物相容性较差。脱细胞真皮基质(acellulardermalmatrix,adm)作为一种天然细胞外基质材料,具备良好的机械特性、组织相容性和较低的免疫原性,是用于组织修复重建的良好基质,也是组织工程研究常用的天然支架材料,已经广泛用作皮肤及软组织创面修复材料。目前将真皮基质脱细胞的方法多采用酶解法、化学试剂洗脱法等,这些方法均存在脱细胞试剂不能彻底去除导致获得的脱细胞真皮基质细胞毒性、遗传毒性大等问题。
将天然的材料脱去细胞后,在经一定的交联剂处理使其具备良好的机械特性、良好的三维结构、较好组织相容性和较低的免疫原性,是组织组织工程研究常用的方法。但是目前这些方法存在一定的问题:目前的交联剂大多为戊二醛等试剂,这些试剂本身还会对环境造成污染,后续处理增加成本;最重要的是试剂的残留会造成严重的细胞毒性,极大地影响临床使用。
因此,提供一种基于脱细胞真皮基质的生物海绵,作为组织工程支架材料,用于皮肤缺损的修复和制备组织工程皮肤,是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种基于脱细胞真皮基质的生物海绵及其制备方法,制备得到的生物海绵具有良好的生物相容性,同时生物安全性好且有利于支持细胞的生长。
为了实现上述目的,本发明采用如下技术方案:
一种基于脱细胞真皮基质的生物海绵,所述生物海绵以脱细胞真皮基质为原材料,利用ca2+和fa-peg进行交联。
一种基于脱细胞真皮基质的生物海绵的制备方法,具体步骤如下:
(1)制备脱细胞真皮基质:
①取储存的人源皮肤,清除皮下附带脂肪成分;
②步骤①清除皮下附带脂肪成分的皮肤用碘伏及酒精清洗消毒,后用低渗溶液反复浸泡清洗皮肤;
③将步骤②清洗后的皮肤用2.5mg/mldispaseii溶液处理过夜;弃去dispaseii溶液,去除表皮,后用生理盐水清洗,获得真皮;
④将步骤③获得的真皮用含有ca2+的高渗盐溶液处理12-24h;弃去高渗盐溶液后,用生理盐水清洗;
⑤将步骤④清洗后的真皮置于配制好的“脱细胞液”中,在“透析装置”中处理2h-6h,获得脱细胞真皮基质;
⑥用生理盐水清洗3次,每次15min,得到人源的脱细胞真皮基质;
(2)胃蛋白酶酶解:向步骤(1)获得的脱细胞真皮基质中加入1%-5%的胃蛋白酶溶液,室温下搅拌酶解12-15h;
(3)清洗:将步骤(2)酶解后的脱细胞真皮基质过滤取沉淀,将沉淀用生理盐水清洗;
(4)冻干:将步骤(3)清洗后的脱细胞真皮基质沉淀在冻干机中冻干12-15h;
(5)粉碎:将步骤(4)冻干后的脱细胞真皮基质沉淀用超微粉碎机粉碎3-5min,获得脱细胞真皮基质粉末;
(6)交联:
在步骤(5)获得的脱细胞真皮基质粉末中加入蒸馏水,使其形成浓度为0.01g/ml-0.5g/ml的溶液,随后加入交联液,充分混合;将混合后的溶液在-20℃条件下冷冻12-24h,冻干即获得生物海绵。
交联液为将一定量的ca2+和fa-peg(four-armpolyethyleneglycolwithsuccinimydilglutarateterminatedbranches)充分溶解于dpbs(dulbecco'sphosphatebufferedsaline)缓冲液中,ca2+浓度为50-200μm/l,fa-peg浓度为0.01g/ml-0.5g/ml。
进一步,步骤(1)制备脱细胞真皮基质:②步骤①清除皮下附带脂肪成分的皮肤,用2%碘伏清洗消毒,用75%酒精脱碘,再用无菌蒸馏水反复浸泡清洗皮肤。
进一步,步骤(1)制备脱细胞真皮基质:④将步骤③获得的真皮用0.5-3mol/l含有ca2+的高渗盐溶液处理12-24h,ca2+的终浓度为1-10mm/l。
进一步,步骤(1)制备脱细胞真皮基质:步骤④所述高渗盐溶液为0.5-3mol/l含有ca2+的的氯化钠溶液,ca2+的终浓度为1-10mm/l。
进一步,步骤(1)制备脱细胞真皮基质:步骤⑤所述的“脱细胞液”包含以下组分:0.1%-0.5wt%胰酶,0.5-5mmedta,0.1%-0.5wt%tritonx-100,na+0.1-0.5mol/l,cl-0.1-0.5mol/l,ca2+1-10mmol/l;ca2+来自ca(no3)2,no3-2-20mmol/l。
进一步,步骤(1)制备脱细胞真皮基质:步骤⑤所述的“脱细胞液”包含以下组分:0.1%-0.5wt%胰酶,0.5-5mmedta,0.1%-0.5wt%tritonx-100,na+0.1-0.5mol/l,cl-0.1-0.6mol/l,ca2+1-10mmol/l;ca2+来自cacl2。
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种基于脱细胞真皮基质的生物海绵及其制备方法,本发明的新型生物海绵来源于同种异体皮肤组织,结构与人体皮肤一致,其经脱细胞处理后免疫免疫排斥反应极小;
本发明利用新型的“脱细胞液”,包含有ca2+、去污剂、nacl等成分,在脱去细胞的同时最大程度保持真皮结构不变化;交联液中也含有ca2+,ca2+作为一种细胞培养必须离子,在合适浓度下不仅能够稳定脱细胞真皮基质的结构,还能在改建脱细胞真皮基质成3d支架材料时具有增强材料的机械、理化性能、生物相容性、止血性能等作用;
本发明创新性的引入“透析装置”,在脱细胞的同时将有害的脱细胞试剂去除,保证产品的低细胞毒性、低遗传毒性,高生物相容性;
本发明利用无毒的新型“交联液”进行交联处理,保证了获得的产品的生物安全性;ca2+、聚乙二醇无毒、无刺激性,具有良好的水溶性,将其按一定比例配制成“交联液”,对脱细胞真皮基质进行交联改性,使其具备疏松的三维空间结构,提高其机械、理化性能、生物相容性等,从而应用到组织工程皮肤中;
本发明制备的生物海绵为多孔结构,孔隙之间相互连通,具有与人体皮肤组织相似的三维结构,能使机体组织细胞迅速生长;且其具有良好的可塑形性,可根据需要制备成不同规格(厚度、大小皆可控)满足需要;
本发明的生物海绵是一种先进的组织工程支架材料,含有丰富的生长因子,具有良好的生物相容性,更有利于支持细胞的生长;不仅能够用于创面修复,也是优良的组织工程皮肤支架材料,可用于皮肤缺损的修复及制备组织工程皮肤。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
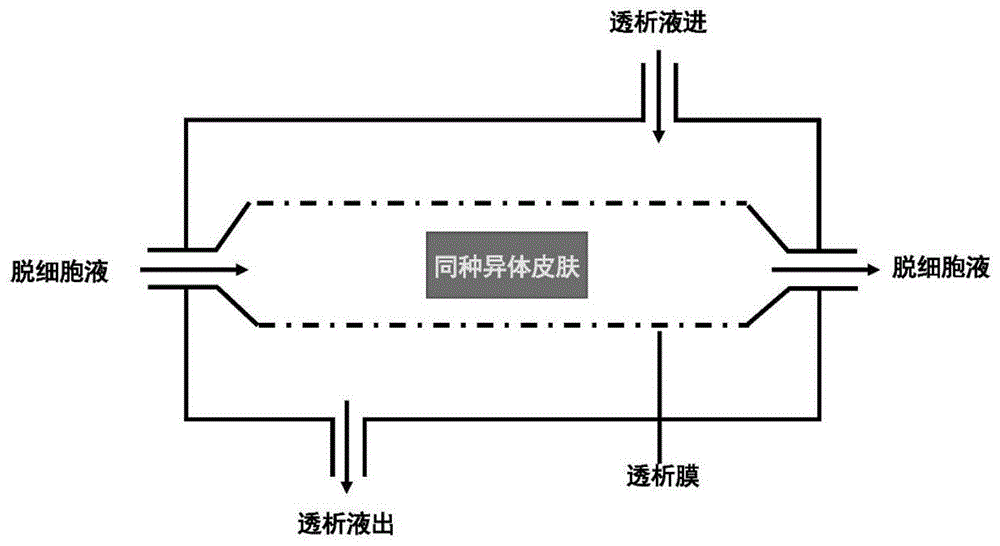
图1附图为本发明的透析装置示意图;
图2附图为本发明获得的脱细胞真皮基质的照片;
图3附图为本发明脱细胞真皮基质内部结构的电镜照片;
图4附图为本发明正常皮肤组织he染色结果;
图5附图为本发明脱细胞真皮基质he染色结果;
图6附图为本发明未使用脱细胞液、未采用透析装置制备的脱细胞真皮基质he染色图;
图7附图为本发明制备得到的生物海绵的扫描电镜图;
图8附图为本发明的生物海绵移植于皮肤创面促进创面愈合图;
图9附图为本发明的生物海绵移植于皮肤创面促进创面愈合he染色结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种人源的脱细胞真皮基质的制备方法,具体步骤如下:
(1)制备脱细胞真皮基质:
①取储存的人源皮肤,清除皮下附带脂肪成分;
②步骤①清除皮下附带脂肪成分的皮肤用碘伏及酒精清洗消毒,后用低渗溶液反复浸泡清洗皮肤;
③将步骤②清洗后的皮肤用2.5mg/mldispaseii溶液处理过夜;弃去dispaseii溶液,去除表皮,后用生理盐水清洗,获得真皮;
④将步骤③获得的真皮用2mol/l含有ca2+的氯化钠溶液处理18h,ca2+的终浓度为5mm/l;弃去氯化钠溶液后,用生理盐水清洗;
⑤将步骤④清洗后的真皮置于配制好的“脱细胞液”中,“脱细胞液”包含以下组分:0.1%-0.5wt%胰酶,0.5-5mmedta,0.1%-0.5wt%tritonx-100,na+0.1-0.5mol/l,cl-0.1-0.5mol/l,ca2+1-10mmol/l;ca2+来自ca(no3)2,no3-2-20mmol/l;在“透析装置”中处理2h-6h,获得脱细胞真皮基质;透析装置示意图如图1所示;
⑥用生理盐水清洗3次,每次15min,得到人源的脱细胞真皮基质,如图2所示;
透析装置:将同种异体皮肤置于透析袋中,脱细胞液从一端进入,从装置另一端流出,在脱细胞的同时将脱细胞液中“有害”离子透析除去,在保证脱细胞效果的同时最大程度降低脱细胞真皮基质的细胞毒性和遗传毒性,有效地提高生物相容性。
实施例2
脱细胞真皮基质的内部结构
(1)将上述获得的脱细胞真皮基质剪切为1cm×1cm大小,粘帖在金属托盘上;断面脱细胞真皮基质采用液氮骤冷的方法使其变硬变脆,再折断;断面朝上粘帖在金属托盘上。
(2)电镜样品准备间喷金后上机,扫描电镜观察并照相,结果如图3所示。
结果可见组织内无细胞残留,且胶原结构完整,与正常皮肤相似。
实施例3脱细胞真皮基质he染色
(1)分别将正常皮肤组织和脱细胞真皮基质分别置于4%的多聚甲醛固定液中固定24h;
(2)酒精脱水、二甲苯透明;
(3)浸蜡30min,包埋,制作5μm厚矢状位石蜡切片;
(4)梯度酒精进行脱蜡,脱水,he染色;
(5)透明,封片,光镜观察,正常皮肤组织he染色结果如图4所示,脱细胞真皮基质he染色结果如图5所示。
结果可见皮肤组织内无细胞残留。
实施例4
一种人源的脱细胞真皮基质的制备方法,具体步骤如下:
(1)取储存的人源皮肤;
(2)清除皮下附带脂肪成分;
(3)将步骤(2)清除皮下附带脂肪成分的皮肤,用2%碘伏清洗消毒,用75%酒精脱碘,再用无菌蒸馏水反复浸泡清洗皮肤;
(4)将步骤(3)清洗后的皮肤用2.5mg/mldispaseii溶液处理过夜;
(5)弃去dispaseii溶液,去除表皮,后用生理盐水清洗,获得真皮;
(6)将步骤(5)获得的真皮用2mol/l含有ca2+的氯化钠溶液处理18h,ca2+的终浓度为5mm/l;
(7)弃去氯化钠溶液后,用生理盐水清洗3次,每次15min,得到人源的脱细胞真皮基质,如图6所示。
实施例5
一种基于脱细胞真皮基质的生物海绵的制备方法,具体步骤如下:
(1)制备脱细胞真皮基质;
(2)胃蛋白酶酶解:向步骤(1)获得的脱细胞真皮基质中加入3%的胃蛋白酶溶液,室温下搅拌酶解12h;
(3)清洗:将步骤(2)酶解后的脱细胞真皮基质过滤取沉淀,将沉淀用生理盐水清洗;
(4)冻干:将步骤(3)清洗后的脱细胞真皮基质沉淀在冻干机中冻干15h;
(5)粉碎:将步骤(4)冻干后的脱细胞真皮基质沉淀用超微粉碎机粉碎5min,获得脱细胞真皮基质粉末;
(6)交联:
在步骤(5)获得的脱细胞真皮基质粉末中加入蒸馏水,使其形成浓度为0.3g/ml的溶液,随后加入交联液,充分混合;将混合后的溶液在-20℃条件下冷冻18h,冻干即获得adm生物海绵。
实施例6
电镜观察生物海绵:
1)取材,取直径为1cm,厚度为1mm的生物海绵,置于电镜固定液中固定2h;
2)乙醇脱水,按30%、50%、70%、80%、90%的乙醇浓度梯度脱水1次,5min/次,100%乙醇脱水2次,5min/次;
3)叔丁醇温水水浴至冰晶溶解,用无水乙醇配制50%、70%、90%、95%浓度梯度的叔丁醇,按浓度梯度由低到高置换乙醇各1次,100%叔丁醇3次,10min/次;
4)将样品平铺在培养皿中,自然晾干后置于密封袋中4℃保存待用;
5)将干燥样品放于铜网上,喷金;
把样品固定于样品托上,扫描电镜观察并拍照,结果如图7所示;结果显示:adm生物海绵的结构较为规则,孔径大小均一,彼此相互通联;获得了具有输送孔径结构的三维生物海绵。
实施例7
(1)用打孔器制造直径为1cm的全层皮肤缺损裸鼠动物模型,模拟皮肤缺损;
(2)制造全层皮肤缺损后设置control(对照组,此组创面仅进行包扎,不覆盖材料)和设置adm生物海绵组(此组创面覆盖adm生物海绵,后进行包扎)。
结果如图8所示,adm生物海绵移植后3d,control组创面仍有暴露,渗出明显,且创面面积较初始有增大;而adm生物海绵组:未见创面暴露,无渗出。adm生物海绵移植后7d,control组创面仍有暴露,少许渗出,创面面积有所缩小;adm生物海绵组:创面结痂,无渗出,创面面积较初始缩小明显。adm生物海绵移植后14d,control组创面面积缩小,但仍未完全愈合;adm生物海绵组:创面基本愈合。结果表明,adm生物海绵能够促进创面愈合。
adm生物海绵移植于皮肤创面促进创面愈合he结果如图9所示,与control组相比,adm生物海绵创面愈合效果更好。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!