肠道细菌在制备用于促进TCRγδ+T细胞增殖的药物中的应用的制作方法
本发明属于免疫学领域,本发明涉及肠道细菌组合在制备用于促进tcrγδ+t细胞增殖的药物中的应用、和/或在制备用于促进cd8阳性杀伤性t淋巴细胞积累的药物中的应用、和/或在制备用于预防和/或治疗肿瘤的药物中的应用,以及用于促进tcrγδ+t细胞增殖、和/或用于促进cd8阳性杀伤性t淋巴细胞积累、和/或用于预防和/或治疗肿瘤的组合物。
背景技术:
恶性肿瘤已经成为威胁人类健康和生命安全的严重问题。最新世界卫生组织(worldhealthorganization,who)全球统计数据显示,2018年新发癌症病例高达181万人,约有96万人死于癌症,是世界范围内主要死因,发病率和死亡率都呈快速增长趋势。2018年世界范围内肝癌患者死亡率高居第五位,死亡人数62.7万人,占所有癌症死亡人数8.2%。传统的治疗手段包括手术、化学治疗、放射治疗、中医药治疗等,临床应用广泛且疗效确切,但是对病人生活质量都有不同程度的影响,尤其是大部分肝癌等肿瘤发现时为晚期,不具备根治手术条件,因此,亟需研发更多、更为安全有效的治疗手段。
自2013年science(《科学》)杂志将肿瘤免疫治疗列为年度科学研究重大突破之首以来,肿瘤生物免疫治疗迅速发展。肿瘤免疫治疗主要是指增强机体免疫系统活性,解除免疫抑制,进而抗肿瘤。但大部分患者治疗效果欠佳,肿瘤微环境中cd8阳性杀伤性t淋巴细胞数量不足,不能进行有效的免疫应答响应。因此,急需寻找有效调节机体免疫系统功能的免疫治疗方法。t细胞根据t细胞表面受体的不同,可分为αβt细胞和γδτ细胞。γδτ细胞表面受体由γ链和δ链两种糖蛋白链组成,γδτ细胞的一个重要生物学特性是可直接识别蛋白质、肽类和非肽类抗原,不需要经细胞表面组织相容性抗原分子提呈。γδτ细胞主要分布在皮肤和粘膜组织,例如消化道、呼吸道、生殖系统等,目前有研究发现γδτ细胞可通过细胞毒性或通过刺激和调节其他免疫细胞如树突状细胞或cd8阳性t细胞的生物学功能间接发挥许多恶性肿瘤的抗肿瘤免疫应答。但是,在肿瘤中尚未发现另枝菌等10种肠道细菌是否能够促进cd8阳性杀伤性t淋巴细胞和/或γδτ细胞(tcrγδ+t细胞)的高效积累增殖。
人体的肠道细菌群对机体具有重要的调节作用,在疾病的发生发展过程中扮演着重要的角色。人体肠道中生存着数百万种细菌,以厌氧菌为主。目前研究表明肠道细菌可以发挥强大的抗肿瘤作用,刺激机体免疫活性,消除肿瘤细胞免疫抑制。另枝菌是一种革兰阴性、严格厌氧的杆状细菌。真杆菌是一种运动可变、不产芽孢、严格厌氧的革兰氏阴性菌,发酵葡萄糖或蛋白胨的主要产物通常包括大量的丁酸、乙酸或甲酸,发现于动物的腔体、粪便、动物和植物产品和土壤中。瘤胃球菌是梭菌属中的一类细菌,斯特氏厌氧菌是一种革兰氏阳性、严格厌氧、无芽孢、杆状细菌。普雷沃氏菌(prevotellacopri)是一种革兰阴性厌氧菌,是人体肠道共生菌,目前研究发现它与类风湿性关节炎的易感性有关,和糖尿病患者胰岛素抵抗有一定的相关性。
技术实现要素:
本发明的目的是提供一种能够有效促进tcrγδ+t细胞增殖,从而促进cd8阳性杀伤性t淋巴细胞积累,从而预防和/或治疗肿瘤的技术方案。
为此,本发明提供了另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌在制备用于促进tcrγδ+t细胞(或简称:γδ简称细胞)增殖的药物中的应用。
优选地,所述肠道细菌是以下中的任意一种或多种:肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的肠道细菌及肠道细菌裂解物;和/或肠道细菌培养上清液。
优选地,所述tcrγδ+t细胞增殖增多的特征包括:盲肠细胞中tcrγδ+t细胞数量相对增加。
相应的,本发明还提供了一种用于促进tcrγδ+t细胞增殖的组合物,其包括另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌作为活性成分。
优选地,所述肠道细菌是以下中的任意一种或多种:肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的肠道细菌及肠道细菌裂解物;和/或肠道细菌培养上清液。
在本发明的另一方面,提供了另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌在制备用于cd8阳性杀伤性t淋巴细胞积累的药物中的应用。
优选地,所述肠道细菌是以下中的任意一种或多种:肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的肠道细菌及肠道细菌裂解物;和/或肠道细菌培养上清液。
优选地,所述cd8阳性杀伤性t淋巴细胞积累的特征包括:肿瘤微环境中的所有细胞中的cd8阳性杀伤性t淋巴细胞的数量相对增加。
相应地,本发明还提供了一种用于促进cd8阳性杀伤性t淋巴细胞积累的组合物,其包括另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌作为活性成分。
优选地,所述肠道细菌是以下中的任意一种或多种:肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的肠道细菌及肠道细菌裂解物;和/或肠道细菌培养上清液。
本发明的发明人发现,在肿瘤中通过另枝菌等10种肠道细菌促进cd8阳性杀伤性t淋巴细胞积累和/或tcrγδ+t细胞增殖来调控t细胞免疫应答是可能的。具体而言,本发明人发现在肿瘤中包含10种肠道细菌任意一种或多种或由其获得的生理活性物质及组合物可以促进肿瘤微环境中盲肠中tcrγδ+t细胞增殖和/或cd8阳性杀伤性t淋巴细胞积累进而增强所述t细胞的抗肿瘤作用,从而实现本发明的目的。该抗肿瘤的机制是通过增强抗肿瘤免疫细胞亚群的功能而实现的。
具体地,所述cd8阳性杀伤性t淋巴细胞是以cd8+为cd8t细胞的表型特征,tcrγδ+t细胞是以tcrγδ+(或又称:γδτcr+)为γδτ细胞的表型特征。
由此,在本发明的另一方面,还提供了另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌在制备用于预防和/或治疗肿瘤的药物中的应用。
优选地,所述肠道细菌是以下中的任意一种或多种:肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的肠道细菌及肠道细菌裂解物;和/或肠道细菌培养上清液。
优选地,所述肿瘤为实体瘤。
相应地,本发明还提供了一种用于预防和/或治疗肿瘤的组合物,其包括另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌作为活性成分。
优选地,所述肠道细菌是以下中的任意一种或多种:肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的肠道细菌及肠道细菌裂解物;和/或肠道细菌培养上清液。
更优选地,所述组合物包括但不限于药物组合物、食品、保健品或食品添加剂中的任意一种。
在本发明的另一个方面,还提供了用于促进tcrγδ+t细胞增殖、和/或促进cd8阳性杀伤性t淋巴细胞积累、和/或预防和/或治疗肿瘤的方法。
具体地,本发明提供了在个体(如有相应需要的个体,诸如需要诱导cd8阳性杀伤性t淋巴细胞积累和/或tcrγδ+t细胞增殖和/或预防和/或治疗肿瘤的个体)中诱导tcrγδ+t细胞增殖、和/或cd8阳性杀伤性t淋巴细胞积累、和/或预防和/或治疗肿瘤的方法,所述方法包括向个体施用组合物,所述组合物包括另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌作为活性成分。
更具体地,所述方法包括如下步骤:
(1)向个体施用组合物,所述组合物包括另枝菌(alistipesshahii)或细枝真杆菌(eubacteriumramulus)或惰性真杆菌(eubacteriumsiraeum)或栖瘤胃普雷沃氏菌(prevotellaruminicola)或乳酸瘤胃球菌(ruminococculactaris)或斯特氏厌氧菌(anaerofustisstercorihominis)或系结梭菌(clostridiumnexile)或拟血杆菌(sanguibacteroidesjustesenii)或多氏菌(doreaformicigenerans)或世纪双歧杆菌(bifidobacteriumsaeculare)中的一种或多种肠道细菌作为活性成分;
(2)诱导cd8阳性杀伤性t淋巴细胞积累和/或tcrγδ+t细胞增殖:施用所述组合物当日按第0天计算,每隔3天施用所述组合物诱导,10天后移植肿瘤,并持续施用所述组合物,检测个体体内cd8阳性t细胞和tcrγδ+t细胞的含量;
(3)cd8t细胞和tcrγδ+t细胞含量的检测:采用流式细胞术,以tcrγδ、cd8作为分子标记,以cd8+为cd8阳性t细胞的表型特征,tcrγδ+为tcrγδ+t细胞的表型特征,检测cd8t细胞和tcrγδ+t细胞在培养细胞中所占的比例。
根据所述的方法,其中对cd8+的测量用作所述个体中cd8阳性杀伤性t细胞的增殖或积累的指标,对tcrγδ+的测量用作所述个体中tcrγδ+t细胞的增殖或积累的指标。
本发明的组合物含有上述10种肠道细菌中的任意一种或多种作为活性成分,是诱导cd8阳性杀伤性t淋巴细胞和/或tcrγδ+t细胞的积累、增殖的极佳组合物。可通过施用作为药物产品的本发明的组合物或作为食品或饮料摄取所述组合物来增强活生物体中的免疫性。因此、本发明的组合物可用于例如预防或治疗感染性疾病、自身免疫性疾病或变应性疾病等。另外,如果食品或饮料诸如健康食品包含本发明的组合物,则健康个体可容易和常规地摄取所述组合物。由此,可能诱导cd8阳性杀伤性t淋巴细胞和/或tcrγδ+t细胞的积累、增殖并从而提高免疫功能。
附图说明
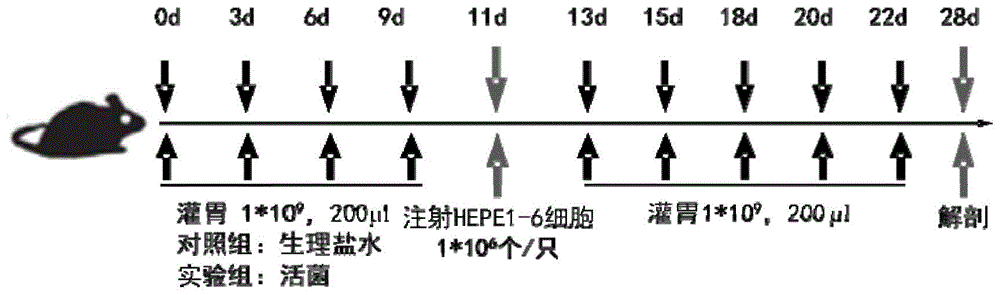
图1为小鼠肝癌模型中10种肠道细菌促进cd8阳性t细胞和/或tcrγδ+t细胞增殖并治疗肿瘤的实验流程示意图。施用肠道细菌或移植肿瘤细胞的时间用天(day,d)表示。
图2为肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)治疗后每组3只典型的小鼠肝癌细胞移植瘤肿瘤大小的统计分析图。
图3为肝癌细胞移植的小鼠肝肿瘤中施用肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)后,每组一只小鼠的典型的cd8阳性t淋巴细胞的流式细胞分析图,右下象限为cd8阳性t淋巴细胞,右下侧象限的数字显示的为cd8阳性t淋巴细胞占盲肠总体细胞的百分比。
图4为肝癌细胞移植的小鼠中施用肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)后cd8阳性t淋巴细胞占盲肠总体细胞的百分比的统计分析图
图5为肝癌细胞移植的小鼠肝肿瘤中施用肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)后,每组一只小鼠的典型的tcrγδ阳性t淋巴细胞的流式细胞分析图,右下象限为tcrγδ阳性t淋巴细胞,右下侧象限的数字显示的为tcrγδ阳性t淋巴细胞占盲肠总体细胞的百分比。
图6为肝癌细胞移植的小鼠中施用肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)后tcrγδ阳性t淋巴细胞占盲肠总体细胞的百分比的统计分析图
图7为肝癌细胞移植的小鼠种施用10种肠道细菌后的肿瘤抑瘤率,肿瘤cd8阳性t细胞和盲肠tcrγδ阳性t淋巴细胞增多百分比统计表格。
具体实施方式
下面将结合具体实施例对本发明作进一步说明。需要指出的是,由本发明中的用于促进cd8阳性杀伤性t淋巴细胞的积累和/或tcrγδ+t细胞的增殖的另枝菌等10种肠道细菌或含有本发明的另枝菌等10种肠道细菌的药物组合物、食品、保健品和食品添加剂在施用于受试者后,都可以应用于上文所述的适应症并展现出上文所述的功能,在本发明范围内的所有剂型均已测试,下文中,仅仅是为说明,只在实施例中描述了其中一少部分,然而不应将其理解为对本发明的限制。
本发明提供促进cd8阳性杀伤性t淋巴细胞的积累和/或tcrγδ+t细胞的增殖的10种肠道细菌的任意一种或多种组合物,所述组合物包含以下至少一种物质作为活性成分:10种肠道细菌活菌体;经基因重组、改造或修饰、减毒、化学处理、物理处理或灭活的10种肠道细菌;10种肠道细菌裂解物;和/或10种肠道细菌培养上清液。
对作为本发明的组合物的活性成分的“另枝菌等10种肠道细菌任意一种或多种”,没有特别限制,只要该细菌具有促进cd8阳性杀伤性t淋巴细胞积累和/或tcrγδ+t细胞的增殖即可。另枝菌等10种肠道细菌可以单独用于本发明的组合物,也可组合使用除此以外的其他细菌。
本发明中,“cd8阳性t细胞”意指在参与免疫应答的淋巴细胞中的表达cd8的t细胞,“γδt细胞”意指在参与免疫应答的淋巴细胞中的表达tcrγ和/或δ链的t细胞。
以下将通过实施例进一步具体描述本发明,但本发明并非仅限于下述实施例的范围。
实施例1:肠道细菌培养
1、另枝菌(alistipesshahii)培养方法
步骤1:取一支冻干保存另枝菌(alistipesshahii)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37摄氏度厌氧培养12h;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
2、细枝真杆菌(eubacteriumramulus)和惰性真杆菌(eubacteriumsiraeum)培养方法
步骤1:取一支冻干保存真杆菌(eubacteriumramulus,eubacteriumsiraeum)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
3、栖瘤胃普雷沃氏菌(prevotellaruminicola)培养方法
步骤1:取一支冻干保存栖瘤胃普雷沃氏菌(prevotellaruminicola)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
4、乳酸瘤胃球菌(ruminococculactaris)培养方法
步骤1:取一支冻干保存乳酸瘤胃球菌(ruminococcuslactaris)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
5、斯特氏厌氧菌(anaerofustisstercorihominis)培养方法
步骤1:取一支冻干保存斯特氏厌氧菌(anaerofustisstercorihominis)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
6、系结梭菌(clostridiumnexile)培养方法
步骤1:取一支冻干保存系结梭菌(clostridiumnexile)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
7、拟血杆菌(sanguibacteroidesjustesenii)培养方法
步骤1:取一支冻干保存拟血杆菌(sanguibacteroidesjustesenii)菌种(购自atcc),加入200μltsa培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mltsa培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mltsa培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
8、多氏菌(doreaformicigenerans)培养方法
步骤1:取一支冻干保存多氏菌(doreaformicigenerans)菌种(购自atcc),加入200μlrgca培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mlrgca培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mlrgca培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
9、世纪双歧杆菌(bifidobacteriumsaeculare)培养方法
步骤1:取一支冻干保存世纪双歧杆菌(bifidobacteriumsaeculare)菌种(购自atcc),加入200μloxoidcm149培养基,复溶,吸取20μl,血平板划线,厌氧罐气体控制系统抽气后在生化培养箱中37℃、厌氧培养48小时;
步骤2:挑取单克隆菌落接入10mloxoidcm149培养基,37℃厌氧培养12小时;
步骤3:取1瓶500mloxoidcm149培养基,接入1%(v/v)菌种,37℃、厌氧培养48小时;
步骤4:取菌液离心,6000rpm、10min。用生理盐水洗涤2次,最后用生理盐水复溶菌泥备用并进行活菌计数。
实施例二:以上肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)诱导肝肿瘤移植小鼠中γδtcr表达、γδt淋巴细胞增殖增多及治疗肿瘤的实验
1、培养方法
另枝菌培养方法同实施例一。
2、样品准备
样品准备方法同实施例一。
3、另枝菌诱导肝肿瘤移植小鼠中的γδt淋巴表达增多的实验
图1为在肿瘤中检测另枝菌增强γδt淋巴细胞的增殖增多实验流程示意图。
实验动物:c57bl/6小鼠3~4周18只,精神状态良好,购自中山大学实验动物中心。将小鼠随机分成2组,每组9只,2组分别为对照组、活菌灌胃组,对2组小鼠分别灌胃109cfu的另枝菌活菌及生理盐水对照,连续灌胃2周。随后待小鼠肝肿瘤移植细胞hep1-6生长到对数期,用te消化细胞,培养基中和,离心收集细胞,并用dpbs洗涤两次,除去残留血清,用dpbs重悬细胞。灌胃1周左右后,将肝肿瘤移植细胞hep1-6细胞计数,按106个细胞右腋皮下接种到每只小鼠。并持续对小鼠分别进行灌胃治疗,2周后处死荷瘤小鼠,统计记录肿瘤大小,分别收集细胞,利用流式细胞术检测分析盲肠中γδt细胞的含量。
实施例三:流式细胞术检测cd8阳性τ细胞含量
(1)收集肿瘤细胞置于流式管中,每管107个,用pbs缓冲液洗两次,1500rpm离心5分钟,弃上清后用400微升pbs缓冲液重悬细胞;
(2)加入anti-cd8-fitc单抗,混匀后4℃避光解育30分钟;
(3)用pbs缓冲液洗两次,1500rpm离心5分钟,弃上清后加入400微升pbs缓冲液重悬细胞;
(4)单细胞悬液在流式细胞仪上机检测,cd8阳性作为cd8阳性τ细胞的表型特征。
实施例四:流式细胞术检测γδτ细胞含量
(1)收集盲肠细胞置于流式管中,每管107个,用pbs缓冲液洗两次,1500rpm离心5分钟,弃上清后用400微升pbs缓冲液重悬细胞;
(2)加入anti-tcrγδ-fitc单抗,混匀后4℃避光解育30分钟;
(3)用pbs缓冲液洗两次,1500rpm离心5分钟,弃上清后加入400微升pbs缓冲液重悬细胞;
(4)单细胞悬液在流式细胞仪上机检测,tcrγδ阳性作为γδτ细胞的表型特征。
结果分析
肝癌细胞移植瘤小鼠施用肠道细菌治疗肿瘤的实验流程如图1所示,以另枝菌(alistipesshahii)为例,但不限于另枝菌(alistipesshahii)。
图2为施用另枝菌(alistipesshahii)后肝癌细胞移植瘤的大小体积统计分析结果,以另枝菌(alistipesshahii)为例,但不限于另枝菌(alistipesshahii)。
由图2的实验结果可以明确地观察到,施用另枝菌(alistipesshahii)后,相较生理盐水对照组,肝癌细胞移植瘤体积大幅度减小约63%,而且减小具有统计学显著性差异(p<0.001)。由此可以得出,通过施用另枝菌(alistipesshahii)治疗小鼠可显著抑制肿瘤的生长。在其他实施例中,施用上述其他9种肠道细菌均可观察到移植瘤体积显著减小,且减小具有统计学差异(p<0.005~0.05)。
在其他实施案例中(实验步骤和实验条件相同),细枝真杆菌(eubacteriumramulus)抑瘤率≈45~60%、惰性真杆菌(eubacteriumsiraeum)抑瘤率≈30~65%、栖瘤胃普雷沃氏菌(prevotellaruminicola)抑瘤率≈40~50%、乳酸瘤胃球菌(ruminococcuslactaris)抑瘤率≈50~60%、斯特氏厌氧菌(anaerofustisstercorihominis)抑瘤率≈45~65%、系结梭菌(clostridiumnexile)抑瘤率≈35~65%、拟血杆菌(sanguibacteroidesjustesenii)抑瘤率≈40~60%、多氏菌(doreaformicigenerans)抑瘤率≈50~75%、世纪双歧杆菌(bifidobacteriumsaeculare)抑瘤率≈35~80%,
由此可见,上述肠道细菌均有明显的抑制肿瘤生长的效果。
图3是肝癌细胞移植的小鼠肝肿瘤中施用肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)后,每组一只小鼠的典型的肝癌细胞移植瘤微环境中cd8阳性t淋巴细胞数量的流式细胞分析图,右下象限的数字显示的为cd8阳性t淋巴细胞占盲肠细胞的百分比情况图。流式分析及统计图以另枝菌(alistipesshahii)为例,但不限于另枝菌(alistipesshahii)。
从流式细胞分析图可以得出,相较生理盐水对照组,另枝菌组显著增加了肝肿瘤微环境中cd8+t淋巴细胞相对量约70%。
图4是肝癌细胞移植的小鼠中施用另枝菌(alistipesshahii)cd8+t淋巴细胞占肝癌细胞移植瘤微环境细胞的百分比的统计分析图,每组3只小鼠。
从统计图可以看出,相对比纯水对照组,另枝菌(alistipesshahii)增加了肿瘤微环境中cd8+t淋巴细胞的相对数量,而且增多具有统计学显著性差异(p<0.01)。
在其他9种肠道细菌种实施例中,对于cd8阳性t淋巴细胞数量增加百分比,细枝真杆菌(eubacteriumramulus)≈55%、惰性真杆菌(eubacteriumsiraeum)≈61%、栖瘤胃普雷沃氏菌(prevotellaruminicola)≈58%、乳酸瘤胃球菌(ruminococculactaris)≈59%、斯特氏厌氧菌(anaerofustisstercorihominis)≈55%、系结梭菌(clostridiumnexile)≈65%、拟血杆菌(sanguibacteroidesjustesenii)≈62%、多氏菌(doreaformicigenerans)≈49%、世纪双歧杆菌(bifidobacteriumsaeculare)≈50%,可见,以上肠道细菌均显著增加了肿瘤微环境中cd8+t淋巴细胞的相对数量,而且增多具有统计学显著性差异(p<0.001~0.05)。
图5是肝癌细胞移植的小鼠肝肿瘤中施用肠道细菌(以另枝菌alistipesshahii为例,但不仅限于另枝菌)后,每组一只小鼠的典型的盲肠中tcrγδ阳性t淋巴细胞数量的流式细胞分析图,右下象限的数字显示的为tcrγδ阳性t淋巴细胞占盲肠细胞的百分比情况图。
从流式细胞分析图可以得出,相较生理盐水对照组,另枝菌组显著增加了肝肿瘤微环境中tcrγδ+t淋巴细胞相对量约48%。
图6是肝癌细胞移植的小鼠中施用另枝菌后tcrγδ+t淋巴细胞占盲肠细胞的百分比的统计分析图,每组3只小鼠。
从统计图可以看出,相对比纯水对照组,另枝菌显著增加了盲肠中tcrγδ+t淋巴细胞的相对数量,而且增多具有统计学显著性差异(p<0.01)。流式分析及统计图以另枝菌(alistipesshahii)为例,但不限于另枝菌(alistipesshahii)。
在其他9种肠道细菌种实施例中,tcrγδ阳性t淋巴细胞数量增加百分比,细枝真杆菌(eubacteriumramulus)≈25%、惰性真杆菌(eubacteriumsiraeum)≈34%、、栖瘤胃普雷沃氏菌(prevotellaruminicola)≈26%、乳酸瘤胃球菌(ruminococculactaris)≈22%、斯特氏厌氧菌(anaerofustisstercorihominis)≈44%、系结梭菌(clostridiumnexile)≈52%、拟血杆菌(sanguibacteroidesjustesenii)≈33%、多氏菌(doreaformicigenerans)≈30%、世纪双歧杆菌(bifidobacteriumsaeculare)≈31%,可见,以上肠道细菌均显著增加了盲肠中tcrγδ+t淋巴细胞的相对数量,而且增多具有统计学显著性差异(p<0.001~0.05)。
上述结果的统计分析图中,*表示studentt-testp<0.05,**表示studentt-testp<0.01,***表示studentt-testp<0.001。p<0.05具有统计学差异意义。
综上所述,本发明所应用的10种肠道细菌具有显著的抑制肿瘤生长的作用,对小鼠肿瘤(肝癌细胞移植瘤)的形成以及生长有明显的抑制作用(图2)。由图3、图4、图5、图6、图7实验结果可见,活菌灌胃实验组相对生理盐水对照组,肿瘤微环境中cd8阳性杀伤性t细胞浸润显著增多,盲肠中tcrγδ+t淋巴细胞的积累增多,从而显著抑制肿瘤生长,对于防治肿瘤具有很好的效果。
以上内容是结合本发明创造的优选实施方式对所提供技术方案所作的进一步详细说明,不能认定本发明创造具体实施只局限于上述这些说明,对于本发明创造所属技术领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明创造的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!