虾头酶解物在制备治疗慢性低度炎症药物中的应用的制作方法
本发明属于生物制药技术领域。更具体地,涉及虾头酶解物在制备治疗慢性低度炎症药物中的应用。
背景技术:
辣椒是我国传统饮食中重要的调味品,部分敏感人群若食用了过量的辣椒会引起大便干燥、咽喉干痛、眼部红肿、口腔溃疡、面部长痘等“上火”症状。现有研究表明:“上火”与慢性低度炎症有着密切的联系,会造成炎症标志物水平的升高。其中的慢性低度炎症,也称亚临床炎症,一般无红、肿、热、痛等全身和局部症状,具有非特异性、持续性、低水平等特点,主要表现为血液循环中炎症标志物水平呈2~4倍升高,并持续较长时间,主要是机体受到外界刺激或饮食不当诱发的肠道菌群紊乱和内毒素入血造成的,属于非感染性炎症,明显区别于局部或全身性感染引起的炎症反应;也与一些慢性疾病,如肥胖、糖尿病、肠易激综合征、过敏、哮喘、自闭症、抑郁症、阿尔茨海默病、帕金森、甚至于衰老等的发生发展有直接的因果关系,已成为医学、健康及营养界关注的焦点。
目前,较少针对慢性低度炎症的治疗药物,仅有少数研究公开了一些化药在治疗慢性低度炎症中的应用。如中国专利申请cn111132678a公开了卵硫醇在治疗与糖尿病相关的慢性低度系统性炎症中的应用;中国专利申请cn104174021a公开了蛋白酶体抑制剂在制备治疗慢性低度炎症性疾病药物中的用途,但是上述药物均为化学制剂,具有明显的毒副作用,长期使用存在一定的安全隐患;常用的抗炎药如氢化可的松、地塞米松、阿司匹林,吡罗昔康等对局部和全身感染性炎症具有较好的疗效,但对由肠道菌群紊乱诱发的内毒素型慢性低度炎症效果不佳。
技术实现要素:
本发明要解决的技术问题是克服现有针对慢性低度炎症的治疗药物可选择的较少且存在一定的安全隐患,而常用的抗炎药物效果不佳的缺陷和不足,提供一种虾头酶解物在制备治疗慢性低度炎症药物中的应用。
本发明的目的是提供一种虾头酶解物在制备治疗慢性低度炎症药物中的应用。
本发明上述目的通过以下技术方案实现:
虾头作为虾加工产业的副产物,产量较大,但利用率偏低,开发其新功能,提高其附加值已成为虾头下脚料再利用亟待解决的课题。发明人在实践中发现,虾头酶解物中含有多种活性物质,其中活性肽占比较大,具有较好的抗氧化活性。通过实验证明,虾头酶解物可以降低机体促炎因子的表达,升高抑炎因子的表达,降低致炎因子内毒素的浓度,达到调节肠道菌群、治疗慢性低度炎症的效果。
因此,本发明提供了一种虾头酶解物在制备治疗慢性低度炎症药物中的应用。
进一步地,所述药物可以降低机体促炎因子的表达。
更进一步地,所述促炎因子包括il-1β、il-6和tnf-α。
进一步地,所述药物可以升高机体抑炎因子的表达。
更进一步地,所述抑炎因子为il-10。
进一步地,所述药物可以降低机体致炎因子内毒素的浓度。
更进一步地,所述药物可以调节肠道菌群结构恢复关键致炎菌群的正常丰度。
进一步地,所述调节肠道菌群结构恢复关键致炎菌群的正常丰度是指恢复肠道菌群多样性、升高被降低的厚壁菌门丰度、降低被升高的变形菌门丰度、降低嗜麦芽窄食单胞菌属和棒状杆菌属等有害风险菌丰度、增加阿洛巴氏菌属和乳杆菌属等有益菌的丰度。
更进一步地,所述虾头酶解物的制备方法为:
将虾头与虾体分离,虾头去壳、粉碎,加入质量体积比为1:(0.5~5)的水,调节ph为5.0~8.5,加入0.05~0.5wt%蛋白酶酶解,灭酶活,离心,取上清液冻干,即得。
进一步地,所述蛋白酶选自中性蛋白酶、胰蛋白酶、木瓜蛋白酶中的一种或几种,酶解条件为30~70℃酶解2~5h。
优选地,所述蛋白酶为中性蛋白酶,酶解条件为40~55℃,ph为6.0~8.0,酶解2~4h。
优选地,所述蛋白酶为胰蛋白酶,酶解条件为30~45℃,ph为7.0~9.0,酶解2~4h。
优选地,所述蛋白酶为木瓜蛋白酶,酶解条件为40~70℃,ph为5.0~8.0,酶解2~4h。
进一步地,所述灭酶活的条件为100℃温度下处理5min。
更进一步地,所述离心的条件为5000r/min离心10min。
虾头酶解物剂量为2~8g/60kg体重,每日两次,连续5~7日。可制成片剂或冲饮剂或在食物中添加,作为药物或保健品,达到治疗慢性低度炎症的效果。
本发明具有以下有益效果:
本发明虾头酶解物在制备治疗慢性低度炎症药物中的应用,经过动物实验证明虾头酶解物中含有多种活性物质,可以降低机体促炎因子的表达,升高抑炎因子的表达,降低致炎因子内毒素的浓度,达到调节肠道菌群、治疗慢性低度炎症药物的效果,具有广泛的应用前景。并且可以充分利用虾加工产业中的副产物,成本低,安全性高,制备方法简单,药物开发基础好。
附图说明
图1为虾头酶解物对血清中内毒素(lps)表达水平的影响柱状图。
图2为虾头酶解物对血清中促炎因子tnf-α表达水平的影响柱状图。
图3为虾头酶解物对血清中促炎因子il-1β表达水平的影响柱状图。
图4为虾头酶解物对血清中促炎因子il-6表达水平的影响柱状图。
图5为虾头酶解物对血清中抑炎因子il-10表达水平的影响。
图6为虾头酶解物干预后小鼠菌群门分类水平物种组成的丰度图。
图7为虾头酶解物干预后小鼠菌群属分类水平物种组成的丰度图。
图8为小鼠炎性指标与肠道菌群的皮尔森相关性分析图;其中,a:门水平,b:属水平;r>|0.5|较强相关性,r<|0.5|弱相关性,相关性存在显著性差异p<0.05,用*标识,p<0.01,用**标识。
图9为虾头酶解物对辣椒素致炎小鼠肠道中革兰氏阴性菌数量的影响柱状图。
图10为虾头酶解物对辣椒素致炎小鼠肠道中潜在致病菌数量的影响柱状图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
统计学处理方法:采用spss22.0统计软件进行数据分析。方差齐采用one-wayanova分析,方差不齐用nonparametrictests分析,组间比较采用多重检验的turkeyhsd,计数以百分率(%)表示,检验水准α=0.05,以p<0.01为差异有统计学意义。
实施例1虾头酶解物的制备
所述虾头酶解物的制备具体包括以下步骤:
取南美白对虾虾头捣碎成泥,按1:0.5的重量体积比加入蒸馏水匀浆,调节ph为7.09,再加入0.1wt%中性蛋白酶充分搅拌均匀,50℃水浴加热3小时,酶解反应后100℃灭酶活5min,冷却后,5000r/min离心10min,取上清液旋蒸浓缩,冷冻干燥,即得。
实施例2虾头酶解物的制备
所述虾头酶解物的制备具体包括以下步骤:
取南美白对虾虾头捣碎成泥,按1:0.5的重量体积比加入蒸馏水匀浆,调节ph为8.0,再加入0.1wt%胰蛋白酶充分搅拌均匀,40℃水浴加热3小时,酶解反应后100℃灭酶活5min,冷却后,5000r/min离心10min,取上清液旋蒸浓缩,冷冻干燥,即得。
实施例3虾头酶解物的制备
所述虾头酶解物的制备具体包括以下步骤:
取南美白对虾虾头捣碎成泥,按1:1的重量体积比加入蒸馏水匀浆,调节ph为6.0,再加入0.5wt%木瓜蛋白酶充分搅拌均匀,35℃水浴加热3小时,酶解反应后100℃灭酶活5min,冷却后,5000r/min离心10min,取上清液旋蒸浓缩,冷冻干燥,即得。
应用例虾头酶解物对辣椒造成的小鼠慢性低度炎症的影响
1、实验材料
1.1实验动物:
30只spf级的6周龄雌性c57bl/6j小鼠(购于北京斯贝福生物技术有限公司,许可证批号:scxk(京)2016-0002)。实验动物被单独饲养在笼中,期间可以自由获取co60辐照灭菌的全价配合饲料(营养成分符合gb14924.3-2001要求)和无菌水,饲养环境温度为28~33℃,相对湿度为40~70%,明暗循环周期为12h,压力梯度为20~50pa,全新风,单向流动,每周进行3次换水瓶和更换垫料。
1.2实验试剂:
虾头酶解物:采用实施例1制备得到的虾头酶解物。
微板定量显色基质法鲎试剂盒;elisa炎性指标快速检测试剂盒,elisakitproductmanual:本实验选用的为欣博盛quanticyto小鼠il-10、il-6、il-iβ、tnf-αelisa试剂盒;内毒素快速检测试剂盒:选用厦门鲎试剂生物科技股份有限公司的内毒素检测鲎试剂盒(微板定量显色法),批号:19080106。
2、实验动物处理
将30只健康spf级雄性c57bl/6j小鼠随机分为6组,每组5只,分笼饲养;分别为空白对照组(nc)、辣椒素致炎组(pc)、阳性对照组(im,深海鱼油,可以一定程度上减轻炎症反应)、虾头酶解物低剂量组(shl)、虾头酶解物中剂量组(shm)、虾头酶解物高剂量组(shh);其中pc组辣椒素浓度为:16mg/kgbw/day,im组深海鱼油浓度为:2.5g/kgbw/day,虾头酶解物低、中、高剂量分别为:0.45g/kgbw/day、0.9g/kgbw/day、1.8g/kgbw/day。
实验前小鼠进行预养2周处理,第3周开始进行灌胃处理,空白对照组小鼠灌胃生理盐水0.4ml,辣椒致炎组小鼠灌胃生理盐水0.2ml和辣椒素0.2ml,阳性对照组小鼠灌胃深海鱼油溶液0.2ml和辣椒素0.2ml,虾头酶解物低剂量组小鼠灌胃低剂量虾头酶解物0.2ml和辣椒素0.2ml,虾头酶解物中剂量组小鼠灌胃中剂量虾头酶解物0.2ml和辣椒素0.2ml,虾头酶解物高剂量组小鼠灌胃高剂量虾头酶解物0.2ml和辣椒素0.2ml,每天晚上喂食前30分钟灌胃1次,连续灌胃7d。
3、样本的采集
3.1小鼠粪便的收集
实验期间每天早上8:30观察小鼠状态,测量各组小鼠体重并记录下来,测量体重后,进行粪便收集,对小鼠采用常规抓取、按摩腹部的方法,在洁净台中采集新鲜粪便颗粒到无菌ep管中,编号,采集所得样品即刻冰浴,直至转入–80℃冰箱中待用。每只小鼠至少采集3颗粪便颗粒,一次采集不足者,可以在同一天的多个时间点反复采集。
3.2血清及器官样本的采集
连续灌胃7d后,对已断水断食6小时的小鼠进行眼球取血,抗凝,离心(4℃,8300r/min,8min),制备血清,并存于-80℃冰箱;实验小鼠眼球取血后,颈椎脱臼处死,随后立即摘取心、肝、脾、肺、胃、肠、肾,称重,记录,按公式计算上述器官指数。
4、指标测定及结果
4.1小鼠血清中lps的测定
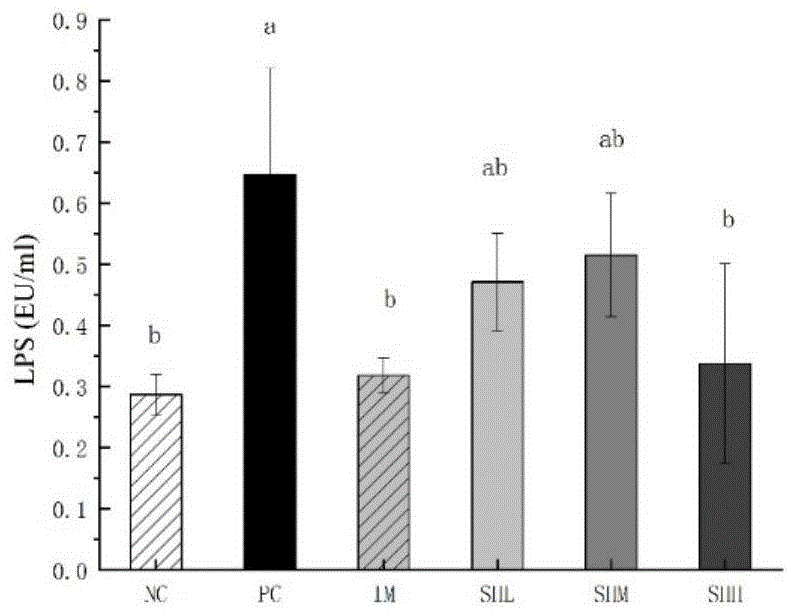
严格按试剂盒操作步骤测定所取得的小鼠血清样本中的lps的含量,结果参见图1。
由图可见,辣椒素致炎模型组小鼠血清中lps的浓度水平是空白对照组的5.62倍;而经不同剂量虾头酶解物干预后,lps均显著降低(p<0.05),其中高剂量组较致炎模型组降低了48%,阳性对照组相比没有显著的差异。说明辣椒素可使血清中lps显著升高,虾头酶解物干预可使血清中lps含量显著下降,其中高剂量组干预效果最为显著。
4.2小鼠血清中炎性因子的测定
严格按试剂盒操作步骤测定所取得的小鼠血清样本中的il-10、il-1β、il-6和tnf-α的含量,结果参见图2~5。
由图可见,辣椒素可使小鼠血清中促炎因子(tnf-α、il-1β、il-6)水平显著升高(p<0.05),其中tnf-α、il-1β水平升高超过对照组的2倍,而抑炎因子il-10水平显著降低(p<0.05)。本发明实施例1虾头酶解物干预后,低、中、高剂量组tnf-α的含量分别降低了52%,54%和47%,基本恢复至空白对照组水平。高剂量虾头酶解物组il-1β的含量较辣椒素致炎组降低了72%,显著低于空白对照组,抑炎因子il-10水平升高了50%;且三个剂量组的tnf-α、il-1β浓度水平均显著低于鱼油对照组。
说明经虾头酶解物干预后,小鼠体内的促炎因子tnf-α和il-1β浓度水平显著降低,机体系统低度炎症得到有效控制,完全恢复到致炎前的水平,且其控制效果显著优于鱼油。
4.3小鼠肠道菌群结构分析
粪便dna提取:置于-80℃冰箱中的粪便样品,采用sds裂解液冻融法进行dna提取,基因组dna通过powermax提取试剂盒(mobiolaboratories,carlsbad,ca,usa)提取,在-20℃储存;采用nanodropnd-1000分光光度计(thermofisherscientific,waltham,ma,usa)测定dna的数量和质量,若样品浓度较低,则视为该样品无效,不可进行下一步电泳检测。
illumina高通量16srdna测序:通过采用illuminahiseq测序平台,使用引物为515f-806r对v4区进行扩增测序,测序得到fastq格式的原始数据,再配对拼接成单条序列;通过barcode确定序列对应的样本,用qiime序列进行质控过滤,去掉嵌合体,得到有效序列。
4.3.1otu聚类与统计
用r软件编写程序,对全部样本所包含的序列的长度分布进行统计。根据otu的聚类结果,默认以97%相似度下以otu为单位绘制韦恩图,比较不同样品(组)之间共有、特有的otu数目。
4.3.2各分类水平组成分析
通过对otu的聚类和注释的结果统计,得到不同分类水平上(由门、纲、目、科、属、种组成)各个样本的微生物类群落组成数量。根据物种注释结果,对每个样本或分组在各分类水平上(门、纲、目、科、属)选取丰度排名前10的物种绘制相对丰度柱状图,分析不同样本或分组间物种组成比例情况。根据不同样本的分类单位的相似度进行聚类,了解样品之间的相似性以及属水平上的群落构成相似性。
4.3.2.1虾头酶解物干预后小鼠肠道菌群在门水平下的差异比较
由图6可见,在门分类水平上,小鼠肠道菌群主要由厚壁菌门(firmicutes)、变形菌门(proteobacteria)、放线菌门(actinobacteria)以及拟杆菌门(bacteroidetes)等组成,其中变形菌门、厚壁菌门、放线菌门这3类优势菌门共同占所有菌群的90%以上。与空白对照组相比,辣椒素致炎组中的proteobacteria丰度增加了123%,而fimicutes和bacteroidetes却显著下降(p<0.05),其中verrucomicrobia由未检出增加至0.3%,actinobacteria则提高了2倍;与辣椒素致炎组相比,经虾头酶解物干预,低剂量虾头酶解物组fimicutes的丰度提高了12倍,proteobacteria的丰度却显著降低,verrucomicrobia的丰度降至为未检出,恢复至空白对照组水平;高剂量虾头酶解物组fimicutes的丰度显著增加,proteobacteria的丰度则降低了87%;verrucomicrobia的丰度是辣椒素致炎组的29倍。说明经虾头酶解物干预,在门水平上可有效恢复由辣椒诱发的菌群结构的改变。
4.3.2.2虾头酶解物干预后小鼠肠道菌群在属水平下的差异比较
由图7可见,在属水平上,所有样本中共有的前10个物种,其中能观察出在各组肠道菌群中乳杆菌属(lactobacillus)和嗜麦芽窄食单胞菌(stenotrophomonas)为优势菌属。与空白对照组相比,辣椒素组乳杆菌属(lactobacillus)的丰度降低了81%,嗜麦芽窄食单胞菌(stenotrophomonas)则增加了106.6%,阿洛巴氏菌属(allobaculum)和颤螺旋菌属(oscillospira)的丰度呈现不同程度的降低,而棒状杆菌属(corynebacterium)则从未检出增加至4.50%;虾头酶解物干预后,相对于辣椒素组,低剂量组和高剂量组嗜麦芽窄食单胞菌属(stenotrophomonas)的丰度均降至未检出,棒状杆菌属(corynebacterium)的丰度则分别降低了87.5%和73.4%,而乳杆菌属(lactobacillus)的丰度则分别增加了85.9%和75.5%,菌种丰度比例的恢复幅度均显著优于鱼油对照组(p<0.05),阿洛巴氏菌属(allobaculum)和adlercreutzia的丰度均有不同程度的增加,其中,高剂量组阿洛巴氏菌属(allobaculum)提高15倍,akkermansia的丰度提高29倍,而中剂量组肠道菌群丰度和辣椒素致炎组相比并没有出现显著的逆转,而是使嗜麦芽窄食单胞菌属(stenotrophomonas)比例进一步增加,乳杆菌属(lactobacillus)的丰度进一步降低。综上所述,低、高剂量虾头酶解物可以恢复致炎模型小鼠的肠道菌群多样性,显著降低嗜麦芽窄食单胞菌属和棒状杆菌属等有害风险菌丰度、增加阿洛巴氏菌属和乳杆菌属等有益菌的丰度。
4.3.3小鼠肠道菌群alpha多样性
通过otu丰度矩阵,计算样本的群落多样性(alpha多样性)指数,利用chao1指数和ace指数指示群落的丰富度(即群落中微生物成员如otu的数量),shannon指数和simpson指数反映群落的均匀度(即各成员间的丰度差异大小),结果参见表1。
表1小鼠肠道菌群alpha多样性指数(x±sd)
注:同列数据肩标不同小写字母表示差异显著(p<0.05),相同或无字母表示差异不显著(p>0.05)。
由表1可见,辣椒素致炎组的simpson、shannon、chao1和ace指数均显著低于空白对照组,说明辣椒素可以显著降低肠道菌群物种丰富度。中剂量虾头酶解物干预后,则进一步降低菌群多样性(p<0.05),而低、高剂量虾头酶解物及鱼油对辣椒致炎模型小鼠进行干预后,各多样性指数均显著增加,中剂量组则显著降低,说明低、高剂量虾头酶解物均能提高因辣椒素刺激而降低的肠道菌群物种丰富度和多样性。
4.3.4小鼠炎性指标与肠道菌群的皮尔森相关性分析
皮尔森相关系数(pearsoncorrelationcoefficient)是一种线性相关系数,反映两个变量线性相关程度的统计量。通过spss对小鼠血清炎性指标的含量与肠道菌群门属相对丰度两个变量进行皮尔逊相关系数分析。
由图8可见,tnf-α与酸杆菌门acidobacteria、绿弯菌门chloroflexi及变形菌门(proteobacteria)呈正相关,il-1β与变形菌门proteobacteria呈显著正相关(p<0.01),与厚壁菌门firmicutes、放线菌门actinobacteria、柔壁菌门tenericutes和梭杆菌门fusobacteria呈显著负相关(p<0.01),il-6与放线菌门actinobacteria和柔壁菌门tenericutes呈负相关(p<0.05),lps与酸杆菌门acidobacteria的丰度呈显著正相关(p<0.01);tnf-α和lps均与葡萄球菌属(staphylococcus)呈显著正相关(p<0.01),il-1β与乳酸杆菌lactobacillus、adlercreutzia、拟杆菌属bacteroides及rf39呈负相关,il-6与乳酸杆菌lactobacillus、拟杆菌属bacteroides及rf39呈负相关,il-10与脱磷孤菌属(desulfovibrio)呈显著负相关(p<0.05),ruminococcaceae与促炎因子及lps呈负相关,与抑炎因子il-10呈正相关。
4.3.5虾头酶解物对辣椒素致炎小鼠肠道中革兰氏阴性菌及潜在致病菌数量的影响
基于bugbase的表型对肠道菌群进行分类比较。bugbase是2016年所提供服务的一款在线16s功能预测工具,该软件包也是使用相同的otu聚类方法该工具主要进行表型预测,通过对otu的聚类和注释的结果统计,得到不同分类水平上(由门、纲、目、科、属、种组成)各个样本的微生物类群落组成的表型比例。根据物种注释结果,选取革兰氏阴性和潜在致病菌的比例,绘制相对丰度柱状图,分析不同样本或分组间物种组成比例情况。
由图9~10可见,经过低、高剂量虾头酶解物干预后,小鼠肠道中革兰氏阴性菌数量和潜在致病菌的数量较辣椒素组比显著下降(p<0.05)。血液中的致炎因子内毒素lps是革兰氏阴性细菌细胞壁外壁的组成成分,肠道内的革兰氏阴性菌数量多少,很大程度上可以代表肠道中lps的浓度高低。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!