用于慢性疼痛缓解的跨粘膜药物传递装置的制作方法
相关申请本申请要求2011年12月21日提交的美国临时申请61/578,755号的优先权。将该申请的全部内容引入于此以作参考。本申请涉及1996年10月18日提交的美国临时申请08/734,519,现为1998年9月1日授权的美国专利5,800,832号;1998年9月1日提交的美国专利申请09/144,827号,现为2000年12月12日授权的美国专利6,159,498号;2005年3月1日提交的美国专利申请11/069,089号,现为2009年8月25日授权的美国专利7,579,019号;2006年12月13日提交的美国专利申请11/639,408号;2007年9月6日提交的美国专利申请11/817,915号;2011年7月15日提交的美国专利申请13/834,306号,现为2012年4月3日授权的美国专利8,147,866号;2012年8月20日提交的美国专利申请13/590,094号,将其全部内容引入于此以作参考。
背景技术:
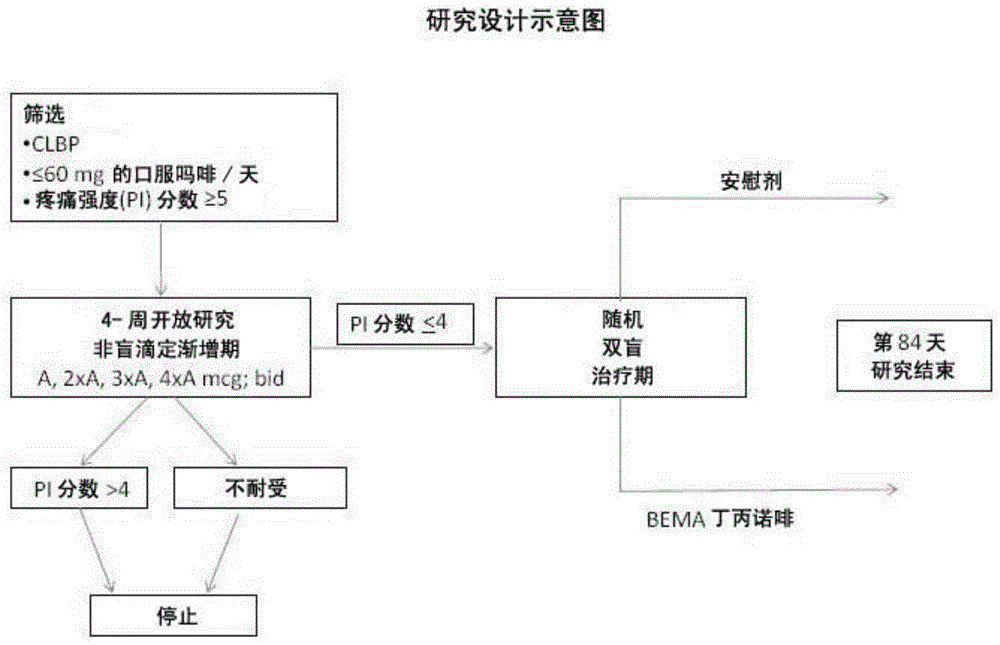
:慢性疼痛为持续超过预期的恢复时间的疼痛(如果来源于损伤),并可从恼人的滋扰进展为深刻的痛苦。慢性疼痛可引起受折磨个体行为的显著改变(伴有抑郁和焦虑)、日常活动的限制及药物和医疗服务的滥用。慢性疼痛的治疗是困难的,经常并不充分且关系到高经济和心理成本。丁丙诺啡(buprenorphine)为部分μ-阿片受体激动剂(partialμ-opiatereceptoragonist)、具有高亲和性和缓慢解离速率的orl1/孤啡肽(nociceptin)受体激动剂,和κ-阿片受体拮抗剂。丁丙诺啡通过肝脏,经细胞色素p450酶系统的cyp3a4同工酶而代谢为去烷基丁丙诺啡(norbuprenorphine)(通过n-脱烷基化)和其它代谢物。丁丙诺啡由于首过代谢非常高而导致口服生物利用率低。丁丙诺啡为止痛剂,可作为0.2mg舌下片剂和作为0.3mg/ml胃肠外制剂商购获得。丁丙诺啡还可作为舌下制剂和作为具有纳洛酮的舌下防滥用制剂获得。fda于2002年批准suboxone/subutex作为阿片样物质依赖的治疗。舌下丁丙诺啡已用于阿片样物质解毒和维持。近来的非盲(open-label)研究使用舌下丁丙诺啡来治疗那些慢性阿片样物质使用者的慢性疼痛(malinoff等人,2005,americanjournaloftherapeutics12,379-384)。患者用2-20mg范围内的每日丁丙诺啡剂量(平均8mg)治疗。治疗从2.4个月持续到16.6个月(平均8.8个月)。文章报道称,患者体验到其病况的改进并且报告其痛感的降低。然而,需要用于治疗慢性疼痛而不涉及不良反应的有效方法,特别是对于那些阿片样物质未耐受型(opioidnaive)或阿片样物质经历型(opioidexperienced)患者。附图说明图1为用于评价患有慢性腰背疼痛(lowbackpain)的受试者每日两次施用bema丁丙诺啡的效力和安全性的临床研究设计的示意图。图2为参与评价患有慢性腰背疼痛的受试者每日两次施用bema丁丙诺啡的效力和安全性的临床研究的受试者安排的示意图。图3为示出患有慢性腰背疼痛的受试者在每日两次施用bema丁丙诺啡后经历的每日疼痛强度从基线的平均变化的图。技术实现要素:本教导提供通过经由粘膜粘附性生物可蚀性药物传递装置每日两次(或每日一次)施用低剂量丁丙诺啡来治疗慢性疼痛的方法。所述方法和装置有效地治疗慢性疼痛而无明显副作用,例如小于15%(优选小于10%,更优选小于5%)的患者经历便秘。所述装置包括约100μg至0.9mg的丁丙诺啡,并提供在约0.1和约1.2ng/ml范围内的稳态cmax的血浆丁丙诺啡浓度,以便治疗受试者的慢性疼痛。在一个实施方案中,丁丙诺啡传递装置包括生物可蚀性粘膜粘附性层,所述生物可蚀性粘膜粘附性层包括设置于缓冲的聚合物扩散环境中的治疗有效量的丁丙诺啡,其中所述聚合物扩散环境为具有约4和约6之间的ph的缓冲环境。在另一实施方案中,丁丙诺啡传递装置进一步包括阻挡层,所述阻挡层包括接近粘膜粘附性层配置的聚合物阻挡环境,从而在应用至粘膜表面时提供单向梯度来快速有效传递丁丙诺啡,其中当应用至粘膜表面时所述单向梯度使丁丙诺啡穿过缓冲的聚合物扩散环境传递。还在另外的实施方案中,所述装置包括缓冲至约4.0和约6.0之间的ph的含有效量的丁丙诺啡的粘膜粘附性层,和缓冲至约4.0和约4.8之间的ph的背衬层。在一个实施方案中,所述装置包括约120μg至0.9mg的丁丙诺啡。本文公开的方法和装置可用于治疗患有慢性腰背疼痛例如中度至重度慢性腰背疼痛的受试者,或患有神经病理性疼痛或骨关节炎疼痛的受试者。具体实施方式本发明提供用低剂量丁丙诺啡治疗慢性疼痛的方法。本治疗疼痛的方法还不涉及明显的阿片样物质不良反应。例如,受试者接受治疗而不经历任何重度常见阿片样物质不良反应。或者,受试者接受治疗经历轻度或中度的常见阿片样物质不良反应,或无常见阿片样物质不良反应。本发明还提供每日两次施用丁丙诺啡的有效的慢性疼痛缓解。本发明至少部分的基于下述出乎意料的发现:含有低剂量丁丙诺啡的跨粘膜药物传递装置可每日两次施用至有服用阿片样物质经历的受试者来有效控制和缓解慢性疼痛,如慢性腰背疼痛。本发明还基于发现该治疗不导致与阿片样物质相关的实质性副作用如便秘和恶心。定义关于本文使用的某些术语的含义,提供下列定义作为指导。如本文所使用的,冠词“一种”(a和an)指“一种或多种”或者“至少一种”,除非另有说明。即,关于由不定冠词“一种”所表示的本发明的任意元素不排除存在多于一种元素的可能性。如本文所使用的,术语“急性疼痛”指特征为持续时间短,例如三至六个月的疼痛。急性疼痛典型地与组织损伤相关,并且以可容易描述和观察的方式表现。例如,可引起排汗或心率增加。急性疼痛还可随时间增强,和/或间歇发生。如本文所使用的,术语“生物利用率”如21cfr320.1节中所定义,并且指活性成分或活性部分从药品吸收并在作用部位可得的速度和程度。术语“生物利用率”、“绝对生物利用率”或“总生物利用率”指包括通过口腔粘膜(即,跨粘膜)和通过下gi道的gi粘膜吸收的量的总生物利用率。在某些实施方案中,本发明的跨粘膜药物传递装置提供65%和85%之间的丁丙诺啡的生物利用率。在某些实施方案中,丁丙诺啡的生物利用率为80%。如本文所使用的,术语“生物等效”或“生物等效的”如21cfr第320.1节中定义,并且指在适当设计的研究中在相似条件下以相同摩尔剂量施用时在药剂等同物(pharmaceuticalequivalents)和药剂替代品(pharmaceuticalalternatives)中的活性成分或活性部分在药物作用部位变得可利用的速度和程度不存在显著差异。生物等效活性的药物动力学参数cmax和auc分别落入80%-125%范围内。如本文所使用的,术语“慢性疼痛”指在伤害或疾病的正常恢复期外仍持续的疼痛。在一个实施方案中,慢性疼痛为持续超过一周的疼痛。慢性疼痛可以是持续或间歇的。慢性疼痛的常见原因包括但不局限于,关节炎、癌症、反射性交感神经营养不良综合征(rsds)、重复应力损伤(repetitivestressinjuries)、带状疱疹、头痛、纤维肌痛和糖尿病性神经病变。如本文所使用的,术语“慢性腰背疼痛”指肌骨骼(muscoskeletal)疾病,其中受试者经历腰部或腰背区域的疼痛至少12周。在具体的实施方案中,受试者经历慢性腰背疼痛至少3个月。如本文所使用的,术语“中度至重度慢性腰背疼痛”指慢性腰背疼痛,其特征在于例如11点数字等级量表(11-pointnumericalratingscale,nrs,其中0表示无疼痛和10表示可想像的最严重的疼痛)的疼痛强度≥5。如本文所使用的,术语“神经病理性疼痛”指通常伴随有组织损伤并由影响躯体感觉系统的病变或疾病造成的复杂的慢性疼痛。在神经病理性疼痛的情况下,神经纤维本身可能损坏、功能障碍或损伤。这些损坏的神经纤维向其它疼痛中心传递不正确的信号。神经纤维损伤的影响包括在损伤部位和损伤周围区域中神经功能的变化。如本文所使用的,术语“骨关节炎疼痛”指由骨关节炎、退行性关节病和最常见类型的关节炎造成的疼痛。这与在正常关节中覆盖和缓冲骨的末端的软骨的退化和缺失相关。骨关节炎使关节中的软骨变得僵硬且失去其弹性,使其对损坏更敏感。随着时间的流逝,软骨可在某些区域磨损,大幅降低其充当缓冲器的能力。由于软骨磨损,肌腱和韧带拉伸,引起疼痛。如果病况恶化,骨可能相互摩擦,引起甚至更加疼痛和运动丧失。除非另有说明,否则如本文所使用的术语“丁丙诺啡”包括丁丙诺啡的任何药学上可接受形式,包括但不局限于其盐、酯和前药。如本文所使用的,术语“丁丙诺啡衍生物”指具有与丁丙诺啡相似结构和功能的化合物。在某些实施方案中,丁丙诺啡衍生物包括下式的那些:或其药学上可接受盐或酯,其中为双键或单键;r3选自-c1-4烷基或环烷基-取代的c1-4烷基;r4选自-c1-4烷基;r5为–oh,或r4和r5一起形成=o基;和r6选自–h或-c1-4烷基。丁丙诺啡衍生物包括,但不限于,埃托啡和二丙诺菲。一般的丁丙诺啡衍生物记载于国际申请公布wo2008/011194号中,将其引入本文作为参考。除非另有说明,否则如本文所使用的术语“纳洛酮”,包括纳洛酮的任何药学上可接受形式,包括但不局限于其盐、酯和前药。如本文所使用的,“非肠胃外”指除了医药品的直接全身传递以外的施用方式。同样地,“非肠胃外”不包括使用静脉内(iv)注射、肌肉内(im)注射、腹膜内(ip)注射、皮下(sc)注射等来施用医药品,但一般包括经皮、口腔跨粘膜施用和经gi道施用。如本文所使用的,术语“粘膜粘附性层”或“聚合物扩散环境”指在通过与粘膜表面粘附而产生梯度时能够使医药品向粘膜表面流动的环境。输送的医药品的流动与环境扩散性成比例相关,考虑到医药品的离子性质和/或包含于环境中的一种聚合物或多种聚合物的离子性质,可通过例如调节ph来控制。如本文所使用的,术语“背衬层”或“阻挡环境”或“非粘附性聚合物环境”指以例如能够减缓或降低医药品从粘膜粘附性层向口腔流动的层或涂层或阻挡层的形式存在的环境。在某些实施方案中,背衬层可包含用来溶解于唾液的第二医药品。在该情况下,调节背衬层的ph,以便阻止医药品向可发生跨膜吸收的粘膜粘附性层流动。如本文所使用的,术语“单向梯度”指允许医药品(例如,丁丙诺啡)基本上沿一个方向流动通过装置(例如通过聚合物扩散环境)到达例如受试者粘膜的梯度。例如,聚合物扩散环境可为以配置为接近于背衬层或膜的层或膜的形式的粘膜粘附性聚合物扩散环境。当口服粘膜应用时,在粘膜粘附性聚合物扩散环境和粘膜之间产生梯度,医药品从粘膜粘附性聚合物扩散环境基本上沿一个方向流向粘膜,直至背衬层溶解。如本文所使用的,受试者的动词“治疗”或名词“治疗”包括为了预防、医治、治愈、缓解、减轻、改变、补救、改善、促进、稳定或影响疾病或病症,或者疾病或病症的症状(例如,减轻疼痛)的目的而将药物向受试者施用。术语“受试者”指活生物体例如人、狗、猫及其他哺乳动物。包含于本发明装置中的医药品的施用可以在有效治疗受试者的剂量和时长下进行。在某些实施方案中,受试者为人。在某些实施方案中,本发明的装置的药物动力学图谱对于雄性和雌性受试者是相似的。达到治疗效果所需的药物的“有效量”可根据例如受试者的年龄、性别和体重等因素而变化。可调节剂量方案以提供最佳的治疗响应。例如,剂量可每日施用一次,或可分成两次独立的剂量用于每日两次施用。还可根据紧急治疗情况的指示来成比例地降低剂量。如本文所使用的,术语“跨粘膜”指经由粘膜的任何施用途径。实例包括但不局限于口腔、舌下、鼻、阴道和直肠。在一个实施方案中,施用为口腔。在一个实施方案中,施用为舌下。如本文所使用的,术语“直接跨粘膜的”指经由口腔粘膜的粘膜施用,例如口腔和/或舌下。如本文所使用的,术语“水可蚀性(watererodable)”或“至少部分地水可蚀性”指显示从可忽略的水可蚀性至完全水可蚀性范围内的水可蚀性的物质。所述物质可易于溶解在水中或可长时间仅部分地难溶于水中。此外,由于体液更加复杂的性质,所述物质与水相比,在体液中可显示不同的可蚀性。例如,在水中的可蚀性可忽略的物质可显示轻微至中度的体液可蚀性。然而,在其它情况中,水和体液中的可蚀性可大体一致。如本文所使用的,与受试者相关的“成瘾治疗”包括以减少对成瘾性物质的渴求为目的向受试者施用药物。如本文所使用的,术语“阿片样物质耐受性”指其中由于前期施用阿片类药物而使受试者对阿片类药物较不敏感的现象。“急性耐受性”描述的是在短期内提供单一剂量或几个剂量的阿片样物质后发展非常迅速的耐受性。“慢性耐受性”描述的是长期施用阿片样物质产生较少效果的情况。关联耐受性(associativetolerance)最常表现为长给药间间隔的低剂量阿片样物质,并且容易通过行为或环境干预来调整。非关联耐受性最常表现为短给药间间隔的高剂量药物,并且不通过行为或环境干预来调整。如本文所使用的,术语“阿片样物质耐受性受试者”指目前接受阿片样物质治疗的受试者。在一个实施方案中,如下表1所示,受试者正在服用>60mg的口服吗啡/天或服用等止痛(equianalgesic)剂量的另一种阿片样物质1周以上。表1.阿片样物质大致的等止痛口服剂量吗啡60mg曲马多300mg氢化吗啡酮12mg羟考酮30mg氢可酮30mg羟吗啡酮20mg可待因400mg如本文所使用的,术语“阿片样物质经历型受试者”指目前接受阿片样物质治疗的受试者。在一个实施方案中,受试者的阿片样物质的日常使用不超过如上表1所示的阿片样物质的日剂量。如本文所使用的,术语“阿片样物质未耐受型受试者”指目前没有接受阿片样物质治疗的受试者。在一个实施方案中,受试者在1周以上未曝露至阿片样物质。如本文所使用的,术语“滥用”或“滥用方式”指除口服跨粘膜施用外例如通过提取药物和注射或嗅吸的装置的使用。如本文所使用的,术语“低剂量丁丙诺啡”指小于1.8mg(例如,约200μg至约1800μg、或约240μg至1800μg)的丁丙诺啡的日剂量。如本文所使用的,术语“稳态血浆浓度”指其中血浆药物浓度的波动在每次剂量后相同或相似的状态。术语“血浆丁丙诺啡浓度的稳态cmax”指其中一次剂量与另一次剂量的丁丙诺啡的后剂量最大血浆浓度没有不同的状态术语“血浆丁丙诺啡浓度的稳态cmin”指其中一次剂量与另一次剂量的丁丙诺啡的后-剂量最小血浆浓度没有不同的状态。在一个实施方案中,用于本发明的装置提供血浆丁丙诺啡浓度的稳态cmax在约0.1和约1.0ng/ml之间。在另一实施方案中,用于本发明的装置提供i血浆丁丙诺啡浓度的稳态cmax在约0.1和约0.5ng/ml之间。如本文所使用的,术语“常见阿片样物质不良反应”指服用阿片样物质止痛剂的受试者普遍经历的不良反应。这些常见阿片样物质不良反应包括头痛、便秘、恶心或呕吐、瘙痒、嗜睡或认知障碍、口干、耐受或依赖及尿潴留等。术语“轻度常见阿片样物质不良反应”指不需要特定治疗且不干扰受试者的日常活动的不良反应。术语“中度常见阿片样物质不良反应”指受试者产生低水平的不便或忧虑并可干扰日常活动,但通常通过简单的治疗措施改善的不良反应。术语“重度常见阿片样物质不良反应”指妨碍日常活动并典型地需要全身性药物治疗或其它治疗的不良反应。术语“显著性便秘”指与连续使用吗啡或其它阿片样物质相关的慢性或重度便秘。术语“显著性恶心”指本领域熟知的恶心的严重状况。在一些实施方案中,术语“显著性恶心”由0至100mm的量表中大于或等于25mm的视觉类比量表(vas)分数限定。如本文所使用的,术语“配置”指元素彼此均匀或非均匀分布。疼痛控制(painmanagement)本发明的某些方面包括向有需要的受试者提供疼痛控制和/或缓解的方法。所述疼痛可为本领域已知的,由任何疾病、病症、病况和/或情形引起的任何疼痛,并且可为慢性疼痛或急性疼痛。慢性疼痛可由包括癌症、反射性交感神经营养不良综合症(rsds)和偏头痛等的多种来源引起。急性疼痛典型地与组织损伤直接相关,并持续相对短的时间,例如数小时至数天,或多至7天。在其它实施方案中,疼痛是突破性癌症疼痛(breakthroughcancerpain)。在一些方面,本发明提供控制或治疗受试者的慢性疼痛的方法。在一些实施方案中,受试者是如上所述的阿片样物质经历型、阿片样物质耐受型或阿片样物质未耐受型。在特定的实施方案中,受试者为阿片样物质耐受型。在另一实施方案中,受试者尚未对之前的最大剂量非甾体抗炎药的治疗做出响应。在一些实施方案中,慢性疼痛为慢性腰背疼痛(clbp)。在一些实施方案中,慢性腰背疼痛为中度至重度慢性腰背疼痛。在其它实施方案中,疼痛为神经病理性疼痛或骨关节炎疼痛。在具体的实施方案中,要治疗中度或重度慢性腰背疼痛的受试者为阿片样物质经历型受试者。目前还发现经由本发明的跨粘膜药物传递装置每日两次(或每日一次)施用低剂量丁丙诺啡与阿片样物质止痛剂相关的常见阿片样物质不良反应的低发生率或缺乏相关联。在一个实施方案中,不良反应为恶心。在另一实施方案中,不良反应为便秘。丁丙诺啡的施用和给药(dosing)在一些实施方案中,本发明的跨粘膜药物传递装置(如bema丁丙诺啡)每日一次或每日两次施用。在一些实施方案中,施用丁丙诺啡的总日剂量在200μg和1800μg之间,例如200μg、220μg、240μg、280μg、300μg、320μg、350μg、360μg、400μg、450μg、480μg、500μg、550μg、600μg、620μg、650μg、700μg、720μg、750μg、800μg、860μg、900μg、960μg、1000μg、1100μg、1200μg、1250μg、1300μg、1400μg、1500μg、1600μg和1800μg。在一些实施方案中,本发明的跨粘膜药物传递装置包括低剂量丁丙诺啡。在一个实施方案中,包含在装置中的丁丙诺啡的低剂量限定为约100μg至约900μg的丁丙诺啡的剂量。在一些实施方案中,包括在本发明的粘膜粘附性装置中的丁丙诺啡的低剂量为100μg、110μg、120μg、140μg、150μg、160μg、175μg、180μg、200μg、225μg、240μg、250μg、275μg、300μg、310μg、325μg、350μg、360μg、375μg、400μg、430μg、450μg、480μg、500μg、550μg、600μg、625μg、650μg、700μg、750μg、800μg、900μg、1000μg、1200μg、1250μg、1300μg、1400μg、1500μg、1600μg和1800μg。跨粘膜的药物传递装置跨粘膜的药物传递装置已预先记载于例如1996年10月18日提交的美国临时申请08/734,519,现为1998年9月1日授权的美国专利5,800,832号;1998年9月1日提交的美国专利申请09/144,827号,现为2000年12月12日授权的美国专利6,159,498号;2005年3月1日提交的美国专利申请11/069,089号,现为2009年8月25日授权的美国专利7,579,019号;2006年12月13日提交的美国专利申请11/639,408号;2007年9月6日提交的美国专利申请11/817,915号;2011年7月15日提交的美国专利申请13/834,306号,现为2012年4月3日授权的美国专利8,147,866号;2012年8月20日提交的美国专利申请13/590,094号,将其全部内容引入于此以作参考。i.粘膜粘附性层在一些实施方案中,本发明的装置在应用后的约5秒内粘附至受试者的粘膜表面。在一些实施方案中,本发明的装置包括阿片样物质激动剂。在一些实施方案中,本发明的装置包括生物可蚀性或水可蚀性粘膜粘附性层,并且阿片样物质激动剂包括在粘膜粘附性层中。在一个实施方案中,阿片样物质激动剂为丁丙诺啡。可并入本发明装置中的丁丙诺啡的剂量依赖于要施用的期望治疗剂量并可在约20μg至约20mg、或在约120μg至约2000μg的丁丙诺啡范围内。ii.背衬层在一些实施方案中,所述装置进一步包括至少一种另外的非粘附性聚合物环境,例如背衬层。该层接近于粘膜粘附性聚合物扩散环境配置,例如背衬层起到促进阿片样物质激动剂如丁丙诺啡向粘膜的传递。该另外的层可包括相同的或不同的聚合物的组合作为粘膜粘附性聚合物扩散环境或非粘附性聚合物扩散环境。在一些实施方案中,背衬层包括另外的药物,例如阿片样物质拮抗剂,来提供本发明的装置以防滥用性。在一些实施方案中,阿片样物质拮抗剂为纳洛酮。可并入本发明装置的背衬层中的纳洛酮的剂量可在约2.5μg至约5mg纳洛酮的范围内。在一些实施方案中,配置于装置中的丁丙诺啡的量和纳洛酮的量以使丁丙诺啡的效果被纳洛酮抵消的选择比例存在(如果注射或吸入混合物)。在一些实施方案中,配置于装置中的丁丙诺啡的量和纳洛酮的量以4:1w/w的比例存在。实施例通过以下实施例将进一步理解本发明。然而,本领域技术人员容易理解,此处所述的具体实验细节仅为说明性的而并不意于限定本发明,本发明由之后的权利要求所限定。实施例1.本发明装置的制备以光盘、具有圆角的矩形的形式构造跨粘膜装置(对侧边框(cheek)的一侧或两侧为黄色)。丁丙诺啡存在于粘膜粘附性层中,这一侧将要与颊粘膜(buccalmucosa)(对侧边框内)接触而放置。当盘在口中侵蚀时将药物传递至粘膜中并穿过粘膜。非粘附性背衬层控制盘的侵蚀速率,并最小化丁丙诺啡溶于唾液并最终吞咽的量,由于首过代谢造成的吸收降低的途径。粘膜粘附性聚合物扩散层和背衬层结合在一起且不在应用期间或应用之后分层。包括期望剂量丁丙诺啡的本发明跨粘膜装置的粘膜粘附性层通过混合纯水、丙二醇(约4.6%总制剂,干重)、苯甲酸钠(约0.5%总制剂,干重)、尼泊金甲酯(约0.9%总制剂,干重)、尼泊金丙酯(约0.2%总制剂,干重)、维生素e醋酸酯(约0.06%总制剂,干重)、柠檬酸(约0.5%总制剂,干重)、黄色氧化铁(约0.5%总制剂,干重)、磷酸二氢钠(约3.4%总制剂,干重)来制备。上述成分连续添加至混合容器。组分溶解后,添加丁丙诺啡hcl(约1.3%总制剂,干重),并将容器加热至120°f至130°f。溶解后,聚合物混合物(羟丙基纤维素(约6.8%总制剂,干重)、羟乙基纤维素(约20.3%总制剂,干重)、聚卡波非(约6.3%总制剂,干重)和羧甲基纤维素(约54.3%总制剂,干重))添加至容器,并搅拌至分散。随后,从混合容器除去热。作为最后的添加步骤,添加磷酸三钠和氢氧化钠来调节共混物至期望的ph。共混物在真空下混合几小时。每个制备的混合物贮藏在气封的容器中直至其用于涂布操作。背衬层通过将纯水加入混合容器,接着顺序添加苯甲酸钠(约0.5%总制剂,干重)、尼泊金甲酯(约0.4%总制剂,干重)、尼泊金丙酯(约0.1%总制剂,干重)、柠檬酸(约0.5%总制剂,干重)、维生素e醋酸酯(约0.05%总制剂,干重)、糖精钠(约0.5%总制剂,干重)来制备。随后,添加聚合物羟丙基纤维素(约63%总制剂,干重)和羟乙基纤维素(约32%总制剂,干重)并在约120°f和130°f之间的温度下搅拌,直至均匀分散。在冷却至室温时,二氧化钛(约2.5%总制剂,干重)和薄荷油(约0.8%总制剂,干重)接着添加至容器并搅拌。制备的混合物贮藏在气封容器中直至其准备好用于涂布操作。将层连续铸造在st.gobain聚酯衬垫上。首先,背衬层使用刀刃(knife-on-a-blade)涂布法。接着将背衬层在约65℃至95℃下在连续炉中固化并干燥。两次交替的涂布干燥后,获得约8mil(203至213微米)厚的背衬层。随后,粘膜粘附性聚合物扩散环境铸造在背衬层上,在约65℃至95℃下在炉中固化并干燥。然后将装置通过吻切法(kiss-cut)模切(die-cut)并从铸造面移除。实施例2.安慰剂对照的双盲研究来评价bema丁丙诺啡在患有中度或重度慢性腰背疼痛的受试者中的效力进行12-周的安慰剂对照的双盲随机退出研究(withdrawalstudy)来评价经由增强吸收的跨粘膜药物传递装置每日两次传递的丁丙诺啡(bema丁丙诺啡)在患有中度或重度慢性腰背疼痛的受试者中的效力和安全性。该研究还涉及为限定对中度至重度慢性腰背疼痛有效的bema丁丙诺啡剂量的范围。i.研究设计该研究由持续多至4周的非盲剂量滴定渐增期(titrationperiod)和随后12周的随机、双盲、安慰剂对照的治疗组成。受试者在起始筛选期(-14至-1天)和直至非盲剂量滴定渐增期的0/1天之前的12至24小时期间继续进行它们目前的疼痛治疗。预计量评价在非盲剂量滴定第0天进行,在非盲剂量滴定第1天取研究药物的第一剂量。在非盲剂量滴定渐增期,受试者大约每12小时施用bema丁丙诺啡,并在直至发现稳定剂量(即,提供有意义的疼痛缓解并很好地耐受的剂量)的多至4周的期间内间隔进行剂量滴定。bema丁丙诺啡的滴定顺序示于下表4中。不能发现稳定剂量的受试者停止研究。表4.bema丁丙诺啡滴定方案研究天数滴定顺序-bem丁丙诺啡低剂量(q12小时)1a7(±3天)2×a14(±3天)3×a21(±3天)4×a鉴定出稳定剂量及在最后7天中取该剂量至少12次的受试者进入12-周双盲治疗期,其中一半的受试者接受bema安慰剂,一半继续接受稳定剂量的bema丁丙诺啡。各受试者对整个研究的参与持续19周。示出研究设计的示意图示于图1中。ii.用于该研究的受试者群体如本申请中前述定义的,选择包括在研究中的受试者为阿片样物质未耐受型或阿片样物质经历型。阿片样物质经历型受试者为服用≤60mg口服日剂量的吗啡或等止痛剂量的另一种允许的阿片样物质1周以上的受试者。阿片样物质未耐受型受试者不服用任何阿片样物质1周以上。总计334名受试者进入研究,其中332名受试者进入4-周非盲剂量滴定渐增期。由于97名受试者在非盲滴定渐增期停止干预,因而总计235名受试者继续进入12-双盲治疗期。117名接受bema丁丙诺啡的受试者中,28名停止干预,89名受试者完成研究。118名接受安慰剂的受试者中,37名停止干预,8名受试者完成研究。研究期间的受试者处置总结于图2中,参与研究的群体特征总结于下表5中:表5.研究群体特征iii.bema丁丙诺啡的止痛效力通过令受试者在0-10的量表上记录在过去的24小时里他们的平均疼痛强度来每日评价止痛效力,其中0表示无疼痛,10表示可想像的最严重的疼痛(11-点数字等级量表,nrs)。在双盲治疗期从基线(cbl)至最终观察的每日疼痛强度的平均变化示于下表6-12。表6-8表示不同受试者组的平均变化数据,表9-12表示用不同剂量丁丙诺啡处理的受试者组的平均变化数据。表6.平均每日疼痛强度-所有受试者表7.平均每日疼痛强度-阿片样物质经历型受试者表8.未耐受型受试者中阿片样物质的平均每日疼痛强度如表7所示,bema丁丙诺啡与安慰剂相比的平均每日疼痛分数从基线的变化在阿片样物质经历型群体中接近于统计上的显著。表9.用aμg的丁丙诺啡的每日剂量治疗的受试者的平均每日疼痛强度表10.用2×aμg的丁丙诺啡的每日剂量治疗的受试者的平均每日疼痛强度表11.用3×aμg的丁丙诺啡的每日剂量治疗的受试者的平均每日疼痛强度表12.用4×aμg的丁丙诺啡的每日剂量治疗的受试者的平均每日疼痛强度图3中绘出的是所有受试者的每日疼痛强度从基线的平均变化;所有受试者接受2×aμg、3×aμg或4×aμg的bema丁丙诺啡;所有阿片样物质经历型受试者;和所有阿片样物质经历型受试者接受2×aμg、3×aμg或4×aμg的bema丁丙诺啡。iv.不良事件的发生率记录研究中所有受试者的不良事件(ae)。ae定义为施用药品的患者或临床研究受试者的任意不适当的医疗事件,且不必与该治疗具有因果关系。记录的非盲滴定和双盲治疗期二者的不良事件的总数列于下表13中。表13.总治疗中出现的不良事件(teae)ae的强度如下分为轻度、中度或重度:轻度:短暂,不需要特殊治疗且不干扰受试者的日常活动的ae。中度:引起受试者低水平不便或忧虑并可干扰日常活动,但通常通过简单的治疗措施改善的ae。重度:打断受试者的日常活动并典型地需要全身性药物治疗或其它治疗的不良反应ae。下表14示出在包括330名受试者的非盲滴定渐增期经历teae的受试者的数量和百分比,所有的teae的特征在于事件强度和与研究药物的关系。下表15示出双盲治疗期和包括117名受试者的丁丙诺啡治疗组的类似数据。各事件曾记录的最大强度和在该强度下的药物关系用于将不良事件分类。“药物相关”分类示为“r”并包括在“大概”或“可能”的与药物的调查者评价关系下的不良事件。“非药物相关”分类示为“nr”。表14.在非盲滴定渐增期事件强度的teae和药物关系。表15.在双盲治疗期事件强度的teae和药物关系。实施例3.bema丁丙诺啡的药动学参数不用于治疗慢性疼痛的bema丁丙诺啡的药动学参数在单独的多剂量研究中确定。bema丁丙诺啡包含2×aμg和4×aμg的丁丙诺啡剂量。各剂量每日两次施用3天,连续采集血样。选择的药动学参数示于下表16。表16.包括1×aμg、2×aμg、3×aμg和4×aμg丁丙诺啡的选择的bema丁丙诺啡口腔粘膜(buccalfilms)的药动学参数。药动学参数(平均值)1×aμg2×aμg3×aμg4×aμgtmax(hr)2.902.612.002.20cmax(ng/ml)0.07660.1560.2160.364cmin(ng/ml)0.01570.03710.05580.0862cavg(ng/ml)0.04090.08050.1130.195auc0-τ(hr*ng/ml)0.49030.96581.3582.343auc终(hr*ng/ml)0.40850.79021.1115.033tmax是指达到血浆丁丙诺啡浓度稳态cmax的时间。cmax是指稳态中的血浆最大浓度。cmin是指稳态中的血浆最小浓度。cavg是指稳态中的血浆平均浓度。auc0-τ是指从时间-零通过给药间隔的血浆浓度时间曲线的面积。auc终是指从时间-零在至最终定量浓度的时间在浓度时间曲线下的面积。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1