负载奥替普拉的人多能干细胞外泌体及其制备方法与用途与流程
本发明属于细胞生物学、分子生物学及药物研发技术领域,尤其是涉及负载奥替普拉的人多能干细胞外泌体及其制备方法与用途。
背景技术:
外泌体是一类由细胞分泌的直径约30-150nm的细胞外囊泡,其携带供体细胞来源的多种生物活性物质包括dna、rna、蛋白等进入效应细胞,有效调控机体细胞信号转导。研究表明,干细胞分泌的外泌体通过向效应细胞传递干细胞来源的生物活性物质,生理性修复或者清除机体损伤、病变和衰老的细胞,发挥抗炎、调节免疫、促进效应细胞增殖、迁移和分化、促进血管新生等功能。
胚胎干细胞(embryonicstemcell,escs)与诱导人多能干细胞(inducedpluripotentstemcells,ipscs)具有体外培养无限增殖、自我更新和多向分化的特性。escs和ipscs具有多能性(pluripotency),即escs和ipscs可分化成三胚层的任意细胞,具有发育成多种组织的能力,参与部分组织的形成。而成体干细胞仅具备多种分化潜能(multipotency),即只能分化成为有限的几种细胞。因而escs和ipscs与组织成体干细胞相比在促进组织器官再生更新方面功能更强大。escs或ipscs分泌的外泌体可能包裹了与多能性相关的因子、转录因子、mrna、microrna等,表现出比成体组织干细胞外泌体更强大的功能。人多能干细胞产生的外泌体,可以抑制细胞衰老过程,改变靶细胞表观遗传特征,使效应细胞逆转至低分化状态,从而促进修复组织损伤。同时人多能干细胞来源的外泌体,也可以起到与组织干细胞类似的作用,如修复血管、抑制炎症、促进组织干细胞增殖分化等功能。
外泌体是细胞分泌的天然纳米载体,外泌体作为药物的纳米载体得到了广泛的关注与研究。与人工合成的纳米载体相比,外泌体在药物释放领域的应用具有独特的优势。外泌体的组成成分均来源于细胞,避免了人工合成的脂质体、高分子、纳米硅等材料的使用带来的细胞毒性、生物相容性等问题。由于外泌体继承了细胞的磷脂、表面蛋白等物质,具有丰富的生理功能,可以提高药物的传递效率,实现药物的特异性递送、跨生物屏障传递以及免疫豁免等功能。外泌体自身携带的蛋白、基因等物质具有细胞调控能力,可以对特定的疾病起到治疗作用。
目前,多种细胞外泌体构建的纳米药物递送系统已经用于疾病治疗的探索。wood课题组最先利用未成熟的树突状细胞(immaturedendriticcells,idc)来源的外泌体负载sirna治疗阿尔兹海默症。idc分泌的外泌体表面缺乏t细胞激活蛋白(例如mhc-i,mhc-ii,cd86),具有免疫惰性。他们通过基因转染的方法,在外泌体表面蛋白lamp2b上修饰乙酰胆碱受体识别多肽片段rvg,进而赋予idc外泌体定位脑部神经细胞的能力;随后,利用电转的方法,将bace-1的sirna导入到idc外泌体中,通过小鼠动物模型,验证了这些载药外泌体治疗阿尔兹海默症的潜力。然而,idc细胞提取过程繁琐,细胞数量有限,成本高昂,难以产业化生产。同样,肿瘤细胞来源的外泌体也被用于药物递送系统的构建。虽然肿瘤细胞可以无限扩增,制备大量的外泌体,但是它们潜在的安全性风险限制其在临床的使用。最近,研究人员报道了利用牛奶来源外泌体构建的纳米药物递送系统。与细胞来源的外泌体相比,牛奶来源的外泌体提取简便、成本低,实现可以大规模制备满足临床需求。但是,由于牛奶外泌体中含有大量的非人源的基因与蛋白质等物质,其通过静脉全身注射的安全性仍有待进一步确认,而且该研究的重点主要集中于外泌体的药物载体功能,并没有充分发挥外泌体自身所携带的物质对疾病与损伤的治疗潜力。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供负载奥替普拉的人多能干细胞外泌体及其制备方法与用途。
本发明的目的可以通过以下技术方案来实现:
本发明第一方面:
提供人多能干细胞外泌体,所述人多能干细胞外泌体为人胚胎干细胞来源的外泌体或人诱导多能干细胞来源的外泌体。
在本发明的一个实施方式中,所述人多能干细胞外泌体是通过以下方法获得的:
采用无饲养层培养方法,在无血清培养体系培养人escs或ipscs,收集培养基,收集纯化培养基中的外泌体,即为人多能干细胞外泌体。
在本发明的一个实施方式中,采用旋转超滤结合低温超速离心方法收集纯化培养基中的外泌体。
旋转超滤结合低温超速离心方法主要步骤是:将一定容积的培养基于4℃400g离心10min,去除游离细胞,得到的上清移入另一管中,4℃15000g20min,去除细胞碎片,获得的上清液倒入millipore超滤装置中,用pbs洗脱收集滤膜(100kd)上的浓缩液体,即再次加入pbs,经millipore超滤装置再次超滤,得到的浓缩液转移至30%蔗糖/重水密度垫(1.210g/cm3),4℃100800g离心210分钟,收集底部蔗糖/重水密度垫,加入两倍体积pbs,转移至可截留100kd分子的超滤细心管中,4℃3500g离心15min;pbs洗涤3次,最终按后续实验要求定容至一定体积,得到exosomes悬液,分装保存至-80℃。
在本发明的一个实施方式中,无血清培养体系选择市售的型号为tesrtm-e8tm或mtesr1或mtesr2的培养基。
在本发明的一个实施方式中,收集外泌体后,通过电镜、粒径分析、免疫印迹等方法对外泌体的特性进行鉴定,结果符合外泌体特征:直径范围50-150nm,透射电子显微镜下呈双层膜囊状结构,其膜结构表面含有cd9,cd63等标志物。
本发明第二方面:
提供所述人多能干细胞外泌体作为制备治疗神经系统疾病用药物的应用。包括以下用途中的一种或几种:
a、作为制备治疗神经系统退行性疾病的药物或保健品应用,神经系统退行性疾病包括阿尔茨海默病、帕金森病、亨廷顿病等;
b、作为制备预防和/或治疗血管性痴呆的药物或保健品应用:血管性痴呆包括脑梗塞性血管性痴呆、脑出血性血管性痴呆、低灌注性血管性痴呆等;
c、作为制备治疗脑出血、脑梗塞等神经系统疾病的药物或保健品的应用。
在本发明的一个实施方式中,应用人多能干细胞外泌体治疗阿尔兹海默病。以阿尔兹海默病实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔滴注或喷雾人多能干细胞外泌体的悬液,观察外泌体对阿尔兹海默病动物认知功能障碍、脑内病变的逆转效果。
在本发明的一个实施方式中,应用人多能干细胞外泌体预防血管性痴呆。以血管性痴呆实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察外泌体对慢性脑缺血性血管性痴呆发病过程中动物认知功能障碍、脑内病变的逆转效果。
在本发明的一个实施方式中,应用人多能干细胞外泌体治疗血管性痴呆。以血管性痴呆实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察外泌体对慢性脑缺血性血管性痴呆建立后的动物认知功能障碍、脑内病变的逆转效果。
在本发明的一个实施方式中,应用人多能干细胞外泌体治疗脑出血。以脑出血实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察外泌体对脑出血实验动物脑组织结构和功能的保护效果。
在本发明的一个实施方式中,应用人多能干细胞外泌体治疗脑梗塞。以脑梗塞实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察外泌体对脑梗塞实验动物脑组织结构和功能的保护效果。
本发明第三方面:
提供基于所述人多能干细胞外泌体的制剂,所述制剂选择以下形式中的任一种:
a、悬浮剂:将所述人多能干细胞外泌体溶于溶剂中,以悬浮剂的形式存在;
b、缓释外泌体的复合物:由人多能干细胞外泌体形成缓释外泌体的复合物;
c、以人多能干细胞外泌体作为添加剂:以人多能干细胞外泌体作为功效成分的添加剂。
在本发明的一个实施方式中,悬浮剂的溶剂为生理盐水或磷酸盐缓冲液或基础细胞培养基。所述悬浮剂可通过静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾等形式进行使用。
在本发明的一个实施方式中,所述缓释外泌体的复合物采用立体定向脑内注射、侧脑室内注射、鞘内注射等形式使用。
本发明第四方面:
提供负载奥替普拉的人多能干细胞外泌体,包括人多能干细胞外泌体及包裹在人多能干细胞外泌体内的奥替普拉。
在本发明的一个实施方式中,所述人多能干细胞外泌体为本发明第一方面所述外泌体。
在本发明的一个实施方式中,所述奥替普拉的包裹浓度为0.1-50μg/ml。
本发明第五方面:
提供所述负载奥替普拉的人多能干细胞外泌体的制备方法,通过孵育、电转、挤压、超声、冻融或皂素处理的方法将一定剂量的奥替普拉包裹入人多能干细胞外泌体。
在本发明的一个实施方式中,孵育的处理技术主要按以下方法进行:将一定浓度的外泌体悬浮液和药物溶液混合,置于一定温度下孵育一定时间。随后将上述溶液置于一定截留分子量的超滤管中,利用生物相容性介质超滤洗涤三次,得到载药的外泌体。本方法中,外泌体悬液的浓度范围为1×106/ml–1×1012/ml,优选为1×1010/ml;孵育温度的范围为4℃–50℃,优选为37℃;孵育时间范围为1h–48h,优选为4h;超滤管的截留分子量范围为10kda–5000kda,优选为100kda;生物相容性介质为生理盐水,生理缓冲液,细胞培养基等。
在本发明的一个实施方式中,冻融的处理技术主要按以下方法进行:将一定浓度的外泌体悬浮液和药物溶液混合,置于一定温度的冰箱中进行冷冻。随后解冻,再冷冻,如此循环一定次数。最后,将上述溶液置于一定的截留分子量的超滤管中,利用生物相容性介质超滤洗涤三次,得到载药的外泌体。本方法中,外泌体悬液的浓度范围为1×106/ml–1×1012/ml,优选为1×1010/ml;冷冻温度范围为-10℃--200℃,,优选为-80℃;循环次数为1–20次,优选为3次;超滤管的截留分子量范围为10kda–5000kda,优选为100kda;生物相容性介质为生理盐水,生理缓冲液,细胞培养基等。
在本发明的一个实施方式中,电转的处理技术主要按以下方法进行:将一定浓度的外泌体悬浮液与药物溶液和电转液混合,置于电转仪中,在一定条件下电转一定时间。随后,将上述溶液置于一定的截留分子量的超滤管中,利用生物相容性介质超滤洗涤三次,得到载药的外泌体。本方法中,外泌体悬液的浓度范围为1×106/ml–1×1012/ml,优选为1×1010/ml;电转液为kcl、k3po4和optipreptm细胞梯度离心液的混合溶液,其中kcl的浓度范围为1mm–1m,优选为25mm,k3po4的浓度范围为0.01mm-1m,优选为1.15mm,optipreptm细胞梯度离心液的体积分数范围为80%-0.1%,优选为21%;电转参数中电压的范围为10kv–0.1v,优选为400v,电容的范围为0.1–1000f,优选为150f;电转时间范围为0.1s–1min,优选为10s;超滤管的截留分子量范围为10kda–5000kda,优选为100kda;生物相容性介质为生理盐水,生理缓冲液,细胞培养基等。
在本发明的一个实施方式中,超声的处理技术主要按以下方法进行:将一定浓度的外泌体悬浮液与药物溶液混合,利用针式超声仪在一定条件下对上述混合溶液超声一定时间。随后,将上述溶液置于一定的截留分子量的超滤管中,利用生物相容性介质超滤洗涤三次,得到载药的外泌体。本方法中,外泌体悬液的浓度范围为1×106/ml–1×1012/ml,优选为1×1010/ml;超声条件中,电压的范围为1kv–1v,优选为500v,频率的范围为1hz–20khz,优选为2khz,循环次数的范围为1–100次,优选为6次,循环中超声输出时间为1s–60s,优选为5s,间隔时间的范围为1s–300s,优选为5s;超滤管的截留分子量范围为10kda–5000kda,优选为100kda;生物相容性介质为生理盐水,生理缓冲液,细胞培养基等。
在本发明的一个实施方式中,通过常规的超滤、超速离心或者脱盐柱等手段将包裹药物奥替普拉的外泌体与游离的药物奥替普拉分离。
在本发明的一个实施方式中,通过高效液相色谱(highperformanceliquidchromatography,hplc)对人多能干细胞外泌体负载奥替普拉的效率进行检测分析,最终获得人多能干细胞外泌体负载奥替普拉的纳米药物递送体系。
本发明第六方面:
提供所述负载奥替普拉的人多能干细胞外泌体作为制备治疗神经系统疾病用药物的应用。包括以下用途中的一种或几种:
a、作为制备治疗神经系统退行性疾病的药物或保健品应用,神经系统退行性疾病包括阿尔茨海默病、帕金森病、亨廷顿病等;
b、作为制备预防和/或治疗血管性痴呆的药物或保健品应用:血管性痴呆包括脑梗塞性血管性痴呆、脑出血性血管性痴呆、低灌注性血管性痴呆等;
c、作为制备治疗脑出血、脑梗塞等神经系统疾病的药物或保健品的应用。
在本发明的一个实施方式中,应用负载奥替普拉的人多能干细胞外泌体治疗阿尔兹海默病。以阿尔兹海默病实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察负载奥替普拉的外泌体对阿尔兹海默病动物认知功能障碍、脑内病变的逆转效果。
在本发明的一个实施方式中,应用负载奥替普拉的人多能干细胞外泌体预防血管性痴呆。以血管性痴呆实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察负载奥替普拉的外泌体对慢性脑缺血性血管性痴呆发病过程中动物认知功能障碍、脑内病变的逆转效果。
在本发明的一个实施方式中,应用负载奥替普拉的人多能干细胞外泌体治疗血管性痴呆。以血管性痴呆实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察负载奥替普拉的外泌体对慢性脑缺血性血管性痴呆建立后的动物认知功能障碍、脑内病变的逆转效果。
在本发明的一个实施方式中,应用负载奥替普拉的人多能干细胞外泌体治疗脑出血。以脑出血实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察负载奥替普拉的外泌体对脑出血实验动物脑组织结构和功能的保护效果。
在本发明的一个实施方式中,应用负载奥替普拉的人多能干细胞外泌体治疗脑梗塞。以脑梗塞实验动物为模型,静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾人多能干细胞外泌体的悬液,观察负载奥替普拉的外泌体对脑梗塞实验动物脑组织结构和功能的保护效果。
本发明第七方面:
提供基于所述负载奥替普拉的人多能干细胞外泌体的制剂,所述制剂选择以下形式中的任一种:
a、悬浮剂:将所述负载奥替普拉的人多能干细胞外泌体溶于溶剂中,以悬浮剂的形式存在;
b、缓释外泌体的复合物:由所述负载奥替普拉的人多能干细胞外泌体形成缓释外泌体的复合物;
c、以负载奥替普拉的人多能干细胞外泌体作为添加剂:以所述负载奥替普拉的人多能干细胞外泌体作为功效成分的添加剂。
在本发明的一个实施方式中,悬浮剂的溶剂为生理盐水或磷酸盐缓冲液或基础细胞培养基。所述悬浮剂可通过静脉注射或口服或直接在组织损伤部位注射(如立体定向脑内注射、侧脑室内注射、鞘内注射等)或鼻腔喷雾等形式进行使用。
在本发明的一个实施方式中,所述缓释外泌体的复合物采用立体定向脑内注射、侧脑室内注射、鞘内注射等形式使用。
奥替普拉(oltipraz,olt),即5-(2-吡嗪基)-4-甲-1,2-二羟基-3-硫酮,商品名为吡噻硫酮,分子式为csh6n2s3,分子量为226.34。它是从十字花科蔬菜等绿色植物中提取的巯基化合物,最早用于血吸虫病的治疗。现有研究表明,奥替普拉是一种抗氧化剂,具有抗氧化作用,结构与还原性谷胱甘肽相似,具有外源性化学物质的解毒、抗氧化剂的保护作用、细胞周期调控和参与应激反应的功能。如奥替普拉可促进皮肤成纤维细胞的增殖,从而促进大鼠皮肤缺损的修复。奥替普拉也可通过抑制肝脏x受体α的活性发挥抗脂肪变性的功能,从而显著降低非酒精性脂肪性肝病患者的肝脏脂肪和体重指数,而不增加包括肝纤维化加重等不良事件,并且耐受性良好。目前奥替普拉已经被fda批准应用于治疗脂肪肝和肝纤维化的三期临床试验。但是奥替普拉的副作用也很多,如恶心、呕吐、腹痛、头痛、头晕、嗜睡,甚至肢端感觉异常,这制约了其广泛应用。脂质体及纳米乳等是奥替普拉的剂型研究的热点。
外泌体是细胞分泌的天然纳米载体,与人工合成的纳米载体相比,外泌体在药物释放领域的应用具有独特的优势。外泌体的组成成分均来源于细胞,避免了人工合成的脂质体、高分子、纳米硅等材料的使用带来的细胞毒性、生物相容性等问题。人多能干细胞外泌体具有抗炎、免疫调节、促进细胞增殖与迁移,清除衰老细胞等功能,且外泌体可通过粘膜屏障或皮肤屏障或血脑屏障直接进入组织细胞内。
利用干细胞外泌体作为纳米载体既可以实现药物的有效递送,同时又可以充分发挥干细胞外泌体的功能,起到更好的疾病治疗效果。在众多种类的干细胞中,多能干细胞(胚胎干细胞、诱导多能干细胞)具有强大的增殖扩增能力,可以实现产业化生产以满足治疗需求。
本发明利用胚胎干细胞与诱导人多能干细胞来源的外泌体作为奥替普拉的药物载体,大大提高奥替普拉的生物学效应并减少其副作用,再结合人多能干细胞外泌体自身的功能,可以大大提高其对于神经系统疾病的治疗效果。
附图说明
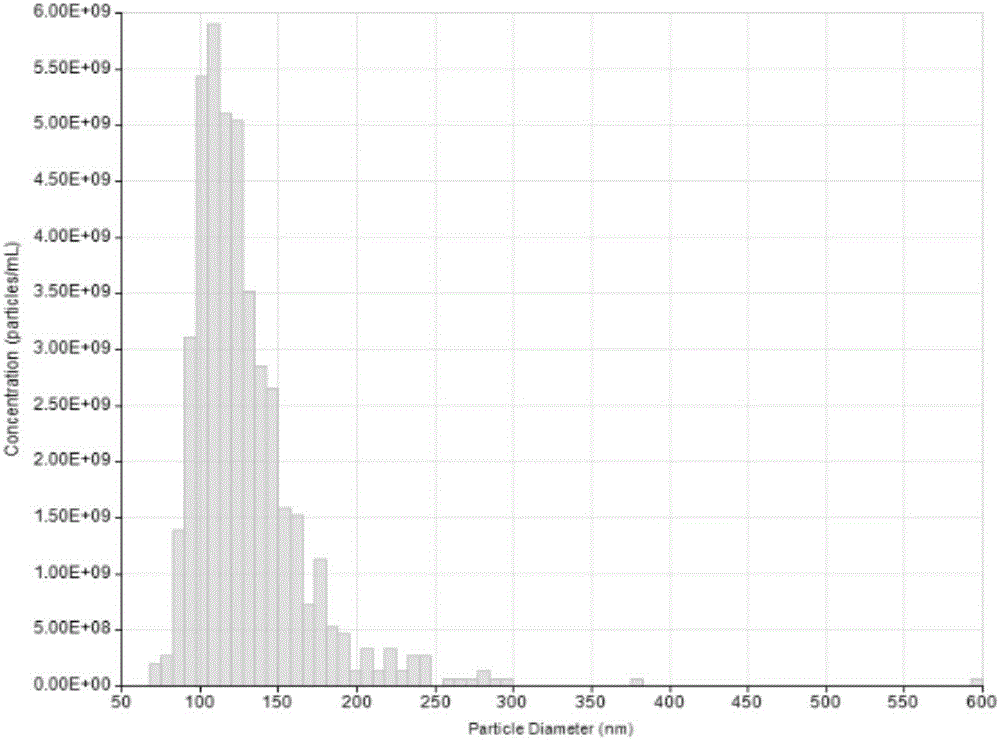
图1:人多能干细胞分泌的外泌体(esc-exos)粒径分布图。
图2:外泌体标志物鉴定。
图3:olt的hplc标准定量曲线。
图4:esc-exos包裹olt的hplc检测结果。
图5:esc-exos和esc-exos-olt治疗阿尔兹海默病。水迷宫定位航行试验检测各组大鼠认知功能(a,b);水迷宫定位航行试验检测各组大鼠认知功能(a,b);水迷宫空间探索实验检测各组大鼠认知功能(c,d);尼氏体染色检测各组大鼠海马区神经元密度(e,f);westernblot检测各组大鼠海马psd-95、synaptophysin的表达水平(g);免疫荧光染色检测各组大鼠海马内aβ的表达水平(h)。
图6:esc-exos和esc-exos-olt预防血管性痴呆。水迷宫定位航行试验检测各组大鼠认知功能(a,b);水迷宫定位航行试验检测各组大鼠认知功能(a,b);水迷宫空间探索实验检测各组大鼠认知功能(c,d);尼氏体染色检测各组大鼠海马区神经元密度(e,f)。
图7:esc-exos和esc-exos-olt治疗血管性痴呆。水迷宫定位航行试验检测各组大鼠认知功能(a,b);水迷宫定位航行试验检测各组大鼠认知功能(a,b);水迷宫空间探索实验检测各组大鼠认知功能(c,d);尼氏体染色检测各组大鼠海马区神经元密度(e,f)。
图8:esc-exos和esc-exos-olt治疗脑出血。mnss神经功能评分检测各组大鼠的神经功能(a);免疫组化染色检测各组大鼠脑出血后脑组织的炎性因子nk-kb的表达量(b,c);免疫组化染色检测各组大鼠脑出血后脑组织的炎性因子mmp-9的表达量(d,e)。
图9:esc-exos和esc-exos-olt治疗脑梗塞。mnss神经功能评分检测各组大鼠的神经功能(a);ttc染色检测各组大鼠脑组织梗塞体积的百分比(b,c);免疫荧光cd31染色检测各组大鼠脑梗塞后脑组织内的微血管数量(d,e)。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例1:
人胚胎干细胞(escs)的培养和外泌体的提取与鉴定
在培养皿中铺一层胚胎干细胞基质胶(esc-qualifiedbdmatrigel,bd
es-exo的形态通过透射电镜(tem)观察。将载样铜网(孔径2nm)固定在支架上,将20μl样本滴加到铜网上,室温静置3分钟后,在铜网一侧用滤纸将液体吸去,滴加3%磷钨酸溶液30μl对样本进行负染(室温,5分钟)。用滤纸吸去负染液,将铜网转移至透射电子显微镜下,观察外泌体形态。
es-exo的粒径和浓度通过纳米粒子分析系统(izonqnano,newzealand)进行检测,按照操作说明书调节仪器各项参数:将nanopore(np100)安装到加样孔下方,调节stretch至43cm,向加样孔内加入40μlpbs,使电流稳定在100-120na范围内。吸去pbs,加入40μl1:100稀释的cpc100标准品(粒径70nm),测量粒子数和浓度,通过软件得到标准曲线。吸去标准品,pbs洗3次,加入40μl1:1000稀释的待测样品,测定粒子数和浓度,重复测量3次。通过软件进行数据分析,得出分析报告。结果显示粒径范围为50-150nm,见图1。
通过westernblot检测es-exo特异性表面标志物cd9和cd63的表达。具体步骤:外泌体总蛋白提取,通过bca蛋白分析试剂盒检测样本蛋白浓度,制胶配制10%的分离胶,电泳,转膜,封闭及抗体孵育,化学发光成像分析仪观察条带显影情况。结果所提取的外泌体均表达特异性表面标志物cd9和cd63。见图2。
实施例2
人诱导人多能干细胞(ipscs)的培养和外泌体的提取与鉴定
在培养皿中铺一层胚胎干细胞基质胶(esc-qualifiedbdmatrigel,bd
ips-exo的形态通过透射电镜(tem)观察。将载样铜网(孔径2nm)固定在支架上,将20μl样本滴加到铜网上,室温静置3分钟后,在铜网一侧用滤纸将液体吸去,滴加3%磷钨酸溶液30μl对样本进行负染(室温,5分钟)。用滤纸吸去负染液,将铜网转移至透射电子显微镜下,观察外泌体形态。
ips-exo的粒径和浓度通过纳米粒子分析系统(izonqnano,newzealand)进行检测,按照操作说明书调节仪器各项参数:将nanopore(np100)安装到加样孔下方,调节stretch至43cm,向加样孔内加入40μlpbs,使电流稳定在100-120na范围内。吸去pbs,加入40μl1:100稀释的cpc100标准品(粒径70nm),测量粒子数和浓度,通过软件得到标准曲线。吸去标准品,pbs洗3次,加入40μl1:1000稀释的待测样品,测定粒子数和浓度,重复测量3次。通过软件进行数据分析,得出分析报告。
通过westernblot检测ips-exo特异性表面标志物cd9和cd63的表达。具体步骤:外泌体总蛋白提取,通过bca蛋白分析试剂盒检测样本蛋白浓度,制胶配制10%的分离胶,电泳,转膜,封闭及抗体孵育,化学发光成像分析仪观察条带显影情况。结果所提取的外泌体均表达特异性表面标志物cd9和cd63。
实施例3
人esc来源外泌体(esc-exos)通过共孵育法包裹奥替普拉(olt)
esc-exos溶液来自实施例1。
olt的定量标准曲线测定:准确称取1mg的olt粉末溶解于1ml的甲醇中,随后将该溶液用甲醇进行稀释,配置成50μg/ml,20μg/ml,10μg/ml的olt的甲醇标准溶液,hplc进样。色谱条件如下:
色谱柱:zorbaxextendc-18,150*4.6μm,5–micro
流动相:甲醇:水=95:5
流速:1ml/min
柱温:室温
检测波长:305nm
获得相应的实验结果后,将色谱峰的峰面积(pa)作为olt浓度(c,μg/ml)的函数作图(如附图3),得到如下该色谱分离条件下olt的定量标准曲线:
pa=38.42c+71.12,r2=0.9991
奥替普拉的包裹:配制1mg/ml的奥替普拉(olt)的生理盐水溶液。取esc-exos溶液100μl(浓度1.0*1012/ml),向其中加入1ml的olt溶液。37℃孵育1h后,用5ml的生理盐水超滤洗涤溶液两次,留取200μl液体,得到负载olt的esc-exos溶液。随后,取50μl该溶液,利用200μl的乙腈进行稀释,12000rad/min下离心,除去蛋白沉淀,上清液在标准曲线的测定条件下,进行hplc检测。检测结果附图4所示,olt的包裹浓度为2μg/ml。
实施例4
应用人多能干细胞外泌体(esc-exos)及负载了奥替普拉的人多能干细胞外泌体(esc-exos-olt)治疗阿尔兹海默病
选择雄性c57bl/6(b6)小鼠,体重25-30g,共60只。实验分为六组,每组10只。阿尔茨海默病组小鼠共三组30只,给予立体定位注射aβl-42(4ug,i.c.v)至小鼠双侧海马,7天后开始治疗。第一对照组给予每天pbs灌胃,第二对照组给予每天2~5×108个esc-exos灌胃。第三对照组给予每天2~5×108个esc-exos-olt灌胃。第一阿尔兹海默组给予每天pbs灌胃,第二阿尔兹海默组给予每天2~5×108个esc-exos灌胃。第三阿尔兹海默组给予每天2~5×108个esc-exos-olt灌胃。连续灌胃2月,2月后进行认知功能及海马组织学检测。
首先进行各组小鼠水迷宫实验,分别通过定位航行试验和空间探索实验检测小鼠的空间学习能力和空间记忆能力。之后留取小鼠海马组织,通过westernblot技术检测不同组小鼠海马内aβ、psd-95和synaptophysin的蛋白表达水平。组织病理学和免疫荧光检测:小鼠生理盐水及4%多聚甲醛灌注后,置于4%多聚甲醛溶液固定(4℃,24-48h),15%、20%、30%蔗糖梯度脱水后,oct包埋,冰冻切片机进行厚度为10um连续切片,用于海马尼氏体染色及免疫荧光染色。
实验结果:定向航行试验结果显示阿尔茨海默组小鼠逃避潜伏期明显长于对照组,这种延长趋势在训练的第3、4、5天依然可见并保持在相对稳定的状态。经esc-exos和esc-exos-olt灌胃治疗的阿尔茨海默小鼠逃避潜伏期随着时间延长明显短于经pbs灌胃的阿尔茨海默小鼠,并且esc-exos-olt治疗效果好于esc-exos(图5,a-b)。在第6天的空间探索试验中,阿尔兹海默小鼠在目标象限内停留时间明显短于对照组小鼠,经esc-exos和esc-exos-olt灌胃治疗的阿尔茨海默小鼠在目标象限内停留时间长于经pbs灌胃的阿尔茨海默小鼠,并且esc-exos-olt治疗效果好于esc-exos(图5,c-d)。结果表明esc-exos和esc-exos-olt灌胃均能改善阿尔兹海默小鼠的认知功能,并且esc-exos-olt展示更强的治疗效果。尼氏体染色结果显示阿尔茨海默病小鼠海马尼氏体密度较对照组明显减少,esc-exos和esc-exos-olt灌胃均能保护阿尔茨海默小鼠海马尼氏体,避免其过度减少,且esc-exos-olt展示更强的保护效果(图5,e-f)。免疫荧光结果显示esc-exos和esc-exos-olt灌胃能减少阿尔兹海默小鼠海马内aβ蛋白的表达,并且esc-exos-olt外泌体减少海马内aβ蛋白的表达更明显(图5,h)。westernblot结果显示esc-exos和esc-exos-olt灌胃能增加阿尔兹海默小鼠海马内psd-95和synaptophysin的蛋白表达水平,并且esc-exos-olt外泌体增加海马内psd-95和synaptophysin蛋白表达更明显(图5,g)。
结果表明,esc-exos和esc-exos-olt均能明显改善阿尔兹海默病小鼠的认知功能,且以esc-exos-olt的效果最显著。
实施例5
应用人多能干细胞外泌体(esc-exos)及负载了奥替普拉的人多能干细胞外泌体(esc-exos-olt)预防血管性痴呆
选择雄性sd大鼠,体重280~300g,共40只。实验分为四组,每组10只。大鼠血管性痴呆模型采用2vd法(结扎并离断双侧颈总动脉),缺血2月后进行认知功能检测并确定模型制作成功。假手术组只暴露并分离双侧颈总动脉,但并不结扎。第一组血管性痴呆大鼠手术后给予连续尾静脉移植pbs;第二组血管性痴呆大鼠手术后给予连续尾静脉移植2~5×109个esc-exos;第三组血管性痴呆大鼠手术后给予连续尾静脉移植2~5×109个esc-exos-olt;假手术组大鼠给予连续尾静脉移植pbs。治疗时间为2月。2月后进行大鼠认知功能及海马组织学检测,以观察esc-exos及esc-exos-olt对血管性痴呆的预防功能。
首先进行各组小鼠水迷宫实验,分别通过定位航行试验和空间探索实验检测小鼠的空间学习能力和空间记忆能力。之后留取大鼠海马组织行组织病理学检测:大鼠经生理盐水及4%多聚甲醛灌注后,置于4%多聚甲醛溶液固定(4℃,24-48h),15%、20%、30%蔗糖梯度脱水后,oct包埋,冰冻切片机进行厚度为10um连续切片,用于海马尼氏体染色。
实验结果:定向航行试验结果显示血管性痴呆大鼠的逃避潜伏期明显长于对照组,这种延长趋势在训练的第3、4、5天依然可见并保持在相对稳定的状态。经esc-exos和esc-exos-olt尾静脉移植治疗的血管性痴呆大鼠逃避潜伏期随着时间延长明显短于经pbs尾静脉移植治疗的血管性痴呆大鼠,并且esc-exos-olt治疗效果好于esc-exos(图6,a-b)。在第6天的空间探索试验中,血管性痴呆大鼠在目标象限内停留时间明显短于对照组大鼠,经esc-exos和esc-exos-olt尾静脉移植治疗的血管性痴呆大鼠在目标象限内停留时间长于经pbs尾静脉移植治疗的血管性痴呆大鼠,并且esc-exos-olt治疗效果好于esc-exos(图6,c-d)。结果表明esc-exos和esc-exos-olt尾静脉移植均能预防血管性痴呆大鼠的认知功能恶化,并esc-exos-olt展示更强的预防效果。尼氏体染色结果显示血管性痴呆大鼠海马尼氏体密度较对照组明显减少,esc-exos和esc-exos-olt尾静脉移植均能保护血管性痴呆大鼠海马尼氏体,避免其因缺血过度减少,且esc-exos-olt展示更强的保护效果(图6,e-f)。
结果表明,esc-exos和esc-exos-olt均能预防血管性痴呆发病过程中的认知功能障碍,且以esc-exos-olt的效果最显著。
实施例6
应用人多能干细胞外泌体(esc-exos)及负载了奥替普拉的人多能干细胞外泌体(esc-exos-olt)治疗血管性痴呆
选择雄性sd大鼠,体重280~300g,共40只。实验分为四组,每组10只。大鼠血管性痴呆模型采用2vd法(结扎并离断双侧颈总动脉),缺血2月后进行认知功能检测并确定模型制作成功。假手术组只暴露并分离双侧颈总动脉,但并不结扎。第一组血管性痴呆大鼠术后2月开始连续尾静脉移植pbs;第二组血管性痴呆大鼠术后2月开始连续尾静脉移植2~5×109个esc-exos;第三组血管性痴呆大鼠术后2月开始连续尾静脉移植2~5×109个esc-exos-olt;假手术组大鼠术后2月开始连续尾静脉移植pbs。治疗时间为2月。2月后进行大鼠认知功能及海马组织学检测,以观察esc-exos及esc-exos-olt对血管性痴呆的治疗功能。
首先进行各组小鼠水迷宫实验,分别通过定位航行试验和空间探索实验检测小鼠的空间学习能力和空间记忆能力。之后留取大鼠海马组织行组织病理学检测:大鼠经生理盐水及4%多聚甲醛灌注后,置于4%多聚甲醛溶液固定(4℃,24-48h),15%、20%、30%蔗糖梯度脱水后,oct包埋,冰冻切片机进行厚度为10um连续切片,用于海马尼氏体染色。
实验结果:定向航行试验结果显示血管性痴呆大鼠的逃避潜伏期明显长于对照组,这种延长趋势在训练的第3、4、5天依然可见并保持在相对稳定的状态。经esc-exos和esc-exos-olt尾静脉移植治疗的血管性痴呆大鼠逃避潜伏期随着时间延长明显短于经pbs尾静脉移植治疗的血管性痴呆大鼠,并且esc-exos-olt治疗效果好于esc-exos(图7,a-b)。在第6天的空间探索试验中,血管性痴呆大鼠在目标象限内停留时间明显短于对照组大鼠,经esc-exos和esc-exos-olt尾静脉移植治疗的血管性痴呆大鼠在目标象限内停留时间长于经pbs尾静脉移植治疗的血管性痴呆大鼠,并且esc-exos-olt治疗效果好于esc-exos(图7,c-d)。结果表明esc-exos和esc-exos-olt尾静脉移植均能治疗血管性痴呆大鼠的认知功能恶化,并esc-exos-olt展示更强的治疗效果。尼氏体染色结果显示血管性痴呆大鼠海马尼氏体密度较对照组明显减少,esc-exos和esc-exos-olt尾静脉移植均能保护血管性痴呆大鼠海马尼氏体,避免其因缺血过度减少,且esc-exos-olt展示更强的保护效果(图7,e-f)。
结果表明,esc-exos和esc-exos-olt均能治疗血管性痴呆发病过程中的认知功能障碍,且以esc-exos-olt的效果最显著。
实施例7
应用人多能干细胞外泌体(esc-exos)及负载了奥替普拉的人多能干细胞外泌体(esc-exos-olt)治疗脑出血
选择雄性sd大鼠,体重280~300g,共40只。实验分为四组,每组10只。采用立体定向下大鼠脑内注射胶原酶vii-s(0.25u)制作大鼠脑出血模型。假手术组只暴露但并不注射。第一组脑出血大鼠术后第一天开始连续尾静脉移植pbs;第二组脑出血大鼠术后第一天开始连续尾静脉移植2~5×109个esc-exos;第三组脑出血大鼠术后第一天开始连续尾静脉移植2~5×109个esc-exos-olt;假手术组大鼠脑出血大鼠术后第一天开始连续尾静脉移植pbs。治疗时间为14天。不同时间点进行神经功能评分、血肿体积检测及脑内相关验证蛋白表达,以观察esc-exos及esc-exos-olt对脑出血的治疗功能。
首先进行不同时间点各组大鼠神经功能评分,采用mnss神经功能评分系统急性。术后第14天评分结束后,进行取材行组织病理学检测:大鼠经生理盐水及4%多聚甲醛灌注后,置于4%多聚甲醛溶液固定(4℃,24-48h),15%、20%、30%蔗糖梯度脱水后,oct包埋,冰冻切片机进行厚度为10um连续切片,进行出血侧脑组织免疫组化染色。
实验结果:对实验动物各时间点神经功能缺损进行评价,假手术组注射pbs对大鼠脑组织有损伤,实验干预后会存在短时的神经功能障碍,24h时神经功能恢复正常;脑出血组神经功能出现了明显的缺损72h达到峰值,神经功能缺损最重,以后缓慢下降。esc-exos和esc-exos-olt尾静脉移植后各时间点脑出血大鼠神经功能缺损较移植pbs轻,且尾静脉移植esc-exos-olt神经功能缺损最小(图8,a)。结果表明esc-exos和esc-exos-olt尾静脉移植均能减轻大鼠脑出血后的神经功能缺损,并esc-exos-olt展示更强的治疗效果。免疫组化nf-kb及mmp-9检测结果显示脑出血后血肿周边脑组织炎性因子nf-kb及mmp-9明显增高,esc-exos和esc-exos-olt尾静脉移植后血肿周边脑组织炎性因子nf-kb及mmp-9表达量较移植pbs明显减少,且尾静脉移植esc-exos-olt减少更明显(图8,b-e)。结果表明esc-exos和esc-exos-olt尾静脉移植均能减轻大鼠脑出血后的炎性反应,并esc-exos-olt展示更强的治疗效果。
结果表明,esc-exos和esc-exos-olt均能对脑出血有治疗效果,且以esc-exos-olt的效果最显著。
实施例8
应用人多能干细胞外泌体(esc-exos)及负载了奥替普拉的人多能干细胞外泌体(esc-exos-olt)治疗脑梗塞
选择雄性sd大鼠,体重250~280g,共40只。实验分为四组,每组10只。采用线栓法大鼠大脑中动脉栓塞制作大鼠脑缺血模型。假手术组只暴露但并不栓塞。第一组脑缺血大鼠术后第一天开始连续尾静脉移植pbs;第二组脑缺血大鼠术后第一天开始连续尾静脉移植2~5×109个esc-exos;第三组脑出血大鼠术后第一天开始连续尾静脉移植2~5×109个esc-exos-olt;假手术组大鼠脑出血大鼠术后第一天开始连续尾静脉移植pbs。治疗时间为28天。不同时间点进行神经功能评分、梗塞体积检测、新生血管数量等,以观察esc-exos及esc-exos-olt对脑梗塞的治疗功能。
首先进行不同时间点各组大鼠神经功能评分,采用mnss神经功能评分系统急性。于术后1天、7天、28天取新鲜脑组织行ttc染色。术后第28天评分结束后,进行取材行组织病理学检测:大鼠经生理盐水及4%多聚甲醛灌注后,置于4%多聚甲醛溶液固定(4℃,24-48h),15%、20%、30%蔗糖梯度脱水后,oct包埋,冰冻切片机进行厚度为10um连续切片,进行出血侧脑组织免疫荧光染色。
实验结果:对实验动物各时间点神经功能缺损进行评价,假手术组注射pbs对大鼠脑组织有损伤,实验干预后会存在短时的神经功能障碍,7天后神经功能恢复正常;脑梗塞组神经功能出现了明显的缺损,7天达到峰值,神经功能缺损最重,以后缓慢下降。esc-exos和esc-exos-olt尾静脉移植后各时间点脑出血大鼠神经功能缺损较移植pbs轻,且尾静脉移植esc-exos-olt神经功能缺损最小(图9,a)。结果表明esc-exos和esc-exos-olt尾静脉移植均能减轻大鼠脑梗塞后的神经功能缺损,并esc-exos-olt展示更强的治疗效果。ttc染色结果显示脑梗塞后第1天三组脑梗塞大鼠均出现脑梗塞,且梗塞体积无明显差异。第7天后第28天esc-exos和esc-exos-olt尾静脉移植后大鼠脑梗塞体积明显较pbs组少,且esc-exos-olt展示更强的治疗效果(图8,b-c)。免疫荧光cd31结果显示esc-exos和esc-exos-olt尾静脉移植能促进梗塞侧脑组织内的血管新生,且esc-exos-olt展示更强的促血管新生功能(图8,d-e)。
结果表明,esc-exos和esc-exos-olt均能对脑梗塞有治疗效果,且以esc-exos-olt的效果最显著。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!