具有1,2,3-三氮唑结构片段的生物碱化合物在制备促血管生成药物中的应用的制作方法
本发明涉及一种生物碱化合物的应用,尤其是具有1,2,3-三氮唑结构片段的生物碱化合物在制备促血管生成药物中的应用。
背景技术:
血管生成(AngiogenesiS)是指在已有微血管基础上形成以毛细血管为主的新生血管系统。血管内皮细胞存在于血管内壁,对维持血管的完整结构及功能具有重要作用。自噬反应广泛存在于机体各细胞中,参与细胞内的物质转化,清除错误折叠的蛋白和衰老或损伤的细胞器,通过自我消化可为饥饿期的细胞提供能量来源。自噬反应受多种信号通路调控,与血管内皮细胞的增殖、迁移和血管生成有关。促血管生成对许多疾病的治疗是十分有益的,如对骨折及创伤病人,利用药物促进其创伤局部的血管生成,可以改善局部血液供应,加快愈合;对缺血性疾病的治疗:如动脉粥样硬化,糖尿病血管病变和周围动脉闭塞性疾病日益增多,部分血管病变范围过重,手术治疗效果不佳,利用化合物刺激血管生成已经成为一种新兴的治疗策略。
1,2,3-三氮唑结构是一种非常重要的结构单元,它作为合成抗生素侧链的连接物,是许多抗生素(如β-内酰胺类抗生素)不可缺少的中间体:作为青霉烷砜类β-内酰胺酶抑制剂的泰唑巴坦的关键中间体就是1,2,3-三氮唑,该药物在临床上广泛应用于治疗多种细菌包括需氧菌和厌氧菌引起的感染,它具有毒性低、稳定性好、抑酶活性强的特点。除此以外1,2,3-三氮唑还可合成多种复杂的化合物,具有易于制备、稳定性良好和可形成多种非共价键作用等诸多优点,在药物有机合成领域具有广泛的应用前景。目前,研究人员通过对三氮唑结构衍生物的生物活性进行试验,发现该类衍生物具有杀菌消炎、抗肿瘤、抗结核、抗利什曼原虫、抗病毒和抗微生物等诸多优点。
已有研究报道,具有1,2,3-三氮唑结构片段的生物碱化合物5-(1-(4- 氟苄基)-1H-1,2,3-三唑-4-基)-2-甲基-N-(2-吗啉代乙基)苯甲酰胺其结构式为:
对Keap1-Nrf2的蛋白-蛋白相互作用具有一定的抑制活性,由此可能对肿瘤、炎症、抗帕金森病及抗老年痴呆症具有预防和/或治疗作用,见专利号为 ZL201610281376.3。但经权威机构检索查新,有关该三氮唑化合物在促进血管生成中的作用及应用,目前国内外尚未见报道。
技术实现要素:
基于上述现有技术,提出下述发明:
本发明的第一方面,提供具有1,2,3-三氮唑结构片段的生物碱化合物在如下1)-3)至少一项中的应用:
1).制备促血管生成的药物;
2).制备治疗缺血性疾病的药物;
3).制备促进创伤愈合的药物。
优选的,所述1,2,3-三氮唑结构片段的生物碱化合为5-(1-(4-氟苄基) -1H-1,2,3-三唑-4-基)-2-甲基-N-(2-吗啉代乙基)苯甲酰胺。
优选的,所述5-(1-(4-氟苄基)-1H-1,2,3-三唑-4-基)-2-甲基-N- (2-吗啉代乙基)苯甲酰胺的有效剂量为5-20μM。
优选的,所述5-(1-(4-氟苄基)-1H-1,2,3-三唑-4-基)-2-甲基-N- (2-吗啉代乙基)苯甲酰胺的有效剂量为10μM。
优选的,所述5-(1-(4-氟苄基)-1H-1,2,3-三唑-4-基)-2-甲基-N-(2- 吗啉代乙基)苯甲酰胺通过诱导内皮细胞的自噬来促进内皮细胞迁移与血管生成。
优选的,所述5-(1-(4-氟苄基)-1H-1,2,3-三唑-4-基)-2-甲基-N- (2-吗啉代乙基)苯甲酰胺通过诱导内皮细胞的自噬降解血管生成抑制因子- 人重组干扰素10(IP10)来促进内皮细胞迁移与血管生成。
优选的,所述缺血性疾病包括动脉粥样硬化、糖尿病血管病变、周围动脉闭塞性疾病、肢体缺血疾病、缺血性脑血管病、缺血性心血管病和缺血性肠病。
优选的,所述创伤愈合包括骨折愈合、溃疡愈合和伤口缝合。
有益效果
本发明为研究内皮细胞血管生成和内皮细胞自噬之间的关联提供了一个强有力的化学工具,本发明涉及的5-(1-(4-氟苄基)-1H-1,2,3-三唑-4- 基)-2-甲基-N-(2-吗啉代乙基)苯甲酰胺(以下简称JL025)能作为一种先导化合物,为研制开发有关促进血管生成从而治疗缺血性病变及促进创伤愈合的药物奠定了基础。
附图说明
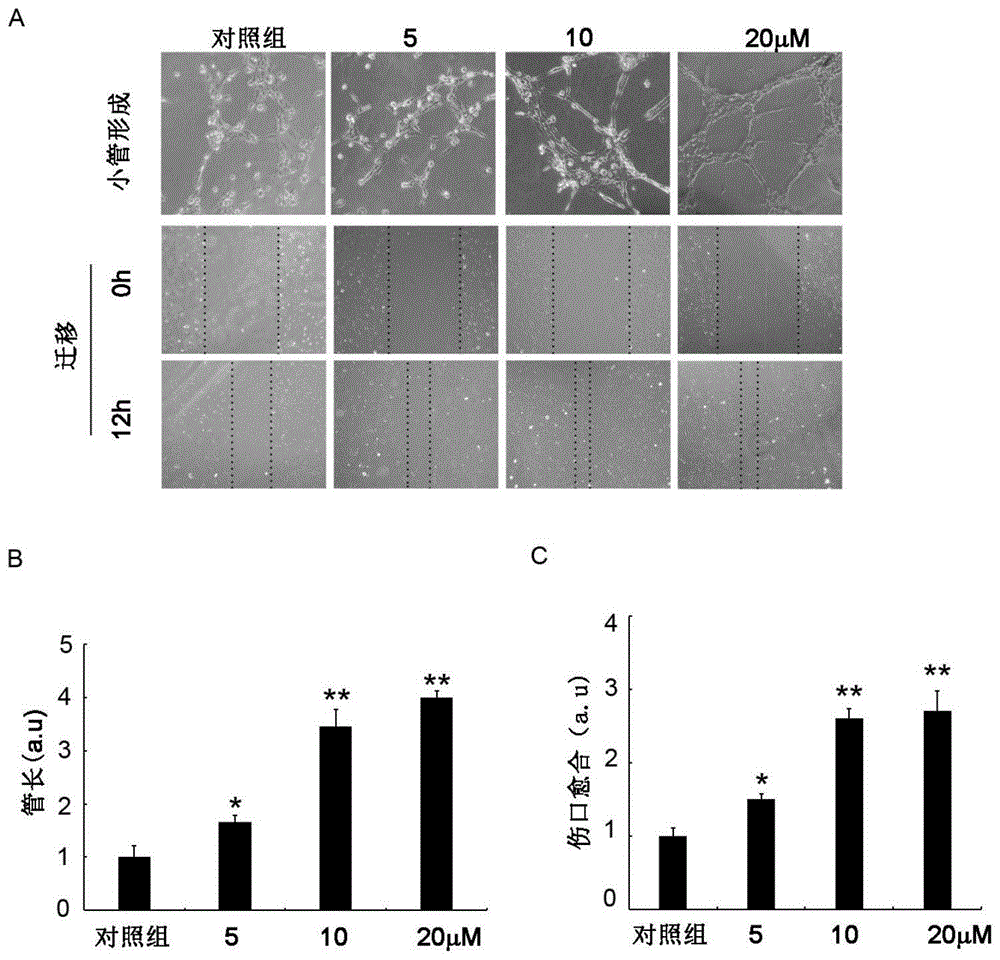
图1 JL025具有促进内皮细胞的迁移和成血管的能力。图中,A:光学显微镜下成血管与内皮细胞的迁移;B:JL025对血管长度的影响;C:JL025对伤口愈合的影响(*,P<0.05;**,P<0.01)。
图2 JL025体内促进血管生成。图中,A:Matrigel胶表面血管与激光扫描共聚焦显微镜下的血管密度;B:试验组中血管生成面积与基质胶面积比 (*,P<0.05;**,P<0.01)。
图3 JL025对内皮细胞增殖不产生影响。
图4 JL025能够诱导内皮细胞自噬的发生。图中,A:激光扫描共聚焦显微镜下的免疫荧光图片;B:不同JL025浓度下LC3点状聚集阳性细胞数;C:不同JL025浓度下单个细胞LC3点状聚集数;D:不同JL025浓度下LC3-Ⅱ的相对水平;
图5 JL025通过自噬调节血管生成。图中,A:光学显微镜下成血管与内皮细胞的迁移;B:试验组对血管长度的影响;C:试验组对伤口愈合的影响; D:Matrigel胶表面血管与激光扫描共聚焦显微镜下的血管密度;E:试验组中血管生成面积与基质胶面积比(*,P<0.05;**,P<0.01)。
图6 JL025通过抑制血管生成抑制因子-干扰素诱导蛋白10(IP10)蛋白水平促进血管生成。图中,A:不同JL025浓度下细胞上清中的IP10含量;B: western blot检测不同JL025浓度下内皮细胞中IP10蛋白表达水平;C:不同JL025浓度下IP10的相对含量水平;D:光学显微镜下成血管与内皮细胞的迁移;E:试验组对血管长度的影响;F:试验组对伤口愈合的影响(*,P<0.05; **,P<0.01)。
图7 JL025通过自噬途径降解IP10。图中,A:加入3-MA后western blot 检测试验结果;B:加入3-MA的试验组中IP10蛋白表达水平;C:干扰掉 ATG5western blot检测试验结果;D:干扰掉ATG5的试验组中IP10蛋白表达水平;E:加入3-MA的试验组中细胞上清中的IP10含量;F:干扰掉ATG5 的试验组中细胞上清中的IP10含量(*,P<0.05;**,P<0.01)。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
正如背景技术部分介绍的,自噬反应受多种信号通路调控,与血管内皮细胞的增殖、迁移和血管生成有关,对促进血管生成重要作用。本发明研究了JL025对内皮细胞自噬的影响,以及内皮细胞自噬与内皮细胞的迁移和血管生成的影响。由此提出了本发明。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中,所用到的部分试验材料如下:
本发明中所使用的JL025采用申请号为:201610281376.3“一种具有 1,2,3-三氮唑结构片段的生物碱化合物及其用途”专利中所公开的如下方法制备:
(1)5.0g 5-溴-2-甲基苯甲酸甲酯与2.57g三甲基硅乙炔在1.5g三乙胺催化作用下经Sonogashira偶联反应,生成2-甲基-5-((三甲基硅)乙炔基)苯甲酸甲酯;反应溶剂为25ml N,N-二甲基甲酰胺;该反应温度为20℃,反应时间为10小时。
(2)3.9g 2-甲基-5-((三甲基硅)乙炔基)苯甲酸甲酯在2.48g氢氧化钾催化作用下脱去三甲基硅基并进行酯水解反应生成5-乙炔基-2-甲基苯甲酸;该反应所用溶剂为50ml甲醇,该反应温度为20℃,反应时间为10小时。
(3)2.5g 5-乙炔基-2-甲基苯甲酸与4.06g 4-(2-氨乙基)吗啉进行缩合反应,生成5-乙炔基-2-甲基-N-(2-吗啉代乙基)苯甲酰胺;所用缩合剂为3.22g N,N'-二环己基碳二亚胺(DCC),该反应所用溶剂为30ml N,N-二甲基甲(乙)酰胺,该反应温度为20℃,反应时间为10小时。
(4)0.5g 5-乙炔基-2-甲基-N-(2-吗啉代乙基)苯甲酰胺与0.34g对氟苄溴进行Click Chemistry反应得到5-(1-(4-氟苄基)-1H-1,2,3- 三唑-4-基)-2-甲基-N-(2-吗啉代乙基)苯甲酰胺。其中,Click Chemistry 反应作用试剂为0.12g叠氮化钠;该反应所用溶剂为15ml甲醇,该反应温度为20℃,反应时间为10小时。
所得化合物分子式为:
实施例1:JL025具有促进内皮细胞的迁移和成血管的能力
1.实验方法1
将内皮细胞接种于直径6cm的培养皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为5μM、10μM和20μM 的JL025培养。待细胞平铺面积达80%后,用1mL的枪头在培养皿内划痕,用PBS洗去脱落细胞,于光学显微镜下对划痕进行拍照。于培养箱中培养12 h,再次于显光学微镜下拍照。用image J软件计算加药前后划痕面积,计算面积比。面积比=(加药前初始划痕面积-加药12h后划痕面积)/(加药前初始划痕面积)×100%。
2.实验方法2
将提前融化的matrigel胶以1:1的比例和原液混合加入24孔板,铺满孔底,在培养箱内静置1h使胶凝固。接种1×105个细胞入孔内,待细胞与基质胶融合,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为5μM、10μM和20μM的JL025培养。于光学显微镜下进行拍照。于培养箱中培养12h,再次于显光学微镜下拍照。
3.实验结果:
用浓度为5μM、10μM和20μM的JL025对内皮细胞进行处理后,细胞划痕和matrigel胶成血管实验表明JL025能够促进内皮细胞的迁移和成血管 (见图1)。
实施例2:JL025体内促进血管生成
1.实验方法
8周龄的C57BL/6J雄性小鼠,购自山东大学动物实验中心。用1%水合氯醛麻醉小鼠,剔除背部鼠毛,去毛面积约为4cm2,用75%酒精消毒背部皮肤。
每组两只,各注射500L提前融化的matrigel胶。分为基质胶+肝素组 (100U)和基质胶+肝素(100U)+JL025(10mM)组。Matrigel胶在小鼠体温下很快凝固。3周之后,将C57BL/6J雄性小鼠脱臼处死,取出背部的Matrigel胶,观察表面血管并进行图片采集。
图片采集结束后,将Matrigel Plus用4%多聚甲醛固定4h,置入30%的蔗糖中脱水至沉底,然后用OTC包埋胶块,进行冷冻切片(60μm)。
通过免疫荧光染色法检测血管密度:将切片取出复温,然后0.1M PBS冲洗2次,每次15min;0.5%Triton-X-100透化30min;驴血清工作液(solarbio 公司购入)封闭30min;弃掉封闭液,加入内皮细胞marker CD31一抗(1:50 抗体稀释液稀释),置于湿盒中4℃孵育过夜(18h以上);恢复到室温,弃掉一抗,用0.1M PBS冲洗3次,每次5min;弃掉PBS,加入荧光基团标记的山羊-488二抗(抗体稀释液1:200稀释),37℃下孵育50min;恢复到室温,弃掉二抗,用0.1M PBS缓冲液洗3次,每次5min;DAPI应用液避光孵育20min,用0.1M PBS缓冲液洗3次,每次5min;用激光扫描共聚焦显微镜观察。
2实验结果
四组Matrigel Plus血管新生对比之后发现,JL025的加入能促进小鼠体内血管生成(见图2)。
实施例3:JL025对内皮细胞增殖不产生影响
1.实验方法
将内皮细胞接种于直径3cm的共聚焦小皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为5μM、10μM和 20μM的JL025培养。37℃,CO2孵箱内培养12小时之后,EdU-594试剂盒检测细胞增殖的变化。将37℃预热的2X EdU工作液等体积加入共聚焦小皿中,继续37℃,CO2孵箱内孵育2个小时。弃去旧培养液,用洗涤液轻轻冲洗细胞 2次;弃掉洗涤液,室温下用4%多聚甲醛固定细胞15min;弃掉4%多聚甲醛,用洗涤液冲洗3次,每次5min;弃掉洗涤液,用通透液室温孵育10min;去除通透液,用洗涤液冲洗3次,每次5min;去除洗涤液,每皿加入0.5ml Click反应液,室温避光孵育30min;吸除Click反应液,用洗涤液冲洗3次,每次5min;吸除洗涤液,每皿加入1ml hoechst 33342溶液,避光孵育10min,吸除hoechst 33342溶液,用洗涤液冲洗3次,每次5min。用倒置荧光显微镜进行荧光检测确定细胞增殖情况。
2.实验结果
用浓度为5μM、10μM和20μM的JL025对内皮细胞进行处理后,EdU 细胞增殖实验表明内皮细胞的增殖没有影响(见图3)。
实施例4:JL 025能够诱导内皮细胞自噬的发生
1.实验方法1
将内皮细胞接种于直径6cm的培养皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为5μM、10μM和20μM 的JL025培养。37℃,CO2孵箱内培养6,12小时之后裂解细胞,收集细胞裂解液,4℃12000g离心15min,取上清,western blot检测内皮细胞中不同时间LC3的表达水平。
2.实验方法2
将内皮细胞接种于直径3cm的共聚焦小皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为5μM、10μM和20 μM的JL025培养。37℃,CO2孵箱内培养6小时之后,弃去旧培养液,用0.1M PBS轻轻冲洗细胞2次;弃掉0.1M PBS,室温下用4%多聚甲醛固定细胞 15min;弃掉4%多聚甲醛,用0.1M PBS冲洗3次,每次5min;弃掉PBS,加入配制好的30%正常血清封闭液,室温下封闭20-40min;弃掉封闭液,加入LC3一抗(1:100抗体稀释液稀释),置于湿盒中4℃孵育过夜(18h以上);恢复到室温,弃掉一抗,用0.1M PBS冲洗3次,每次5min;弃掉PBS,加入荧光基团标记的兔-488二抗(抗体稀释液1:200稀释),37℃下孵育 50min;恢复到室温,弃掉二抗,用0.1M PBS缓冲液洗3次,每次5min;用激光扫描共聚焦显微镜观察,拍照。免疫荧光检测内皮细胞中LC3的表达水平。
3.实验结果
用浓度为5μM、10μM和20μM的JL025对内皮细胞进行处理后,western blot和免疫荧光结果表明JL025能够诱导内皮细胞自噬的发生(见图4)。
实施例5:JL025能够通过自噬调节内皮细胞的血管生成,抑制自噬后,JL025 调节内皮细胞的血管生成的能力下降
1.实验方法
将内皮细胞接种于直径6cm的培养皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度20μM的JL025培养;实验组:在去血清条件下加入浓度20μM的JL025和10mM自噬抑制剂3-MA培养。进行了细胞划痕实验和matrigel胶成血管实验(具体方法参照实施例1)。
2.实验结果
加入自噬抑制剂3-MA后,再加入20μM的JL025的处理组;与加入20 μM的JL025的处理组的细胞迁移和matrigel成血管实验结果表明抑制自噬,内皮细胞迁移和成血管能力下降(见图5)。
实施例6:JL025通过自噬途径降解IP10促进血管生成
1.实验方法1
将内皮细胞接种于直径6cm的培养皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度分别为5μM、10μM和20μM 的JL025培养。37℃,CO2孵箱内培养3,6,12小时之后裂解细胞,收集细胞裂解液,4℃12000g离心15min,取蛋白,western blot检测内皮细胞中不同时间IP10的表达水平。另外,将上述处理后的上清培养液利用ELISA 试剂盒(R&D)检测上清培养液中IP10的水平。
2.实验方法2
将内皮细胞接种于直径6cm的培养皿中,设置对照组:去血清的正常条件下培养;实验组:在去血清条件下加入浓度20μM的JL025培养;实验组:在去血清条件下加入浓度20μM的JL025和0.2mg/ml IP10。
待细胞平铺面积达80%后,用1mL的枪头在培养皿内划痕,用PBS洗去脱落细胞,于光学显微镜下对划痕进行拍照。于培养箱中培养12h,再次于显光学微镜下拍照。同时裂解细胞,收集细胞裂解液,4℃12000g离心15min,取上清,用于western blot检测。用image J软件计算加药前后划痕面积,计算面积比。面积比=(加药前初始划痕面积-加药12h后划痕面积)/(加药前初始划痕面积)×100%。
利用实例5中的方法,加入自噬抑制剂3MA,加入JL025利用western blot 检测内皮细胞中IP10蛋白表达水平。ELISA试剂盒(R&D)检测上清培养液中IP10的水平。
ATG-5的siRNA的设计由上海吉玛生物公司完成,lipofectamine2000 转染技术转染细胞。将内皮细胞接种于直径6cm的培养皿中,细胞转染后无血清培养6h,更换完全培养基,继续培养至24h,加药处理。设置对照组:阴性干扰去血清的条件下培养;阴性干扰实验组加入浓度20μM的JL025培养;实验组:ATG-5siRNA干扰在去血清条件下培养,ATG-5siRNA干扰加入浓度20μM的JL025培养;利用western blot检测内皮细胞中IP10蛋白表达水平。ELISA试剂盒(R&D)检测上清培养液中IP10的水平。
3.实验结果
western blot结果表明,5μM、10μM和20μM的JL025在3,6,12h 均能抑制人重组干扰素10(IP10)的表达;加入外源性的人重组干扰素10 (IP10)后,促进内皮细胞迁移的能力下降(见图6),western blot以及 ELISA结果表明抑制自噬后,JL025降解IP10的能力下降(见图7)。
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!