卡格列净在制备抗肿瘤药物中的应用的制作方法
本发明属制药领域,涉及卡格列净在制备抗肿瘤药物中的应用。
背景技术:
程序性死亡受体-1(Programmed death-1,PD-1)及其配体(Programmed death ligand-1,PD-L1)结合后形成免疫抑制性微环境,在肿瘤免疫逃逸中发挥关键作用,多个基于阻断PD-1/PD-L1结合的单克隆抗体药物已成功应用于临床血液系统肿瘤及实体瘤的治疗,部分患者甚至可以达到“临床治愈”状态,是肿瘤免疫治疗领域的突破性进展。尽管临床数据表明PD-1/PD-L1抗体药物具有显著的临床抗肿瘤疗效,但PD-1/PD-L1单克隆抗体药物仍面临巨大的挑战:1)应答率低需进一步提高,在多数实体瘤治疗中应答率不超过20%。有研究认为其中原因之一是大分子抗体药物难以有效渗透肿瘤组织,无法以足够的量到达肿瘤的所有区域所致;2)不良反应需进一步降低,由抗体疗法引起的免疫相关不良事件是由免疫系统的非特异性激活引起的离散毒性,可以影响几乎任何器官系统。与大分子抗体药物相比,小分子药物通常具有器官或肿瘤渗透性好、对免疫系统刺激小及可以口服等优点,因此,寻找针对PD-1/PD-L1的小分子药物被认为是克服抗体药物缺陷的重要途径,已成为该领域的研究热点。
当前针对PD-1/PD-L1的小分子药物研发主要由两种思路展开:1)根据PD-1/PD-L1复合物的晶体结构特点,开发直接阻断两者结合的全新结构小分子药物;2)基于PD-L1的蛋白表达调控机制,设计小分子化合物对关键环节进行干预,抑制其表达或促进其降解。然而这些化合物多停留于实验室研究阶段,因此,PD-1/PD-L1的小分子药物的研究总体上进展缓慢。
卡格列净(Canagliflozin)是当前临床上用于2型糖尿病治疗的药物,其药理机制是通过抑制钠依赖的葡萄糖运载体(Sodium-glucose cotransporter 2,SGLT2)的活性抑制其对葡萄糖的重吸收,促进葡萄糖排泄,从而达到降低血糖的作用。卡格列净对高血糖患者的降糖疗效明显,并且对正常血糖水平几乎无影响,糖尿病患者在使用该类药物降糖时发生低血糖风险低,不良反应少,已广泛用于糖尿病的治疗。
技术实现要素:
本发明的目的是提供卡格列净(Canagliflozin)在制备抗肿瘤药物中的应用,尤其在制备治疗实体瘤药物中的应用,所述实体瘤因肿瘤细胞PD-L1的蛋白水平增高导致。卡格列净,化学名(1S)-1,5-脱水-1-C-[3-[[5-(4-氟苯基)-2-噻吩基]甲基]-4-甲基苯基]-D-葡萄糖醇,分子式:C18H42O6Si4,分子量为466.86448。
经实验证实,所述卡格列净(20μM)在体外实验,通过Western blotting和流式细胞术考察发现其能显著降低非小细胞肺癌细胞及骨肉瘤细胞中免疫检查点蛋白PD-L1及细胞表面PD-L1的表达。并且在T细胞与肿瘤细胞共孵育模型中,卡格列净能有效增强T细胞对肿瘤细胞的杀伤作用,与阳性对照药PD-L1抗体药物作用相近。
所述药物由卡格列净与药学上可接受的辅料制成,制剂形式为凝胶剂、软胶囊剂、口服制剂、注射液、冻干粉针剂或大输液剂型。每天一次。
卡格列净是钠依赖的葡萄糖运载体(Sodium-glucose cotransporter 2,SGLT2)的活性抑制剂,目前临床上主要用于治疗2型糖尿病。本发明经体外实验研究证明,卡格列净对多种肿瘤细胞中的免疫检查点蛋白PD-L1有显著的下调作用,且在T细胞与肿瘤细胞共孵育模型中能有效增强T细胞对肿瘤细胞的杀伤作用,从而扩大化学药物卡格列净在肿瘤免疫治疗的临床应用。本发明的意义不仅在于明确卡格列净用于临床肿瘤治疗的可能性,也为基于PD-L1的小分子药物研发提供新的思路和潜在靶点。
发明人前期研究中对已在临床上使用的药物进行系统的筛选,发现临床上用于治疗2型糖尿病的卡格列净能显著降低多种肿瘤细胞PD-L1蛋白水平,恢复T细胞对肿瘤细胞的杀伤作用。目前临床尚未有较好的已上市小分子抑制剂通过干预PD-L1的蛋白表达调控机制达到抗肿瘤的作用,同时也未见卡格列净调控PD-L1蛋白表达的相关研究发明。本发明提供了一种肿瘤免疫治疗的已上市小分子抑制剂。本发明为卡格列净提供了新的医药用途。
附图说明
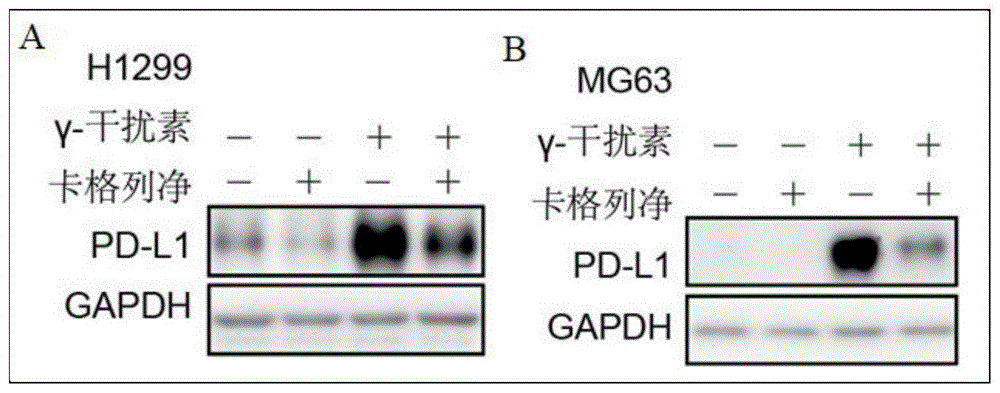
图1是卡格列净(Canagliflozin,20μM)作用于非小细胞肺癌H1299细胞、骨肉瘤MG63细胞的蛋白质免疫印迹图。
图2是卡格列净(Canagliflozin,20μM)作用于非小细胞肺癌H1299细胞、骨肉瘤MG63细胞的流式细胞术柱状图。
图3是卡格列净(Canagliflozin,20μM)作用于非小细胞肺癌H1299细胞对PD-L1蛋白稳定性的影响。
图4是卡格列净(Canagliflozin,20μM)作用于非小细胞肺癌H1299细胞、骨肉瘤MG63细胞能增强T细胞对肿瘤细胞的杀伤效应。
具体实施方式
本发明结合附图和实施例作进一步的说明。
实施例1
卡格列净作用于非小细胞肺癌H1299细胞、骨肉瘤MG63细胞24h后显著下调PD-L1蛋白水平。具体步骤如下:
选取非小细胞肺癌H1299细胞、骨肉瘤MG63细胞多株人源肿瘤细胞分别接种于6孔板中,1.0×106细胞/孔,37℃、5%CO2培养箱中培养过夜;次日分别给予卡格列净(Canagliflozin,20μM)及γ-干扰素(IFNγ,10ng/ml)作用24h,收集并裂解细胞,提取蛋白,通过Western blotting检测细胞中PD-L1的表达情况,具体浓度的卡格列净对非小细胞肺癌H1299细胞、骨肉瘤MG63细胞中PD-L1蛋白的抑制效果见图1,卡格列净能显著抑制肿瘤细胞PD-L1总蛋白表达。
实施例2
卡格列净作用于非小细胞肺癌H1299细胞、骨肉瘤MG63细胞24h后显著下调细胞表面PD-L1蛋白水平。具体步骤如下:
选取非小细胞肺癌H1299细胞、骨肉瘤MG63细胞两株人源肿瘤细胞分别接种于6孔板中,1.0×106细胞/孔,37℃、5%CO2培养箱中培养过夜;次日分别给予卡格列净(Canagliflozin,20μM)及γ-干扰素(IFNγ,10ng/ml)作用24h,采用流式细胞术检测细胞表面PD-L1的表达情况,具体卡格列净对非小细胞肺癌H1299细胞、骨肉瘤MG63细胞中PD-L1蛋白的抑制效果见图2,卡格列净能显著抑制肿瘤细胞表面PD-L1蛋白表达。
实施例3
卡格列净在非小细胞肺癌H1299细胞中对PD-L1蛋白稳定性的影响。具体步骤如下:
选取非小细胞肺癌H1299细胞接种于6孔板中,1.0×106细胞/孔,37℃、5%CO2培养箱中培养过夜。次日先给予IFNγ(10ng/ml)提前作用24h,接着同时给予蛋白合成抑制剂放线菌酮(CHX,10μg/mL)或CHX(10μg/mL)+Canagliflozin(20μM)共给药组分别作用0h、2h、4h、6h、8h、12h,收集细胞,通过Western blotting检测细胞中PD-L1的蛋白水平变化,进行灰度分析,做出曲线图后以此考察蛋白的稳定性。具体作用见图3,卡格列净能显著促进PD-L1蛋白降解,缩短其蛋白半衰期。
实施例4
卡格列净增强T细胞对非小细胞肺癌H1299细胞、骨肉瘤MG63细胞的杀伤效应。具体步骤如下:
采用Ficoll分离液从人血样中分离得到PBMC细胞,再用CD3和CD28刺激3天,使PBMC中的T细胞活化,并同时给予白介素-2(IL-2,50U/ul)维持T细胞生长,最后将活化好的T细胞与经过卡格列净(Canagliflozin,20μM)及γ-干扰素(IFNγ,10ng/ml)共同作用24h的肿瘤细胞进行共孵育,以PD-L1抗体药物作为阳性对照,考察T细胞对肿瘤细胞的杀伤作用。采用结晶紫染色法考察T细胞对肿瘤细胞的杀伤情况。具体作用见图4,卡格列净能显著增强T细胞对肿瘤细胞的杀伤作用。
- 还没有人留言评论。精彩留言会获得点赞!