一种兽用狂犬病灭活疫苗的制备方法及该疫苗包含的稳定剂与流程
本发明涉及生物制品领域,尤其涉及一种兽用狂犬病灭活疫苗的制备方法及该疫苗包含的稳定剂。
背景技术:
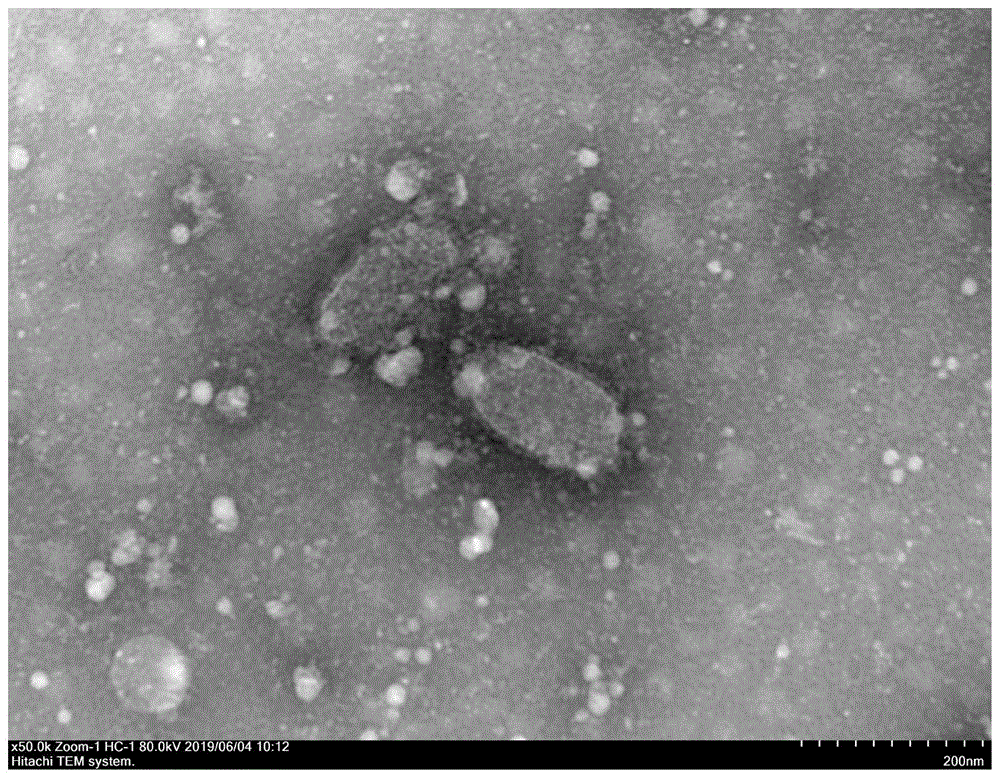
:狂犬病(rabies)是由弹状病毒科、狂犬病病毒属的狂犬病病毒(rabiesvirus)感染引起的一种人兽共患传染病,又称恐水病、疯狗病等,是一种侵害中枢神经系统的急性病毒性传染病,所有温血动物包括人类,都可被感染,该病主要是通过动物唾液中携带的狂犬病病毒液侵入体内而受到感染,犬是我国狂犬病毒最主要的贮藏宿主和传播媒介。狂犬病的潜伏期一般是半个月到三个月,多数集中在30~90天,狂犬病一旦发病,其发展速度很快,多数在3~5天,很少有超过10天的,病死率为100%。狂犬病在世界各个地方均有流行。针对狂犬病,由于目前尚无特效治疗药物,疫苗免疫接种可以有效控制和预防狂犬病的发生,现在用于预防动物狂犬病的疫苗有弱毒苗和灭活苗,狂犬病弱毒活疫苗,制备简单,但毒力存在反强的可能,安全性低,故而现在普遍使用灭活苗。近年来,狂犬疫苗的制备技术已经逐渐提高,但是仍然不能避免狂犬病的发生,因此必须提高技术,加快狂犬病疫苗质量提升的步伐。狂犬疫苗的安全性和有效性主要受病毒滴度、抗原纯度、灭活工艺及佐剂等因素影响,常规工艺生产的狂犬病毒灭活疫苗在临床应用中有一定的副反应,主要与病毒抗原中所含的抗原外成分有关,包括:病毒培养用动物细胞的残留蛋白质和dna、血清、细胞碎片、灭活剂等。这些外源成分不仅会引起免疫动物的副反应,而且会大大降低疫苗的效力。现在狂犬病灭活疫苗的生产方法中,主要是转瓶培养,转瓶培养的缺点是生产效率低,批间差异大,后期通过沉降的方式去除细胞大分子,抗原纯度无法提高,杂蛋白含量增加,导致疫苗产品免疫原性弱并存在安全隐患。通过电镜检测对比纯悬浮和转瓶培养病毒粒子的完整性,发现悬浮培养获得的病毒粒子形态清晰,膜结构完整。狂犬病灭活疫苗生产中,通常需要添加低浓度的人血清白蛋白提高疫苗的保存期,增加了动物源性外源物质的污染,是临床上该疫苗发生副反应的主要原因之一。常规疫苗添加蛋白保护剂延长疫苗稳定性,由于配方复杂增加了动物体的代谢负担,同时增加了成本。为了后期疫苗品质的提升和临床使用的安全性,急需要改进现有生产工艺。技术实现要素:本发明提供一种兽用狂犬病灭活疫苗的制备方法及该疫苗包含的稳定剂,通过优化生产过程中的浓缩、纯化操作,并采用特定的稳定剂克服现有技术狂犬病疫苗抗原纯度较低,稳定性和质量难以兼顾的缺陷。第一方面,本发明提供一种兽用狂犬病灭活疫苗的制备方法,包括病毒浓缩流程,具体操作为:(1)使病毒上清液经以0.8~1l/min流速持续透过300kd膜包,至所述病毒上清液体积浓缩至原体积的1/50~1/40得粗浓缩液;(2)向粗浓缩液中加入10~15倍体积的pbs溶液,在压力为0.5~1.0bar,流速为1.8~2l/min的条件下持续透过300kd膜包,体积浓缩至透过前的1/4~2/5时调整流速为0.8~1l/min,持续浓缩至所述粗浓缩液原体积;步骤(2)重复多次获得病毒浓缩液。本发明采用固定模式的透过流速对待浓缩样品进行浓缩,在待浓缩样品中的抗原浓度较低时采用高流速,抗原浓度较高时采用低流速,并且所用流速均低于现有其他方式病毒浓缩方法,如此获得的病毒浓缩液中的杂质可以得到有效去除,抗原纯度更高。常规的膜包或中空纤维处理料液选取的流速是防止产生凝胶层、保证处理效率,本发明中采用的浓缩方法杂蛋白去除率较传统的处理方式提高15-23%,抗原纯度显著提升。进一步地,所述病毒浓缩流程还包括:对所述病毒上清液进行浓缩之前,使所述病毒上清液在抗原处理罐中以30~55l/min循环2~10min。本发明在浓缩操作前使待浓缩样品在抗原处理罐中循环一定的时间,使待浓缩样品混合均匀,并且使膜包在高流速下达到最佳状态,更利于后续的浓缩步骤。进一步地,还包括病毒制备流程;所述病毒制备流程具体为:取37℃条件下培养的用于狂犬病病毒接种的纯悬浮细胞,以0.01-0.1moi接种狂犬病病毒,采用批次换液的方式收获病毒液,将所述病毒液过滤后即得病毒上清液,所述纯悬浮细胞优选为bhk-21纯悬浮细胞,所述狂犬病毒株优选为狂犬病毒(sad株)。更进一步,所述过滤操作具体为:对所述病毒液先采用连续流离心处理,再采用多级微滤处理。进一步地,连续流采用离心转速为8000-12000rpm,上样流速控制在100-150l/h,去除细胞及大的细胞碎片;多级微滤采用:醋酸纤维素材料的8um低吸附滤膜去除料液中的杂质,再用0.65um或3um+0.8um聚丙烯材料的滤膜过滤。离心和多级过滤的联合使用是对上一步操作的完善,能够逐级提高料液的澄清度,提高下一步操作的处理效率,保证下一步操作顺利进行。进一步地,所述300kd膜包在使用前经过如下处理:用无菌碱溶液对所述300kd膜包进行消毒处理,再用注射用水清洗所述300kd膜包直至ph为7.0,然后用无菌pbs溶液平衡膜包。进一步地,还包括疫苗制备流程;所述疫苗制备流程具体操作为:将所述病毒浓缩液灭活纯化,配以氨基酸稳定剂制成兽用狂犬病疫苗,所述稳定剂由以下成分组成:水解乳蛋白15~30mg/ml,赖氨酸20~60mg/ml,脯氨酸叔丁酯8~25mg/ml和山梨醇12~25mg/ml。本发明综合利用稳定剂中各组分中氨基酸增强免疫效果,水解乳蛋白降低蛋白的过敏性等作用,利用稳定剂中各成分相互搭配,可以更好地保证疫苗的稳定性。更进一步,所述灭活操作具体为:采用β-丙内酯对所述病毒浓缩液进行灭活,所述β-丙内酯浓度为0.01%-0.03%。β-丙内酯是针对核酸物质的灭活剂,会保证病毒粒子的完整性和良好的免疫原性,可以更好地保证疫苗的效力。更进一步,所述纯化操作具体为:将灭活后的病毒浓缩液进行层析纯化,所述层析纯化的条件为:病毒浓缩液上样的线性流速为45~100cm/h,压力小于2.5bar,上样量控制在5%~15%(v/v)柱体积,洗脱剂为0.01~0.1mol/lpbs溶液。再进一步地,层析流程如下:用无菌的0.5~1mol/lnaoh溶液对分子筛凝胶层析柱冲洗2个柱体积,再用注射用水冲洗直至ph为7.0,随后用无菌pbs溶液平衡分子筛凝胶层析柱至柱前柱后电导率一致(柱前和柱后的电导率都在15~16ms/cm),ph稳定在7.0,紫外检测uv280基线平稳;然后将灭活的病毒浓缩液上样,上样结束后,用pbs洗脱,待uv280值开始回升时,开始收集洗脱液,至第一洗脱峰结束收获停止。层析处理过程中对于上样量的调控会直接影响规模化生产处理效率和病毒分离效果,但是上样量不仅受到层析柱规格的影响,也和纯化前的病毒液纯度相关,过低的纯度会导致上样压力增加,处理效率下降,上样量相应减少,规模化生产效率降低;上样量过大会导致分离效果差,无法满足病毒分离的纯度要求。第二方面,本发明提供一种用于制备灭活疫苗的稳定剂,由包括以下组分的原料制成:水解乳蛋白、赖氨酸、脯氨酸叔丁酯和山梨醇。进一步地,原料含量为:水解乳蛋白15~30mg/ml,赖氨酸20~60mg/ml,脯氨酸叔丁酯8~25mg/ml和山梨醇12~25mg/ml。更进一步,原料含量为:水解乳蛋白20~30mg/ml,赖氨酸35~60mg/ml,脯氨酸叔丁酯15~25mg/ml和山梨醇20~25mg/ml。再进一步,原料含量为:水解乳蛋白25mg/ml,赖氨酸45mg/ml,脯氨酸叔丁酯20mg/ml和山梨醇20mg/ml。第三方面,本发明提供一种兽用狂犬病灭活疫苗,由上述纯化后的病毒浓缩液和上述稳定剂制备而成。在本发明一个优选的实施方式中,兽用狂犬病疫苗的制备方法具体如下:1、病毒制备流程:取37℃纯悬浮培养bhk-21细胞,接种狂犬病毒(sad株),收获病毒液,将病毒液采用连续流离心处理,再采用多级微滤处理得到病毒上清液150~300l。2、病毒浓缩流程:(1)将病毒上清液置于抗原处理罐中,使病毒上清液在抗原处理罐中以30~55l/min循环2min,降低泵流速,打开透过端,控制透过端以0.8~1l/min流速持续透过至体积浓缩为3~5l得粗浓缩液;300kd膜包在使用前经过如下处理:用无菌碱溶液对300kd膜包及管道进行循环消毒处理,再用注射用水清洗300kd膜包直至ph为7.0,然后用无菌pbs溶液平衡膜包。(2)向粗浓缩液中补加40~75lpbs溶液,设定泵流速为45-60l/min,循环10min;调节泵速打开透过端,调节浓缩压力为0.5~1.0bar,控制透过端以1.8~2l/min流速持续透过,在体积浓缩至15~30l时,调整透过端流速为0.8~1l/min,持续透过至体积浓缩至3~5l,关闭透过端;此步骤重复3次以上获得病毒浓缩液。3、疫苗制备流程:(1)将病毒浓缩液采用β-丙内酯进行灭活,β-丙内酯浓度为0.01%-0.03%。(2)将灭活后的病毒浓缩液利用4ff分子筛凝胶凝胶层析柱层析纯化,所用层析柱中填料为sepharose4ff琼脂糖凝胶层析填料;层析柱的型号为bpg450/1000column;层析纯化流程如下:用无菌的0.5~1mol/lnaoh溶液对分子筛凝胶层析柱冲洗2个柱体积,再用注射用水冲洗直至ph为7.0,随后用pbs溶液平衡分子筛凝胶层析柱至柱前柱后电导率一致(柱前和柱后的电导率都在15~16ms/cm),ph稳定在7.0,紫外检测uv280基线平稳;然后将灭活的病毒浓缩液上样,上样结束后,用pbs洗脱,待uv280值开始回升时,开始收集洗脱液,至第一洗脱峰结束收获停止;其中,病毒浓缩液上样的线性流速为45~100cm/h,压力小于2.5bar,上样量控制在5%~15%(v/v)柱体积,洗脱剂为0.01~0.1mol/lpbs溶液。(3)将纯化后的病毒浓缩液配以15-30mg/ml水解乳蛋白,20-60mg/ml赖氨酸,8-25mg/ml脯氨酸叔丁酯,12-25mg/ml山梨醇制成兽用狂犬病疫苗。本发明提供一种兽用狂犬病灭活疫苗的制备方法及该疫苗包含的稳定剂,具有如下有益效果:(1)本发明通过优化病毒浓缩的流程,采用不同的透过流速更好地去除蛋白质杂质,在浓缩过程即可去除30-50%杂蛋白,同时毒价维持在90%以上,缩小后期抗原处理的体积,便于大规模高效生产。(2)本发明筛选出一组针对高纯度狂犬抗原的稳定剂配方,配比科学,组分简单,37℃下放置28天抗原效力仍无明显下降,针对纯化后狂犬疫苗的稳定性有显著保护作用,解决了兽用狂犬病疫苗稳定性差的问题。(3)本发明的技术参数和生产规模可以进行线性放大,生产规模扩大到500l、1000l、2000l、3000l、5000l具有可操作性。(4)本发明采用的连续流离心和多级微滤的方式处理纯化前病毒液,解决了兽用疫苗传统处理方法处理效率低、多步操作无法控制无菌的问题,为产品的升级提供了新思路。附图说明图1为本发明实施例1提供的兽用狂犬病病毒电镜检测图;图2为本发明实施例2提供的兽用狂犬病病毒的凝胶层析纯化图谱。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1本实施例提供一种兽用狂犬病灭活疫苗的制备方法,具体步骤如下:1、病毒制备流程:取37℃纯悬浮培养bhk-21细胞,接种狂犬病毒0.05moi,收获病毒液220l,将病毒液采用连续流离心处理,转速8000rpm,进样流速设定为150l/h,再采用多级微滤膜过滤:先用醋酸纤维素材质的8um滤膜过滤处理,再采用3um+0.8um复合滤膜过滤,即得病毒上清液200l。2、病毒浓缩流程:(1)将病毒上清液置于抗原处理罐中,使病毒上清液在抗原处理罐中以55l/min循环2min,调节泵流速打开透过端,控制透过端以0.8l/min流速持续透过,至病毒上清液体积浓缩至5l,得粗浓缩液,关闭透过端;300kd膜包在使用前经过如下处理:用1mol/lnaoh对300kd膜包及管道进行循环消毒处理,碱液回收、排空;再用注射用水清洗300kd膜包直至ph为7.0,注射用水排空;然后用30l无菌pbs溶液平衡膜包2min,排空pbs。(2)向粗浓缩液中补加50lpbs溶液,设定泵流速为45l/min,循环10min,调节泵速打开透过端,调节浓缩压力为1bar,控制透过端以1.8l/min流速持续透过,在体积浓缩至20l时,降低泵速调整透过端流速为0.8l/min,持续透过至体积浓缩至5l,关闭透过端;此步骤重复四次获得病毒浓缩液。(3)病毒浓缩液采用免疫荧光法检测病毒含量,毒价折算浓缩倍数后不低于原病毒液毒价的90%;用蛋白浓度测定仪检测总蛋白含量。3、疫苗制备流程:(1)将病毒浓缩液采用β-丙内酯进行灭活,β-丙内酯浓度为0.025%。(2)将灭活后的病毒浓缩液利用4ff分子筛凝胶凝胶层析柱层析纯化,所用层析柱中填料为sepharose4ff琼脂糖凝胶层析填料;层析柱的型号为bpg450/1000column;层析流程如下:用无菌的0.5mol/lnaoh溶液对分子筛凝胶层析柱冲洗2个柱体积,再用注射用水冲洗直至ph为7.2,随后用pbs溶液平衡分子筛凝胶层析柱至柱前柱后电导率一致(柱前和柱后的电导率都在15~16ms/cm),ph稳定在7.0,紫外检测uv280基线平稳;然后将灭活的病毒浓缩液上样,上样结束后,用pbs洗脱,待uv280值开始回升时,开始收集洗脱液,至第一洗脱峰结束收获停止;其中,病毒浓缩液上样的线性流速为55cm/h,压力小于2.5bar,上样量控制在10%(v/v)柱体积,洗脱液为0.01mol/lpbs溶液。(3)将纯化后的病毒浓缩液配以15mg/ml水解乳蛋白,20mg/ml赖氨酸,8mg/ml脯氨酸叔丁酯,12mg/ml山梨醇制成兽用狂犬病疫苗。图1为本实施例对于步骤(3)获得的病毒浓缩液对兽用狂犬病病毒进行病毒粒子的电镜检测照片。图2为本实施例步骤(4)层析过程中兽用狂犬病病毒的凝胶层析纯化图谱。如图2所示,第一个洗脱峰即为病毒抗原。实施例2本实施例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于病毒浓缩流程的步骤(2)调整为:向粗浓缩液中补加50lpbs溶液,设定泵流速为45l/min,循环10min,调节泵速打开透过端,控制透过端以1.8l/min流速持续透过,在体积浓缩至20l时,降低泵速调整透过端流速为0.8l/min,持续透过至体积浓缩至5l,关闭透过端;此步骤重复3次获得病毒浓缩液。实施例3本实施例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于稳定剂为水解乳蛋白30mg/ml,赖氨酸60mg/ml,脯氨酸叔丁酯25mg/ml和山梨醇25mg/ml。实施例4本实施例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于稳定剂为水解乳蛋白28mg/ml,赖氨酸40mg/ml,脯氨酸叔丁酯18mg/ml和山梨醇22mg/ml。实施例5本实施例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于稳定剂为水解乳蛋白25mg/ml,赖氨酸45mg/ml,脯氨酸叔丁酯20mg/ml和山梨醇20mg/ml。对比例1本对比例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于病毒浓缩流程步骤(2)调整为:向粗浓缩液中补加50lpbs溶液,设定泵流速为45l/min,循环10min,调节泵速打开透过端,控制透过端以2.5l/min流速持续透过,在体积浓缩至20l时,降低泵速调整透过端流速为1.5l/min,持续透过至体积浓缩至5l,关闭透过端;此步骤重复4次获得病毒浓缩液。对比例2本对比例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于步骤(2)调整为:向粗浓缩液中补加50lpbs溶液,设定泵流速为45l/min,循环10min,调节泵速打开透过端,控制透过端以3.5l/min流速持续透过,在体积浓缩至20l时,降低泵速调整透过端流速为2.0l/min,持续透过至体积浓缩至5l,关闭透过端;此步骤重复4次获得病毒浓缩液。对比例3本对比例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于步骤(2)调整为:向粗浓缩液中补加50lpbs溶液,设定泵流速为45l/min,循环10min,调节泵速打开透过端,控制透过端以0.8l/min流速持续透过至体积浓缩至5l,关闭透过端;此步骤重复4次获得病毒浓缩液。对比例4本对比例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于保护剂组分为:水解乳蛋白25mg/ml,赖氨酸45mg/ml,脯氨酸叔丁酯20mg/ml。对比例5本对比例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于保护剂组分为:赖氨酸45mg/ml,脯氨酸叔丁酯20mg/ml,山梨醇20mg/ml。对比例6本对比例提供一种兽用狂犬病疫苗的制备方法,具体步骤和实施例1相同,区别在于保护剂组分为:赖氨酸45mg/ml,脯氨酸叔丁酯20mg/ml,山梨醇20mg/ml,人参三醇10mg/ml。实验例1本实验例对实施例1、2及对比例1-3所得疫苗制备流程中步骤(3)所得病毒浓缩液的蛋白含量及毒价进行检测,用荧光法检测毒价,用蛋白浓度测定仪检测结果如下:表1病毒浓缩液杂蛋白去除率及浓缩毒价检测杂蛋白去除率浓缩毒价(ffu/ml)浓缩耗时(h)实施例155%109.84实施例253%109.83.5对比例128%108.52.5对比例220%108.52.0对比例335%109.08实验例2本实验例对实施例1、3-5及对比例4-6所得疫苗进行高温破坏性试验,nih法具体步骤如下:配制的疫苗分2组,一组在4℃存放2年,另一组在37℃下放置28天,用ph7.2、0.01mol/l的pbs将待检疫苗和参考疫苗作5倍系列稀释,待检疫苗取1:5、1:25、1:125和1:6254个稀释度,参考疫苗取1:25、1:125、1:625和1:31254个稀释度,每个稀释度分别腹腔接种体重11~13g的同一性别小鼠至少16只,每只0.5ml。间隔7日再免疫1次。各组小鼠应在同条件下饲养,并预留同批小鼠作病毒回归对照。第一次免疫14日后攻毒,攻毒14日后观察实验结果。表2疫苗稳定性检测结果汇总最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1