一种抗肿瘤的联合用药物组合物及其应用的制作方法
本发明属于生物医药领域,涉及一种抗肿瘤的联合用药物组合物及其应用。
背景技术:
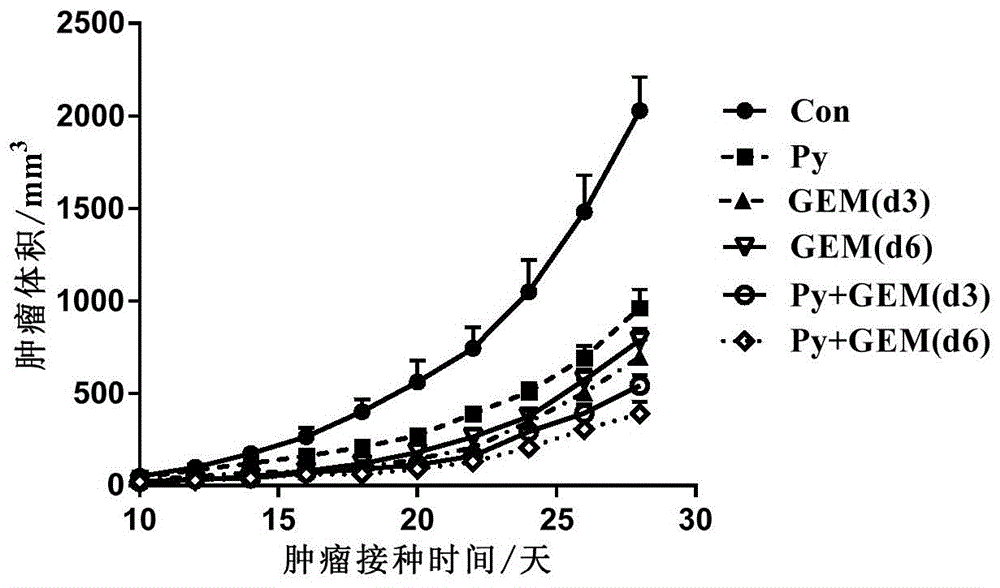
:肿瘤治疗方法有手术、放射、化疗(含靶向治疗)三大传统模式,还有新型的生物治疗(含免疫治疗)。临床上以综合治疗为主,手术结合放化疗方式对于早期发现的肿瘤治疗效果较好,但对于进展到晚期的肿瘤,疗效欠佳。现在治疗晚期恶性实体瘤,各种生物治疗提供更多的选择,靶向药物、抗体、免疫治疗药物(如pd-1)和细胞治疗(如car-t、til细胞),取得一些进展,但是还未能阻止癌症快速发展的形势。疟疾主要是经按蚊叮咬传播而由疟原虫感染引起的虫媒传染病,被世界卫生组织列为世界三大传染病(艾滋病、结核病和疟疾)之一。感染人类的疟原虫主要有五种类型:恶性疟原虫、间日疟原虫、三日疟原虫、卵形疟原虫和诺氏疟原虫,最常见的是恶性疟原虫和间日疟原虫。小鼠疟原虫也主要有四种类型:夏氏疟原虫、约氏疟原虫、伯氏疟原虫和文氏疟原虫。在小鼠中证明了疟原虫感染显著抑制肺癌、肝癌、结肠癌、乳腺癌等肿瘤模型的荷瘤小鼠的肿瘤生长和转移,显著延长荷瘤小鼠的生存期。化疗在肿瘤的临床治疗中主要通过细胞毒药物杀伤肿瘤细胞,但是并不能特异性识别肿瘤细胞,而且存在药物毒副作用,现有化疗越来越难以控制肿瘤发展的形势。将化疗与生物疗法联合治疗肿瘤成为一项具有广阔前景的治疗策略,综合利用化疗和生物疗法发挥协同效应。现有技术中也对其有相关报道。cn107929231a公开了一种化疗免疫联合治疗的原位温敏凝胶药物递送系统。该递送系统由药物载体肽类树状大分子、抗肿瘤药物和温敏凝胶基质材料plga-peg-plga组成,将抗肿瘤药物包载于肽类树状大分子空腔内形成载药肽类树状大分子,通过溶胀过程将载药肽类树状大分子包裹于温敏凝胶基质中,形成室温下为可注射型溶胶,体温下转变为凝胶的原位药物递送系统。该发明的原位递送系统能在肿瘤附近形成凝胶,缓慢释放出载药肽类树状聚合物分子作用于肿瘤组织,肽类树状聚合物分子作用于肿瘤组织内的巨噬细胞生成no,与抗肿瘤药物共同作用于肿瘤,形成化疗免疫联合治疗,抑制肿瘤的发展。cn103347521a公开了一种用于治疗癌症的方法,其包括施用代谢靶向的化疗-免疫治疗方案。在一个实施例中,代谢靶向的化疗-免疫治疗方案可包括以下步骤:在患有癌症的对象中施用治疗有效剂量的一种或多种免疫剂(例如,治疗性抗体),以刺激免疫应答,以及施用治疗有效剂量的一种或多种化疗剂。该发明所述的方法可用于治疗任何类型的癌症,特别是恶性和转移的晚期癌症。cn102481365a公开了一种通过施用dll4拮抗剂和化疗剂的组合从而治疗各种类型的癌症/肿瘤的方法,其中所述dll4拮抗剂,尤其是特异性结合dll4的dll4抗体和其片段。此类联合治疗与单独用任一治疗剂治疗相比表现出协同作用。因此,该发明的方法对于由单独用任一治疗剂治疗所需的高剂量引起的副作用具有低耐受性的癌症患者尤其有益,这是因为能够降低有效剂量。还提供了含有dll4拮抗剂和化疗剂的药物组合物及药盒。综上,现有技术中关于将化疗与生物疗法联合治疗肿瘤且能实现显著的抗肿瘤效果的策略还很有限,因此,开发出一种新的能获得显著抗肿瘤效果的生物化疗治疗策略是非常有意义的,其可以提供一种新的癌症治疗思路。技术实现要素:针对现有技术的不足,本发明的目的在于提供一种抗肿瘤的联合用药物组合物及其应用,该联合用药物组合物成功地将化学疗法和疟原虫免疫疗法(一种生物疗法)结合起来,具有较高的生物安全性,具有比单一化学疗法或单一的疟原虫免疫疗法更强的抗肿瘤活性,能够延长肿瘤小鼠模型的生存期,为癌症的治疗提供了新的策略和思路;同时能够降低化疗药物的使用剂量,降低化疗药物产生的毒副作用,降低肿瘤患者的治疗成本;另外化疗药物通过阻断肿瘤细胞增殖或者直接杀伤肿瘤细胞导致肿瘤细胞死亡,促使肿瘤细胞被巨噬细胞吞噬加工释放肿瘤抗原,在疟原虫免疫疗法的诱导下促进巨噬细胞和树突状细胞的抗原呈递能力增强,从而诱导出更强的抗肿瘤特异性免疫反应,发挥持续的免疫疗法和化疗的协同效应。为达到此发明目的,本发明采用以下技术方案:一方面,本发明提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括疟原虫和化疗药物。所述联合用药物组合物中的疟原虫主要通过激活天然免疫和诱导一定的特异性免疫发挥抗肿瘤的效应,具体来说:一方面,疟原虫感染释放的危险信号分子,包括糖基磷脂酰肌醇锚、血红素、免疫刺激核酸基序和其他未知分子,这些病原体相关的模式识别分子,能被宿主的免疫细胞的模式识别受体识别。由疟原虫模式识别分子激活的模式识别受体触发不同的转录程序和刺激多个下游信号途径诱导产生全身免疫反应,包括释放促炎因子和th1型细胞因子,激活nk细胞、nkt细胞、巨噬细胞和树突状细胞,进一步激活cd4+和cd8+t细胞,抑制tgf-β、il-10等细胞因子产生,抑制调节性t细胞(tregs)、骨髓衍生的抑制性细胞(mdscs)和肿瘤相关巨噬细胞(tams)等细胞活性,改善肿瘤免疫抑制微环境,将肿瘤患者的瘤内的免疫抑制微环境转变为免疫激活状态,从而将肿瘤转化为有效的肿瘤疫苗。另一方面,疟原虫感染通过损伤相关分子模式激活免疫,疟原虫感染的红细胞和已知的内源性尿酸、微泡都能诱导相似的免疫活性。化疗药物种类繁多,根据化疗药物的来源和化学结构,化疗药物主要包括烷化剂类化疗药物、抗代谢类化疗药物、抗生素类化疗药物、激素类化疗药物、动植物类化疗药物和杂类化疗药物。烷化剂类化疗药物直接作用于dna上,防止癌细胞再生,常见的烷化剂药物有环磷酰胺、异环磷酰胺、塞替派。抗代谢化疗药物,是通过干扰dna和rna的合成,阻止细胞分裂和增殖,主要是吉西他滨、培美曲塞、氟尿嘧啶、阿糖胞苷、甲氨蝶呤、巯嘌呤、羟基脲等。抗生素类化疗药物是通过抑制酶的作用和有丝分裂或者改变细胞膜来干扰dna,主要是细胞周期非特异性的药物,主要有丝裂霉素、柔红霉素、平阳霉素、多柔比星、放线菌素d、米托蒽醌等。动植物类化疗药物主要是植物碱和天然产物,可以通过抑制有丝分裂或酶的作用,从而防止细胞再生必需的蛋白质合成,主要有长春新碱、依托泊苷、替尼泊苷、紫杉醇、多西他赛,它们通常与其他类化疗药物联合用于治疗肿瘤。激素类化疗药物通过应用某些激素或者拮抗剂杀伤或者减缓激素依赖的肿瘤细胞的生长,主要有他莫昔芬、甲地孕酮、曲普瑞林、甲羟孕酮。杂类化疗药物,主要包括顺铂、卡铂、奥沙利铂、门冬酰胺酶等。hiv蛋白酶抑制剂(hivpis)是一类治疗hiv感染的化疗药物,它们通过抑制病毒的蛋白酶活性,从而抑制天冬氨酰蛋白前体裂解成其功能形式以阻止hiv病毒颗粒的成熟。hivpis主要有nelfinavir(奈非那韦)、saquinavir(沙奎那韦)、indinavir(茚地那韦)、ritonavir(利托那韦)。gills等人研究发现hivpis对60多个细胞系具有抗癌活性,阐述了包括内质网应激、自噬、凋亡以及抑制akt通路等机制。在胰腺癌患者,nelfinavir联合吉西他滨、顺铂或放疗,可以增强akt抑制水平和增强放疗的敏感性,而且并没有发现nelfinavir引起的毒副作用。rengan等发现在无法手术切除的非小细胞肺癌患者,nelfinavir联合依托泊苷、顺铂或放疗,也未发现nelfinavir剂量依赖的毒性反应。疟原虫感染能系统性激活机体的天然免疫并能增强机体抗肿瘤的特异性免疫。而化疗药物,包括hivpis,能直接杀伤肿瘤细胞或者抑制肿瘤细胞的增殖。将疟原虫感染(疟原虫免疫疗法)和化疗药物联合起来,从激活免疫和降低肿瘤负荷两个方面入手,起到协同治疗肿瘤的作用,比单一的疟原虫免疫疗法或单一的化学疗法具有更显著的治疗效果。综上,该联合用药物组合物成功地将化学疗法和疟原虫免疫疗法(一种生物疗法)结合起来,具有较高的生物安全性,比单一化学疗法和单一疟原虫免疫疗法具有更强的抗肿瘤活性,能够延长患癌小鼠的生存期,为癌症的治疗提供了新的策略和思路;同时能够降低化疗药物的使用剂量,降低化疗药物产生的毒副作用,降低肿瘤患者的治疗成本;另外该联合用药物组合物能够促使肿瘤细胞释放肿瘤抗原,诱导更强的抗肿瘤特异性免疫反应,发挥持续的免疫疗法和化疗的协同效应。在本发明中,所述化疗药物包括烷化剂类化疗药物、抗代谢类化疗药物、抗生素类化疗药物、动植物类化疗药物、杂类化疗药物或hiv蛋白酶抑制剂。优选地,所述烷化剂类化疗药物包括环磷酰胺或异环磷酰胺。优选地,所述抗代谢类化疗药物包括吉西他滨、培美曲塞、5-氟尿嘧啶、阿糖胞苷或甲氨蝶呤。优选地,所述抗生素类化疗药物包括丝裂霉素、多柔比星或放线菌素d。优选地,所述动植物类化疗药物包括依托泊苷、多西他赛、紫杉醇、长春新碱或伊立替康。优选地,所述杂类化疗药物包括顺铂、卡铂、奥沙利铂或门冬酰胺酶。优选地,所述hiv蛋白酶抑制剂化疗药物包括奈非那韦、沙奎那韦、茚地那韦或利托那韦。在本发明中,所述联合用药物组合物的剂型包括药剂学上可接受的任意一种剂型。例如片剂、散剂、混悬剂、颗粒剂、胶囊剂、注射剂、喷雾剂、溶液剂、灌肠剂、乳剂、膜剂、栓剂、贴剂、滴鼻剂或滴丸剂等。优选地,所述联合用药物组合物还包括药剂学上可接受药用辅料中的任意一种或至少两种的组合。本发明所述联合用药物组合物可单独给药也可以与辅料搭配做成适当的剂型进行给药,所述辅料包括稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、乳化剂、助溶剂、增溶剂、渗透压调节剂、表面活性剂、ph调节剂、抗氧剂、抑菌剂或缓冲剂中的任意一种或至少两种的组合。所述至少两种的组合例如稀释剂和赋形剂的组合、乳化剂和助溶剂的组合、填充剂和粘合剂和润湿剂的组合等。优选地,所述联合用药物组合物为单一的复方制剂。优选地,所述联合用药物组合物为两种单独的制剂的组合。优选地,所述两种单独的制剂同时施用。优选地,所述两种单独的制剂依次施用。所述联合用药物组合物可以为单一的复方制剂形式,也可以为两种单独的制剂的组合;当为两种单独的制剂的组合时,其用药方式可以为同时施用,也可以为依次施用,例如可以先施用疟原虫,间隔一段时间再施用化疗药物,也可以先施用化疗药物,间隔一段时间再施用疟原虫,或者疟原虫和化疗药物交替施用。在本发明中,所述联合用药物组合物的给药途径包括静脉注射、腹腔注射、肌肉注射、皮下注射、口服给药、舌下给药、鼻腔给药或经皮给药,优选腹腔注射。优选地,所述联合用药物组合物为负载于药用载体上的联合用药物组合物。优选地,所述药用载体包括脂质体、胶束、树枝状大分子、微球或微囊。另一方面,本发明提供一种如上所述的联合用药物组合物在制备抗肿瘤药物中的应用。优选地,所述肿瘤包括肺癌、胃癌、结肠癌、肝癌、乳腺癌或胰腺癌。再一方面,本发明提供一种新型的抗肿瘤联合疗法,所述抗肿瘤联合疗法为化学疗法与疟原虫疗法的联合疗法。将化学疗法和疟原虫免疫疗法结合起来,具有较高的生物安全性,比单一化学疗法和单一的疟原虫免疫疗法具有更强的抗肿瘤活性,能够更有效地地延长荷瘤小鼠的生存期,为癌症的治疗提供了新的策略和思路;同时通过低剂量的化疗药物能够降低化疗药物的使用剂量,降低化疗药物产生的毒副作用,降低肿瘤患者的治疗成本;另外该联合疗法能够促使肿瘤细胞释放肿瘤抗原,诱导更强的抗肿瘤特异性反应,发挥持续的免疫疗法和化疗的协同效应。优选地,所述肿瘤包括肺癌、胃癌、结肠癌、肝癌、乳腺癌或胰腺癌。优选地,所述化学疗法所使用的化疗药物包括烷化剂类化疗药物、抗代谢类化疗药物、抗生素类化疗药物、动植物类化疗药物、杂类化疗药物或hiv蛋白酶抑制剂。优选地,所述烷化剂类化疗药物包括环磷酰胺或异环磷酰胺。优选地,所述抗代谢类化疗药物包括吉西他滨、培美曲塞、5-氟尿嘧啶、阿糖胞苷或甲氨蝶呤。优选地,所述抗生素类化疗药物包括丝裂霉素、多柔比星或放线菌素d。优选地,所述动植物类化疗药物包括依托泊苷、多西他赛、紫杉醇、长春新碱或伊立替康。优选地,所述杂类化疗药物包括顺铂、卡铂、奥沙利铂、门冬酰胺酶等。优选地,所述hiv蛋白酶抑制剂化疗药物包括奈非那韦、沙奎那韦、茚地那韦、利托那韦。优选地,所述化学疗法的给药途径包括静脉注射、腹腔注射、肌肉注射、皮下注射、口服给药、舌下给药、鼻腔给药或经皮给药,优选腹腔注射。优选地,所述疟原虫疗法的给药途径包括腹腔注射。相对于现有技术,本发明具有以下有益效果:本发明所涉及的抗肿瘤的联合用药物组合物将化学疗法和疟原虫免疫疗法(一种生物疗法)结合起来,具有较高的生物安全性,比单一化学疗法和单一的疟原虫免疫疗法具有更强的抗肿瘤活性,能够更有效地地延长荷瘤小鼠的生存期,为癌症的治疗提供了新的策略和思路;同时通过低剂量的化疗药物能够降低化疗药物的使用剂量,降低化疗药物产生的毒副作用,降低肿瘤患者的治疗成本;另外该联合用药物组合物能够促使肿瘤细胞释放肿瘤抗原,诱导更强的抗肿瘤特异性反应,发挥持续的免疫疗法和化疗的协同效应。附图说明图1是实施例1中肿瘤生长曲线图;图2是实施例1中荷瘤小鼠的生存曲线图;图3是实施例1中疟原虫感染率曲线图;图4是实施例1中荷瘤小鼠的体重生长曲线图;图5是实施例2中肿瘤生长曲线图;图6是实施例2中荷瘤小鼠的生存曲线图;图7是实施例2中疟原虫感染率曲线图;图8是实施例2中荷瘤小鼠的体重生长曲线图;图9是实施例3中肿瘤生长曲线图;图10是实施例3中荷瘤小鼠的生存曲线图;图11实施例3中疟原虫感染率曲线图;图12是实施例3中荷瘤小鼠的体重生长曲线图;图13是实施例4中肿瘤生长曲线图;图14是实施例4中荷瘤小鼠的生存曲线图;图15是实施例4中疟原虫感染率曲线图;图16是实施例4中荷瘤小鼠的体重生长曲线图;图17是实施例5中肿瘤生长曲线图;图18是实施例5中荷瘤小鼠的生存曲线图;图19是实施例5中疟原虫感染率曲线图;图20是实施例5中荷瘤小鼠的体重生长曲线图;图21是实施例6中肿瘤生长曲线图;图22是实施例6中荷瘤小鼠的生存曲线图;图23是实施例6中疟原虫感染率曲线图;图24是实施例6中荷瘤小鼠的体重生长曲线图;图25是实施例7中肿瘤生长曲线图;图26是实施例7中荷瘤小鼠的生存曲线图;图27是实施例7中疟原虫感染率曲线图;图28是实施例7中荷瘤小鼠的体重生长曲线图;图29是实施例8中肿瘤生长曲线图;图30是实施例8中荷瘤小鼠的生存曲线图;图31是实施例8中疟原虫感染率曲线图;图32是实施例8中荷瘤小鼠的体重生长曲线图;图33是实施例9中肿瘤生长曲线图;图34是实施例9中荷瘤小鼠的生存曲线图;图35是实施例9中疟原虫感染率曲线图;图36是实施例9中荷瘤小鼠的体重生长曲线图;图37是实施例10中肿瘤生长曲线图;图38是实施例10中荷瘤小鼠的生存曲线图;图39是实施例10中疟原虫感染率曲线图;图40是实施例10中荷瘤小鼠的体重生长曲线图;图41是实施例11中肿瘤生长曲线图;图42是实施例11中荷瘤小鼠的生存曲线图;图43是实施例11中疟原虫感染率曲线图;图44是实施例11中荷瘤小鼠的体重生长曲线图;图45是实施例12中肿瘤生长曲线图;图46是实施例12中荷瘤小鼠的生存曲线图;图47是实施例12中疟原虫感染率曲线图;图48是实施例12中荷瘤小鼠的体重生长曲线图。具体实施方式下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。实施例1本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物吉西他滨,观察不同给药时间的吉西他滨联合约氏疟原虫治疗肺癌效果。本实施例所需的实验材料和试剂包括:动物:c57bl/6小鼠,雌性,6-8周龄,来源于上海斯莱克实验动物有限责任公司或北京维通利华实验动物有限公司;疟原虫:小鼠约氏疟原虫(p.yoelii17xnl,mra-593,py),来自malariaresearchandreferencereagentresourcecenter(mr4)免费馈赠;化学治疗药物:吉西他滨(gemcitabine,缩写gem),购自sigma-aldrich公司;giemsa染剂粉:购自sigma-aldrich公司。(1)建立动物模型,具体方法为:(ⅰ)细胞复苏:复苏小鼠lewis肺癌细胞系llc,在5%co2、37℃恒温培养箱中静置培养;(ⅱ)细胞扩培:每2-3天传代一次,当细胞长满培养皿底部的80%时,用0.25%胰酶-edta消化液消化,按照1:3稀释传代;(ⅲ)单细胞制备及细胞接种:取对数生长期的细胞,经胰酶消化后,用pbs洗涤3次,用无血清1640培养基重悬细胞,小鼠右侧肩胛区皮下接种,每只注射细胞悬液体积为0.1ml,llc细胞接种量为5×105个/只(接种c57bl/6小鼠);(ⅳ)实验分组:按照肿瘤大小随机分为六组:对照肿瘤组(con),约氏疟原虫治疗组(py),第3天给药的吉西他滨治疗组(gem(d3)),第6天给药的吉西他滨治疗组(gem(d6),第3天给药的吉西他滨联合治疗组(py+gem(d3)),第6天给药的吉西他滨联合治疗组(py+gem(d6))。每组10只小鼠,共60只。(2)疟原虫接种荷瘤小鼠,具体方法为:(ⅰ)疟原虫复苏:将冻存于液氮罐中的鼠疟原虫血(1.0ml/支),于37℃水浴锅中快速震荡,使其混匀融化,保持疟原虫活性。(ⅱ)疟原虫接种:混匀后0.2ml/只腹腔注射接种c57bl/6小鼠,每次接种两只。(ⅲ)薄血膜制作和镜检:小鼠剪尾采血取约1-1.5μl,涂于载玻片,制作2.5cm长舌状薄血膜,吹风机吹干。甲醇浸润血膜1min,1×giemsa染液染色30min,用自来水冲洗干净,吹干。用油镜100×观察疟原虫感染率。观察疟原虫感染率变化。(ⅳ)疟原虫溶液制备:当感染率达到3%-10%时,先红细胞计数,剪尾巴取血5μl重悬于995μlpbs中,红细胞计数。计算出每ml体积感染疟原虫的红细胞数。用0.2ml体积的3.8%枸橼酸钠抗凝剂润湿ep管,摘眼球采血,计算所需要的接种疟原虫的浓度和总量,用pbs配制浓度2.5×106/ml。(v)接种荷瘤小鼠:肿瘤皮下接种第7天后,每只小鼠接种0.2ml,即接种5×105个疟原虫。(3)吉西他滨给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:总剂量100mg/kg;(ⅲ)药物制备:溶解在生理盐水,配置浓度为10mg/ml;(ⅳ)给药时间:gem(d3)治疗组和py+gem(d3)治疗组在肿瘤接种第3天给药,gem(d6)治疗和py+gem(d6)治疗组在肿瘤接种第6天给药。(4)检测指标包括:(ⅰ)肿瘤体积大小测量:每3天进行肿瘤测量,用椭圆体积计算公式计算肿瘤体积(单位立方毫米):(d×d×d)/2,其中“d”表示肿瘤的长径,“d”表示短径。肿瘤大小以平均肿瘤体积±标准平均误差(sem)表示,制作肿瘤生长曲线。通过two-wayanova方差分析进行组间统计分析,当p≤0.05时,用“*”表示,当p≤0.01时,用“**”表示,均说明组间差异具有显著的统计学意义。(ⅱ)小鼠生存统计:存活以中位生存期和延长的存活期的百分数来评定,采用kaplan-meier法估计生存率,做生存曲线图,计算中位生存时间。当p≤0.05时,用“*”表示,当p≤0.01时,用“**”表示,均说明组间差异具有显著的统计学意义。(ⅲ)疟原虫感染率统计:疟原虫感染率以小鼠红细胞感染疟原虫百分数来评定,计算公式为:(感染疟原虫红细胞数目/总红细胞)×100%;具体操作为尾静脉取血涂片,用甲醇固定,并用吉姆萨染液染色,显微镜下观察感染红细胞的疟原虫数量和总红细胞数,总红细胞数在1000个左右,计算疟原虫感染率,感染率以平均感染率±标准平均误差(sem)表示,并绘制疟原虫感染周期曲线,观察化疗药物是否对疟原虫感染有影响。(ⅳ)小鼠体重称重:每3天进行称量,体重生长以平均体重±标准平均误差(sem)来表示,观察化疗药物和疟原虫感染对荷瘤小鼠体重的影响。(5)实验结果(ⅰ)如图1和表1所示:约氏疟原虫治疗组(py),第3天给药的吉西他滨治疗组(gem(d3)),第6天给药的吉西他滨治疗组(gem(d6),第3天给药的吉西他滨联合治疗组(py+gem(d3))和第6天给药的吉西他滨联合治疗组(py+gem(d6))均显著地抑制肺癌的生长。第6天给药的联合治疗组可能比第3天给药的联合治疗组抑制肺癌的效果好,但不具有显著的统计学意义。第6天给药的联合治疗组比单一的约氏疟原虫治疗组、单一的第6天给药的吉西他滨治疗组抑制肺癌的效果更好,具有显著的统计学意义。表1组间比较显著性convspy**convsgem(d3)**convsgem(d6)**convspy+gem(d3)**convspy+gem(d6)**pyvspy+gem(d3)**pyvspy+gem(d6)**gem(d6)vspy+gem(d6)**(ⅱ)如图2和表2所示:对照肿瘤组的中位生存期是30.5天,约氏疟原虫治疗组是38.5天,第3天给药的吉西他滨治疗组是34.5天,第6天给药的吉西他滨治疗组是33天,第3天给药的联合治疗组是42.5天,第6天给药的联合治疗组是45天。约氏疟原虫治疗组(py),第3天给药的吉西他滨治疗组(gem(d3)),第6天给药的吉西他滨治疗组(gem(d6),第3天给药的吉西他滨联合治疗组(py+gem(d3))和第6天给药的吉西他滨联合治疗组(py+gem(d6))都显著地延长荷瘤小鼠的生存期。第6天给药的联合治疗组比第3天给药的联合治疗组的中位生存期长,但不具有显著的统计学意义。第6天给药的联合治疗与单一的约氏疟原虫治疗、单一的吉西他滨治疗的中位生存期长,但生存差异不具有显著的统计学意义。表2组间比较显著性convsgem(d3)*convsgem(d6)**gem(d6)vspy+gem(d6)*(ⅲ)如图3所示:约氏疟原虫治疗组与两个联合治疗组的荷瘤小鼠其原虫血症时程周期比较一致,感染周期都在一个月左右。第3天给药的联合治疗组约氏疟原虫感染高峰期提前,第6天给药的联合治疗组的约氏疟原虫感染高峰期延后。说明吉西他滨对约氏疟原虫有一定的抑制作用,但不会清除疟原虫。(ⅳ)如图4所示:联合治疗组的荷瘤小鼠的体重主要受到疟原虫的影响,受到吉西他滨的影响较小,吉西他滨联合疟原虫使荷瘤小鼠的体重减轻作用叠加。(6)小结:第6天给药的吉西他滨联合组能显著抑制肺癌的生长,延长荷瘤小鼠的中位生存期。吉西他滨对疟原虫有抑制作用,但不清除疟原虫。吉西他滨和疟原虫联合用药会对荷瘤小鼠的体重减轻作用叠加。总剂量100mg/kg、第6天给药的吉西他滨与第7天接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药组合物。实施例2本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物吉西他滨,观察总剂量相同情况下,单次或者分次吉西他滨给药联合约氏疟原虫疗法治疗肺癌效果。本实施例所使用的实验材料和试剂与实施例1相同。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例1相同。(ⅳ)实验分组:按照肿瘤大小随机分为六组:对照肿瘤组(con),约氏疟原虫治疗组(py),单次给药的吉西他滨治疗组(gem(单次)),分次给药的吉西他滨治疗组(gem(分次),单次给药的联合治疗组(py+gem(单次)),分次给药的联合治疗组(py+gem(分次))。每组10只小鼠,共60只。(2)疟原虫接种荷瘤小鼠,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)(ⅳ)(v)与实施例1相同。(3)吉西他滨给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:总剂量为100mg/kg;(ⅲ)药物制备:溶解在生理盐水,配置浓度为5mg/ml和10mg/ml两个浓度;(ⅳ)给药时间:gem(单次)治疗组和py+gem(单次)治疗组在肿瘤接种第6天给药,给药剂量为100mg/kg,药物浓度为10mg/ml。gem(分次)治疗组和py+gem(分次)组分别在肿瘤接种第6、13天给药,每次给药剂量为50mg/kg,药物浓度为5mg/kg。(4)检测指标与实施例1一致。(5)实验结果:(ⅰ)如图5和表3所示:对照肿瘤组(con),约氏疟原虫治疗组(py),单次给药的吉西他滨治疗组(gem(单次)),分次给药的吉西他滨治疗组(gem(分次),单次给药的联合治疗组(py+gem(单次)),分次给药的联合治疗组(py+gem(分次))都显著抑制肺癌的生长。分次给药的吉西他滨联合治疗组比单次给药的吉西他滨给药联合治疗组抑制肺癌生长效果好。两组联合治疗分别都比单一的约氏疟原虫治疗组、单一的吉西他滨治疗组抑制肺癌生长的效果好。表3组间比较显著性convspy**convsgem(单次)**convsgem(分次)**convspy+gem(单次)**convspy+gem(分次)**pyvspy+gem(单次)**pyvspy+gem(分次)**gem(单次)vspy+gem(单次)**gem(分次)vspy+gem(分次)**py+gem(单次)vspy+gem(分次)**(ⅱ)如图6和表4所示:对照肿瘤组的中位生存期是30.5天,约氏疟原虫治疗组是38.5天,单次给药吉西他滨治疗组是33天,分次给药吉西他滨治疗组是38.5天,单次给药吉西他滨联合约氏疟原虫治疗组是45天,分次给药吉西他滨联合约氏疟原虫治疗组是52.5天。两个联合治疗组显著地延长荷瘤小鼠的中位生存期。两个联合治疗组都分别比对应的单一吉西他滨治疗组更加有效地延长荷瘤小鼠的中位生存期。分次给药的联合治疗组比单次给药的联合治疗组更加有效地延长荷瘤小鼠生存期。单次给药的联合治疗与单一的疟原虫治疗的生存差异不具显著的统计学意义,而分次给药的联合治疗比单一的疟原虫治疗更加有效地延长荷瘤小鼠的中位生存期。表4组间比较显著性convspy+gem(单次)*convspy+gem(分次)**pyvspy+gem(分次)**gem(单次)vspy+gem(单次)*gem(分次)vspy+gem(分次)**py+gem(单次)vspy+gem(分次)*(ⅲ)如图7所示:约氏疟原虫治疗组与两个吉西他滨联合治疗组的荷瘤小鼠的原虫血症时程周期比较一致,感染周期在一个月左右。单次和分次吉西他滨给药,都推迟疟原虫高峰期出现时间,分次给药推迟的时间更长。说明吉西他滨对疟原虫有一定的抑制作用。(ⅳ)如图8所示:联合治疗组的荷瘤小鼠的体重主要受到疟原虫的影响,受到吉西他的影响较小,吉西他滨联合疟原虫使荷瘤小鼠的体重减轻作用轻微地叠加,但分次给药比单次给药对荷瘤小鼠小鼠体重影响更小。(6)小结:分次给药吉西他滨联合治疗比单次给药吉西他滨联合治疗具有更有效地抑制肺癌生长和延长荷瘤小鼠的中位生存期的作用。单次和分次的吉西他滨给药对约氏疟原虫都有抑制作用。吉西他滨分次给药比单次给药对荷瘤小鼠的体重影响更小。总剂量100mg/kg、第6与13天分次给药的吉西他滨与第7天接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药组合物。实施例3本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物吉西他滨,观察优化方案的吉西他滨给药联合疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例1相同。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例1相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(con),疟原虫治疗组(py),吉西他滨治疗组(gem),吉西他滨联合疟原虫治疗组(py+gem)。每组15只小鼠,共60只。(2)疟原虫接种荷瘤小鼠,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)(ⅳ)(v)与实施例1相同。(3)吉西他滨给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:100mg/kg;(ⅲ)药物制备:溶解在生理盐水,配置浓度为5mg/ml;(ⅳ)给药时间:gem治疗组和py+gem治疗组在肿瘤接种第6、13天给药,每次给药剂量为50mg/kg。(4)检测指标与实施例1一致。(5)实验结果:(ⅰ)如图9和表5所示:对照肿瘤组(con),疟原虫治疗组(py),吉西他滨治疗组(gem),吉西他滨联合疟原虫治疗组(py+gem)都显著抑制肺癌的生长。吉西他滨与疟原虫的联合治疗比单一的吉西他滨治疗、单一的约氏疟原虫治疗更加有效地抑制肿瘤生长。说明吉西他滨和约氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长的效果。表5组间比较显著性convspy**convsgem**convspy+gem**pyvspy+gem**gemvspy+gem**(ⅱ)如图10和表6所示:对照肿瘤组的中位生存期是26天,约氏疟原虫治疗组是36天,吉西他滨治疗组是36天,联合治疗组是55天。联合治疗比单一的约氏疟原虫治疗、单一的吉西他滨治疗更有效地延长荷瘤小鼠的生存。说明吉西他滨和约氏疟原虫的联合用药物组合物能够显著地延长荷瘤小鼠的生存。表6组间比较显著性convspy**convsgem**convspy+gem**pyvspy+gem**gemvspy+gem**(ⅲ)如图11所示:吉西他滨使疟原虫高峰期推迟,原虫血症时程周期不变。吉西他滨对约氏疟原虫有一定的抑制作用,但是不会清除约氏疟原虫。说明吉西他滨可以与约氏疟原虫联合治疗肺癌,两种疗法干扰较小。(ⅳ)如图12所示:联合治疗组的荷瘤小鼠的体重主要受到疟原虫的影响,受到吉西他的影响较小,吉西他滨与疟原虫联合使荷瘤小鼠的体重减轻作用轻微地叠加,但不会显著地增加荷瘤小鼠的毒副作用。(5)小结:吉西他滨和约氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长和延长荷瘤小鼠的中位生存期的效果,但不会增加荷瘤小鼠的毒副作用。总剂量100mg/kg、在第6、13天分次给药的吉西他滨与第7天接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药组合物。实施例4本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括夏氏疟原虫和化疗药物吉西他滨,观察优化方案的吉西他滨给药联合夏氏疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例3的区别仅在于疟原虫使用小鼠夏氏疟原虫(plasmodiumchabaudi,mra-429,pc),来自malariaresearchandreferencereagentresourcecenter(mr4)免费馈赠。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例3相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(llc),夏氏疟原虫治疗组(pc),吉西他滨治疗组(gem),吉西他滨联合夏氏疟原虫治疗组(pc+gem)。每组10只小鼠,共40只。(2)疟原虫接种荷瘤小鼠,具体方法与实施例3相同。(3)吉西他滨给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:总剂量为100mg/kg;(ⅲ)药物制备:溶解在生理盐水,配置浓度为5mg/ml;(ⅳ)给药时间:gem治疗组和pc+gem治疗组在肿瘤接种第6、13天给药,每次给药剂量为50mg/kg。(4)检测指标与实施例3一致。(5)实验结果:(ⅰ)如图13和表7所示:对照肿瘤组(llc),夏氏疟原虫治疗组(pc),吉西他滨治疗组(gem),吉西他滨联合夏氏疟原虫治疗组(pc+gem)都显著抑制肺癌的生长。联合治疗比单一的夏氏疟原虫治疗组、单一的吉西他滨治疗组更加有效地抑制肿瘤的生长。说明吉西他滨和夏氏疟原虫的联合用药组合物具有更有效地抑制肺癌生长的效果。表7组间比较显著性convspc**convsgem**convspc+gem**pcvspc+gem*gemvspc+gem**(ⅱ)如图14和表8所示:比较荷瘤小鼠中位生存期,肿瘤组是27.5天,夏氏疟原虫治疗组是34天,吉西他滨治疗组是35天,联合治疗组是41天。联合治疗显著延长荷瘤小鼠的生存,但与单一的夏氏疟原虫治疗、单一的吉西他滨治疗的生存差异没有显著的统计学意义。说明吉西他滨与夏氏疟原虫的联合用药组合物能够显著地延长荷瘤小鼠的生存。表8(ⅲ)如图15所示:夏氏疟原虫治疗组和联合治疗组的荷瘤小鼠的原虫血症时程周期一致。吉西他滨对夏氏疟原虫有抑制作用,但是不会清除疟原虫。说明吉西他滨可以与夏氏疟原虫联合治疗肺癌,两种疗法干扰较小。(ⅳ)如图16所示:联合治疗组的荷瘤小鼠的体重主要受到夏氏疟原虫的影响,受到吉西他滨的影响较小,吉西他滨与疟原虫联合使荷瘤小鼠的体重减轻作用轻微地叠加,但不会显著地增加荷瘤小鼠的毒副作用。(6)小结:吉西他滨和夏氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长和延长荷瘤小鼠的中位生存期的效果,但不会增加荷瘤小鼠的毒副作用。总剂量100mg/kg、第6、13天分次给药的吉西他滨与第7天接种的夏氏疟原虫,是很有潜力的的用于治疗肺癌的联合用药组合物。实施例5本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物环磷酰胺,观察环磷酰胺给药联合约氏疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例1的区别仅在于化学治疗药物为环磷酰胺(cyclophosphamide,缩写ctx),购自sigma-aldrich公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例3相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(con),疟原虫治疗组(py),环磷酰胺治疗组(ctx),环磷酰胺联合疟原虫治疗组(py+ctx)。每组11只小鼠,共44只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例3相同。(3)环磷酰胺给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:20mg/kg×3;(ⅲ)药物制备:溶解在生理盐水,配置浓度为2mg/ml;(ⅳ)给药时间:ctx治疗组和py+ctx治疗组在肿瘤接种第6、13、20天给药,每次给药剂量为20mg/kg。(4)检测指标与实施例3相同。(5)实验结果:(ⅰ)如图17和表9所示:对照肿瘤组(con),疟原虫治疗组(py),环磷酰胺治疗组(ctx),环磷酰胺联合疟原虫治疗组(py+ctx)都显著地抑制肺癌的生长。联合治疗比单一的环磷酰胺治疗组、单一的约氏疟原虫治疗组更有效地抑制肿瘤的生长。说明环磷酰胺和约氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长的效果。表9组间比较显著性convspy**convsctx*convspy+ctx**pyvspy+ctx*ctxvspy+ctx**(ⅱ)如图18和表10所示:比较荷瘤小鼠中位生存期,肿瘤组是28.5天,约氏疟原虫治疗组是37.5天,环磷酰胺治疗组是37天,联合治疗组是42.5天。单一的疟原虫治疗组、单一的环磷酰胺治疗组和联合治疗组都显著延长荷瘤小鼠的生存。联合治疗与单一的疟原虫治疗组、单一的环磷酰胺治疗组的生存差异不具有显著的统计学意义,但仍提示环磷酰胺和约氏疟原虫的联合用药物组合物可能延长荷瘤小鼠的生存。表10组间比较显著性convspy*convsctx**convspy+ctx**(ⅲ)如图19所示:环磷酰胺对疟原虫的影响较小,约氏疟原虫治疗组和联合治疗组的荷瘤小鼠的原虫血症感染时程周期比较一致。说明环磷酰胺可以与约氏疟原虫疗法联合用于治疗肺癌,两种疗法干扰较小。(ⅳ)如图20所示:联合治疗组的荷瘤小鼠的体重主要受到夏氏疟原虫的影响,受到环磷酰胺的影响较小,环磷酰胺与疟原虫联合使荷瘤小鼠的体重减轻作用轻微的叠加,但不会显著地增加荷瘤小鼠的毒副作用。(5)小结:环磷酰胺和约氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长和延长荷瘤小鼠的中位生存期的效果,不会显著地增加荷瘤小鼠的毒副作用。总剂量60mg/kg、第6、13和20天分三次给药的环磷酰胺和第7天接种的约氏疟原虫,是很有潜力的的用于治疗肺癌的联合用药组合物。实施例6本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括夏氏疟原虫和化疗药物环磷酰胺,观察优化方案的环磷酰胺给药联合夏氏疟原虫疗法治疗肺的癌效果。本实施例所需的实验材料和试剂包与实施例5的区别仅在于疟原虫为小鼠夏氏疟原虫(plasmodiumchabaudi,mra-429,pc),来自malariaresearchandreferencereagentresourcecenter(mr4)免费馈赠。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例5相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(con),疟原虫治疗组(pc),环磷酰胺治疗组(ctx),环磷酰胺联合疟原虫治疗组(pc+ctx)。每组10只小鼠,共40只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例5相同。(3)环磷酰胺给药的具体方法与实施例5相同。(4)检测指标与实施例5相同。(5)实验结果:(ⅰ)如图21和表11所示:对照肿瘤组(con),疟原虫治疗组(pc),环磷酰胺治疗组(ctx),环磷酰胺联合疟原虫治疗组(pc+ctx)都显著地抑制肺癌的生长。联合治疗比单一的夏氏疟原虫治疗、单一的环磷酰胺治疗更有效地抑制肿瘤的生长。说明环磷酰胺和夏氏疟原虫的联合用药组合物具有更有效地抑制肺癌生长的效果。表11(ⅱ)如图22和表12所示:肿瘤组是27.5天,夏氏疟原虫治疗组是34.5天,环磷酰胺治疗组是39.5天,联合治疗组是42.5天。联合治疗与单一的疟原虫治疗、环磷酰胺治疗的中位生存期长,但生存差异不具有显著的统计学意义,但仍提示夏氏疟原虫和环磷酰胺的联合用药物组合物可能比单一治疗更能延长荷瘤小鼠的生存。表12组间比较显著性convsctx*convspc+ctx**(ⅲ)如图23所示:夏氏疟原虫治疗组和联合治疗组的荷瘤小鼠的原虫血症感染时程周期比较一致,环磷酰胺对夏氏疟原虫的影响较小。说明环磷酰胺可以与夏氏疟原虫疗法联合用于治疗肺癌,两种疗法干扰较小。(ⅳ)如图24所示:联合治疗组的荷瘤小鼠的体重主要受到夏氏疟原虫的影响,受到环磷酰胺的影响较小,环磷酰胺与疟原虫联合使荷瘤小鼠的体重减轻作用轻微的叠加,但不会显著地增加荷瘤小鼠的毒副作用。(6)小结:环磷酰胺与夏氏疟原虫的联合治疗比单一环磷酰胺、单一夏氏疟原虫更有效地抑制肺癌的生长,延长荷瘤小鼠的中位生存期,不会增加荷瘤小鼠的毒副作用。环磷酰胺总剂量60mg/kg、第6、13和20天分三次给药和第7天接种的夏氏疟原虫,是很有潜力的的用于治疗肺癌的联合用药组合物。实施例7本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物培美曲塞,观察优化方案的培美曲塞给药联合约氏疟原虫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例3的区别仅在于化学治疗药物为培美曲塞(缩写pem),购自sigma-aldrich公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例3相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(con),疟原虫治疗组(py),培美曲塞治疗组(pem),培美曲塞联合疟原虫治疗组(py+pem)。每组10只小鼠,共40只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例3相同。(3)培美曲塞给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:20mg/kg×6;(ⅲ)药物制备:溶解在生理盐水,配置浓度为2mg/ml;(ⅳ)给药时间:pem组和py+pem组在肿瘤接种第3、7、10、14、17、21天给药,每次给药剂量为20mg/kg。(4)检测指标与实施例3相同。(5)实验结果:(ⅰ)如图25和表13所示:对照肿瘤组(con),疟原虫治疗组(py),培美曲塞治疗组(pem),培美曲塞联合疟原虫治疗组(py+pem)都显著抑制肺癌的生长。联合治疗比单一的培美曲塞治疗、单一的约氏疟原虫治疗更有效地抑制肿瘤的生长。说明培美曲塞和约氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长的效果。表13组间比较显著性convspy**convspem**convspy+pem**pyvspy+pem*pemvspy+pem**(ⅱ)如图26和表14所示:对照肿瘤组的中位生存期是28天,约氏疟原虫治疗组是37天,培美曲塞治疗组是32.5天,联合治疗组是43天。联合治疗比单一的疟原虫治疗、单一的疟原虫治疗的中位生存期长,与单一的培美曲塞治疗的生存差异具有显著的统计学意义,与单一的疟原虫治疗的生存差异没有显著的统计学意义。提示培美曲塞和约氏疟原虫的联合用药物组合物可能比单一的治疗更加有效地延长荷瘤小鼠的生存期。表14组间比较显著性convspy*convspy+pem**pemvspy+pem*(ⅲ)如图27所示:约氏疟原虫治疗组和联合治疗组的荷瘤小鼠的原虫血症时程周期比较一致。培美曲塞对疟原虫的影响较小。(ⅳ)如图28所示:联合治疗组的荷瘤小鼠的体重受到夏氏疟原虫和培美曲塞的双重影响,培美曲塞与疟原虫联合使荷瘤小鼠的体重减轻作用叠加,影响荷瘤小鼠的生存。(6)小结:培美曲塞和约氏疟原虫的联合治疗具有更加有效地抑制肺癌的生长和延长荷瘤小鼠的中位生存期的效果。培美曲塞对约氏疟原虫没有抑制作用,但联合用药会使荷瘤小鼠体重更轻,影响荷瘤小鼠的生存。培美曲塞总剂量120mg/kg、第3、7、10、13、17、20天分六次给药的培美曲塞给药和第7天接种约氏疟原虫,是很有潜力的的用于治疗肺癌的联合用药组合物。实施例8本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物顺铂,观察顺铂联合约氏疟原虫疗法治疗肺癌的效果。本实施例所需的实验材料与实施例3的区别仅在于化学治疗药物为顺铂(cis-platinum,缩写ddp),购自sigma-aldrich公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例3相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(con),疟原虫治疗组(py),顺铂治疗组(ddp),顺铂联合疟原虫治疗组(py+ddp)。每组11只小鼠,共44只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例3相同。(3)顺铂给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:1mg/kg×7;(ⅲ)药物制备:溶解在生理盐水,配置浓度为0.1mg/ml;(ⅳ)给药时间:ddp治疗组和py+ddp治疗组在肿瘤接种第7天开始给药,每两天给一次药,给药两周,每次给药剂量为1mg/kg。(4)检测指标与实施例3相同。(5)实验结果:(ⅰ)如图29和表15所示:对照肿瘤组(con),疟原虫治疗组(py),顺铂治疗组(ddp),顺铂联合疟原虫治疗组(py+ddp)都显著抑制肺癌的生长。联合治疗比单一的顺铂治疗、单一的约氏疟原虫治疗更有效地抑制肿瘤的生长。说明顺铂和约氏疟原虫的联合用药物组合物具有更有效地的抑制肺癌生长的效果。表15组间比较显著性convspy**convsddp**convspy+ddp**pyvspy+ddp*ddpvspy+ddp*(ⅱ)如图30和表16所示:比较荷瘤小鼠中位生存期,肿瘤组是27天,约氏疟原虫治疗组是37天,顺铂治疗组是30天,联合治疗组是38天。疟原虫治疗和联合治疗都延长荷瘤小鼠的生存。联合治疗组与单一的疟原虫治疗组相比并没有显著延长荷瘤小鼠的中位生存期,生存差异没有显著的统计学意义。表16组间比较显著性convspy*convspy+ddp*ddpvspy+ddp*(ⅲ)如图31所示:联合治疗组比单一的约氏疟原虫治疗组的荷瘤小鼠的原虫血症时程周期短其原虫血症峰值也较低,提示顺铂对疟原虫有抑制作用。(ⅳ)如图32所示:顺铂联合约氏疟原虫治疗组的荷瘤小鼠要受到顺铂和疟原虫的双重影响,顺铂治疗和疟原虫都使荷瘤小鼠体重降低。(6)小结:顺铂与约氏疟原虫的联合治疗比单一的顺铂治疗、单一的约氏疟原虫治疗更有效地抑制肺癌的生长,但并没有显著延长中位生存期。顺铂对约氏疟原虫感染周期有显著影响,顺铂和约氏疟原虫联合用药会使荷瘤小鼠体重更轻。总剂量7mg/kg、第7天开始给药两周的顺铂和第7天接种的约氏疟原虫,是很有潜力的治疗肺癌的联合用药组合物。实施例9本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和丝裂霉素,观察不同剂量的丝裂霉素联合约氏疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例3的区别仅在于化学治疗药物为丝裂霉素(mitomycin,缩写mmc),购自sigma-aldrich公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例3相同。(ⅳ)实验分组:按照肿瘤大小随机分为五组:对照肿瘤组(con),疟原虫疗组(py),低剂量丝裂霉素联合疟原虫治疗组(py+mmc(低剂量)),中剂量丝裂霉素联合疟原虫治疗组(py+mmc(中剂量)),高剂量丝裂霉素联合疟原虫治疗组(py+mmc(高剂量))。每组10只小鼠,共50只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例3相同。(3)丝裂霉素给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:低剂量为0.027mg/kg×2,中剂量为0.083mg/kg×2,高剂量为0.25mg/kg×2;(ⅲ)药物制备:溶解在生理盐水,配置浓度为0.027、0.083和0.25mg/ml等三个浓度;(ⅳ)给药时间:(py+mmc(低剂量))、(py+mmc(中剂量))和(llc+py+mmc(高剂量))组在肿瘤接种第11、18天给药。(4)检测指标与实施例3相同。(5)实验结果:(ⅰ)如图33和表17所示:对照肿瘤组(con),疟原虫疗组(py),低剂量丝裂霉素联合疟原虫治疗组(py+mmc(低剂量)),中剂量丝裂霉素联合疟原虫治疗组(py+mmc(中剂量)),高剂量丝裂霉素联合疟原虫治疗组(py+mmc(高剂量))都显著抑制肺癌的生长。联合治疗表现出丝裂霉素的剂量依赖效应,剂量越大,抑制肺癌的生长的效果越好。说明约氏疟原虫和丝裂霉素的联合用药具有更有效地抑制肺癌生长的效果。表17组间比较显著性convspy**convspy+mmc(低剂量)**convspy+mmc(中剂量)**convspy+mmc(高剂量)**pyvspy+mmc(低剂量)*pyvspy+mmc(中剂量)**pyvspy+mmc(高剂量)**py+mmc(低剂量)vspy+mmc(高剂量)**py+mmc(中剂量)vspy+mmc(高剂量)**(ⅱ)如图34和表18所示:肿瘤组是28天,单一的约氏疟原虫治疗组是36天,低剂量的丝裂霉素的联合治疗组是44天,中剂量的丝裂霉素的联合治疗组是34天,高剂量的丝裂霉素的联合治疗组是31天。低剂量的丝裂霉素联合治疗组比中、高剂量的丝裂霉素的联合治疗组更有效地延长荷瘤小鼠的生存期,说明低剂量的丝裂霉素和约氏疟原虫的联合用药能更有效地延长荷瘤小鼠的生存期。中、高剂量的丝裂霉素可能存在一定的毒副作用。表18组间比较显著性convspy*convspy+mmc(低剂量)**py+mmc(低剂量)vspy+mmc(高剂量)*py+mmc(中剂量)vspy+mmc(高剂量)**(ⅲ)如图35所示:三个联合治疗的荷瘤小鼠的原虫血症高峰期出现的时间并不一致,丝裂霉素浓度越高,高峰期出现时间越推后。丝裂霉素对疟原虫有一定程度的抑制作用,浓度越高,抑制越明显,但不会清除疟原虫。(ⅳ)如图36所示:三个联合治疗组的荷瘤小鼠的体重主要受到疟原虫的影响,受到丝裂霉素的影响较小。(6)小结:低剂量的丝裂霉素给药与约氏疟原虫的联合治疗能更有效地抑制肺癌的生长和延长荷瘤小鼠的生存期。低丝裂霉素对约氏疟原虫有轻微的抑制作用,但不会清除疟原虫。中、高剂量有一定的毒副作用,不适合与疟原虫联合治疗肺癌。总剂量0.054mg/kg、第11、18天分次给药的丝裂霉素和第7天接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药组合物。实施例10本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物多西他赛,观察不同剂量的多西他赛给药联合约氏疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例9的区别仅在于化学治疗药物为多西他赛(docetaxel,缩写dtx),购自赛诺菲公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例9相同。(ⅳ)实验分组:按照肿瘤大小随机分为五组:对照肿瘤组(con),疟原虫治疗组(py),低剂量的多西他赛联合疟原虫治疗组(py+dtx(低剂量)),中剂量的多西他赛联合疟原虫治疗组(py+mmc(中剂量)),高剂量的多西他赛联合疟原虫治疗组(py+mmc(高剂量))。每组10只小鼠,共50只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例9相同。(3)多西他赛给药,具体方法为:(ⅰ)给药方式:静脉注射给药;(ⅱ)给药剂量:低剂量为2.2mg/kg×3,中剂量为6.7mg/kg×3,高剂量为2mg/kg×3;(ⅲ)药物制备:溶解在生理盐水,配置浓度为0.22、0.673和2mg/ml等三个浓度;(ⅳ)给药时间:(py+dtx(低剂量))、(py+dtx(中剂量))和(py+dtx(高剂量))组在肿瘤接种第3、10、17天给药。(4)检测指标与实施例9相同。(5)实验结果:(ⅰ)如图37和表19所示:对照肿瘤组(con),疟原虫治疗组(py),低剂量的多西他赛联合疟原虫治疗组(py+dtx(低剂量)),中剂量的多西他赛联合疟原虫治疗组(py+mmc(中剂量)),高剂量的多西他赛联合疟原虫治疗组(py+mmc(高剂量))都能显著抑制肺癌的生长。三个联合治疗都比单一的疟原虫治疗的抑制肺癌生长的效果好。在联合治疗中,中剂量多西他赛的联合治疗抑瘤效果最好,高剂量次之,低剂量最差。说明多西他赛与约氏疟原虫的联合用药能更加有效地抑制肺癌的生长,但并不表现为多西他赛的剂量依赖关系。表19(ⅱ)如图38和表20所示:肿瘤组是28天,单一的约氏疟原虫治疗组是36天,低剂量的多西他赛的联合治疗组是38天,中剂量剂量的多西他赛的联合治疗组是41天,高剂量的多西他赛的联合治疗组是30.5天。单一的约氏疟原虫治疗和中、低剂量的多西他赛的联合治疗能更有效地延长荷瘤小鼠的生存期,而高剂量的多西他赛的联合治疗不能延长荷瘤小鼠的生存期。中、低剂量的两组联合治疗与单一的约氏疟原虫治疗的生存差异不具有显著的统计学意义。中、高剂量的多西他赛可能存在一定的毒副作用。表20组间比较显著性convspy*convspy+dtx(低剂量)**convspy+dtx(中剂量)**py+dtx(中剂量)vspy+dtx(高剂量)*(ⅲ)如图39所示:单一的约氏疟原虫治疗组和三个联合治疗组的荷瘤小鼠的原虫血症时程周期出现不一致。说明中、高剂量的多西他赛显著抑制疟原虫,导致感染周期异常,低剂量对疟原虫影响较小。(ⅳ)如图40所示:单一的约氏疟原虫治疗组和联合治疗组的荷瘤小鼠的体重受到疟原虫和多西他赛双重影响。联合治疗中,高剂量的多西他赛对荷瘤小鼠体重下降作用非常明显,中、低剂量的多西他赛则影响较小。(6)小结:中剂量的多西他赛与约氏疟原虫的联合治疗能更有效地抑制肺癌的生长和延长荷瘤小鼠的中位生存期。总剂量6.7mg/kg、第3、10、17天分次给药的多西他赛和第7天接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药物组合物。实施例11本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和化疗药物依托泊苷,观察不同剂量的依托泊苷给药联合约氏疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例9的区别仅在于化学治疗药物为依托泊苷(etoposide,缩写vp16),购自百时美施贵宝公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例9相同。(ⅳ)实验分组:按照肿瘤大小随机分为五组:对照肿瘤组(con),疟原虫治疗组(py),低剂量的依托泊苷联合疟原虫治疗组(py+vp16(低剂量)),高剂量的多西他赛联合疟原虫治疗组(py+vp16(高剂量))。每组10只小鼠,共40只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例9相同。(3)依托泊苷给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:低剂量为10mg/kg×3,高剂量为30mg/kg×3;(ⅲ)药物制备:溶解在生理盐水,配置浓度为1和3mg/ml等三个浓度;(ⅳ)给药时间:(py+vp16(低剂量))和(py+vp16(高剂量))组,在肿瘤接种第11、14、17天给药。(4)检测指标与实施例9相同。(5)实验结果:(ⅰ)如图41和表21所示:对照肿瘤组(con),疟原虫治疗组(py),低剂量的依托泊苷联合疟原虫治疗组(py+vp16(低剂量)),高剂量的多西他赛联合疟原虫治疗组(py+vp16(高剂量))都能显著抑制肺癌的生长。低剂量的依托泊苷联合治疗与高剂量的联合治疗相比抑制肺癌生长的效果好。低剂量的依托泊苷联合治疗与单一的疟原虫治疗相比抑制肺癌生长的效果好。说明低剂量的依托泊苷和约氏疟原虫的联合用药物组合物具有更有效地抑制肺癌生长的效果。表21组间比较显著性convspy**convspy+vp16(低剂量)**convspy+vp16(高剂量)**pyvspy+vp16(低剂量)*py+vp16(低剂量)vspy+vp16(高剂量)*(ⅱ)如图42和表22所示:肿瘤组是28天,约氏疟原虫治疗组是36天,低剂量的依托泊苷联合治疗组是44天,高剂量的依托泊苷联合治疗组是40.5天。单一的约氏疟原虫治疗和高、低剂量的依托泊苷的联合治疗都能延长荷瘤小鼠的生存期。低剂量的依托泊苷的联合治疗与高剂量的依托泊苷的联合治疗的中位生存期长,但生存差异不具有显著的统计学意义。高剂量的依托泊苷可能存在一定的毒副作用。低剂量的依托泊苷与约氏疟原虫的联合治疗可能有效地延长荷瘤小鼠的生存期。表22组间比较显著性convspy*convspy+vp16(低剂量)**convspy+vp16(高剂量)**(ⅲ)如图43所示:约氏疟原虫治疗组和两个联合约氏疟原虫治疗组的荷瘤小鼠的原虫血症时程周期不一致。说明依托泊苷对疟原虫有明显的抑制作用。(ⅳ)如图44所示:高、低剂量的依托泊苷联合约氏疟原虫治疗组的荷瘤小鼠的体重受到疟原虫和依托泊苷双重影响,使得荷瘤小鼠体重更轻。(6)小结:低剂量的依托泊苷联合约氏疟原虫能更有效地抑制肺癌的生长和延长荷瘤小鼠的中位生存期。高、低依托泊苷对约氏疟原虫感染均有抑制作用,但不会清除疟原虫。总剂量30mg/kg、第11、14、17天分次给药的依托泊苷和在第7天疟原虫接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药物组合物。实施例12本实施例提供一种抗肿瘤的联合用药物组合物,所述联合用药物组合物包括约氏疟原虫和hiv蛋白酶抑制剂奈非那韦,观察奈非那韦给药联合约氏疟原虫免疫疗法治疗肺癌的效果。本实施例所需的实验材料和试剂与实施例9的区别仅在于化学治疗药物为奈非那韦(nelfinavir,缩写nfv),购自阿古龙医药制品公司。(1)建立动物模型,具体方法为:步骤(ⅰ)(ⅱ)(ⅲ)与实施例9相同。(ⅳ)实验分组:按照肿瘤大小随机分为四组:对照肿瘤组(con),疟原虫治疗组(py),奈非那韦治疗组(nfv),奈非那韦联合疟原虫治疗组(py+ctx)。每组10只小鼠,共40只。(2)疟原虫接种荷瘤小鼠的具体方法与实施例9相同。(3)奈非那韦给药,具体方法为:(ⅰ)给药方式:腹腔注射给药;(ⅱ)给药剂量:400mg/kg×10;(ⅲ)药物制备:溶解在生理盐水,配置浓度为40mg/ml;(ⅳ)给药时间:nfv和py+nfv在肿瘤接种第10天开始给药,连续给药10天,每次给药剂量为400mg/kg。(4)检测指标与实施例9相同。(5)实验结果:(ⅰ)如图45和表23所示:对照肿瘤组(con),疟原虫治疗组(py),奈非那韦治疗组(nfv),奈非那韦联合疟原虫治疗组(py+ctx)都有效地抑制肺癌的生长。联合治疗比单一的奈非那韦治疗、单一的约氏疟原虫能更有效地抑制肿瘤的生长。说明奈非那韦和约氏疟原虫的联合用药组合物具有更有效地抑制肺癌生长的效果。表23组间比较显著性convspy**convsnfv**convspy+nfv**pyvspy+nfv**nfvvspy+nfv**(ⅱ)如图46和表24所示:比较荷瘤小鼠中位生存期,肿瘤组是29天,约氏疟原虫治疗组是38天,奈非那韦治疗组是34天,奈非那韦联合约氏疟原虫治疗组是44天。单一的疟原虫治疗和联合治疗组都更有效地延长荷瘤小鼠的中位生存期。联合治疗比单一的奈非那韦治疗更有效地延长荷瘤小鼠的中位生存期,但与单一的疟原虫治疗的生存差异不具有显著的统计学意义。提示奈非那韦和约氏疟原虫的联合用药组合物可能更有效地延长荷瘤小鼠的中位生存期。表24组间比较显著性convspy*convspy+nfv**nfvvspy+nfv*(ⅲ)如图47所示:单一的约氏疟原虫治疗组和联合治疗组的荷瘤小鼠的原虫血症时程周期比较一致。奈非那韦对疟原虫的影响较小,奈非那韦可以与约氏疟原虫疗法联合用于治疗肺癌。(ⅳ)如图48所示:单一的奈非那韦持续灌胃给药对荷瘤小鼠体重影响比较小,但联合治疗组的荷瘤小鼠的体重主要受疟原虫和奈非那韦持续灌胃给药的影响。(6)小结:奈非那韦与约氏疟原虫的联合治疗能更有效地抑制肺癌的生长,更好的延长荷瘤小鼠的中位生存期。奈非那韦不会增加荷瘤小鼠的毒副作用。总剂量4g/kg、第10天开始给药持续10天给药的奈非那韦和第7天接种的约氏疟原虫,是很有潜力的用于治疗肺癌的联合用药物组合物。申请人声明,本发明通过上述实施例来说明本发明的疟原虫免疫疗法联合化疗的多种组合方法及其在癌症治疗方面的应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属
技术领域:
的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1