金诺芬在制备治疗遗传性血色病药物中的应用的制作方法
本发明涉及化合物金诺芬(auranofin)在治疗遗传性血色病中的应用。
背景技术:
铁调素是铁代谢过程中的关键调节分子,是维持人体系统性铁平衡的核心因子,可以通过调节小肠上皮细胞和巨噬细胞表面的相关铁转运蛋白来调控机体储存和利用铁的功能,维持机体的铁稳态平衡。铁调素表达异常,会引起机体的铁稳态出现紊乱,造成机体铁的缺失或蓄积,造成机体系统功能受损及脏器的损伤,引起疾病的发生。尤其是铁过载,会导致一系列重大慢性疾病,如肝硬化、肿瘤、心血管疾病、糖尿病等,严重影响了我国居民的生活质量。
遗传性血色病为基因变异导致的一种与铁代谢有关的铁过载综合征,其主要特征是进入血液中的铁的总量超过了红细胞生成所需要的量。这种疾病造成的铁蓄积是一个慢性的无症状的过程,患者在30岁之前无明显症状,多余的铁可以积聚在肝脏、心脏、内分泌腺体等组织,并导致器官的损伤。
目前现有的遗传性血色病的治疗手段十分有限,主要包括两类:1)通过放血疗法等外科手段降低机体铁水平,对病人损伤较大;2)口服铁离子螯合剂,如地拉罗斯、edta二钠等,需长期持续服药,用药成本高,且效果不稳定。
金诺芬(auranofin)是由smithkline&french研制的一类专为治疗类风湿性关节炎的口服金制剂。金诺芬微溶于水,易溶于类脂体。在1985年被美国食品和药物管理局(fda)批准用于治疗类风湿性关节炎。金诺芬经口服给药后,血浆中可以检测到15%~25%的药物,主要与白蛋白结合。药物血浆半衰期为15~25天,55~80天后几乎完全排出体外。85%的金诺芬通过粪便排泄,仅有15%通过尿液排泄,而肾脏中仅仅会蓄积0.4%的给药剂量。
技术实现要素:
本发明要解决的技术问题是提供金诺芬在制备治疗遗传性血色病药物中的应用,为防治铁代谢紊乱引起的铁过载性疾病提供新的治疗方案。
为了解决上述技术问题,本发明提供金诺芬在制备治疗遗传性血色病药物中的应用。
在人源肝癌细胞系huh7细胞中,发明人发现金诺芬能激活jak-stat3通路下游基因铁调素hepcidin的表达,并呈现较强的时间、剂量依赖性。通过jak-stat3信号通路抑制剂stattic的刺激,发现stattic能显著抑制金诺芬引起的stat3的磷酸化水平。基于此,进一步研究发现,金诺芬能在体内通过nf-κb通路显著上调il-6表达,继而显著激活jak-stat3信号通路的磷酸化水平,从而激活下游通路基因的转录。此外,通过双荧光素酶报告系统,实验发现金诺芬能够显著激活铁调素启动子活性。同时,本发明进一步在遗传性血色病小鼠模型中进行实验,发现金诺芬可以显著降低雄性小鼠模型的机体铁水平。
综上,金诺芬能通过nf-κb通路显著上调il-6表达,继而显著激活jak-stat3信号通路的磷酸化水平,从而激活下游通路基因的转录。基于金诺芬的药物特性,金诺芬可应用于临床遗传性血色病的治疗。同时,金诺芬也为临床上因铁调素减少引起的铁过载性疾病的治疗提供了可能,如地中海性贫血等。
当作为治疗遗传性血色病的药物时,金诺芬的用法和用量可为:0.4mg/kg体重,每天静脉注射,持续1个月。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
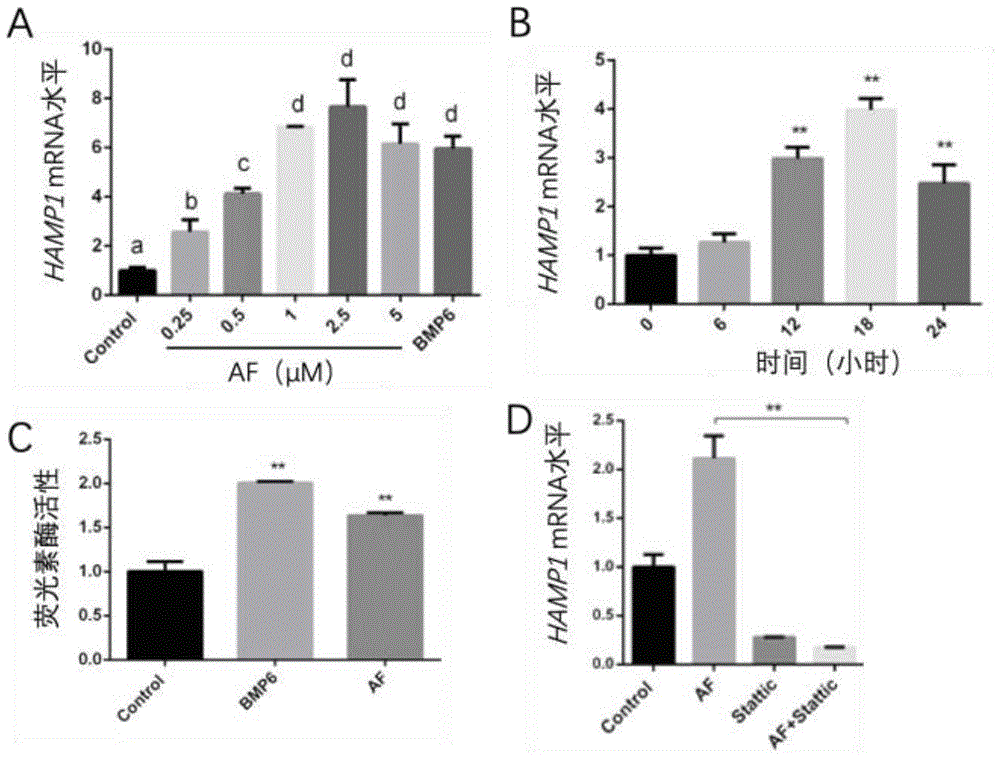
图1是体现金诺芬体外激活hepcidin表达的图;
a:不同浓度的金诺芬作用于huh7细胞12小时,实时荧光定量pcr检测hamp1基因表达水平;
b:0.5μm金诺芬分别处理huh7细胞6h、12h、18h、24h后,提取rna,实时荧光定量pcr检测hamp1基因表达水平;
c:双荧光素酶报告基因实验检测金诺芬对hepcidin启动子的作用;
d:stattic(10μm)预处理1小时,0.5μm金诺芬处理18h,提取细胞rna,实时荧光定量pcr检测hamp1基因表达水平。
图2是体现金诺芬体内通过nf-κb-il-6-stat3激活hepcidin表达、降低铁水平的图;
a:8周龄c57bl/6雄鼠,5mg/kg金诺芬腹腔注射一次,在注射后0h、3h、6h、12h、24h处理小鼠并取肝脏组织,提取rna,实时荧光定量pcr检测hamp1表达;
b:8周龄c57bl/6雄鼠腹腔注射5mg/kg金诺芬,检测注射后0小时、3小时、6小时、12小时、24小时血清铁水平;
c:8周龄c57bl/6雄鼠腹腔注射5mg/kg金诺芬,检测注射后0小时、3小时、6小时、12小时、24小时血清转铁蛋白饱和度;
d:c57bl/6雄鼠注射金诺芬后0小时、3小时、6小时血清il-6水平;
e:8周龄c57bl/6小鼠腹腔注射5mg/kg金诺芬,分别在注射后0小时、3小时、6小时、12小时、24小时,取肝脏组织westernblot检测nf-κb通路关键蛋白iκb-α、p65的磷酸化水平。
图3是体现金诺芬激活hfe-/-雄鼠肝脏hepcidin、降低机体铁水平的图;
a:8周龄hfe-/-雄鼠,金诺芬(每天5mg/kg体重)腹腔注射6周,肝脏hamp1表达;
b:8周龄hfe-/-雄鼠,金诺芬(每天5mg/kg体重)腹腔注射6周,血清铁水平;
c:8周龄hfe-/-雄鼠,金诺芬(每天5mg/kg体重)腹腔注射6周,各脏器组织铁含量;
d:8周龄hfe-/-雄鼠,金诺芬(每天5mg/kg体重)腹腔注射6周,肝脏普鲁士蓝染色。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:
1材料和方法
1.1实验细胞
人肝癌细胞株huh7和人肾脏细胞株hek293t,两种细胞株均购买于中国科学院上海生命科学院细胞库。
1.2实验动物
8周龄spf级c57bl/6小鼠(80只,雌雄各半)购买于北京维通利华实验动物技术有限公司。spf级的动物饲养环境中饲养。
1.3rna提取和realtime-pcr
trizol(lifetechnologies)法提取细胞和组织的rna,具体操作按说明书进行。nanodrop1000spectrophotometer上检测rna纯度(od260/od280≈1.9-2.1)及rna浓度(ng/μl),调整rna浓度到1μg/μl。2.0μgrna经dnase(promega)处理后,m-mlv反转录酶(promega)和oligo(dt)18primer(takarabioinc.)进行反转录。cfx96real-timesystem(bio-rad)中进行realtimepcr,试剂采用iqsybrgreensupermix(bio-rad),反应体系为10μl,包括sybgreen5μl、cdna1μl、引物2μl、ddh2o2μl。real-time程序为95℃预变性3分钟,40个循环(每个循环95℃10秒,60℃15秒过程中检测荧光),检测溶解曲线。引物序列如下:
mouseactb(β-actin):
forwardaaatcgtgcgtgacatcaaaga
reversegccatctcctgctcgaagtc
mousehamp1:
forwardgcaccacctatctccatcaac
reversettcttccccgtgcaaagg;
1.4统计方法
所用统计采用r软件分析,实验数据以mean±sd表示。多于两组间比较采用tukey’s检验(anova),两组间比较以student'st-test检验,以p<0.05认为有统计学意义。
2结果
2.1金诺芬通过激活stat3磷酸化上调huh7细胞hamp1表达水平:
以人肝癌细胞系huh7细胞为实验对象,6孔板中培养。在培养基中加入二甲亚砜dmso作为空白对照组,在培养基中分别加入金诺芬(0.25μm)、金诺芬(0.5μm)、金诺芬(1μm)、金诺芬(2.5μm)、金诺芬(5μm)作为实验组,在培养基中加入人源重组bmp6(50ng/ml)作为阳性对照。12小时后收细胞,提取细胞rna,反转cdna,实时荧光定量pcr检测hamp1表达水平。每个处理设3个复孔,实验重复三次。实验发现金诺芬可以上调huh7细胞的hamp1表达水平,且上调作用与药物浓度呈相关性,如图1(a)所示。
6孔板培养huh7细胞,在培养基中加入金诺芬(0.5μm),分别于0小时、6小时、12小时、18小时、24小时后收细胞,提取细胞rna,反转cdna,实时荧光定量pcr检测hamp1表达水平。每个处理设3个复孔,实验重复三次。实验发现金诺芬(0.5μm)上调huh7细胞的hamp1表达水平与处理时间呈相关性,在处理18小时后作用最显著,如图1(b)所示。
以hek293t细胞系为实验对象,共同转染hamp1-promotor2.7kb-pgl3和内参renilla报告基因质粒36小时后,以加入二甲亚砜dmso作为空白对照;加入金诺芬(0.5μm)作为实验组,人源重组bmp6(50ng/ml)作为阳性对照。处理18小时后,裂解细胞,收集离心上清液,用双荧光素酶报告基因检测上清液内荧光酶素活性。实验发现,金诺芬可以激活hepcidin启动子的活性。如图1(c)所示。
以人肝癌细胞系huh7细胞为实验对象,6孔板中培养。在培养基中分别加入二甲亚砜dmso,金诺芬(0.5μm),stat3通路抑制剂stattic(10μm),金诺芬(0.5μm)+stat3通路抑制剂stattic(10μm)。处理18小时后,提取细胞rna,反转cdna,实时荧光定量pcr检测hamp1表达水平。实验发现,stat3通路抑制剂stattic可以抑制金诺芬对hamp1表达水平的作用,说明金诺芬上调hamp1表达水平依赖stat3通路,如图1(d)所示。
2.2金诺芬通过nf-κb-il-6-stat3激活hepcidin表达,降低c57bl/6小鼠铁水平:
给予8周龄c57bl/6小鼠急性注射,采用腹腔注射的方式,注射一次金诺芬(5mg/kg),分别在注射后的0小时、3小时、6小时、12小时及24小时对相应组别的小鼠处理、采集组织样品,检测血清铁相关指标、血清白介素-6(il-6)水平、肝脏hamp1表达水平以及肝脏hepcidin调控通路关键蛋白表达水平等。
实验发现,金诺芬可以通过上调c57bl/6小鼠肝脏hepcidin水平,降低c57bl/6小鼠体内的血清铁水平和转铁蛋白饱和度;如图2(a-c)所示。金诺芬可以通过上调c57bl/6小鼠血清il-6水平;如图2(d)所示。同时,金诺芬可以激活c57bl/6小鼠肝脏p65、iκb磷酸化;如图2(e)所示。说明金诺芬上调hepcidin与激活jak2/stat3通路有关,推测主要机制为通过nf-κb通路上调il-6,激活jak2/stat3通路上调hepcidin。
2.3金诺芬可以有效改善血色病小鼠铁蓄积:
遗传性血色病是一种慢性铁负荷过多性疾病,遗传性血色素沉着症伴有hfe突变(hfe-hh)。hfe敲除(hfe-/-)小鼠为经典血色病动物模型,其表型与hfe-hh患者症状相似,表现为铁调素表达异常下降,全身铁过载。
8周hfe-/-雄性小鼠随机分为对照组和实验组,每组10只。实验组给予5mg/kg金诺芬,对照组注射同等剂量的生理盐水(溶剂)。采取腹腔注射的方式,每天注射一次,连续注射6周后处理小鼠、取组织样品,检测血清铁水平、组织铁水平、肝脏hamp1表达水平以及肝脏铁染色等。
实验发现,金诺芬可以上调hfe-/-雄性小鼠肝脏hamp1表达水平,如图3(a)所示。金诺芬可以下调hfe-/-雄性小鼠血清铁水平,如图3(b)所示。金诺芬可以下调hfe-/-雄性小鼠肝脏铁、脾脏铁水平,如图3(c)所示。金诺芬可以改善hfe-/-雄性小鼠肝脏铁蓄积,如图3(d)所示。说明金诺芬可以通过上调血色病小鼠肝脏的hamp1表达,以降低血清铁及肝脏、脾脏铁,改善血色病小鼠肝脏铁蓄积。
基于此,金诺芬上调铁调素hepcidin降低机体铁水平是治疗铁过载相关疾病(血色病)的治疗方法。
目前现有的治疗关节炎常用药物还包括非甾体抗炎药(如布洛芬)、阿片类药物(如羟考酮)和激素类药物(如地塞米松)等;在发明过程中,将布洛芬、利多卡因、地塞米松、琥珀胆碱、泼尼松龙、格列齐特、前列腺素等药物如同金诺芬针对huh7细胞系和小鼠进行了相应检测,发现除了金诺芬,上述这些治疗关节炎药物均不能上调hepcidin或者降低小鼠血清及肝脏铁含量。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
序列表
<110>郑州大学
<120>金诺芬在制备治疗遗传性血色病药物中的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>1
aaatcgtgcgtgacatcaaaga22
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
gccatctcctgctcgaagtc20
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcaccacctatctccatcaac21
<210>4
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttcttccccgtgcaaagg18
- 还没有人留言评论。精彩留言会获得点赞!