1,2,3,4,6-五没食子酰葡萄糖在制备防治骨质疏松症药品中的应用的制作方法
本发明属于骨质疏松症防治技术领域,具体涉及1,2,3,4,6-五没食子酰葡萄糖在制备防治骨质疏松症药品中的应用。
背景技术:
骨质疏松症(osteoporosis,op)是最常见的骨骼疾病,是一种以骨量低、骨组织微结构损坏,导致骨脆性增加、易发生骨折为特征的全身性骨病。op不仅对患者和社会造成巨大的经济负担,并且严重降低中老年人生活质量,危及中老年人的健康。骨代谢主要以骨重建的方式进行。骨重建包括由成骨细胞(osteoblast,ob)介导骨形成和由来源于骨髓造血系统的破骨细胞(osteoclast,oc)介导骨吸收。当oc的骨吸收能力增强,超过了ob的骨形成水平,将会诱发op。
临床上op的治疗药物按照其作用机制可以分为以下几类:(1)拮抗骨吸收药物:雌激素、降钙素(ct)和双膦酸盐等;(2)促骨形成药物:维生素k和氟化物等;(3)骨矿类药物:钙剂、维生素d及硼制剂等。这些药物存在不同程度的毒副作用,长期应用存在治疗效果低下及成骨质量不好等问题,因此寻找新的op治疗药物是世界性的难点与热点。中医在“整体观念”与辨证施治的医学理论指导下,对op的治疗和预防上突显出独特的优势,引起国内外学者的广泛关注。
1,2,3,4,6-五没食子酰葡萄糖是一类无毒副作用鞣质类天然化合物,五倍子中含量最高,其次是牡丹皮和芍药。目前现有技术中还没有关于1,2,3,4,6-五没食子酰葡萄糖在防治骨质疏松的报道。
技术实现要素:
解决的技术问题:本发明的目的是在1,2,3,4,6-五没食子酰葡萄糖现有药理作用的基础上,通过大量实验深入研究开发其药理功效,提供1,2,3,4,6-五没食子酰葡萄糖在防治骨质疏松症的新用途,以进一步提升其药用价值。
技术方案:1,2,3,4,6-五没食子酰葡萄糖在制备防治骨质疏松症药品中的应用。
所述骨质疏松症是一种以骨量降低、骨微结构破坏,导致骨脆性增加、易发生骨折为特征的全身性骨病。
进一步地,所述骨质疏松症包括原发性骨质疏松症和继发性骨质疏松症。
进一步地,所述原发性骨质疏松症为女性绝经后骨质疏松症或老年退化性骨质疏松症。
进一步地,所述继发性骨质疏松症为由内分泌代谢疾病、结缔组织疾病、肾脏疾病、消化道疾病和/或药物引起的骨质疏松症。
进一步地,所述应用是将1,2,3,4,6-五没食子酰葡萄糖和药剂学上可接受辅料制成丸剂、片剂、胶囊剂、颗粒剂或冻干粉剂。
1,2,3,4,6-五没食子酰葡萄糖在制备促进骨形成药品中的应用。
防治骨质疏松症的药品,有效成分包括1,2,3,4,6-五没食子酰葡萄糖。
在所述防治骨质疏松症的药品中,1,2,3,4,6-五没食子酰葡萄糖的最低有效浓度为10-9m。
有益效果:1,2,3,4,6-五没食子酰葡萄糖可通过抗氧化应激,从而抗成骨细胞凋亡,最终达到治疗骨质疏松症的目的。从而,1,2,3,4,6-五没食子酰葡萄糖可用于制备防治骨质疏松症的药品。
附图说明
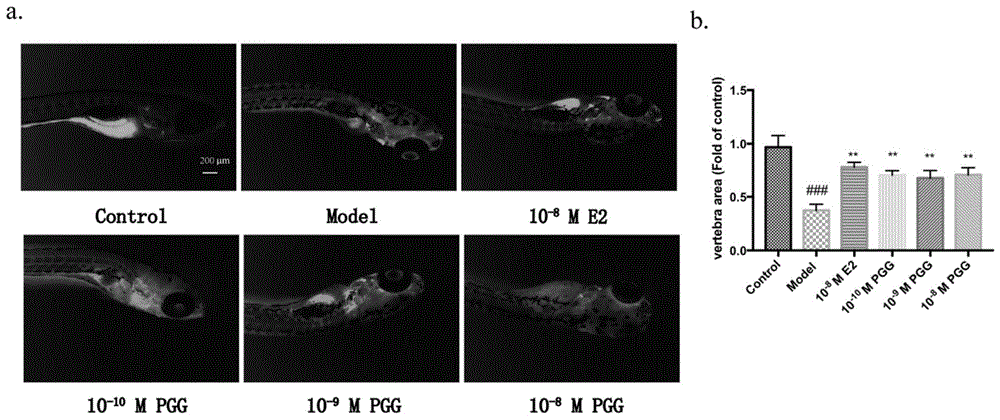
图1为实施例1中1,2,3,4,6-五没食子酰葡萄糖对泼尼松龙所致的斑马鱼骨质疏松的影响,其中a为斑马鱼颅骨内骨成像照片、b为斑马鱼椎骨股面积统计图。
图2为实施例2中1,2,3,4,6-五没食子酰葡萄糖对成骨细胞分化的影响,其中a为mc3t3-e1分化第7,14,21天茜素红染色图、b为bmsc分化第14天茜素红染色图。
图3为实施例3、实施例4和实施例5中1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下抗mc3t3-e1细凋亡的影响作用。其中a为mtt检测pgg对氧化应激下mc3t3-e1的存活率、b为流式检测pgg抗mc3t3-e1细胞凋亡图、c为凋亡率统计图、d为wb检测凋亡相关蛋白bcl2和bax图、e为bcl2/bax比率。
图4为实施例6、实施例7、实施例8中1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞线粒体功能的影响结果,其中a为流式检测线粒体膜电位图、b为线粒体膜电位统计图、c为atp含量检测、d为流式检测mc3t3-e1内ros水平、e为ros水平统计图。
具体实施方式
下面结合具体实施例对本发明的技术方案作进一步说明。
本发明所述的1,2,3,4,6-五没食子酰葡萄糖,其结构式如式ⅰ所示:
1,2,3,4,6-五没食子酰葡萄糖目前可以由含有该成分的常用中药,如五倍子、牡丹皮、白芍、赤芍等植物中提取得到,由于1,2,3,4,6-五没食子酰葡萄糖在许多天然植物药物中都存在,因此在本发明的实施例中,作为有效成分使用的1,2,3,4,6-五没食子酰葡萄糖,以采用来源更为丰富的天然存在形式的1,2,3,4,6-五没食子酰葡萄糖更为有利。以下实施例所采用的1,2,3,4,6-五没食子酰葡萄糖均是购买市售产品,casno:14937-32-7,产品货号:lw-00008,品牌:良玮,中文名:1,2,3,4,6-五没食子酰葡萄糖,英文名:1,2,3,4,6-penta-o-galloyl-β-d-glucose。
实施例1
1,2,3,4,6-五没食子酰葡萄糖对泼尼松龙所致的斑马鱼骨质疏松的影响。
实验动物:斑马鱼ab品系购于凯基生物有限公司;昼夜节律:昼:夜=14h:10h;温度:(28.5±0.5)℃。
试剂和药品:泼尼松龙购自上海源叶生物科技有限公司;依替膦酸二钠购自上海源叶生物科技有限公司。
仪器:leicam205fa体式荧光显微镜等。
分组与给药:分为对照组control(0.2%dmso)、模型组model(25μm泼尼松龙)、阳性药组de(15μg/ml依替磷酸二钠)、1,2,3,4,6-五没食子酰葡萄糖(10-10、10-9和10-8m)
实验方法:在受精后3天(dpf)开始,用25μm泼尼松龙处理斑马鱼幼鱼连续6天。在造模2天后用依替膦酸二钠(de;15μg/ml)作为阳性药物,或给予1,2,3,4,6-五没食子酰葡萄糖(10-10、10-9和10-8m)治疗。为了检测斑马鱼幼鱼中的钙沉积,将活鱼在0.2%钙黄绿素中孵育1小时,用0.02%三卡因麻醉幼鱼,并用leicam205fa体式荧光显微镜成像。在整个实验中使用相同的放大率、曝光时间、增益和对比度,得到成像图。
图1为斑马鱼颅骨内骨量成像。结果显示,25μm泼尼松龙组与空白组相比,斑马鱼颅骨内骨量生成减少。与25μm泼尼松龙组比,依替磷酸二钠(15μg/ml)组颅骨内骨量增加,10-10、10-9和10-8m1,2,3,4,6-五没食子酰葡萄糖与依替磷酸二钠的治疗效果相似。该结果表明1,2,3,4,6-五没食子酰葡萄糖可以治疗泼尼松龙诱导的斑马鱼骨形成抑制。
实施例2
1,2,3,4,6-五没食子酰葡萄糖对成骨细胞分化的影响。
细胞:前成骨细胞系mc3t3-e1购自上海中科学院细胞库,大鼠股骨来源的骨髓间充质干细胞(bmscs)自提。
试剂和药品:β-甘油磷酸盐购自sigma;地塞米松购自sigma;抗坏血酸购自sigma。
仪器:leica体式显微镜等。
分组与给药:分为空白组(0.1%dmso)、1,2,3,4,6-五没食子酰葡萄糖组(10、50和100μm)。
实验方法:用含10%热灭活fbs的α-mem培养液,同时按1:100的稀释比在培养液中添加双抗,于37℃、5%co2、饱和湿度的培养箱中进行培养。每两天更换培养基。当细胞长至90%左右时,用胰酶消化细胞至离心管中。以1000rpm离心3min。细胞离心后用α-mem培养液重悬计数。将成骨细胞接种在12孔板(1×105个细胞/孔)中,用含10%热灭活fbs的α-mem培养液,添加10mmβ-甘油磷酸盐、10nm地塞米松、50mg/ml抗坏血酸,同时按1:100的稀释比在培养液中添加双抗,配置成骨分化诱导液,于37℃、5%co2、饱和湿度的培养箱中进行培养。空白组(0.1%dmso)和1,2,3,4,6-五没食子酰葡萄糖组(10、50和100μm)用成骨分化诱导液培养7~21天,茜素红染色观察成骨细胞分化形成的矿化结节,得到染色结果。
茜素红染色检测钙化结节:将细胞在实验时间点取出后,用pbs小心清洗2次,每次1min,清洗时注意不要将细胞钙化结节冲掉。细胞清洗后,向每孔加入3ml的4%多聚甲醛,置于通风橱内固定15min。弃去固定液,每孔加入3ml的pbs清洗2次,每次1min。将茜素红染液加入细胞培养孔,每孔1ml,然后室温静置15min,进行茜素红染色。染色完毕后弃去茜素红染液,并用三蒸水冲洗掉多余染液,然后将细胞培养板放入60℃恒温箱中30min烘干。细胞板中的白色钙化结节将与茜素红反应染成橘红色。体式显微镜下观察各组钙化结节染色结果,并拍照保存。
如图2所示,mc3t3-e1细胞诱导分化7天时,均没有发现明显的钙化结节产生;分化14天时,空白组产生少量钙化结节,1,2,3,4,6-五没食子酰葡萄糖组以浓度依赖的方式促进钙化结节的产生;分化21天时,由于空白组成骨分化产生的钙化结节较多,与加药组没有显著差异;bmscs诱导分化14天时,空白组开始分化,1,2,3,4,6-五没食子酰葡萄糖组与空白组相比,以浓度依赖的方式促进钙化结节的产生。该结果表明,1,2,3,4,6-五没食子酰葡萄糖可以有效促进成骨细胞分化成熟。
实施例3
1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞存活率的影响。
细胞:前成骨细胞系mc3t3-e1购自上海中科学院细胞库。
仪器:bio-tek酶标仪。
分组与给药:分为空白对照组control(0.1%dmso),模型组model(0.4mmh2o2),1,2,3,4,6-五没食子酰葡萄糖组(10-12m~10-5m)。
实验方法:用含10%热灭活fbs的α-mem培养液,同时按1:100的稀释比在培养液中添加双抗,于37℃、5%co2、饱和湿度的培养箱中进行培养。每两天更换培养基。当细胞长至90%左右时,用胰酶消化细胞至离心管中。以1000rpm离心3min。细胞离心后用α-mem培养液重悬计数,以每孔含培养液200μl,1×104个/孔接种于96孔细胞培养板中,细胞贴壁生长24h后,加入含0.4mmh2o2损伤4h后加入1,2,3,4,6-五没食子酰葡萄糖(10-12m~10-5m)继续培养24h。mtt法检测细胞活力,观察1,2,3,4,6-五没食子酰葡萄糖对过氧化损伤后细胞活力的影响。
mtt法:孵育结束后弃除板中培养液,每孔加入5mg/ml的mtt溶液10μl和100μl不含血清的α-mem培养基。4h后弃去培养上清,加入每孔加入150mldmso。将细胞培养板放到振荡器上震荡10min。设定酶标仪波长490nm,检测并记录光密度(od值)。
统计分析:实验结果采用均数±标准误(mean±sem)表示,使用graphpadprism7软件中one-wayanova的分析方法比较各组之间的差异,以p<0.05代表有统计学意义。
图3中a为mc3t3-e1细胞活力统计结果。与空白组相比,0.4mmh2o2损伤mc3t3-e1细胞4h后细胞活力降低20%左右,此时,与模型组相比,1,2,3,4,6-五没食子酰葡萄糖组细胞在10-9m~10-5m范围内可明显提高细胞活力,说明1,2,3,4,6-五没食子酰葡萄糖能显著改善氧化应激状态下的细胞存活率。
实施例4
1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞凋亡的影响。
细胞:前成骨细胞系mc3t3-e1。
仪器:beckman流式细胞仪。
分组与给药:分为空白对照组control(0.1%dmso),模型组model(0.4mmh2o2),1,2,3,4,6-五没食子酰葡萄糖组(10-10m~10-7m)。
实验方法:用含10%热灭活fbs的α-mem培养液,同时按1:100的稀释比在培养液中添加双抗,于37℃、5%co2、饱和湿度的培养箱中进行培养。每两天更换培养基。当细胞长至90%左右时,用胰酶消化细胞至离心管中。以1000rpm离心3min。细胞离心后用α-mem培养液重悬计数。以每孔含培养液1.5ml,3×105个/孔接种于6孔细胞培养板中,细胞贴壁生长24h后加入含0.4mmh2o2损伤4h后加入1,2,3,4,6-五没食子酰葡萄糖共培养24h。用annexinv-fitc/pi标记细胞,流式细胞仪检测细胞凋亡。(流式细胞仪检测细胞凋亡:用fitc标记的膜联蛋白-v(annexinvfitc)检测成骨细胞的凋亡。碘化丙啶(pi)用于确定细胞坏死。在暴露于各种实验条件后,将细胞用不含edta的0.25%胰蛋白酶消化并在37℃下用荧光染料标记,然后用流式细胞仪进行细胞荧光分析。)
统计分析:实验结果采用均数±标准误(mean±sem)表示,使用graphpadprism7软件中one-wayanova的分析方法比较各组之间的差异,以p<0.05代表有统计学意义。
如图3中b、c所示,与空白对照组相比,0.4mmh2o2损伤mc3t3-e1细胞4h后可造成明显的细胞凋亡,同时,与模型组相比1,2,3,4,6-五没食子酰葡萄糖可以抗成骨细胞凋亡,说明1,2,3,4,6-五没食子酰葡萄糖能显著抗氧化应激状态下的细胞凋亡。
实施例5
1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞凋亡相关蛋白的影响。
具体实验过程包括以下步骤:
1、蛋白提取:将细胞培养板置于冰上,除去细胞上清,每孔加2ml冰pbs清洗两遍后每孔加入100μl细胞裂解液(ripa:pmsf=100:1),细胞刮刀刮取细胞裂解液至1.5ml离心管中,于冰上裂解30min,12000rpm4℃离心15min,取出备用。
2、蛋白定量:准备96孔可拆卸酶标板,蛋白标准孔加入0.5mg/mlbsa标准品(0、2、4、6、8、12、16、20μl),并用pbs补足至20μl,样品检测孔每孔加入样本5μl和20μlpbs(稀释4倍)。后每孔加入200μlbca蛋白工作液(bca试剂:cu试剂=50:1),37℃避光孵育30min,在波长562nm处检测吸光度。根据吸光度、标准曲线和样本稀释倍数,计算蛋白浓度。
3、蛋白变性:吸取80μl样品细胞裂解液上清至1.5ml离心管中,加入20μl蛋白上样缓冲液(5×),100℃干式恒温器中加热10min变性,室温冷却,-20℃保存待用。
4、制胶:
按下表的配方制胶:
5、上样及电泳:按20μg蛋白上样,后在60v电压下跑电泳,样品全部进入分离胶后在120v电压下跑电泳。
6、转膜:在100v电压下转膜90min。
7、一抗:转膜结束后,tbst洗膜5×5min,用5%脱脂牛奶室温孵育1h,tbst洗膜5×5min,加入一抗(稀释比例1:1000),4℃过夜孵育。
8、二抗:吸除一抗,tbst洗膜5×5min,加入二抗室温孵育1h,tbst洗膜5×5min,加入曝光液,数字化凝胶成像工作站曝光。
9、imagelab灰度值统计分析。
如图3中d所示,与空白组相比,h2o2组降低抗凋亡蛋白bcl-2的表达,升高凋亡蛋白bax的表达;与h2o2组相比,pgg可以显著升高bcl-2蛋白的影响,降低凋亡蛋白bax的表达。图3中e为bcl-2/bax的比率统计图,结果显示pgg可以抗氧化应激下mc3t3-e1凋亡。
实施例6
1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞线粒体膜电位影响。
细胞:前成骨细胞系mc3t3-e1。
仪器:bd-c6流式细胞仪。
分组与给药:分为空白对照组control(0.1%dmso),模型组model(0.4mmh2o2),1,2,3,4,6-五没食子酰葡萄糖组(10-10m~10-7m)。
实验方法:用含10%热灭活fbs的α-mem培养液,同时按1:100的稀释比在培养液中添加双抗,于37℃、5%co2、饱和湿度的培养箱中进行培养。每两天更换培养基。当细胞长至90%左右时,用胰酶消化细胞至离心管中。以1000rpm离心3min。细胞离心后用α-mem培养液重悬计数。以每皿(60mm×15mm)含培养液3ml,3×105个细胞接种于细胞培养皿中,细胞贴壁生长24h后加入含0.4mmh2o2损伤4h后加入1,2,3,4,6-五没食子酰葡萄糖共培养24h。对于细胞悬液每50-100万细胞需0.5mljc-1染色工作液。取适量jc-1(200x),按照每50μljc-1(200x)加入8ml超纯水的比例稀释jc-1。剧烈vortex充分溶解并混匀jc-1。然后再加入2mljc-1染色缓冲液(5x),混匀后即为jc-1染色工作液。吸除培养液,根据具体实验如有必要可以用pbs或其它适当溶液洗涤细胞一次,加入1ml细胞培养液。细胞培养液中可以含有血清和酚红。
吸除培养液,根据具体实验如有必要可以用pbs或其它适当溶液洗涤细胞一次,加入1ml细胞培养液。细胞培养液中可以含有血清和酚红。加入0.5mljc-1和0.5ml完培染色工作液,充分混匀,细胞培养箱中37℃孵育20分钟。37℃孵育结束后,冰浴,流式细胞仪待上机。荧光显微镜或激光共聚焦显微镜下观察。
统计分析:实验结果采用均数±标准误(mean±sem)表示,使用graphpadprism7软件中one-wayanova的分析方法比较各组之间的差异,以p<0.05代表有统计学意义。
如图4中a和b所示,与空白对照组相比,0.4mmh2o2损伤mc3t3-e1细胞4h后可造成明显的细胞线粒体膜电位下降,同时,与模型组相比1,2,3,4,6-五没食子酰葡萄糖可以升高成骨细胞线粒体膜电位。
实施例7
1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞线粒体atp产能的影响。
细胞:前成骨细胞系mc3t3-e1。
仪器:glomaxluminometer。
分组与给药:分为空白对照组control(0.1%dmso),模型组model(0.4mmh2o2),1,2,3,4,6-五没食子酰葡萄糖组(10-9m)。
实验方法:用含10%热灭活fbs的α-mem培养液,同时按1:100的稀释比在培养液中添加双抗,于37℃、5%co2、饱和湿度的培养箱中进行培养。每两天更换培养基。当细胞长至90%左右时,用胰酶消化细胞至离心管中。以1000rpm离心3min。细胞离心后用α-mem培养液重悬计数。以每孔含培养液1.5ml,3×105个/孔接种于6孔细胞培养板中,细胞贴壁生长24h后加入含0.4mmh2o2损伤4h后加入1,2,3,4,6-五没食子酰葡萄糖共培养24h。吸除培养液,按照6孔板每孔加入200μl裂解液的比例(即相当于细胞培养液量2ml的1/10)加入裂解液,裂解细胞。裂解细胞时为了裂解充分,可以使用移液器进行反复吹打或晃动培养板使裂解液充分接触并裂解细胞。通常细胞在接触裂解液后会立即裂解。裂解后4℃12000g离心5分钟,取上清,用于后续的测定。
具体测定过程包括以下步骤:
1、atp检测工作液的配制:按照每个样品或标准品需100μlatp检测工作液的比例配制适当量的atp检测工作液。把待用试剂在冰浴上融解。取适量的atp检测试剂,按照1:9的比例用atp检测试剂稀释液稀释atp检测试剂。例如100μlatp检测试剂加入900μlatp检测试剂稀释液配制成1mlatp检测工作液。稀释后的atp检测试剂即为用于后续实验的atp检测工作液。atp检测工作液可在冰浴上暂时保存。
2、atp浓度的测定:a.加100μlatp检测工作液到检测孔或检测管内。室温放置3-5分钟,以使本底性的atp全部被消耗掉,从而降低本底。可以一次性把10-20个检测孔或检测管分别加上100μlatp检测工作液,从而节省时间。
3、在检测孔或检测管内加上20μl样品或标准品,迅速用枪(微量移液器)混匀,至少间隔2秒后,用化学发光仪(luminometer)或液闪仪测定rlu值或cpm。(注:样品的体积可以自行在10-100μl范围内调节。如果样品中的atp浓度比较低则可以加入100μl样品,如果样品中atp浓度比较高则可以加入较小体积的样品,同时标准品也需要使用相同的体积。如果样品中atp的浓度特别高,可以用atp检测裂解液稀释样品后再测定。本试剂盒在加入10-100μl标准品时,大致在1nm~10μm的浓度范围内有很好的线性关系。
统计分析:实验结果采用均数±标准误(mean±sem)表示,使用graphpadprism7软件中one-wayanova的分析方法比较各组之间的差异,以p<0.05代表有统计学意义。
如图4中c所示,与空白对照组相比,0.4mmh2o2损伤mc3t3-e1细胞4h后可造成明显的细胞线粒体atp产能下降,同时,与模型组相比10-9m1,2,3,4,6-五没食子酰葡萄糖可以升高成骨细胞线粒体atp产能。
实施例8
1,2,3,4,6-五没食子酰葡萄糖对氧化应激状态下mc3t3-e1细胞ros水平的影响。
细胞:前成骨细胞系mc3t3-e1。
仪器:beckman流式细胞仪。
分组与给药:分为空白对照组control(0.1%dmso),模型组model(0.4mmh2o2),1,2,3,4,6-五没食子酰葡萄糖组(10-10m~10-7m)。
实验方法:用含10%热灭活fbs的α-mem培养液,同时按1:100的稀释比在培养液中添加双抗,于37℃,5%co2,饱和湿度的培养箱中进行培养。每两天更换培养基。当细胞长至90%左右时,用胰酶消化细胞至离心管中。以1000rpm离心3min。细胞离心后用α-mem培养液重悬计数。以每皿(60mm×15mm)含培养液3ml,3×105个细胞接种于细胞培养皿中,细胞贴壁生长24h后加入含0.4mmh2o2损伤4h后加入1,2,3,4,6-五没食子酰葡萄糖共培养24h。按照1:1000用无血清培养液稀释dcfh-da,使终浓度为10μm/l。去除细胞培养液,加入适当体积稀释好的dcfh-da。加入稀释好的dcfh-da1ml。37℃细胞培养箱内孵育20分钟。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh-da,用流式细胞仪检测和荧光显微镜拍照观察。
统计分析:实验结果采用均数±标准误(mean±sem)表示,使用graphpadprism7软件中one-wayanova的分析方法比较各组之间的差异,以p<0.05代表有统计学意义。
如图4中d和e所示,与空白对照组相比,0.4mmh2o2损伤mc3t3-e1细胞4h后可造成明显的细胞内ros水平上升,同时,与模型组相比1,2,3,4,6-五没食子酰葡萄糖可以降低成骨细胞内ros水平。
上述实验说明,1,2,3,4,6-五没食子酰葡萄糖可以提高氧化应激状态下成骨细胞的存活率,恢复线粒体功能障碍,抑制细胞凋亡,进而对成骨细胞产生保护作用。证明1,2,3,4,6-五没食子酰葡萄糖可能通过对抗氧化应激对成骨细胞的损伤,从而减少成骨细胞的凋亡,最终达到治疗骨质疏松症的目的,从而,可将1,2,3,4,6-五没食子酰葡萄糖应用于制备治疗骨质疏松症的药物。
- 还没有人留言评论。精彩留言会获得点赞!