一种代代花萼多酚及制备方法与在制备抗炎药物中的应用与流程
本发明属于中药领域,具体涉及一种代代花萼多酚及制备方法与在制备抗炎药物中的应用。
背景技术:
茶多酚又叫茶单宁,茶鞣质,是茶叶中酚类及其衍生物的总称,约占茶叶干物质总质量的25%,主要是儿茶素类、黄酮类、花青素和酚酸四类物质,其中儿茶素类的含量占80%左右。儿茶素中的主要成分有四种:表儿茶素(EC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素没食子酸酯(EGCG)。现代科学研究表明,茶叶中的生理活性物质主要为茶多酚,它具有优异的抗氧化性能和显著的清除自由基能力。
目前最有前途的替代经典抗生素治疗的抗炎方法之一是使用能增强宿主防御反应的免疫调节剂。现已知的多种免疫调节剂,包括哺乳动物蛋白,如:γ-干扰素、粒细胞集落刺激因子和粒细胞-巨噬细胞集落刺激因子及从微生物分离纯化的物质。对于免疫细菌多糖和人工合成的化合物来说,其不良反应和副作用已引起人们广泛注意。大多数植物多酚均为无不良反应的物质,不会对机体产生较大的副作用。随着人们对这一特性研究的不断深入,茶多酚在医疗保健、食品、化工、油脂等行业具有广泛的发展空间,尤其是在日本,美国。虽然我国茶叶资源丰富,但对于茶叶中茶多酚的提取技术及茶多酚在医药中的应用还处于研究开发阶段。
代代(Citrus aurantium L.var.amara Engl)是芸香科柑橘属植物酸橙的一个变种,代代花是其花蕾的干品,具有良好的药理作用,常用于治疗气郁不舒、脘腹胀痛、积食不化、恶心呕吐等。目前国内外对代代花的研究主要以其挥发油类化合物为主,而对代代花多酚抗炎的研究报道几乎没有。代代花作为药食两用价值的天然保健品,其多酚的提取纯化和药理活性等方面的研究还有待进一步深入探讨,全面加强代代花的生物利用,对于开发新药、指导临床用药具有重要的意义。
技术实现要素:
为了克服现有技术的不足和缺点,本发明的首要目的在于提供一种代代花萼多酚的制备方法。
本发明的另一目的在于提供上述制备方法制备得到的代代花萼多酚。
本发明的再一目的在于提供上述代代花萼多酚在制备抗炎药物中的应用。
本发明的目的通过下述方案实现:
一种代代花萼多酚的制备方法,包含如下步骤:
将代代花萼粗粉加入溶剂中,加热提取,离心,取上清液,去除溶剂,得到代代花萼多酚;所述溶剂为水、乙醇水溶液或甲醇水溶液。
以蒸馏水做为溶剂提取到的代代花萼多酚记为CAVP-W,以乙醇做为溶剂提取到的代代花萼多酚记为CAVP-E,以甲醇做为溶剂提取到的代代花萼多酚记为CAVP-M。
所述乙醇水溶液的体积分数为40~60%;优选为50%。
所述甲醇水溶液的体积分数为40~60%;优选为50%。
所述溶剂与代代花萼粗粉的体积质量比为(10~30)mL:1g;
所述溶剂与代代花萼粗粉的体积质量比优选为20:1;
所述加热提取的温度为80~100℃;优选为90℃;所述加热提取的时间为1~3h;优选为1h。
所述离心的转速为3000~5000r/min;优选为4000r/min。
所述离心的时间为8~12min;优选为10min。
所述去除溶剂的方式优选为减压浓缩和干燥;所述减压浓缩的温度为40~60℃,干燥的温度为40~60℃,干燥的时间为18~24h。
所述代代花萼粗粉是将代代花萼(Citrus aurantium L.var.amara Engl)干燥,粉碎,过筛,得到。
所述干燥温度为40~60℃;所述干燥时间为18~24h;所述粉碎过筛为50~60目筛。
一种代代花萼多酚(代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)),通过上述制备方法制备得到。
所述代代花萼多酚(代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M))在制备抗炎药物中的应用;
所述的代代花萼多酚可作为新型的抗炎药物,应用于炎症的治疗。
一种抗炎药物,含有上述代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)中的至少一种。
本发明的原理:植物来源的多酚能通过调节巨噬细胞的免疫功能体现出各种有益的药理作用。本发明发现和确证植物多酚具有显著的抗炎活性,且植物多酚的使用剂量低,在同样剂量下的毒副作用也较低。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明首次发现代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)在体外能显著抑制LPS诱导的RAW264.7巨噬细胞NO的释放。
(2)本发明首次发现代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)在体外能显著抑制LPS诱导的RAW264.7巨噬细胞iNOS、IL-6、TNF-α、IL-1β、和COX-2mRNA的表达。
(3)本发明首次发现代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)在体外能显著抑制LPS诱导的RAW264.7巨噬细胞p-ERK、p-JNK、p-p38、p-p65和COX-2蛋白的表达。
(4)代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)的用药剂量比较低,而且在有效用药剂量范围内毒性较低。
附图说明
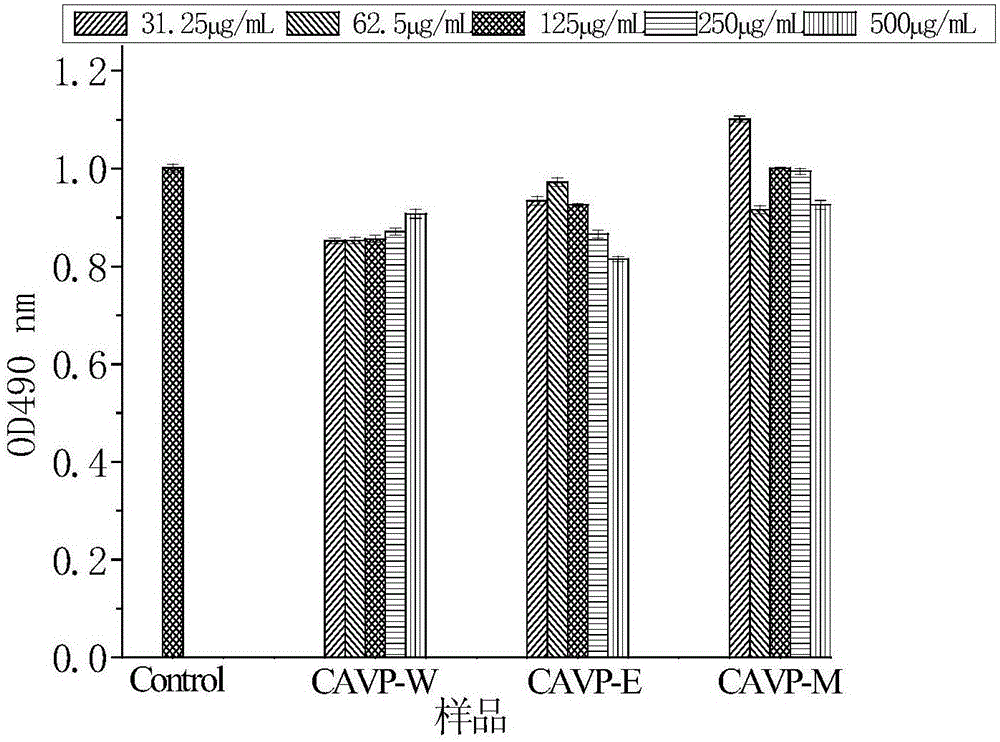
图1是实施例1制备得到的代代花萼多酚(CAVP-W)、实施例4制备的代代花萼多酚(CAVP-E)和实施例7制备的代代花萼多酚(CAVP-M)对RAW264.7巨噬细胞的毒性作用图;
图2是实施例1制备得到的代代花萼多酚(CAVP-W)、实施例4制备的代代花萼多酚(CAVP-E)和实施例7制备的代代花萼多酚(CAVP-M)对LPS诱导的RAW264.7巨噬细胞释放NO的影响图;
图3是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞形态的影响图;
图4是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞iNOS mRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01;
图5是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞IL-6mRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01。
图6是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞TNF-αmRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01;
图7是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞IL-1βmRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01;
图8是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞COX-2mRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01;
图9是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化ERK(p-ERK)蛋白水平影响的结果分析图,其中图A为p-ERK蛋白表达曝光图,图B为p-ERK蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01;
图10是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化JNK(p-JNK)蛋白水平影响的结果分析图,其中图A为p-JNK蛋白表达曝光图,图B为p-JNK蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01;
图11是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化P38(p-P38)蛋白水平影响的结果分析图,其中图A为p-P38蛋白表达曝光图,图B为p-P38蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01;
图12是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化P65(p-P65)蛋白水平影响的结果分析图,其中图A为p-P65蛋白表达曝光图,图B为p-P65蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01;
图13是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞COX-2蛋白水平影响的结果分析图,其中图A为COX-2蛋白表达曝光图,图B为COX-2蛋白相对表达量。其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中,小鼠巨噬细胞RAW 264.7购自中科院上海生命科学研究院细胞资源中心;代代花萼购自广州清平药材市场。
实施例1从代代花萼中制备得到代代花萼多酚(CAVP-W)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中50℃干燥24h,用粉碎机粉碎后,过60目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入100mL蒸馏水,充分震荡摇匀,水浴锅90℃加热1h;加热结束后,离心机4000r/min下离心10min,取上层澄清液,将上清液用旋转蒸发仪在50℃下减压浓缩,50℃真空干燥至恒重即得代代花萼粗多酚(CAVP-W)。
实施例2从代代花萼中制备得到代代花萼多酚(CAVP-W)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中40℃干燥20h,用粉碎机粉碎后,过50目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入50mL蒸馏水,充分震荡摇匀,水浴锅80℃加热2h;加热结束后,离心机3000r/min下离心8min,取上层澄清液,将上清液用旋转蒸发仪在55℃下减压浓缩,40℃真空干燥至恒重即得代代花萼粗多酚(CAVP-W)。
实施例3从代代花萼中制备得到代代花萼多酚(CAVP-W)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中60℃干燥18h,用粉碎机粉碎后,过40目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入150mL蒸馏水,充分震荡摇匀,水浴锅100℃加热3h;加热结束后,离心机5000r/min下离心12min,取上层澄清液,将上清液用旋转蒸发仪在60℃下减压浓缩,60℃真空干燥至恒重即得代代花萼粗多酚(CAVP-W)。
实施例4从代代花萼中制备得到代代花萼多酚(CAVP-E)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中50℃干燥24h,用粉碎机粉碎后,过60目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入100mL的50%乙醇溶液,充分震荡摇匀,水浴锅90℃加热1h;加热结束后,离心机4000r/min下离心10min,取上层澄清液,将上清液用旋转蒸发仪在50℃下减压浓缩,45℃真空干燥至恒重,即得代代花萼粗多酚(CAVP-E)。
实施例5从代代花萼中制备得到代代花萼多酚(CAVP-E)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中40℃干燥20h,用粉碎机粉碎后,过50目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入50mL的40%乙醇溶液,充分震荡摇匀,水浴锅80℃加热2h;加热结束后,离心机3000r/min下离心8min,取上层澄清液,将上清液用旋转蒸发仪在55℃下减压浓缩,50℃真空干燥至恒重即得代代花萼粗多酚(CAVP-E)。
实施例6从代代花萼中制备得到代代花萼多酚(CAVP-E)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中60℃干燥18h,用粉碎机粉碎后,过40目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入150mL的60%乙醇溶液,充分震荡摇匀,水浴锅100℃加热3h;加热结束后,离心机5000r/min下离心12min,取上层澄清液,将上清液用旋转蒸发仪在60℃下减压浓缩,60℃真空干燥至恒重即得代代花萼粗多酚(CAVP-E)。
实施例7从代代花萼中制备得到代代花萼多酚(CAVP-M)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中50℃干燥24h,用粉碎机粉碎后,过60目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入100mL的50%甲醇溶液,充分震荡摇匀,水浴锅90℃加热1h;加热结束后,离心机4000r/min下离心10min,取上层澄清液,将上清液用旋转蒸发仪在50℃下减压浓缩,45℃真空干燥至恒重即得代代花萼粗多酚(CAVP-M)。
实施例8从代代花萼中制备得到代代花萼多酚(CAVP-M)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中40℃干燥20h,用粉碎机粉碎后,过50目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入50mL的40%甲醇溶液,充分震荡摇匀,水浴锅80℃加热2h。加热结束后,离心机3000r/min下离心8min,取上层澄清液,将上清液用旋转蒸发仪在55℃下减压浓缩,50℃真空干燥至恒重,即得代代花萼粗多酚(CAVP-M)。
实施例9从代代花萼中制备得到代代花萼多酚(CAVP-M)
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中60℃干燥18h,用粉碎机粉碎后,过40目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉5.0g于锥形瓶中,加入150mL的60%甲醇溶液,充分震荡摇匀,水浴锅100℃加热3h;加热结束后,离心机5000r/min下离心12min,取上层澄清液,将上清液用旋转蒸发仪在60℃下减压浓缩,55℃真空干燥至恒重,即得代代花萼粗多酚(CAVP-M)。
实施例10 MTT法检测代代花萼多酚(CAVP-W)、代代花萼多酚(CAVP-E)和代代花萼多酚(CAVP-M)对RAW264.7细胞毒性的影响
分别取生长对数期的小鼠巨噬细胞RAW264.7,1000rpm离心5min,弃去上清液,用含质量分数为10%胎牛血清的DMEM培养基调整细胞数为3×105/mL,100μL接种于96孔培养板中,置于5%CO2培养箱中,37℃培养24h后,弃去上清液,各组分别加入含有CAVP-W(实施例1制得)、CAVP-E(实施例4制得)、CAVO-M(实施例7制得)的DMEM培养基(CAVO-W、CAVO-E和CAVO-M的终浓度分别为31.25μg/mL、62.5μg/mL、125μg/mL、250和500μg/mL)。在37℃、5%CO2培养箱中培养24h,弃去上清液,PBS清洗两次,每孔加入200μL不含血清的DMEM基础培养基和20μL噻唑蓝(MTT),放入培养箱中继续孵育4h,弃上清液,每孔加入150μL二甲基亚砜(DMSO),避光放置于微量振荡器均匀震荡10min,用酶标仪测量在490nm波长下的OD值,计算细胞增殖抑制率。图1是实施例1制备得到的代代花萼多酚(CAVP-W)、实施例4制备的代代花萼多酚(CAVP-E)和实施例7制备的代代花萼多酚(CAVP-M)对RAW264.7巨噬细胞的毒性作用图。
在CAVO-W、CAVO-E和CAVO-M浓度为31.25~500μg/mL范围内,三种代代花萼多酚作用于RAW264.7细胞24h,对RAW264.7细胞的生长均没有毒性作用(图1)。因此后续的实验中,CAVO-W、CAVO-E和CAVO-M的浓度设定为500、250、125、62.5、31.25和16.13μg/mL。
实施例11 Griess法检测CAVO-W、CAVO-E和CAVO-M对RAW264.7细胞释放NO的影响
常规培养细胞,取对数生长期的RAW264.7细胞,吹打细胞成单细胞悬液,显微镜下用血细胞计数板计数后,1000rpm,离心5min去上清,培养基重悬并调整细胞浓度,按20万个/孔的细胞密度接种于24孔培养板,置于37℃,5%CO2培养箱培养,贴壁24h,吸弃上清,按如下分组要求给药,每组设3个复孔:Control组,脂多糖(LPS,终浓度为1μg/mL)组,LPS(终浓度为1μg/mL)+地塞米松(DXM,终浓度为50μg/mL)组,LPS(终浓度为1μg/mL)+CAVP-W(实施例1制备得到的代代花萼多酚,终浓度为16.13、31.25、62.5、125、250和500μg/mL)组,LPS(终浓度为1μg/mL)+CAVO-E(实施例4制备得到的代代花萼多酚,终浓度为16.13、31.25、62.5、125、250和500μg/mL)组,LPS(终浓度为1μg/mL)+CAVO-M(实施例7制备得到的代代花萼多酚,终浓度为16.13、31.25、62.5、125、250和500μg/mL)组,对照组添加同体积的培养基。给药后,置于37℃,5%CO2培养箱,继续培养24h。分别取各孔细胞上清100μL,相应加入另一新的96孔板中。每孔加50μL Griess试剂A,置于37℃培养箱中反应10min,每孔再加50μL Griess试剂B,置于37℃培养箱中反应10min,立即置板于多标记微孔板检测仪上,在550nm波长下检测各孔吸光度值。图2是实施例1制备得到的代代花萼多酚(CAVP-W)、实施例4制备的代代花萼多酚(CAVP-E)和实施例7制备的代代花萼多酚(CAVP-M)对LPS诱导的RAW264.7巨噬细胞释放NO的影响图。
CAVO-W、CAVO-E和CAVO-M能够抑制LPS诱导的RAW264.7巨噬细胞NO的释放(图2)。当浓度为500μg/mL时,CAVO-W对LPS诱导的RAW264.7巨噬细胞NO的抑制率显著高于CAVO-E和CAVO-M(P<0.01),因此在后续的实验中选择CAVO-W进行深入研究。
实施例12代代花萼多酚CAVO-W对LPS诱导的RAW264.7细胞影响的电子显微镜观察
常规培养细胞,取对数生长期的RAW264.7细胞,吹打细胞成单细胞悬液,显微镜下用血细胞计数板计数后,1000rpm,离心5min去上清,培养基重悬并调整细胞浓度,按20万个/孔的细胞密度接种于24孔培养板,置于37℃,5%CO2培养箱培养,贴壁24h,吸弃上清,按如下分组要求给药,每组设3个复孔:Control组,脂多糖(LPS,终浓度为1μg/mL)组,LPS(终浓度为1μg/mL)+地塞米松(DXM,终浓度为50μg/mL)组,LPS(终浓度为1μg/mL)+CAVP-W(实施例1制备得到的CAVP-W,终浓度为62.5、125、250和500μg/mL)组,对照组添加同体积的DMEM基础培养基。给药后,置于37℃,5%CO2培养箱,继续培养24h。然后取出细胞在电子显微镜下拍照。图3是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞形态的影响图。
RAW264.7细胞经LPS诱导后,随着作用时间的改变,细胞形态发生改变,control组细胞呈圆形,边界清晰,贴壁良好,给予LPS诱导后,随着时间的延长,RAW264.7细胞形态学的改变逐渐明显,出现体积变大,呈不规则圆形、椭圆形、伸出伪足,边界不规则,部分细胞内呈明显泡沫化(图3)。经不同浓度的代代花萼多酚CAVP-W治疗后,细胞形态改变缓慢,趋于正常(图3)。
实施例13代代花萼多酚CAVO-W对LPS诱导的RAW264.7细胞iNOS、IL-6、TNF-α、IL-1β和COX-2mRNA表达的影响
常规培养细胞,取对生长数期的RAW264.7细胞,按100万/孔细胞数接种于6孔板,孵育24h后,吸弃上清,按如下分组要求给药,每组设3个复孔。Control组,脂多糖(LPS,终浓度为1μg/mL)组,LPS(终浓度为1μg/mL)+地塞米松(DXM,终浓度为50μg/mL)组,LPS(终浓度为1μg/mL)+CAVP-W(实施例1制备得到的代代花萼多酚CAVP-W,终浓度为62.5、125、250和500μg/mL)组,对照组添加同体积的培养基。给药后,置于37℃,5%CO2培养箱,继续培养12h。作用12h后,吸弃细胞上清,PBS洗2次。每孔加入Trizol 1mL,静置5min,吸管吹打至液体无粘稠物,吸取细胞裂解液转入EP管,每管加入0.2mL氯仿,盖上EP管盖,手持用力上下震荡10s,室温静置5min,4℃以12,000rpm离心15min,离心后转移上层水相至另一EP管中,加入0.5mL异丙醇,室温静置10min,4℃离心机以12,000rpm离心10min,小心吸弃去上清,用冷体积分数75%的乙醇1mL清洗2次,分别4℃条件下以7,500rpm离心5min,小心吸弃上清,空气吹干,约15min,加入0~50μL RNase-free纯水,60℃加热10min溶解沉淀。测定mRNA的纯度和浓度。并用RevertAid First Strand cnthesis Kit(Thermo公司)反转录试剂盒,20μL反应体系,对RNA进行逆转录。采用DyNAmo Flash SYRB Green qPCR Kit(Thermo公司)试剂盒,ABI实时荧光定量PCR仪(Rrism 7500,Applied Biosystems,Foster City,CA,USA)对mRNA进行扩增,扩增后用ABI PRISM7500SDS软件中Relative Quantification(ddCt)Study法进行自动分析以获得目的基因的相对表达量。相关基因mRNA引物序列为iNOS(forward,5′-CGG CAA ACA TGA CTT CAG GC-3′,reverse,5′-GCA CAT CAA AGC GGC CAT AG-3′),IL-6(forward,5′-GTA CTC CAG AAG ACC AGA GG-3′,reverse,5′-TGC TGG TGA CAA CCA CGG CC-3′),TNF-α(forward,5′-GGG GAT TAT GGC TCA GGG TC-3′,reverse,5′-CGA GGC TCC AGT GAA TTC GG-3′),IL-1β(forward,5′-CCA TGG AAT CCG TGT CTT CCT-3′,reverse,5′-GTC TTG GCC GAG GAC TAA GG-3′),COX-2(forward,5′-CAG CAA ATC CTT GCT GTT CC-3′,reverse,5′-TGG GCA AAG AAT GCA AAC ATC-3′)和GAPDH(forward,5′-CAC TCA CGG CAA ATT CAA CGG CAC-3′,reverse,5′-GAC TCC ACG ACA TAC TCA GCA-3′)。
图4是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞iNOS mRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01。图5是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞IL-6mRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01。图6是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞TNF-αmRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01。图7是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞IL-1βmRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01。图8是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞COX-2mRNA表达的影响图;其中,##:与control组比较,P<0.01;**:与LPS组比较,P<0.01。
与control组相比,LPS组分泌的iNOS、IL-6、IL-1β和COX-2显著增加(P<0.01),表明LPS诱导RAW264.7巨噬细胞释放NO的炎症模型成立。代代花萼多酚CAVP-W可以抑制iNOS mRNA(图4)、IL-6mRNA(图5)、TNF-αmRNA(图6)、IL-1βmRNA(图7)和COX-2mRNA(图8)的分泌(P<0.05)。
实施例14代代花萼多酚CAVO-W对LPS诱导的RAW264.7细胞相关蛋白水平的影响
常规培养细胞,取对生长数期的RAW264.7细胞,按100万/孔细胞数接种于6孔板,孵育24h后,吸弃上清,按如下分组要求给药,每组设3个复孔。Control组,脂多糖(LPS,终浓度为1μg/mL)组,LPS(终浓度为1μg/mL)+地塞米松(DXM,终浓度为50μg/mL)组,LPS(终浓度为1μg/mL)+CAVP-W(实施例1制备得到的代代花萼多酚CAVP-W,终浓度为125、250和500μg/mL)组,对照组添加同体积的培养基。其中,LPS+CAVP-W组采用CAVO-II预先刺激2h后,再加脂多糖(LPS+地塞米松组同样处理),置于37℃,5%CO2培养箱,继续培养12h。作用2h后,吸弃细胞上清,并且用预冷的PBS清洗两次,收集细胞至1.5mL离心管中,加入60μL的PIPA裂解液(含磷酸酶抑制剂(PhosSTOP,Roche)和蛋白酶抑制剂(cOmplete ULTRA Tablets,Mini,EDTA-free,EASYpack,Roche)),用1mL的注射器吸取裂解液反复吹打细胞至充分混匀,于冰上放置30min,每隔10min于涡旋振荡器上振荡30s。以12000rpm离心15min,将上清转移至新的1.5mLEP管,置于冰上待测定蛋白浓度。采用BCA法检测蛋白浓度(按照BCA Protein Assay Kit说明书进行):先将浓度为2mg/mL的BSA溶液予超纯去离子水稀释为系列质量浓度(0μg/mL、25μg/mL、125μg/mL、250μg/mL、500μg/mL、1000μg/mL)的标准品溶液,再根据需要配置一定量的工作液(BCA Solution:4%(体积分数)Cupric Sulfate=200:4)。取一块无底物的96孔板,每孔分别加入已稀释好的系列标准品溶液25μL,以及需要检测的蛋白溶液25μL(已稀释5倍),每组均设置复孔。同时加入200μL/孔工作液,轻轻震荡混匀,置于37℃孵育30min后,取出,于多标记微孔板检测仪570nm处检测OD值。根据标准品蛋白溶液所测OD值绘制标准曲线,计算出待测蛋白溶液浓度。根据BCA法测得的蛋白浓度,计算出40μg总蛋白所需蛋白体积,同时加5μL 5×SDS-PAGE上样缓冲液,再补充相应体积的超纯去离子水至总体积为25μL,混匀,充分离心,使液体聚集在底部,100℃加热变性10min,离心,置于冰上备用。选择10%(体积分数)分离胶和5%(体积分数)浓缩胶,将已变性好的蛋白样品依次加入各泳道,样品两侧的泳道分别加入5μL Marker。电泳槽中加入足够量的TGS缓冲液,电泳条件为:100V,约150min,直至溴酚蓝指示剂跑至距胶下缘约0.5cm时,停止电泳。然后在冰浴中以100V的电压转膜100min。用含5%(质量分数)脱脂奶粉的TBST封闭,缓慢摇荡1h。一抗抗体分别为:GAPDH(14c10)Rabbit mAb、p-ERK、p-JNK、p-P38、p-P65和COX-2(均购自CST公司),二抗抗体为山羊抗兔(HRP标记),购自聚研生物科技有限公司。按照说明书推荐的稀释比例(1:1000),配制一抗,室温下轻摇孵育4h或4℃静置过夜。一抗孵育结束后,更换二抗,HRP标记的二抗按相应比例稀释(1:2000),室温轻摇1h。二抗结束后,加入发光液(购自BioFuture公司)并利用凝胶成像仪蛋白条带显影。
图9是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化ERK(p-ERK)蛋白水平影响的结果分析图,其中图A为p-ERK蛋白表达曝光图,图B为p-ERK蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01。图10是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化JNK(p-JNK)蛋白水平影响的结果分析图,其中图A为p-JNK蛋白表达曝光图,图B为p-JNK蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01。图11是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化P38(p-P38)蛋白水平影响的结果分析图,其中图A为p-P38蛋白表达曝光图,图B为p-P38蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01。图12是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞磷酸化P65(p-P65)蛋白水平影响的结果分析图,其中图A为p-P65蛋白表达曝光图,图B为p-P65蛋白相对表达量;其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01。图13是实施例1制备得到的代代花萼多酚(CAVP-W)对LPS诱导的RAW264.7巨噬细胞COX-2蛋白水平影响的结果分析图,其中图A为COX-2蛋白表达曝光图,图B为COX-2蛋白相对表达量。其中,##:与control组比较,P<0.01,**:与LPS组比较,P<0.01。
正常组RAW264.7巨噬细胞内磷酸化的ERK、JNK、P38、P65和COX-2蛋白表达较低,当1μg/mL的LPS作用细胞12h,细胞内磷酸化的ERK、JNK、P38、P65和COX-2蛋白表达显著上调(P<0.01),从而激活MAPK和NF-κB信号通路(图9~12)。代代花萼多酚(CAVP-W)可以显著下调p-ERK(图9)p-JNK(图10)、p-P38(图11)、p-P65(图12)和COX-2(图13)蛋白表达。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 华南理工大学
<120> 一种代代花萼多酚及制备方法与在制备抗炎药物中的应用
<130> 1
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> iNOS的forward
<400> 1
cggcaaacat gacttcaggc 20
<210> 2
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> iNOS的reverse
<400> 2
gcacatcaaa gcggccatag 20
<210> 3
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-6的forward
<400> 3
gtactccaga agaccagagg 20
<210> 4
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-6的reverse
<400> 4
tgctggtgac aaccacggcc 20
<210> 5
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> TNF-α的forward
<400> 5
ggggattatg gctcagggtc 20
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> TNF-α的 reverse
<400> 6
cgaggctcca gtgaattcgg 20
<210> 7
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-1β的forward
<400> 7
ccatggaatc cgtgtcttcc t 21
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> IL-1β的reverse
<400> 8
gtcttggccg aggactaagg 20
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> COX-2的forward
<400> 9
cagcaaatcc ttgctgttcc 20
<210> 10
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> COX-2的reverse
<400> 10
tgggcaaaga atgcaaacat c 21
<210> 11
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> GAPDH的forward
<400> 11
cactcacggc aaattcaacg gcac 24
<210> 12
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> GAPDH的reverse
<400> 12
gactccacga catactcagc a 21
- 还没有人留言评论。精彩留言会获得点赞!