在辐射灭菌过程中保护生物活性分子的制作方法
背景技术:
本实施方案总体上涉及体外生物学测定。更具体地,本公开涉及保存、保护和/或恢复和/或稳定生物活性分子的生物活性的组合物和方法,所述生物活性分子包括但不限于生物活性蛋白和/或生物反应调节剂,例如免疫反应调节剂,否则其活性在辐射灭菌期间和/或之后会受到损害和/或减弱。
相关领域描述
用于从患者获得的生物样品中存在的细胞(例如免疫系统细胞,例如,淋巴细胞,单核细胞,巨噬细胞,树突状细胞或免疫系统其他细胞)的免疫活性的体外测定是本领域众所周知的诊断方法和预后目的。例如,可以通过多种测量方法体外测试从此类样品分离的全血样品或白细胞,以评估免疫反应能力,例如细胞增殖,可溶性介体释放和/或响应丝裂原、特异性抗原或病原体相关分子模式(pamp)、受体和其他激动剂的刺激的活化。
丝裂原包括已知刺激细胞有丝分裂的蛋白质,并用作免疫试剂以非抗原特异性方式诱导淋巴细胞增殖。淋巴细胞丝裂原可以是刺激淋巴细胞增殖和/或释放/分泌可溶性介体的多克隆激活剂,并且可以通过利用非抗原刺激驱动的淋巴细胞分子机制而绕过抗原特异性受体(免疫球蛋白(ig)或t-细胞受体(tcr))引发强烈的多克隆反应,可以很容易地检测到。示例性t-细胞丝裂原包括生物活性蛋白植物血凝素(pha)和伴刀豆球蛋白a(cona),它们是凝集素(例如植物来源的碳水化合物结合蛋白)。另一种凝集素,商陆丝裂原(pwm)能够刺激t细胞和b细胞。已经描述了来自多种来源的促有丝分裂凝集素(例如shanmugham等人,2006rivbiol.99:227;naeem等人,2007curr.proteinpept.sci8:261;singh等人,2014crit.rev.microbiol.40:329)。某些与能激活信号转导的淋巴细胞表面分子特异性结合的抗体也可以用作丝裂原。
因此,通过引发/刺激在样品中容易测量的稳健的多克隆反应,丝裂原特别适用于评估含淋巴细胞的样品的总体免疫反应性,其中,由于信号强度低或抗原特异性反应淋巴细胞的频率低,单克隆或寡克隆反应的免疫检测可能不够灵敏。
例如,
期望在血液收集/培养管中具有无菌环境,以使暴露于已知生物活性测定成分(例如,促有丝分裂蛋白如pha)后生物样品(例如全血或分离的外周血白细胞)中淋巴细胞的免疫反应能力不会因对测定/培养管中存在的微生物污染物的细胞反应而改变或被遮盖。此外,由于采血管可以直接与患者的血液接触,因此如果管中的内容物不是无菌的,就有可能将传染性病原传递给患者。
然而,据报道电子束辐射灭菌会显著改变蛋白质的结构、生物学和/或免疫学特性,从而引起人们对此类辐射对生物和生物医学产品的潜在有害影响的担忧(例如,katial等人,2002jallergclinimmunol110:215;terryn等人,2007intjpharm343:4;antebi等人,2016revbrasortop51:224)。例如,电子束灭菌可能会大大降低效力,并影响无菌免疫测定/培养管中蛋白质制剂的批次间一致性,例如
各种出版物教导了在辐射灭菌期间通过改变溶剂含量,温度,ph,氧气含量或其他参数和/或在灭菌过程中使用各种稳定剂来保护生物组织、细胞和/或生物分子免受辐射损害的方法。从这些公开中,很明显无法预测通过给定的稳定剂或稳定剂组合对任何特定生物分子或生物分子类别的实用性、相容性以及对这些分子的辐射防护,或通过改变其他条件来实现辐射防护,而是必须根据经验确定需要保护的生物分子。
例如,ep2236520描述了在选择避免冷冻生物分子的条件下生物分子的稳定化,包括稳定化以防止电磁辐射的有害影响。稳定剂包括使用最少需要的至少两种不同的氨基酸和多达18种的不同的氨基酸,优选结合2至5种不同的氨基酸。us5730933描述了通过使生物分子与外源蛋白质(例如牛血清白蛋白或变性胶原蛋白)和自由基清除剂/抗氧化剂接触并在辐照之前冷冻以及任选的冻干步骤来保护生物分子免受辐射损害。us6946098描述了将人血清白蛋白(hsa)作为稳定剂添加到生物制剂中,然后进行辐射灭菌以破坏朊病毒、病毒或其他病原体。公开了替代稳定剂的广泛列表,包括脂肪酸,抗氧化剂,自由基清除剂,肝素和硫醇化合物,但是在工作实施例中仅描述了hsa。
us20030012687和us20030031584描述了使用选自多种化合物的稳定剂对组织或生物分子(例如免疫球蛋白)进行辐射防护,所述稳定剂包括脂肪酸,自由基清除剂,抗氧化剂,糖,选定的氨基酸和二肽,trolox(cas53188-07-1)和其他。us20030143106和us20040086420描述了使用各种抗氧化剂,脂肪酸,氨基酸,维生素和/或自由基清除剂对组织以及各种血液、血清和血浆蛋白的辐射防护。us20050069453描述了通过改变样品性质(例如,溶剂组成,ph,温度等)或通过添加大量稳定剂中的任何一种,在辐射灭菌期间对尿激酶的保护,在工作实施例中仅证明了其中的少数具有辐射防护作用。
显然,需要保护生物活性蛋白和其他生物活性分子的生物活性,使其免受辐射灭菌过程中的辐射损害,以提高免疫测定产品的质量和一致性,并减少免疫测定/培养管/系统生产所需的原料量。当前公开的发明实施方式解决了这些需求并提供了其他相关的优点。
发明概述
根据当前公开的发明的某些方面,提供了一种保护生物活性蛋白或其他生物活性分子的生物活性免于辐射灭菌期间的辐射损害的方法,该方法包括:(a)在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子与至少一种可溶性辐射防护剂化合物接触以获得辐射防护混合物;(b)对辐射防护混合物进行辐射灭菌,其中辐射灭菌后的辐射防护混合物中的生物活性蛋白或其他生物活性分子的生物活性大于在不存在辐射防护剂化合物的情况下进行辐射灭菌的对照样品中该生物活性蛋白或其他生物活性分子的生物活性,从而保护生物活性蛋白或其他生物活性分子的生物学活性,使其免受辐射灭菌过程中的辐射损害。在另一个实施方案中,将辐射防护混合物在辐射灭菌步骤之前干燥。
在另一个实施方案中,提供了一种保护生物活性蛋白或其他生物活性分子的多个分子以防止在存储期间内所述多个分子丧失生物活性的方法,该方法包括(a)在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子与至少一种可溶性辐射防护剂化合物接触以获得辐射防护混合物;(b)干燥辐射防护混合物以获得干燥的辐射防护混合物;(c)对干燥的辐射防护混合物进行辐射灭菌;和(d)将干燥的辐射防护混合物储存一段时间以获得储存的干燥辐射防护混合物,其中在所述辐射灭菌和储存所述时间段后所储存的干燥的辐射防护混合物中的所述生物活性蛋白或其他生物活性分子的生物活性大于在不存在辐射防护剂化合物的情况下将其干燥、辐射灭菌、然后储存一段时间的对照样品中所述生物活性蛋白或其他生物活性分子的生物活性,从而在储存期间内保护生物活性蛋白或其他生物活性分子的多个分子免受生物活性的损失。
在某些其他实施方案中,提供了一种方法,该方法保护生物活性蛋白或其他生物活性分子例如具有tlr激动剂活性的生物活性的咪唑并喹啉的生物活性免受辐射灭菌过程中的辐射损害,该方法包括:(a)在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子,例如具有tlr激动剂活性的生物活性咪唑并喹啉,与至少一种可溶性辐射防护剂化合物接触,以获得辐射防护混合物;(b)干燥辐射防护混合物以获得干燥的辐射防护混合物;和(c)对干燥的辐射防护混合物进行辐射灭菌以获得干燥的辐射灭菌的辐射防护混合物,其中,在将干燥的辐射灭菌的辐射防护混合物再水化以获得再水化的辐射灭菌的辐射防护混合物之后,辐射灭菌后辐射防护混合物中的生物活性蛋白或其他生物活性分子(例如,生物活性咪唑并喹啉)的生物活性大于在不存在辐射防护剂化合物的情况下进行辐射灭菌的对照样品中生物活性蛋白或其他生物活性分子(例如,生物活性咪唑并喹啉)的生物活性,从而保护生物活性蛋白或其他生物活性分子(例如,生物活性咪唑并喹啉)的生物活性免受辐射灭菌过程中的辐射损害。在某些进一步的实施方案中,具有tlr激动剂活性的生物活性的咪唑并喹啉包括咪喹莫特(imiquimod),加地喹莫特(gardiquimod)和雷西莫特(resiquimod)(r848)中的一种或多种。
在上述方法的某些其他实施方案中,生物活性蛋白是丝裂原,在某些其他实施方案中,其选自植物血凝素(pha),伴刀豆球蛋白a(cona)和商陆丝裂原(pwm)。在上述方法的某些其他进一步的实施方案中,生物活性蛋白包含以下一种或多种:(i)丝裂原,(ii)抗体,(iii)酶,(iv)细胞因子,(v)生长因子,和(vi)激素。在某些实施方案中,辐射防护剂化合物包含至少一种抗氧化剂化合物,在某些其他实施方案中,其选自半胱氨酸、谷胱甘肽和褪黑素。在某些实施方案中,辐射防护剂化合物包含组氨酸。在上述方法的某些实施方案中,辐射防护剂化合物以至少0.1、0.2、0.3、0.5、0.7、1.0、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或50毫摩尔/升的浓度存在于辐射防护混合物中。在某些实施方案中,生物活性包括促有丝分裂活性,在某些进一步的实施方案中,其具有诱导淋巴细胞增殖的活性。在某些其他实施方案中,淋巴细胞增殖活性包括诱导t细胞增殖的活性。
参考以下详细描述和附图,本文描述的发明的这些和其他方面以及实施例将显而易见。本说明书中提及的和/或列于申请数据表单中的所有美国专利、美国专利申请公开文本、美国专利申请、外国(非美国)专利、外国专利申请和非专利公开文本均通过引用其全文纳入本文,如同各自单独纳入。本发明所述各方面和实施方式可被修改,必要时可应用各种专利、申请和出版物的概念,以提供更多的实施方式。
附图的若干视图的简要说明
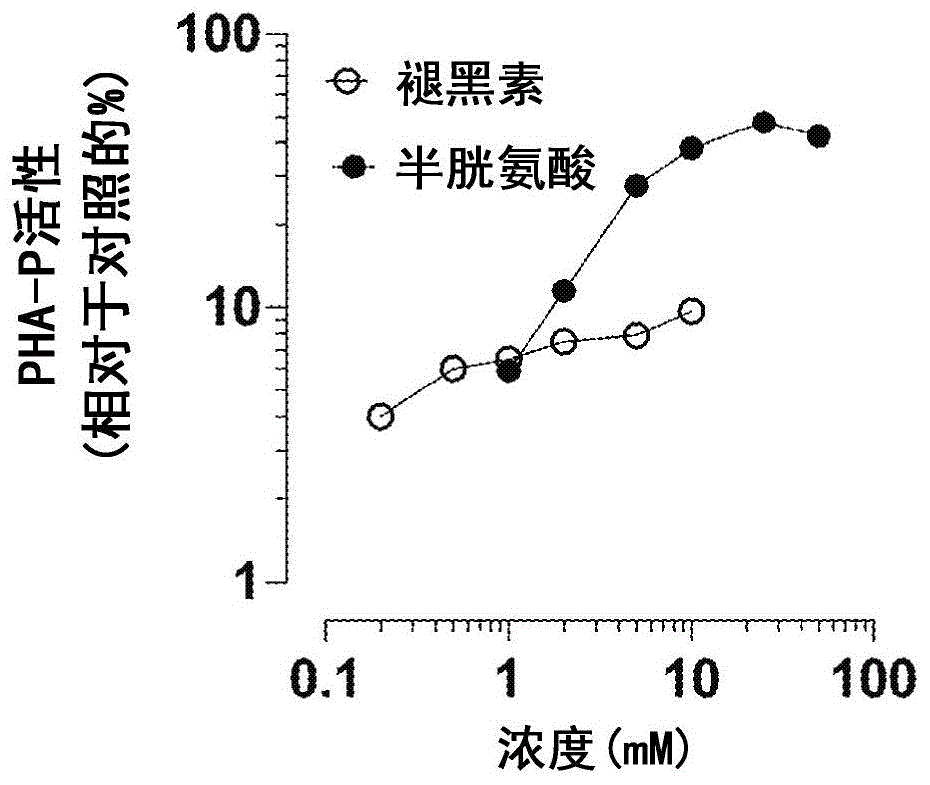
图1显示了在溶液中以25kgy电子束辐射灭菌处理的pha-p制剂中,生物活性的浓度依赖性保护。将半胱氨酸(实心圆圈)和褪黑素(空心圆圈)溶于相同的pha-p制剂中至各种最终浓度。根据制造商的说明(凯杰公司(qiagen),马里兰州德国镇),使用
图2显示了保护丝裂原效力免于电子束辐射灭菌过程中,
图3显示了在pha中使用5mm半胱氨酸和不使用5mm半胱氨酸生产的
图4显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护抗-cd3抗体的t细胞刺激活性免于电子束辐射的影响。
图5显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,滴定辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护抗-cd3抗体的t细胞刺激活性免于电子束辐射的影响。
图6显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护tlr激动剂咪唑并喹啉免疫反应调节剂r848(雷西莫特)的nk细胞刺激活性免于电子束辐射的影响。
图7显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,滴定辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护tlr激动剂咪唑并喹啉免疫反应调节剂r848(雷西莫特)的nk细胞刺激活性免于电子束辐射的影响。
图8显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护抗-cd3抗体的t细胞刺激活性和tlr激动剂咪唑并喹啉免疫反应调节剂r848(雷西莫特)的nk细胞刺激活性免于电子束辐射的影响。
图9显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,滴定辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护抗-cd3抗体的t细胞刺激活性和tlr激动剂咪唑并喹啉免疫反应调节剂r848(雷西莫特)的nk细胞刺激活性免于电子束辐射的影响。
图10显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护商陆丝裂原(pwm)的促有丝分裂效力免于电子束辐射的影响。
图11显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,滴定辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护商陆丝裂原(pwm)的促有丝分裂效力免于电子束辐射的影响。
图12显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护t细胞丝裂原伴刀豆球蛋白a(cona)的t细胞刺激活性免于电子束辐射的影响。
图13显示了通过来自六个供体的全血样品中的ifn-γ分泌评估,滴定辐射防护剂化合物半胱氨酸(cys)或谷胱甘肽(g-sh)保护t细胞丝裂原伴刀豆球蛋白a(cona)的t细胞刺激活性免于电子束辐射的影响。
具体实施方式
当前公开的某些实施方案涉及令人惊讶的发现,如果在辐射灭菌之前将生物活性蛋白或其他生物活性分子与本文提供的辐射防护剂化合物接触,可以基本上辐射防护生物活性蛋白或其他生物活性分子例如生物反应调节剂或免疫反应调节剂的生物活性(例如,相对于适当的对照而言以统计学显著性方式增加),否则所述生物活性会被辐射灭菌破坏。
更具体地,并且作为非限制性实例,如本文所述,发现通过对包含喷雾干燥的pha溶液的免疫测定管进行辐射灭菌,pha对t淋巴细胞的促有丝分裂活性显著降低。然而,如本文首次公开的,如果在辐射灭菌之前使pha与本文提供的至少一种辐射防护剂化合物接触,例如,一种或多种辐射防护剂化合物例如半胱氨酸、还原型谷胱甘肽、褪黑素和/或组氨酸,那么辐射灭菌后的pha生物学活性(即人类全血样品中存在的白细胞的促有丝分裂活性)出乎意料地比不含辐射防护剂化合物的经过辐射灭菌的对照pha样品的活性高。另外,并且如本文首次公开的那样,将生物活性蛋白(pha)与溶液中的辐射防护剂化合物接触以获得辐射防护混合物后的保护效果出乎意料地在混合物基本干燥后持续存在,例如通过喷雾干燥和/或冷冻干燥(例如冻干)。而且,基本干燥的辐射防护混合物表现出令人惊讶的长期稳定性,在储存超过八个月后证明了对生物学活性的充分保护。
因此,这些和相关的实施方案将在大量场景中找到用途,在这些场景中可能需要在无菌环境中提供生物活性蛋白或其他生物活性分子(包括生物反应调节剂,例如免疫反应调节剂),例如作为单独的或在任何类型的容器(例如,试管,测定板,微孔,培养皿,血液样本容器,瓶子,烧杯,小瓶,安瓿瓶,注射器或任何其他合适的容器)表面上的生物活性蛋白(或其他生物活性分子)的喷雾干燥、脱水和/或干燥制剂,有益地对其进行辐射灭菌,以获得与无菌环境相关的益处。本文所述的某些优选实施方案涉及用于多种体外免疫学测定中的任一种的辐射防护的蛋白丝裂原,所考虑的实施方案并不旨在限制作用,其他生物学活性蛋白(例如免疫刺激抗体)或其他生物学活性分子(例如,生物反应调节剂,例如免疫反应调节剂,例如咪唑并喹啉toll样受体(tlr)激动剂,例如但不限于咪喹莫特,加地喹莫特和雷西莫特等)也是考虑的,其中生物活性蛋白或生物活性分子可以有益地进行辐射灭菌而基本上没有生物活性损失。
生物活性
如本文所述,物质的生物活性是指可以影响与生物体有关的生物系统、途径、分子或相互作用的任何物理或生化特性的任何活性,所述生物体包括例如但不限于细胞,病毒,细菌,噬菌体,朊病毒,昆虫,真菌,植物,动物和人类。具有生物活性的物质的实例包括但不限于:多核苷酸,肽,蛋白质,尤其是生物活性蛋白质,包括酶,抗体,糖蛋白,凝集素,促有丝分裂蛋白,包括促有丝分裂凝集素,小分子(例如生物活性小分子),药物组合物(例如药物),疫苗,生物反应调节剂,包括免疫反应调节剂,例如具有tlr激动剂活性的咪唑并喹啉(例如咪喹莫特,加地喹莫特和雷西莫特(r848)等),碳水化合物,脂质,类固醇,激素,趋化因子,生长因子,细胞因子,脂质体和毒素。
熟悉相关技术的人员将认识到用于确定影响生物系统的物理或生化特性的物质的生物活性的适当测定法和方法,例如,一种或多种生物活性,其可以包括但不限于免疫学,免疫化学,细胞因子,激素和生物活性肽的活性以及其他细胞增殖(例如,促有丝分裂)和/或分化活性(例如,参见coligan等人(编),2007《免疫学最新方案》(currentprotocolsinimmunology),新泽西州霍博肯的威利父子公司(wileyandsonsinc.,hoboken,nj),信号转导(例如,参见bonifacino等人(编),2007《细胞生物学最新方案》(currentprotocolsincellbiology),新泽西州霍博肯的威利父子公司),免疫增强和/或免疫反应调节剂活性,例如咪唑并喹啉,例如tlr激动剂咪喹莫特,加地喹莫特和雷西莫特(r848)等(例如,gerster等人,2005j.med.chem.48:3481;shukla等人,2010j.med.chem.53:4450;shi等人,2012acsmed.chem.lett.3(6):501-504;tomai等人,第8章,“用于疫苗佐剂的toll-样受体7和8激动剂”(toll-likereceptor7and8agonistsforvaccineadjuvantuse),第149-161页,和skountzu等人,第20章,《皮肤疫苗佐剂》(adjuvantsforskinvaccination),第399-419页,《现代疫苗中的免疫增强剂》(immunopotentiatorsinmodernvaccines),schijns等人(编),2017纽约科学出版社(academicpress,ny)),基因表达(例如,参见asubel,fm等人(编),2007《分子生物学最新方案》(currentprotocolsinmolecularbiology),新泽西州霍博肯的威利父子公司),受体-配体相互作用(例如,参见coligan等人(编),2007《免疫学最新方案》(currentprotocolsinimmunology),新泽西州霍博肯的威利父子公司),酶活性(例如,参见eisenthal和hanson(编),《酶测定》(enzymeassays),第二版,实践方法系列,第257期,2002,英国牛津的牛津大学出版社;kaplan和colowick(编),《酶的制备与测定:酶学方法》(preparationandassayofenzymes,methodsinenzymology),(第1,2和6卷),1955和1961,英国牛津的科学出版社公司(academicpress,ltd.,oxford,uk)),以及细胞毒性(例如,细胞毒性,兴奋性毒性)(例如,参见busjs等人(编),2007《毒性最新方案》(currentprotocolsintoxicology),新泽西州霍博肯的威利父子公司),凋亡与坏死(green和reed,1998science281(5381):1309-12;greendr,1998naturedec17:629;greendr,1998cell94(6):695-69;reed,jc(编),2000《凋亡:酶学方法》(apoptosis,methodsinenzymology)(第322期),英国牛津的科学出版社公司(academicpressltd.,oxford,uk));或其他生物活性。
在本文公开的优选实施方案中,提供了一种基本上保护生物活性蛋白和/或另一种生物活性分子(包括生物反应调节剂,例如免疫反应调节剂,例如具有tlr激动剂活性的咪唑并喹啉(例如咪喹莫特,加地喹莫特和雷西莫特(r848))的生物活性免于辐射灭菌期间的辐射损害的方法。在某些进一步优选的实施方案中,生物活性蛋白是一种或多种丝裂原,例如pha,cona和/或pwm中的一种或多种,和/或生物活性蛋白包括抗体,细胞因子,酶,生长因子和激素中的一种或多种,和/或生物活性分子包括免疫反应调节剂,包括一种或多种具有tlr激动剂活性的咪唑并喹啉,例如咪喹莫特,加地喹莫特和/或雷西莫特(r848)。
在本文公开的某些优选的实施方案中,提供了针对生物活性分子的多个分子,在某些优选的实施方案中,其可以是生物活性蛋白,在某些其他优选实施方案中,可以是生物活性分子,包括一种或多种生物反应调节剂,例如免疫反应调节剂,例如,具有tlr激动剂活性的咪唑并喹啉免疫反应调节剂,在储存期间保护所述多个分子的生物活性免于丧失的方法,该方法包括:在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子与至少一种可溶性辐射防护剂化合物接触以获得辐射防护混合物;使辐射防护混合物干燥以获得干燥的辐射防护混合物;对干燥的辐射防护混合物进行辐射灭菌;和将干燥的辐射防护混合物储存一段时间,以获得储存的干燥的辐射防护混合物,其中,在所述辐射灭菌和储存所述时间段后,所储存的干燥的辐射防护混合物中的所述生物活性蛋白或其他生物活性分子的生物活性大于在不存在辐射防护剂化合物的情况下将其干燥、辐射灭菌、然后储存一段时间的对照样品中所述生物活性蛋白或其他生物活性分子的生物活性,从而在储存期间内保护生物活性蛋白或其他生物活性分子的多个分子免受生物活性的损失。
根据具体的生物活性分子,具体的生物活性或这些分子的活性,辐射灭菌条件,辐射防护剂,辐射防护混合物的干燥程度,储存条件(包括例如,温度,相对湿度,环境大气等)以及其他因素,存储时间可能会有很大差异。通常,保护生物活性分子(例如,生物活性蛋白)免受生物活性损失(例如,相对于适当的对照,存在统计学显著的生物活性降低)的储存时间可以为至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36个月或更长时间。
当在对包含生物活性蛋白或其他生物活性分子的组合物进行辐射灭菌后,根据本文公开的某些实施方案,可以基本上保护生物活性蛋白或其他生物活性分子的生物活性,生物活性完全保留,或基本保留(例如,保留至少30%,32%,34%,36%,38%,40%,42%,44%,46%,48%或50%,优选至少52%,54%,56%,58%或60%,更优选至少62%,64%,66%,68%或70%,更优选至少72%,74%,76%或80%,通常在更优选的实施方式中至少81%,82%,83%,84%或85%,更优选至少86%,87%,88%,89%,90%,91%,92%,93%或94%,更优选至少95%,还更优选大于96%,97%,98%或99%)的生物活性。
在本文所述的某些实施方案中,在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子(包括具有生物学活性的生物反应调节剂,例如免疫反应调节剂,例如具有tlr激动剂活性的咪唑并喹啉免疫反应调节剂)与至少一种可溶性辐射防护剂化合物接触以获得辐射防护混合物。
可以根据许多已知方法中的任何一种来实现对辐射防护混合物的辐射灭菌,例如电子束辐射,参见例如smith等人,2016healthphys.111(2增补2):s141;silindir等人,2012pdajpharmscitechnol.66:184;mehta等人,1993meddevicetechnol.4:24;yaman,2001curr.opin.drugdevel.4:760;katial等人,2002jallergclinimmunol110:215;terryn等人,2007intjpharm343:4;和antebi等人,2016revbrasortop51:224。
在某些优选的实施方案中,将辐射防护混合物在辐射灭菌之前干燥或基本上干燥,这通常可以是完全干燥(例如,具有统计学意义,已除去所有或基本上所有可检测的溶剂)。在某些实施方案中,其可以根据要存储的样品的性质及其预期用途而变化,大于75%,80%,82%,84%,86%,88%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%的可检测溶剂已被除去,以获得干燥的,干的,基本上干燥的,或基本上干的辐射防护混合物。
在使本文提供的生物活性蛋白或其他生物活性分子与辐射防护剂化合物接触以获得辐射防护混合物的步骤之后,可以根据多种干燥方法中的任一种来干燥辐射防护混合物。优选的干燥方法是冻干(例如冷冻干燥,例如在部分或完全真空下干燥冷冻的水溶液,以通过从冷冻的固态升华到气相而促进水的除去而不形成液态水)。也可以采用其他干燥技术,例如,通过在环境温度和压力下通过蒸发溶剂(例如水)进行干燥,或者在层流罩或干燥室中,或在降低的大气压下(包括在真空下)(例如通过真空泵,例如
可以通过简单的目视检查或触摸(即用移液管尖端轻敲)来确定样品的干燥,以确保所有水分均已蒸发或除去。在一些实施方案中,可以优选地包括湿度指示剂以确定已达到的干燥程度。例如,可任选地包括氯化钴作为样品中水分含量的可检测的(通过可见的颜色变化或比色法)指示剂。在这些以及某些相关的实施方案中,还可以考虑使用水分指示剂,例如测量材料的介电含量以确定水分含量的电子设备(例如,aqua-speartm,英国道格拉斯的马斯特有限公司(mastradlimited,douglas,uk))。还考虑将干燥剂例如硫酸钙(即,
辐射防护剂化合物
如本文其他地方所述,本公开涉及以下意外发现:如果在辐射灭菌之前使生物活性分子与本文提供的辐射防护剂化合物接触,以形成辐射防护混合物再进行辐射灭菌,本文所提供的生物活性分子(例如生物活性蛋白)的生物活性基本上得到辐射防护(例如,相对于未经保护的适当对照,例如在没有辐射防护剂的情况下进行辐射灭菌的相同生物活性分子(例如,生物活性蛋白),生物活性以统计学显著的方式增加),否则所述生物活性会因辐射灭菌而受到损失。
尽管先前观察到某些稳定剂赋予某些辐射防护作用以保留或部分保留生物组织、细胞或生物分子的至少一些结构和/或功能属性(例如,如上所述),但是本领域技术人员不会合理地预期得到本公开所述的特征的组合。
因此,本文首次公开了一种基本上保护生物活性蛋白或其他生物活性分子的生物活性免受辐射灭菌过程中的辐射伤害的方法,该方法包括:在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子与至少一种可溶性辐射防护剂化合物接触以获得辐射防护混合物;并对辐射防护混合物进行辐射灭菌,其中,辐射灭菌后辐射防护混合物中的生物活性蛋白或其他生物活性分子的生物活性大于在不存在辐射防护剂化合物的情况下进行辐射灭菌的对照样品中生物活性蛋白或其他生物活性分子的生物学活性(例如,相对于适当的对照,以统计学显著的方式增加),从而基本上保护生物活性蛋白或其他生物活性分子的生物活性免于辐射灭菌过程中的辐射损害。在某些其他实施方案中,在辐射灭菌步骤之前,将辐射防护混合物充分干燥。
本文还首次公开了一种在辐射灭菌过程中基本保护生物活性蛋白或其他生物活性分子的生物活性免受辐射损害的方法,该方法包括:在辐射灭菌之前,使水溶液中的生物活性蛋白或其他生物活性分子与至少一种可溶性辐射防护剂化合物接触以获得辐射防护混合物;将辐射防护混合物充分干燥以获得基本上干燥的辐射防护混合物;和对基本上干燥的辐射防护混合物进行辐射灭菌,以获得基本上干燥的辐射灭菌的辐射防护混合物,其中,在将基本上干燥的辐射灭菌的辐射防护混合物再水化以获得再水化的辐射灭菌的辐射防护混合物之后,辐射灭菌后的辐射防护混合物中的生物活性蛋白或其他生物活性分子的生物活性大于在不存在辐射防护剂化合物的情况下进行辐射灭菌的对照样品中生物活性蛋白或其他生物活性分子的生物活性(例如,相对于适当的对照,以统计学显著的方式增加),从而在辐射灭菌过程中基本保护该生物活性蛋白或其他生物活性分子的生物活性免受辐射损害。
更具体地,根据本公开,首次证明了作为人和其他哺乳动物外周血淋巴细胞的丝裂原的生物活性蛋白,例如pha,cona或pwm或抗cd3抗体的生物活性对电子束辐射灭菌敏感,并且与未经过辐射灭菌的同一丝裂原相比活性降低(例如,相对于适当的对照,以统计学显著的方式降低)。此外,并且如本文首次公开的那样,通过与至少一种本文提供的辐射防护剂化合物接触以形成辐射防护混合物然后再进行辐射灭菌,可以保护这种丝裂原的生物活性免受电子束辐射的损害作用(例如,相对于适当的对照,以统计学显著的方式增加)。
本公开还首次教导,在本文所述的方法中,赋予本发明丝裂原生物活性保护作用的辐射防护剂化合物可以包括半胱氨酸,褪黑素,谷胱甘肽和组氨酸中的一种或多种(或者由其组成)。
更进一步,本公开内容首次教导了本发明提供的辐射防护剂化合物(例如,包括半胱氨酸,褪黑素,谷胱甘肽和组氨酸中的一种或多种,或由其组成)可以与本发明的生物活性蛋白丝裂原(例如,pha,cona和/或pwm,或抗cd3抗体)或免疫反应调节剂(例如,具有tlr激动剂活性的咪唑并喹啉,如咪喹莫特,加地喹莫特和雷西莫特(r848)等)组合,以形成如本文所提供的可以基本上干燥(例如冻干)以进行辐射灭菌的辐射防护混合物,作为基本上干燥的辐射防护混合物,其中,相对于没有辐射防护剂化合物的对照样品中丝裂原的活性,即使以这种干燥形式存在,辐射防护剂化合物也能保护丝裂原的生物活性(例如,相对于适当的对照,其活性以统计学显著的方式增加)。
因此,本发明公开了通过本领域先前未能认识到的方法对丝裂原和其他生物活性分子进行辐射防护,该方法使用以前未曾预期具有这种能力的辐射防护剂化合物,包括与丝裂原一起以本文所述的基本上干燥的辐射防护混合物形式存在时的防护能力。例如,本文描述了先前被认为在溶液中对除本发明的丝裂原之外的蛋白质具有辐射防护性质的试剂,当与本文所述的不同物理状态(例如,作为冻干的基本上干燥的辐射防护混合物,而不是溶液形式)的丝裂原一起存在时,令人惊讶地展现出对不同蛋白质(例如,本发明的丝裂原)的辐射防护作用。在本发明之前不会预测到这些性质。
因此,在某些优选的实施方案中,可将一种或多种生物活性蛋白(例如本文所述的丝裂原,例如抗-cd3抗体,pha,cona和/或pwm)和/或一种或多种生物活性免疫反应调节剂(例如本文所述的咪唑并喹啉tlr激动剂,例如咪喹莫特,雷西莫特(r848)和/或加地喹莫特)与至少一种可溶性辐射防护剂化合物(例如半胱氨酸,谷胱甘肽,褪黑素和/或组氨酸)接触,以使生物活性蛋白和/或免疫反应调节剂和辐射防护剂化合物同时进行干燥,从而获得基本上干燥的辐射防护混合物,然后可以对其进行辐射灭菌,从而获得基本上干燥的经辐射灭菌的辐射防护混合物。
在某些优选的实施方案中,一种或多种生物活性蛋白可以包括针对细胞表面受体的抗体,例如特异性结合cd3,ox40,cd40l,cd152和/或cd28的抗体或其抗原结合片段,所述抗体或其抗原结合片段可以与至少一种可溶性辐射防护剂化合物(例如半胱氨酸,谷胱甘肽,褪黑素和/或组氨酸)接触,以使生物活性蛋白和辐射防护剂化合物同时进行干燥,从而获得基本上干燥的辐射防护混合物,然后可以对其进行辐射灭菌,从而获得基本上干燥的经辐射灭菌的辐射防护混合物。
在某些其他优选的实施方案中,一种或多种生物活性蛋白可以包括抗原,例如可以通过适应性免疫系统的选择性元件(例如抗体或其抗原结合片段,t细胞受体或其抗原结合片段等)在特异性结合相互作用中识别的肽或蛋白质,所述抗原可以与至少一种可溶性辐射防护剂化合物(例如半胱氨酸,谷胱甘肽,褪黑素和/或组氨酸)接触,以使生物活性蛋白和辐射防护剂化合物同时进行干燥,从而获得基本上干燥的辐射防护混合物,然后可以对其进行辐射灭菌,从而获得基本上干燥的经辐射灭菌的辐射防护混合物。
在某些其他优选的实施方案中,一种或多种生物活性蛋白可以包括细胞因子,例如tnf-α,ifn-γ,il-1,il-2等,其可以与至少一种可溶性辐射防护剂化合物(例如半胱氨酸,谷胱甘肽,褪黑素和/或组氨酸)接触,以使生物活性蛋白和辐射防护剂化合物同时进行干燥,从而获得基本上干燥的辐射防护混合物,然后可以对其进行辐射灭菌,从而获得基本上干燥的经辐射灭菌的辐射防护混合物。
在某些优选的实施方案中,一种或多种生物活性分子可包括蛋白质,dna和/或rna中的一种或多种,其可以与至少一种可溶性辐射防护剂化合物(例如半胱氨酸,谷胱甘肽,褪黑素和/或组氨酸)接触,以使生物活性分子和辐射防护剂化合物同时进行干燥,从而获得基本上干燥的辐射防护混合物,然后可以对其进行辐射灭菌,从而获得基本上干燥的经辐射灭菌的辐射防护混合物。
在辐射灭菌之后,可以将基本上干燥的经辐射灭菌的辐射防护混合物再水化(例如,通过生化,生物学和/或免疫学领域的技术人员熟悉的重悬和/或溶解在水或水性溶剂(例如水基缓冲液)中)以获得再水化的辐射灭菌的辐射防护混合物。辐射灭菌后辐射防护混合物中生物活性蛋白的生物活性大于在不存在辐射防护剂化合物的情况下进行辐射灭菌的对照样品中生物活性蛋白的生物活性(例如,相对于适当的对照,以统计上显著的方式增加)。因此,本文公开的实施方案出乎意料地基本上保护生物活性蛋白的生物活性没有辐射灭菌期间的辐射损害。
根据本发明优选的辐射防护剂化合物包括半胱氨酸,褪黑素,谷胱甘肽和组氨酸。在某些实施方案中,辐射防护剂化合物可以包含辐射防护剂化合物半胱氨酸,褪黑素,谷胱甘肽和组氨酸中的一种、两种、三种或全部四种;在某些其他实施方案中,辐射防护剂化合物可以由所述辐射防护剂化合物半胱氨酸,褪黑素,谷胱甘肽和组氨酸中的一种、两种、三种或全部四种组成。在使用中,这些化合物的来源,处理,储存和增溶是众所周知的,并且可以容易地根据已知方法和本公开内容(包括以下实施例)适用于本发明方法。本文所提供的辐射防护剂化合物可以能够有效地基本上保护生物活性蛋白(例如,丝裂原,例如抗-cd3抗体,pha,cona,pwn)或本文提供的其他生物活性分子的生物学活性(例如,促有丝分裂活性)的浓度存在于本文描述的辐射防护混合物中。通常,辐射防护剂化合物可以以至少0.1、0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、300或400mm的浓度存在,包括它们之间的任何中间浓度。本文公开的辐射防护剂化合物的结构如下所示。
不希望被理论所束缚,某些本文描述的辐射防护剂化合物可以表现出抗氧化剂和/或自由基清除剂的功能特性。然而,本发明的实施方案无意就这些辐射防护剂化合物保护本文所述的生物活性蛋白或其他生物活性分子(特别是本文所述的生物活性蛋白,即哺乳动物外周血淋巴细胞的丝裂原)免受辐射灭菌结果所引起的生物活性受损的能力进行限制。
l-半胱氨酸(2-氨基-3-巯基丙酸)具有以下结构(i):
谷胱甘肽(还原形式)(γ-l-谷氨酰基-l-半胱氨酰甘氨酸)具有以下结构(ii):
褪黑素(n-乙酰基-5-甲氧基色胺)具有以下结构(iii):
组氨酸具有以下结构(iv):
应当理解,除非特别相反地指出,否则本发明的几个实施方案的实施将采用本领域技术范围内的病毒学,免疫学,微生物学,分子生物学和重组dna技术中的常规方法,并且为了说明的目的,下面描述其中的许多方法。文献中对这种技术进行了充分的解释。例如,参见《分子生物学最新方案或免疫学最新方案》(currentprotocolsinmolecularbiologyorcurrentprotocolsinimmunology),纽约州纽约的约翰·威利父子公司(johnwiley&sons,newyork,ny)(2009);ausubel等人,《分子生物学简本》(shortprotocolsinmolecularbiology),第3版,纽约的约翰·威利父子公司1995;green和sambrook,《分子克隆:实验室手册》(molecularcloning:alaboratorymanual)(第4版,2012)纽约州冷泉港的冷泉港实验室出版社(coldspringharborlaboratorypress,coldspringharbor,ny);《dna克隆:实用方法》(dnacloning:apracticalapproach),第i&ii期(d.glover编),第2版,1995,英国牛津大学出版社(oxforduniv.press,uk);《寡核苷酸合成》(oligonucleotidesynthesis)(n.gait编,1984)irl/英国牛津大学出版社;《核酸杂交》(nucleicacidhybridization)(b.hames&s.higgins编,1985)irl/英国牛津大学出版社(oxforduniv.press,uk);《转录和翻译》(transcriptionandtranslation)(b.hames&s.higgins编,1984)irl/英国牛津大学出版社;《动物细胞培养》(cultureofanimalcells)(r.freshney,2010)纽约的约翰·威利父子公司;perbal,《分子克隆实用指南》(apracticalguidetomolecularcloning)(1984),纽约的约翰·威利父子公司;以及其他类似的参考文献。
可使用标准技术进行免疫分析,包括免疫化学和细胞免疫分析,以及生物样品的采集和处理(例如血液,淋巴液,唾液,痰,脓液,活组织检查等),组织培养和转化(例如电穿孔,脂质转染)。免疫化学和酶促反应及纯化技术可使用商购的试剂根据制造商的说明或本领域通常完成的或如本文所述进行。这些和相关的技术和方法可以一般性地按照如本领域所知、亦如本说明书所引用和论述的众多综合性和专论性文献中所述来进行。除非提供具体定义,否则与本文所述的分子生物学,细胞和分子免疫学,生物化学,分析化学,合成有机化学以及药物和药物化学结合使用的命名法以及实验室方法和技术是本领域公知且普遍使用的。标准技术可用于重组技术,分子生物学和/或细胞或微生物学方法,化学合成,化学分析,药物制备,配制,递送以及患者的诊断和/或治疗。
在本说明书和所附权利要求书中所用的单数形式“一个”、“一种”和“该”包括多个指示物,除非上下文中有明显的表示。在整篇说明书中,除非上下文需要另外说明,词语“包括”或其变化形式如“包含”或“含有”应理解为暗示包括所述元素或整数或者元素或整数组,但不排除任何其他元素或整数或者元素或整数组。除非另有明确说明,否则本说明书中的每个实施方案均应作必要的变通而应用于所有其他实施方案。
等价形式
尽管出于说明的目的已经在本文中示出和描述了本发明的特定步骤,要素,实施方式和应用,但是应当理解,尤其是根据前述教导,本领域技术人员可以进行修改而不会背离本发明的精神和范围,因此本发明不限于此。因此,本发明不受限制,所附权利要求书例外。
引用的其他文献
meltzml,reiterrj,hermants,kumarks(1999年3月).“褪黑素和全身辐射防护:小鼠的存活研究”(melatoninandprotectionfromwhole-bodyirradiation:survivalstudiesinmice),mutat.res.425(1):21–7.reiterrj,hermants,meltzml(1996年12月)。“褪黑素和辐射防护免受基因损害:人类志愿者的体内/体外研究”(melatoninandradioprotectionfromgeneticdamage:invivo/invitrostudieswithhumanvolunteers),mutat.res.371(3–4):221–8。reiterrj,hermants,meltzml(1998年2月),“褪黑素减少了人血液淋巴细胞中γ辐射引起的初级dna损伤”(melatoninreducesgammaradiation-inducedprimarydnadamageinhumanbloodlymphocytes),mutat.res.397(2):203–8。tandx,manchesterlc,terronmp,floreslj,reiterrj(2007年1月),“一个分子,许多衍生物:褪黑素与活性氧和氮物种之间永无止境的相互作用?”(onemolecule,manyderivatives:anever-endinginteractionofmelatoninwithreactiveoxygenandnitrogenspecies?),j.pinealres.42(1):28–42。
tandx,chenld,poeggelerb,manchesterlc,reiterrj(1993).“褪黑素:有效的内源性羟基自由基清除剂”(melatonin:apotent,endogenoushydroxylradicalscavenger),endocrinej.1:57–60。pohankam(2011).“阿尔茨海默氏病和相关的神经退行性疾病:褪黑素的影响和作用”(alzheimer′sdiseaseandrelatedneurodegenerativedisorders:implicationandcounteractingofmelatonin),journalofappliedbiomedicine9(4):185–196。reiterrj,manchesterlc,tandx(2010年9月),“神经毒素:自由基机制和褪黑素保护”(neurotoxins:freeradicalmechanismsandmelatoninprotection),currneuropharmacol8(3):194–210。poeggelerb,saarelas,reiterrj,tandx,chenld,manchesterlc,barlow-waldenlr(1994年11月),“褪黑素-一种高效的内源性自由基清除剂和电子供体:在体外获得的吲哚的氧化化学的新方面”(melatonin–ahighlypotentendogenousradicalscavengerandelectrondonor:newaspectsoftheoxidationchemistryofthisindoleaccessedinvitro),ann.n.y.acad.sci.738:419–20。arnaomb,hernández-ruizj(2006年5月),“褪黑素在植物中的生理功能”(thephysiologicalfunctionofmelatonininplants),plantsignalbehav1(3):89–95。pieric,marram,moronif,recchionir,marchesellif(1994),“褪黑素:一种比维生素e更有效的过氧化自由基清除剂”(melatonin:aperoxylradicalscavengermoreeffectivethanvitamine),lifesci.55(15):pl271–6。
wade等人,1998j.nutritionalbiochem.9(6):308-315)。
下列实施例是说明性而非限制性的。
实施例
实施例1
pha促有丝分裂活性免于辐射灭菌损害的辐射防护
简而言之,从制造商(凯杰公司(qiagen),马里兰州德国镇)获得
根据生产商的说明(凯杰公司(qiagen),马里兰州德国镇),使用
表1:处理后qfn丝裂原管的效力
相对于相同批次的未经任何处理的丝裂原管(100%效力),再次确定经处理的qfn-丝裂原对照采血管的促有丝分裂效力的组平均百分比。
使用电子束(16.6-30kgy),γ-辐射(25kgy)和2倍电子束(2x电子束)对来自单个生产批次的丝分裂原对照管进行灭菌。用来自一组11个血液供体的全血样品评估促有丝分裂活性,即丝裂原管的ifn-γ水平。灭菌管的促有丝分裂效力表示为相对于未经任何处理的试管的组平均效力百分比。
这些结果表明,必须在每个试管上喷雾干燥更多量的pha,才能使得经辐射灭菌的试管具有的pha促有丝分裂活性水平接近未经辐射灭菌的试管中的pha促有丝分裂活性水平。
因此选择候选的辐射防护剂化合物,并筛选其对pha促有丝分裂活性的影响。作为第一选择,鉴定了候选辐射防护剂化合物,即使在辐射灭菌之前包含在喷雾干燥的pha制剂中,其本身不会显著改变促有丝分裂活性(例如,相对于适当的对照,以统计学显著的方式增加或减少)。如表2所示,含有50mm候选辐射防护剂化合物半胱氨酸或10mm候选辐射防护剂化合物褪黑素的pha-p制剂表现出与未补充的pha制剂相当的pha促有丝分裂活性。
表2:用半胱氨酸或褪黑素配制时的pha-p活性
*具有半胱氨酸和褪黑素的pha-p制剂的效力是针对不含添加剂的相同制剂(效力为100%)确定的。
在来自6个血液供体的全血样本中评估了pha-p制剂的效力。结果表示为具有添加剂的制剂效力相对于不含任何添加剂的制剂效力的平均百分比。
接下来测试不干扰pha促有丝分裂活性的候选辐射防护剂化合物在辐射灭菌过程中保护pha免于促有丝分裂活性丧失的能力。在pha液体制剂中添加l-半胱氨酸,还原型谷胱甘肽或褪黑素至终浓度为5.0mm,在8.3、16.7和25kgy电子束辐射灭菌处理后,部分地防止了pha促有丝分裂活性的丧失(表3)。在不存在任何候选辐射防护剂化合物的情况下,pha液体制剂(表3,“对照”)在8.3kgy的辐射灭菌处理后仅具有11%的促有丝分裂活性。相比之下,在8.3kgy相同剂量的辐射灭菌处理后,包含l-半胱氨酸,还原型谷胱甘肽或褪黑素的喷雾干燥pha制剂分别显示出相对于对照水平68%,53%和53%的促有丝分裂活性水平,因此保留了基本上受保护的促有丝分裂活性。
表3:用电子束处理的pha-p制剂中活性损失的保护
pha-p制剂的促有丝分裂活性的组平均百分比是相对于不进行电子束处理(0.0kgy)的对照确定的。
在来自6个血液供体的全血样本中确定含有5.0mm终浓度添加剂的pha-p制剂的组平均活性。结果表示为相对于不含添加剂的未处理对照样品,效力的平均百分比。
含有本文确定的保护性化合物的液体pha制剂在较高剂量(即16.7和25kgy)的电子束处理下进行辐射灭菌后,还显示基本上保护pha促有丝分裂活性的能力。
进一步评估了l-半胱氨酸和褪黑素的剂量-效应保护能力。将l-半胱氨酸溶于pha-p制剂中至1.0-50mm。由于其较低的水溶性,首先在100%的乙醇中制备200mm的褪黑素储备液。然后将储备液添加到pha-p制剂中,使最终浓度为0.2-10mm。电子束处理后,根据制造商的说明,使用
结果总结在图1中。将pha-p制剂中的l-半胱氨酸浓度从1.0mm增加到10mm,可以显著增强其在25kgy时对pha促有丝分裂活性的辐射防护,相对于pha对照制剂(其不含辐射防护剂化合物作为添加剂并且未进行辐射灭菌处理),促有丝分裂活性水平从5.9%增至38%。
进一步测试了l-半胱氨酸降低由采血管中喷雾干燥的pha的辐射灭菌引起的pha促有丝分裂效力丧失的能力。包含喷雾干燥的pha(在喷雾干燥步骤中没有辐射防护剂化合物)的采血管进行辐射灭菌,并如上所述测试了pha对全血样品的促有丝分裂活性。当喷雾干燥的pha制剂中存在半胱氨酸(5mm)但试管未经过辐射灭菌时,pha对全血样品的促有丝分裂反应平均为对照水平的94.8%(对照为无辐射防护剂,无辐射灭菌)(图2,左栏),表明半胱氨酸不会改变未灭菌丝裂原管中的丝裂原反应。辐射灭菌步骤将pha促有丝分裂活性降低至对照水平的56%(对照为无辐射防护剂,无辐射灭菌)(图2,中间一栏)。当喷雾干燥的pha制剂中存在半胱氨酸(5mm)并对试管进行辐射灭菌时,pha对全血样品的促有丝分裂反应从对照水平的56%(无半胱氨酸)增加到72%(5mm半胱氨酸)(对照为无辐射防护剂,无辐射灭菌)(图2,右栏)。
实施例2
辐射防护剂对pha促有丝分裂活性保护作用的储存稳定性
如实施例1所述制备丝裂原(喷雾干燥的pha)试管并进行辐射灭菌,将未添加半胱氨酸的pha制剂与含有5.0mm半胱氨酸的pha制剂进行比较。还评估了半胱氨酸对喷雾干燥的pha的促有丝分裂活性的辐射防护作用的长期储存稳定性。
在喷雾干燥和辐射灭菌之后,将试管储存不同的时间段,然后如前所述测试其促有丝分裂活性。在第一个测试时间点(制备后一个月内),不含半胱氨酸的含丝裂原试管的促有丝分裂活性水平与存在半胱氨酸的试管相似(图3)。然而,在随后的时间点进行的测试长达制备后的八个月以上,结果显示,与未使用半胱氨酸制备的试管相比,包含半胱氨酸的试管保留了相对较高的促有丝分裂活性水平。
实施例3
抗cd3抗体t细胞刺激活性免受辐射灭菌影响的辐射防护
该实施例描述了如本文所述的辐射防护剂化合物用于保护生物活性抗体的活性免受辐射灭菌作用的用途。在该实施例中,材料和方法基本上如上文实施例1和2中所述,除非本文另外指明。
将抗-cd3抗体样品溶解在杜氏(dulbecco)磷酸盐缓冲盐水(dpbs)中,并稀释至66.7μg/ml的浓度,然后在存在或不存在10mm半胱氨酸(cys)或3mm谷胱甘肽(g-sh)的情况下暴露于各种剂量的电子束辐照。在
功能性抗-cd3抗体能够引发t细胞反应,从而诱导全血培养物中的干扰素γ(ifn-γ)分泌。在电子束辐射期间用10mm半胱氨酸或3.0mmg-sh保护的抗-cd3抗体在全血样品中引发的ifnγ反应的代表性结果显示在图4中,与未保护的对照样品(在未补充的dpbs中辐射)进行比较。在仅在dpbs中照射抗体时,以8.3kgy或更高的剂量进行电子束处理完全消除了抗-cd3抗体活性(y轴中的组平均ifn-γ响应,图4)(空心圆)。相比之下,在还含有10mm半胱氨酸(cys,实心正方形)或3.0mmg-sh(实心圆圈)的dpbs中照射的电子束处理的抗-cd3抗体样品保持刺激活性,即使在最高达25kgy的电子束剂量下(图4)。因此,cys和g-sh均清楚地保护了用电子束辐射处理的抗-cd3抗体的活性。
在用25kgy电子束辐射处理的抗体样品中,两种辐射防护剂cys和g-sh均赋予了抗-cd3活性的保护作用,cys(实心圆圈)和g-sh(实心正方形)均显示从1.0到10mm的剂量依赖性增加(图5)。
实施例4
r848(雷西莫特)tlr激动剂活性对辐射灭菌的辐射防护
该实施例描述了使用本文所述的辐射防护剂化合物来保护咪唑并喹啉免疫反应调节剂(r848)的tlr激动剂活性免受辐射灭菌的影响。在该实施例中,材料和方法基本上如上文实施例1-3中所述,除非本文另外指明。
r848(雷西莫特,cas144875-48-9)是一种toll样受体(tlr)激动剂,可以刺激自然杀伤(nk)细胞产生生物反应,其活性可以在
代表性的结果显示,与在载剂对照(dpbs)中辐照的r848相比,在10mmcys或3.0mmg-sh存在下辐照的r848样品具有辐射防护作用,如图6所示。8.3kgy和更高剂量的电子束处理完全消除了仅在dpbs中制备的r848的活性(y轴上的组平均ifn-γ反应,图6)(空心圆)。相反,包含10mmcys(实心正方形)或3.0mmg-sh(实心圆圈)的电子束处理过的r848样品保留了r848的刺激活性。
在用25kgy电子束处理的样品中,cys和g-sh对r848活性的保护作用对于cys(实心圆)和g-sh(实心正方形)均表现出从1.0mm到10mm的剂量依赖性增加(图7)。
实施例5
联合的抗-cd3抗体t-细胞刺激活性和r848(雷西莫特)tlr激动剂活性对辐射灭菌的辐射防护。
该实施例描述了使用本文所述的辐射防护剂化合物来保护生物活性抗体和咪唑并喹啉tlr激动剂免疫反应调节剂(r848)的联合活性免于辐射灭菌的影响。在该实施例中,材料和方法基本上如上文实施例1-4中所述,除非本文另外指明。
将
代表性结果显示了与对照(dpbs)相比,在存在10mmcys或3.0mmg-sh的情况下辐照的qfm样品具有的辐射防护作用,如图8所示。8.3kgy或更高剂量进行的电子束处理完全消除了仅在未补充的dpbs中制备的刺激性抗-cd3/r848组合的活性(y轴的组平均ifn-γ反应,图8)(空心圆)。相反,在含辐射防护剂的样品中,该样品在含有10mmcys(实心正方形)或3.0mmg-sh(实心圆圈)的pbsd中进行电子束辐照,抗-cd3和r848的刺激活性得到保留。
在用25kgy电子束处理的样品中,cys和g-sh对联合的抗-cd3和r848活性的保护作用对于cys(实心圆)和g-sh(实心正方形)均表现出从1.0mm到10mm的剂量依赖性增加(图9)。
实施例6
商陆丝裂原(pwm)促有丝分裂活性对辐射灭菌的辐射防护
该实施例描述了如本文所述的辐射防护剂化合物用于保护生物活性凝集素的活性免受辐射灭菌作用的用途。在该实施例中,材料和方法基本上如上文实施例1-5中所述,除非本文另外指明。
将商路丝裂原(pwm)样品以33.3μg/ml的浓度溶解在dpbs中,并在存在或不存在10mm半胱氨酸(cys)或3mm谷胱甘肽(g-sh)的情况下,用各种剂量的电子束辐射处理。qfnnil试管中每毫升全血使用1.0μgpwm,测试经处理的pwm样品对从六个随机选择的供体中收集的人全血样品中存在的白细胞的生物学活性(在体外孵育过程中引发ifnγ释放的能力)。根据
代表性结果显示了与对照(dpbs)相比,在存在10mmcys或3.0mmg-sh的情况下辐照的pwm样品具有辐射防护作用,如图10所示。8.3kgy和更高剂量的电子束处理完全消除了仅在未补充的dpbs中制备和辐照的对照pwm样品的活性(y轴上的组平均ifn-γ反应,图10)(空心圆)。相反,在含辐射防护剂的样品中,该样品在含有10mmcys(实心正方形)或3.0mmg-sh(实心圆圈)的pbsd中进行电子束辐照,pwm的刺激活性得到保留。
在用25kgy电子束处理的样品中,cys和g-sh对pwm活性的保护作用对于cys(实心圆)和g-sh(实心正方形)均表现出从1.0mm到10mm的剂量依赖性增加(图11)。
实施例7
伴刀豆球蛋白a(cona)促有丝分裂活性对辐射灭菌的辐射防护
该实施例描述了如本文所述的辐射防护剂化合物用于保护生物活性凝集素的活性免受辐射灭菌作用的用途。在该实施例中,材料和方法基本上如上文实施例1-6中所述,除非本文另外指明。
伴刀豆球蛋白a(cona)被称为激活t淋巴细胞的凝集素。将cona样品以3333μg/ml的浓度溶解在dpbs中,并在存在或不存在10mm半胱氨酸(cys)或3mm谷胱甘肽(g-sh)的情况下,用各种剂量的电子束辐射处理。
qfnnil试管中每毫升全血使用100μgcona,测试经处理的cona样品对从六个随机选择的供体中收集的人全血样品中存在的白细胞的生物学活性(在体外孵育过程中引发ifnγ释放的能力)。根据
代表性结果显示了与对照(dpbs)相比,在存在10mmcys或3.0mmg-sh的情况下辐照的cona样品具有辐射防护作用,如图12所示。8.3kgy和更高剂量的电子束处理完全消除了仅在未补充的dpbs中制备和辐照的对照cona样品的活性(y轴上的组平均ifn-γ反应,图12)(空心圆)。相反,在含辐射防护剂的样品中,该样品在含有10mmcys(实心正方形)或3.0mmg-sh(实心圆圈)的pbsd中进行电子束辐照,cona的刺激活性得到保留。
在用25kgy电子束处理的样品中,cys和g-sh对cona活性的保护作用对于cys(实心圆)和g-sh(实心正方形)均表现出从1.0mm到10mm的剂量依赖性增加(图13)。
也可以组合上述所述各种实施方式以提供其它实施方式。本说明书中提及的和/或列于申请数据表单中的所有美国专利、美国专利申请公开文本、美国专利申请、外国专利、外国专利申请和非专利公开文本,包括2018年5月18日提交的美国临时专利申请62/673,671,均通过引用其全文纳入本文。所述实施方式的各方面可被修改,必要时可应用各种专利、申请和出版物的概念,以提供更多的实施方式。
根据上述详细说明可对实施方式进行这些和其它改变。总体而言,权利要求中所用的术语应不被认为是将权利要求限制到本说明书和权利要求中公开的具体的实施方式,而应认为是包括遵循与所列权利要求等同的完全范围的所有可能的实施方式。因此,权利要求并不受本公开内容限制。
- 还没有人留言评论。精彩留言会获得点赞!