使用溶瘤病毒的治疗的制作方法
本发明涉及溶瘤免疫治疗剂和该溶瘤免疫治疗剂在治疗癌症中的用途。
背景技术:
病毒具有以高效率进入细胞的独特能力。进入细胞后,表达病毒基因并复制病毒。这通常导致受感染细胞的死亡和细胞的抗原成分的释放,因为当细胞死亡时细胞破裂。结果,病毒介导的细胞死亡倾向于导致对这些细胞组分的免疫应答,所述细胞组分包括源自宿主细胞的那些和由病毒本身编码或掺入病毒本身的那些。由于宿主识别辅助免疫应答激活的所谓的损伤相关分子模式(damp),因此免疫应答也得到增强。
病毒也与先天免疫应答的各种调节物相互作用,作为宿主对下述识别的应答的一部分:例如,通过toll样受体、cgas/sting信号传导识别病毒感染,和/或识别病原体相关分子模式(pamp),所述识别导致干扰素反应和炎症(对宿主而言,它们也是免疫原性信号)的激活。这些免疫应答可以对癌症患者产生免疫原性益处,使得对肿瘤抗原的免疫应答提供系统的总体益处,从而导致治疗未感染病毒的肿瘤,包括微转移性疾病,并提供针对复发的疫苗接种。
病毒的组合直接(“溶瘤”)效应和针对肿瘤抗原的免疫应答(包括非自身“新生抗原”,即源自个体肿瘤中的特定突变基因)被称为“溶瘤免疫疗法”。
病毒也可用作递送媒介物(“载体”)以在感染细胞中表达插入病毒基因组中的异源基因。这些特性使病毒可用于各种生物技术和医学应用。例如,表达异源治疗基因的病毒可用于基因治疗。在溶瘤免疫疗法的背景下,递送的基因可包括:编码特定肿瘤抗原的基因,旨在诱导免疫应答或增加病毒复制和细胞死亡后释放的抗原的免疫原性的基因,旨在塑造产生的免疫应答的基因,增加肿瘤的一般免疫激活状态的基因,或增加病毒的直接溶瘤特性(即细胞毒性作用)的基因。重要的是,病毒具有递送经编码的分子的能力,所述经编码的分子旨在有助于直接和选择性地引发、增强或塑造对肿瘤的全身性抗肿瘤免疫应答,这可能具有以下益处:例如,与对这些相同分子的全身施用或靶向相同途径的其他分子的全身施用相比,毒性降低或将有益效果集中于肿瘤(包括未被病毒感染的那些)而不是对正常(即非癌性)组织的脱靶效应。
已经证明,包括例如单纯疱疹病毒(hsv)在内的许多病毒在癌症的溶瘤治疗中具有应用。必须使用于癌症的溶瘤治疗的hsv失去能力,使其不再致病,但仍可进入并杀死肿瘤细胞。已经鉴定了许多对hsv的致残突变,包括编码icp34.5、icp6和/或胸苷激酶的基因的破坏,其不能阻止病毒在培养物中或在体内肿瘤组织中复制,但是其阻止在正常组织中的明显复制。其中仅有icp34.5基因被破坏的hsv在体外在许多肿瘤细胞类型中复制,并且在小鼠肿瘤模型中选择性地在肿瘤组织中复制,但不在周围组织中复制。缺失icp34.5或缺失icp34.5和icp6的hsv的临床试验也显示出安全性和在人类肿瘤组织中的选择性复制。
如上所述,包括hsv在内的溶瘤病毒也可用于在癌症治疗中递送治疗基因。另外缺失icp47并且编码用于gm-csf的异源基因的这种类型的缺失icp34.5的病毒也已经在临床试验中进行了测试,包括在黑色素瘤中的3期试验,其中显示了对人的安全性和功效。gm-csf是一种促炎性细胞因子,其具有多种功能,包括刺激单核细胞离开循环并迁移到组织中,在那里它们增殖并成熟为巨噬细胞和树突状细胞。gm-csf对于抗原呈递细胞的增殖和成熟很重要,而抗原呈递细胞的活性是激活抗肿瘤免疫应答所必需的。试验数据表明,在注射的肿瘤中可以看到肿瘤反应,在未注射的肿瘤中可以看到较小程度的肿瘤反应。反应倾向于高度持久(数月-数年),并且在响应患者中似乎实现了生存益处。除了直接溶瘤作用外,这些中的每一个都表明免疫系统在癌症治疗中的参与。然而,这一数据和使用溶瘤病毒的其他数据通常表明并非所有肿瘤都对治疗有响应,并且并非所有患者都能获得生存优势。因此,显然需要改进溶瘤治疗和溶瘤免疫治疗的技术。这些可用于增加治疗的直接溶瘤作用、治疗的抗肿瘤免疫刺激作用或一起增加这两种作用。
最近已经表明,溶瘤免疫疗法可以与免疫检查点阻断(即免疫检查点途径的抑制或“拮抗作用”)结合产生加和或协同治疗效果,免疫检查点阻断也称为免疫共抑制途径阻断。检查点(免疫共抑制途径)阻断旨在阻断宿主免疫抑制机制,其通常用于防止自身免疫性的发生。然而,在癌症患者中,这些机制也可用于阻断(例如,抑制诱导)针对肿瘤诱发的任何免疫应答的潜在有益作用。备选地,由于缺失激活或缺失免疫增强途径的完全激活,免疫应答可能不会被完全加强。因此,减轻这些阻断(抑制“免疫共抑制途径”)或刺激免疫增强途径(即,其激活“免疫共刺激途径”或是“免疫共刺激途径”的“激动剂”)的药物对于测试和开发癌症治疗是有吸引力的。这些批准的或实验药物的靶标包括ctla-4、pd-1、pd-l1、lag-3、tim-3、vista、csf1r、ido、ceacam1、gitr、4-1-bb、kir、slamf7、ox40、cd40、icos或cd47。
通过靶向ctla-4、pd-1或pd-l1的药剂对这些途径的系统性阻断已经在许多肿瘤类型(包括黑色素瘤和肺癌)中显示出功效。然而,毫不奇怪,基于作用机制,由于自身免疫的诱导,会发生脱靶毒性。即使这样,这些药剂也足够耐受以提供可观的临床效用。正在开发的药剂(主要是抗体)的其他免疫共抑制途径和相关靶标包括lag-3、tim-3、vista、csf1r、ido、ceacam1、cd47。这些药剂的最佳临床活性,例如pd1、pdl1、lag-3、tim-3、vista、csf1r、ido、cd47、ceacam1,可能由于作用机制(即包括靶向免疫效应细胞与肿瘤的界面或肿瘤中/肿瘤的其他免疫抑制机制)而需要全身施用或需要存在于所有肿瘤中。在一些情况下,在例如仅一些肿瘤或一些淋巴结中的更多局部存在也可能是最佳有效,例如靶向ctla-4的药剂。
增加癌症患者中的抗肿瘤免疫应答的另一种方法是靶向(激活)免疫共刺激途径,即与抑制免疫共抑制途径相反。这些途径将激活信号发送到t细胞和其他免疫细胞中,通常是由于抗原呈递细胞(apc)上的相关配体与t细胞和其他免疫细胞表面上的相关受体的相互作用所致。取决于配体/受体,这些信号可导致t细胞和/或apc和/或nk细胞和/或b细胞(包括特定的亚型)活化增加,t细胞和/或apc和/或nk细胞和/或b细胞(包括特定的亚型)分化和增殖增加,或抑制免疫抑制性t细胞(例如调节性t细胞)的活性。因此,预期这些途径的激活将导致增强的抗肿瘤免疫应答,但是也可以预期这些途径的全身激活,即通常是免疫应答的激活而不是特异性或选择性地抗肿瘤免疫应答的激活,将导致在非肿瘤组织中的相当大的脱靶毒性,这种脱靶毒性的程度取决于所靶向的特定免疫共刺激途径。但是,靶向免疫共刺激途径的药剂(主要是激动性抗体,或较少见的所讨论的受体的可溶性配体),包括靶向gitr、4-1-bb、ox40、cd40或icos的药剂,并且旨在全身使用(即静脉内递送)的药剂处于临床开发或已经提议用于临床开发。
为了使这些方法成功,需要预先存在的针对肿瘤的免疫应答,即,使得预先存在的免疫应答可以被加强或能够解除对抗肿瘤免疫应答的阻断。还需要存在发炎的肿瘤微环境,其表明这种持续的应答。预先存在的针对肿瘤新生抗原的免疫应答似乎对免疫共抑制途径阻断和相关药物的活性特别重要。只有一些患者可能对肿瘤抗原(包括新生抗原)有持续的免疫应答和/或有发炎的肿瘤微环境,这两者都是这些药物活性(例如,最佳活性)所必需的。因此,可以诱导针对肿瘤抗原(包括新生抗原)的免疫应答和/或可以诱导发炎的肿瘤微环境的溶瘤剂对于与免疫共抑制途径阻断和免疫增强药物组合使用是有吸引力的。这可能解释了迄今为止观察到的小鼠和人类中溶瘤剂和免疫共抑制途径阻断的有希望的联合抗肿瘤作用。
吲哚胺2,3-双加氧酶(ido)途径在肿瘤和肿瘤引流淋巴结中均通过直接抑制t细胞和增强局部调节性t细胞(treg)介导的免疫抑制作用产生致耐受性环境而促进肿瘤诱导的耐受性。ido催化沿犬尿氨酸途径的色氨酸降解的限速步骤,并且局部色氨酸浓度的降低和免疫调节性色氨酸代谢物的产生都有助于ido的免疫抑制作用。在许多癌症患者中ido被长期激活,ido激活与更广泛的疾病相关。它还可以作为其他抗肿瘤免疫性激活剂的拮抗剂。因此,正在开发ido途径的抑制剂作为抗癌剂,特别是与检查点阻断剂(例如靶向ctla-4、pd-1或pdl-1的那些)组合。ido抑制剂还可以与溶瘤免疫疗法协同作用,包括与靶向其他免疫检查点或免疫共刺激途径的药物一起协同作用。
上述讨论表明,改善溶瘤剂和利用溶瘤剂的癌症治疗仍有很大的余地。
技术实现要素:
本公开提供了改善的溶瘤病毒。改善的溶瘤病毒具有改善的直接溶瘤作用。由本公开内容的病毒提供的改善的直接溶瘤作用也将导致改善的全身性抗肿瘤免疫作用。由本公开内容的病毒提供的改善的直接溶瘤作用也将导致患者的治疗效果改善。肿瘤细胞中增强的复制和杀死肿瘤细胞将导致增强的肿瘤抗原释放和增强的对释放的抗原的全身免疫应答。插入以增大直接溶瘤作用和/或免疫刺激的任何基因的表达水平也将增加。
病毒物种以一系列变体(毒株)天然存在于自然群体内,其可能相差少量或大量的核苷酸,同时仍保留了抗原特性和足够的序列同一性,仍被视为同一病毒物种。由于其序列不同,这些毒株而可能表现出一系列不同的特性,包括已经通过自然选择在它们的一个或多个天然宿主中选择的特性(例如,感染所讨论的病毒的靶细胞类型或在所讨论的病毒的靶细胞类型中复制、在这些细胞之间扩散、或逃避宿主的先天或适应性免疫系统、或在宿主物种的受感染个体之间扩散的能力),以及尚未特别选择的特性(例如,在细胞类型中复制以及杀死细胞类型或在细胞类型间扩散的能力,所述细胞类型并非所讨论的病毒的天然靶标,包括肿瘤或其他非靶细胞类型或组织)。本发明人已经认识到,对天然宿主群体中存在的特定病毒物种的一系列病毒株(在病毒感染人类的情况下,在本文中称为“临床分离株”)进行采样,并将它们彼此进行比较以选择对于其将用于的预期目的(例如感染和杀死肿瘤细胞)具有最佳特性的病毒株可用于鉴定用于此目的的具有最佳特性的病毒(即病毒株)。最佳特性可以是为开发以产生可用作治疗剂的病毒提供最佳起点的特性。与尚未从广泛的病毒株的组中选择所需的一种或多种特性的“原型”或“实验室”病毒株或临床株相比,通过这种方法鉴定出的病毒可能具有更多的用于预期目的的最佳特性。这是因为天然群体中的充分生物学复杂性,特别是在特定的所需的一种或多种特性方面,考虑到天然病毒群体中存在的序列变异的程度,不太可能通过采取狭窄的方法来筛选所需的一种或多种特性。特别地,序列可能在受感染的宿主内变化(如在rna或逆转录病毒群体中经常存在,rna或逆转录病毒群体中经常存在所谓的准种),在个体感染的宿主之间或在不同地理上分离的病毒群体之间变化。
因此,通过对特定病毒物种的天然群体中存在的一系列病毒株进行采样并针对所需的一种或多种特性(例如,感染和杀死肿瘤细胞的能力)彼此进行测试来选择本公开内容的病毒。具有用于预期目的的最佳特性的一株或多株病毒株用于进一步开发。
在预期用途是溶瘤病毒疗法的情况下,采用这种方法为开发溶瘤剂提供了改进的起点,这可能需要进一步操作有利的病毒株。这样的操作包括病毒基因的缺失以提供例如肿瘤选择性,和/或外源基因的插入以进一步改善溶瘤或免疫增强特性。
因此,本公开内容的病毒包括新的病毒物种临床分离株,该病毒分离株比与其进行比较并通过比较鉴定的其他临床分离株具有更好的抗肿瘤作用。特别地,本公开内容的临床分离株比相同病毒类型的这些参考临床分离株在体外更快和/或以更低的剂量杀死肿瘤细胞系。通常,针对所需的一种或多种特性,已经通过比较病毒物种>5株临床分离株来鉴定本公开内容的临床分离株,优选通过比较病毒物种>10株临床分离株,并且更优选通过比较病毒物种>20株临床分离株。本公开内容的临床分离株通常显示出比3/5、6/10或11/20所测试的病毒株更好的肿瘤细胞杀伤活性,优选比4/5、8/10或17/20所测试的病毒株更好,更优选比9/10或19/20所测试的病毒株更好。
通常,本公开内容的临床分离株可以在感染后24至48小时内以0.01至0.001或更小的感染复数(moi)在体外杀死两种或更多种肿瘤细胞系。
本公开内容的临床分离株可以被修饰以进一步增强其抗肿瘤作用。可以修饰本公开内容的临床分离株的基因组以缺失或改变一种或多种病毒基因表达,和/或可以修饰临床分离株的基因组以表达一种或多种异源基因,例如编码促融合蛋白和/或一种或多种免疫刺激分子的基因。
本公开内容提供了表达促融合蛋白和至少一种免疫刺激分子的溶瘤病毒。
本公开内容的溶瘤病毒通过改善的直接溶瘤作用、病毒复制和通过肿瘤的扩散来提供改善的癌症治疗,其(i)增加肿瘤抗原的量,所述肿瘤抗原包括新生抗原,其被释放用于诱导抗肿瘤免疫应答;以及(ii)增强病毒编码的一种或多种免疫刺激分子的表达。由病毒表达的一种或多种免疫刺激分子可以进一步增强和加强抗肿瘤免疫作用。由病毒表达的一种或多种促融合蛋白可以进一步增强病毒在肿瘤中的扩散。由病毒表达的一种或多种促融合蛋白可以进一步增强肿瘤细胞杀伤。在促融合基因是由病毒表达的情况下,通过肿瘤的扩散可以由促融合蛋白介导。
在一个实施方案中,本公开内容提供了表达ctla-4抑制剂的溶瘤病毒。所述病毒可以进一步包含其他免疫调节剂。特别地,所述病毒可以包含gm-csf和/或靶向免疫共刺激途径的至少一种分子。ctla-4抑制剂起阻断共抑制途径的作用,即干扰ctla-4与b7之间的相互作用。gm-csf有助于诱导炎性肿瘤微环境并刺激抗原呈递细胞(包括树突状细胞)的增殖和成熟,从而有助于抗肿瘤免疫应答的诱导。这些免疫应答可以通过使用一种或多种免疫共刺激途径激活分子来激活一种或多种免疫共刺激途径来增大,所述一种或多种免疫共刺激途径激活分子也可以由溶瘤病毒递送。
溶瘤病毒在肿瘤内复制,引起肿瘤细胞裂解和肿瘤抗原释放,并伴有局部炎症和先天免疫应答的激活,所有这些都有利于抗肿瘤免疫应答的激活和ctla-4/b7相互作用的抑制剂的活性。
将抑制ctla-4/b7相互作用的分子直接递送到免疫应答引发肿瘤中,包括预期其将流向引流淋巴结的地方,将抑制剂的免疫增强作用集中在肿瘤上,从而集中在肿瘤内存在的肿瘤抗原上,降低全身毒性并阻断调节性t细胞(treg)的活化,否则其会抑制免疫应答引发部位的t细胞活化。
使用溶瘤病毒将靶向免疫共刺激途径的分子(例如靶向ctla-4的分子)递送至肿瘤,其将免疫作用的放大集中在抗肿瘤免疫应答,并减少针对非肿瘤抗原的免疫应答的放大。因此,通过激活免疫共刺激途径的分子,肿瘤和肿瘤引流淋巴结中的免疫细胞选择性地参与,而不是免疫细胞整体参与,这导致免疫共刺激途径激活和抗肿瘤免疫应答放大的功效增强,并且还可以导致脱靶毒性降低。对于将组合的全身性免疫共抑制途径阻断和免疫共刺激途径活化的作用集中于肿瘤也很重要,即,使得从其释放的共抑制性阻断的放大的免疫应答是抗肿瘤免疫应答,而不是对非肿瘤抗原的应答。
本公开内容利用以下事实:当由溶瘤病毒递送时,异源基因表达(例如共刺激途径激活和gm-csf表达和/或ctla-4阻断)的作用位点在肿瘤和/或引流淋巴结,但这种激活(放大的全身性抗肿瘤免疫应答)的结果是全身性的。这通常靶向肿瘤,并且不仅靶向溶瘤病毒已经递送由异源基因编码的一种或多种分子的肿瘤,所述由异源基因编码的一种或多种分子例如靶向一种或多种免疫共刺激途径的一种或多种分子以及gm-csf和/或ctla-4抑制剂。因此,本公开内容的溶瘤病毒通过产生改善的聚焦肿瘤的免疫应答而提供改善的癌症治疗。本公开内容的溶瘤病毒还提供改善的抗肿瘤免疫刺激作用,从而增强对未被溶瘤破坏的肿瘤(包括微转移性疾病)的免疫介导作用,导致更有效的对这些肿瘤的破坏,以及更有效的长期抗肿瘤疫苗接种,以防止未来复发并提高总体生存率。
当病毒用作单一药剂时并且当病毒还与其他抗癌方式组合使用时,本公开内容的溶瘤病毒的抗肿瘤功效得以实现,所述其他抗癌方式包括化学疗法、使用靶向药剂的治疗、放射、免疫检查点阻断(即施用免疫共抑制途径的一种或多种拮抗剂,例如针对pd1或pd-l1的抗体)和/或免疫增强药物(例如,免疫共刺激途径的一种或多种激动剂)。本公开内容的病毒的改善的直接溶瘤作用(即病毒在肿瘤细胞中复制、在肿瘤细胞之间扩散和直接杀死肿瘤细胞)和改善的全身抗肿瘤免疫作用改善了溶瘤治疗和免疫共抑制途径阻断和/或免疫共刺激途径激活的综合益处。
因此,提供了一种溶瘤病毒,其用于治疗或预防以下疾病的方法:皮肤鳞状细胞癌(cscc)、肾细胞癌(rcc)、非小细胞肺癌(nsclc)、三阴性乳腺癌(tnbc)、小细胞肺癌(sclc)、晚期复发性头颈癌、头颈部鳞状细胞癌(scchn)、鼻咽癌(npc)、肝细胞癌(hcc)、肛门癌、结肠直肠癌(crc)、基底细胞癌(bcc)、梅克尔细胞癌、阑尾癌、皮肤肉瘤、术后复发性黑色素瘤、晚期或转移性尿路上皮癌、肝转移、高微卫星不稳定性癌(msi-h)、混合性晚期实体瘤、病毒引起的癌症、局部区域性晚期癌症、儿科癌症、没有或有极少先前存在的抗癌免疫力的患者的癌症、进行一线治疗的癌症、先前接受过治疗的患者的癌症、未接受过检查点阻断治疗的患者的癌症和/或已接受过检查点阻断治疗的患者的癌症,其中:
(a)溶瘤病毒是临床分离株或衍生自临床分离株,所述临床分离株是通过下述选择的:比较相同病毒物种的一组三株或更多株临床分离株在体外杀死两种或更多种肿瘤细胞系的肿瘤细胞的能力,并选择一株临床分离株,所述临床分离株能够比所述组中的一株或多株其他临床分离株更快地和/或以更低的剂量在体外杀死两种或更多种肿瘤细胞系的细胞;
(b)所述溶瘤病毒包含:(i)促融合蛋白编码基因;和(ii)免疫刺激分子编码基因;
(c)所述溶瘤病毒包含:(i)gm-csf编码基因;和(ii)免疫共刺激途径激活分子或免疫共刺激途径激活分子编码基因;和/或
(d)编码ctla-4抑制剂。
临床分离株可以被修饰。经修饰的临床分离物可以具有突变,例如病毒基因组中的缺失和/或可以表达一种或更多种异源基因。
所述病毒可以是可用于癌症的溶瘤治疗的任何病毒物种的毒株,包括疱疹病毒、痘病毒、腺病毒、逆转录病毒、弹状病毒、副粘病毒或呼肠孤病毒的毒株。所述病毒优选是单纯疱疹病毒(hsv),例如hsv1。hsv通常不表达功能性icp34.5和/或功能性icp47和/或将us11基因作为立即早期基因表达。
所述病毒可包含:(i)促融合蛋白编码基因;和/或(ii)免疫刺激分子或免疫刺激分子编码基因。所述病毒可以编码多于一种的促融合蛋白和/或多于一种的免疫刺激分子。促融合蛋白编码基因是非病毒基因,即它是异源基因。免疫刺激分子编码基因是非病毒基因,即它是异源基因。促融合蛋白优选是来自长臂猿白血病病毒(galv)的糖蛋白,并且r跨膜肽被突变或去除(galv-r-)。免疫刺激分子优选为gm-csf和/或免疫共刺激途径的激动剂,例如gitrl、4-1-bbl、ox40l、icosl、cd40l或flt3,或其中任一种的修饰形式。修饰形式的实例包括分泌而不是膜结合的共刺激途径的激动剂,和/或经修饰以形成蛋白质多聚体的激动剂。免疫刺激分子可以是能够阻断通过ctla-4的信号传导的蛋白质,例如结合ctla-4的抗体或其片段。
所述病毒可编码多于一种的免疫共刺激途径激活分子/基因。免疫共刺激途径激活分子优选为gitr、4-1-bbl、ox40、iscol、cd40或flt3的激动剂,例如gitrl、4-1-bbl、ox40l、icosl、cd40l或flt3配体或其中任一种的修饰形式或能够阻断通过ctla-4的信号传导的蛋白质,例如结合ctla-4的抗体。修饰形式的示例包括分泌而不是膜结合的共刺激途径的激动剂,和/或经修饰以形成蛋白质多聚体的激动剂。
ctla-4抑制剂优选为抗ctla-4抗体或抗体样分子或其抗原结合片段。
本发明还提供了:
-本公开内容的病毒用于治疗癌症的方法,其中所述方法包括施用另一种抗癌剂,其中所述另一种抗癌剂是酪氨酸激酶抑制剂;
-包含本公开内容的病毒和药学上可接受的运载体或稀释剂的药物组合物,其用于治疗或预防以下疾病的方法:皮肤鳞状细胞癌(cscc)、肾细胞癌(rcc)、非小细胞肺癌(nsclc)、三阴性乳腺癌(tnbc)、小细胞肺癌(sclc)、晚期复发性头颈癌、头颈部鳞状细胞癌(scchn)、鼻咽癌(npc)、肝细胞癌(hcc)、肛门癌、结肠直肠癌(crc)、基底细胞癌(bcc)、梅克尔细胞癌、阑尾癌、皮肤肉瘤、术后复发性黑色素瘤、晚期或转移性尿路上皮癌、肝转移、高微卫星不稳定性癌(msi-h)、混合性晚期实体瘤、病毒引起的癌症、局部区域性晚期癌症、儿科癌症、没有或有极少先前存在的抗癌免疫力的患者的癌症、进行一线治疗的癌症、先前接受过治疗的患者的癌症、未接受过检查点阻断治疗的患者的癌症和/或已接受过检查点阻断治疗的患者的癌症;
-本公开内容的病毒用于治疗或预防以下疾病的方法:皮肤鳞状细胞癌(cscc)、肾细胞癌(rcc)、非小细胞肺癌(nsclc)、三阴性乳腺癌(tnbc)、小细胞肺癌(sclc)、晚期复发性头颈癌、头颈部鳞状细胞癌(scchn)、鼻咽癌(npc)、肝细胞癌(hcc)、肛门癌、结肠直肠癌(crc)、基底细胞癌(bcc)、梅克尔细胞癌、阑尾癌、皮肤肉瘤、术后复发性黑色素瘤、晚期或转移性尿路上皮癌、肝转移、高微卫星不稳定性癌(msi-h)、混合性晚期实体瘤、病毒引起的癌症、局部区域性晚期癌症、儿科癌症、没有或有极少先前存在的抗癌免疫力的患者的癌症、进行一线治疗的癌症、先前接受过治疗的患者的癌症、未接受过检查点阻断治疗的患者的癌症和/或已接受过检查点阻断治疗的患者的癌症,任选地,其中所述方法包括将病毒与另一种抗癌剂组合施用,任选地,其中所述另一种抗癌剂是酪氨酸激酶抑制剂;
-治疗癌症的方法,其包括向有需要的患者施用治疗有效量的病毒或本公开内容的药物组合物,其中所述癌症选自皮肤鳞状细胞癌(cscc)、肾细胞癌(rcc)、非小细胞肺癌(nsclc)、三阴性乳腺癌(tnbc)、小细胞肺癌(sclc)、晚期复发性头颈癌、头颈部鳞状细胞癌(scchn)、鼻咽癌(npc)、肝细胞癌(hcc)、肛门癌、结肠直肠癌(crc)、基底细胞癌(bcc)、梅克尔细胞癌、阑尾癌、皮肤肉瘤、术后复发性黑色素瘤、晚期或转移性尿路上皮癌、肝转移、高微卫星不稳定性癌(msi-h)、混合性晚期实体瘤、病毒引起的癌症、局部区域性晚期癌症、儿科癌症、没有或有极少先前存在的抗癌免疫力的患者的癌症、进行一线治疗的癌症、先前接受过治疗的患者的癌症、未接受过检查点阻断治疗的患者的癌症和/或已接受过检查点阻断治疗的患者的癌症,并且其中所述方法任选地包括施用另一种抗癌剂,所述另一种抗癌剂任选地为免疫共抑制途径的拮抗剂、或免疫共刺激途径的激动剂和/或酪氨酸激酶抑制剂;和
-治疗癌症的方法,其包括将治疗有效量的本公开内容的病毒或药物组合物与酪氨酸激酶抑制剂组合施用给有需要的患者。
附图简述
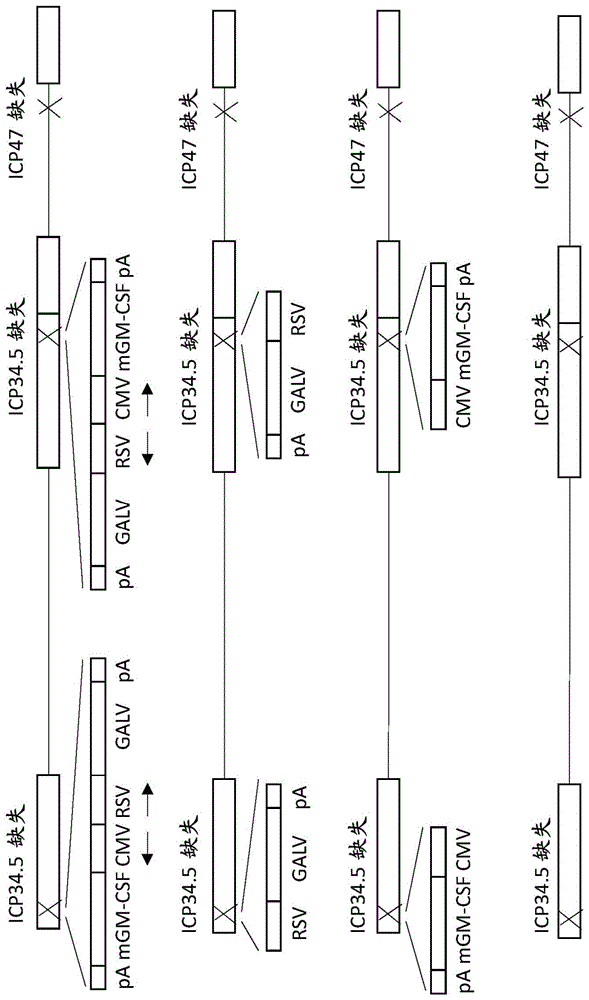
图1描绘了示例性病毒的结构,其包含插入icp34.5基因座的编码galv-r-的基因和编码gm-csf的基因,并且其中icp47基因缺失使得us11基因处在icp47立即早期启动子的控制下(上图)。图1还显示了仅表达galv-r编码基因(第二图)或仅表达gm-csf编码基因(第三图)的类似的示例性病毒。还显示了缺失icp34.5基因和icp47基因但没有任何插入基因的示例性病毒。
图2描绘了示例性病毒的结构,其包含编码galv-r-的基因、编码gm-csf的基因和编码cd40l的基因。
图3显示了如图所示以0.1、0.01或0.001的moi感染后24小时或48小时通过结晶紫染色评估的八株排名最高的hsv1临床分离株杀死fadu、sk-mel-28、a549、ht1080、mia-pa-ca-2、ht29和mda-mb-231人肿瘤细胞系的差异能力。显示了针对每个细胞系排名第一和第二的病毒株。病毒rh018a针对fadu、ht1080、mia-pa-ca-2和ht29细胞系中的每一种排名第一,针对sk-mel-28、a549和mda-mb-231细胞系中的每一种排名第二。rh004a针对ht29细胞系与rh018a和rh015a并列排在第一位,针对sk-mel-28和a549细胞系排第一,针对fadu细胞系排第二。rh023a针对mda-mb-231细胞系排名第一,针对ht1080细胞系排名第二。rh031a针对mia-pa-ca-2和ht29细胞系中的每一种排名第二。rh040a针对ht29细胞系并列排名第二。
图4显示毒株rh018a(在所有测试毒株中均排名第一的毒株)与来自筛选的“平均”毒株(即毒株rh065a)之间的比较。如在sk-mel-28、ht1080、mda-mb-231、fadu、mia-pa-ca-2和a549细胞系中以0.1、0.01和0.001的moi感染后24或48小时的结晶紫染色所示,与毒株rh065a所需的相比,杀死相同比例的细胞需要大约10倍更少的rh018a毒株。
图5描绘了通过缺失icp34.5和icp47和在icp34.5基因座中含有异源基因而修饰的hsv1病毒的结构,其中所述缺失icp34.5和icp47使得us11基因处在icp457立即早期启动子的控制下。除非图中另有说明,否则使用rh018a毒株构建病毒。
图6显示了用于检测感染病毒16(mgm-csf和galvr-)、病毒17(hgm-csf和galvr-)和病毒19(mgm-csf)的bhk细胞的上清液中人或小鼠gm-csf表达的elisa结果。
图7是其中缺失icp34.5并且表达galvr-和gfp的毒株rh018a(病毒10)与仅表达gfp的病毒(病毒12)的细胞杀伤能力之间的比较,如通过在低放大倍数下在三个细胞系中的结晶紫染色所确定的。
图8是其中icp34.5和icp47缺失并且表达galvr-和gm-csf的毒株rh018a(病毒17)与具有相同修饰的现有技术毒株的细胞杀伤能力之间的比较,如通过在四个细胞系中的结晶紫染色所确定的。
图9显示病毒16(icp34.5和icp47缺失,表达galvr-和mgm-csf)在治疗两侧腹部携带a20淋巴瘤肿瘤的小鼠中的有效性。在右侧腹部的肿瘤注射病毒或媒介物,持续30天观察对肿瘤大小的影响。该病毒对注射的肿瘤和未注射的肿瘤均有效。
图10显示了通过结晶紫染色评估的病毒15(icp34.5和icp47缺失,表达galvr-和gfp)和病毒24(icp34.5和icp47缺失,表达gfp)在体外对大鼠9l细胞的作用。与不表达galv的病毒(病毒24)相比,表达galv的病毒(病毒15)在体外显示出对大鼠9l细胞的增强的杀伤作用。
图11显示病毒16在左侧和右侧腹部中携带小鼠ct26肿瘤的balb/c小鼠中的抗肿瘤作用。然后用以下物质处理10只小鼠的组:媒介物(每隔一天向右侧腹部肿瘤注射3次);每隔一天在右侧腹部肿瘤中注射5x10exp6pfu的病毒16(mrp1);单独的抗小鼠pd1(每3天腹膜内10mg/kg,bioxcell克隆rmp1-14);抗小鼠ctla-4(每3天腹膜内3mg/kg,bioxcell克隆9d9);抗小鼠pd1和病毒16;抗小鼠ctla4与病毒16一起;1-甲基色氨酸(i-mt;ido抑制剂(饮用水中5mg/ml));抗小鼠pd1与1-甲基色氨酸一起;或抗小鼠pd1与1-甲基色氨酸和病毒16一起。持续另外30天观察对肿瘤大小的影响。在用病毒和检查点阻断组合治疗的动物中观察到比单一处理组更大的肿瘤减小。图11a显示组合使用病毒16和抗pd1比单独使用抗pd1或病毒具有更好的抗肿瘤效果。图11b显示病毒16与抗-ctla-4组合的抗肿瘤作用优于单独的病毒16或抗-ctla-4的抗肿瘤作用。图11c显示,与不存在病毒的抗pd1和1-mt抑制相比,使用病毒16以及抗pd1和ido抑制观察到增强的肿瘤减小。
图12显示与单独的病毒或单独的检查点阻断(抗-pd1)相比,病毒16与免疫检查点阻断相组合在balb/c小鼠两侧腹部的小鼠a20肿瘤中增强的抗肿瘤活性。
图13显示了表达galvr-、gm-csf和密码子优化的抗小鼠或抗人ctla-4抗体构建体(分泌的scfv分子与人或小鼠igg1fc区连接)的icp34.5和icp47缺失病毒的结构。scfv含有连接([g4s]3)的来自抗体9d9(us2011044953:小鼠形式)和伊匹单抗(ipilimumab)(us20150283234;人类形式)的轻链和重链。还显示了ctla-4抑制剂的所得结构。
图14显示病毒16和病毒19在人异种移植模型(a549)中的抗肿瘤作用。在一周内以三个不同的剂量水平(n=10/组)注射三次病毒16、病毒19或媒介物。显示了所用病毒的剂量。表达galv的病毒16的抗肿瘤作用优于不表达galv的病毒19的抗肿瘤作用。
图15显示了表达galvr-的病毒对fischer344大鼠侧腹中的9l细胞的作用。对大鼠组(每组10只)施用以下治疗,仅施用到每只大鼠的一侧腹部,每周三次,持续三周:50μl媒介物;50μl107pfu/ml病毒19(表达mgm-csf但不表达galvr-);或50μl107pfu/ml病毒16(表达小鼠gm-csf和galv-r-两者)。然后持续另外30天观察对肿瘤生长的影响。与仅表达gm-csf的病毒相比,用表达gm-csf和galv-r-的病毒观察到优异的肿瘤控制和收缩。
图16显示了表达抗mctla-4(病毒27)、mcd40l(病毒32)、mox4ol(病毒35)、m4-2bbl(病毒33)的病毒的抗肿瘤作用,与病毒16(表达galv和mgm-csf)相比,每种病毒也含有mgm-csf和galv-r-。
图17描绘了用于构建本发明的示例性病毒的病毒结构,其包含抗小鼠或抗人ctla-4构建体,所述构建体是与人或小鼠igg1fc区连接的密码子优化的分泌scfv分子。scfv包含由15-mer[g4s]3(ggggsggggsggggs)连接的来自9d9(最初用于验证ctla-4的初始小鼠抗体;wo2007/123737:小鼠形式)或来自伊匹单抗(wo2014/066532;人类形式)的轻链和重链。该病毒是hsv1rh018a毒株(临床株18)的修饰形式。icp34.5和icp47基因在病毒中失活。通过缺失icp47启动子,将us11基因置于icp47立即早期基因启动子的控制之下。将表达盒插入icp34.5基因座。在病毒17中,表达盒包括在cmv启动子控制下的人gm-csf基因和在rsv启动子控制下的galv基因。病毒16与病毒17相同,除了包括人gm-csf而不是小鼠gm-csf。病毒25和29分别与病毒16和17相同,除了它们在表达盒中各自另外地包含mmlv启动子控制下的gfp基因。病毒27和31分别与病毒25和29相同,除了gfp基因分别被小鼠抗ctla4和人抗ctla4替代。
图18描述了用于构建本发明的示例性病毒的质粒的结构。
图19显示了抗小鼠ctla-4或抗人ctla-4构建体的结构,所述构建体是与人或小鼠igg1fc区连接的密码子优化的分泌scfv分子。
图20是蛋白质印迹,证明抗小鼠ctla-4从病毒27表达。所用的凝胶是还原变性的pvdf膜tris-甘氨酸凝胶。使用碱性磷酸酶标记的抗小鼠igg1抗体检测了抗ctla-4。泳道1:光谱宽范围分子量梯度;泳道2:病毒27的纯上清液;泳道3:病毒27的上清液以1比2稀释;泳道4:病毒27的上清液以1比4稀释;泳道5:病毒27的上清液以1比8稀释;泳道6:病毒27的上清液以1比16稀释;泳道7:病毒27的上清液以1比32稀释;泳道8:阴性对照病毒(纯上清液)。抗ctla-4(还原的)的预期大小为57kda。
图21显示与不表达ctla-4的其他相同病毒(病毒16)相比,表达抗mctla-4的病毒(病毒27)的未注射肿瘤具有更好的肿瘤控制和收缩。使用的病毒剂量为5x104pfu(在每种情况下均为50ul1x106pfu/ml),一周内给予三次。对于病毒16的未注射的肿瘤,该病毒剂量水平是未达治疗剂量的,这允许清楚地看到由病毒27编码的另外的分子的递送益处。
图22显示与不表达ctla-4的其他相同病毒(病毒16)相比,表达抗mctla-4的病毒(病毒27)在注射和未注射的肿瘤中均具有优异的肿瘤控制和收缩。与不表达ctla-4的其他相同病毒(病毒16)相比,表达抗mctla-4的病毒(病毒27)在一周内向右侧肿瘤使用的病毒剂量为5x104pfu。每条线代表不同的小鼠。
图23显示了使用抗pd1和表达mgm-csf、galvr和抗mctla-4的病毒27组合治疗双侧小鼠a20肿瘤的效果。上图显示了单独的抗pd1对注射的(右)和未注射的(左)肿瘤的效果。中间的图显示单独的病毒27对注射的(右)和未注射的(左)肿瘤的效果。下图显示了当将抗pd1和病毒27都注射到右侧肿瘤中时实现优异的肿瘤控制和收缩。在注射的(右)和未注射的(左)肿瘤中均观察到组合治疗的抗肿瘤作用得到改善。每条线代表不同的小鼠。
图24显示了在表达人ctla-4的敲入小鼠中,表达hgm-csf、galvr和抗人ctla-4的病毒31与仅表达hgm-csf和galvr的病毒17相比,在小鼠mc38肿瘤中具有优异的肿瘤控制和收缩。当单独或与抗pd1组合施用病毒时,观察到病毒31的抗肿瘤作用。与不表达抗人ctla-4的其他相同病毒相比,表达抗人ctla-4的病毒31在注射的肿瘤中获得了优异的肿瘤控制和收缩(左图)。当病毒处理与抗pd1处理组合时,该效果进一步增强。当将任一病毒处理与抗pd1处理组合时,在未注射的肿瘤中也观察到了优异的肿瘤控制和收缩(右图)。表达抗ctla-4的病毒31的这种改善比不表达抗ctla-4的病毒17更显著。每条线代表不同的小鼠。
图25显示了使用表达hgm-csf、galvr和抗人ctla-4的病毒31组合抗pd1处理获得的抗肿瘤作用的持久性。a显示在通过组合治疗消除肿瘤后,在左侧肿瘤中再次攻击小鼠,并且15只小鼠中有14只被保护免受肿瘤再攻击。b显示在同一天用肿瘤细胞攻击的10只肿瘤和病毒幼稚小鼠均生长了肿瘤。c显示用单独的抗pd-1处理的小鼠没有显示抗肿瘤反应。
序列表的简要说明
seqidno:1是小鼠gm-csf的核苷酸序列。
seqidno:2是小鼠gm-csf的密码子优化形式的核苷酸序列。
seqidno:3是人gm-csf的核苷酸序列。
seqidno:4是人gm-csf的密码子优化形式的核苷酸序列。
seqidno:5是小鼠gm-csf的氨基酸序列。
seqidno:6是人gm-csf的氨基酸序列。
seqidno:7是galv-r-的核苷酸序列。
seqidno:8是galv-r-的密码子优化形式的核苷酸序列(前三个核苷酸是可选的)
seqidno:9是galv-r-的氨基酸序列。
seqidno:10是人膜结合形式的cd40l的密码子优化形式的核苷酸序列。
seqidno:11是人膜结合形式的cd40l的氨基酸序列。
seqidno:12是人cd40l的多聚体分泌形式的密码子优化形式的核苷酸序列。
seqidno:13是人cd40l的多聚体分泌形式的氨基酸序列。
seqidno:14是小鼠cd40l的多聚体分泌形式的密码子优化形式的核苷酸序列。
seqidno:15是小鼠cd40l的多聚体分泌形式的氨基酸序列。
seqidno:16是野生型人cd40l的核苷酸序列的密码子优化形式。
seqidno:17是野生型人cd40l的氨基酸序列。
seqidno:18是野生型小鼠cd40l的核苷酸序列的密码子优化形式。
seqidno:19是野生型小鼠cd40l的氨基酸序列。
seqidno:20是鼠4-1bbl的密码子优化形式的核苷酸序列。
seqidno:21是人4-1bbl的密码子优化形式的核苷酸序列。
seqidno:22是分泌的小鼠4-1bbl的密码子优化形式的核苷酸序列。
seqidno:23是人分泌的4-1bbl的密码子优化形式的核苷酸序列。
seqidno:24是鼠gitrl的密码子优化形式的核苷酸序列。
seqidno:25是人gitrl的密码子优化形式的核苷酸序列。
seqidno:26是分泌的鼠gitrl的密码子优化形式的核苷酸序列。
seqidno:27是分泌的人gitrl的密码子优化形式的核苷酸序列。
seqidno:28是鼠ox40l的密码子优化形式的核苷酸序列。
seqidno:29是人ox40l的密码子优化形式的核苷酸序列。
seqidno:30是分泌的鼠ox40l的密码子优化形式的核苷酸序列。
seqidno:31是分泌的人ox40l的密码子优化形式的核苷酸序列。
seqidno:32是鼠icosl的密码子优化形式的核苷酸序列。
seqidno:33是人icosl的密码子优化形式的核苷酸序列。
seqidno:34是鼠scfvctla-4抗体的核苷酸序列。前六个和后八个核苷酸是为克隆目的而添加的限制性位点。
seqidno:35是鼠scfvctla-4抗体的核苷酸序列。前六个和后八个核苷酸是为克隆目的而添加的限制性位点。
seqidno:36是cmv启动子的核苷酸序列。
seqidno:37是rsv启动子的核苷酸序列。
seqidno:38是bghpolya的核苷酸序列。
seqidno:39是sv40晚期polya的核苷酸序列。
seqidno:40是sv40增强子启动子的核苷酸序列。
seqidno:41是兔β-球蛋白(rbg)polya的核苷酸序列。
seqidno:42是gfp的核苷酸序列。
seqidno:43是momulvltr启动子的核苷酸序列。
seqidno:44是ef1a启动子的核苷酸序列。
seqidno:45是hghpolya的核苷酸序列。
seqidno:46是在实施例中使用的人ctla-4抗体的轻链可变区氨基酸序列。
seqidno:47是完整的轻链氨基酸序列,其包含实施例中使用的人ctla-4抗体的轻链可变区氨基酸序列。
seqidno:48是实施例中使用的人ctla-4抗体的重链可变区氨基酸序列。
seqidno:49是在实施例中使用的人ctla-4抗体的重链ch1氨基酸序列。
seqidno:50是在实施例中使用的人ctla-4抗体的重链ch2/3氨基酸序列。
seqidno:51是实施例中使用的人ctla-4抗体的完整重链氨基酸序列。
seqidno:52是在实施例的ctla-4抗体中存在的信号肽的氨基酸序列。
seqidno:53是在实施例的ctla-4抗体中的轻链可变区和重链可变区之间存在的接头的氨基酸序列。
seqidno:54是实施例的人scfvctla-4抗体的氨基酸序列。
seqidno:55是实施例的人scfvctla-4抗体的核苷酸序列。
seqidno:56是在实施例中使用的鼠ctla-4抗体的轻链可变区氨基酸序列。
seqidno:57是在实施例中使用的鼠ctla-4抗体的重链可变区氨基酸序列。
seqidno:58是在实施例中使用的鼠ctla-4抗体的完整重链氨基酸序列。
seqidno:59是实施例的鼠scfvctla-4抗体的氨基酸序列。
seqidno:60是实施例的鼠scfvctla-4抗体的核苷酸序列。
seqidno:61是具有用于克隆目的位于n末端和c末端的插入的限制性位点的实施例的鼠scfvctla-4抗体的核苷酸序列,其存在于示例性病毒中。限制性位点是序列的前六个核苷酸和后八个核苷酸。
seqidno:62是具有用于克隆目的位于n末端和c末端的插入的限制性位点的实施例的人scfvctla-4抗体的核苷酸序列,其存在于示例性病毒中。限制性位点是序列的前六个核苷酸和后八个核苷酸。
具体实施方式
发明详述
溶瘤病毒
本公开内容的病毒是溶瘤的。溶瘤病毒是在肿瘤细胞中感染和复制从而杀死肿瘤细胞的病毒。因此,本公开内容的病毒具有复制能力。优选地,病毒能够选择性地在肿瘤组织中复制。如果病毒在肿瘤组织中比在非肿瘤组织中更有效地复制,则病毒能够选择性地在肿瘤组织中复制。可以使用本领域的标准技术确定病毒在不同组织类型中复制的能力。
溶瘤作用依赖于病毒在最初感染的细胞中复制并杀死最初感染的细胞,并且后代病毒体继续感染并杀死其他肿瘤细胞,因此在肿瘤内扩散。因此,本公开内容的病毒有效杀死肿瘤细胞并在肿瘤内扩散的能力导致最佳的直接抗肿瘤作用。与肿瘤细胞裂解相关的有效扩散和病毒复制也使肿瘤抗原释放的量最大化,因此也最大化诱导的抗肿瘤免疫应答的效力。
本公开内容的病毒可以是具有这些特性的任何病毒,包括疱疹病毒、痘病毒、腺病毒、逆转录病毒、弹状病毒、副粘病毒或呼肠孤病毒、或这些较大组内的任何物种或毒株。本公开内容的病毒可以是野生型(即,不由亲本病毒物种改变),或者具有基因破坏或基因添加。具体是这些情况中的哪一个将取决于要使用的病毒物种。优选地,病毒是疱疹病毒物种,更优选是hsv的毒株,包括hsv1和hsv2的毒株,并且最优选是hsv1的毒株。在特别优选的实施方案中,本公开内容的病毒基于待使用的病毒物种的临床分离株。可以基于其具有用于治疗癌症的特别有利特性来选择临床分离株。
与从其他患者分离的相同病毒的其他毒株相比,本公开内容的临床分离株/病毒具有令人惊讶的良好抗肿瘤效果,其中患者是携带待测试病毒物种的个体。用于比较以鉴定本公开内容的病毒的病毒株可以从患者或其他健康的(即,不携带待测试的病毒物种)志愿者分离,优选从其他健康志愿者中分离。用于鉴定本公开内容的病毒的hsv1毒株通常从携带hsv1的个体的唇疱疹中分离,通常通过使用例如virocult(sigma)品牌拭子/包含运输介质的容器擦拭,然后运输到机构用于进一步测试。
在从个体分离要比较的病毒后,通常制备病毒原种,例如通过在bhk或vero细胞上培养分离的病毒而制备。优选地,这是在取样和在例如bhk或vero细胞上生长之间不超过3个循环的冻融之后进行的,以制备病毒原种以供进一步使用。更优选地,病毒样品在制备用于进一步使用的原种之前经历2次或少于2次的冻融循环,更优选一次冻融循环,最优选没有冻融循环。比较用分离后以这种方式制备的病毒感染的细胞系的裂解物,通常通过测试病毒在体外杀死肿瘤细胞系的能力进行比较。备选地,可以在测试之前将病毒原种储存在合适的条件下,例如通过冷冻。与从其他个体分离的相同病毒的其他毒株相比,优选与从>5个个体、更优选>10个其他个体、最优选>20个其他个体分离的那些毒株相比时,本公开内容的病毒可具有令人惊讶的良好抗肿瘤效果。
在修饰之前或之后,鉴定为本公开内容的病毒或用于修饰以产生本公开内容的病毒(即,与它们所比较的其他病毒株相比具有令人惊讶的良好杀伤肿瘤细胞的性质)的临床分离株的原种可以在合适的条件下储存,并适当地用于生成其他原种。
临床分离株是从其天然宿主中分离的病毒物种的毒株。优选分离临床分离株,用于测试和比较临床分离株与该病毒物种的其他临床分离株的所需性质,在本公开内容的病毒的情况下,其具有杀死人肿瘤细胞的能力。可用于比较的临床分离株还包括来自临床试验库中存在的临床样品的那些,即先前为临床诊断或其他目的而收集的临床分离株。在任一种情况下,用于比较和鉴定本公开内容病毒的临床分离株优选在测试所需性质之前在体外经历最小程度的培养,优选仅经历足够的培养以允许产生足够的原种用于比较测试目的。因此,用于比较以鉴定本公开内容病毒的病毒还可包括保藏的毒株,其中保藏的毒株已从患者分离,优选为从患者唇疱疹中分离的hsv1毒株。
本公开内容的病毒可以是溶瘤病毒,其是临床分离株或衍生自临床分离株,所述临床分离株是通过下述选择的:比较相同病毒物种的一组三株或更多株临床分离株在体外杀死两种或更多种肿瘤细胞系的肿瘤细胞的能力,并选择一株临床分离株,所述临床分离株能够比所述组中的一株或多株其他临床分离株更快地和/或以更低的剂量在体外杀死两种或更多种肿瘤细胞系的细胞。因此,所述病毒可以是临床分离株,其与相同病毒物种的一株或多株参考临床分离株相比,更快地和/或以更低的剂量在体外杀死两种或更多种肿瘤细胞系,或者可以是此类临床分离株的修饰形式。修饰的临床分离株通常保留与临床分离株基本相同的肿瘤细胞杀伤活性,但是表达如本文公开的一种或多种异源基因以改善其抗肿瘤特性和/或缺失一种或多种病毒基因以改善其对肿瘤细胞的选择性。
通常,本公开内容临床分离株将以小于或等于0.1的感染复数(moi)、优选小于或等于0.01的moi、更优选小于或等于0.001的moi感染的72小时内,优选在48小时内,更优选在24小时内杀死两种或更多种肿瘤细胞系。优选地,临床分离株将杀死广泛的肿瘤细胞系,例如以下人肿瘤细胞系中的2、3、4、5、6、7、8、9、10种或例如全部:u87mg(神经胶质瘤)、ht29(结肠直肠癌)、lncap(前列腺癌)、mda-mb-231(乳腺癌)、sk-mel-28(黑色素瘤)、fadu(鳞状细胞癌)、mcf7(乳腺癌)、a549(肺癌)、miapaca-2(胰腺癌)、capan-1(胰腺癌)、ht1080(纤维肉瘤)。
因此,本公开内容的病毒可能能够杀死两种或更多种细胞,例如3、4、5、6、7种或更多种不同类型的肿瘤,例如两种或更多种,例如3、4、5、6、7种或更多种实体瘤,包括但不限于:结肠直肠肿瘤细胞,前列腺肿瘤细胞,乳腺肿瘤细胞,卵巢肿瘤细胞,黑色素瘤细胞,鳞状细胞癌细胞,肺肿瘤细胞,胰腺肿瘤细胞,肉瘤细胞和/或纤维肉瘤细胞。
可以通过任何合适的方法确定肿瘤细胞系杀伤。通常,首先从患者中分离样品,优选地,在hsv1的情况下,从唇疱疹中分离样品,用于感染bhk细胞或另一种合适的细胞系,例如vero细胞。通常通过感染后24-72小时(例如感染后48小时)存在细胞病变效应(cpe)来鉴定阳性样品,并通过例如免疫组织化学或pcr确认其为靶病毒物种。然后从阳性样品中产生病毒原种。通常测试来自病毒原种的样品,并与使用来自不同患者的拭子以相同方式产生的其他样品进行比较。可以通过确定以一系列感染复数(moi)和在感染后不同时间达到的cpe水平来进行测试。
例如,80%汇合的细胞系可以用病毒样品以moi为1、0.1、0.01和0.001进行感染,并且板一式两份在37℃、5%co2下孵育24和48小时,然后测定病毒细胞杀伤程度。这可以通过例如用戊二醛固定细胞并用标准方法用结晶紫染色来测定。然后可以通过标准方法评估细胞裂解水平,所述标准方法例如粗略观察、显微镜检查(细胞计数)和摄影。可以用在测定细胞杀伤之前孵育更短的时间段,例如8、12或16小时,或更长的时间段,例如72小时,或以如0.0001或更低的另外的moi孵育的细胞,重复该方法。
还可以进行生长曲线实验以评估不同临床分离株在体外肿瘤细胞系中复制的能力。例如,80%汇合的细胞系可以用病毒样品以moi为1、0.1、0.01和0.001进行感染,在37℃,5%co2孵育,在感染后0、8、16、24和48小时,通常通过冷冻/解冻裂解细胞,然后测定病毒细胞杀伤的程度。这可以通过例如通过标准空斑测定评估病毒滴度来确定。
本公开内容的临床分离株可以比与其进行比较的其他临床分离株(优选相同的病毒物种的2、3、4、5或10或更多株其他临床分离株)更快速地和/或以更低的moi杀死感染的肿瘤细胞系。与同本公开内容的临床分离株相比较的相同病毒物种的至少一株、优选2、3、4、5或10或更多株其他临床分离株以相同moi和在相同时间点相比,本发明的临床分离株以特定moi和在特定时间点通常杀死10%、25%或50%更大比例的存在的肿瘤细胞。本发明的临床分离株通常杀死相同或更大比例的肿瘤细胞,其moi为用于比较的相同病毒物种的一株或多株、优选2、3、4、5、10或15或更多株其他临床分离株在相同时间点(通常在12、24和/或48小时)杀死相同比例的肿瘤细胞的moi的一半或小于该moi的一半。优选地,本公开内容的临床分离株通常杀死相同或更大比例的肿瘤细胞,其moi比用于比较的相同病毒的一株或多株、优选2、3、4、5、10或15或更多株其他临床分离株在相同时间点(通常在12、24和/或48小时)杀死相同比例的肿瘤细胞的moi低5倍或10倍。与用于比较的相同病毒物种的其他临床分离株的至少50%、75%或90%相比,通常实现本公开内容病毒的改善的肿瘤细胞杀伤能力。优选将病毒与至少4株其他病毒株进行比较,例如,与相同物种的7、9、19、39或49株其他病毒株进行比较。
分离的毒株可以分批测试,例如一次4-8株病毒株针对例如一次4-8种肿瘤细胞系测试。对于每批实验,对在该实验中比较的病毒,实现的杀伤程度针对每个细胞系排列为最佳(即每个时间点/moi的最少存活细胞)至最差(即每个时间点/moi的最多存活细胞)。然后可以将来自每个实验的在所测试的肿瘤细胞系范围内表现最佳的病毒株(即,一致地被列为杀死细胞系的最佳之一)在使用其他临床分离株和/或在其他肿瘤细胞系的进一步实验中进行头对头比较,以鉴定所取样的全部病毒株(例如,>20株病毒株)中的最佳病毒株。整体排名最高的那些是本公开内容的病毒。
在优选的实施方案中,本公开内容的病毒是选自以下的毒株:
毒株rh018a,其具有保藏号ecacc16121904;
毒株rh004a,其具有保藏号ecacc16121902;
毒株rh031a,其具有保藏号ecacc16121907;
毒株rh040b,其具有保藏号ecacc16121908;
毒株rh015a,其具有保藏号ecacc16121903;
毒株rh021a,其具有保藏号ecacc16121905;
毒株rh023a,其具有保藏号ecacc16121906;和
毒株rh047a,其具有保藏号ecacc16121909。
更优选地,本公开的病毒是选自以下的毒株:
毒株rh018a,其具有保藏号ecacc16121904;
毒株rh004a,其具有保藏号ecacc16121902;
毒株rh031a,其具有保藏号ecacc16121907;
毒株rh040b,其具有保藏号ecacc16121908;和
毒株rh015a,其具有保藏号ecacc16121903;
最优选地,本公开内容的病毒是毒株rh018a,其具有保藏号ecacc16121904。任何保藏的毒株都可以如本文所定义的进行修饰。
本公开内容的hsv能够选择性地在肿瘤(例如人肿瘤)中复制。通常,hsv在靶肿瘤中有效复制,但在非肿瘤组织中不能有效复制。该hsv可包含在一种或多种病毒基因中的一种或多种突变,所述突变抑制在正常组织中的复制但仍允许在肿瘤中复制。例如,突变可以是阻止hsv表达功能性icp34.5、icp6和/或胸苷激酶的突变。
在一个优选的实施方案中,突变icp34.5编码基因以赋予hsv选择性的溶瘤活性。阻止功能性icp34.5表达的icp34.5编码基因的突变记载在chou等人(1990)science250:1262-1266,maclean等人(1991)j.gen.virol.72:631-639和liu等人(2003)genetherapy10:292-303中,它们通过引用并入本文。也可以使icp6编码基因和/或胸苷激酶编码基因失活,也可以使其他基因失活,条件是这种失活不会阻止病毒在肿瘤中感染或复制。
hsv可以含有另外的一种或多种增强hsv在肿瘤中复制的突变。由此导致的肿瘤中病毒复制的增强不仅导致病毒改善的直接“溶瘤性”肿瘤细胞的杀伤,而且还增强了异源基因(即插入病毒的基因,例如编码一种或多种促融合蛋白、免疫调节分子(例如gm-csf)或一种或多种免疫共刺激途径激活分子的基因和/或编码ctla-4抑制剂的基因)表达的水平,并增加肿瘤细胞死亡时释放的肿瘤抗原的量,这两者也可以改善治疗癌症的疗法的免疫原性。例如,在本公开内容的一个优选的实施方案中,以使us11基因置于通常控制icp47编码基因表达的立即早期启动子控制下的方式缺失icp47编码基因导致在肿瘤中增强的复制(参见liu等人,2003,其通过引用并入本文)。
也可以在本公开内容的病毒中引入使us11编码序列(其为hsv晚期基因)置于不依赖于病毒复制的启动子控制下的其他突变。此类突变允许在hsv复制发生之前表达us11并增强肿瘤中的病毒复制。特别地,此类突变增强了缺失功能性icp34.5编码基因的hsv的复制。
因此,在一个实施方案中,本公开内容的hsv包含与启动子可操作地连接的us11基因,其中启动子的活性不依赖于病毒复制。启动子可以是立即早期(ie)启动子或是在哺乳动物(优选人)肿瘤细胞中有活性的非hsv启动子。启动子可以是,例如,真核启动子,例如衍生自哺乳动物(优选人)的基因组的启动子。启动子可以是普遍存在的启动子(例如β-肌动蛋白或微管蛋白的启动子)或细胞特异性启动子,例如肿瘤特异性启动子。启动子可以是病毒启动子,例如莫洛尼鼠白血病病毒长末端重复序列(mmlvltr)启动子或者人或小鼠巨细胞病毒(cmv)ie启动子。hsv立即早期(ie)启动子在本领域中是众所周知的。hsvie启动子可以是驱动icp0、icp4、icp22、icp27或icp47表达的启动子。
上述基因,其功能失活可以为病毒提供肿瘤选择性的特性,可以通过任何合适的方法使其功能失活,例如通过缺失或取代所述基因和/或所述基因的控制序列的全部或部分、或通过将一个或多个核酸插入所述基因和/或所述基因的控制序列中或代替所述基因和/或所述基因的控制序列使所述基因功能失活。例如,本领域标准的同源重组方法可用于产生本公开内容的病毒。备选地,可以使用基于细菌人工染色体(bac)的方法。
如本文所用,术语“基因”意指编码蛋白质的核苷酸序列,即基因的编码序列。通过突变基因本身或基因侧翼的控制序列,例如启动子序列,可以使上述各种基因成为没有功能的。缺失可以去除基因的一个或多个部分、整个基因或整个基因以及所有或一些控制序列。例如,可以仅缺失基因内的一个核苷酸,导致移码。然而,可以进行更大的缺失,例如总编码和/或非编码序列的至少约25%,更优选至少约50%。在一个优选的实施方案中,缺失要被功能失活的基因。例如,可以从病毒中去除整个基因和任选的一些侧翼序列。当病毒基因组中存在两个或更多个基因拷贝时,使基因的两个拷贝都功能失活。
可以通过取代其他序列使基因失活,例如通过用异源基因和任选的启动子序列取代全部或部分内源基因使基因失活。在没有启动子序列被取代的情况下,可插入异源基因,使所述异源基因受失去功能的基因的启动子控制。在本公开内容的hsv中,优选通过在每个icp34.5编码基因的基因座中插入一种或多种异源基因和与其可操作地连接的一种或多种启动子序列和任选的其他调节元件(例如多腺苷酸化序列)使icp34.5编码基因失去功能。
本公开内容的病毒可用于在肿瘤中表达促融合蛋白和/或免疫刺激蛋白。本公开内容的病毒用于在肿瘤中表达gm-csf和免疫共刺激途径激活分子。本公开内容的病毒可以用于在肿瘤中表达ctla-4抑制剂和任选的gm-csf、促融合蛋白和/或免疫刺激蛋白。这通常是通过在具有选择性复制能力的病毒的基因组中插入编码促融合蛋白的异源基因和/或编码免疫刺激蛋白的异源基因来实现的。这通常是通过在具有选择性复制能力的病毒的基因组中插入编码gm-csf的异源基因和编码免疫共刺激途径激活分子的异源基因来实现的。这通常是通过在具有选择性复制能力的病毒的基因组中插入编码ctla-4抑制剂的异源基因、以及任选地编码gm-csf的异源基因和/或编码免疫共刺激途径激活分子的异源基因来实现的。每个基因在启动子序列的控制下。由于这种病毒的复制将选择性地在肿瘤组织中发生,因此与身体的非肿瘤组织相比,病毒对异源基因编码的蛋白质的表达也得以增强。与身体的其他组织相比,在肿瘤中的表达更高时发生增强的表达。由溶瘤病毒表达的蛋白质也预期会存在于溶瘤病毒感染的肿瘤引流淋巴结中,包括由于表达的蛋白和病毒在来自肿瘤的抗原呈递细胞内和细胞上的运输。因此,本公开内容提供了促融合蛋白和/或免疫刺激蛋白在肿瘤中选择性表达结合由溶瘤病毒复制提供的抗肿瘤作用的益处。因此,本公开内容提供了gm-csf和免疫共刺激途径活化分子在肿瘤和肿瘤引流淋巴结中选择性表达结合由溶瘤病毒复制提供的抗肿瘤作用的益处。因此,本公开内容提供了gm-csf和免疫共刺激途径激活分子在肿瘤和肿瘤引流淋巴结中选择性表达结合溶瘤病毒复制提供的抗肿瘤作用的益处。
除促融合蛋白和免疫刺激蛋白外,本公开内容的病毒可包含一种或多种其他异源基因,包括其他促融合蛋白或免疫刺激蛋白。
本公开内容的病毒包含gm-csf。可以对编码异源蛋白质的基因(例如编码gm-csf的基因)的序列进行密码子优化,以与如果使用未经改变的序列相比,增加相应蛋白在靶细胞中的表达水平。
促融合蛋白
本公开内容的病毒可以包含编码促融合蛋白的基因。促融合蛋白可以是能够促进被本发明病毒感染的细胞与另一细胞融合的任何异源蛋白。促融合蛋白,优选野生型或修饰的病毒糖蛋白(即,经过修饰以增加其促融合特性),是能够诱导其中表达所述促融合蛋白的细胞中细胞与细胞融合(合胞体(syncitia)形成)的蛋白质。促融合糖蛋白的实例包括:vsv-g,合胞蛋白(syncitin)-1(来自人内源性逆转录病毒-w(herv-w))或合胞蛋白-2(来自hervfrde1),副粘病毒sv5-f,麻疹病毒-h,麻疹病毒-f,rsv-f,来自逆转录病毒或慢病毒(例如长臂猿白血病病毒(galv)、鼠白血病病毒(mlv)、mason-pfizer猴病毒(mpmv)和马传染性贫血病毒(eiav))的糖蛋白,其中r跨膜肽被去除(r-形式)。在一个优选的实施方案中,促融合蛋白来自galv并且去除了r-肽(galv-r-)。
本公开内容的病毒可包含多个拷贝,优选1或2个拷贝的促融合蛋白编码基因。病毒可包含两种或更多种不同的促融合蛋白,包括上文列出的任何促融合蛋白。
由本公开内容的病毒表达的一种或多种促融合蛋白可以与天然存在的蛋白质相同,或者可以是经修饰的蛋白质。
促融合蛋白编码基因(促融合基因)可以具有天然存在的核酸序列或修饰的序列。例如,可以修饰促融合基因的序列以增加所编码的蛋白质的促融合特性,或提供密码子优化并因此提高所编码的蛋白质的表达效率。
免疫刺激分子
本公开内容的病毒可以包含一种或多种免疫刺激分子和/或一种或多种编码免疫刺激分子的基因,例如免疫共刺激通路激活分子。免疫刺激分子包括可以帮助诱导免疫应答的蛋白质,可以减轻针对免疫应答诱导或有效性的抑制信号的蛋白质和抑制免疫抑制分子表达的rna分子(例如shrna、反义rna、rnai或微小rna)。免疫共刺激途径激活分子包括蛋白质和核酸分子(例如适配体序列)。
免疫刺激分子的实例包括:il-2,il12,il-15,il-18,il-21,il-24,cd40配体,gitr配体,4-1-bb配体,ox40配体,icos配体,flt3配体,tl1a,cd30配体,cd70,i型干扰素,包括干扰素α和干扰素β,干扰素γ,iii型干扰素(il-28、il-29),其他细胞因子如tnfα或gm-csf、tgfβ或免疫检查点拮抗剂。免疫检查点拮抗剂包括抗体,靶向这些分子(cd40、gitr、4-1-bb、ox40、icos、flt3、dr3、cd30、cd27)各自的受体的单链抗体和rna1/sirna/微小rna/反义rna敲低方法。cd40l、gitrl、4-1-bbl、ox40l、icosl、ft3l、tl1a、cd30l或cd70l可以是其任何修饰形式,例如可溶性形式。
免疫增强/共刺激途径的激动剂包括突变型或野生型、可溶性、分泌性和/或膜结合的配体,以及包括单链抗体的激动性抗体。关于免疫共抑制或免疫共刺激途径的靶向,特别优选靶向下述的蛋白或其他分子(依据情形为激动性的或拮抗性的):ctla-4(拮抗剂),pd-1(拮抗剂),pd-l1(拮抗剂),lag-3(拮抗剂),tim-3(拮抗剂),vista(拮抗剂),csf1r(拮抗剂),ido(拮抗剂),ceacam1(拮抗剂),gitr(激动剂),4-1-bb(激动剂),kir(拮抗剂),slamf7(拮抗剂),ox40(激动剂),cd40(激动剂),icos(激动剂)或cd47(拮抗剂)。因此,本发明的病毒优选编码这些分子中的一种或多种。更优选地,本公开内容的病毒编码gm-csf和/或野生型或修饰形式的cd40l、icosl、4-1-bbl、gitrl或ox40l,最优选gm-csf。
共抑制途径的抑制剂可以是ctla-4抑制剂。ctla-4抑制剂通常是结合ctla-4并减少或阻断通过ctla-4的信号传导(例如通过减少经由b7的活化)的分子,例如肽或蛋白质。通过减少ctla-4信号传导,该抑制剂减少或消除ctla-4对免疫刺激途径的阻断。
ctla-4抑制剂优选为抗体或其抗原结合片段。
本文提及的术语“抗体”包括完整抗体和任何抗原结合片段(即“抗原结合部分”)或其单链。抗体是指包含通过二硫键相互连接的至少两条重(h)链和两条轻(κ)(l)链的糖蛋白,或其抗原结合部分。每条重链由重链可变区(本文中缩写为vh)和重链恒定区组成。每条轻链由轻链可变区(本文中缩写为vl)和轻链恒定区组成。重链和轻链的可变区含有与抗原相互作用的结合结构域。vh和vl区可以进一步细分为称为互补决定区(cdr)的高变区,散布有称为框架区(fr)的更保守的区域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的各种细胞(例如效应细胞)和经典补体系统的第一组分(c1q)。
抗体通常是单克隆抗体。抗体可以是嵌合抗体。抗体优选为人源化抗体,更优选为人抗体。
术语抗体的“抗原结合片段”是指抗体的一个或多个保留特异性结合ctla-4的能力的片段。抗原结合片段还保留抑制ctla-4的能力,从而减少或消除刺激性免疫应答的ctla-4阻断。合适片段的实例包括fab片段、f(ab')2片段、fab'片段、fd片段、fv片段、dab片段和分离的互补决定区(cdr)。单链抗体如scfv和重链抗体如vhh和骆驼抗体也包括在术语抗体的“抗原结合部分”内。在优选的实施方案中,抗体是scfv。合适的scfv分子的实例公开于例如wo2007/123737和wo2014/066532中,其通过引用并入本文。scfv可以由seqidno:34中所示的核苷酸序列、seqidno:35中所示的核苷酸序列编码。
抗体编码序列通常编码具有n末端信号序列的抗体或抗体片段。所述信号序列可以具有seqidno:52所示的氨基酸序列。例如,该信号序列被包括在具有seqidno:54所示的氨基酸序列并由seqidno:55所示的核苷酸序列编码的scfv中,以及被包括在具有seqidno:59所示氨基酸序列并由seqidno:60所示的核苷酸序列编码的scfv中。
在抗体或抗体片段中,轻链和重链序列可以通过氨基酸接头连接。所述接头通常包含约15至约25个氨基酸,例如约18或20个氨基酸。可以使用任何合适的接头,例如包含甘氨酸和丝氨酸残基的接头,例如seqidno:53所示的氨基酸序列。例如,该接头被包括在具有seqidno:54所示的氨基酸序列并由seqidno:55所示的核苷酸序列编码的scfv中,以及被包括在具有seqidno:59所示的氨基酸序列并由seqidno:60所示的核苷酸序列编码的scfv中。两者都是优选的抗体片段。
具有相似结构的其他抗体片段也是优选的。因此,所述病毒的抗体或片段包含或基本上由轻链可变区、接头、重链可变区、重链ch1结构域、重链ch2结构域和重链ch3结构域组成。病毒可以进一步在抗体的n端编码信号序列。
抗体或抗体片段可以包含fc区,其是igg1、igg2、igg3或igg4区,igg1区。优选地,抗体是scfv抗体,其中所述scfv连接至igg重链ch2和ch3结构域。
优选的ctla-4抗体或片段包含seqidno:48所示的重链可变区和/或seqidno:46所示的轻链可变区或seqidno:56所示的重链可变区和/或seqidno:57所示的轻链可变区。抗体可包含具有seqidno:4所示的氨基酸序列的重链ch1结构域和/或seqidno:50所示的ch2/ch3结构域。抗体可包含seqidno:47所示的轻链氨基酸序列。抗体可备选地包含这些重链或轻链可变区或cdr序列中之一的变体。例如,变体可以是任何上述氨基酸序列的取代、缺失或添加变体。
变体抗体可包括从上面讨论的特定序列和片段中取代和/或缺失1、2、3、4、5、多至10、多至20、多至30个或更多个氨基酸,而同时保持本文所述的抗体的活性。“缺失”变体可包括例如1、2、3、4或5个单个氨基酸的缺失或一个或多个小的氨基酸组例如2、3、4或5个氨基酸的缺失。“取代”变体优选涉及用相同数目的氨基酸替代一个或多个氨基酸并进行保守的氨基酸取代。例如,氨基酸可以被具有相似特性的替代氨基酸取代,例如,另一种碱性氨基酸,另一种酸性氨基酸,另一种中性氨基酸,另一种带电荷氨基酸,另一种亲水性氨基酸,另一种疏水性氨基酸,另一种极性氨基酸,另一种芳香族氨基酸或另一种脂肪族氨基酸。
本公开内容的病毒包含一种或多种编码ctla-4抑制剂的多核苷酸序列。所述多核苷酸序列在合适的启动子的控制下。所述病毒可以包含编码抗体重链可变区的第一多核苷酸序列和编码抗体轻链可变区的第二多核苷酸。第一多核苷酸可编码全长重链和/或第二多核苷酸可编码全长轻链。第一和第二多核苷酸可以在单个启动子的控制下,任选地具有ires,或者可以在两个分开的启动子的控制下。分开的启动子可以相同或不同。
第一多核苷酸可包含、基本上由或由seqidno:54所示的重链可变区编码序列组成,和/或第二多核苷酸可包含、基本上由或由seqidno:55所示的重链可变区编码序列组成。第一多核苷酸可包含、基本上由或由seqidno:2所示的重链可变区编码序列组成,和/或第二多核苷酸可包含、基本上由或由seqidno:3所示的重链可变区编码序列组成。
第一和/或第二多核苷酸序列可以是seqidno:54、55、2或3的变体。例如,变体可以是这些核酸序列中任一个的取代、缺失或添加变体。变体多核苷酸可包含1、2、3、4、5、多至10、多至20、多至30、多至40、多至50、多至75个或更多个的核酸取代和/或从seqidno:54、55、2或3的缺失。
合适的变体可以与本文公开的任何一种核酸序列的多核苷酸至少70%同源,优选与其至少80或90%同源,以及更优选至少95%、97%或99%同源。优选地,至少相对于多核苷酸的编码区,在这些水平上存在的同源性和同一性。测量同源性的方法是本领域众所周知的,并且本领域技术人员将理解,在本文中,基于核酸同一性计算同源性。这种同源性可存在于至少15个,优选至少30个,例如至少40、60、100、200个或更多个连续核苷酸的区域上。这种同源性可存在于未修饰的多核苷酸序列的整个长度上。
本领域已知测量多核苷酸同源性或同一性的方法。例如,uwgcg包提供了可用于计算同源性的bestfit程序(例如,在其默认设置下使用)(devereux等人(1984年)nucleicacidsresearch12,第387页-第395页)。
pileup和blast算法也可用于计算同源序列或排列序列(通常在其默认设置下使用),例如,如altschuls.f.(1993)jmolevol36:290-300;altschul,s,f等人(1990)jmolbiol215:403-10中所述的。
用于执行blast分析的软件可通过美国国家生物技术信息中心公开提供(http://www.ncbi.nlm.nih.gov/)。该算法涉及首先通过识别查询序列中长度为w的短字符(word)来识别高分序列对(hsp),其与数据库序列中相同长度的字符对齐时匹配或满足某个正值阈值得分t。t被称为相邻字符分数阈值(altschul等人,同上)。这些最初的相邻字符命中充当启动搜索以查找包含它们的hsp的种子。字符命中沿着每个序列在两个方向上扩展,直到可以增加累积比对得分为止。在以下情况下,将停止在每个方向上字符命中的扩展:由于一个或多个负得分残基比对的累积,累积比对得分变为零或更低;或到达任一序列的末尾。blast算法参数w、t和x确定比对的灵敏度和速度。blast程序默认使用字长(w)为11、blosum62得分矩阵(参见henikoff和henikoff(1992)proc.natl.acad.sci.usa89:10915-10919)对齐(b)为50,期望(e)为10,m=5,n=4,并比较两条链。
blast算法对两个序列之间的相似性进行统计分析;参见,例如,karlin和altschul(1993)proc.natl.acad.sci.usa90:5873-5787。blast算法提供的一个相似性度量是最小和概率(p(n)),它提供了表示两个核苷酸或氨基酸序列之间偶然发生匹配的概率。例如,如果将第一序列与第二序列比较的最小和概率小于约1,优选小于约0.1,更优选小于约0.01,以及最优选小于约0.001,则认为序列与另一序列相似。
在一个实施方案中,由于遗传密码的冗余性,变体序列可以不同于序列表中给出的特定序列。dna密码具有4个主要的核酸残基(a、t、c和g),并使用它们来“拼写”三个字母的密码子,这些密码子代表了生物体基因中编码的蛋白质的氨基酸。沿着dna分子的密码子线性序列被翻译成这些基因编码的一个或多个蛋白质中氨基酸的线性序列。该编码高度简并,其中61个密码子编码20个天然氨基酸,以及3个密码子代表“终止”信号。因此,大多数氨基酸由一个以上的密码子编码——事实上,几种氨基酸由四个或更多个不同的密码子编码。因此,本发明的变体多核苷酸可以与本发明的另一多核苷酸编码相同的多肽序列,但是由于使用不同的密码子来编码相同的氨基酸而可以具有不同的核酸序列。可以对密码子进行优化,以与如果使用未经改变的序列相比,增加编码的蛋白在靶细胞中的表达水平。
本公开内容的病毒优选包含gm-csf。可以对编码gm-csf的基因的序列进行密码子优化,以与如果使用未经改变的序列相比,增加靶细胞中相应蛋白质的表达水平。
本公开内容的病毒优选包含一种或多种免疫共刺激途径激活分子和/或一种或多种编码免疫共刺激途径激活分子的基因。免疫共刺激途径激活分子包括蛋白质和核酸分子(例如适配体序列)。免疫共刺激途径激活分子的实例包括cd40配体、gitr配体、4-1-bb配体、ox40配体、icos配体、flt3配体、tl1a、cd30配体、cd70和靶向这些分子(cd40、gitr、4-1-bb、ox40、icos、flt3、dr3、cd30、cd27)的相应受体的单链抗体。
免疫共刺激途径的激活剂包括突变型或野生型、可溶性、分泌性和/或膜结合的配体,以及包括单链抗体的激动性抗体。本公开内容的病毒优选编码cd40l、icosl、4-1-bbl、gitrl或ox40l中的一种或多种。
本公开内容的病毒可编码一种或多种免疫刺激分子,优选1、2、3或4种免疫刺激分子,更优选1或2种免疫刺激分子。
本公开内容的病毒可编码一种或多种免疫共刺激途径激活分子,优选1、2、3或4种免疫共刺激途径激活分子,更优选1或2种免疫共刺激途径激活分子。
例如,病毒可包含编码以下的基因:
-cd40l以及icosl、4-1-bbl、gitrl、ox40l和ctla-4抑制剂中的一种或多种;
-icosl以及cd40l、4-1-bbl、gitrl、ox40l和ctla-4抑制剂中的一种或多种;
-4-1-bbl以及cd40l、icosl、gitrl、ox40l和ctla-4抑制剂中的一种或多种;
-gitrl以及cd40l、icosl、4-1-bbl、ox40l和ctla-4抑制剂中的一种或多种;
-ox40l以及cd40l、icosl、4-1-bbl、gitrl和ctla-4抑制剂中的一种或多种;
-ctla-4抑制剂以及cd40l、icosl、4-1-bbl、gitrl和ox40l中的一种或多种。
可以对编码免疫刺激分子(例如免疫共刺激激活分子)的基因的序列进行密码子优化,以与如果使用未经改变的序列相比,增加靶细胞中相应的中的一种或多种蛋白质的表达水平。
在一些实施方案中,本公开内容的病毒可以包含除gm-csf和/或免疫共刺激途径激活分子和/或ctla-4抑制剂之外的一种或多种其他异源基因。在一个优选的实施方案中,病毒可以进一步包含促融合蛋白,例如galvr-。
促融合蛋白可以是能够促进被本公开内容的病毒感染的细胞与另一细胞融合的任何异源蛋白。促融合蛋白,优选为野生型或经修饰的病毒糖蛋白(即,经修饰以增加其促融合特性),是一种能够诱导其中表达它的细胞中细胞与细胞融合(合胞体形成)的蛋白。促融合糖蛋白的实例包括:vsv-g,合胞蛋白-1(来自人内源性逆转录病毒-w(herv-w))或合胞蛋白-2(来自hervfrde1),副粘病毒sv5-f,麻疹病毒-h,麻疹病毒-f,rsv-f,来自逆转录病毒或慢病毒(例如长臂猿白血病病毒(galv)、鼠白血病病毒(mlv)、mason-pfizer猴病毒(mpmv)和马传染性贫血病毒(eiav))的糖蛋白,其中r跨膜肽被去除(r-形式)。在一个优选的实施方案中,促融合蛋白来自galv并且去除了r-肽(galv-r-)。
本公开内容的病毒可任选地包含多个拷贝、优选1或2个拷贝的促融合蛋白编码基因。病毒可以包含两种或多种不同的促融合蛋白,包括上文列出的任何促融合蛋白。
由本公开内容的病毒任选地表达的一种或多种促融合蛋白可以与天然存在的蛋白质相同,或者可以是经修饰的蛋白质。
促融合蛋白编码基因(促融合基因)可以具有天然存在的核酸序列或经修饰的序列。例如,可以对促融合基因的序列进行修饰以增加所编码的蛋白质的促融合特性,或提供密码子优化,从而提高编码蛋白的表达效率。
病毒株的修饰
本公开内容的经修饰的病毒是病毒的修饰形式,例如与用于比较的其他病毒株相比,被鉴定为具有杀死肿瘤细胞的有利特性的临床分离株的修饰形式。使用本领域众所周知的方法构建本公开内容的经修饰的病毒。例如,编码待包装的病毒基因组的质粒(用于较小的病毒和单个和多个基因组组分rna病毒)或bac(用于较大的dna病毒,包括疱疹病毒),包括在适当的调节控制下编码所希望的异源基因(例如编码促融合和/或免疫刺激分子的基因)的任何基因,可以通过标准分子生物学技术构建并转染到允许细胞中,从中可以回收重组病毒。
备选地,在一个优选的实施方案中,可构建含有位于预期插入位点侧翼的dna区域的质粒,以及然后与病毒基因组dna共转染到允许细胞中,从而发生在质粒中靶向插入位点侧翼区域与亲本病毒(例如亲本临床分离株)相同区域之间的同源重组。然后可以通过丢失或添加由用于修饰的质粒插入或缺失的功能来选择和纯化重组病毒,例如,在亲本病毒预期的插入位点插入或缺失标记基因(例如gfp或lacz)。在最优选的实施方案中,插入位点是hsv的icp34.5基因座,因此用于操作的质粒含有位于该插入位点侧翼的hsv序列,其间是编码至少一种异源蛋白(诸如,例如,促融合蛋白和免疫刺激分子或gm-csf和免疫共刺激途径激活分子,和/或ctla-4抑制剂)的表达盒。在这种情况下,亲本病毒(例如亲本临床分离株)可以含有编码gfp的盒以替代icp34.5,并且通过丢失gfp的表达来选择重组病毒空斑。在最优选的实施方案中,hsv的us11基因也作为ie基因表达。这可以通过缺失icp47编码区域或通过其他方式来实现。
异源基因,例如促融合蛋白编码序列、免疫刺激分子编码序列(例如ctla-4抑制剂编码序列、gm-csf编码序列)和/或免疫共刺激途径激活分子编码序列可以插入到病毒基因组中处在适当的调节控制下。根据物种和插入位点,这可以在所用的本公开内容的病毒物种的天然启动子的调节控制之下,或者优选在异源启动子的控制下。合适的异源启动子包括哺乳动物启动子,例如ief2a启动子或肌动蛋白启动子。更优选的是强病毒启动子,例如cmvie启动子、rsvltr、mmlvltr、其他逆转录病毒ltr启动子、或衍生自sv40的启动子。优选地,每个外源基因(例如,编码促融合蛋白、免疫调节分子、gm-csf、免疫共刺激途径激活分子和/或clt-4抑制剂)将处在分开的启动子的控制下,但也可以从单个rna转录物表达,例如通过在蛋白质编码序列之间插入内部核糖体进入位点(ires)。来自每个启动子的rna通常使用多腺苷酸化序列(例如哺乳动物序列,例如牛或/人生长激素(bgh)polya序列,合成的多腺苷酸化序列,兔β珠蛋白多腺苷酸化序列,或病毒序列,例如sv40早期或晚期多腺苷酸化序列)终止。
本公开内容还提供了一种病毒,例如痘病毒或hsv,优选hsv1,其表达至少三种异源基因,其中三种异源基因中的每一种由选自cmv启动子、rsv启动子、ef1a启动子、sv40启动子和逆转录病毒ltr启动子的不同启动子驱动。例如,病毒可以表达四种异源基因,其中四种异源基因中的每一种由选自cmv启动子、rsv启动子、ef1a启动子、sv40启动子和逆转录病毒ltr启动子的不同启动子驱动。逆转录病毒ltr优选来自mmlv(seqidno:43),也称为momulv。异源基因可以由多腺苷酸化序列终止。多腺苷酸化序列可以相同或不同。优选地,每个异源基因由不同的多腺苷酸化序列终止,所述多腺苷酸化序列优选选自bgh、sv40、hgh和rbg多腺苷酸化序列。
本公开内容还提供了一种病毒,例如痘病毒或hsv,优选hsv1,其表达至少三种异源基因,其中三种异源基因中的每一种被选自bgh、sv40、hgh和rbg多腺苷酸化序列的不同多腺苷酸化序列终止。例如,病毒可以表达分别由bgh、sv40、hgh和rbg多腺苷酸化序列中的每一种终止的四种异源基因。
病毒中的每种异源基因通常在启动子的控制下。控制异源基因表达的启动子可以相同或不同。例如,抗ctla-4以及gm-csf、促融合基因和免疫共刺激途径激活分子编码基因中的一种或多种可以各自在cmv启动子、rsv启动子、ef1a启动子、sv40启动子或逆转录病毒ltr启动子的控制下。备选地,例如,抗ctla-4可以在逆转录病毒ltr启动子(例如mmlv启动子)的控制下,gm-csf基因可以在cmv启动子的控制下和/或促融合基因(例如galvr-)可以在rsv启动子的控制下。
至少三种异源基因可以例如选自ctla-4抑制剂、编码gm-csf的基因、编码免疫共刺激途径激活分子的基因和促融合基因。这三种异源基因的实例是ctla-4抑制剂、编码gm-csf的基因和编码免疫共刺激途径激活分子的基因;ctla-4抑制剂、编码gm-csf的基因和促融合基因;以及ctla-4抑制剂、编码免疫共刺激途径激活分子的基因和促融合基因。四种异源基因可以是例如ctla-4抑制剂、编码gm-csf的基因、编码免疫共刺激途径激活分子的基因和促融合基因。所述三种或四种异源基因可包括例如两种或更多种编码免疫共刺激途径激活分子的基因和/或两种或更多种促融合基因。
在一个实施方案中,控制三种异源基因表达的启动子是cmv、rsv和mmlv启动子。例如,优选的病毒可包括在cmv启动子控制下的gm-csf基因、在rsv启动子控制下的galv基因和在mmlv启动子控制下的ctla-4抑制剂。
在一个实施方案中,终止至少三种异源基因的多腺苷酸化序列是sv40、bgh和rbg多腺苷酸化序列。控制这三种异源基因表达的是cmv、rsv和mmlv启动子。例如,优选的病毒可包含由bgh多腺苷酸化序列终止的gm-csf基因、由sv40多腺苷酸化序列终止的galv基因和由rgb多腺苷酸化序列终止的ctla-4抑制剂。
各种启动子和多腺苷酸化序列的任何组合可以与任何异源基因一起使用。例如,优选的病毒可包含在cmv启动子控制下并由bgh多腺苷酸化序列终止的gm-csf基因、在rsv启动子控制下并由sv40多腺苷酸化序列终止的galv基因以及在mmlv启动子控制下并由rgb多腺苷酸化序列终止的ctla-4抑制剂。
药物组合物
本公开内容提供了包含本公开内容的病毒和药学上可接受的运载体或稀释剂的药物组合物。合适的运载体和稀释剂包括等渗盐水溶液,例如磷酸盐缓冲盐水。该组合物可以进一步包含其他成分,例如糖或蛋白质,以改善诸如产品稳定性的性质。备选地,可以使用冻干制剂,其在使用前在药学上可接受的运载体或稀释剂中重构。
如果需要,运载体的选择通常是组合物递送途径的函数。在本公开内容中,可以配制组合物用于任何合适的施用途径和方式。药学上可接受的运载体或稀释剂是用于适合于肿瘤内施用、静脉内/动脉内施用、施用到脑内或施用到体腔内(例如膀胱、胸膜腔或通过腹膜内施用)的组合物中的那些。组合物可以以任何合适的形式施用,优选以液体形式施用。
本公开内容还提供了在无菌小瓶、安瓿或注射器中包含本公开内容的病毒的制品。
医药用途/治疗方法
本公开内容提供了本公开内容的病毒,其用于通过疗法治疗人体或动物体,特别是用于治疗癌症的方法。癌症通常在哺乳动物中,优选在人中。该病毒通过病毒介导的毒性杀死受感染的肿瘤细胞,包括通过裂解和坏死或凋亡,优选通过裂解或坏死,并且在病毒编码促融合蛋白的情况下,通过使受感染的肿瘤细胞彼此融合。本公开内容的病毒还引发全身性抗肿瘤免疫应答,通过表达免疫刺激分子(例如通过表达gm-csf和免疫共刺激途径激活分子)而增强,所述全身性抗肿瘤免疫应答也杀死癌细胞。
本公开内容还提供了治疗癌症的方法,该方法包括将治疗有效量的本发明的病毒施用给有需要的个体。
本公开内容另外提供了本发明的病毒在制备用于治疗癌症的药物中的用途。
本公开内容的病毒特别适用于治疗任何实体瘤,包括任何腺癌,癌,黑色素瘤或肉瘤。例如,本公开内容的病毒可用于治疗头颈癌、前列腺癌、乳腺癌、卵巢癌、肺癌、肝癌、子宫内膜癌、膀胱癌、胆囊癌、胰腺癌、结肠癌、肾癌、胃癌、食道癌或宫颈癌、间皮瘤、黑色素瘤或其他皮肤癌、淋巴瘤、神经胶质瘤或其他神经系统癌症、或肉瘤如软组织肉瘤。
所述癌症优选选自皮肤鳞状细胞癌(cscc)、肾细胞癌(rcc)、非小细胞肺癌(nsclc)、三阴性乳腺癌(tnbc)、小细胞肺癌(sclc)、晚期复发性头颈癌、头颈部鳞状细胞癌(scchn)、鼻咽癌(npc)、肝细胞癌(hcc)、肛门癌、结肠直肠癌(crc)、基底细胞癌(bcc)、梅克尔细胞癌、阑尾癌、皮肤肉瘤、术后复发性黑色素瘤、晚期或转移性尿路上皮癌、肝转移、高微卫星不稳定性癌(msi-h)、混合性晚期实体瘤、病毒引起的癌症、局部区域性晚期癌症和儿科癌症。所述基底细胞癌可以是例如皮肤的基底细胞癌。例如,nmsc可以是罕见的皮肤恶性肿瘤,例如隆突性皮肤纤维瘤、皮肤血管肉瘤、非hiv相关的卡波西肉瘤、皮脂细胞癌或小汗腺癌中的任何一种。例如,msi-h肿瘤可能发生在以下任何一种癌症类型中:子宫内膜癌、卵巢癌、胃癌、结肠直肠癌、胰腺癌、卵巢癌、前列腺癌、中枢神经系统癌和nsclc。病毒引起的癌症可以例如由hbv或hpv引起。肝转移可以是任何肿瘤类型。癌症可以是没有或有极少先前存在的抗癌免疫力的患者的癌症、先前接受过治疗的患者的癌症、未接受过检查点阻断治疗的患者的癌症或已接受过检查点阻断治疗的患者的癌症。例如,先前接受过治疗的患者包括铂类化学疗法失败的膀胱癌患者。所述治疗可以是一线治疗。
本公开内容的病毒可用于治疗恶性肿瘤,包括已从原始肿瘤部位转移的肿瘤。在该实施方案中,病毒可以施用于原发性肿瘤或一种或多种继发性肿瘤。
本公开内容的病毒可以与其他治疗剂组合施用,包括化学疗法、靶向治疗、免疫疗法(包括免疫共抑制途径阻断(免疫检查点阻断)或免疫共刺激途径激活,例如使用免疫共抑制途径的一种或多种拮抗剂和/或免疫共刺激途径的一种或多种激动剂)和/或与放射疗法结合和/或与这些疗法的任何组合结合。治疗剂优选是抗癌剂。
治疗剂可以是酪氨酸激酶抑制剂,例如mek抑制剂,例如曲美替尼(trametinib),braf抑制剂,例如维拉菲尼(verurafenib)和/或达达拉菲尼(dabrafenib)和/或pi3激酶抑制剂。
本公开内容的病毒可以与第二种病毒结合施用,例如与第二种溶瘤病毒结合施用。
例如,治疗剂可以包含免疫原(包括重组或天然存在的抗原,包括这样的抗原或以编码其的dna或rna递送的抗原组合),以进一步刺激针对肿瘤细胞(特别是肿瘤新生抗原)的免疫应答,例如细胞或体液免疫应答。治疗剂可以是旨在增加或增强免疫应答的药剂,例如细胞因子,旨在抑制免疫检查点途径或刺激免疫增强途径的药剂或抑制调节性t细胞(tregs)或骨髓来源的阻抑细胞(mdsc)活性的药剂。
治疗剂可以是已知用于现有癌症治疗处理的药剂。治疗剂可以是放射疗法或化学治疗剂。治疗剂可选自:环磷酰胺,烷化样药剂如顺铂或美法仑(melphalan),植物生物碱和萜类化合物如长春新碱或紫杉醇(taxol),抗代谢物如5-氟尿嘧啶,拓扑异构酶抑制剂i型或ii型例如喜树碱或阿霉素,细胞毒性抗生素如放线菌素,蒽环霉素例如表柔比星,糖皮质激素例如曲安西龙(triamcinolone),蛋白质、dna和/或rna合成的抑制剂如甲氨蝶呤和达卡巴辛(dacarbaxine),组蛋白去乙酰化酶(hdac)抑制剂或任何其他化学治疗剂。
治疗剂可以是下述的一种或其组合:免疫治疗剂或免疫调节剂,例如tlr激动剂;下调调节性t细胞的药物,如环磷酰胺;或旨在阻断免疫检查点或刺激免疫增强途径的药剂,包括但不限于单克隆抗体,如ctla-4抑制剂,pd-1抑制剂,pd-l1抑制剂,lag-3抑制剂,tim-3抑制剂,vista抑制剂,csf1r抑制剂,ido抑制剂,ceacam1抑制剂,gitr激动剂,4-1-bb激动剂,kir抑制剂,slamf7抑制剂,ox40激动剂,cd40激动剂,icos激动剂或cd47抑制剂。在一个优选的实施方案中,治疗剂是ctla-4抑制剂,例如抗-ctla-4抗体,pd1抑制剂,例如抗pd-1抗体或pd-l1抑制剂,例如抗pd-l1抗体。可以通过本领域已知的标准方法产生和测试这些抑制剂、激动剂和抗体。
合适的抗pd-1抗体的实例包括纳武单抗(nivolumab)、派姆单抗(pembrolizumab)和西米普利单抗(cemiplimab)。合适的抗pd-l1抗体的实例包括阿维单抗(avelumab)、德瓦鲁单抗(durvalumab)和阿特朱单抗(atezolizumab)。
免疫治疗剂还可包括双特异性抗体,基于细胞的疗法,所述基于细胞的疗法基于树突细胞、nk细胞或工程化t细胞,例如car-t细胞或表达工程化t细胞受体的t细胞。免疫治疗剂还包括靶向肿瘤中发生的特定基因突变的药剂,旨在诱导针对特定肿瘤抗原或肿瘤抗原(包括新生抗原)的组合的免疫应答的药剂和/或旨在激活sting/cgas途径、tlr或其他先天免疫应答和/或炎症途径的药剂,包括肿瘤内药物。
例如,可以使用本公开内容的病毒:与达卡巴嗪(dacarbazine)、braf抑制剂和/或ctla-4,pd1或pd-l1阻断联合以治疗黑素瘤;与紫杉醇、阿霉素、长春瑞滨、环磷酰胺和/或吉西他滨联合治疗乳腺癌;与5-氟尿嘧啶和任选的甲酰四氢叶酸、伊立替康(irinoteacan)和/或奥沙利铂(oxaliplatin)联合治疗结肠直肠癌;与紫杉醇、卡铂、长春瑞滨和/或吉西他滨、pd-1或pd-l1阻断联合治疗肺癌;与顺铂和/或放射疗法联合治疗头颈癌。
治疗剂可以是吲哚胺2,3-双加氧酶(ido)途径的抑制剂。ido抑制剂的实例包括epacadostat(incb024360)、1-甲基-色氨酸、indoximod(1-甲基-d-色氨酸)、gdc-0919或f001287。
ido在抑制抗肿瘤免疫应答中的作用机制也可以抑制溶瘤病毒治疗后产生的免疫应答。ido表达由toll样受体(tlr)激活和干扰素-γ诱导,这两者都可能由溶瘤病毒感染引起。溶瘤病毒疗法用于癌症治疗的用途的一个实施方案包括溶瘤病毒与ido途径的抑制剂和任选的免疫共抑制途径的一种或多种其他拮抗剂和/或免疫共刺激途径的一种或多种激动剂(包括靶向ctla-4、pd-1和/或pd-l1的那些)的组合,所述溶瘤病毒包括表达一种或多种免疫刺激蛋白和/或促融合蛋白的病毒、或表达gm-csf和一种或多种免疫共刺激途径激活分子和/或一种或多种另外的蛋白质编码序列(例如编码促融合蛋白(例如galvr-)的序列)的病毒、和/或表达ctla-4抑制剂的病毒。
本公开内容还提供了一种治疗癌症的方法,所述方法包括对有需要的患者施用治疗有效量的溶瘤病毒、吲哚胺2,3-双加氧酶(ido)途径的抑制剂和免疫共抑制途径的另一种拮抗剂、和/或免疫共刺激途径的激动剂。
溶瘤病毒优选是经修饰的临床分离株。溶瘤病毒优选为痘病毒,更优选为hsv,例如hsv1和/或使icp34.5和/或icp47功能性失活的hsv。溶瘤病毒可以表达免疫刺激分子,例如gm-csf和/或共刺激途径编码分子,例如cd4ol、gitrl、ox4ol、4-i-bbl、icosl或flt3,和/或ctla-4的抑制剂,和/或促融合蛋白,例如galv促融合糖蛋白,其中r序列突变或缺失。免疫共抑制途径的另一种拮抗剂优选是ctla-4的拮抗剂、pd1的拮抗剂或pd-l1的拮抗剂。例如,免疫共抑制途径的另一种拮抗剂可以是pd1和pd-l1之间相互作用的抑制剂。
当治疗剂和/或放射疗法与本公开内容的病毒结合使用时,病毒和治疗剂和/或放射疗法的施用可以是同时的或者在时间上分开。本公开内容的组合物可以在治疗剂或放射疗法之前、同时或之后施用。治疗癌症的方法可包括多次施用本公开内容的病毒和/或治疗剂和/或放射疗法。熟练的从业者将能够容易地确定病毒和治疗剂的合适施用过程。
在优选的实施方案中,在与免疫共抑制途径的一种或多种拮抗剂(检查点阻断)、免疫共刺激途径的一种或多种激动剂和/或其他免疫增强剂组合的情况下,本公开内容的病毒在同时施用免疫共抑制途径的拮抗剂(检查点阻断)、免疫共刺激途径的激动剂和/或其他一种或多种免疫增强剂之前施用一次或多次,或者在不预先施用本公开内容的病毒的情况下,与免疫共抑制途径的拮抗剂(检查点阻断)、免疫共刺激途径的激动剂和/或其他一种或多种免疫增强剂的施用同时进行。
可以通过任何合适的途径将本公开内容的病毒施用于受试者。通常,通过直接肿瘤内注射施用本公开内容的病毒,包括通过使用成像指导来靶向一个或多个肿瘤。肿瘤内注射包括直接注射到浅表皮肤、皮下或淋巴结肿瘤,以及成像引导(包括ct,mri或超声)注射到更深处或更难处以定位沉积物,包括内脏器官和其他地方。可以将病毒施用到体腔中,例如施用到胸膜腔、膀胱中或通过腹膜内施用。可以将病毒注射到血管中,优选地是供应肿瘤的血管。
可以与本公开内容的病毒组合的治疗剂可以使用各种已知的途径和技术在体内施用给人或动物受试者。例如,组合物可以作为可注射溶液,悬浮液或乳液提供,并使用常规针头和注射器或使用液体喷射注射系统通过肠胃外、皮下、口腔、表皮、皮内、肌肉内、动脉内、腹膜内、静脉内注射施用。组合物可局部施用至皮肤或粘膜组织,例如鼻腔、气管内、肠内、舌下、直肠或阴道施用,或以适于呼吸或肺部施用的细小喷雾形式提供。在不同的实施方案中,组合物通过静脉内输注、口服或直接施用于肿瘤内。优选将病毒直接施用于肿瘤。
病毒和/或治疗剂可以以与治疗有效的剂量组合物相容的量施用于受试者。施用本公开内容的病毒是用于“治疗”目的。如本文所用,术语“治疗性”或“治疗”包括以下任何一种或多种作为其目的:预防任何转移或进一步发生转移;减轻或消除症状;减少或完全消除肿瘤或癌症,增加患者癌症进展的时间;治疗后复发时间增加;或者增加生存时间。
治疗性治疗可以给予i、ii、iii或iv期癌症,优选ii、iii或iv期,更优选iii期或iv期,手术前或手术后干预(例如,作为新辅助疗法,例如,手术后肿瘤复发或不完全切除肿瘤之后),优选在外科手术干预之前(用于切除原发性或复发性/转移性疾病),或在手术后复发后或在不完全手术切除疾病之后(即存在残留肿瘤时)。
在将病毒组合物直接注射到靶组织(可以是肿瘤)、体腔或血管内之后,可以进行治疗性治疗。作为指导,在hsv的情况下施用的病毒量为104至1010pfu,优选105至109pfu,例如104、105或106pfu。在hsv的情况下,可以向患者给予初始较低剂量(例如104至107pfu,例如106pfu),以使针对hsv为血清阴性的患者血清转化并且在血清阳性患者中增强免疫力,然后在之后给予更高剂量(例如,106至109pfu,例如108pfu)。通常,高达20ml的基本上由病毒和药学上可接受的合适的运载体或稀释剂组成的药物组合物可以用于直接注射到肿瘤中,或者最多50ml用于施用到体腔中(在施用之前,可以进行进一步稀释到适当的稀释剂中)或进入血流中。然而,对于一些溶瘤治疗应用,也可以使用更大或更小的体积,这取决于肿瘤和施用途径和部位。
所描述的施用途径和剂量仅作为指导,因为熟练的从业者将能够容易地确定最佳施用途径和剂量。剂量可根据各种参数确定,尤其是根据肿瘤的位置,肿瘤的大小,待治疗患者的年龄、体重和状况以及施用途径。优选地,通过直接注射到肿瘤中来施用病毒。病毒还可以通过注射到血管或体腔中来施用。最佳施用途径取决于肿瘤的位置和大小。可能需要多个剂量以实现免疫学或临床效果,如果需要,通常间隔2天至12周,优选间隔3天至3周施用。可以给予长达5年或更长的重复剂量,优选长达一个月至两年,取决于所治疗的肿瘤类型的响应速度和特定患者的响应,以及也可能是给予的任何组合疗法。
以下实施例举例说明本发明。
实施例
实施例1.具有改善的抗肿瘤作用的临床分离株
用于举例说明本发明的病毒物种是hsv,特别是hsv1。从20多名健康志愿者采集唇疱疹。每个拭子的样品用于感染bhk细胞。通过感染后24-72小时细胞病变效应(cpe)的存在并通过免疫组织化学鉴定含有hsv1的样品,并从阳性样品中产生主要临床分离株的病毒原种。
测试了hsv1的主要临床分离株杀死一组人肿瘤衍生细胞系的能力,并选择在低剂量下具有最大能力的迅速杀死大量此类细胞的病毒株。用于该比较的肿瘤细胞系是ht29(结肠直肠癌)、mda-mb-231(乳腺癌)、sk-mel-28(黑色素瘤)、fadu(鳞状细胞癌)、mcf7(乳腺癌)、a549(肺癌)、miapaca-2(胰腺癌)、capan-1(胰腺癌)、ht1080(纤维肉瘤)。这些细胞系用于测试每种主要临床分离株在一系列的moi和感染后的时间达到的cpe水平。
更具体地,肿瘤细胞系用于接种多孔组织培养板,使得它们在感染当天汇合约80%。用胰蛋白酶消化每个肿瘤细胞系的代表性孔,并确定孔中的细胞数。这些细胞计数用于确定给出1、0.1、0.01和0.001的moi所需的每株临床分离株的体积。在这些moi下,用临床分离株感染单独孔中的肿瘤细胞系,并用生长培养基和羧甲基纤维素覆盖。所有感染均一式四份进行。在37℃、5%co2下,将一式两个孔孵育24小时,以及将一式两个孔孵育48小时,然后用戊二醛固定细胞并用结晶紫染色。然后通过粗略观察、显微镜检查(细胞计数)和摄影或使用代谢测定法(例如mtt测定法)来评估细胞裂解的水平。
还进行了生长曲线实验以评估不同临床分离株在体外在肿瘤细胞系中复制的能力。肿瘤细胞系用于接种多孔组织培养板,以使它们在感染当天汇合约80%。如上确定细胞计数,并用于确定病毒的体积以得到1、0.1、0.01和0.001的moi。针对moi和时间点,一式两份感染肿瘤细胞。将被感染的细胞在37℃,5%co2下孵育,并在感染后0、8、16、24和48小时通过冷冻/解冻裂解细胞。通过标准空斑测定评估病毒滴度。
实施例2.临床分离株的修饰
在该实施例中,通过使用与含有hsv1核苷酸145300至145582(在其之间是编码的gfp)的侧翼区域的质粒(hsv1核苷酸145300至145582是待缺失的序列;hsv1毒株17序列参见genbank文件nc_001806.2)的同源重组从病毒基因组中缺失icp47来修饰实施例1中选择的临床分离株。选择表达gfp的病毒空斑,然后通过与空的侧翼区域同源重组去除gfp,并选择不表达gfp的空斑。这产生icp47缺失的病毒,其中us11表达为ie蛋白,因为它现在处于icp47启动子的控制下。然后通过使用与含有hsv1核苷酸124953至125727(在其之间是编码的gfp)的侧翼区域的质粒(hsv1核苷酸124953至125727是待缺失的序列;hsv1毒株17序列参见genbank文件nc_001806.2)进行同源重组来缺失icp34.5。再次选择表达gfp的病毒空斑,然后通过与相同侧翼区域(但其之间现在是包含密码子优化形式的小鼠gm-csf序列和密码子优化形式的galvr-序列的表达盒,其分别由cmvie启动子和rsv启动子驱动并且处于背对背的方向)的同源重组去除gfp,并再次选择不表达gfp的病毒空斑。使用本领域标准的方法进行该病毒构建。
再次选择表达gfp的病毒空斑,然后通过与相同侧翼区域(但其之间现在是包含密码子优化形式的小鼠gm-csf序列和密码子优化形式的galvr-序列的表达盒,其分别由cmvie启动子和rsv启动子驱动并且处于背对背的方向)的同源重组去除gfp,并再次选择不表达gfp的病毒空斑。使用本领域标准的方法进行该病毒构建。
所得病毒的结构如图1所示(上图)。mgm-csf和galv-r-序列分别显示于seqidno2和8中。通过限制性消化和dna印迹(southernblot)确认所得病毒的结构,通过elisa确认gm-csf表达,并通过感染人ht1080肿瘤细胞和观察到合胞体斑块来确认galv-r-表达。
病毒也使用类似的程序构建,这些病毒没有插入icp34.5,或者只插入了小鼠gm-csf或galv-r-的基因。这些病毒的结构也显示在图1中。
对于人类使用,使用hgm-csf,其密码子优化形式的序列显示在seqidno4中。
实施例3.来自表达促融合蛋白的病毒的两种免疫刺激分子的表达
构建了与上述表达galv-r-和mgm-csf的病毒相似的病毒,但另外表达了cd40l的形式。这里,没有使用含有icp34.5侧翼区和包含由cmv和rsv启动子驱动的gm-csf和galv-r-的表达盒的质粒,而是使用含有icp34.5侧翼区和包含由cmv、rsv和sv40启动子驱动的gm-csf、galv和cd40l的表达盒的质粒用于与含有插入到icp34.5中的gfp的病毒重组,并且再次选择不表达gfp的空斑。
更详细地说,使用与含有hsv1核苷酸145300至145582(在其之间是编码的gfp)的侧翼区域的质粒(hsv1核苷酸145300至145582是待缺失的序列;hsv1毒株17序列参见genbank文件nc_001806.2)的同源重组从病毒基因组中缺失icp47。选择表达gfp的病毒空斑,然后通过与空侧翼区域的同源重组去除gfp,并选择不表达gfp的空斑。这导致icp47缺失的病毒,其中us11表达为ie蛋白,因为它现在处于icp47启动子的控制下。然后使用与含有hsv1核苷酸124953至125727(在其之间是编码的gfp)的侧翼区域的质粒(hsv1核苷酸124953至125727是待缺失的序列;hsv1毒株17序列参见genbank文件nc_001806.2)进行同源重组来缺失icp34.5。再次选择表达gfp的病毒空斑,然后通过与相同侧翼区域(但其之间现在是包含密码子优化形式的小鼠gm-csf序列、密码子优化形式的galvr-序列和密码子优化形式的小鼠可溶性多聚体cd40l的表达盒,其分别由cmv启动子、rsv启动子和sv40启动子驱动)的同源重组去除gfp。再次选择不表达gfp的病毒空斑。
所得病毒的结构示于图2。鼠gm-csf、鼠cd40l和galv-r-序列分别示于seqidno2、14和8。通过限制性消化和dna印迹确认所得病毒的结构,通过elisa确认gm-csf和cd40l表达,并通过感染人ht1080肿瘤细胞和观察到合胞体斑块来确认galv-r-表达。
对于人类使用,使用hgm-csf和hcd40l,其密码子优化形式的序列显示在seqidno4和13中。
实施例4.来自溶瘤病毒的促融合蛋白和免疫刺激分子在小鼠肿瘤模型中的联合表达的作用
galvr-蛋白在人细胞中导致细胞与细胞融合,但在小鼠细胞中不导致此,因为发生细胞融合所需的pit-1受体在小鼠中具有不允许细胞融合发生的序列。结果,首先使用本领域标准方法制备表达人pit-1的小鼠肿瘤细胞。将人pit-1克隆到也包含选择标记基因的慢病毒载体中。将载体转染到靶ct26小鼠结肠直肠癌肿瘤细胞中,选择对选择标记具有抗性的克隆以产生ct26/pit-1细胞。通过蛋白质印迹在未转染的细胞和用表达pit-1的慢病毒转染的细胞中以及通过转染表达galv-r-的质粒并确认细胞融合发生来证实pit-1表达。
通过将ct26/pit-1细胞施用到balb/c小鼠的两侧腹部并允许ct26/pit-1肿瘤生长至直径约0.5cm来证明本发明的效用。
然后对小鼠组(每组5只)施用以下治疗,仅施用到每只小鼠的一侧腹部,每周3次,持续两周:
-50μl生理盐水(1组);
-50μl105pfu/ml、106pfu或107pfu/ml没有插入的基因的hsv(3组);
-50μl105pfu/ml、106pfu/ml或107pfu/ml仅插入小鼠gm-csf的hsv(3组);
-50μl105pfu/ml、106pfu/ml或107pfu/ml仅插入galv-r-的病毒(3组);或
-50μl105pfu/ml、106pfu/ml或107pfu/ml插入小鼠gm-csf和galv-r-的病毒(3组)。
然后观察对肿瘤生长的影响长达一个月。与其他组相比,使用表达gm-csf和galv-r-的病毒在注射和未注射的肿瘤中均观察到优异的肿瘤控制和收缩,包括通过改善的剂量响应曲线所观察到的。
实施例5.来自溶瘤病毒的gm-csf和免疫共刺激途径激活分子在小鼠肿瘤模型中的联合表达的作用
galvr-蛋白在人细胞中导致细胞与细胞融合,但在小鼠细胞中不导致此,因为发生细胞融合所需的pit-1受体在小鼠中具有不允许细胞融合发生的序列。结果,首先使用本领域标准方法制备表达人pit-1的小鼠肿瘤细胞。将人pit-1克隆到也包含选择标记基因的慢病毒载体中。将载体转染到靶ct26小鼠结肠直肠癌肿瘤细胞中,选择对选择标记具有抗性的克隆以产生ct26/pit-1细胞。通过蛋白质印迹在未转染的细胞和用表达pit-1的慢病毒转染的细胞中以及通过转染表达galv-r-的质粒并确认细胞融合发生来证实pit-1表达。
通过将ct26/pit-1细胞施用到balb/c小鼠的两侧腹部并允许ct26/pit-1肿瘤生长至直径约0.5cm来证明本发明的效用。
然后对小鼠组(每组5只)施用以下治疗,仅施用到每只小鼠的一侧腹部,每周3次,持续两周:
-50μl生理盐水(1组);
-50μl105pfu/ml、106pfu/ml或107pfu/ml仅插入galvr-的hsv(3组);
-50μl105pfu/ml、106pfu/ml或107pfu/ml仅插入galvr-和小鼠gm-csf的hsv(3组);
-50μl105pfu/ml、106pfu/ml或107pfu/ml插入galvr-和小鼠gm-csf和cd40l的病毒(3组)。
然后观察对肿瘤生长的影响长达一个月。与其他组相比,使用表达gm-csf和cd40l的病毒在注射和未注射的肿瘤中均观察到优异的肿瘤控制和收缩,包括通过改善的剂量响应曲线所观察到的。
实施例6.来自溶瘤病毒的促融合蛋白和免疫刺激分子的联合表达对小鼠肿瘤模型中免疫检查点阻断的治疗效果的影响
重复上述实施例4中的实验,但是通过腹膜内途径每两周给小鼠另外给予靶向小鼠pd-1的抗体(10mg/kg;bioxcellrmp-1-14,与病毒给药同一天)或靶向小鼠ctla-4的抗体(10mg/kg;bioxcell9h10,与病毒给药同一天)。增加未接受抗体治疗的另外一组小鼠。更具体地,小鼠组接受:(1)盐水,(2)没有插入基因的hsv,(3)如实施例3中插入gm-csf和galv-r-的hsv,(4)pd-1抗体,(5)ctla-4抗体,(6)没有插入基因的hsv加pd-1抗体,(7)没有插入基因的hsv加ctla-4抗体,(8)具有gm-csf和galv-r-的hsv和pd-1抗体或(9)具有gm-csf和galv-r-的hsv和ctla-4抗体。与其他组相比,使用表达gm-csf和galv-r-的病毒以及抗pd-1抗体或抗-ctla-4抗体在注射和未注射的肿瘤中均观察到优异的肿瘤控制和收缩,包括通过改善的剂量响应曲线所观察到的。
实施例7.来自溶瘤病毒的gm-csf和免疫共刺激途径激活分子的联合表达对小鼠肿瘤模型中免疫检查点阻断的治疗效果的影响
重复上述实施例5中的实验,但是通过腹膜内途径每两周给小鼠另外给予靶向小鼠pd-1的抗体(10mg/kg;bioxcellrmp-1-14,与病毒给药同一天)或靶向小鼠ctla-4的抗体(10mg/kg;bioxcell9h10,与病毒给药同一天)。增加未接受抗体治疗的另外一组小鼠。更具体地,小鼠组接受:(1)盐水,(2)如实施例5中插入galvr-的hsv,(3)如实施例2中插入gm-csf和galv-r-的hsv,(4)如实施例2中插入gm-csf、cd40l和galv-r-的hsv,(5)pd-1抗体,(6)ctla-4抗体,(7)插入galv-r-的hsv加pd-1抗体,(8)插入galv-r-的hsv加ctla-4抗体,(9)具有gm-csf和galv-r-的hsv和pd-1抗体,或(10)具有gm-csf和galv-r-的hsv和ctla-4抗体,(11)具有gm-csf、cd40l和galv-r-的hsv和pd-1抗体,或(12)具有gm-csf、cd40l和galv-r-的hsv和ctla-4抗体。与其他组相比,使用表达gm-csf和cd40l的病毒以及抗pd-1抗体或抗-ctla-4抗体在注射和未注射的肿瘤中均观察到优异的肿瘤控制和收缩,包括通过改善的剂量响应曲线所观察到的。
实施例8.临床分离株的采集
用于举例说明本公开内容的病毒物种是hsv,特别是hsv1。招募了181名患有复发性唇疱疹的志愿者。这些志愿者被给予样品采集试剂盒(包括sigmavirovult采集管),并且当唇疱疹出现时用它们擦拭唇疱疹,随后将这些样品运送到英国牛津的replimune(oxforduk)。从2015年6月至2016年2月,收到了来自72名志愿者的拭子。每个拭子的样品用于感染bhk细胞。在铺板并在bhk细胞上生长后,从这些中回收到36个活病毒样品。这些样品详见表1。
表1:经测试的拭子样品和结果的详细信息
名称a、b、c等表示来自同一志愿者的多个拭子。
实施例9.具有改善的抗肿瘤作用的临床分离株的鉴定
测试了hsv1的原代临床分离株杀死一组人肿瘤来源的细胞系的能力。用于该比较的肿瘤细胞系是ht29(结肠直肠癌)、mda-mb-231(乳腺癌)、sk-mel-28(黑素瘤)、fadu(鳞状细胞癌)、mcf7(乳腺癌)、a549(肺癌)、miapaca-2(胰腺癌)和ht1080(纤维肉瘤)。细胞系用于测试每株原代临床分离株以一系列的moi和感染后的时间达到的cpe水平。
同时使用5至8株新病毒株平行地进行实验。将病毒株以一系列moi(0.001-1)一式两份铺板,并在感染后24和48小时评估结晶紫染色后的cpe程度。对杀死肿瘤细胞系最有效的病毒株进行评分,并且在进一步的实验中鉴定并平行比较来自5-8株毒株的每次筛选的最有效的两株或三株毒株,以鉴定用于进一步开发的最强毒株。
初始筛选证明了不同毒株杀死不同肿瘤细胞系的能力的显著可变性。在最初测试的29株毒株中,在初始筛选中鉴定了8株感兴趣的毒株用于进一步比较。它们是毒株rh004a、rh015a、rh018a、rh021a、rh023a、rh31a、rh040a和rh047a。
在肿瘤细胞系组中平行测试用于进一步比较的8株毒株,并且在结晶紫染色和观察cpe后评估它们杀死这些肿瘤细胞系的相对能力。图3显示了这些病毒中每种病毒针对每种细胞系的代表性时间点和moi,证明了观察到的病毒杀死靶肿瘤细胞系的差异能力。
毒株之间存在显著差异,并且发现虽然特定毒株可能在杀死一种细胞系方面特别有效,但它对杀死其他细胞系也不一定特别有效,进一步证明了hsv的临床株杀死不同类型的肿瘤细胞的能力的可变性程度。
图3还表明哪种病毒株在杀死每种细胞系中是最佳和次佳的,使得病毒株能够按其杀死整个细胞系组的整体相对能力排序。该分析表明毒株rh004a、rh015a、rh018a、rh031a和rh040a比其他毒株相对更有效,并且选择这五株毒株用于作为溶瘤剂的潜在的进一步开发。在这前五株毒株中,基于它们杀死一组细胞系的能力的相对等级顺序是rh018a>rh004a>rh031a>rh040a>rh015a。
更具体地,在这些实验中,肿瘤细胞系用于接种多孔组织培养板,使得它们在感染当天约80%汇合。来自每个肿瘤细胞系的代表性孔用胰蛋白酶消化并测定孔中的细胞数。这些细胞计数用于确定给出1、0.1、0.01和0.001的moi所需的每株临床分离株的体积。以这些moi,用临床分离株感染单独孔中的肿瘤细胞系。所有感染均一式四份进行。将一式两个孔孵育24小时,一式两个孔孵育48小时,均在37℃,5%co2下孵育,然后用戊二醛固定细胞并用结晶紫染色。然后通过粗略观察、显微镜检查(细胞计数)和摄影评估细胞裂解水平。
将毒株rh018a(在所有测试毒株中排名第一)与筛选的“平均”毒株(即毒株不在前8位,但也不在杀死肿瘤细胞系组的效果最差的毒株组中)进行比较。该比较显示毒株rh018a在杀死肿瘤细胞系时的有效性是该平均毒株(毒株rh065a)的约10倍(即杀死等量细胞需要的毒株rh018a是所需的毒株rh065a的约十分之一)。这显示在图4中。
实施例10.临床分离株的修饰
在该实施例中,修饰实施例9中选择的临床分离株,通过使用与含有icp34.5编码基因的侧翼区域(其间是编码的gfp和galv-r-促融合糖蛋白)(核苷酸143680-145300和145,582-147,083;hsv1毒株17序列参见genbank文件nc_001806.2)的质粒的同源重组,从病毒基因组中缺失icp34.5进行。该病毒(病毒10)的结构如图5所示。
还构建了基于毒株rh018a的其他病毒,其中icp34.5和icp47(使用含有核苷酸123464-124953和125727-126781的侧翼区域;hsv1毒株17序列参见genbank文件nc_001806.2)均缺失(导致us11置于icp47启动子的控制下)。为了构建这些病毒,首先选择表达gfp的病毒空斑,其中表达的gfp代替icp47。然后通过与空侧翼区域的同源重组除去gfp,并选择不表达gfp的空斑。这导致icp47缺失的病毒,其中us11表达为ie蛋白,因为它现在处于icp47启动子的控制下。然后使用与含有hsv1核苷酸(143680-145300和145,582-147,083;hsv1毒株17序列参见genbank文件nc_001806.2)的侧翼区域(其之间编码gfp)的质粒进行同源重组来缺失icp34.5。再次选择表达gfp的病毒空斑,然后通过与相同侧翼区域(但现在其之间是包含待插入基因的表达盒)的同源重组除去gfp。构建的病毒显示在图1和5中。这些包括分别由cmvie启动子和rsv启动子驱动的密码子优化形式的小鼠gm-csf序列和密码子优化形式的galvr-序列,其处于背对背方向,以及再次选择不表达gfp的病毒空斑。使用本领域标准的方法进行该病毒构建。
mgm-csf和galv-r-序列分别显示于seqidno2和8中。通过pcr确认所得病毒的结构,通过elisa确认gm-csf表达,并通过感染人ht1080肿瘤细胞和观察到合胞体斑块来确认galv-r-表达。
对于人类使用,使用hgm-csf,其密码子优化形式的序列显示在seqidno4中。该病毒的结构如图5所示。来自病毒16、17和19的小鼠或人gm-csf的表达示于图6中。
实施例11.与不表达促融合糖蛋白的病毒相比,经修饰用于溶瘤用途并表达促融合糖蛋白的病毒在体外显示出增强的肿瘤细胞杀伤作用
基于临床毒株rh018a的病毒10(参见图5)(其中icp34.5缺失并且表达galvr-和gfp)在体外与仅表达gfp的病毒(病毒12)进行比较。与病毒12相比,病毒10在一组人肿瘤细胞系中显示出增强的杀伤,如图7所示。
实施例12.与经类似修饰的已知病毒相比,经修饰用于溶瘤用途的病毒显示出增强的肿瘤细胞杀伤
基于临床毒株rh018a的病毒17(参见图5)(其中icp34.5和icp47缺失并且表达galvr-和gm-csf)在体外与已知的病毒(该病毒也缺失icp34.5和icp47,但它是来源于已知毒株并且仅表达gm-csf)进行比较。与先前的病毒相比,病毒17在一组人肿瘤细胞系中显示出增强的杀伤,如图8所示。
实施例13.经修饰用于溶瘤用途的病毒在体内有效地治疗小鼠肿瘤
在左侧和右侧腹部携带a20淋巴瘤肿瘤的小鼠中测试病毒16。首先将100万个肿瘤细胞植入balb/c小鼠的两侧腹部,使肿瘤生长至直径为0.5-0.7cm。然后将右侧腹部的肿瘤用媒介物(10只小鼠)或5×10exp6pfu的病毒16(10只小鼠)注射3次(每隔一天),并观察对肿瘤大小的影响,持续另外30天。这证明,注射和未注射的肿瘤均得到病毒16的有效治疗(参见图9)。
实施例14.来自溶瘤病毒的促融合蛋白和免疫刺激分子在大鼠肿瘤模型中的联合表达的作用
galvr-蛋白导致人细胞中的细胞与细胞融合,但在小鼠细胞中不能这样。然而,galvr-确实引起大鼠细胞融合。
通过将9l细胞施用到fischer344大鼠的侧腹并使9l肿瘤生长至直径约0.5cm,进一步证明了本发明的效用。
然后对大鼠组(每组10只)施用以下治疗,仅施用到每只大鼠的一侧腹部,每周3次,持续三周:
-50μl媒介物;
-50μl107pfu/ml病毒19(表达mgm-csf但不表达galvr-);
-50μl107pfu/ml病毒16(表达小鼠gm-csf和galv-r-二者)。
然后观察对肿瘤生长的影响,进行另外≈30天。这表明使用表达galv-r-的病毒在注射和未注射的肿瘤中优异的肿瘤控制和收缩,证明了改善的系统效应。这显示在图15中。图10显示与不表达galv的病毒(病毒24)相比,表达galv的病毒(病毒15)在体外也显示出增强的大鼠9l细胞杀伤。
实施例15.在小鼠肿瘤模型中,经修饰用于溶瘤用途的病毒与免疫检查点阻断协同作用
在左侧和右侧腹部中携带ct26肿瘤的小鼠中测试病毒16。首先将100万个肿瘤细胞植入balb/c小鼠的两侧腹部,并使肿瘤生长至直径0.5-0.6cm。
然后用以下物质处理10只小鼠的组:
-媒介物(每隔一天向右侧腹部肿瘤注射,3次注射);
-每隔一天在右侧腹部肿瘤中注射5x10exp6pfu的病毒16;
-单独的抗小鼠pd1(每3天腹膜内10mg/kg,bioxcell克隆rmp1-14);
-抗小鼠ctla-4(每3天腹膜内3mg/kg,bioxcell克隆9d9);
-抗小鼠pd1和病毒16;
-抗小鼠ctla4和病毒16;
-1-甲基色氨酸(ido抑制剂(饮用水中5mg/ml));
-抗小鼠pd1和1-甲基色氨酸;
-抗小鼠pd1与1-甲基色氨酸和病毒16;
观察对肿瘤大小的影响,进行另外30天。与用单一治疗组治疗的动物相比,用病毒和检查点阻断组合治疗的动物的肿瘤减小更多(见图11)。与仅与抗pd1一起的病毒16相比,还证实了使用病毒16与抗pd1和ido抑制一起的增强的肿瘤减小(参见图11)。
在a20肿瘤中也观察到病毒16与免疫检查点阻断组合的增强活性(图12)。
实施例16.来自溶瘤病毒的促融合蛋白的表达在免疫缺陷小鼠的人异种移植模型中的作用
galvr-蛋白导致人细胞中的细胞与细胞融合,但在小鼠细胞中不能如此。然而,在免疫缺陷小鼠中生长的人异种移植肿瘤可用于评估galv表达对抗肿瘤功效的影响。
因此,通过将a549人肺癌细胞施用到裸鼠的侧腹并允许肿瘤生长至直径约0.5cm,进一步证明了本发明的效用。
然后对小鼠组(每组10只)施用以下治疗,施用到每只小鼠的含肿瘤侧腹,在一周进行3次:
-50μl媒介物;
-50μl107pfu/ml病毒16(表达小鼠gm-csf和galv-r-二者);
-50μl106pfu/ml病毒16;
-50μl105pfu/ml病毒16;
-50μl107pfu/ml病毒19(仅表达小鼠gm-csf);
-50μl106pfu/ml病毒19;
-50μl105pfu/ml病毒19。
然后观察对肿瘤生长的影响,进行另外≈30天。该实验证明了在两种肿瘤模型中使用表达galv-r-的病毒优异的肿瘤控制和收缩(参见图14)。
实施例17.来自表达促融合蛋白的病毒的两种免疫刺激分子的表达
构建了与上述表达galv-r-和mgm-csf的病毒(病毒16)相似的病毒,但其另外表达了小鼠形式的cd40l(病毒32)、icosl(病毒36)、ox40l(病毒35)、4-1bbl(病毒33)和gitrl(病毒34)。这里,不使用含有icp34.5侧翼区和包含由cmv和rsv启动子驱动的gm-csf和galv-r-的表达盒的质粒,而是使用含有icp34.5侧翼区和包含分别由cmv、rsv和mmlv启动子驱动的gm-csf、galv和另外蛋白质的表达盒的质粒用于与含有插入到icp34.5中的gm-csf、galv和gfp的病毒重组。再次选择不表达gfp的空斑。通过pcr确认正确插入,并通过蛋白质印迹和/或elisa确认另外插入的基因的表达。这些病毒显示在图5中。类似地,还构建了除galv和mgm-csf之外还表达抗小鼠和抗人ctla-4的病毒(图5中的病毒27和31,还参见图13)。除了mgm-csf和galvr-之外,还表达抗小鼠ctla-4(病毒27)、mcd40l(病毒32)、m4-1bbl(病毒33)或mox40l(病毒35)的病毒的体内效果如图16所示:与病毒16(表达mgm-csf和galvr-)相比,其在a20肿瘤中显示出增强的活性。在这些实验中,在小鼠的两侧腹部诱导肿瘤,并且仅将病毒或媒介物注射到右侧腹部肿瘤中。使用的病毒剂量为5×104pfu(每种情况下50ul的1×106pfu/ml),在一周内给予三次。对于病毒16而言,对未注射的肿瘤,该病毒剂量水平是未达治疗剂量的,这使得可以清楚地看到递送由病毒27、32、33和35编码的另外的分子的益处。
实施例18.示例性病毒的构建
用于举例说明的病毒物种是hsv,特别是hsv1。
所用质粒的图示显示在图18中。病毒的图示显示在图17中。所有病毒均使用hsv1毒株rh018a构建。通过由genscriptinc.进行的基因合成和亚克隆相结合,生成了用于病毒构建的质粒。
通过将质粒77与病毒16dna共转染来构建表达抗小鼠ctla4以及小鼠gm-csf和galv的病毒,以将gfp插入病毒16中,通过选择表达gfp的空斑而得到病毒25。然后通过将病毒25dna与质粒119共转染来将gfp从病毒25中敲除。这样得到病毒27。
通过将质粒78与病毒17dna共转染来构建表达抗人ctla4以及人gm-csf和galv的病毒,以将gfp插入病毒16中,通过选择表达gfp的空斑而得到病毒29。然后通过将病毒29dna与质粒122共转染来将gfp从病毒29中敲除。这样得到病毒31。
通过将编码gfp(由sv40启动子驱动,在小鼠gm-csf和抗小鼠ctla-4编码序列之间)的质粒与病毒27共转染来构建表达抗小鼠ctla-4和共刺激配体以及小鼠gm-csf和galv的病毒。然后用编码代替gfp的每个个体小鼠的共刺激配体的质粒来将gfp从所得病毒中敲除。
通过将编码gfp(由sv40启动子驱动,在人gm-csf和抗人ctla-4编码序列之间)的质粒与病毒31共转染来构建表达抗人ctla-4和共刺激配体以及人gm-csf和galv的病毒。然后用编码代替gfp的每个个体人的共刺激配体的质粒来将gfp从所得病毒中敲除。
图20显示了蛋白质印迹,证明了来自病毒27的抗小鼠ctla-4的表达。
实施例19.来自溶瘤病毒的galv、gm-csf和抗ctla4的联合表达的作用
通过以下方式来证明本发明的效用。将a20细胞施用到balb/c小鼠的两侧腹部并允许a20肿瘤生长至直径约0.5cm。
然后对小鼠组施用以下治疗,仅施用到每只小鼠的一侧腹部(右侧肿瘤),每周3次,持续一周:
-50μl媒介物(1组);
-50μl106pfu/ml仅插入小鼠gm-csf和galvr-的hsv(病毒16);
-50μl106pfu/ml插入galvr-、小鼠gm-csf和抗小鼠ctla-4抗体的hsv(病毒27);
然后观察对肿瘤生长的影响长达一个月。使用的病毒剂量为5×104pfu(每种情况下50ul的1×106pfu/ml),在一周内给予三次。对于病毒16而言,对未注射的肿瘤,该病毒剂量水平是未达治疗剂量的,这使得可以清楚地看到递送由病毒27编码的另外的分子的益处。图21和22显示了与不表达ctla-4的病毒16相比,表达抗ctla-4的病毒在未注射的肿瘤中具有优异的肿瘤控制和收缩。
实施例20.来自溶瘤病毒的galv、gm-csf和抗ctla4的联合表达与抗pd-1的作用
将a20细胞施用到balb/c小鼠的两侧腹部并允许a20肿瘤生长至直径约0.5cm。
然后对小鼠组(每组10只)施用以下治疗,仅施用到每只小鼠的一侧腹部,每周3次,持续一周:
-50μl媒介物(1组);
-腹膜内抗小鼠pd1(bioxcellrmp-1-14每三天10mg/kg)
-50μl107pfu/ml插入galvr-、小鼠gm-csf和抗小鼠ctla-4抗体的hsv(病毒27);
-50μl107pfu/ml插入galvr-、小鼠gm-csf和抗小鼠ctla-4抗体的hsv(病毒27)以及腹膜内抗小鼠pd1(每三天10mg/kg)(3组)。
然后观察对肿瘤生长的影响长达80天。当用病毒的治疗与用抗pd-1的治疗组合时,在注射的和未注射的肿瘤中具有优异的肿瘤控制和收缩。此数据显示在图23中。
实施例21.来自溶瘤病毒的galv、gm-csf和抗人ctla4的联合表达单独和与抗pd-1组合的作用
将mc38细胞施用于通过基因编辑工程化以表达人而不是小鼠ctla-4的c57bl/6小鼠的两侧腹部。这使得小鼠对抗人ctla-4抗体(例如伊匹单抗)易感。允许mc38肿瘤生长至直径约0.5cm。
然后对小鼠组(每组10只)施用以下治疗,仅施用到每只小鼠的一侧腹部,每周3次,持续两周:
-50μl媒介物;
-50μl108pfu/ml的病毒17(即表达hgm-csf和galv);
-50μl108pfu/ml的病毒31(即表达hgm-csf、galv和抗人ctla-4);
-50μl108pfu/ml的病毒17以及腹膜内抗小鼠pd1(每三天10mg/kg);
-50μl108pfu/ml的病毒31以及腹膜内抗小鼠pd1(每三天10mg/kg)。
然后观察对肿瘤生长的影响长达35天。用表达抗人ctla-4的病毒在注射的肿瘤中观察到优异的肿瘤控制和收缩,其通过与抗pd1联合治疗进一步增强。当用任一种病毒治疗与抗pd1治疗联合时,在未注射的肿瘤中观察到优异的肿瘤控制和收缩。对表达抗ctla4的病毒的改善更为显著。此数据显示在图24中。
实施例22.用表达抗ctla4的溶瘤病毒和抗pd1疗法治疗肿瘤后诱导记忆免疫应答
在使用病毒31联合抗pd-1治疗的进一步实验中,评估了其中已根除肿瘤的小鼠中的抗肿瘤应答的持久性,以及确认这些小鼠是否被保护免受肿瘤细胞的再次攻击,这将证明已经诱导了记忆免疫应答。
在该实验中,观察到在施用病毒31联合抗pd-1抗体后治愈了15只小鼠的双侧肿瘤,直到实验开始后第108天,然后用肿瘤细胞再次攻击以评估小鼠是否被保护免于新肿瘤的形成。在整个实验过程中保持抗肿瘤作用,并且15只小鼠中有14只被保护免受肿瘤细胞的再次攻击。结果如图25所示。在该模型中,单独用抗pd-1治疗没有抗肿瘤作用。
实施例23.来自溶瘤病毒的galv、gm-csf、抗ctla4和免疫共刺激途径激活分子的联合表达的作用
重复上述实施例20中的实验,但是给小鼠施用另外表达免疫共刺激途径配体以及表达galv、mgm-csf和抗ctla4的病毒。
更具体地说,小鼠组接受:
(1)媒介物;
(2)腹膜内抗小鼠pd1;
(3)如实施例2中的插入mgm-csf、galvr-和抗ctla4的hsv;
(4)插入mgm-csf、galvr-、抗ctla4和小鼠cd40l的hsv;
(5)插入mgm-csf、galvr-、抗ctla4和小鼠4-1bbl的hsv;
(6)插入mgm-csf、galvr-、抗ctla4和小鼠gitrl的hsv;
(7)插入mgm-csf、galvr-、抗ctla4和小鼠ox40l的hsv;
(8)插入mgm-csf、galvr-、抗ctla4和小鼠icosl的hsv;
(9)如实施例2中的插入mgm-csf、galvr-和抗ctla4的hsv以及腹膜内抗pd1;
(10)插入mgm-csf、galvr-、抗ctla4和小鼠cd40l的hsv以及腹膜内抗pd1;
(11)插入mgm-csf、galvr-、抗ctla4和小鼠4-1bbl的hsv以及腹膜内抗pd1;
(12)插入mgm-csf、galvr-、抗ctla4和小鼠gitrl的hsv以及腹膜内抗pd1;
(13)插入mgm-csf、galvr-、抗ctla4和小鼠ox40l的hsv以及腹膜内抗pd1;或者
(14)插入mgm-csf、galvr-、抗ctla4和小鼠icosl的hsv以及腹膜内抗pd1。
用表达免疫共刺激配体的病毒可以观察到优异的肿瘤控制。
保藏信息
以下hsv1毒株于2016年12月19日由replimunelimited保藏于欧洲动物细胞保藏中心(ecacc),culturecollections,publichealthengland,portondown,salisbury,sp40jg,unitedkingdom,并分配了指定的保藏号:
rh004a-保藏号16121902
rh015a-保藏号16121903
rh018a-保藏号16121904
rh021a-保藏号16121905
rh023a-保藏号16121906
rh031a-保藏号16121907rh040b-保藏号16121908rh047a-保藏号16121909。
- 还没有人留言评论。精彩留言会获得点赞!