包含有机磷酸酯的液体蛋白质制剂的制作方法
本申请是申请日为2014年09月11日、申请号为201480061378.0(国际申请号为pct/us2014/055210)、名称为“包含有机磷酸酯的液体蛋白质制剂”的发明专利申请的分案申请。
对相关申请的交叉引用
本申请要求2014年7月29日提交的标题为“low-viscosityproteinformulationscontaininghydrophobicsalts”的美国临时申请62/030,521、2014年7月18日提交的标题为“low-viscosityproteinformulationscontaininggrasviscosity-reducingagents”的美国临时申请62/026,497、2014年6月5日题为“low-viscosityproteinformulationscontainingionicliquids”的美国临时申请62/008,050、2014年5月2日提交的标题为“low-viscosityproteinformulationscontainingorganophosphates”的美国临时申请61/988,005、2014年2月28日提交的标题为“concentrated,low-viscosityinfliximabformulations”的美国临时申请61/946,436、2014年2月21日提交的标题为“concentrated,low-viscosity,high-molecular-weight-proteinformulations”的美国临时申请61/943,197、2014年2月14日提交的标题为“concentrated,low-viscosityhigh-molecular-weightproteinformulations”的美国临时申请61/940,227和2013年9月11日提交的标题为“concentrated,low-viscosity,high-molecular-weightproteinformulations”的美国临时申请61,876,621的优先权和权益,通过引用的方式将其公开的内容明确并入本文。
本发明大体为蛋白质诸如单克隆抗体的注射用药物制剂领域及其制备和使用的方法。
背景技术:
单克隆抗体(mab)是重要的基于蛋白质的治疗剂,其用于治疗各种人类疾病诸如癌症、感染性疾病、炎症和自身免疫性疾病。超过20种单克隆抗体产品已被美国食品药品监督管理局(fda)所批准,且目前在临床试验中正在进行评价的全部生物药物中的约20%是单克隆抗体(daugherty等人,adv.drugdeliv.rev.58:686-706,2006;和buss等人,curr.opinioninpharmacol.12:615-622,2012)。
基于单克隆抗体的治疗剂通常在延长的时段内反复给药且需要若干种mg/kg剂量。抗体溶液或混悬液可通过胃肠外途径来给药,诸如通过静脉内(iv)输注及皮下(sc)或肌内(im)注射。与静脉内途径相比,皮下或肌内途径在给药期间降低治疗成本,提高患者顺应性且改善患者和医疗服务提供者的方便性。为了成为有效和在药学上可接受的,胃肠外制剂应当优选是无菌的、稳定的、可注射的(例如经由注射器)且在注射部位无刺激性,从而符合fda指导方针。因为皮下(通常低于约2ml)和肌内(通常低于约5ml)注射需要小体积,所以用于高剂量蛋白质治疗剂的这些给药途径需要浓缩的蛋白质溶液。这些高浓度通常导致非常粘的制剂,其难以通过注射来给药,在注射部位引起疼痛,通常是不精确的和/或可能具有降低的化学和/或物理稳定性。
这些特征导致可能不易满足的制备、储存和使用要求,特别是对于具有高浓度的高分子量蛋白质诸如单克隆抗体的制剂。所有蛋白质治疗剂在一定程度上都受到物理和化学不稳定性的影响,诸如聚集、变性、交联、脱酰胺、异构化、氧化和剪裁(wang等人,j.pharm.sci.96:1-26,2007)。因此,优化制剂的开发在商业化蛋白质药物的开发中是至关重要的。
高蛋白质浓度造成与蛋白质的物理和化学稳定性相关的挑战及蛋白质制剂的生产、储存和递送困难。一个问题是蛋白质在加工和/或储存期间发生聚集并形成颗粒的倾向,这使进一步加工和/或递送期间的操作变得困难。浓度依赖性降解和/或聚集是开发较高浓度的蛋白质制剂中的主要挑战。除非天然蛋白质聚集和颗粒形成的可能性外,可发生水溶液中的可逆性自缔合,这也促进了使注射递送变得复杂的粘度增加(参见例如stevenj.shire等人,j.pharm.sci.93:1390-1402,2004)。粘度增加是在浓缩的蛋白质组合物中遇到的主要挑战之一,其使生产工艺和通过常规方法容易地递送此类组合物的能力都受到影响(参见例如j.jezek等人,advanceddrugdeliveryreviews63:1107-1117,2011)。
高粘性液体制剂难以制备、吸到注射器中并皮下或肌内注射。在操作粘性制剂中力的使用可导致过度起泡,这可进一步使治疗活性蛋白质发生变性和失活。高粘度溶液还需要较大直径的注射用针头并在注射部位产生较多的疼痛。
目前市售的通过皮下或肌内注射来给药的单克隆抗体产品通常在含水缓冲液及赋形剂或表面活性剂中配制以防止聚集且改善稳定性,所述含水缓冲液为诸如磷酸盐或l-组氨酸缓冲液,所述赋形剂或表面活性剂为诸如甘露醇、蔗糖、乳糖、海藻糖、
美国专利7,758,860描述了在低分子量蛋白质的制剂中使用缓冲液和使粘度降低的无机盐诸如氯化钙或氯化镁来降低粘度。然而,这些相同的盐对高分子量抗体(ima-638)制剂的粘度显示出很小的作用。如美国专利7,666,413所述,高分子量蛋白质的含水制剂的粘度已通过添加浓度大于约100mm的精氨酸盐酸盐、硫氰酸钠、硫氰酸铵、硫酸铵、氯化铵、氯化钙、氯化锌或乙酸钠等盐来降低或如美国专利7,740,842所述通过添加有机酸或无机酸来降低。然而,这些盐没有使粘度降低至所需要的水平并在一些情况下使制剂呈足够的酸性以致很可能在注射部位引起疼痛。
美国专利7,666,413描述了含有特定盐和复溶的抗ige单克隆抗体的粘度降低的制剂,但是最高抗体浓度至多只有约140mg/ml。美国专利7,740,842描述了含有乙酸盐/乙酸缓冲液的其中抗体浓度高达257mg/ml的e25抗ige单克隆抗体制剂。盐诸如nacl、cacl2或mgcl2的添加被证实降低了高剪切条件下的动态粘度;然而,所述盐在低剪切时产生不合希望且显著的动态粘度增加。此外,无机盐诸如nacl可降低溶液粘度和/或减少聚集(ep1981824)。
非水性抗体或蛋白质制剂也已有描述。wo2006/071693描述了高达100mg/ml的单克隆抗体在具有粘度增强剂(聚乙烯基吡咯烷酮即pvp)和溶剂(苯甲酸苄酯或peg400)的制剂中的非水性混悬液。wo2004/089335描述了含有pvp、四氢呋喃聚乙二醇醚、苯甲酸苄酯、苄醇或peg400的100mg/ml非水性溶菌酶混悬液制剂。us2008/0226689a1描述了100mg/ml人生长激素(hgh)单相三种媒介物组分(聚合物、表面活性剂和溶剂)非水性粘性制剂。美国专利6,730,328描述了用于蛋白质制剂的非水性、疏水性、非极性、低反应性媒介物诸如全氟萘烷。这些制剂不是最佳的并具有妨碍加工、制备和注射的高粘度;导致多种媒介物组分在制剂中的存在;并存在与使用fda尚未批准的聚合物相关的潜在规章挑战。
已描述了使用有机溶剂的可选择的非水性蛋白质或抗体制剂,所述有机溶剂为诸如苯甲酸苄酯(miller等人,langmuir26:1067-1074,2010)、乙酸苄酯、乙醇或甲基乙基酮(srinivasan等人,pharm.res.30:1749-1757,2013)。在这两种情况下,小于50厘泊(cp)的粘度当所配置的蛋白质浓度为至少约200mg/ml时被实现。美国专利6,252,055描述了浓度范围为100mg/ml至高达257mg/ml的单克隆抗体制剂。浓度大于约189mg/ml的制剂显示出显著增加的粘度、低的回收率和加工难度。美国专利申请公开文本2012/0230982描述了浓度为100mg/ml至200mg/ml的抗体制剂。这些制剂都不具有足以使注射变得容易的低粘度。
du和klibanov(biotechnologyandbioengineering108:632-636,2011)描述了最大浓度高达400mg/ml的牛血清白蛋白和最大浓度高达300mg/ml的牛丙种球蛋白的浓缩水溶液的粘度降低。guo等人(pharmaceuticalresearch29:3102-3109,2012)描述了使用疏水性盐来实现四种模型单克隆抗体的低粘度水溶液。guo所使用的单克隆抗体制剂在添加盐前具有不大于73cp的初始粘度。此外,多种药学上重要的单克隆抗体在治疗相关浓度时的粘度可超过1,000cp。
在高浓度单克隆抗体溶液中控制聚集和粘度不是无关紧要的事情(ep2538973)。这被目前市场上呈高浓度制剂(>100mg/ml)形式的寥寥几种单克隆抗体产品所证实(ep2538973)。
上文引用的参考文献表明虽然多个小组已试图制备单克隆抗体和其它在治疗上重要的蛋白质的低粘度制剂,但是对于多种蛋白质尚未获得真正有用的制剂。值得注意的是,上述多篇报道使用了尚未完全建立安全性和毒性特征的物质。因此,这些制剂与含有已知是安全的化合物的制剂相比在获批前会面临较高的规章负担。事实上,即使化合物被证实大幅降低粘度,所述化合物也可能最终不适用于旨在注射到人体中的制剂。
由于大蛋白质的浓缩溶液的高粘度和其它性质所带来的问题,多种药学上重要的高分子量蛋白质诸如单克隆抗体目前经由静脉内输注来给药以递送治疗有效量的蛋白质。例如,为了在小于约2ml的体积中提供治疗有效量的多种高分子量蛋白质诸如单克隆抗体,通常需要大于150mg/ml的蛋白质浓度。
因此,本发明的目的是提供药学上重要的蛋白质特别是高分子量蛋白质诸如单克隆抗体的浓缩的低粘度液体制剂。
本发明的另一个目的是提供蛋白质特别是高分子量蛋白质诸如单克隆抗体的浓缩的低粘度液体制剂,其能够在可用于皮下和肌内注射的体积中递送治疗有效量的这些蛋白质。
本发明的另一个目的是提供蛋白质特别是高分子量蛋白质诸如单克隆抗体的具有低粘度的浓缩的低粘度液体制剂,所述低粘度可改善可注射性和/或患者顺应性、方便性和舒适性。
本发明的目的还在于提供用于制备和储存蛋白质特别是高分子量蛋白质诸如单克隆抗体的浓缩的低粘度制剂的方法。
本发明的另一个目的是提供给药蛋白质特别是高分子量蛋白质诸如单克隆抗体的浓缩的低粘度液体制剂的方法。本发明的另一个目的是提供用本领域技术人员已知的浓缩和过滤技术加工粘度降低的高浓度生物制剂的方法。
技术实现要素:
已开发出蛋白质的浓缩的低粘度低体积液体药物制剂。此类制剂可通过皮下(sc)或肌内(im)注射而不是通过长时间静脉内输注来快速且方便地给药。这些制剂包含低分子量和/或高分子量蛋白质诸如单克隆抗体及有机磷酸酯。代表性有机磷酸酯包括焦磷酸硫胺素(tpp)、三磷酸腺苷(atp)、三磷酸脱氧腺苷(datp)、三磷酸脱氧鸟苷(dgtp)、三磷酸脱氧胸苷(dttp)、三磷酸脱氧胞苷(dctp)、环腺苷酸(camp)、烟酰胺腺嘌呤二核苷酸磷酸(nadp+)和磷酸吡哆醛及其盐,其浓度优选为约0.01m至约0.50m,最优选约0.05m至约0.25m。
蛋白质的浓度为约10mg/ml至约5,000mg/ml,更优选约100mg/ml至高达约2,000mg/ml。在一些实施方案中,蛋白质的浓度为约100mg/ml至约500mg/ml,更优选约300mg/ml至高达约500mg/ml。含有蛋白质和有机磷酸酯的制剂当在4℃的温度储存时稳定的时间为至少一个月,优选至少两个月且最优选至少三个月。所述制剂的粘度在约25℃小于约75cp,优选低于50cp且最优选低于20cp。在一些实施方案中,所述粘度在约25℃小于约15cp或甚至小于或为约10cp。在一些实施方案中,所述制剂的粘度为约10cp。含有蛋白质和有机磷酸酯的制剂当使用锥板式粘度计来测量时通常在约0.6s-1至约450s-1且优选约2s-1至约400s-1的剪切速率测量。含有蛋白质和有机磷酸酯的制剂当使用微流体粘度计来测量时通常在约3s-1至约55,000s-1且优选约20s-1至约2,000s-1的剪切速率测量。
蛋白质制剂的粘度由于存在一种或多种使粘度降低的有机磷酸酯而降低。除非另有明确说明,否则术语“使粘度降低的有机磷酸酯”包括单一化合物和两种或更多种化合物的混合物。优选的是,存在于制剂中的一种或多种使粘度降低的有机磷酸酯的浓度小于约1.0m,优选小于约0.50m,更优选小于约0.30m且最优选小于约0.15m。所述制剂所具有的粘度可比在相同条件下除用约相同浓度的适当缓冲剂或盐代替使粘度降低的有机磷酸酯外的相应制剂的粘度低至少约30%,优选低至少约50%,最优选低至少约75%。在一些实施方案中提供低粘度制剂,其中不含使粘度降低的有机磷酸酯的相应制剂的粘度大于约200cp,大于约500cp或甚至高于约1,000cp。在优选实施方案中,所述制剂的剪切速率当使用锥板式粘度计来测量时为至少约0.5s-1或当使用微流体粘度计来测量时为至少约1.0s-1。
对于其中蛋白质为“高分子量蛋白质”的实施方案,高分子量蛋白质所具有的分子量可为约100kda至约500kda,优选约120kda至约1,000kda且最优选约120kda至约250kda。高分子量蛋白质可为抗体诸如单克隆抗体或其聚乙二醇化或其它衍生形式。优选的单克隆抗体包括那他珠单抗(natalizumab)
在一些实施方案中,将蛋白质和使粘度降低的有机磷酸酯提供在冻干剂量单元中,其大小适于用无菌水性药用媒介物复溶以产生浓缩的低粘度液体制剂。与不含使粘度降低的有机磷酸酯的冻干剂量单元相比,一种或多种使粘度降低的有机磷酸酯的存在有助于和/或加速冻干剂量单元的复溶。
本文提供用于制备高分子量蛋白质诸如单克隆抗体的浓缩的低粘度液体制剂的方法及用于储存低粘度高浓度蛋白质制剂和将其给药于患者的方法。在另一个实施方案中,添加使粘度降低的有机磷酸酯以通过降低蛋白质溶液的粘度而有助于加工(例如泵送、浓缩和/或过滤)。本文中高分子量蛋白质的浓度为约10mg/ml至约5,000mg/ml,最优选约100mg/ml至约2,000mg/ml。所述制剂的粘度小于约75cp,优选低于50cp且最优选低于20cp。在一些实施方案中,所述粘度小于约15cp或甚至小于约10cp。
本发明还涉及以下实施方案:
实施方案1.用于注射的液体药物制剂,其包含
(i)一种或多种蛋白质;
(ii)一种或多种使粘度降低的有机磷酸酯;和
(iii)药用溶剂;
其中当所述蛋白质与溶剂和有机磷酸酯在适于注射的体积中组合时,所述制剂在25℃具有约1cp至约50cp的绝对粘度,其使用锥板式粘度计来测量;且所述制剂的绝对粘度小于其它方面相同但包含等量的磷酸钠代替所述有机磷酸酯的制剂的绝对粘度;
其中每种情况下的绝对粘度为外推零剪切粘度。
实施方案2.实施方案1的制剂,其中所述一种或多种蛋白质是分子量为约70kda至100kda、约100kda至约250kda或约250kda至约500kda的高分子量蛋白质。
实施方案3.实施方案1和2中任一项的制剂,其中所述蛋白质的分子量为约120kda至约250kda。
实施方案4.实施方案1-3中任一项的制剂,其中至少一种所述蛋白质为酶、抗体或抗体片段、融合蛋白或聚乙二醇化蛋白质。
实施方案5.实施方案1-4中任一项的制剂,其中所述一种或多种蛋白质以约100mg至约2,000mg/1ml(mg/ml)的组合量存在;任选以大于约150mg/ml的组合量存在。
实施方案6.实施方案1-5中任一项的制剂,其中所述制剂包含至少两种不同的蛋白质,优选其中所述蛋白质的分子量均为至少约50kda。
实施方案7.实施方案1-6中任一项的制剂,其中在添加有机磷酸酯前在相同蛋白质浓度时的初始绝对粘度超过约60cp,超过约80cp或超过约100cp。
实施方案8.实施方案1-7中任一项的制剂,其中所述液体制剂是ph为约5.0至约8.0的水溶液。
实施方案9.实施方案1-8中任一项的制剂,其包含以约0.01m至约1.0m的浓度存在的所述有机磷酸酯。
实施方案10.实施方案1-9中任一项的制剂,其包含以小于0.30m或小于0.15m的量存在的所述有机磷酸酯。
实施方案11.实施方案1-10中任一项的制剂,其包含一种或多种选自以下的用于皮下或肌内注射的药用赋形剂:糖或糖醇、缓冲剂、防腐剂、载体、抗氧化剂、螯合剂、天然或合成的聚合物、冷冻保护剂、冻干保护剂、表面活性剂、填充剂和稳定剂。
实施方案12.实施方案11的制剂,其中一种或多种所述赋形剂选自聚山梨醇酯、泊洛沙姆188、月桂基硫酸钠、选自糖醇诸如甘露醇和山梨醇、聚(乙二醇)、甘油、丙二醇和聚(乙烯醇)的多元醇。
实施方案13.实施方案11的制剂,其中所述表面活性剂以小于约10mg/ml的量存在。
实施方案14.实施方案12的制剂,其包含以约2mg/ml至约900mg/ml的量存在的多元醇。
实施方案15.实施方案1-14中任一项的制剂,其中所述绝对粘度在25℃为约5cp至约50cp。
实施方案16.实施方案1-15中任一项的制剂,其中所述绝对粘度比不含所述有机磷酸酯的除用约相同浓度的合适缓冲剂代替所述有机磷酸酯外在相同条件下测量的制剂的绝对粘度低至少约30%。
实施方案17.实施方案1-16中任一项的制剂,其中所述绝对粘度是不含所述有机磷酸酯的除用约相同浓度的合适缓冲剂代替所述有机磷酸酯外在相同条件下测量的制剂的绝对粘度的至多约二分之一或四分之一。
实施方案18.实施方案1-17中任一项的制剂,其呈单位剂量小瓶、容器或预填充注射器形式。
实施方案19.实施方案18的制剂,其中所述蛋白质、有机磷酸酯和/或赋形剂呈干燥形式,优选是冻干的。
实施方案20.实施方案1-19中任一项的制剂,其中当有机磷酸酯、蛋白质和溶剂组合时,所述制剂的体积就皮下注射而言小于约1.5ml且就肌内注射而言小于约3ml。
实施方案21.实施方案1-20中任一项的制剂,其中所述制剂对于人类血清为等张的。
实施方案22.实施方案1-21中任一项的制剂,在将所述制剂给药于有此需要的人类的条件下,所述制剂在流变学上基本表现为牛顿液体。
实施方案23.实施方案1-22中任一项的制剂,其与相同剂量的通过静脉内输注来给药的所述蛋白质相比实现了治疗上有效的给药。
实施方案24.实施方案1-23中任一项的制剂,其中当经由皮下或肌内注射来给药时,所述一种或多种有机磷酸酯的存在浓度不引起显著的毒性迹象或注射部位刺激。
实施方案25.实施方案1-24中任一项的制剂,其中当使用锥板式粘度计来测量时,所述制剂的绝对粘度以至少约0.5s-1的剪切速率来测量。
实施方案26.实施方案1-24中任一项的制剂,其中当使用微流体粘度计来测量时,所述制剂的绝对粘度以至少约1.0s-1的剪切速率来测量。
实施方案27.给药治疗有效量的蛋白质的方法,所述方法包括皮下或肌内注射实施方案1-26中任一项的制剂。
实施方案28.实施方案27的方法,其中所述皮下或肌内注射用选自以下的注射器进行:经加热的注射器、自混合式注射器、自动注射器、预填充注射器及其组合。
实施方案29.实施方案28的方法,其中所述注射器为经加热的注射器,且在25℃至40℃的温度给药所述制剂。
实施方案30.实施方案27-29中任一项的方法,其中当使用draize评分系统来评价时,所述制剂引起小于3的主要刺激指数。
实施方案31.实施方案27-30中任一项的方法,其中注射力比其它方面相同但不含所述有机磷酸酯的以相同方式给药的制剂的注射力小至少10%或20%。
实施方案32.实施方案27-31中任一项的方法,其中所述注射用直径为27至31号的针头进行,且用27号针头的注射力小于30n。
实施方案33.制备药物制剂的方法,所述方法包括组合实施方案1-26中任一项的蛋白质、溶剂和有机磷酸酯的步骤。
实施方案34.实施方案33的方法,其中所述制剂呈预填充注射器或筒形式。
实施方案35.促进蛋白质纯化的方法,所述方法包括向蛋白质溶液中添加有效量的实施方案1或7-10中任一项的有机磷酸酯以降低所述蛋白质溶液的粘度。
实施方案36.实施方案35的方法,其中所述蛋白质-有机磷酸酯溶液使用选自以下的方法来纯化或浓缩:超滤/渗滤、切向流动过滤、离心浓缩和透析。
附图说明
图1描绘了生物类似物
具体实施方式
i.定义
本文通常使用的术语“蛋白质”是指氨基酸的聚合物,所述氨基酸通过肽键彼此连接以形成其链长足以产生可检测的至少三级结构的多肽。分子量(以kda表示,其中“da”代表“道尔顿”且1kda=1,000da)大于约100kda的蛋白质可被指定为“高分子量蛋白质”,而分子量小于约100kda的蛋白质可被指定为“低分子量蛋白质”。术语“低分子量蛋白质”不包括以下小肽,所述小肽缺乏被认为是蛋白质所需要的必需条件即至少三级结构。蛋白质分子量可使用本领域技术人员已知的标准方法来确定,包括但不限于质谱(例如esi、maldi)或由已知的氨基酸序列和糖基化来计算。蛋白质可为天然存在或非天然存在、合成或半合成的。
“大体纯的蛋白质”和“基本纯的蛋白质”在本文中可互换使用且是指包含至少约90wt%纯蛋白质优选至少约95wt%纯蛋白质的组合物。“大体均质”和“基本均质”在本文中可互换使用且是指以下组合物,其中所存在的蛋白质的至少约90wt%优选至少约95wt%为单体及可逆性二聚和寡聚缔合物(不是不可逆性聚集体)的组合。
本文通常使用的术语“抗体”宽泛地涵盖单克隆抗体(包括具有免疫球蛋白fc区的全长抗体)、具有聚表位特异性的抗体组合物、双特异性抗体、双抗体和单链抗体分子及抗体片段(例如fab、fab’、f(ab’)2和fv)、单域抗体、多价单域抗体、fab融合蛋白及其融合体。
本文通常使用的术语“单克隆抗体”或“mab”是指从基本均质的抗体群中获得的抗体,即构成群的各个抗体是相同的,除了可少量存在的可能的天然存在的突变。单克隆抗体针对单个表位是高度特异性的。例如,这些抗体通常通过如kohler等人(nature256:495,1975)所述那样培养杂交瘤细胞来合成或可通过重组dna方法(参见例如美国专利4,816,567)来制备或使用clackson等人(nature352:624-628,1991)和marks等人(j.mol.biol.222:581-597,1991)所述的技术从噬菌体抗体库中分离。本文使用的“单克隆抗体”具体包括衍生化抗体、抗体-药物缀合物和“嵌合”抗体(其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而所述链的其余部分与衍生自另一个物种或属于另一个抗体类别或亚类的抗体中的相应序列相同或同源)及这些抗体的片段,只要其展现出所期望的生物学活性(美国专利号4,816,567;morrison等人,proc.natl.acad.sci.usa81:6851-6855,1984)。
“抗体片段”包含完整抗体的一部分,包括完整抗体的抗原结合区和/或可变区。抗体片段的实例包括fab、fab’、f(ab’)2和fv片段;双抗体;线性抗体(参见美国专利号5,641,870;zapata等人,proteineng.8:1057-1062,1995);单链抗体分子;多价单域抗体;和由抗体片段形成的多特异性抗体。
非人类(例如鼠类)抗体的“人源化”形式是大部分人源序列的嵌合免疫球蛋白、免疫球蛋白链或其片段(诸如fv、fab、fab’、f(ab’)2或抗体的其它抗原结合亚序列),其含有衍生自非人类免疫球蛋白的最小序列(参见例如jones等人,nature321:522-525,1986;reichmann等人,nature332:323-329,1988;和presta,curr.op.struct.biol.2:593-596,1992)。
“流变学”是指对物质的变形和流动进行的研究。
“粘度”是指物质(通常为液体)对流动的阻力。粘度与剪切力的概念相关;其可被理解为流体的不同层当它们彼此相对移动时彼此施加剪切力或对其它表面施加剪切力的效果。有若干种粘度测量方法。粘度的单位是ns/m2,称为帕斯卡-秒(pa-s)。粘度可为“动力的”或“绝对的”。动力粘度是对动量通过流体传递的速率的量度。其以史托(st)进行测量。动力粘度是对流体在重力影响下的阻力性流动的量度。当将体积相等但粘度不同的两种流体置于相同的毛细管粘度计中并使其依靠重力流动时,与较低粘性的流体相比,较高粘性的流体需要较长的时间流动通过毛细管。例如,若一种流体需要200秒(s)完成其流动,而另一种流体需要400s,则称第二种流体的粘度在动力粘度量表上两倍于第一种流体。动力粘度的量纲是长度2/时间。通常,动力粘度以厘史托(cst)表示。动力粘度的si单位是mm2/s,其等于1cst。“绝对粘度”(有时称为“动态粘度”或“单纯粘度”)是动力粘度和流体密度的乘积。绝对粘度以厘泊(cp)为单位表示。绝对粘度的si单位是毫帕斯卡-秒(mpa-s),其中1cp=1mpa-s。粘度可通过使用例如粘度计在给定的剪切速率或多个剪切速率进行测量。“外推零剪切”粘度可如下确定:创建绝对粘度对剪切速率的曲线上的四个最高剪切点的最佳拟合线且线性外推粘度回至零剪切。可选择地,对于牛顿流体,粘度可通过在多个剪切速率的平均粘度值来确定。粘度也可使用微流体粘度计在单个或多个剪切速率(也称为流速)进行测量,其中绝对粘度得自液体流经通道时压力的变化。粘度等于剪切应力比剪切速率。在一些实施方案中,用微流体粘度计测量的粘度可直接与外推零剪切粘度例如由使用锥板式粘度计在多个剪切速率测量的粘度外推的那些粘度进行比较。
“剪切速率”是指一层流体在相邻层上经过时粘度的变化率。速度梯度是速度随着与板的距离的变化率。该简单的情况显示了其中单位为(cm/秒)/(cm)的剪切速率(v1-v2)/h=1/秒的均匀速度梯度。因此,剪切速率的单位为倒数秒或通常为倒数时间。对于微流体粘度计,压力和流速的变化与剪切速率相关。“剪切速率”用于指使材料发生变形的速度。当使用锥板式粘度计和本领域技术人员所适当选择的梭杆进行测量时,含蛋白质和有机磷酸酯的制剂通常在剪切速率为约0.5s-1至约200s-1时测量以在感兴趣的样品的粘度范围内精确地测量粘度(即20cp的样品用固定于dv2t粘度计(brookfield)的cpe40梭杆最精确地测量);当使用微流体粘度计进行测量时,剪切速率大于约20s-1至约3,000s-1。
对于本文通常使用的经典“牛顿”流体,粘度与剪切速率基本无关。然而,对于“非牛顿流体”,粘度随着剪切速率增加而降低或增加,例如流体分别是“剪切稀化”或“剪切增稠”的。在浓缩的(即高浓度)蛋白质溶液的情况下,这可表现为假塑性剪切稀化行为,即粘度随着剪切速率而降低。
本文通常使用的术语“化学稳定性”是指制剂中的蛋白质组分抵抗化学途径诸如氧化、脱酰胺或水解所致降解的能力。若小于约5%的组分在4℃保存24个月后发生降解,则蛋白质制剂通常被认为是化学稳定的。
本文通常使用的术语“物理稳定性”是指蛋白质制剂抵抗物理变质诸如聚合的能力。物理稳定的制剂仅形成可接受的百分比的生物活性蛋白质的不可逆性聚集体(例如二聚体、三聚体或其它聚集体)。聚集体的存在可通过多种方式来评价,包括通过借助动态光散射来测量制剂中蛋白质的平均粒度。若所形成的不可逆性聚集体在4℃保存24个月后小于约5%,则制剂被认为是物理稳定的。聚集的杂质的可接受的水平理想地应小于约2%。虽然低至约0.2%的水平是可以实现的,但是约1%是较典型的。
本文通常使用的术语“稳定的制剂”是指既化学稳定又物理稳定的制剂。稳定的制剂可为以下制剂,其中制剂中超过约95%的生物活性蛋白质分子在4℃储存24个月后或在高温等效处理条件下诸如在40℃储存1个月后仍然保留生物活性。用于测量蛋白质稳定性的各种分析技术在本领域中是可得到的并参见例如peptideandproteindrugdelivery,247-301,vincentlee,ed.,marceldekker,inc.,newyork,n.y.(1991)和jones,a.,adv.drugdeliveryrevs.10:29-90,1993。稳定性可在所选择的温度测量一定的时段。例如,为了进行快速筛选,可将制剂在40℃保存2周至1个月,然后测量剩余的生物活性并与初始条件进行比较以评价稳定性。当制剂在2℃-8℃储存时,制剂通常应当在30℃或40℃稳定至少1个月和/或在2℃-8℃稳定至少2年。当制剂在室温即约25℃储存时,制剂通常应当在约25℃稳定至少2年和/或在40℃稳定至少约6个月。冻干和储存后聚集的程度可用作蛋白质稳定性的指标。在一些实施方案中,稳定性通过测量制剂中蛋白质的粒度来评价。在一些实施方案中,稳定性可如下评价:使用本领域技术人员已知的标准生物学活性或结合测定来测量制剂的活性。
本文通常使用的术语“蛋白质粒度”是指当通过使用已知的粒度仪例如动态光散射、sec(尺寸排阻色谱)或本领域技术人员已知的其它方法来测定时,制剂中生物活性分子颗粒的主要群体的平均直径或其粒度分布。
本文通常使用的术语“浓缩的”或“高浓度”描述了以下液体制剂,其所具有的蛋白质的最终浓度大于约10mg/ml,优选大于约50mg/ml,更优选大于约100mg/ml,更优选大于约200mg/ml或最优选大于约250mg/ml。
本文通常使用的“复溶制剂”是指如下制备的制剂:将干燥粉末即冻干、喷雾干燥或由溶剂析出的蛋白质溶解在稀释剂中,从而将蛋白质溶解或分散在用于给药的水溶液中。
“冻干保护剂”是以下物质,其当与蛋白质组合时在冻干和/或后续储存过程中显著降低蛋白质的化学和/或物理不稳定性。示例性冻干保护剂包括糖及其相应的糖醇,诸如蔗糖、乳糖、海藻糖、葡聚糖、赤藓醇、阿糖醇、木糖醇、山梨醇和甘露醇;氨基酸,诸如精氨酸或组氨酸;易溶盐,诸如硫酸镁;多元醇,诸如丙二醇、甘油、聚(乙二醇)或聚(丙二醇);及其组合。其它示例性冻干保护剂包括明胶、糊精、改性淀粉和羧甲基纤维素。优选的糖醇是通过对单糖和二糖诸如乳糖、海藻糖、麦芽糖、乳果糖和麦芽酮糖进行还原而得到的那些化合物。糖醇的其它实例是葡萄糖醇、麦芽糖醇、乳糖醇和异麦芽酮糖。通常以“冻干保护量”向预冻干制剂中添加冻干保护剂。这是指在冻干保护量的冻干保护剂存在下对蛋白质进行冻干后,蛋白质基本保留其物理和化学稳定性及完整性。
本文通常使用的“稀释剂”或“载体”是药学上可接受的(即就向人类或其它哺乳动物给药而言是安全且无毒的)且可用于制备液体制剂(诸如冻干后复溶的含水制剂)的成分。示例性稀释剂包括无菌水、注射用抑菌水(bwfi)、ph缓冲溶液(例如磷酸盐缓冲盐水)、无菌盐水溶液、林格溶液或葡萄糖溶液及其组合。
“防腐剂”是以下化合物,可将其添加到本发明制剂中以减少由细菌、真菌或其它感染原所引起的污染和/或作用。例如,防腐剂的添加可有助于生产多次使用(多剂量)制剂。潜在的防腐剂的实例包括十八烷基二甲基苄基氯化铵、氯己双铵、苯扎氯铵(氯化烷基苄基二甲基铵的混合物,其中所述烷基为长链的)和苄索氯铵。其它类型的防腐剂包括芳族醇,诸如苯酚、丁醇和苄醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚。
本文通常使用的“填充剂”是以下化合物,其增加冻干混合物的质量并促成冻干饼的物理结构(例如有助于产生基本均匀的保持开孔结构的冻干饼)。示例性填充剂包括甘露醇、甘氨酸、乳糖、改性淀粉,聚(乙二醇)和山梨醇。
“治疗有效量”是实现任何症状或特定病症或障碍的可测量的改善或预防、实现预期寿命的可测量的延长或大体改善患者生活质量所需要的最小浓度。治疗有效量取决于具体生物活性分子和待治疗的具体病症或障碍。多种蛋白质诸如本文所述的单克隆抗体的治疗有效量是本领域已知的。尚未确定的蛋白质的治疗有效量或已知的蛋白质诸如单克隆抗体用于治疗特定障碍和临床用于治疗其它障碍的治疗有效量可通过本领域技术人员诸如医师已知的标准技术来确定。
本文通常使用的术语“可注射性”或“通针性”是指药物制剂通过配备有18-32号针头的注射器的注射性能。可注射性取决于多种因素诸如注射所需要的压力或力量、流动的均匀性、吸入量和堵塞的避免。液体药物制剂的可注射性可通过对粘度降低制剂的注射力与没有添加使粘度降低的有机磷酸酯的标准制剂的注射力进行比较来评价。含使粘度降低的有机磷酸酯的制剂的注射力的降低反映了该制剂的改善的可注射性。当与在相同条件下除用约相同浓度的适当缓冲液代替使粘度降低的有机磷酸酯外的具有相同蛋白质浓度的标准制剂相比注射力降低至少10%、优选至少30%、更优选至少50%和最优选至少75%时,粘度降低制剂具有改善的可注射性。可选择地,液体药物制剂的可注射性可如下评价:比较当用相同力量按压注射器时注射相同体积诸如0.5ml或更优选约1ml的不同液体蛋白质制剂所需要的时间。
本文通常使用的术语“注射力”是指以给定的注射速度推动给定的液体制剂通过配备有给定大小的针头的给定的注射器所需要的力。注射力通常以牛顿报道。例如,可将注射力测量为以250mm/min的注射速度推动液体制剂通过内径为0.25英寸的配备有0.50英寸27号针头的1ml塑料注射器所需要的力。测试设备可用于测量注射力。当在相同条件下测量时,具有较低粘度的制剂通常将需要整体较低的注射力。
在一个实施方案中,用27号针头进行注射且注射力小于30n。在大多数情况下,制剂可使用非常小号的针头来给药,例如27至31号,通常27、29或31号,任选薄壁的。
本文使用的“粘度梯度”是指蛋白质溶液的粘度当蛋白质浓度增加时的变化率。粘度梯度可由以下曲线图来近似,所述曲线图为粘度对其它方面相同但蛋白质浓度不同的一系列制剂的蛋白质浓度的函数。随着蛋白质浓度增加,粘度以近似指数的方式增加。特定蛋白质浓度时的粘度梯度可由以下曲线图的切线的斜率来近似,所述曲线图为粘度对蛋白质浓度的函数。粘度梯度可由以下曲线图的线性近似来近似,所述曲线图为粘度对任何蛋白质浓度的函数或蛋白质浓度的窄窗口处的曲线图。在一些实施方案中,当粘度对蛋白质浓度的函数近似为指数函数时,若所述指数函数的指数小于就其它方面相同但不含使粘度降低的有机磷酸酯的制剂所得到的指数,则认为制剂具有降低的粘度梯度。以类似的方式,当与第二种制剂比较时,若制剂的指数低于/高于第二种制剂的指数,则认为制剂具有较低/较高的粘度梯度。粘度梯度可通过熟练的制剂研究人员所已知的其它方法由粘度对蛋白质浓度的函数的曲线图进行数值近似。
本文通常使用的术语“粘度降低制剂”是指具有高浓度的高分子量蛋白质诸如单克隆抗体或低分子量蛋白质的液体制剂,所述液体制剂与不含一种或多种使粘度降低的添加剂的相应制剂相比通过存在一种或多种使粘度降低的添加剂来改性。
本文通常使用的术语“摩尔渗透压浓度”是指每升中所溶解的组分的总数。摩尔渗透压浓度类似于摩尔浓度,但是包括溶液中所溶解的各种物质的摩尔总数。1osm/l的摩尔渗透压浓度是指在每升溶液中有1摩尔所溶解的组分。一些溶质诸如在溶液中离解的离子性溶质将在溶液中贡献超过1摩尔所溶解的组分/摩尔溶质。例如,nacl在溶液中离解成na+和cl-且由此在溶液中提供2摩尔所溶解的组分/1摩尔所溶解的nacl。生理学摩尔渗透压浓度通常为约280mosm/l至约310mosm/l。
本文通常使用的术语“张力”是指通过半透膜使两种溶液分离所引起的渗透压梯度。具体地,张力用于描述当细胞暴露于外部溶液时在细胞膜两侧产生的渗透压。可穿过细胞膜的溶质不促成最终的渗透压梯度。只有那些不能穿过细胞膜的所溶解的物质将促成渗透压差及由此促成张力。
本文通常使用的术语“高张性”是指溶液所具有的溶质浓度高于在细胞内侧存在的溶质浓度。当将细胞浸入到高张性溶液中时,趋势是水从细胞中流出以平衡溶质的浓度。
本文通常使用的术语“低张性”是指溶液所具有的溶质浓度低于在细胞内侧存在的溶质浓度。当将细胞浸入到低张性溶液中时,水流到细胞中以平衡溶质的浓度。
本文通常使用的术语“等张性”是指其中在细胞膜两侧的渗透压梯度基本平衡的溶液。等张性制剂是具有与人类血液基本相同的渗透压的制剂。等张性制剂通常将具有约250mosm/kg至350mosm/kg的渗透压。
本文使用的术语“液体制剂”是在可接受的药物稀释剂中提供的蛋白质或向患者给药前在可接受的药物稀释剂中复溶的蛋白质。
术语“品牌”和“参照”当用于指蛋白质或生物制品时在本文中可互换使用且是指根据美国公共卫生服务法案(42u.s.c.§262)第351(a)条所许可的单个生物制品。
本文使用的术语“生物类似物”通常与“一般等价物”或“第二代产品”互换使用。例如,“生物类似物单克隆抗体”是指创新者的单克隆抗体的通常由另一家公司生产的后续变体。“生物类似物”当用于指品牌蛋白质或品牌生物制品时可指相对于品牌蛋白质或品牌生物制品进行评价并根据美国公共卫生服务法案(42u.s.c.§262)第351(k)条所许可的生物制品。生物类似物单克隆抗体可为满足由欧洲药品监督管理局人用药品委员会(chmp)在2012年5月30日正式通过且由欧盟公开为“guidelineonsimilarbiologicalmedicinalproductscontainingmonoclonalantibodies-non-clinicalandclinicalissues”的一个或多个指导方针(参考文献ema/chmp/bmwp/403543/2010)的生物类似物单克隆抗体。
生物类似物可通过微生物细胞(原核、真核)、人类或动物来源(例如哺乳动物、鸟类、昆虫)的细胞系或衍生自动物或植物的组织来产生。所提出的生物类似物产物的表达构建体通常将编码与其参照产物相同的主要氨基酸序列。可存在小的修改诸如不会对安全性、纯度或效力产生影响的n-或c-末端截短。
生物类似物单克隆抗体在安全性和有效性方面与参照单克隆抗体是物理化学或生物学类似的。生物类似物单克隆抗体可相对于参照单克隆抗体使用包括细节如下的测定在内的一种或多种体外研究来评价:结合于一种或多种目标抗原;结合于fcγ受体(fcγri、fcγrii和fcγriii)、fcrn和补体(c1q)的同工型;fab相关功能(例如可溶性配体的中和、受体活化或阻断);或fc相关功能(例如抗体依赖性由细胞介导的细胞毒性、补体依赖性细胞毒性、补体活化)。体外比较可与使药物动力学、药效学和/或安全性的相似性得以证实的体内数据组合。相对于参照单克隆抗体对生物类似物单克隆抗体进行的临床评价可包括比较药物动力学性质(例如auc0-inf、auc0-t、cmax、tmax、ctrough);药效学终点;或临床效果的相似性(例如使用随机平行组比较性临床试验)。生物类似物单克隆抗体和参照单克隆抗体之间的质量比较可使用已确定的程序来评价,包括“guidelineonsimilarbiologicalmedicinalproductscontainingbiotechnology-derivedproteinsasactivesubstance:qualityissues”(emea/chmp/bwp/49348/2005)和“guidelineondevelopment,production,characterizationandspecificationsformonoclonalantibodiesandrelatedsubstances”(emea/chmp/bwp/157653/2007)所述的那些程序。
生物类似物单克隆抗体与参照单克隆抗体之间的差异可包括翻译后修饰,例如通过使其它生化基团诸如磷酸酯、各种脂质和碳水化合物接附到单克隆抗体;通过在翻译后进行蛋白质水解裂解;通过改变氨基酸的化学性质(例如甲酰化);或通过多种其它机制。其它翻译后修饰可为制备过程操作的结果,例如糖基化可在产物暴露于还原性糖的情况下发生。在其它情况下,储存条件可允许一些降解途径诸如氧化、脱酰胺或聚集。所有这些产物相关变体都可包含在生物类似物单克隆抗体中。
本文使用的术语“药用盐”是指由药用无毒酸和碱(包括无机酸和碱及有机酸和碱)制备的盐。合适的无毒酸包括无机和有机酸诸如乙酸、苯磺酸、苯甲酸、樟脑磺酸、枸橼酸、乙磺酸、富马酸、葡糖酸、谷氨酸、氢溴酸、盐酸、羟乙磺酸、乳酸、马来酸、苹果酸、扁桃酸、甲磺酸、粘液酸、硝酸、扑酸、泛酸、磷酸、琥珀酸、硫酸、酒石酸和对甲苯磺酸。合适的带正电荷的抗衡离子包括钠、钾、锂、钙和镁。
本文使用的术语“离子性液体”是指以下结晶性或无定形的盐、两性离子或其混合物,其在大多数常规盐是固体的温度或在该温度附近是液体,所述温度小于200℃,优选小于100℃或更优选小于80℃。一些离子性液体具有在室温附近的熔融温度例如10℃至40℃或15℃至35℃。术语“两性离子”在本文中用于描述以下电荷总体为中性的分子,其在分子的不同化学基团上带有形式为正的电荷和形式为负的电荷。离子性液体的实例参见riduan等人,chem.soc.rev.,42:9055-9070,2013;rantwijk等人,chem.rev.,107:2757-2785,2007;earle等人,pureappl.chem.,72(7):1391-1398,2000;和sheldon等人,greenchem.,4:147-151,2002。
本文使用的“水溶性有机染料”是以下有机分子,其在25℃和ph7的情况下具有至少0.001m的摩尔溶解度且吸收一些波长的光优选电磁波谱的可见光至红外线部分同时可透射或反射其它波长的光。
本文使用的术语“硫族元素”是指第16族元素,包括呈任何氧化态的氧、硫和硒。例如,除非另有说明,否则术语“硫族元素”还包括so2。
本文使用的术语“烷基”是指直链、支链和环状烃基。除非另有说明,否则术语“烷基”包括含有一个或多个双键或叁键的烃基。含有至少一个环系的烷基是“环烷基”。含有至少一个双键的烷基是“烯基”,且含有至少一个叁键的烷基是“炔基”。
本文使用的“芳基”是指包括稠环系统在内的芳族碳环系统。在“芳基”中,形成环的每个原子都为碳原子。
本文使用的“杂芳基”是指包括稠环系统在内的芳族环系统,其中形成环的至少一个原子为杂原子。
本文使用的“杂环”是指包括稠环系统在内的非芳族环系统,其中形成环的至少一个原子为杂原子。
本文使用的“杂原子”为任何非碳或非氢原子。优选的杂原子包括氧、硫和氮。示例性杂芳基和杂环基环包括苯并咪唑基、苯并呋喃基、苯并噻吩基、苯并噻吩基、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、4ah-咔唑基、咔啉基、色满基、色烯基、噌啉基、十氢喹啉基、2h,6h-1,5,2-二噻嗪基、二氢呋喃并[2,3-b]四氢呋喃基、呋喃基、呋咱基、咪唑烷基、咪唑啉基、咪唑基、1h-吲唑基、3h-吲哚基、二氢吲哚基、吲嗪基、吲哚基、3h-吲哚基、靛红酰基、异苯并呋喃基、异色满基、异吲唑基、异二氢吲哚基、异吲哚基、异喹啉基、异噻唑基、异噁唑基、亚甲基二氧基苯基、吗啉基、二氮杂萘基、十氢异喹啉基、噁二唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、噁唑烷基、噁唑基、羟吲哚基、嘧啶基、菲啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噻噁基、吩噁嗪基、酞嗪基、哌嗪基、哌啶基、哌啶酮基、4-哌啶酮基、胡椒基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑基、哒嗪基、吡唑并噁唑基、吡唑并咪唑基、吡唑并噻唑基、吡啶基、吡啶基、嘧啶基、吡咯烷基、吡咯啉基、2h-吡咯基、吡咯基、喹唑啉基、喹啉基、4h-喹嗪基、喹喔啉基、奎宁环基、四氢呋喃基、四氢异喹啉基、四氢喹啉基、四唑基、6h-1,2,5-噻二嗪基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基和呫吨基。
本文的术语“有机磷酸酯”是指含有一个或多个磷酰基的化合物,所述磷酰基中的至少一个通过磷酸酯键而共价连接到有机基团。有机磷酸酯可为天然存在或非天然存在、合成或半合成的。
本文使用的术语“核酸碱基”泛指经取代和未经取代的含氮杂芳环,优选同时具有氢键供给基团和氢键接受基团且能够与互补碱基形成watson-crick氢键。核酸碱基包括天然存在的核酸碱基和非天然存在的核酸碱基。非天然存在的核酸碱基包括在天然核酸中仅罕有或瞬时发现的核酸碱基例如次黄嘌呤、6-甲基腺嘌呤、5-甲基嘧啶诸如5-甲基胞嘧啶、5-羟基甲基胞嘧啶(hmc)、葡萄糖基hmc和龙胆二糖基hmc及合成的核酸碱基例如2-氨基腺苷、2-巯基尿嘧啶、2-巯基胸腺嘧啶、5-溴尿嘧啶、5-羟基甲基尿嘧啶、8-氮杂鸟嘌呤、7-脱氮杂鸟嘌呤、n6-(6-氨基己基)腺嘌呤和2,6-二氨基嘌呤。核酸碱基包括嘌呤和嘌呤碱基诸如腺嘌呤、鸟嘌呤、次黄嘌呤,黄嘌呤和7-甲基鸟嘌呤。核酸碱基包括嘧啶和嘧啶碱基诸如胸腺嘧啶、胞嘧啶、尿嘧啶、5,6-二氢尿嘧啶、5-甲基胞嘧啶和5-羟基甲基胞嘧啶。
一些有机磷酸酯含有酸性或碱性官能团。这些官能团是否完全或部分离子化取决于其所处制剂的ph。除非另有说明,否则当提及含有具有可离子化的官能团的有机磷酸酯的制剂时,既包括母体化合物,又包括任何可能的离子化状态。
本文使用的术语“核苷”是指其中核酸碱基共价偶联到优选呈其环状形式的五碳糖的任何化合物。五碳糖包括核糖、脱氧核糖、阿拉伯糖、木糖、来苏糖及其衍生物。
本文使用的术语“核苷酸”是指其中核苷在糖上的一个或多个位置共价偶联到磷酸酯基团或多磷酸酯基团例如二磷酸酯或三磷酸酯基团的任何化合物。
ii.制剂
生物相容性低粘度蛋白质溶液诸如单克隆抗体的那些生物相容性低粘度蛋白质溶液可用于以皮下(sc)和肌内(im)注射所适用的体积递送治疗有效量的蛋白质,通常对于皮下注射小于或为约2ml且对于肌内注射小于或为约5ml,更优选对于皮下注射小于或为约1ml且对于肌内注射小于或为约3ml。蛋白质通常可具有任何分子量,虽然在一些实施方案中,高分子量蛋白质是优选的。在其它实施方案中,蛋白质是低分子量蛋白质。
制剂所具有的蛋白质浓度可为约10mg/ml至约5,000mg/ml。包括单克隆抗体制剂在内的制剂所具有的蛋白质浓度可大于100mg/ml,优选大于150mg/ml,更优选大于约175mg/ml,更优选大于约200mg/ml,更优选大于约225mg/ml,更优选大于约250mg/ml且最优选大于或为约300mg/ml。在不存在有机磷酸酯的情况下,蛋白质制剂的粘度随着浓度增加而以指数方式增加。此类蛋白质制剂在不存在有机磷酸酯的情况下当在25℃测量时所具有的粘度可大于100cp,大于150cp,大于200cp,大于300cp,大于500cp或甚至大于1,000cp。此类制剂通常不适于皮下或肌内注射。一种或多种使粘度降低的有机磷酸酯的使用允许制备当在25℃测量时粘度小于或为约100cp、优选小于或为约75cp、更优选小于或为约50cp、小于或为约30cp、小于或为约20cp或甚至最优选小于或为约10cp的制剂。
虽然使粘度降低的有机磷酸酯可用于降低浓缩的蛋白质制剂的粘度,但是其也可用于浓缩程度较小的制剂。在一些实施方案中,制剂所具有的蛋白质浓度可为约10mg/ml至约100mg/ml。制剂所具有的蛋白质浓度可大于约20mg/ml,大于约40mg/ml或大于约80mg/ml。
对于一些蛋白质,不具有使粘度降低的有机磷酸酯的制剂所具有的粘度可大于约20cp,大于约50cp或大于约80cp。一种或多种使粘度降低的有机磷酸酯的使用允许制备当在25℃测量时粘度小于或为约80cp、优选小于或为约50cp、更优选小于约20cp或最优选小于或为约10cp的制剂。
在一些实施方案中,当在相同条件下测量时,所述含水蛋白质制剂的粘度比不含一种或多种使粘度降低的有机磷酸酯的类似制剂低至少约30%。在其它实施方案中,所述制剂的粘度比不含一种或多种使粘度降低的有机磷酸酯的类似制剂低40%,低50%,低60%,低70%,低80%,低90%或甚至低90%以上。在优选实施方案中,制剂在小于约2ml、优选小于约1ml或更优选小于约0.75ml的体积中含有治疗有效量的一种或多种高分子量蛋白质诸如单克隆抗体。
与其它条件相同但不含使粘度降低的有机磷酸酯(例如在磷酸钠缓冲液中)的类似制剂相比,粘度降低制剂具有改善的可注射性且需要较小的注射力。在一些实施方案中,与其它条件相同但不含一种或多种使粘度降低的有机磷酸酯的标准制剂相比,注射力降低超过约20%,超过约30%,超过约40%,超过约50%或超过约2倍。在一些实施方案中,所述制剂具有“牛顿流动特性”,其被定义为具有与剪切速率基本无关的粘度。可容易地将所述蛋白质制剂注射通过大小为约18-32号的针头。用于递送所述低粘度制剂的优选针头大小包括27、29和31号,任选薄壁的。
所述制剂可含有一种或多种其它赋形剂诸如缓冲剂、表面活性剂、糖和糖醇、其它多元醇、防腐剂、抗氧化剂和螯合剂。所述制剂具有适于给药但不引起显著不良副作用的ph和摩尔渗透压浓度。在一些实施方案中,浓缩的低粘度制剂的ph为5至8、5.5至7.6、6.0至7.6或5.5至6.5。
低粘度蛋白质制剂可在制剂开发中允许较大的灵活性。与其它方面相同但不含使粘度降低的有机磷酸酯的制剂相比,低粘度制剂可展现出较少依赖于蛋白质浓度的粘度变化。低粘度蛋白质制剂可允许增加蛋白质的浓度并降低蛋白质的给药频率。在一些实施方案中,低粘度蛋白质制剂含有2种或更多种、3种或更多种或4种或更多种不同的蛋白质。例如,可将2种或更多种单克隆抗体的组合提供在单一低粘度蛋白质制剂中。
因为可按比其它方面类似但不含使粘度降低的有机磷酸酯的蛋白质制剂高的蛋白质浓度向患者给药蛋白质(诸如单克隆抗体)制剂,所以可降低蛋白质的给药频率。例如,当蛋白质与使粘度降低的有机磷酸酯一起配制时,先前需要每天给药一次的蛋白质可每两天给药一次,每三天给药一次或甚至更不频繁地给药。目前需要在同一天(在一天的同一时间或不同时间)多次给药的蛋白质可按每天较少次的注射来给药。在一些情况下,频率可减少至每天一次单次注射。通过使每次注射给药的剂量增加多倍,可降低给药频率,例如由每2周一次降低至每6周一次。
在一些实施方案中,本文的液体制剂所具有的生理学摩尔渗透压浓度为例如约280mosm/l至约310mosm/l。在一些实施方案中,所述液体制剂所具有的摩尔渗透压浓度大于约250mosm/l,大于约300mosm/l,大于约350mosm/l,大于约400mosm/l或大于约500mosm/l。在一些实施方案中,所述制剂所具有的摩尔渗透压浓度为约200mosm/l至约2,000mosm/l或约300mosm/l至约1,000mosm/l。在一些实施方案中,所述液体制剂与人类血液是基本等张的。在一些情况下,所述液体制剂可为高张的。
可按任何量引入包括使粘度降低的有机磷酸酯在内的添加剂以实现液体制剂的所需粘度水平,只要所述量不是有毒或有害的且基本不干扰制剂的化学和/或物理稳定性。在一些实施方案中,一种或多种使粘度降低的有机磷酸酯可按以下浓度独立存在:小于约1.0m,优选小于约0.50m,小于或等于约0.30m或小于或等于0.15m。尤其优选的浓度包括约0.10m和约0.30m。对于一些具有两种或更多种使粘度降低的有机磷酸酯的实施方案,所述化合物优选但不必须以相同浓度存在。
使粘度降低的有机磷酸酯允许冻干剂量单元的较快复溶。剂量单元是蛋白质、使粘度降低的有机磷酸酯和其它赋形剂的冻干饼,向所述冻干饼中添加水、盐水或其它药用流体。在不存在使粘度降低的有机磷酸酯的情况下,通常需要10分钟或更长时间以使高蛋白质浓度的冻干饼完全溶解。当冻干饼含有一种或多种使粘度降低的有机磷酸酯时,使冻干饼完全溶解所需要的时间通常减少为原来的二分之一、五分之一或十分之一。在一些实施方案中,使蛋白质浓度大于或为约150、200或甚至300mg/ml的冻干饼完全溶解需要不到1分钟。
低粘度蛋白质制剂在制剂开发中允许较大的灵活性。与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的制剂相比,低粘度制剂展现出当蛋白质浓度增加时改变较少的粘度。与其它方面相同但不含使粘度降低的有机磷酸酯的制剂相比,低粘度制剂展现出降低的粘度梯度。
与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的蛋白质制剂的粘度梯度相比,所述蛋白质制剂的粘度梯度可为其二分之一、三分之一或甚至低于三分之一。对于蛋白质浓度为10ml/mg至2,000ml/mg的蛋白质制剂,所述蛋白质制剂的粘度梯度可小于2.0cpml/mg,小于1.5cpml/mg,小于1.0cpml/mg,小于0.8cpml/mg,小于0.6cpml/mg或小于0.2cpml/mg。通过降低制剂的粘度梯度,可在观察到粘度的指数增加前将蛋白质浓度增加至较高的水平。
a.蛋白质
可配制任何蛋白质,包括重组、分离或合成的蛋白质、糖蛋白或脂蛋白。这些蛋白质可为抗体(包括抗体片段和重组抗体)、酶、生长因子或激素、免疫调节因子、抗感染因子、抗增殖因子、疫苗或其它治疗性、预防性或诊断性蛋白质。在一些实施方案中,蛋白质所具有的分子量大于约150kda,大于160kda,大于170kda,大于180kda,大于190kda或大于200kda。
在一些实施方案中,蛋白质可为聚乙二醇化蛋白质。本文使用的术语“聚乙二醇化蛋白质”是指具有一种或多种聚(乙二醇)或其它隐形聚合物基团的蛋白质,所述一种或多种聚(乙二醇)或其它隐形聚合物基团共价接附到所述蛋白质,任选通过可与所述一种或多种聚合物基团不同的化学连接基。聚乙二醇化蛋白质的特征在于其通常降低的肾滤过、减少的网状内皮系统摄取和减弱的酶降解,从而导致例如延长的半衰期和提高的生物利用度。隐形聚合物包括聚(乙二醇);聚(丙二醇);聚(氨基酸)聚合物,诸如聚(谷氨酸)、聚(羟基乙基-l-天冬酰胺)和聚(羟基乙基-l-谷氨酰胺);聚(甘油);聚(2-噁唑啉)聚合物,诸如聚(2-甲基-2-噁唑啉)和聚(2-乙基-2-噁唑啉);聚(丙烯酰胺);聚(乙烯基吡咯烷酮);聚(n-(2-羟基丙基)甲基丙烯酰胺);及其共聚物和混合物。在优选实施方案中,聚乙二醇化蛋白质中的隐形聚合物是聚(乙二醇)或其共聚物。聚乙二醇化蛋白质可为随机聚乙二醇化的即具有一种或多种共价接附在蛋白质上的一个或多个非特异性位点的隐形聚合物或可按位点特异性方式通过使隐形聚合物共价接附到蛋白质上的一个或多个特异性位点来聚乙二醇化。位点特异性聚乙二醇化可例如使用具有一种或多种反应性官能团的活化隐形聚合物来实现。实例参见例如hoffman等人,progressinpolymerscience,32:922-932,2007。
在优选实施方案中,蛋白质为高分子量的且为抗体(最优选单克隆抗体)且在缓冲水溶液中当浓缩到足以就皮下注射而言按不超过1.0至2.0ml的体积和就肌内注射而言按不超过3.0至5.0ml的体积来注射治疗有效量时具有高粘度。高分子量蛋白质可包括以下文献所述的那些高分子量蛋白质:scolnik,mabs1:179-184,2009;beck,mabs3:107-110,2011;baumann,curr.drugmeth.7:15-21,2006;或federici,biologicals41:131-147,2013。用于本文所述制剂的蛋白质优选是大体纯和大体均匀的(即基本不含其污染性蛋白质和/或不可逆性聚集物)。
本文优选的单克隆抗体包括那他珠单抗
本文所述抗体的示例性分子靶标包括cd蛋白,诸如cd3、cd4、cd8、cd19、cd20和cd34;her受体家族成员,诸如egf受体、her2、her3或her4受体;细胞粘附分子,诸如lfa-1、mo1、p150,95、vla-4、icam-1、vcam和αv/β3整联蛋白,包括其α或β亚基(例如抗cd11a、抗cd18或抗cd11b抗体);生长因子,诸如vegf;ige;血型抗原;flk2/flt3受体;肥胖(ob)受体;蛋白c;pcsk9等。
目前市场上的抗体治疗剂
目前市场上的多种蛋白质治疗剂尤其是本文所定义的抗体由于需要高剂量而经由静脉内输注来给药。制剂可包含目前市场上的抗体治疗剂之一或其生物类似物。目前市场上的一些蛋白质治疗剂不是高分子量的,但是由于疗效需要高剂量而仍然经由静脉内输注来给药。在一些实施方案中提供本文所定义的这些低分子量蛋白质的液体制剂,其浓度就皮下或肌内注射而言适于递送治疗有效量。
目前市场上的抗体治疗剂包括贝利木单抗(belimumab)
那他珠单抗作为针对细胞粘附分子α4-整联蛋白的人源化单克隆抗体用于治疗多发性硬化和克罗恩病。那他珠单抗先前以商品名
本文使用的术语“那他珠单抗”包括以国际非专有名称“natalizumab”已知的针对细胞粘附分子α4-整联蛋白的单克隆抗体或其抗原结合部分。那他珠单抗包括在美国专利5,840,299、美国专利6,033,665、美国专利6,602,503、美国专利5,168,062、美国专利5,385,839和美国专利5,730,978中所述的抗体。那他珠单抗包括由biogenidec和elancorporation以商品名
西妥昔单抗是用于治疗转移性结直肠癌和头颈癌的表皮生长因子受体(egfr)抑制剂。西妥昔单抗是通常通过静脉内输注来给药的嵌合(鼠类/人类)单克隆抗体。西妥昔单抗以商品名
西妥昔单抗适用于与化学疗法联合治疗患有表达表皮生长因子受体(egfr)的kras野生型转移性结直肠癌(mcrc)的患者并在用基于奥沙利铂和伊立替康的疗法不能治疗或不耐受伊立替康的患者中作为单一药物。西妥昔单抗适用于与用于一线治疗复发性和/或转移性疾病的基于铂的化学疗法联合和与用于局部晚期疾病的放射疗法联合治疗患有头颈鳞状细胞癌的患者。患有转移性结直肠癌的患者中的约75%具有表达egfr的肿瘤且由此根据fda指导方针据信适于用西妥昔单抗或帕尼单抗治疗。
本文使用的术语“西妥昔单抗”包括以国际非专有名称“cetuximab”已知的单克隆抗体或其抗原结合部分。西妥昔单抗包括在美国专利6,217,866中所述的抗体。西妥昔单抗包括以商品名
贝伐珠单抗即一种抑制血管内皮生长因子a(vegf-a)的人源化单克隆抗体作为抗血管生成剂发挥作用。其以商品名
美国国家综合癌症网络(“nccn”)推荐贝伐珠单抗与任何基于铂的化学疗法联合作为标准一线疗法,然后保持贝伐珠单抗直到疾病进展。nccn在2010年更新了其针对乳腺癌的肿瘤学临床实践指南(nccn指南)以肯定关于在治疗转移性乳腺癌中使用贝伐珠单抗(
本文使用的术语“贝伐珠单抗”包括以国际非专有名称/通用名称“bevacizumab”已知的抑制血管内皮生长因子a(vegf-a)的单克隆抗体或其抗原结合部分。贝伐珠单抗参见美国专利6,054,297。贝伐珠单抗包括以商品名
曲妥珠单抗是干扰her2/neu受体的单克隆抗体。曲妥珠单抗以商品名
曲妥珠单抗主要用于治疗一些乳腺癌。her2基因在20-30%的早期乳腺癌中是扩增的,这使其在细胞膜中过表达表皮生长因子(egf)受体。曲妥珠单抗对于患有her2阳性乳腺癌的患者通常作为维持疗法来给药,通常在化学疗法后持续一年。曲妥珠单抗目前以每周一次的频率且以约2mg/kg至约8mg/kg的剂量经由静脉内输注来给药。
本文使用的术语“曲妥珠单抗”包括以国际非专有名称/通用名称“trastuzumab”已知的干扰her2/neu受体的单克隆抗体或其抗原结合部分。曲妥珠单抗参见美国专利5,821,337。曲妥珠单抗包括以商品名
英利昔单抗是用于治疗自身免疫性疾病的针对肿瘤坏死因子α(tnf-α)的单克隆抗体。其以商品名
英利昔单抗含有约30%鼠可变区氨基酸序列,其赋予对人tnfα的抗原结合特异性。剩余70%对应于人igg1重链恒定区和人κ轻链恒定区。英利昔单抗对人tnfα具有高亲和力,而人tnfα为具有包括介导炎症应答和调节免疫系统在内的多种生物作用的细胞因子。
英利昔单抗是通常由小鼠骨髓瘤细胞(sp2/0细胞)产生和分泌的重组抗体。所述抗体目前通过连续预灌注细胞培养物来生产。英利昔单抗使用构成如下的嵌合抗体基因来表达:由鼠抗tnfα杂交瘤细胞a2克隆的可变区序列及由质粒表达载体提供的人抗体恒定区序列。鼠抗tnfα杂交瘤的产生通过用纯化的重组人tnfα使balb/c小鼠免疫来进行。对重链和轻链载体构建体进行线性化并通过电穿孔而转染到sp2/0细胞中。标准纯化步骤可包括色谱纯化、病毒灭活、纳米过滤及超滤/渗滤。
本文使用的术语“英利昔单抗”包括以国际非专有名称“infliximab”已知的嵌合小鼠/人类单克隆抗体或其抗原结合部分。英利昔单抗通过以高亲和力与tnfα的可溶性跨膜形式结合来中和tnfα的生物活性并抑制tnfα与其受体的结合。英利昔单抗参见美国专利5,698,195。术语“英利昔单抗”包括以商品名
denosumab(
帕尼单抗是fda批准用于对伴随疾病进展的表达egfr的转移性癌症进行治疗的完整人单克隆抗体。帕尼单抗以商品名
贝利单抗
阿昔单抗
托西莫单抗
阿仑单抗(以
帕利珠单抗
奥法木单抗是似乎抑制早期b淋巴细胞活化的人抗cd20单克隆抗体。奥法木单抗以商品名
trastuzumabemtansine(在美国,ado-trastuzumabemtansine,以
帕妥珠单抗
达克珠单抗(daclizumab)是人源化抗cd25单克隆抗体并用于预防器官移植特别是肾移植中的排斥。也在研究所述药物用于治疗多发性硬化。达克珠单抗的分子量为约143kda。达克珠单抗在美国以
艾库组单抗
托珠单抗
利妥昔单抗
利妥昔单抗在美国以商品名
高分子量低粘度液体制剂可包含利妥昔单抗,优选浓度为约475mg/ml至约875mg/ml(使用就5英尺40kg至6英尺100kg的人由mosteller公式得到的体表面积范围即1.3至2.3平方米来近似)。浓度就1ml制剂来计算。
依匹木单抗是由bristol-myerssquibbcompany(“bristol-myerssquibb”)开发的人单克隆抗体。其以
瑞西巴库单抗
尼妥珠单抗
贝伦妥单抗维多汀
itolizumab
最初由roche开发并根据与biogen的合作协议正在进一步开发的obinutuzumab
聚乙二醇化赛妥珠单抗(certolizumabpegol)
可与使粘度降低的有机磷酸酯一起配制的其它抗体治疗剂包括来自celltrion,inc.(celltrion)的ct-p6。
后期试验和开发中的抗体治疗剂
进行至后期临床开发和行政审批的抗体治疗剂以迅猛步伐向前发展。在2014年有超过300种单克隆抗体处于临床试验中且有30种商业上发起的抗体治疗剂正在进行后期研究评价。最近向fda提交了两种单克隆抗体(维多珠单抗(vedolizumab)和雷莫芦单抗(ramucirumab))的第一次上市申请。amgen目前正在发起多项针对在患有斑块状银屑病的患者中使用brodalumab而进行的具有额外试验计划或患者招募的iii期试验。xbiotech,inc.已发起了两项mabp1(xilonix)针对患有晚期癌症或2型糖尿病的患者的i期临床试验。关于mabp1的其它试验正在招募患者。针对用moxetumomabpasudotox治疗白血病,多项试验由medimmune,llc(“medimmune”)发起并正在进行或招募患者。针对使用tildrakizumab治疗慢性斑块状银屑病的长期安全性和有效性而正在进行研究。最近已完成针对使用rilotumumab治疗多种癌症的多项ii期试验。
目前针对治疗炎性或免疫性病症、癌症、高胆固醇、骨质疏松症、阿尔茨海默病和感染性疾病正在进行或最近完成iii期研究的至少28种单克隆抗体为高分子量蛋白质。目前正在进行或最近完成iii期试验的单克隆抗体包括amg145、elotuzumab、依帕珠单抗(epratuzumab)、farletuzumab(morab-003)、gantenerumab(rg1450)、gevokizumab、伊珠单抗奥佐米星(inotuzumabozogamicin)、itolizumab、ixekizumab、lebrikizumab、美泊利单抗(mepolizumab)、naptumomabestafenatox、necitumumab、nivolumab、ocrelizumab、onartuzumab、racotumomab、ramucirumab、reslizumab、romosozumab、sarilumab、secukinumab、sirukumab、solanezumab、tabalumab和vedolizumab。单克隆抗体混合物(actoxumab和bezlotoxumab)也正在进行iii期试验评价。参见例如reichert,mabs5:1-4,2013。
维多珠单抗是由millenniumpharmaceuticals,inc(“millennium”;takedapharmaceuticalscompany,ltd.(“takeda”)的子公司)开发的单克隆抗体。发现维多珠单抗在患有中度至重度溃疡性结肠炎的患者中就诱导和保持临床缓解而言是安全和高度有效的。iii期临床试验表明其在克罗恩病和溃疡性结肠炎患者中实现了诱导临床应答和保持缓解的目的。评价长期临床结果的研究表明接近60%的患者实现了临床缓解。维多珠单抗的常用剂量为静脉内输注6mg/kg。
雷莫芦单抗是被开发用于治疗实体瘤的人单克隆抗体。针对治疗乳腺癌、转移性胃腺癌、非小细胞肺癌和其它类型的癌症正在进行iii期临床试验。雷莫芦单抗在一些iii期试验中以约8mg/kg通过静脉内输注来给药。
rilotumumab是对肝细胞生长因子/分散因子的作用进行抑制的人单克隆抗体。其由amgen开发且处于针对治疗实体瘤的iii期试验中。针对在晚期或转移性食管癌患者中用rilotumumab进行治疗的开放式iii期研究将经由静脉内输注以约15mg/kg来给药rilotumumab。
evolocumab(amg145)也由amgen开发且是结合于pcsk9的单克隆抗体。evolocumab的适应症为高胆固醇血症和高脂血症。
alirocumab(regn727)是来自regeneronpharmaceuticals,inc.(“regeneron”)和sanofi-aventisu.s.llc(“sanofi”)的人单克隆抗体,其适应症为高胆固醇血症和急性冠状动脉综合征。
来自activebiotechab(“activebiotech”)的naptumomabestafenatox即abr-217620是适用于肾细胞癌的单克隆抗体。
来自cimab,sa(“cimab”);laboratorioeleas.a.c.i.f.ya.的racotumomab是适用于非小细胞肺癌的单克隆抗体。
可与使粘度降低的有机磷酸酯一起配制的其它抗体包括bococizumab(pf-04950615)和tanezumab;来自amgen的ganitumab、blinatumomab、trebananib;来自cangenecorporation的炭疽免疫球蛋白;来自macrogenics,inc.的teplizumab;来自merck&co(“merck”)的mk-3222、mk-6072;来自wilexag的girentuximab;来自navideabiopharmaceuticals(“navidea”)的rigscan;来自pfizer的pf-05280014;来自chugaipharmaceuticalco.ltd.(“chugai”)的sa237;来自janssen/johnsonandjohnsonservices,inc.(“j&j”)的guselkumab;来自kyowa的抗凝血酶γ(kw-3357);和来自celltrion的ct-p10。
早期临床试验中的抗体
多种单克隆抗体最近已经进入或正在进入临床试验。其可包括目前经由静脉内输注来给药的蛋白质,优选分子量大于约120kda的那些蛋白质,通常约140kda至约180kda。其还可包括也正在进入临床试验或已被fda批准的高分子量蛋白质诸如与白蛋白缀合的药物或肽。多种来自amgen的单克隆抗体目前处于临床试验中。这些单克隆抗体可为高分子量蛋白质例如amg557,其是由amgen和astrazeneca联合开发的人单克隆抗体且目前处于针对治疗狼疮的i期试验中。类似地,amg729是由amgen开发的人源化单克隆抗体且目前处于针对治疗狼疮和类风湿性关节炎的i期试验中。此外,amg110是针对上皮细胞粘附分子的单克隆抗体;由amgen和astrazeneca联合开发的amg157是目前处于针对治疗哮喘的i期试验中的人单克隆抗体;amg167是已在多项针对治疗骨质疏松症的i期试验中进行评价的人源化单克隆抗体;已完成i期给药研究且目前处于针对治疗偏头痛和潮热的ii期研究中的amg334是对降钙素基因相关肽进行抑制的人单克隆抗体;amg780是对内皮细胞选择性tie2受体与其配体ang1和ang2的相互作用进行抑制的人抗血管生成素单克隆抗体且最近完成了作为癌症疗法的i期试验;amg811是抑制干扰素γ且作为用于系统性红斑狼疮的疗法正在被研究的人单克隆抗体;amg820是抑制c-fms并降低肿瘤相关巨噬细胞(tam)功能并作为癌症疗法正在被研究的人单克隆抗体;由amgen和astrazeneca联合开发的amg181是抑制α4/β7的作用且作为用于溃疡性结肠炎和克罗恩病的疗法处于ii期试验中的人单克隆抗体。
多种单克隆抗体目前处于针对治疗自身免疫性病症的临床试验中。这些单克隆抗体可包含在低粘度高分子量液体制剂中。rg7624是被设计为特异性且选择性与人白细胞介素-17家族的细胞因子结合的完整人单克隆抗体。针对自身免疫性疾病评价rg7624的i期临床试验正在进行。biib033是由biogen开发的目前处于针对治疗多发性硬化的ii期试验中的抗lingo-1单克隆抗体。
高分子量蛋白质还可包括ags-009即由argostherapeutics,inc.开发的靶向于ifn-α的单克隆抗体,其最近完成了针对治疗狼疮的i期试验。经由静脉内输注向患者给药至多30mg/kg的ags-009。由abbvie开发的bt-061处于针对类风湿性关节炎患者的ii期试验中。聚乙二醇化赛妥珠单抗
cnto-136(sirukumab)和cnto-1959是最近已由janssen完成ii期和iii期试验的单克隆抗体。达克珠单抗(先前以
medi-546和medi-570是目前处于由astrazeneca针对治疗狼疮而进行的i期和ii期试验中的单克隆抗体。medi-546在ii期研究中通过常规静脉内输注300-1,000mg来给药。medi-551是另一种由astrazeneca开发的用于多种适应症的单克隆抗体且目前也通过静脉内输注来给药。nn8209是由novonordiska/s(“novonordisk”)开发的用于阻断c5ar受体的单克隆抗体且已完成针对治疗类风湿性关节炎的ii期给药研究。nn8210是另一种正在由novonordisk开发的抗c5ar单克隆抗体且目前处于i期试验中。iph2201(nn8765)是由novonordisk正在开发的用于对患有炎性病症和自身免疫性疾病的患者进行治疗的靶向于nkg2a的人源化单克隆抗体。nn8765最近完成了i期试验。
olokizumab是强效靶向于细胞因子il-6的人源化单克隆抗体。il-6参与几种自身免疫性和炎性通路。olokizumab已完成针对治疗类风湿性关节炎的ii期试验。otelixizumab(也已知为trx4)是正在被开发用于治疗1型糖尿病、类风湿性关节炎和其它自身免疫性疾病的单克隆抗体。ozoralizumab是已完成ii期试验的人源化单克隆抗体。
pfizer目前进行针对单克隆抗体pd-360324和pf-04236921用于治疗狼疮的i期试验。利妥昔单抗生物类似物pf-05280586已由pfizer开发且处于针对类风湿性关节炎的i期/ii期试验中。
rontalizumab是正在由genentech开发的人源化单克隆抗体。其最近完成了针对治疗狼疮的ii期试验。sar113244(抗cxcr5)是由sanofi开发的处于i期试验中的单克隆抗体。sifalimumab(抗ifn-α单克隆抗体)是处于针对治疗狼疮的ii期试验中的单克隆抗体。
高分子量低粘度液体制剂可包含处于针对治疗各种血液疾病的早期临床开发中的单克隆抗体中的一种。例如,贝利木单抗
处于针对治疗各种癌症和相关病症的早期开发中的一种或多种单克隆抗体可包含在低粘度高分子量液体制剂中。unitedtherapeutics,corporation具有两种处于i期试验中的单克隆抗体即8h9单克隆抗体和ch14.18单克隆抗体。来自abbvie的单克隆抗体abt-806、enavatuzumab和volociximab处于早期开发中。actiniumpharmaceuticals,inc.针对单克隆抗体actimab-a(m195mab)、抗cd45mab和iomab-b已进行早期试验。seattlegenetics,inc.(“seattlegenetics”)具有处于针对癌症和相关病症的早期试验中的几种单克隆抗体,包括抗cd22adc(rg7593;pinatuzumabvedotin)、抗cd79badc(rg7596)、抗steap1adc(rg7450)、来自agensys,inc.(“agensys”)的asg-5me和asg-22me、抗体-药物缀合物rg7458和vorsetuzumabmafodotin。来自genentech的早期癌症治疗剂可包含在低粘度制剂中,包括alt-836、抗体-药物缀合物rg7600和dedn6526a、抗cd22adc(rg7593)、抗egfl7mab(rg7414)、抗her3/egfrdafmab(rg7597)、抗pd-l1mab(rg7446)、dfrf4539a、mint1526a。bristol-myerssquibb正在开发针对癌症治疗剂的早期单克隆抗体,包括被鉴定为抗cxcr4的那些单克隆抗体、抗pd-l1、il-21(bms-982470)、lirilumab和urelumab(抗cd137)。作为癌症治疗剂处于早期试验中的其它单克隆抗体包括来自apeironbiologicsag的apn301(hu14.18-il2)、来自aveopharmaceuticals,inc.(“aveo”)的av-203、来自alphavax的avx701和avx901、来自baxterinternational,inc.(“baxter”)的bax-69、来自bayerhealthcareag的bay79-4620和bay20-10112、来自novartisag的bhq880、来自arevamed的212-pb-tcmctrastuzumab、来自abgenomicsinternationalinc.的abgn-7和来自abiogenpharmas.p.a的abio-0501(tall-104)。
可与使粘度降低的有机磷酸酯一起配制的其它抗体治疗剂包括alzumab、ga101、daratumumab、siltuximab、alx-0061、alx-0962、alx-0761、bimagumab(bym338)、ct-011(pidilizumab)、actoxumab/bezlotoxumab(mk-3515a)、mk-3475(pembrolizumab)、dalotuzumab(mk-0646)、icrucumab(imc-18f1、ly3012212)、amg139(medi2070)、sar339658、dupilumab(regn668)、sar156597、sar256212、sar279356、sar3419、sar153192(regn421,enoticumab)、sar307746(nesvacumab)、sar650984、sar566658、sar391786、sar228810、sar252067、sgn-cd19a、sgn-cd33a、sgn-liv1a、asg15me、抗lingo、biib037、alxn1007、teprotumumab、concizumab、anrukinzumab(ima-638)、ponezumab(pf-04360365)、pf-03446962、pf-06252616、etrolizumab(rg7413)、quilizumab、兰尼单抗(ranibizumab)、lampalizumab、onclacumab、gentenerumab、crenezumab(rg7412)、imc-ron8(narnatumab)、tremelimumab、vantictumab、eemcizumab、ozanezumab、mapatumumab、tralokinumab、xmab5871、xmab7195、cixutumumab(ly3012217)、ly2541546(blosozumab)、olaratumab(ly3012207)、medi4893、medi573、medi0639、medi3617、medi4736、medi6469、medi0680、medi5872、pf-05236812(aab-003)、pf-05082566、bi1034020、rg7116、rg7356、rg7155、rg7212、rg7599、rg7636、rg7221、rg7652(mpsk3169a)、rg7686、humaxtfadc、mor103、bt061、mor208、omp59r5(抗notch2/3)、vay736、mor202、bay94-9343、ljm716、omp52m51、gsk933776、gsk249320、gsk1070806、nn8828、cep-37250/khk2804ags-16m8f、ags-16c3f、ly3016859、ly2495655、ly2875358和ly2812176。
可与使粘度降低的有机磷酸酯一起配制的其它早期单克隆抗体包括来自astrazeneca和medimmune的benralizumab、medi-8968、anifrolumab、medi7183、sifalimumab、medi-575、tralokinumab;来自biogenidec/eisaico.ltd(“eisai”)/bioarcticneuroscienceab的ban2401;来自biogen的cdp7657(一种抗cd40l一价聚乙二醇化抗体fab片段)、stx-100(一种抗avb6单克隆抗体)、biib059、抗tweak(biib023)和biib022;来自janssen和amgen的fulranumab;来自bioinventinternational/genentech的bi-204/rg7418;来自biotestpharmaceuticalscorporation的bt-062(indatuximabravtansine);来自boehringeringelheim/xencor的xmab;来自bristol-myerssquibb的抗ip10;来自bzlbiologicsllc的j591lu-177;来自celldextherapeutics的cdx-011(glembatumumabvedotin)、cdx-0401;来自crucell的foravirumab;来自daiichisankyocompanylimited的tigatuzumab;来自eisai的morab-004、morab-009(amatuximab);来自elililly的ly2382770;来自emdseronoinc.的di17e6;来自emergentbiosolutions,inc.的zanolimumab;来自fibrogen,inc.的fg-3019;来自freseniusse&co.kgaa的catumaxomab;来自genentech的pateclizumab、rontalizumab;来自genzyme和sanofi的fresolimumab;来自gilead的gs-6624(simtuzumab);来自janssen的cnto-328、bapineuzumab(aab-001)、carlumab、cnto-136;来自kalobiospharmaceuticals,inc.的kb003;来自kyowa的askp1240;来自labrysbiologicsinc.的rn-307;来自lifesciencepharmaceuticals的ecromeximab;来自elililly的ly2495655、ly2928057、ly3015014、ly2951742;来自massbiologics的mbl-hcv1;来自mentrikbiotech,llc的ame-133v;来自merckkgaa的abituzumab;来自merrimackpharmaceuticals,inc.的mm-121;来自novartisag的mcs110、qax576、qbx258、qge031;来自novartisag和xomacorporation(“xoma”)的hcd122;来自novonordisk的nn8555;来自peregrinepharmaceuticals,inc.的bavituximab、cotara;来自progenicspharmaceuticals,inc.的psma-adc;来自questpharmatech,inc.的oregovomab;来自regeneron的fasinumab(regn475)、regn1033、sar231893、regn846;来自roche的rg7160、cim331、rg7745;来自taimedbiologicsinc.的ibalizumab(tmb-355);来自theraclonesciences的tcn-032;来自traconpharmaceuticals,inc.的trc105;来自unitedbiomedicalinc.的ub-421;来自viventiabio,inc.的vb4-845;来自abbvie的abt-110;来自ablynx的caplacizumab、ozoralizumab;来自cytodyn,inc.的pro140;来自medarex,inc.的gs-cda1、mdx-1388;来自amgen的amg827、amg888;来自tgtherapeuticsinc.的ublituximab;来自toleratherapeutics,inc.的tol101;来自immunogeninc.的hun901-dm1(lorvotuzumabmertansine);来自immunomedics,inc.的epratuzumaby-90/veltuzumab组合(immu-102);来自agenix,limited的抗纤维蛋白单克隆抗体/3b6/22tc-99m;来自alderbiopharmaceuticals,inc.的ald403;来自pfizer的rn6g/pf-04382923;来自cgtherapeutics,inc.的cg201;来自kalobiospharmaceuticals/sanofi的kb001-a;来自kyowa.的krn-23;来自immunomedics,inc.的y-90hpam4;来自morphosysag和oncomedpharmaceuticals,inc.的tarextumab;来自morphosysag和novartisag的lfg316;来自morphosysag和jannsen的cnto3157、cnto6785;来自roche和chugai的rg6013;来自merrimackpharmaceuticals,inc.(“merrimack”)的mm-111;来自glaxosmithkline的gsk2862277;来自amgen的amg282、amg172、amg595、amg745、amg761;来自biocon的bvx-20;来自celltrion的ct-p19、ct-p24、ct-p25、ct-p26、ct-p27、ct-p4;来自glaxosmithkline的gsk284933、gsk2398852、gsk2618960、gsk1223249、gsk933776a;来自morphosysag和bayerag的anetumabravtansine;来自morphosysag和boehringeringelheim的bi-836845;来自morphosysag和novartisag的nov-7、nov-8;来自merrimack的mm-302、mm-310、mm-141、mm-131、mm-151;来自roche和seattlegenetics的rg7882;来自roche/genentech的rg7841;来自pfizer的pf-06410293、pf-06438179、pf-06439535、pf-04605412、pf-05280586;来自roche的rg7716、rg7936、gentenerumab、rg7444;来自astrazeneca的medi-547、medi-565、medi1814、medi4920、medi8897、medi-4212、medi-5117、medi-7814;来自bristol-myerssquibb的ulocuplumab、pcsk9adnectin;来自fiveprimetherapeutics,inc.的fpa009、fpa145;来自gilead的gs-5745;来自kyowahakkokirin的biw-8962、khk4083、khk6640;来自merckkgaa的mm-141;来自regeneron的regn1154、regn1193、regn1400、regn1500、regn1908-1909、regn2009、regn2176-3、regn728;来自sanofi的sar307746;来自seattlegenetics的sgn-cd70a;来自ablynx的alx-0141、alx-0171;来自immunomedics,inc.的milatuzumab-dox、milatuzumab、tf2;来自millennium的mln0264;来自abbvie的abt-981;来自abgenomicsinternationalinc.的abgn-168h;来自aveo的ficlatuzumab;来自bioinventinternational的bi-505;来自celldextherapeutics的cdx-1127、cdx-301;来自celleranttherapeuticsinc.的clt-008;来自circadian的vgx-100;来自daiichisankyocompanylimited的u3-1565;来自dekkuncorp.的dkn-01;来自elililly的flanvotumab(tyrp1蛋白)、il-1β抗体、imc-cs4;来自elililly和imclone,llc的vegfr3单克隆抗体、imc-tr1(ly3022859);来自elusystherapeuticsinc.的anthim;来自galaxybiotechllc的hul2g7;来自immunogeninc.的imgb853、imgn529;来自janssen的cnto-5、cnto-5825;来自kaketsuken的kd-247;来自kalobiospharmaceuticals的kb004;来自macrogenics,inc.的mga271、mgah22;来自morphosysag/xencor的xmab5574;来自neogenixoncology,inc.的ensituximab(npc-1c);来自novartisag和xoma的lfa102;来自novartisag的ati355;来自santarusinc.的san-300;来自selexys的selg1;来自targatherapeutics,corp.的hum195/rgel;来自tevapharmaceuticals,industriesltd.(“teva”)和vaccinexinc.的vx15;来自theraclonesciences的tcn-202;来自xencor的xmab2513、xmab5872;来自xoma和美国国立过敏与感染性疾病研究所的xoma3ab;来自mabvaxtherapeutics的神经母细胞瘤抗体疫苗;来自cytodyn,inc.的cytolin;来自emergentbiosolutionsinc.的thravixa;来自cytovancebiologics的fb301;来自janssen和sanofi的狂犬病单克隆抗体;来自janssen且由美国国立卫生研究院部分资助的流感单克隆抗体;来自mappbiopharmaceutical,inc.的mb-003和zmapp;和来自defyrusinc.的zmab。
其它蛋白质治疗剂
蛋白质可为酶、融合蛋白、隐形或聚乙二醇化蛋白质、疫苗或其它生物活性蛋白质(或蛋白质混合物)。本文使用的术语“酶”是指催化靶标分子生化转化成所需产物的蛋白质或其功能性片段。
作为药物的酶具有至少两个重要的特征即i)通常以高亲和力和特异性结合且作用于其靶标,和ii)催化并转化多种靶标分子成所需产物。在一些实施方案中,蛋白质可如本文所定义的那样为聚乙二醇化的。
本文使用的术语“融合蛋白”是指由对两种单独蛋白质进行编码的两种不同基因产生的蛋白质。融合蛋白通常通过本领域技术人员已知的重组dna技术来产生。两种蛋白质(或蛋白质片段)共价融合在一起并展现出两种母体蛋白的性质。
有多种上市的融合蛋白。
aflibercept在重组中华仓鼠卵巢(cho)细胞中产生,由regeneron上市。
alprolixtm即凝血因子ix(重组)fc融合蛋白是由重组dna产生的凝血因子ix浓缩物,适用于在患有乙型血友病的成人和儿童中控制和预防出血发作、围手术期管理、旨在防止或减少出血发作频率的常规预防。
pegloticase
阿替普酶(alteplase)
glucarpidase
alglucosidaseα
pegdamasebovine
α-半乳糖苷酶是催化糖脂即神经酰胺三己糖苷(gl-3)水解成半乳糖和神经酰胺二己糖苷的溶酶体酶。法布里病是罕见的遗传性溶酶体贮积病,其特征在于低于正常酶活性的α-半乳糖苷酶和由此产生的gl-3积累。半乳糖苷酶α
拉布立酶(rasburicase)
伊米苷酶(imiglucerase)
abraxane即与紫杉醇缀合的白蛋白被批准用于转移性乳腺癌、非小细胞肺癌和晚期胰腺癌。
taligluceraseα
laronidase
elosulfaseα
可与使粘度降低的有机磷酸酯一起配制的其它生物制品包括asparaginaseerwiniachrysanthemi
开发中的蛋白质治疗剂
versartis,inc.的vrs-317是使用xten半衰期延长技术的重组人生长激素(hgh)融合蛋白。其旨在降低患有hgh缺乏的患者所需要的hgh注射的频率。vrs-317已完成ii期研究,对其效力与每天注射的非衍生化hgh进行了比较,具有阳性结果。计划进行iii期研究。
弧菌溶血素是由革兰氏阴性海洋微生物vibrioproteolyticus分泌的蛋白质水解酶。该内切蛋白酶对蛋白质的疏水区具有特异性亲和力且能够在邻近疏水性氨基酸处裂解蛋白质。弧菌溶血素目前正在由biomarin研究用于烧伤的清理和/或治疗。弧菌溶血素制剂参见专利wo02/092014。
peg-pal(聚乙二醇化重组苯丙氨酸解氨酶或“pal”)是用于治疗苯丙酮酸尿症(pku)(一种由于缺乏苯丙氨酸羟化酶(pah)而引起的遗传性代谢病)的研究性酶代替疗法。peg-pal正在被开发作为用于血液苯丙氨酸(phe)水平没有被
可与使粘度降低的有机磷酸酯一起配制的其它蛋白质治疗剂包括alprolix/rfixfc、eloctate/rfviiifc、bmn-190;bmn-250;lamazyme;galazyme;za-011;sebelipaseα;sbc-103;和hgt-1110。此外,含xten半衰期延长技术的融合蛋白可与使粘度降低的有机磷酸酯一起配制,包括但不限于vrs-317gh-xten;凝血因子viia、凝血因子viii、凝血因子ix;pf05280602、vrs-859;艾塞那肽-xten;amx-256;glp2-2g/xten;和amx-179叶酸-xten-dm1。
可与使粘度降低的有机磷酸酯一起配制的其它后期蛋白质治疗剂包括来自curemarkllc的cm-at;来自novonordisk的nn7999、nn7088、利拉鲁肽(liraglutide)(nn8022)、nn9211、索马鲁肽(semaglutide)(nn9535);来自amgen的amg386、非格司亭(filgrastim);来自cslbehring的csl-654、凝血因子viii;来自novartisag的la-ep2006(聚乙二醇化非格司亭生物类似物);来自cel-scicorporation的multikine(白细胞介素);来自elililly的ly2605541、特立帕肽(teriparatide)(重组pth1-34);来自nuronbiotech,inc.的nu-100;来自sigma-taupharmaceuticals,inc.的calaspargasepegol;来自polarispharmaceuticals,inc.的adi-peg-20;来自biomarin的bmn-110、bmn-702;来自molmeds.p.a.的ngr-tnf;来自pharminggroup/santarusinc.的重组人c1酯酶抑制剂;来自lglifesciencesltd的生长激素生物类似物;来自npspharmaceuticals,inc.的natpara;来自asahikaseicorporation的art123;来自baxter的bax-111;来自inspirationbiopharmaceuticals的obi-1;来自octapharmaag的wilate;来自agennixag的talactoferrinα;来自lundbeck的去氨普酶(desmoteplase);来自shire的cinryze;来自roche和exelixis,inc.的rg7421;来自novartisag的米哚妥林(midostaurin)(pkc412);来自bayerag的damoctocogαpegol、bay86-6150、bay94-9027;来自bristol-myerssquibb的聚乙二醇化干扰素λ-1a、nulojix(belatacept);来自merckkgaa的pergoveris、绒促卵泡素α(mk-8962);来自biogen的重组凝血因子ixfc融合蛋白(rfixfc;biib029)和重组凝血因子viiifc融合蛋白(rfviiifc;biib031);和来自astrazeneca的myalept。
可与使粘度降低的有机磷酸酯一起配制的其它早期蛋白质生物制品包括来自hemispherxbiopharma,inc.的alferonldo;来自stemlinetherapeutics,inc.的sl-401;来自protalixbiotherapeutics,inc.的prx-102;来自kaketsuken/teijinpharmalimited的ktp-001;来自bayerag的vericiguat;来自biomarin的bmn-111;来自janssen的acc-001(pf-05236806);来自elililly的ly2510924、ly2944876;来自novonordisk的nn9924;来自exsulin的ingap肽;来自abbvie的abt-122;来自astrazeneca的azd9412;来自biogen的neublastin(bg00010);来自celgenecorporation的luspatercept(ace-536)、sotatercept(ace-011);来自glaxosmithkline的prame免疫治疗剂;来自merckkgaa的plovameracetate(pi-2301);来自shire的premiplex(607);来自biomarin的bmn-701;来自eisai的ontak;来自halozyme,inc.的rhuph20/胰岛素;来自phasebiopharmaceuticals,inc.的pb-1023;来自alvinepharmaceuticalsinc.和abbvie的alv-003;来自novonordisk的nn8717;来自proteontherapeuticsinc.的prt-201;来自halozyme,inc.的pegph20;来自astellaspharmainc.的
其它生物药物
可与使粘度降低的有机磷酸酯一起配制的其它生物药物包括来自pfizer的pf-05285401、pf-05231023、rn317(pf-05335810)、pf-06263507、pf-05230907、dekavil、pf-06342674、pf06252616、rg7598、rg7842、rg7624d、omp54f28、gsk1995057、bay1179470、imc-3g3、imc-18f1、imc-35c、imc-20d7s、pf-06480605、pf-06647263、pf-06650808、pf-05335810(rn317)、pd-0360324、pf-00547659;来自merck的mk-8237;来自biogen的bi033;来自sanofi的gz402665、sar438584/regn2222;imc-18f1;来自imclonellc的icrucumab、imc-3g3;来自novonordisk的ryzodeg、tresiba、xultophy;来自sanofi的toujeo(u300)、lixilan、lyxumia(lixisenatide);来自glaxosmithkline的mage-a3免疫治疗剂;来自merckkgaa的tecemotide;来自novartisag的sereleaxin(rlx030);红细胞生成素;聚乙二醇化非格司亭;来自elililly的ly2963016、度拉糖肽(dulaglutide)(ly2182965);和来自boehringeringelheim的甘精胰岛素。
b.有机磷酸酯
包含低分子量和/或高分子量蛋白质的液体蛋白质制剂的粘度通过添加一种或多种有机磷酸酯来降低。在一些情况下,通过添加有效量的一种或多种有机磷酸酯将药物制剂由非牛顿流体转变成牛顿流体。本文中的“有机磷酸酯”是含有一个或多个磷酰基的化合物,所述磷酰基中的至少一个通过磷酸酯键而共价连接到有机基团。有机磷酸酯可为磷酸或聚磷酸的单酯。有机磷酸酯可为磷酸或聚磷酸的二酯。有机磷酸酯可为盐或两性离子。术语“两性离子”在本文中用于描述以下电荷总体为中性的化学分子,其在分子的不同化学基团上带有形式为正的电荷和形式为负的电荷。
有机磷酸酯可为盐或两性离子。术语“两性离子”在本文中用于描述以下电荷总体为中性的化学分子,其在分子的不同化学基团上带有形式为正的电荷和形式为负的电荷。
当有机磷酸酯呈盐形式时,抗衡离子可为碱金属或碱土金属诸如钠、钙、锂、钾等。在其它实施方案中,抗衡离子可为含氮化合物,包括具有连续亚甲基和/或次甲基、苯、萘、莰酮、金刚烷、甲苯、醌、蒽、菲、吡啶、吡嗪、哌嗪、吡咯烷、哌啶、咪唑、吡唑、噁唑、噻吩、苯并咪唑或其经取代的类似物的含氮化合物。示例性含氮化合物包括但不限于l-赖氨酸、l-精氨酸、l-组氨酸、戊烷-1,5-二胺和己烷-1,6-二胺、金刚烷胺、1-(3-氨基丙基)-2-甲基-1h-咪唑、氨基甲基乙基吡咯烷、二甲基氨基丙基哌嗪、氨基乙基哌啶、氨基乙基哌嗪和乙醇胺。例如,有机磷酸酯可为焦磷酸硫胺素和1-(3-氨基丙基)-2-甲基-1h-咪唑的盐,称为tpp-apmi。
虽然通常任何有机磷酸酯可降低蛋白质制剂的粘度,但是在一些实施方案中,使粘度降低的有机磷酸酯是核苷酸或核苷酸衍生物或含有核苷酸或核苷酸衍生物。使粘度降低的有机磷酸酯可为一磷酸核苷酸、二磷酸核苷酸、三磷酸核苷酸或其衍生物。使粘度降低的有机磷酸酯可为单磷酸核苷、二磷酸核苷、三磷酸核苷或其衍生物。使粘度降低的有机磷酸酯可含有核酸碱基或其衍生物。在一些实施方案中,使粘度降低的有机磷酸酯是核酸碱基和磷酰基的缀合物;糖和磷酰基的缀合物;或核酸碱基、糖和磷酰基的缀合物。糖可为5-碳糖、6-碳糖或7-碳糖,任选具有一个或多个取代基。核酸碱基可为嘌呤、腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤、7-甲基鸟嘌呤、嘧啶、胸腺嘧啶、胞嘧啶、尿嘧啶、5,6-二氢尿嘧啶、5-甲基胞嘧啶、5-羟基甲基胞嘧啶或其衍生物。核苷可为腺苷、鸟苷、5-甲基尿苷、尿苷、胞苷、脱氧腺苷、脱氧鸟苷、胸苷、脱氧尿苷、脱氧胞苷或其衍生物。核苷酸可为任何上述核苷的一磷酸酯、二磷酸酯或三磷酸酯。
使粘度降低的有机磷酸酯可具有式i结构,其中x是磷酸酯基团,优选二磷酸酯基团或三磷酸酯基团;y不存在或是糖,优选核糖、脱氧核糖或其衍生物;且z为核酸碱基,优选上述那些核酸碱基或其衍生物之一。
x-y-z
式i
使粘度降低的有机磷酸酯可具有式ii结构,其中n是1至20、1至10、2至10或2至6的整数;其中r1是具有3至50个碳原子、5至30个碳原子或7至20个碳原子的有机基团,优选r1为核酸碱基、核苷或其衍生物;且其中r2在每次出现时独立选自不存在、氢、一价阳离子基团及具有1至50个碳原子、1至30个碳原子、3至30个碳原子或7至20个碳原子的有机基团。一价阳离子基团包括钾、钠、锂、铵和烷基铵基。无论何时r2都是有机基团,r1和r2可为经取代或未经取代的具有3至50个碳原子、5至30个碳原子或7至20个碳原子的碳环或杂环。r1可为核苷诸如上述那些核苷或其衍生物之一。
使粘度降低的有机磷酸酯可具有式iii结构,其中n是1至20、1至10、2至10或2至6的整数;其中r3不存在或是糖,优选具有1至30个碳原子、1至20个碳原子或4至20个碳原子的单糖或二糖;其中r4是可经取代或未经取代的大体积环状基团,优选经取代或未经取代的具有3至50个碳原子、5至30个碳原子或7至20个碳原子的碳环或杂环;且其中r5在每次出现时独立选自不存在、氢、一价阳离子基团及具有1至50个碳原子、1至30个碳原子、3至30个碳原子或7至20个碳原子的有机基团。r3可为脱氧核糖、果糖、半乳糖、gentiobiulose、龙胆二糖、葡萄糖、蔗果三糖、异麦芽糖、异麦芽三糖、曲二糖、昆布二糖、麦芽糖、麦芽酮糖、麦芽三糖、麦芽四糖、甘露二糖、甘露糖、蜜二糖、车前二糖、黑曲霉糖、黑曲霉三糖、棉子糖、核糖、芸香糖、芸香二糖、槐糖、海藻糖、β,β-海藻糖、α,β-海藻糖或松二糖,任选含有一个或多个取代基。在一些实施方案中,取代基r3和r5可一起形成环,如在环腺苷酸中发现的那样。
r4可为含氮杂环。含氮杂环可为饱和或不饱和的。含氮杂环可包括经取代和未经取代的吡咯烷、吡咯、咪唑烷、吡唑烷、咪唑、吡唑、噁唑烷、异噁唑烷、噁唑、异噁唑、哌啶、四氢吡啶、二氢吡啶、吡啶、嘧啶、哌嗪、其多环和稠环结构及其衍生物。r4可为大体积环状基团。合适的大体积环状基团可包括5元碳环和杂环诸如环戊烷、环戊烯、环戊二烯、吡咯烷、吡咯、咪唑烷、吡唑烷、咪唑、吡唑、噁唑烷、异噁唑烷、噁唑、异噁唑、四氢呋喃、呋喃、二氧杂环戊烷、四氢噻吩、噻吩、二硫杂环戊烷、噻唑、异噻唑、磷杂环戊二烯、硅杂环戊二烯、三唑、噁二唑及其衍生物。合适的大体积环状基团可包括6元碳环和杂环诸如环己烷、环己烯、环己-1,3-二烯、环己-1,4-二烯、苯、哌啶、四氢吡啶、二氢吡啶、吡啶、氧杂环己烷、吡喃、哌嗪、吡嗪、嘧啶、哒嗪、吗啉、1,3,5-三嗪及其衍生物。合适的大体积环状基团可包括7元碳环和杂环诸如环庚烷、环庚烯、氮杂环庚烷、氮杂
使粘度降低的有机磷酸酯可为磷酸二核苷酸。使粘度降低的有机磷酸酯可具有式iv结构,其中n是1至20、1至10、2至10或2至6的整数;其中r6在每次出现时独立选自不存在或糖,优选具有1至30个碳原子、1至20个碳原子或4至20个碳原子的单糖或二糖;其中r7在每次出现时独立为可经取代或未经取代的大体积环状基团,优选经取代或未经取代的具有3至50个碳原子、5至30个碳原子或7至20个碳原子的碳环或杂环;且其中r8在每次出现时独立选自不存在、氢、一价阳离子基团及具有1至50个碳原子、1至30个碳原子、3至30个碳原子或7至20个碳原子的有机基团。每个r6可独立为脱氧核糖、果糖、半乳糖、gentiobiulose、龙胆二糖、葡萄糖、蔗果三糖、异麦芽糖、异麦芽三糖、曲二糖、昆布二糖、麦芽糖、麦芽酮糖、麦芽三糖、maltotriulose、甘露二糖、甘露糖、蜜二糖、车前二糖、黑曲霉糖、黑曲霉三糖、棉子糖、核糖、芸香糖、芸香二糖、槐糖、海藻糖、β,β-海藻糖、α,β-海藻糖或松二糖,任选含有一个或多个取代基。每个r7可独立为含氮杂环。含氮杂环可为饱和或不饱和的。含氮杂环可包括经取代和未经取代的吡咯烷、吡咯、咪唑烷、吡唑烷、咪唑、吡唑、噁唑烷、异噁唑烷、噁唑、异噁唑、哌啶、四氢吡啶、二氢吡啶、吡啶、嘧啶、哌嗪、其多环和稠环结构及其衍生物。每个r7可独立为大体积的环状基团。合适的大体积环状基团可包括5元碳环和杂环诸如环戊烷、环戊烯、环戊二烯、吡咯烷、吡咯、咪唑烷、吡唑烷、咪唑、吡唑、噁唑烷、异噁唑烷、噁唑、异噁唑、四氢呋喃、呋喃、二氧杂环戊烷、四氢噻吩、噻吩、二硫杂环戊烷、噻唑、异噻唑、磷杂环戊二烯、硅杂环戊二烯、三唑、噁二唑及其衍生物。合适的大体积环状基团可包括6元碳环和杂环诸如环己烷、环己烯、环己-1,3-二烯、环己-1,4-二烯、苯、哌啶、四氢吡啶、二氢吡啶、吡啶、氧杂环己烷、吡喃、哌嗪、吡嗪、嘧啶、哒嗪、吗啉、1,3,5-三嗪及其衍生物。合适的大体积环状基团可包括7元碳环和杂环诸如环庚烷、环庚烯、氮杂环庚烷、氮杂
使粘度降低的有机磷酸酯可为结构如下所示呈氯化物盐形式的焦磷酸硫胺素(tpp)或其衍生物。tpp的衍生物可包括用不同的磷酸酯诸如一磷酸酯至三磷酸酯代替二磷酸酯;用其它阴离子成分代替氯阴离子;用较高级的烷基或n-烷基取代基代替一个或多个甲基取代基;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、杂环基、芳基或杂芳基代替一个或多个氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。合适的阴离子成分包括卤离子、硫酸根、磺酸根、亚硫酸根、亚磺酸根、磷酸根、膦酸根、亚磷酸根、亚膦酸根、碳酸根和羧酸根阴离子,任选取代有一个或多个烷基、杂烷基、烯基、炔基、碳环或杂环基团,优选具有1至20个或1至12个碳原子。示例性阴离子成分包括氯离子、溴离子、甲基磷酸根、甲基-乙基-磷酸根、甲基硫酸根、甲基磺酸根、甲酸根、乙酸根、丁酸根、枸橼酸根和乳酸根及大体积疏水性阴离子诸如樟脑磺酸(csa)、苯磺酸(bsa)、甲苯磺酸(tsa)、1-(3-氨基丙基)-2-甲基-1h-咪唑(apmi)或甲磺酸(msa)。衍生物可包括tpp的使用常规无机碱诸如naoh或上述示例性疏水性碱的碱加成盐。
在其它实施方案中,使粘度降低的有机磷酸酯可为苯磷硫胺或相应的二磷酸酯或三磷酸酯类似物。使粘度降低的有机磷酸酯可为一磷酸呋喃硫胺、一磷酸丙舒硫胺或一磷酸蒜硫胺素及其相应的二磷酸酯或三磷酸酯。
使粘度降低的有机磷酸酯可为结构如下所示呈钠盐形式的三磷酸腺苷(atp)或其衍生物。atp的衍生物可包括用不同的磷酸酯诸如一磷酸酯或二磷酸酯代替三磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的三磷酸脱氧腺苷(datp)或其衍生物。datp的衍生物可包括用不同的磷酸酯诸如一磷酸酯或二磷酸酯代替三磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的三磷酸脱氧鸟苷(dgtp)或其衍生物。dgtp的衍生物可包括用不同的磷酸酯诸如一磷酸酯或二磷酸酯代替三磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、杂环基、芳基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的三磷酸脱氧胸苷(dttp)或其衍生物。dttp的衍生物可包括用不同的磷酸酯诸如一磷酸酯或二磷酸酯代替三磷酸酯;用较高级的烷基或n-烷基取代基代替甲基取代基;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、杂环基、芳基或杂芳基代替一个或多个氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的三磷酸脱氧胞苷(dctp)或其衍生物。dctp的衍生物可包括用不同的磷酸酯诸如一磷酸酯或二磷酸酯代替三磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的环腺苷酸(camp)或其衍生物。camp的衍生物可包括用不同的磷酸酯诸如二磷酸酯或三磷酸酯代替一磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的环鸟苷酸(cgmp)或其衍生物。cgmp的衍生物可包括用不同的磷酸酯诸如二磷酸酯或三磷酸酯代替一磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的环胸苷酸(ctmp)或其衍生物。ctmp的衍生物可包括用不同的磷酸酯诸如二磷酸酯或三磷酸酯代替一磷酸酯;用较高级的烷基或n-烷基取代基代替甲基取代基;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替一个或多个氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的环胞苷酸(ccmp)或其衍生物。ccmp的衍生物可包括用不同的磷酸酯诸如二磷酸酯或三磷酸酯代替一磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、芳基、杂环基或杂芳基代替氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的烟酰胺腺嘌呤二核苷酸磷酸(nadp)或其衍生物。nadp的衍生物可包括用不同的磷酸酯诸如一磷酸酯或三磷酸酯代替二磷酸酯;用不同的磷酸酯代替二磷酸酯;用经取代或未经取代的具有1至30个碳原子的烷基、氨基烷基、杂环基、芳基或杂芳基代替一个或多个氨基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的磷酸吡哆醛或其衍生物。磷酸吡哆醛的衍生物可包括用不同的磷酸酯诸如二磷酸酯或三磷酸酯代替一磷酸酯;用较高级的烷基或n-烷基取代基代替甲基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
使粘度降低的有机磷酸酯可为结构如下所示的核黄素-5’-磷酸酯或其衍生物。核黄素-5’-磷酸酯的衍生物可包括用不同的磷酸酯诸如二磷酸酯或三磷酸酯代替磷酸酯;用其它阳离子成分代替钠抗衡离子;用较高级的烷基或n-烷基取代基代替一个或多个甲基取代基;用o-酰基或o-烷基代替一个或多个羟基;或其组合。
c.赋形剂
很多种可用于液体蛋白质制剂的药物赋形剂是本领域技术人员已知的。其包括一种或多种添加剂,诸如液体溶剂或共溶剂;糖或糖醇,诸如甘露醇、海藻糖、蔗糖、山梨醇、果糖、麦芽糖、乳糖或葡聚糖;表面活性剂,诸如
其它药用载体、赋形剂或稳定剂诸如在remington:“thescienceandpracticeofpharmacy”,第20版,alfonsor.gennaro,ed.,lippincottwilliams&wilkins(2000)中描述的那些也可包含在本文所述的蛋白质制剂中,条件是其不会不利地影响制剂的所需性质。
制剂除上述使粘度降低的有机磷酸酯外还可含有一种或多种其它使粘度降低的赋形剂。本文所述的使粘度降低的有机磷酸酯可与一种或多种其它类型的使粘度降低的物质组合,例如在由arsiatherapeutics共同提交的标题为“liquidproteinformulationscontainingwatersolubleorganicdyes”的pct申请中所述的水溶性有机染料;典型的大体积极性有机化合物,诸如疏水性化合物、gras(美国食品药品监督管理局通常认为是安全的化合物的列表)中的多种物质和非活性注射用成分及fda所批准的治疗剂;在由arsiatherapeutics共同提交的标题为“liquidproteinformulationscontainingviscosity-loweringagents”的pct申请中所述的物质;和在由arsiatherapeutics共同提交的标题为“liquidproteinformulationscontainingionicliquids”的pct申请中所述的离子性液体。
iii.制备方法
a.蛋白质制剂
待配制的蛋白质诸如单克隆抗体可通过任何已知的技术来产生,诸如通过如本领域已知的那样对用含有一种或多种编码所述蛋白质的核酸序列的载体转化或转染的细胞进行培养或通过合成技术(诸如重组技术和肽合成或这些技术的组合)或可从所述蛋白质的内源性来源中分离。
待配制的蛋白质的纯化可通过本领域已知的任何合适的技术来进行,诸如乙醇或硫酸铵析出、反相hplc、硅胶或阳离子交换树脂(例如deae-纤维素)色谱、透析、色谱聚焦、使用蛋白a
以使粘度降低的浓度诸如0.010m至1.0m、优选0.050m至0.50m、最优选0.10m至0.30m引入的使粘度降低的有机磷酸酯允许使用本领域技术人员已知的常规方法将药学活性单克隆抗体的溶液纯化和/或浓缩至较高的单克隆抗体浓度,包括但不限于切向流动过滤、离心浓缩和透析。
在一些实施方案中,蛋白质的冻干制剂被提供和/或使用在浓缩的低粘度蛋白质制剂的制备和制造中。在一些实施方案中,呈粉末形式的预冻干蛋白质通过溶解在水溶液中来复溶。在该实施方案中,将液体制剂填充到特定剂量单元容器诸如小瓶或预填充的混合式注射器中,冻干,任选与冻干保护剂、防腐剂、抗氧化剂和其它典型的药用赋形剂一起,然后在无菌储存条件下储存直到临用前,此时将其用限定体积的稀释剂复溶以使液体达到所期望的浓度和粘度。
本文所述的制剂可通过本领域技术人员已知的任何合适的方法来储存。用于制备供储存的蛋白质制剂的方法的非限制性实例包括对液体蛋白质制剂进行冷冻、冻干和喷雾干燥。在一些情况下,冻干制剂在零度以下的温度诸如在约-80℃或在液氮中冷冻储存。在一些情况下,冻干或含水制剂在2-8℃储存。
可用于在注射前复溶冻干制剂的稀释剂的非限制性实例包括无菌水、注射用抑菌水(bwfi)、ph缓冲溶液(例如磷酸盐缓冲盐水)、无菌盐水溶液、林格溶液、葡萄糖溶液或盐和/或缓冲剂的水溶液。在一些情况下,将制剂喷雾干燥,然后储存。
iv.向有此需要的个体给药
通过肌内、腹膜内(即注射到体腔中)、脑脊髓内或皮下注射使用18-32号针头(任选薄壁的针头)以小于约5ml、小于约3ml、优选小于约2ml、更优选小于约1ml的体积向有此需要的人类给药蛋白质制剂,包括但不限于复溶制剂。
蛋白质诸如单克隆抗体的适当剂量(“治疗有效量”)将取决于待治疗的病症、疾病或病症的严重程度和病程、给药蛋白质是出于预防还是治疗目的、先前的疗法、患者的临床史和对蛋白质的应答、所用蛋白质的类型及主治医师的判断。蛋白质适当地以单次或多次注射来一次性给药或在一系列治疗过程中作为单一疗法或与其它药物或疗法联合。
对剂量制剂进行设计以使注射在注射部位不引起显著的刺激迹象,例如其中当使用draize评分系统进行评价时,主要刺激指数小于3。在可选择的实施方案中,当与注射等体积的盐水溶液相比时,注射引起目视相似的刺激水平。在另一个实施方案中,当与其它方面相同但不含有机磷酸酯的以相同方式给药的制剂相比时,蛋白质的生物利用度是较高的。
在优选实施方案中,注射所述制剂以得到水平提高的治疗性蛋白质。例如,auc值可比就其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的以相同方式给药的制剂所计算的auc值高至少10%,优选至少20%。
使粘度降低的有机磷酸酯也可影响生物利用度。例如,蛋白质的百分比生物利用度可为其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的以相同方式给药的制剂的百分比生物利用度的至少1.1倍,优选至少1.2倍。
使粘度降低的有机磷酸酯也可影响药物动力学。例如,皮下或肌内注射后的cmax可比大致等同的药学上有效的静脉内给药剂量的cmax低至少10%,优选至少20%。
在一些实施方案中,蛋白质以比其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的制剂高的剂量和低的频率来给药。
粘度较低的制剂需要较小的注射力。例如,注射力可比其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的以相同方式给药的制剂所需要的注射力小至少10%,优选至少20%。在一个实施方案中,用27号针头进行注射,且注射力小于30n。在大多数情况下,制剂可使用非常小号的针头来给药,例如27至31号,通常27、29或31号。
使粘度降低的有机磷酸酯可用于制备适于复溶以形成供皮下或肌内注射的液体药物制剂的剂量单元制剂。剂量单元可含有一种或多种蛋白质的干燥粉末;一种或多种使粘度降低的有机磷酸酯;和其它赋形剂。存在于剂量单元中的蛋白质使在药用溶剂中复溶后所得到的制剂具有约100mg至约2,000mg/1ml的蛋白质浓度(mg/ml)。此类复溶制剂可在25℃具有约1cp至约50cp的绝对粘度。
低粘度制剂可按溶液或剂量单元形式提供,其中在具有或不具有使粘度降低的有机磷酸酯和其它赋形剂的情况下将蛋白质在一个小瓶中冻干,且将具有或不具有使粘度降低的有机磷酸酯和其它赋形剂的溶剂提供在第二个小瓶中。在该实施方案中,在注射前即刻或在注射时向蛋白质中添加溶剂以确保均匀混合和溶解。
一种或多种使粘度降低的有机磷酸酯按以下浓度存在于制剂中,所述浓度当经由皮下、肌内或其它注射类型来给药时不引起显著的毒性迹象和/或不可逆的毒性迹象。本文使用的“显著的毒性迹象”包括中毒、嗜睡、行为改变诸如当中枢神经系统受损时发生的那些行为改变、不育、严重的心脏毒性迹象诸如心律失常、心肌病、心肌梗塞和心源性或充血性心力衰竭、肾衰竭、肝衰竭、呼吸困难及死亡。
在优选实施方案中,所述制剂当给药不超过每天两次、每天一次、每周两次、每周一次或每月一次时不引起显著的刺激。所述蛋白质制剂的给药可在注射部位不引起显著的刺激迹象,例如当使用draize评分系统进行评价时,主要刺激指数小于3,小于2或小于1。本文使用的“显著的刺激迹象”包括在注射部位直径大于10cm、大于5cm或大于2.5cm的红斑、发红和/或肿胀、在注射部位出现坏死,在注射部位出现剥脱性皮炎及妨碍日常活动和/或需要就医或住院的严重疼痛。在一些实施方案中,当与注射等体积的盐水溶液相比时,所述蛋白质制剂的注射引起目视相似的刺激水平。
当经由皮下或肌内注射来给药时,所述蛋白质制剂与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的制剂相比可展现出提高的生物利用度。“生物利用度”是指生物活性物质例如单克隆抗体进入循环或到达作用部位的程度和速率。皮下或肌内注射的整体生物利用度与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的制剂相比是提高的。“百分比生物利用度”是指生物活性物质的给药剂量中进入循环的分数,其相对于静脉内给药剂量来确定。测量生物利用度的一种方式是通过比较血浆浓度对时间的函数曲线的“曲线下面积”(auc)。auc可例如使用线性梯形规则来计算。本文使用的“auc0-t”是指零时间至后来的t时间的血浆浓度曲线下面积。时间通常将以天进行测量,虽然当上下文明显时,也可使用小时。本文使用的“auc∞”是指零时间至血浆浓度恢复到基线水平时的时间的血浆浓度曲线下面积。测量生物利用度的一种方式是通过比较血浆浓度对时间的函数曲线的“曲线下面积”(auc)。auc可例如使用线性梯形规则来计算。本文使用的“auc∞”是指零时间至血浆浓度恢复到基线水平时的时间的血浆浓度曲线下面积。本文使用的“auc0-t”是指零时间至后来的t时间例如至达到基线的时间的血浆浓度曲线下面积。时间通常将以天进行测量,虽然当上下文明显时,也可使用小时。例如,auc与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的以相同方式给药的制剂相比可增加超过10%、20%、30%、40%或50%。
本文使用的“tmax”是指在给药后血浆浓度达到最大值的时间。
本文使用的“cmax”是指在给药剂量后且在给药后续剂量前的最大血浆浓度。
本文使用的“cmin”或“c谷”是指在给药剂量后且在给药后续剂量前的最小血浆浓度。
皮下或肌内注射后的cmax可比静脉内给药剂量的cmax小例如至少10%,更优选至少20%。cmax的这种减少也可使毒性降低。
药物动力学和药效学参数可使用本领域技术人员已知的措施进行跨物种近似。
抗体治疗剂的药物动力学和药效学可基于具体的抗体而是显著不同的。经批准的鼠单克隆抗体在人类中显示出的半衰期为约1天,而人单克隆抗体的半衰期通常将为约25天(waldmann等人,int.immunol.,2001,13:1551-1559)。抗体治疗剂的药物动力学和药效学可基于给药途径而是显著不同的。肌内或皮下注射igg后达到最大血浆浓度的时间通常为2至8天,尽管可能出现较短或较长的时间(wang等人,clin.pharm.ther.,2008,84(5):548-558)。抗体治疗剂的药物动力学和药效学可基于制剂而是显著不同的。与其它方面相同但不含一种或多种有机磷酸酯的制剂相比,含有机磷酸酯的蛋白质制剂就皮下或肌内注射而言可展现出改善的药物动力学。皮下或肌内给药后的cmax与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的以相同方式给药的制剂相比可为降低的。例如,cmax与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的静脉内给药的制剂的cmax相比可降低超过1天、2天、3天或4天或可降低超过10%、20%、30%、40%或50%。与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的制剂相比,整体生物利用度就皮下或肌内注射而言可为提高的。整体生物利用度可如下评价:对一个或多个auc值进行比较或对例如相对于静脉内给药剂量来计算的百分比生物利用度进行比较。例如,auc与其它方面相同但不含一种或多种使粘度降低的有机磷酸酯的静脉内给药的制剂相比可增加超过10%、20%、30%、40%或50%。
低粘度蛋白质制剂与不含一种或多种使粘度降低的有机磷酸酯的那些蛋白质制剂相比可允许给药中较大的灵活性并降低给药频率。例如,通过使每次注射给药的剂量增加多倍,可在一些实施方案中将给药频率由每2周一次降低至每6周一次。
包括但不限于复溶制剂在内的蛋白质制剂可使用经加热的和/或自混合式注射器或自动注射器来给药。蛋白质制剂也可在填充注射器前在单独的温热单元中预加热。
i.经加热的注射器
经加热的注射器可为使用注射器温热装置来预加热的标准注射器。注射器温热装置通常将具有一个或多个各自能够接收含蛋白质制剂的注射器的开口和用于在使用前将注射器加热和保持在特定温度(通常在环境温度以上)的装置。其在本文中将被称为经预加热的注射器。适于经加热的注射器的温热装置包括可得自vistadentalproducts和inter-med的那些温热装置。温热装置能够容纳各种尺寸的注射器并加热到至多约130℃的任何温度(通常变化在1℃内)。在一些实施方案中,将注射器在加热浴中预加热,诸如保持在所需温度的水浴。
经加热的注射器可为自加热式注射器即能够将注射器中的液体制剂加热和保持在特定温度。自加热式注射器也可为其已与加热装置接附的标准医用注射器。能够与注射器接附的合适的加热装置包括可得自watlowelectricmanufacturingco.,st.louis,mo的注射器加热器或注射器加热带及可得自warnerinstruments,hamden,ct的注射器加热模块、阶段式加热器和在线预灌注加热器诸如sw-61型注射器温热器。加热器可通过中央控制器来控制,例如可得自warnerinstruments的tc-324b或tc-344b型加热器控制器。
经加热的注射器将液体蛋白质制剂保持在特定温度或变化在1℃、2℃或5℃内的特定温度。经加热的注射器可将蛋白质制剂保持在室温至高达约80℃、至高达约60℃、至最高达约50℃或至高达约45℃的任何温度,只要蛋白质制剂在该温度是足够稳定的。经加热的注射器可将蛋白质制剂保持在20℃至60℃、21℃至45℃、22℃至40℃或25℃至37℃的温度。通过在注射期间将蛋白质制剂保持在升高的温度而降低了液体制剂的粘度,增加了制剂中蛋白质的溶解度或两者兼备。
ii.自混合式注射器
注射器可为自混合式的或可具有所接附的混合器。混合器可为静态混合器或动态混合器。静态混合器的实例包括美国专利5,819,988、6,065,645、6,394,314、6,564,972和6,698,622公开的那些静态混合器。一些动态混合器的实例可包括美国专利6,443,612和6,457,609及美国专利申请公开文本us2002/0190082公开的那些动态混合器。注射器可包括多个用于对液体蛋白质制剂的组分进行混合的桶。美国专利5,819,998描述了具有用于对双组分粘性物质进行混合的两个桶和混合梢的注射器。
iii.蛋白质制剂的自动注射器和预填充注射器
液体蛋白质制剂可使用预填充针筒式自动注射器或无针注射装置来给药。自动注射器包括可手持的通常为笔状的用于抓握替换式预填充筒的筒抓握件和用于从预填充筒中皮下或肌内注射液体药物剂量的基于弹簧或类似的机构。自动注射器通常被设计为用于自我给药或由未经培训的人员进行给药。自动注射器可用于从预填充筒中分配单一剂量或多个剂量。自动注射器能够实现不同的用户设置,尤其包括注射深度、注射速度等。其它注射系统可包括美国专利8,500,681所述的那些注射系统。
可将经冻干的蛋白质制剂提供在预填充或单位剂量注射器中。美国专利3,682,174、4,171,698和5,569,193描述了含有两个腔室的无菌注射器,其可预填充有能够在注射前即刻混合的干燥制剂和液体。美国专利5,779,668描述了用于药物组合物的冻干、复溶和给药的注射器系统。在一些实施方案中,将蛋白质制剂以冻干形式提供在预填充或单位剂量注射器中,在给药前在注射器中复溶并通过单次皮下或肌内注射来给药。用于递送单位剂量冻干药物的自动注射器参见wo2012/010,832。自动注射器诸如safeclicklyotm(由futureinjectiontechnologies,ltd.,oxford,u.k.上市)可用于给药单位剂量蛋白质制剂,其中所述制剂以冻干形式储存且在给药前即刻复溶。在一些实施方案中,将蛋白质制剂提供在用于冻干药物的单位剂量筒(有时称为vetter筒)中。合适的筒的实例可包括美国专利5,334,162和5,454,786所述的那些筒。
v.纯化和浓缩的方法
使粘度降低的有机磷酸酯也可用于协助蛋白质纯化和浓缩。以使粘度降低的有机磷酸酯的有效量向蛋白质中添加一种或多种使粘度降低的有机磷酸酯和赋形剂以降低蛋白质溶液的粘度。例如,添加使粘度降低的有机磷酸酯至浓度为约0.01m至约1m,优选约0.01m至约0.5m且最优选约0.01m至约0.25m。
然后使用选自超滤/渗滤、切向流动过滤、离心浓缩和透析的方法对蛋白质-有机磷酸酯溶液进行纯化或浓缩。
实施例
前述内容将通过以下非限制性实施例来进一步理解。
在25℃平衡5分钟后,所有充分混合的单克隆抗体水溶液的粘度都使用mvroc微流体粘度计(rheosense)或dv2t锥板式粘度计(brookfield;“c&p”)来测量(除非另有说明)。mvroc粘度计配备有“a”或“b”芯片,各自被制造有50微米通道。通常,将0.10ml蛋白质溶液在后部加载到气密性微型实验室仪器注射器(hamilton;100μl)中,固定于芯片并以多个流速(每个芯片的最大压力的约20%、40%和60%)进行测量。例如,约50cp的样品以约10、20和30μl/min(在“a”芯片上分别为约180、350和530s-1)进行测量直到粘度稳定,通常在至少30秒后。然后由这样的至少三次测量结果来计算平均绝对粘度和标准偏差。c&p粘度计配备有cpe40或cpe52梭杆(锥角分别为0.8°和3.0°),且0.50ml样品以2至400s-1的多个剪切速率来测量。具体地,将样品以22.58、24.38、26.25、28.13、30、31.88、45、67.5、90、112.5、135、157.5、180、202.5、247、270、292.5、315、337.5、360、382、400s-1各自测量30秒,开始于实现至少10%转矩的剪切速率并继续直到仪器转矩达到100%,。然后对于在dv2t锥板式粘度计上测量的样品,外推零剪切粘度由动态粘度对剪切速率的曲线图来确定。所报道的外推零剪切粘度是至少三次测量结果的平均值和标准偏差。
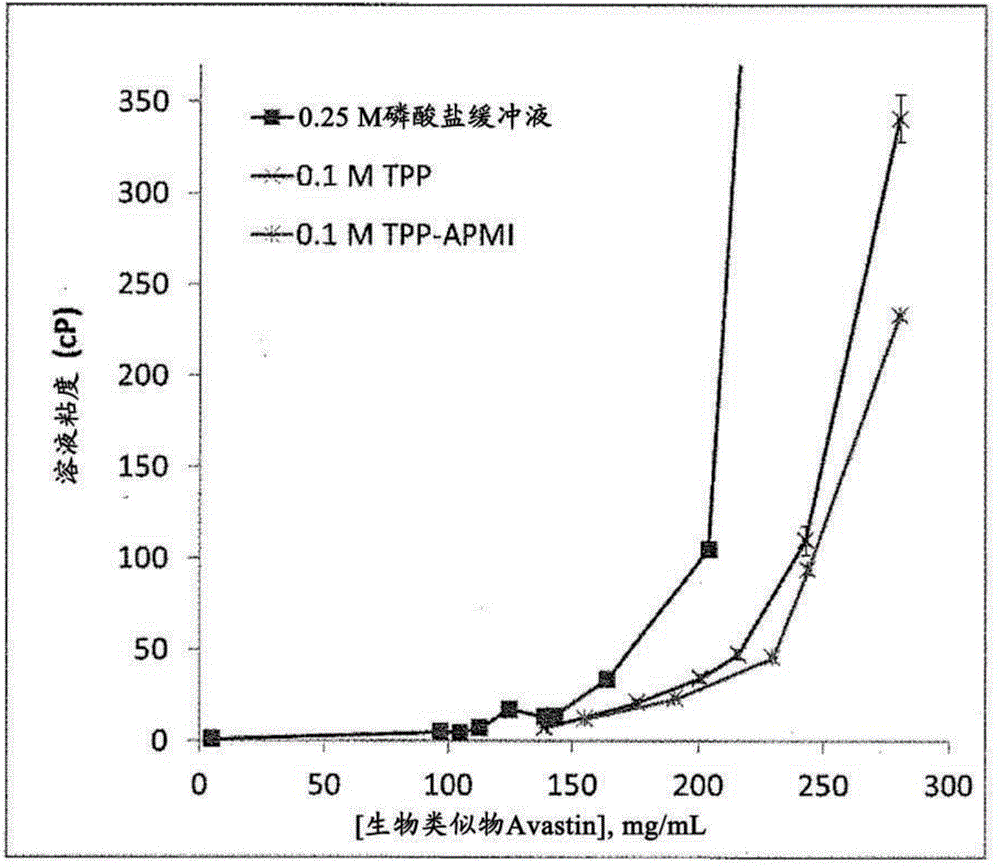
实施例1:有机磷酸酯降低生物类似物
对含有药用赋形剂(聚山梨醇酯20、磷酸盐和枸橼酸盐缓冲剂、甘露醇和nacl)的市售生物类似物
表1中的数据表明生物类似物
表1.生物类似物
在各种有机磷酸酯存在下在25℃和ph7的情况下的粘度
pb:磷酸盐缓冲剂;tpp:焦磷酸硫胺素;atp:三磷酸腺苷;adp:二磷酸腺苷;amp:一磷酸腺苷;camp:环腺苷酸;datp:脱氧三磷酸腺苷;dttp:脱氧三磷酸胸苷;dgtp:脱氧三磷酸鸟苷;dctp:脱氧三磷酸胞苷;nadp:烟酰胺腺嘌呤二核苷酸磷酸。除非另有说明,否则所有磷酸盐均为钠盐。
实施例2.生物类似物
市售生物类似物
表2中的数据表明生物类似物
表2.生物类似物
在各种浓度的有机磷酸酯存在下的粘度
*内插值
实施例3.有机磷酸酯降低多种治疗相关单克隆抗体的粘度
市售生物类似物
以相同方式对含有药用赋形剂(磷酸钠缓冲剂、nacl、聚山梨醇酯80)的市售
表3中的数据表明使粘度降低的有机磷酸酯可降低多种治疗相关单克隆抗体的浓缩水溶液的粘度。在一些情况下,camp-tris使粘度降低高达约9倍。
表3.单克隆抗体的水溶液在有机磷酸酯存在下的粘度
除非上文另有明确定义,否则本文使用的所有技术和科学术语具有与本领域技术人员通常所理解相同的含义。本领域技术人员仅使用常规实验就将认识到或将能够确定本文所述发明的具体实施方案的多种等效形式。所附权利要求书意在涵盖此类等效形式。
- 还没有人留言评论。精彩留言会获得点赞!