川楝素作为吲哚胺2,3-双加氧酶1抑制剂的用途的制作方法
本发明属于医药领域,具体涉及川楝素作为吲哚胺2,3-双加氧酶1抑制剂的用途。
背景技术:
目前,恶性肿瘤的诊疗仍是医学界最大的挑战之一,而传统的恶性肿瘤治疗手段如化疗和放疗等,虽经不断发展,却仍存在一定的局限和弊端,如不良反应大及易诱导耐药等。近年来,随着肿瘤免疫相关研究的不断深入,免疫治疗成为改善恶性肿瘤患者预后的新希望。肿瘤与宿主免疫系统之间的相互作用复杂而多变。科学家们正试图阐明两者之间的作用机制,希望借此改善肿瘤治疗现状。相应的,肿瘤免疫疗法已成为制药工业的热门研究领域。
作为众多肿瘤免疫周期调节因子中的一员,吲哚胺2,3-双加氧酶1(indoleamine2,3-dioxygenase1,ido1)备受关注。ido1是色氨酸分解代谢的第一限速酶,可通过介导色氨酸的耗竭及其代谢产物犬尿氨酸的积累来诱导t细胞和nk细胞的凋亡或功能紊乱,从而减弱机体的抗肿瘤免疫。在多数组织中,ido1处于沉默状态,但在多种实体肿瘤如肺癌、肝癌、乳腺癌和结肠癌等肿瘤组织中则呈持续高表达状态,且与预后差密切相关。研究表明,ido1活性的抑制可以促进免疫接种及化学治疗的疗效,使得ido1成为肿瘤免疫治疗药物的一个重要靶标。近年来,抑制ido1的活性在肿瘤治疗中的作用引起了众多学者的关注。因此,筛选ido1抑制剂,激活t细胞和nk细胞的功能,打破肿瘤免疫耐受,可能为肿瘤免疫治疗带来新的突破。基于ido1在肿瘤发生发展和肿瘤免疫耐受过程中的重要作用,ido1已被证实是抑制恶性肿瘤形成和提高免疫治疗效果的重要靶点。ido1抑制剂作为肿瘤免疫治疗的潜在药物具有十分广阔的开发前景。
根据ido1的调节及效应机制,以ido1为靶点的治疗可通过抑制ido1基因表达、抑制ido1活性及阻滞其效应途径,发挥治疗的作用。目前国内外研究开发的以ido1为靶点的小分子抑制剂主要集中在以直接抑制ido1活性方面的研究,目前ido1抑制剂主要分为以下几类:竞争性抑制剂,如1-mt;非竞争性抑制剂,如苯基咪唑;反竞争性抑制剂,如生物碱;通过其他作用的抑制剂等。目前ido1抑制剂的相关报道已经有很多,但只有部分抑制剂如1-mt和incb024360等进入了临床研究阶段,世界上还没有ido1抑制类的药物上市。对于临床研究中的1-mt,由于其抑制浓度较高,使得1-mt在使用时需要的剂量较大,药物成本是不可忽视的问题。而对于incb024360,其药物分子代谢快,具有不稳定性。同时,根据目前临床试验的结果,单纯抑制ido1活性仅只能产生有限的治疗效果,而在与传统的化学治疗、疫苗治疗等联用时则显著增强了抗肿瘤反应,ido1在肿瘤进展中的复杂作用仍不是十分清楚。基于以上分析,ido1及其抑制剂仍有较大发展空间和研究前景。
川楝素(toosendanin,tsn)是一种从传统的驱蛔中药楝科植物川楝的树皮或种子中分离得到的四环三萜类化合物,具有驱蛔、杀虫、抗肉毒效应、抑制神经递质释放和抗肿瘤等多种生物活性,但川楝素能下调肿瘤细胞中ido1的表达还是首次被发现。近年来,川楝素的抗肿瘤作用受到了越来越广泛的关注,研究者对多种人类肿瘤细胞进行了体外实验和体内实验,但其作用机制尚不明确。川楝素因来源广(川楝子、川楝树和苦楝树等)且生物活性多样,尤其在人类对恶性肿瘤无法攻克的时候,川楝素可作为新型抗肿瘤药物的候选者之一,具有广阔的发展前景。
本领域仍然期待有治疗肿瘤的新方法,例如使用天然活性物质治疗肿瘤的新方法。
技术实现要素:
本发明的目的在于提供一种治疗肿瘤的新方法,例如使用天然活性物质治疗肿瘤的新方法。本发明人出人意料地发现,通过本发明方法治疗肿瘤获得优良的效果。本发明基于此发现而得以完成。
为此,在本发明的第一方面,提供一种川楝素的新用途,即川楝素作为吲哚胺2,3-双加氧酶1(ido1)抑制剂的用途。
根据本发明的第一方面,川楝素作为吲哚胺2,3-双加氧酶1(ido1)抑制剂的用途,所述川楝素(其在本发明中可缩写为ns-180)具体结构为:
根据本发明的第一方面,所述川楝素ido1抑制剂在治疗肿瘤中的应用,包括体外增强免疫细胞(如nk细胞)对肿瘤细胞的杀伤作用。
根据本发明的第一方面,川楝素在制备预防和/或治疗具有吲哚胺2,3-双加氧酶1介导的色氨酸代谢紊乱的病理学特征的疾病的药物中的应用。
进一步的,本发明第二方面提供了川楝素在制备用于预防和/或治疗肿瘤的药物中的用途。
根据本发明第二方面的用途,其中所述药物中包含川楝素、甲硫氨酸和司盘60。
根据本发明第二方面的用途,其中所述药物中包含川楝素、甲硫氨酸和司盘60,三者的重量比为1:1.5:0.4。
根据本发明第二方面的用途,其中所述药物是口服给药剂型。
进一步的,本发明第三方面提供了包含川楝素、甲硫氨酸和司盘60的组合在制备用于预防和/或治疗肿瘤的药物中的用途。
根据本发明第三方面的用途,其中所述药物中包含川楝素、甲硫氨酸和司盘60,三者的重量比为1:1.5:0.4。
根据本发明第三方面的用途,其中所述药物是口服给药剂型。
进一步的,本发明第四方面提供了一种药物组合物,其中包含川楝素、甲硫氨酸和司盘60,以及任选的药用辅料。
根据本发明第四方面的药物组合物,其中川楝素、甲硫氨酸和司盘60三者的重量比为1:1.5:0.4。
根据本发明第四方面的药物组合物,其是口服给药剂型。
本发明的有益效果在于:本发明提供了川楝素的新用途,川楝素可通过显著下调ifn-γ诱导的非小细胞肺癌a549细胞中ido1表达来治疗肿瘤。mtt实验表明川楝素对a549细胞具有较小的细胞毒性;westernblotting和双荧光素酶报告基因实验表明川楝素可显著抑制ido1启动子活性,下调ifn-γ诱导的ido1表达并且抑制stat1、stat3的磷酸化。ldh释放实验表明,在体外,川楝素可显著增强nk细胞对a549细胞的杀伤作用。体内抗肿瘤实验结果表明,川楝素可明显抑制小鼠lewis肺癌移植瘤的生长,50mg/kg川楝素的抑瘤率约为60%。
附图说明
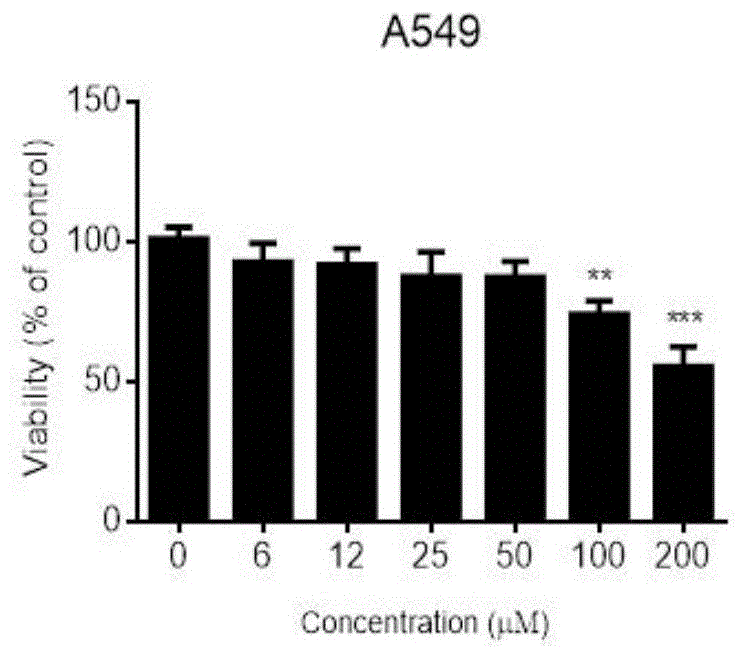
图1为mtt法检测川楝素作用24h后,人非小细胞肺癌a549细胞存活率和川楝素浓度的关系(横坐标代表川楝素浓度,纵坐标代表细胞存活率)。其中,**p<0.01,***p<0.001,与control组比较;
图2为双荧光素酶报告基因实验检测川楝素对ido1启动子荧光素酶的活性的影响。其中,**p<0.01,***p<0.001,与dmso组比较;
图3为免疫印迹分析给予不同浓度川楝素预处理2h,5ng/ml的ifn-γ处理24h后,a549细胞中pstat3、stat3、pstat1、stat1和ido1蛋白的表达结果;其中,tubulin为参照;
图4将a549细胞与nk细胞共培养,通过ldh释放实验检测川楝素是否可以增强nk细胞对a549细胞的杀伤活性。其中,**p<0.01,***p<0.001,与ifn-γ组比较。
图5为川楝素抑制小鼠体内lewis肺癌移植瘤的生长。c57bl/6腋下接种鼠源lewis肺癌细胞,腹腔给药1-mt或灌胃给药川楝素(20mg/kg,50mg/kg)14天后,不同给药组移植瘤瘤重的变化情况。其中,*p<0.05,**p<0.01,与2%羧甲基纤维素钠组组比较。
图6为川楝素体内抗肿瘤试验过程中,不同给药组小鼠体重的变化情况。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。
试验例1:mtt法检测川楝素对a549细胞增殖的变化
1.1试验方法:
1.对数生长期的a549细胞经胰酶消化后制成细胞悬液,以5×104/ml的浓度接种于96孔细胞培养板,每孔100μl,设置空白对照组、正常细胞组及加药组,每组3个复孔,置37℃,5%co2的无菌培养箱内培养48h。
2.于加药组中分别加入川楝素,使其终浓度分别为5μm、10μm、20μm、40μm、80μm、150μm、200μm,以培养基作为空白对照(control组,0μm),于无菌培养箱内培养24h。
3.培养结束前4h,每孔加入5mg/ml的mtt溶液20μl,结束培养后用2ml注射器吸去上清,每孔加入100μl二甲基亚砜,震荡10min,使紫色结晶充分溶解,酶标仪检测各孔吸光度(a570)值,结果见图1。
1.2试验结果:从图1中可以看出,0~50μm的川楝素对a549细胞的增殖无影响,当川楝素的浓度达到200μm时,可使a549细胞的存活率降低50%左右。
1.3试验结论:0~50μm浓度的川楝素对a549细胞具有较小的细胞毒性。
试验例2:双荧光素酶报告基因实验检测川楝素对ido1启动子荧光素酶的活性的影响
2.1试验方法
1.细胞的培养:转染24h前,采用0.25%胰酶消化,利用含10%胎牛血清的dmem/f12培养基将处于对数生长期的细胞制备成单细胞悬液,按1×105个/孔接种至24孔板中,每孔培养基为500μl,置37℃、5%co2饱和湿度培养箱培养,待细胞生长至铺满孔底70%左右进行实验。
2.瞬时转染与加药处理:用150mmol/l的nacl稀释待转染的质粒,含ido1启动子序列的pgl4-ido1-luc载体和空白对照pgl4.20-basic载体均按每孔400ng的量,内参载体prl-tkvector按每孔20ng的量,以每孔50μl体积稀释质粒,轻轻混匀,每个质粒做3个复孔。参照vigofect转染试剂说明,在a549细胞中进行pgl4-ido1-luc/prl-tk共转染,同时设立pgl4.20-basic/prl-tk共转染作为阴性对照组。细胞在37℃培养24h后,弃去培养液。分别于加药孔中加入川楝素至终浓度为5μm,10μm,对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h。
双荧光素酶报告基因活性的检测:参照dual-luciferasereporterassaysystemkit试剂盒(美国promega公司)说明测定荧光素酶活性。去除培养孔中的培养液,用1×pbs(ph=7.4)清洗2次;每孔加被动裂解缓冲液plb100μl,室温振摇15min;每孔裂解产物取上清20μl转移至96孔板中;使用荧光素酶检测试剂ii(larii)和
2.2试验结果:从图2中可以看出,川楝素可显著降低ido1启动子的荧光素酶活性并且具有剂量依赖性。
2.3试验结论:川楝素可显著降低ido1启动子的荧光素酶活性并且具有剂量依赖性。
根据试验例1和试验例2的结果可见,50μm以下浓度的川楝素并不会直接杀灭a549细胞,但是可以显著降低ido1启动子的荧光素酶活性,而ido1启动子的荧光素酶活性高时会抑制免疫细胞的活性,因此川楝素降低ido1启动子的荧光素酶活性的功能有望提高免疫细胞的活性,进而通过免疫细胞来杀灭肿瘤细胞。下面的试验将证明此种趋势。
试验例3:westernblotting检测不同浓度的川楝素对a549细胞中ido1、p-stat1和p-stat3表达水平的影响
3.1试验方法
1.a549细胞经0.25%胰酶消化后制成细胞悬液,以5×105/ml的浓度接种于6孔细胞培养板,每孔1ml,置37℃,5%co2的无菌培养箱内培养24h,然后随机分成2组,分别为对照组和川楝素组。
2.分别于加药孔中加入川楝素至终浓度为5μm、10μm、20μm、40μm、50μm,对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h。
3.培养结束后收获细胞,吸去细胞培养液,用1ml的pbs清洗培养板2次,六孔板每孔加入50μl的裂解液,刮刀刮下细胞后,放置冰上裂解30min后在4℃,12000rpm离心15min。
4.离心后将上清液转移到新的ep管中,取2μl上清液加600μl的bradford,静置10min测蛋白浓度。
5.每个样本取总蛋白50μg至新的ep管中,按4:1加5×sdsloading。混匀后于100℃孵育10min。
6.样本经10%及15%的sds-page胶电泳后,将蛋白转移至pvdf膜上,5%脱脂牛奶室温封闭1h,4℃孵育一抗过夜。
7.一抗孵育结束后,回收一抗,用tbs-t洗涤30min(每次10min),孵育二抗,二抗孵育结束,用tbs-t洗涤30min(每次10min),于成像仪中进行曝光,检测结果见图3。
3.2试验结果
从图3中可以看出,a549细胞于加药24h后,川楝素加药剂量从5μm开始,即可显著降低ido1总蛋白的表达并且抑制stat1和stat3的磷酸化。
3.3试验结论
川楝素能显著抑制stat1、stat3的磷酸化,并抑制ifn-γ诱导的ido1的表达
试验例4:川楝素增强免疫细胞的杀伤活性
4.1试验方法
1.a549细胞经胰酶消化后制成细胞悬液,以5×104/ml的浓度接种于96孔细胞培养板,每孔100μl,设置空白对照组、正常细胞组、最大ldh释放组、ifn-γ组及加药组,每组3个复孔,置37℃,5%co2的无菌培养箱内培养24h。
2.a549细胞的加药组分别加入终浓度为10μm、20μm的川楝素或者阳性对照1-mt处理2h后加入ifn-γ,置37℃,5%co2的无菌培养箱内再培养24h。
3.用100μlnk细胞的完全培养基更换掉a549的培养基,之后nk细胞以5×105/ml的浓度接种于已铺有a549细胞的96孔板中,每孔100μl,置37℃,5%co2的无菌培养箱内培养3h。
4.于最大ldh释放组中加入20μl1.0%np40,置37℃,5%co2的无菌培养箱内裂解45min。
5.取出96孔板,于1500rpm,离心5分钟,取50μl上清液于新的96孔板中,加入50μl底物避光反应30min。
6.再向每孔中加入50μl终止液,于492nm处测定吸收值。
7.每孔的吸收值与最大ldh释放组的吸收值的比值进行统计学计算,ldh杀伤率(%)=(ldh实验孔-ldh自然释放孔)/(ldh最大释放孔-ldh自然释放孔)×100%,检测结果见图4。
4.2试验结果:从图4中可以看出,在ifn-γ存在的情况下,将a549细胞与nk细胞以1:10的比例共培养,用川楝素预处理a549细胞后,可以显著提高nk细胞对a549细胞的杀伤活性。
4.3试验结论:川楝素可增强免疫细胞的杀伤活性。
试验例5:川楝素的体内抗肿瘤试验
5.1供试品:川楝素20mg/kg、50mg/kg混悬于2%羧甲基纤维素钠中。
5.2实验方法:将32只spf级别的c57bl/6小鼠(雌性,6周龄,18-22g,北京维通利华实验动物技术有限公司)分为4组(8只/每组),在每只小鼠左侧腋下接种1×106个小鼠lewis肺癌细胞,建立lewis肺癌移植瘤模型。接种72h后,对照组给予2%羧甲基纤维素钠,阳性药组给予20mg/kg的1-mt,供试品组给予20mg/kg或50mg/kg的川楝素。阳性药组每日腹腔给药1次,其余各组每日灌胃给药1次,连续14天。每两天测量一次小鼠体重,末次给药后称取小鼠体重及肿瘤重量,结果见图5和图6。
5.3试验结果:体内抗肿瘤结果表明,川楝素可明显减缓lewis移植瘤的生长,给药结束后可观察到川楝素对于肿瘤生长的抑制作用,20mg/kg和50mg/kg的川楝素平均抑瘤率分别为39.1%和60.5%(图5),并且,灌胃给药川楝素(20mg/kg、50mg/kg)对于小鼠的体重没有影响(图6)。
5.4试验结论:川楝素可明显抑制小鼠lewis移植瘤的生长。
试验例11:mtt法检测川楝素对a549细胞增殖的变化
11.1试验方法:
1.对数生长期的a549细胞经胰酶消化后制成细胞悬液,以5×104/ml的浓度接种于96孔细胞培养板,每孔100μl,设置空白对照组、正常细胞组及加药组,每组3个复孔,置37℃,5%co2的无菌培养箱内培养48h;
2.于加药组中分别加入川楝素、甲硫氨酸和司盘60,使其中川楝素终浓度分别为5μm、10μm、20μm、40μm、80μm、150μm、200μm,甲硫氨酸浓度是川楝素浓度的1.5倍,司盘60浓度是川楝素浓度的0.4倍,以培养基作为空白对照(control组,0μm),于无菌培养箱内培养24h;
3.培养结束前4h,每孔加入5mg/ml的mtt溶液20μl,结束培养后用2ml注射器吸去上清,每孔加入100μl二甲基亚砜,震荡10min,使紫色结晶充分溶解,酶标仪检测各孔吸光度(a570)值;
11.2试验结果:与图1的结果基本一致,0~50μm的川楝素(包含甲硫氨酸和司盘60)对a549细胞的增殖无影响,当川楝素(包含甲硫氨酸和司盘60)的浓度达到200μm时,可使a549细胞的存活率降低55%左右;
11.3试验结论:0~50μm浓度的川楝素(包含甲硫氨酸和司盘60)对a549细胞具有较小的细胞毒性。
补充试验11a:参照试验例11的方法,不同的仅是只增补添加甲硫氨酸,而未添加司盘60,试验的结果与图1的结果基本一致。
补充试验11b:参照试验例11的方法,不同的仅是只增补添加司盘60,而未添加甲硫氨酸,试验的结果与图1的结果基本一致。
试验例12:双荧光素酶报告基因实验检测川楝素对ido1启动子荧光素酶的活性的影响
12.1试验方法
1.细胞的培养:转染24h前,采用0.25%胰酶消化,利用含10%胎牛血清的dmem/f12培养基将处于对数生长期的细胞制备成单细胞悬液,按1×105个/孔接种至24孔板中,每孔培养基为500μl,置37℃、5%co2饱和湿度培养箱培养,待细胞生长至铺满孔底70%左右进行实验;
2.瞬时转染与加药处理:用150mmol/l的nacl稀释待转染的质粒,含ido1启动子序列的pgl4-ido1-luc载体和空白对照pgl4.20-basic载体均按每孔400ng的量,内参载体prl-tkvector按每孔20ng的量,以每孔50μl体积稀释质粒,轻轻混匀,每个质粒做3个复孔;参照vigofect转染试剂说明,在a549细胞中进行pgl4-ido1-luc/prl-tk共转染,同时设立pgl4.20-basic/prl-tk共转染作为阴性对照组;细胞在37℃培养24h后,弃去培养液;分别于加药孔中加入川楝素(其中还包含甲硫氨酸和司盘60)至终浓度为5μm、10μm(甲硫氨酸浓度是川楝素浓度的1.5倍,司盘60浓度是川楝素浓度的0.4倍),对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h;
双荧光素酶报告基因活性的检测:参照dual-luciferasereporterassaysystemkit试剂盒(美国promega公司)说明测定荧光素酶活性;去除培养孔中的培养液,用1×pbs(ph=7.4)清洗2次;每孔加被动裂解缓冲液plb100μl,室温振摇15min;每孔裂解产物取上清20μl转移至96孔板中;使用荧光素酶检测试剂ii(larii)和
12.2试验结果:相比图2的结果,添加甲硫氨酸和司盘60的5μm组和10μm组的rla值分别为183.2±11.7(与实施例2之5μm组相比p<0.05)和87.6±13.4(与实施例2之10μm组相比p<0.05);
12.3试验结论:添加甲硫氨酸和司盘60的川楝素可显著降低ido1启动子的荧光素酶活性并且具有剂量依赖性,并且比之于未添加甲硫氨酸和司盘60的情形有更显著的降低ido1启动子的荧光素酶活性的效果。
补充试验12a:参照试验例12的方法,不同的仅是只增补添加甲硫氨酸,而未添加司盘60,试验的结果与图2的结果基本一致。补充试验12b:参照试验例12的方法,不同的仅是只增补添加司盘60,而未添加甲硫氨酸,试验的结果与图2的结果基本一致。补充试验12c:参照试验例12的方法,不同的仅是不添加川楝素而只添加司盘60和甲硫氨酸,试验的结果与图2之dmso组的结果基本一致。补充试验12a、补充试验12b和补充试验12c的结果表明,未同时添加甲硫氨酸和司盘60二者的情况下不能增强川楝素在本试验中的效果。
试验例13:westernblotting检测不同浓度的川楝素对a549细胞中ido1、p-stat1和p-stat3表达水平的影响
13.1试验方法
1.a549细胞经0.25%胰酶消化后制成细胞悬液,以5×105/ml的浓度接种于6孔细胞培养板,每孔1ml,置37℃,5%co2的无菌培养箱内培养24h,然后随机分成2组,分别为对照组和川楝素组(添加甲硫氨酸和司盘60);
2.分别于加药孔中加入川楝素、甲硫氨酸和司盘60,使其中川楝素至终浓度为3μm、6μm、12μm、24μm、30μm,甲硫氨酸浓度是川楝素浓度的1.5倍,司盘60浓度是川楝素浓度的0.4倍,对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h;
3.培养结束后收获细胞,吸去细胞培养液,用1ml的pbs清洗培养板2次,六孔板每孔加入50μl的裂解液,刮刀刮下细胞后,放置冰上裂解30min后在4℃,12000rpm离心15min;
4.离心后将上清液转移到新的ep管中,取2μl上清液加600μl的bradford,静置10min测蛋白浓度;
5.每个样本取总蛋白50μg至新的ep管中,按4:1加5×sdsloading;混匀后于100℃孵育10min;
6.样本经10%及15%的sds-page胶电泳后,将蛋白转移至pvdf膜上,5%脱脂牛奶室温封闭1h,4℃孵育一抗过夜;
7.一抗孵育结束后,回收一抗,用tbs-t洗涤30min(每次10min),孵育二抗,二抗孵育结束,用tbs-t洗涤30min(每次10min),于成像仪中进行曝光;
13.2试验结果:基本上与图3相同,这表明,在添加甲硫氨酸和司盘60的情况下,相对于实验例3之60%浓度的川楝素即可达到试验例3基本相同的结果;
13.3试验结论:上述结果表明,川楝素能显著抑制stat1、stat3的磷酸化,并抑制ifn-γ诱导的ido1的表达,这些抑制作用因甲硫氨酸和司盘60的添加而得到加强。
补充试验13a:参照试验例13的方法,不同的仅是步骤2中:分别于加药孔中加入川楝素、甲硫氨酸,使其中川楝素至终浓度为5μm、10μm、20μm、40μm、50μm,甲硫氨酸浓度是川楝素浓度的1.5倍,对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h;试验的结果与图3的结果基本一致。补充试验13b:参照试验例13的方法,不同的仅是步骤2中:分别于加药孔中加入川楝素、司盘60,使其中川楝素至终浓度为5μm、10μm、20μm、40μm、50μm,司盘60浓度是川楝素浓度的0.4倍,对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h;试验的结果与图3的结果基本一致。补充试验13c:参照试验例13的方法,不同的仅是步骤2中:于加药孔中加入甲硫氨酸15μm和4μm司盘60,对照组加入等体积dmso,药物预处理2h后,每孔分别加入5ng/ml的ifn-γ,置37℃,5%co2的无菌培养箱内培养24h;试验的结果与图3之0μm川楝素的结果基本一致。补充试验13a、补充试验13b和补充试验13c的结果表明,未同时添加甲硫氨酸和司盘60二者的情况下不能增强川楝素在本试验中的效果。
试验例14:川楝素增强免疫细胞的杀伤活性
14.1试验方法
1.a549细胞经胰酶消化后制成细胞悬液,以5×104/ml的浓度接种于96孔细胞培养板,每孔100μl,设置空白对照组、正常细胞组、最大ldh释放组、ifn-γ组及加药组,每组3个复孔,置37℃,5%co2的无菌培养箱内培养24h;
2.a549细胞的加药组分别:加入终浓度为6μm的川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸,川楝素浓度0.4倍的司盘60)、加入终浓度为12μm的川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸,川楝素浓度0.4倍的司盘60)、或者阳性对照1-mt处理2h后加入ifn-γ,置37℃,5%co2的无菌培养箱内再培养24h;
3.用100μlnk细胞的完全培养基更换掉a549的培养基,之后nk细胞以5×105/ml的浓度接种于已铺有a549细胞的96孔板中,每孔100μl,置37℃,5%co2的无菌培养箱内培养3h;
4.于最大ldh释放组中加入20μl1.0%np40,置37℃,5%co2的无菌培养箱内裂解45min;
5.取出96孔板,于1500rpm,离心5分钟,取50μl上清液于新的96孔板中,加入50μl底物避光反应30min;
6.再向每孔中加入50μl终止液,于492nm处测定吸收值;
7.每孔的吸收值与最大ldh释放组的吸收值的比值进行统计学计算,ldh杀伤率(%)=(ldh实验孔-ldh自然释放孔)/(ldh最大释放孔-ldh自然释放孔)×100%;
14.2试验结果:试验结果与图4基本相同,6μm川楝素(含甲硫氨酸和司盘60)组的值为35.7±4.2%,12μm川楝素(含甲硫氨酸和司盘60)组的值为41.3±5.4%;
14.3试验结论:上述结果表明,在ifn-γ存在的情况下,将a549细胞与nk细胞以1:10的比例共培养,用川楝素预处理a549细胞后,可以显著提高nk细胞对a549细胞的杀伤活性,即川楝素可增强免疫细胞的杀伤活性;并且,川楝素经由免疫细胞即nk细胞对a549细胞的杀伤活性因甲硫氨酸和司盘60的添加而得到加强。
补充试验14a:参照试验例14的方法,不同的仅是步骤2中,a549细胞的加药组分别:加入终浓度为10μm的川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸)、加入终浓度为20μm的川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸)、或者阳性对照1-mt处理2h后加入ifn-γ,置37℃,5%co2的无菌培养箱内再培养24h;试验结果与图4基本相同,10μm川楝素(含甲硫氨酸)组的值为34.1±4.9%,20μm川楝素(含甲硫氨酸)组的值为40.5±5.1%。
补充试验14b:参照试验例14的方法,不同的仅是步骤2中,a549细胞的加药组分别:加入终浓度为10μm的川楝素(其中还添加川楝素浓度0.4倍的司盘60)、加入终浓度为20μm的川楝素(其中还添加川楝素浓度0.4倍的司盘60)、或者阳性对照1-mt处理2h后加入ifn-γ,置37℃,5%co2的无菌培养箱内再培养24h;试验结果与图4基本相同,10μm川楝素(含司盘60)组的值为33.8±3.6%,20μm川楝素(含司盘60)组的值为39.7±5.6%。补充试验14a和补充试验14b的结果表明,未同时添加甲硫氨酸和司盘60二者的情况下不能增强川楝素在本试验中的效果。
试验例15:川楝素的体内抗肿瘤试验
15.1供试品:川楝素20mg/kg、50mg/kg混悬于2%羧甲基纤维素钠中;
15.2实验方法:将32只spf级别的c57bl/6小鼠(雌性,6周龄,18-22g,北京维通利华实验动物技术有限公司)分为4组(8只/每组),在每只小鼠左侧腋下接种1×106个小鼠lewis肺癌细胞,建立lewis肺癌移植瘤模型;接种72h后,对照组给予2%羧甲基纤维素钠,阳性药组给予20mg/kg的1-mt,第一供试品组给予12mg/kg川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸,川楝素浓度0.4倍的司盘60),第二供试品组给予30mg/kg川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸,川楝素浓度0.4倍的司盘60);阳性药组每日腹腔给药1次,其余各组每日灌胃给药1次,连续14天;每两天测量一次小鼠体重,末次给药后称取小鼠体重及肿瘤重量;
15.3试验结果:12mg/kg川楝素(添加甲硫氨酸和司盘60)组平均抑瘤率为43.4%,30mg/kg川楝素(添加甲硫氨酸和司盘60)组平均抑瘤率为68.7%,各组动物体重变化与图6基本一致。
补充试验15a:参照试验例15的方法,不同的仅是步骤15.2中的两个供试品组设置变化:第一供试品组给予20mg/kg川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸),第二供试品组给予50mg/kg川楝素(其中还添加川楝素浓度1.5倍的甲硫氨酸),结果,两组平均抑瘤率分别为40.2%和59.6%,各组动物体重变化与图6基本一致。
补充试验15b:参照试验例15的方法,不同的仅是步骤15.2中的两个供试品组设置变化:第一供试品组给予20mg/kg川楝素(其中还添加川楝素浓度0.4倍的司盘60),第二供试品组给予50mg/kg川楝素(其中还添加川楝素浓度0.4倍的司盘60),结果,两组平均抑瘤率分别为38.4%和61.2%,各组动物体重变化与图6基本一致。补充试验15c:参照试验例15的方法,不同的仅是步骤15.2中的供试品组设置为一组:供试品组给予75mg/kg甲硫氨酸和20mg/kg司盘60,结果该组平均抑瘤率2.3%,各组动物体重变化与图6基本一致。
补充试验15a、补充试验15b、补充试验15c的结果表明,川楝素可明显抑制小鼠lewis移植瘤的生长,同时添加甲硫氨酸和司盘60后可增强川楝素抑制肿瘤生长的作用,未同时添加甲硫氨酸和司盘60二者的情况下不能增强川楝素在本试验中的效果。
- 还没有人留言评论。精彩留言会获得点赞!