一种基于乳杆菌的减肥粉剂及其制备方法与流程
本发明涉及食品领域,尤其涉及一种基于乳杆菌的减肥粉剂及其制备方法。
背景技术:
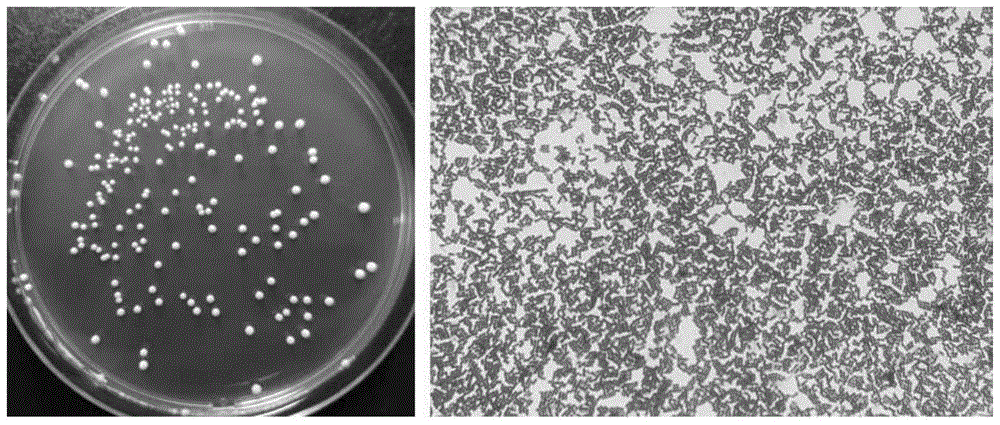
:近年来,随着生活水平的提高和生活方式的改变,中国居民超重及肥胖患病率呈逐年上升趋势。据报道,2018年中国平均肥胖率达到12%,肥胖总人数位居世界第一,同时肥胖人口特征呈年轻化趋势发展。肥胖不仅影响患者的生活质量,还会增加心血管疾病、糖尿病、癌症等患病风险。目前,国家批准可用的减肥药物有限,且副作用较大,因而寻求一种新型健康有效的预防或治疗手段意义重大。多项研究显示,肥胖与肠道菌群结构和数量的变化密切相关。而特定益生菌的摄入有助于维持肠道菌群平衡、调节宿主免疫和肠神经系统、改善肠屏障、减少致病菌的黏附等,从而减少宿主炎症以及肥胖的发生。然而市场上所用减肥益生菌不多,且基本为国外筛选得到,国内菌株的研究较少,因而大力挖掘我国特有的具有减肥功效的益生菌意义重大。荷叶、魔芋、蓝莓、菊粉、连翘等天然食品原料中含有能够减少脂肪堆积、控制体重的功能性成分,但功效有限,目前还没有将具有减肥功效的益生菌与这些天然食品原料复配后的功能相关研究。技术实现要素:为了解决上述技术问题,本发明提供了一种基于乳杆菌的减肥粉剂及其制备方法。在该减肥粉剂中,植物乳杆菌1701与发酵乳杆菌whh3906之间具有协同作用,复配后能发挥较好的降脂减肥效果;辅料可以抑制致病菌,并作为植物乳杆菌1701和发酵乳杆菌whh3906的能源物质,因而能够促进植物乳杆菌1701和发酵乳杆菌whh3906的生长和定植,促进其发挥降脂减肥的作用。本发明的具体技术方案为:一种基于乳杆菌的减肥粉剂,包括植物乳杆菌冻干粉、发酵乳杆菌冻干粉、荷叶提取物、茶多酚、魔芋粉、蓝莓果粉、赤藓糖醇、菊粉、连翘提取物、壳聚糖;所述发酵乳杆菌冻干粉由发酵乳杆菌和/或其突变体制得;所述发酵乳杆菌命名为whh3906,已在2020年3月13日在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏单位地址为北京市朝阳区北辰西路1号院3号,微生物保藏编号为cgmccno.19472,微生物分类命名为发酵乳杆菌lactobacillusfermentum;所述突变体为对所述发酵乳杆菌进行诱变、驯化、基因重组或者经自然突变而获得的突变体;所述植物乳杆菌冻干粉由植物乳杆菌和/或其突变体制得;所述植物乳杆菌命名为1701,已在2019年10月23日在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏单位地址为北京市朝阳区北辰西路1号院3号,其保藏编号为cgmccno.18728,微生物分类命名为植物乳杆菌lactobacillusplantarum;所述突变体为对所述植物乳杆菌进行诱变、驯化、基因重组或者经自然突变而获得的突变体。本发明配方中,以植物乳杆菌冻干粉和发酵乳杆菌冻干粉为主要功能物,荷叶提取物、茶多酚、魔芋粉、蓝莓果粉、赤藓糖醇、菊粉、连翘提取物、壳聚糖为辅料。其中,发酵乳杆菌whh3906是一种从中国西藏地区采集的传统发酵食品中所分离得到的益生菌菌株,经过动物实验验证,其具有良好的耐受性和黏附性,能够显著降低体重、减少体内脂肪堆积、降低脏器比和体脂比,并能降低瘦素水平,降低血脂,改善肥胖相关慢性炎症,缓解非酒精性脂肪肝,可用于预防和治疗肥胖。此外,在动物实验过程中,未发现实验动物死亡、精神不振、食欲不振等不良状态,说明该菌种具有较高的安全性。具体而言,上述发酵乳杆菌whh3906具有以下优点:(1)具有良好的耐酸耐胆盐能力和黏附性,可以顺利通过胃肠道,并定殖于肠道中,发挥益生功能:在ht-29细胞模型试验中表现出良好的黏附能力,单细胞黏附菌数达7.01±0.86,分别是对照商业菌株lcs和lgg的4.64倍和1.34倍;在ph2.5环境下孵育4h存活率为97.48%,在0.3%胆盐浓度下孵育8h存活率为79.85%,优于对照商业菌株lcs和lgg;(2)能够有效降低体重,减少脂肪堆积:服用剂量在1×109cfu/d具有显著效果,体重降低水平达8.18%,体重增加量降低22.03%,脂肪重量降低19.13%,体脂比降低13.25%;(3)能够显著降低血清总胆固醇和甘油三酯水平;(4)能够显著降低血清瘦素水平,使肥胖个体恢复对瘦素的敏感性,因而能有效促进脂解和脂肪细胞凋亡,抑制脂肪合成,减少体内脂肪堆积,减轻体重。而目前尚未发现具有降低血清瘦素功能的发酵乳杆菌。上述发酵乳杆菌whh3906能缓解非酒精性脂肪肝,具体表现在以下方面:(1)能够显著降低肝脏重量和脏器比:服用剂量在1×109cfu/d具有显著效果,肝脏重量降低16.88%,脏器比降低6.25%;(2)能够显著减轻肝脏组织细胞的脂肪变性,减少脂肪空泡,且空泡更小;(3)具有较强的抗氧化能力,具有较高的清除dpph能力和清除羟自由基能力:清除dpph和羟自由基的能力分别是对照商业菌株的2.10倍和1.69倍,能够缓解肝脏由于氧化应激引起的损伤;(4)能够显著降低肝脏中总胆固醇和甘油三酯的水平:服用活菌株剂量在1×109cfu/d具有显著效果,肝脏中总胆固醇降低15.15%,甘油三酯降低7.07%。上述发酵乳杆菌whh3906能缓解慢性炎症,具体表现在以下方面:(1)能够有效促进脾淋巴细胞增殖;(2)能够有效促进脾淋巴细胞分泌抑炎因子(即具有抑制炎症作用的细胞因子)il-10,且能够促进il-12的分泌;(3)能够有效促进巨噬细胞分泌抑炎因子il-10,抑制其分泌促炎因子(即具有促进炎症作用的细胞因子)il-6、tnf-α和no;(4)能够显著降低血清中lps的水平:服用剂量在1×109cfu/d具有显著效果,长期肥胖的大鼠血清中lps的水平降低21.27%;(5)能够显著降低血清中促炎因子il-1β、il-6、tnf-α、mcp-1和no的水平;(6)能够显著降低肝脏中促炎因子l-1β、il-6、tnf-α、mcp-1和no的水平。植物乳杆菌1701(已在公开号为cn111254089a的中国专利文献中公开)是一种从中国西藏地区采集的传统发酵食品中所分离得到的益生菌菌株,经过动物实验验证,其具有良好的耐受性和黏附性,能够显著降低体重、减少体内脂肪堆积、降低脏器比和体脂比,并能减少瘦素水平,降低血脂,可用于预防和治疗肥胖,而且,在其灭活后也具有减肥功能。此外,在动物实验过程中,未发现实验动物死亡、精神不振、食欲不振等不良状态,说明该菌种具有较高的安全性。本发明将发酵乳杆菌whh3906和植物乳杆菌1701复配后,两者在减肥上表现出协同增效的作用:在大鼠实验中发现,相较于单独服用而言,将两种菌复配后,高脂饮食的大鼠体重以及肝脏和脂肪重量增加明显减缓,粪便中排出的甘油三酯和总胆固醇量明显增加。本发明中的各辅料具有以下作用:(1)荷叶含有多种有效成分,如生物碱、黄酮类等,能够辅助降脂减肥,此外还具有抑制血糖升高、抑菌和抗氧化等功能。(2)茶多酚类化合物有助于降低肠管内胆汁酸对食源性胆固醇的溶解作用,从而抑制小肠对胆固醇的吸收并促进其排泄,由此达到控制体重增长的目的。(3)魔芋粉中的主要成分葡甘露聚糖为一种黏性天然水溶膳食纤维,能在消化道中减缓脂肪和葡萄糖的消化吸收,增加肠道中胆汁酸浓度,显著降高脂血症者血胆固醇、甘油三酯、低密度脂蛋白浓度;并能通过与谷物联合减缓谷类碳水化合物在肠道中的吸收,缩短谷物在消化道的转运时间及加速食物从肠道中排泄,增加粪便重量,从而达到控制体重的功效。(4)蓝莓中含有丰富的多酚物质,且自身热量较低,含有丰富膳食纤维和维生素c,而且果酸成分也较高,所以可以帮助促进新陈代谢和调节肠道微生态,因而对瘦身减肥有良好作用。(5)连翘提取物中的连翘苷可减少脂肪堆积,同时还可以降低血清中总胆固醇、甘油三酯等指标。(6)壳聚糖具有降血脂、抗菌、降血糖、抗氧化作用,并能减少机体对脂肪的吸收以及促进摄入的脂肪外排,从而起到减肥的功效。(7)菊粉是一种优质的膳食纤维,摄入菊粉有利于改善宿主肠道微生态,刺激有益菌的生长,产生短链脂肪酸,控制血脂及血糖,促进胰岛素分泌,提高机体能量消耗,抑制脂肪堆积。(8)赤藓糖醇是一种天然的四碳多元醇,其甜味与蔗糖较为接近,但是其能量热值却很低,且不能被人体消化。另外,赤藓糖醇吸湿性极低,可用于维持组合物低水分、低水分活度的食品原料,因而加入赤藓糖醇不仅可以改善组合物的口味,也有利于维持植物乳杆菌和发酵乳杆菌的活性稳定。本发明将辅料与植物乳杆菌1701和发酵乳杆菌whh3906复配后,能发挥以下作用:长期肥胖个体肠道菌群结构发生改变,革兰氏阴性菌丰度增加,而革兰氏阴性菌细胞壁脂多糖能够引起机体慢性炎症,而致病菌会影响有益菌的生长和定植,原因在于:一方面,致病菌产生的代谢毒素会影响有益菌的生长,同时与有益菌竞争能源物质;另一方面,致病菌会竞争有益菌的生态位(例如黏附肠壁的位点),减少或抑制有益菌的定植。荷叶、连翘提取物和茶多酚类化合物能够抑制致病菌的生长,致病菌多为革兰氏阴性菌,其能够改善机体肠道菌群结构,减少致病菌在体内定植,促进有益菌的生长和定植,进而缓解慢性炎症。魔芋粉、蓝莓、壳聚糖、菊粉和赤藓糖醇富含膳食纤维,一方面可作为乳酸菌的能源物质,有利于其生长;另一方面可以调节肠道菌群结构,对机体健康有利。由此可见,植物乳杆菌1701和发酵乳杆菌whh3906与上述辅料配合使用后,辅料一方面可以抑制致病菌,促进植物乳杆菌和发酵乳杆菌的生长和定植,另一方面辅料可以作为植物乳杆菌和发酵乳杆菌的能源物质,促进其生长,更好地发挥益生功能。作为优选,按重量份包括植物乳杆菌冻干粉1-10份、发酵乳杆菌冻干粉1-10份、荷叶提取物20-30份、茶多酚10-20份、魔芋粉10-20份、蓝莓果粉10-15份、赤藓糖醇10-15份、菊粉10-15份、连翘提取物1-5份、壳聚糖1-5份。作为优选,所述植物乳杆菌冻干粉和发酵乳杆菌冻干粉中的活菌数均为1×109cfu/g-1×1012cfu/g。一种制备所述减肥粉剂的方法,包括以下步骤:(1)称取各原料备用;(2)将除植物乳杆菌冻干粉和发酵乳杆菌冻干粉以外的原料混合均匀,得到混合半成品;(3)将步骤(2)所得混合半成品进行沸腾制粒,过筛,得到沸腾制粒半成品;(4)将步骤(3)所得沸腾制粒半成品与植物乳杆菌冻干粉、发酵乳杆菌冻干粉混合均匀,得到总混合半成品;(5)将步骤(4)所得总混合半成品进行包装,即得基于乳杆菌的减肥粉剂。在步骤(3)中,将除植物乳杆菌冻干粉和发酵乳杆菌冻干粉外的原料通过沸腾制粒技术进行制粒,可显著改善组合物口感,若采用条包灌装机进行包装,则还可显著改善组合物的灌装性能。作为优选,步骤(2)中,混合转速为15-35rpm,混合时间为10-20min。作为优选,步骤(3)中,沸腾制粒时,进风温度85-95℃,排风变频50%-80%,物料温度50-60℃,雾化压力2.5-3.5bar,喷浆供浆泵转速50-80rpm。作为优选,步骤(3)中,过筛时,筛网选择15-40目标准筛。作为优选,步骤(4)中,混合转速为15-35rpm,混合时间为10-20min。作为优选,步骤(5)中,包装时,充入氮气,残氧量为3%-10%。作为优选,步骤(3)中,沸腾制粒过程采用粘合剂,所述粘合剂为纯水、玉米淀粉、麦芽糊精中的至少一种。作为优选,步骤(1)-(5)全部在gmp车间中恒温恒湿环境中进行,温度为18-26℃,湿度为25%-40%。作为优选,所述植物乳杆菌冻干粉的制备方法包括以下步骤:1)培养基的制备;2)菌株保护剂的制备;3)以5%-10%接种量将植物乳杆菌和/或其突变体接种于发酵基质中进行发酵培养;4)发酵结束后取发酵产物,离心,去除上清液;5)将离心获得的沉积物与菌株保护剂混合;6)冻干;7)冻干产物粉碎、过筛,得到植物乳杆菌冻干粉;所述发酵乳杆菌冻干菌粉的制备方法包括以下步骤:将步骤3)中的植物乳杆菌和/或其突变体换成发酵乳杆菌和/或其突变体,重复步骤1)-7),得到发酵乳杆菌冻干粉。进一步地,步骤1)中,所述培养基为改良mrs培养基;所述培养基包括以下成分:葡萄糖20-30g、牛肉膏10-13g、胰蛋白胨5-7g、大豆蛋白胨5-7g、酵母粉5-6g、醋酸钠3-5g、柠檬酸氢二铵1-2g、磷酸氢二钾2-3g、硫酸镁0.4-0.6g、半胱氨酸盐酸盐0.4-0.7g、吐温-801-2ml、一水合硫酸锰0.2-0.25g、水1000ml;所述培养基的ph为6.5±0.2。进一步地,步骤2)中,所述菌株保护剂包括以下成分:脱脂乳60-100g/l,海藻糖80-120g/l,甘油15-25g/l。进一步地,步骤3)中,发酵温度为34-38℃,发酵时间为13-18h,发酵ph为4.5-6.0。进一步地,步骤5)中,所述离心获得的沉积物与菌株保护剂以1:1.5-3的重量比混合。进一步地,步骤7)中,过筛时,筛网选择15-80目标准筛。作为优选,步骤(5)中,所述含有植物乳杆菌和发酵乳杆菌的减肥组合物的水分含量为2%-5%(质量),水分活度为0.1-0.4aw。与现有技术相比,本发明具有以下优点:(1)本发明中采用的发酵乳杆菌whh3906具有良好的耐酸耐胆盐能力和黏附性,能够显著降低体重、减少体内脂肪堆积、降低脏器比和体脂比,并能降低瘦素水平,降低血脂,改善肥胖相关慢性炎症,缓解非酒精性脂肪肝,可用于预防和治疗肥胖;(2)本发明将发酵乳杆菌whh3906和植物乳杆菌1701复配后,两者在减肥上表现出协同增效的作用,能更有效地促进甘油三酯和胆固醇排出,更好地控制体重以及肝脏和脂肪重量;(3)本发明中的辅料可以抑制致病菌,并作为植物乳杆菌1701和发酵乳杆菌whh3906的能源物质,因而能够促进植物乳杆菌1701和发酵乳杆菌whh3906的生长和定植,促进其发挥降脂减肥的作用。附图说明图1为本发明菌株发酵乳杆菌whh3906的菌落特征(左图)和革兰氏染色显微镜观察特征(右图)。图2为本发明菌株发酵乳杆菌whh3906的生长曲线。图3为本发明菌株发酵乳杆菌whh3906的黏附实验镜检结果图。其中,左图为对照商业菌株lcs的黏附实验镜检结果图,中间图为对照商业菌株lgg的黏附实验镜检结果图,右图为本发明菌株发酵乳杆菌whh3906的黏附实验镜检结果图。图4为大鼠摄食量和摄入总能量的变化。a图为摄食量,b图为摄入总能量。*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。图5为大鼠体重和总增重的变化。a图为体重,b图为总增重。*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。图6为大鼠脂肪重和体脂比的变化。a图为脂肪重,b图为体脂比。*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。图7为大鼠血清总胆固醇和甘油三酯的变化。a图为总胆固醇,b图为甘油三酯。*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。图8为大鼠血清瘦素的变化。*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。图9为各组别大鼠的肝脏组织he染色切片图。切片放大倍数为200倍,其中,左图为对照组,中间为模型组,右边为实验组。具体实施方式下面结合实施例对本发明作进一步的描述。总实施例一种基于乳杆菌的减肥粉剂,包括植物乳杆菌冻干粉1-10份、发酵乳杆菌冻干粉1-10份、荷叶提取物20-30份、茶多酚10-20份、魔芋粉10-20份、蓝莓果粉10-15份、赤藓糖醇10-15份、菊粉10-15份、连翘提取物1-5份、壳聚糖1-5份。所述植物乳杆菌冻干粉、发酵乳杆菌冻干粉中的活菌数均为1×109cfu/g-1×1012cfu/g。所述发酵乳杆菌冻干粉由发酵乳杆菌和/或其突变体制得;所述发酵乳杆菌命名为whh3906,已在2020年3月13日在中国微生物菌种保藏管理委员会普通微生物中心保藏,微生物保藏编号为cgmccno.19472,微生物分类命名为发酵乳杆菌lactobacillusfermentum;所述突变体为对所述发酵乳杆菌进行诱变、驯化、基因重组或者经自然突变而获得的突变体;所述植物乳杆菌冻干粉由植物乳杆菌和/或其突变体制得;所述植物乳杆菌命名为1701,已在2019年10月23日在中国微生物菌种保藏管理委员会普通微生物中心保藏,其保藏编号为cgmccno.18728,微生物分类命名为植物乳杆菌lactobacillusplantarum;所述突变体为对所述植物乳杆菌进行诱变、驯化、基因重组或者经自然突变而获得的突变体。所述植物乳杆菌冻干粉的制备方法包括以下步骤:1)培养基的制备:所述培养基为改良mrs培养基,其配方为葡萄糖20-30g、牛肉膏10-13g、胰蛋白胨5-7g、大豆蛋白胨5-7g、酵母粉5-6g、醋酸钠3-5g、柠檬酸氢二铵1-2g、磷酸氢二钾2-3g、硫酸镁0.4-0.6g、半胱氨酸盐酸盐0.4-0.7g、吐温-801-2ml、一水合硫酸锰0.2-0.25g、水1000ml;调整其ph为6.5±0.2;2)菌株保护剂的制备:所述菌株保护剂的配方为脱脂乳60-100g/l、海藻糖80-120g/l、甘油15-25g/l;3)以5%-10%接种量将植物乳杆菌和/或其突变体接种于发酵基质中进行发酵培养,发酵温度为34-38℃,发酵时间为13-18h,发酵过程ph为5.0-5.6;4)发酵结束后取发酵产物,以4,000-10,000rpm的转速离心3-10min,去除上清液;5)将离心获得的沉积物与菌株保护剂以1:1.5-3的重量比混合;6)冻干;7)冻干产物粉碎、过筛,筛网选择15-80目标准筛,得到植物乳杆菌冻干粉;所述发酵乳杆菌冻干菌粉的制备方法包括以下步骤:将步骤3)中的植物乳杆菌和/或其突变体换成发酵乳杆菌和/或其突变体,重复步骤1)-7),得到发酵乳杆菌冻干粉。一种基于植物乳杆菌和发酵乳杆菌的减肥组合物的制备方法,包括以下步骤:(1)称取各原料备用;(2)将除植物乳杆菌冻干粉、发酵乳杆菌冻干粉以外的原料混合均匀,混合转速为15-35rpm,混合时间为10-20min,得到混合半成品;(3)将步骤(2)所得混合半成品进行沸腾制粒;沸腾制粒过程采用粘合剂,所述粘合剂为纯水、玉米淀粉、麦芽糊精中的至少一种;沸腾制粒时,进风温度85-95℃,排风变频50%-80%,物料温度50-60℃,雾化压力2.5-3.5bar,喷浆供浆泵转速50-80rpm;沸腾制粒后产物进行过筛,筛网选择15-40目标准筛,得到沸腾制粒半成品;(4)将步骤(3)所得沸腾制粒半成品与植物乳杆菌冻干粉、发酵乳杆菌冻干粉混合均匀,混合转速为15-35rpm,混合时间为10-20min,得到总混合半成品;(5)将步骤(4)所得总混合半成品用条包灌装机包装,包装时充入氮气,残氧量为3%-10%,包装采用铝塑包材,即得基于乳杆菌的减肥粉剂;减肥粉剂的水分含量为2-5%(质量),水分活度为0.1-0.4aw。步骤(1)-(5)全部在十万级gmp车间中恒温恒湿环境中进行,温度为18-26℃,湿度为25-40%。实施例1:基于乳杆菌的减肥粉剂一种基于乳杆菌的减肥粉剂,包括植物乳杆菌冻干粉5份、发酵乳杆菌冻干粉5份、荷叶提取物20份、茶多酚10份、魔芋粉20份、蓝莓果粉10份、赤藓糖醇13份、菊粉15份、连翘提取物1份、壳聚糖1份。所述植物乳杆菌冻干粉和发酵乳杆菌冻干粉中的活菌数均为1×1011cfu/g。所述植物乳杆菌冻干粉的制备方法包括以下步骤:1)培养基的制备:所述培养基为改良mrs培养基,其配方为葡萄糖20g、牛肉膏10g、胰蛋白胨5g、大豆蛋白胨5g、酵母粉5.5g、醋酸钠4g、柠檬酸氢二铵1.5g、磷酸氢二钾2g、硫酸镁0.6g、半胱氨酸盐酸钠0.4g、吐温-801ml、一水合硫酸锰0.23g、水1000ml;调整其ph为6.5;2)菌株保护剂的制备:所述菌株保护剂的配方为脱脂乳80g/l、海藻糖100g/l、甘油20g/l;3)以10%接种量将植物乳杆菌接种于发酵基质中进行发酵培养,发酵温度为37℃,发酵时间为16h,发酵过程ph为5.5;4)发酵结束后取发酵产物,以8,000rpm的转速离心10min,去除上清液;5)将离心获得的沉积物与菌株保护剂以1:2的重量比混合;6)冻干;7)冻干产物粉碎、过筛,筛网选择60目标准筛,得到植物乳杆菌冻干粉;所述发酵乳杆菌冻干菌粉的制备方法包括以下步骤:将步骤3)中的植物乳杆菌和/或其突变体换成发酵乳杆菌,重复步骤1)-7),得到发酵乳杆菌冻干粉。一种基于乳杆菌的减肥粉剂的制备方法,包括以下步骤:(1)称取各原料备用;(2)将除植物乳杆菌冻干粉、发酵乳杆菌冻干粉以外的原料混合均匀,混合转速为30rpm,混合时间为15min,得到混合半成品;(3)将步骤(2)所得混合半成品进行沸腾制粒;沸腾制粒过程采用纯水作为粘合剂;沸腾制粒时,进风温度85℃,排风变频80%,物料温度50℃,雾化压力2.5bar,喷浆供浆泵转速80rpm;沸腾制粒后产物进行过筛,筛网选择20目标准筛,得到沸腾制粒半成品;(4)将步骤(3)所得沸腾制粒半成品与植物乳杆菌冻干粉、发酵乳杆菌冻干粉混合均匀,混合转速为30rpm,混合时间为15min,得到总混合半成品;(5)将步骤(4)所得总混合半成品用条包灌装机包装,包装时充入氮气,残氧量为5%,包装采用铝塑包材,即得基于乳杆菌的减肥粉剂。步骤(1)-(5)全部在十万级gmp车间中恒温恒湿环境中进行,温度为25℃,湿度为40%。对所得减肥粉剂进行关键指标检测,检测结果见表1。表1实施例1所得减肥粉剂检测结果实施例2:基于乳杆菌的减肥粉剂一种基于乳杆菌的减肥粉剂,包括植物乳杆菌冻干粉1份、发酵乳杆菌冻干粉1份、荷叶提取物22份、茶多酚12份、魔芋粉20份、蓝莓果粉12份、赤藓糖醇12份、菊粉12份、连翘提取物1份、壳聚糖2份。所述植物乳杆菌冻干粉和发酵乳杆菌冻干粉中的活菌数均为5×1011cfu/g。所述植物乳杆菌冻干粉的制备方法包括以下步骤:1)培养基的制备:所述培养基为改良mrs培养基,其配方为葡萄糖25g、牛肉膏13g、胰蛋白胨7g、大豆蛋白胨7g、酵母粉6g、醋酸钠5g、柠檬酸氢二铵2g、磷酸氢二钾3g、硫酸镁0.6g、半胱氨酸盐酸钠0.7g、吐温-801ml、一水合硫酸锰0.25g、水1000ml;调整其ph为6.7;2)菌株保护剂的制备:所述菌株保护剂的配方为脱脂乳100g/l、海藻糖120g/l、甘油25g/l;3)以5%接种量将植物乳杆菌接种于发酵基质中进行发酵培养,发酵温度为37℃,发酵时间为18h,发酵过程ph为5.6;4)发酵结束后取发酵产物,以10,000rpm的转速离心3min,去除上清液;5)将离心获得的沉积物与菌株保护剂以1:3的重量比混合;6)冻干;7)冻干产物粉碎、过筛,筛网选择80目标准筛,得到植物乳杆菌冻干粉;所述发酵乳杆菌冻干菌粉的制备方法包括以下步骤:将步骤3)中的植物乳杆菌和/或其突变体换成发酵乳杆菌,重复步骤1)-7),得到发酵乳杆菌冻干粉。一种基于乳杆菌的减肥粉剂的制备方法,包括以下步骤:(1)称取各原料备用;(2)将除植物乳杆菌冻干粉、发酵乳杆菌冻干粉以外的原料混合均匀,混合转速为30rpm,混合时间为15min,得到混合半成品;(3)将步骤(2)所得混合半成品进行沸腾制粒;沸腾制粒过程采用纯水作为粘合剂;沸腾制粒时,进风温度85℃,排风变频80%,物料温度50℃,雾化压力2.5bar,喷浆供浆泵转速80rpm;沸腾制粒后产物进行过筛,筛网选择20目标准筛,得到沸腾制粒半成品;(4)将步骤(3)所得沸腾制粒半成品与植物乳杆菌冻干粉、发酵乳杆菌冻干粉混合均匀,混合转速为30rpm,混合时间为15min,得到总混合半成品;(5)将步骤(4)所得总混合半成品用条包灌装机包装,包装时充入氮气,残氧量为5%,包装采用铝塑包材,即得基于乳杆菌的减肥粉剂。步骤(1)-(5)全部在十万级gmp车间中恒温恒湿环境中进行,温度为25℃,湿度为40%。对所得减肥粉剂进行关键指标检测,检测结果见表2。表2实施例2所得减肥粉剂检测结果实施例3:减肥效果本实施例根据国家保健食品检验与评价技术规范进行,在基础饲料中添加15%蔗糖、15%猪油、10%酪蛋白来诱发雄性大鼠肥胖。同时灌胃植物乳杆菌1701和发酵乳杆菌whh3906、除2株菌外的所有辅料以及完整减肥组合物,其间每周对大鼠摄食量和体重进行监测,最后检测大鼠体重、肝脏和脂肪重量、粪便中甘油三脂(tg)和总胆固醇(tc)的含量,来判断该组合物是否具有减轻大鼠体重的功效。1实验和分组本实施例将大鼠分成15组,各组的大鼠数量和处理方式见表3。其中,实验组1、3、4、5、6、7、8、9、10、11、12、13采用的植物乳杆菌冻干菌粉和发酵乳杆菌冻干菌粉与实施例1中的相同;实验组2和实验组3采用的辅料中,各辅料的配比与实施例1相同;实验组1-13中,灌胃液体中的溶剂均为生理盐水。表3实验分组及组别处理方式2实验方法选择6-8周龄的spf级雄性大鼠(200±20g)作为实验对象。动物饲养保持环境温度为21±2℃,湿度为30%-70%,12h光照交替,自由饮水,自由摄入饲料。饲料购自江苏省协同医药生物工程有限责任公司,基础饲料主要由鱼粉、小麦、玉米、豆粕、麸皮等组成,高脂饲料是在基础饲料中添加15%蔗糖、15%猪油、10%酪蛋白。适应期结束后先随机分成2组,10只大鼠给予正常饲料作为空白组,210只给予高脂饲料作为模型组,每周监测摄食量和体重。饲喂2周后,将模型组大鼠按体重增重排序,淘汰体重增重较低的1/3肥胖抵抗大鼠。将剩余的140只肥胖大鼠按体重随机分成14组,分别为模型组和13个实验组。模型组和实验组给予高脂饲料,空白组给予正常饲料。13个实验组分别灌胃相应的受试样品,模型组和空白组均给予等量的生理盐水。灌胃时间为10周,期间监测每周的摄食量和体重。试验结束后,称体重,1%戊巴比妥钠(0.5ml/100gbw)麻醉,解剖称取肾周围脂肪、睾丸周围脂肪以及肝脏组织。取粪便,用试剂盒检测粪便中tc和tg的含量。3实验结果3.1造模期间大鼠的体重变化根据表4可知,与模型组相比,第2周空白组大鼠的体重显著低于模型组(p<0.01),说明大鼠肥胖模型建立成功。表4造模期间大鼠体重变化组别第0周(g)第1周(g)第2周(g)空白组(n=10)220.70±10.58250.32±10.44276.04±10.83**模型组(n=210)220.23±11.16262.19±12.55299.35±13.98*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。3.2大鼠每日摄食量和能量摄入量根据表5可知,实验期间,空白组大鼠的每日摄食量显著高于模型组(p<0.05),但空白组大鼠的每日能量摄入量显著低于模型组(p<0.05);而模型组和13个实验组之间无显著差异(p>0.05),表明摄入植物乳杆菌和发酵乳杆菌、减肥组合物中的辅料、各辅料与乳杆菌的组合以及完整减肥组合物均不影响高脂饮食大鼠每日的摄食量和能量摄入量。表5每日摄食量和能量摄入的变化组别摄食量(g/d)日能量摄入(kcal/d)空白组20.45±0.49*73.95±1.78*模型组18.25±0.6280.08±2.67实验组118.43±0.4279.07±1.38实验组219.01±0.5382.41±2.73实验组318.42±0.3479.84±1.45实验组418.53±0.4780.23±1.21实验组518.41±0.3379.72±1.27实验组618.59±0.2980.49±1.01实验组718.24±0.3979.64±1.35实验组818.22±0.3579.52±1.42实验组918.86±0.2980.64±1.03实验组1018.39±0.4680.24±1.39实验组1118.45±0.4180.37±1.32实验组1218.36±0.3780.19±1.18实验组1318.47±0.3180.39±1.07*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。3.3实验期间大鼠的体重变化实验期间,各个组别大鼠的体重变化如表6所示,从中可以看出:(1)空白组(第10周时达到421.6g)的大鼠体重始终显著低于模型组(第10周时达到515.40g)(p<0.01)。(2)实验组1至13的结果显示,从第6周开始,所有实验组大鼠的体重均显著低于模型组(p<0.05),其中,实验组3的大鼠体重最低(实验组3的大鼠体重在第10周时达到448.4g),表明植物乳杆菌1701和发酵乳杆菌whh3906、减肥组合物中的辅料、各辅料与乳杆菌的组合以及完整减肥组合物均具有减缓高脂饮食大鼠体重增长的作用,完整组合物(2株菌+所有辅料)表现出的控制体重效果最佳。(3)实验组1的大鼠体重在第10周时达到463.6g,低于单株菌实验组4(469.1g)、5(471.8g),表明植物乳杆菌1701与发酵乳杆菌whh3906的结合使用效果优于单株菌的使用,两者在控制高脂饮食大鼠体重上具有协同作用。(4)实验组3的大鼠体重在第3周开始低于实验组1和2,且差距逐渐增大,表明辅料与两株菌的结合使用效果优于两株菌或者所有辅料单独使用,两者在控制高脂饮食大鼠体重上具有协同作用。(5)实验组6-13的大鼠体重在第10周时均低于实验组1,表明荷叶提取物、茶多酚、魔芋粉、蓝莓果粉、赤藓糖醇、菊粉、连翘提取物、壳聚糖这八种辅料与两株菌的结合使用后,在控制高脂饮食大鼠体重上均具有协同作用。表6大鼠的体重变化组别第0周(g)第3周(g)第6周(g)第10周(g)空白组275.70±11.22**330.00±15.26**377.20±19.73**421.60±18.21**模型组306.10±9.88383.60±13.20447.00±15.88515.40±18.87实验组1306.40±10.53371.50±14.22410.00±19.03*463.56±17.85**实验组2306.60±11.08377.10±16.42426.60±20.89*485.80±20.07*实验组3306.20±11.23370.20±16.34401.20±20.97**438.40±16.49**实验组4306.70±9.87372.20±14.31419.00±19.03*479.13±19.14**实验组5306.30±10.04373.00±13.87421.00±18.56*481.80±19.11**实验组6306.20±11.07370.90±14.02413.50±19.52**444.30±19.21**实验组7306.40±10.46371.10±14.75414.20±19.63**446.20±17.65**实验组8306.20±10.73371.30±15.13414.90±18.27*447.00±18.43**实验组9306.50±11.05371.50±15.26416.00±19.05*449.80±18.52**实验组10306.21±10.29371.80±14.34415.90±19.32*445.21±17.66**实验组11306.55±11.00371.10±14.37415.00±18.97*447.50±18.67**实验组12306.40±10.23371.20±13.58414.90±20.04*448.00±19.06**实验组13306.10±9.76371.30±14.69415.80±18.92*449.30±18.41***:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。3.4大鼠的肝脏、脂肪重量变化根据表7可知,由于高脂饮食的影响,大鼠的肝脏和脂肪重量显著升高(p<0.01)。而13个实验组的处理均有助于减少肝脏和脂肪重量的增加,其中灌胃完整组合物(实验组3)的效果最佳,其次为2株菌与单独每种辅料的结合使用(实验组6至13),再者是2株菌结合使用(实验组1),最后是所有辅料(实验组2)以及两株菌单独使用(实验组4和5),这些结果表明:植物乳杆菌1701与发酵乳杆菌whh3906之间、两株菌与所有辅料之间、两株菌与单一辅料之间均具有协同作用,复配效果更佳,且2株菌和其余辅料结合的完整组合物显示出最强的减少脂肪堆积、降低脏器比和体脂比的作用。表7大鼠的肝脏和脂肪重量组别肝脏重(g)脏器比(%)脂肪重(g)体脂比(%)空白组14.25±0.84**3.38±0.11**22.30±1.90**5.29±0.34**模型组22.32±1.124.33±0.1443.29±2.778.40±0.35实验组117.29±1.30**3.73±0.17**32.72±2.19**7.06±0.39*实验组218.70±1.19*3.85±0.16*37.21±1.69*7.66±0.25*实验组314.60±0.98**3.33±0.13**29.86±1.64**6.81±0.18**实验组418.30±1.03**3.82±0.14**34.73±1.21**7.25±0.30*实验组518.65±0.84*3.87±0.11**35.26±1.02*7.32±0.23*实验组615.81±1.07**3.56±0.12**30.43±1.06**6.85±0.27*实验组716.15±1.22**3.62±0.14**30.65±1.27**6.87±0.31*实验组816.23±1.15**3.63±0.12**30.71±1.35**6.87±0.26*实验组916.37±1.03**3.64±0.11**30.99±1.51**6.89±0.32*实验组1015.89±0.97**3.57±0.11**30.54±1.64**6.86±0.29*实验组1116.11±1.08**3.60±0.13**30.74±1.23**6.87±0.37*实验组1216.22±1.12**3.62±0.14**30.87±1.48**6.89±0.28*实验组1316.31±1.31**3.63±0.13**30.91±1.75**6.88±0.16**:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。3.5大鼠粪便中甘油三脂和总胆固醇含量的变化根据表8可知,空白组大鼠粪便中的tc含量显著低于模型组(p<0.01),且tg含量显著高于模型组(p<0.01),这与摄入饲料的脂质配比与含量不同有关。所有实验组大鼠粪便中的tc、tg外排量显著高于模型组(p<0.05),且服用完整组合物的实验组3的脂质外排量最高(tc外排量达到20.95μmol/g,tg外排量达到4.25μmol/g),降脂效果最佳。此外,2株菌结合使用(实验组1)的tc、tg外排效果优于单株菌使用(实验组4、5),2株菌与所有辅料结合使用(实验组3)的tc、tg外排效果优于2株菌结合使用(实验组1)以及所有辅料结合使用(实验组2),并且实验组6至13的结果表明,2株菌与单独每种辅料的结合使用优于2株菌结合使用(实验组1)的效果,特别是2株菌+茶多酚配合使用的实验组7(tc外排量达到19.52μmol/g)、2株菌+魔芋粉配合使用的实验组8(tg外排量达到4.12μmol/g)。以上结果表明单独服用辅料对于促进体内脂质外排作用较为有限,但植物乳杆菌1701和发酵乳杆菌whh3906的结合使用、2株菌与辅料结合使用后,具有较好的协同作用,能更好地促进摄入的脂质外排,且完整组合物的效果最好。表8大鼠粪便中甘油三脂和总胆固醇的含量*:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01。综上所述,植物乳杆菌1701和发酵乳杆菌whh3906、减肥菌剂中的辅料均表现出降低体重、减少体内脂肪堆积、降低脏器比和体脂比以及促进脂质外排的作用。此外,2株菌之间以及菌株与辅料之间具有协同作用,相较于单独服用而言,复配后能够表现出更好的减肥效果。实施例4:发酵乳杆菌whh3906的生物学性质本发明所提供的菌株经鉴定属于发酵乳杆菌(lactobacillusfermentum),命名为whh3906菌株,于2020年3月13日在中国微生物菌种保藏管理委员会普通微生物菌种保藏中心保藏,微生物保藏编号为cgmccno.19472。本发明所提供的菌株发酵乳杆菌whh3906是从我国西藏自治区采集的酥油中分离得到。本发明所提供的菌株发酵乳杆菌whh3906的生物学性质如下:形态学特征:在mrs琼脂培养基中生长形态为乳白色圆形菌落,表面光滑湿润、边缘整齐、不透明、中央凸起。革兰氏染色呈典型阳性,显微镜下观察细胞呈短杆状,无鞭毛,不产芽孢,不运动(图1所示)。培养特征:最适生长温度为37℃,兼性厌氧,生长于mrs培养基中。生理特征:使用api50chl系统。表9中列出了本发明菌株发酵乳杆菌whh3906的api50chl测试的结果。表9api50结果生物学鉴定:针对16srrna基因序列测序,结果如seqidno:1所示,将序列于ncbi的genbank数据库中进行同源性比对分析,结果显示该菌株为发酵乳杆菌(lactobacillusfermentum)。实施例5:发酵乳杆菌whh3906的培养本发明菌株发酵乳杆菌whh3906经二代活化后,按1%接种量接种于mrs培养基中,在37℃温度下培养24h,每隔1h取样一次,测定在600nm波长的光密度(od)值,绘制生长曲线,设置三次重复。结果如图2所示,发酵乳杆菌whh3906在经过0-2h的迟缓期后,从2h开始快速生长进入对数生长期,13h结束对数期进入稳定期。实施例6:发酵乳杆菌whh3906的耐酸耐胆盐性能本发明菌株发酵乳杆菌whh3906、对照商业菌株干酪乳杆菌代田株(lcs)和对照商业菌株鼠李糖乳杆菌gg(lgg)经二代活化后,取对数生长末期菌液,4000rpm离心10min,弃上清,获得菌泥,分别进行如下操作:①加入相同体积ph2.5的mrs溶液,吹打混匀后,在37℃环境下孵育,用稀释涂布计数法测定0点及孵育1h、2h、4h后菌数的变化;②加入相同体积的含0.3%胆盐的mrs溶液,吹打混匀后,在37℃环境下孵育,用稀释涂布计数法测定0点及孵育4h、8h后菌数的变化,设置三次重复。菌株存活率计算公式:菌株存活率(%)=n1/n0*100%。n1为菌株孵育后活菌数的log10值,n0为菌株初始活菌数的log10值。结果如表10所示,本发明菌株发酵乳杆菌whh3906具有良好的耐受特性。在ph2.5环境下,孵育2h存活率为98.97%,孵育4h存活率为97.48%,显著优于对照商业菌株lcs,与对照商业菌株lgg相当。在0.3%胆盐浓度下,孵育4h存活率为80.38%,孵育8h存活率为79.85%,且4-8h活菌数基本没有变化,而对照商业菌株lcs和lgg未检测到活菌数。说明发酵乳杆菌whh3906具有良好的胃酸和胆盐耐受特性,优于对照商业菌株lcs和lgg。表10耐受性结果-:未检测到。实施例7:发酵乳杆菌whh3906的黏附性建立ht-29细胞培养体系,细胞生长于含10%胎牛血清的dmem培养基中(含青霉素100u/ml,链霉素100mg/ml)。待细胞传至第三代,采用0.25%的胰酶(含edta)消化,获得单细胞悬液,细胞以1×106细胞/孔的密度接种于已放置细胞爬片的12孔细胞培养板中,于37℃,5%co2培养箱中培养2d。本发明菌株发酵乳杆菌whh3906、对照商业菌株干酪乳杆菌代田株(lcs)和对照商业菌株鼠李糖乳杆菌gg(lgg)经二代活化后,取对数生长末期菌液,4000rpm离心10min,弃上清,获得菌泥,重悬于含10%胎牛血清的dmem完全培养基(不加双抗)中,取2×108cfu/ml的菌液1ml接种于上述12孔细胞培养板中,37℃下于5%co2培养箱中孵育2h。孵育结束后,缓慢吸去培养液,用pbs洗涤3次,用100%甲醇固定8min。取出细胞爬片静置20min,经革兰氏染色后,用中性树脂封片。于光学显微镜下进行观察,设置三次重复,每个片子随机选取10个视野计数。结果如表11和图3所示,发酵乳杆菌whh3906的单细胞黏附数达7.01±0.86,显著优于对照商业菌株lcs和lgg(1.51±0.30,5.25±0.78)。表11黏附性结果菌株编号黏附率(菌数/细胞数)lcs1.51±0.30algg5.25±0.78bwhh39067.01±0.86ca,b,c:p<0.05。实施例8:发酵乳杆菌whh3906的减肥功效本发明根据国家保健食品管理法规的有关规定,采用大鼠,在基础饲料中添加15%蔗糖、15%猪油、10%酪蛋白来诱发大鼠肥胖症。同时灌胃发酵乳杆菌whh3906菌株,活菌数1×109cfu/ml,其间每周对大鼠摄食量和体重进行检测,最后检测大鼠体重和脂肪含量,来判断该菌株是否具有减轻大鼠体重的功效。将健康的spf级雄性大鼠(6-8周龄,200±20g),适应7天后,随机分为3组,每组10只。动物饲养保持环境温度为21±2℃,湿度为30-70%,12h光照交替,自由饮水,自由摄入饲料,试验周期为8周。分组如下:对照组:基础饲料喂养;模型组:高脂饲料喂养造模,诱导肥胖模型;实验组:高脂饲料喂养造模,灌胃本发明菌株发酵乳杆菌whh3906菌悬液,灌胃剂量为1×109cfu/d;饲料购自江苏省协同医药生物工程有限责任公司,基础饲料主要由鱼粉、小麦、玉米、豆粕、麸皮等组成,总能:3616kcal/kg;高脂饲料是在基础饲料中添加15%蔗糖、15%猪油、10%酪蛋白,总能:4334kcal/kg。试验结束后,称体重,1%戊巴比妥钠(0.5ml/100gbw)麻醉,采用心脏穿刺取血获取大鼠血液样本,将血液样本取出后,静置30min,4℃,4000rpm离心15min,取上清,用elisa试剂盒检测血清中总胆固醇、甘油三酯和瘦素含量。脱颈处死后,解剖取肝脏、肾周围脂肪、睾丸周围脂肪,并称重,计算脏器比和体脂比。由图4可知,实验组的摄食量(图4a)和能量摄入量(图4b)同模型组之间无显著差异,说明发酵乳杆菌whh3906并不是通过减少摄食量和能量摄入降低体重。由图5a可知,高脂饮食饲喂一周后,与对照组相比,模型组体重显著高于对照组(p<0.01),说明造模成功。与模型组相比,第0-6周实验组体重低于模型组,但没有显著性差异,第6-8周实验组体重显著低于模型组(p<0.05,p<0.01),第8周时,体重降低水平达8.18%。由图5b可知,与模型组相比,实验组体重总增重显著低于模型组(p<0.01),比模型组低22.03%。说明发酵乳杆菌whh3906服用浓度在1×109cfu/d能够显著降低体重。由图6可知,与模型组相比,实验组脂肪重和体脂比显著低于模型组(图6a和b,p<0.05,p<0.01),分别比模型组降低19.13%和13.25%。说明发酵乳杆菌whh3906菌株服用浓度在1×109cfu/d能够显著减少脂肪堆积和降低体脂比。由图7可知,与模型组相比,实验组血清中总胆固醇(图7a)和甘油三酯(图7b)显著低于模型组(p<0.01,p<0.05)。说明发酵乳杆菌whh3906菌株服用浓度在1×109cfu/d能够显著降低血脂水平。由图8可知,与模型组相比,实验组血清中瘦素含量显著下降(p<0.01)。说明发酵乳杆菌whh3906菌株服用浓度在1×109cfu/d能够显著降低血清瘦素水平,从而促进脂解和脂肪细胞凋亡,抑制脂肪合成,减少体内脂肪堆积,减轻体重。总之,发酵乳杆菌whh3906菌株服用浓度在1×109cfu/d能够显著降低体重,减少脂肪堆积,降低体脂比、血脂和血清瘦素,促进脂解和脂肪细胞凋亡,抑制脂肪合成,是一株具有减肥功能的新菌株。实施例9:发酵乳杆菌whh3906缓解非酒精性脂肪肝的功效1清除dpph自由基的能力本发明菌株发酵乳杆菌whh3906和对照商业菌株鼠李糖乳杆菌gg(lgg)经二代活化后,取对数生长末期菌液,4000rpm离心10min,弃上清,获得菌泥,pbs(ph=7.4)洗涤2次,菌悬液od600调至0.5±0.1。在反应体系中加入发酵乳杆菌whh3906的菌悬液1ml,再加入1ml0.1mmol/ldpph的无水乙醇溶液,充分混匀后,室温下避光反应30min,然后经过6000rpm离心10min,取上清液,测定517nm处的吸光度(od值)。以等体积的生理盐水代替样品溶液作为对照组,并用等体积的生理盐水和无水乙醇的混合液作为空白调零。按照下式计算dpph自由基的清除率:dpph自由基清除率=(a0-a1)/a0×100%。a0:对照的od510值,a1:植物乳杆菌1701菌液的od510值。如表12所示,发酵乳杆菌whh3906的dpph自由基清除率达96.24±1.06%,显著高于对照商业菌株lgg(清除率为45.90±0.89%),是对照商业菌株的2.10倍。说明发酵乳杆菌whh3906具有较强的抗氧化能力。表12菌株的dpph自由基清除能力结果菌株编号lggwhh3906dpph自由基清除率(%)45.90±0.8996.24±1.06**与商业对照菌相比,**:p<0.01。2清除羟自由基的能力本发明菌株发酵乳杆菌whh3906和对照商业菌株鼠李糖乳杆菌gg(lgg)经二代活化后,取对数生长末期菌液,4000rpm离心10min,弃上清,获得菌泥,pbs(ph=7.4)洗涤2次,测定菌悬液od600。在反应体系中加入od值为5的发酵乳杆菌whh3906菌悬液1ml,再加入1ml生理盐水和1mlfeso4(3mmol/l)。混匀后,加入1mlh2o2(3mmol/l),室温静置10min后加入1ml水杨酸(3mmol/l,乙醇溶解),混匀,37℃水浴20min,离心取上清测定510nm处的吸光值。以等体积的生理盐水代替样品溶液作为对照组,并用等体积的生理盐水和无水乙醇的混合液作为空白调零。按照下式计算羟自由基的清除率:羟自由基清除率=(as-ap)/as×100%ap:发酵乳杆菌whh3906菌液的od510值,as:菌悬液换成0.9%的生理盐水的od510值。如表13所示,发酵乳杆菌whh3906的羟自由基清除率达95.01±3.54%,显著高于对照商业菌株lgg(清除率为56.29±2.13%),是对照商业菌株的1.69倍。说明发酵乳杆菌whh3906具有较强的抗氧化能力。表13菌株的羟自由基清除能力结果菌株编号lggwhh3906羟自由基清除率(%)56.29±2.1395.01±3.54**与商业对照菌相比,**:p<0.01。3对肝脏重量以及肝脏中的甘油三酯和总胆固醇含量的影响将健康的spf级雄性大鼠(6-8周龄,200±20g),适应7天后,随机分为3组,每组10只。动物饲养保持环境温度为21±2℃,湿度为30-70%,12h光照交替,自由饮水,自由摄入饲料。饲料购自江苏省协同医药生物工程有限责任公司,基础饲料主要由鱼粉、小麦、玉米、豆粕、麸皮等组成;高脂饲料是在基础饲料中添加15%蔗糖、15%猪油、10%酪蛋白。动物实验分组如下:对照组:基础饲料喂养;模型组:高脂饲料喂养造模,诱导肥胖模型,使大鼠发生非酒精性脂肪肝;实验组:高脂饲料喂养造模,灌胃发酵乳杆菌whh3906菌悬液,灌胃剂量为1×109cfu/d;试验周期为10周,试验结束后,称取体重,1%戊巴比妥钠(0.5ml/100gbw)麻醉,采用心脏穿刺取血获取大鼠血液样本,静置30min,4℃,4000rpm离心15min,取上清,备用。脱颈处死后,解剖取肝脏并称重,按照下式计算肝重系数:肝重系数=肝脏重量(g)/体重(g)×100%。肝脏称重后用pbs缓冲液制成匀浆,用试剂盒测定肝脏中甘油三酯、总胆固醇的含量。另取同一部位肝脏以1:9体积比,用4%多聚甲醛固定,用于石蜡包埋切片,随后进行he染色,显微镜下观察肝脏组织形态变化。由表14可知,与对照组相比,模型组大鼠的体重、肝脏重量以及肝重系数均显著高于对照组(p<0.001),肝脏重比对照组高出46.17%,表明大鼠已经形成非酒精性脂肪肝。与此同时,实验组的体重、肝重显著低于模型组(p<0.01),计算得到的肝重指数亦显著低于模型组(p<0.01)。说明发酵乳杆菌whh3906在摄入剂量为1×109cfu/d时,具有显著改善非酒精性脂肪肝的作用。表14大鼠的体重、肝重及肝重系数组别体重(g)肝脏重(g)肝重系数(%)对照组361.41±15.60***12.93±0.94***3.58±0.22***模型组437.01±11.1918.90±0.984.62±0.14实验组386.50±37.25**15.71±2.44**4.05±0.25***:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01;***:表示与模型组相比,差异极极显著,p<0.001。由表15可知,与对照组相比,模型组大鼠肝脏中的甘油三酯和总胆固醇含量显著高于对照组(p<0.001),说明高脂饮食会导致大鼠肝脏中脂质的增加,造成非酒精性脂肪肝。同时,实验组大鼠肝脏中的甘油三酯和总胆固醇含量显著低于模型组(p<0.05和p<0.01)。说明发酵乳杆菌whh3906菌株在摄入剂量为1×109cfu/d时,可以有效减少肝脏中甘油三酯和总胆固醇含量的增加。表15大鼠肝脏中的甘油三酯和总胆固醇含量组别甘油三酯(mmol/l)总胆固醇(mmol/l)对照组21.78±4.68***0.34±0.03***模型组258.53±14.940.66±0.08实验组240.25±17.15*0.56±0.07***:表示与模型组相比,差异显著,p<0.05;**:表示与模型组相比,差异极显著,p<0.01;***:表示与模型组相比,差异极极显著,p<0.001。组织形态学观察结果如图9所示,对照组大鼠的肝脏组织结构完整,细胞界限清晰,细胞核位于中央,未发现脂肪空泡。而模型组大鼠的肝脏细胞结构被破坏,胞内存在大量大小不等的脂滴聚集,细胞间隙不清,脂肪沉积明显,可见大量肝细胞脂肪空泡,说明高脂饮食会诱导大鼠非酒精性脂肪肝的发生。同时,我们发现实验组大鼠的肝脏细胞脂肪变性减少,脂肪空泡减少,且空泡变小。说明发酵乳杆菌whh3906菌株在摄入剂量为1×109cfu/d时,可以有效缓解高脂饮食诱导的非酒精性脂肪肝。综上所述,发酵乳杆菌whh3906菌株在摄入剂量为1×109cfu/d时,可有效缓解高脂饮食诱导的非酒精性脂肪肝,减少肝脏中甘油三酯和胆固醇的积累,减轻肝脏组织脂肪变性,是一株具有缓解非酒精性脂肪肝功能的菌株。实施例10:发酵乳杆菌whh3906缓解慢性炎症的功效1对脾淋巴细胞增殖的影响昆明小鼠饲养温度为22±2℃,湿度为30-70%,12h光照交替,自由饮用水。昆明小鼠饲养1周后,断颈处死,无菌取小鼠脾脏,用无菌的玻璃注射器芯将其碾碎,200目金属筛网过滤后,经ack细胞裂解液裂解5min,加入含10%胎牛血清的无菌hank’s液终止裂解,1000rpm,4℃离心5min,沉淀重悬于5ml含10%胎牛血清的rpmi-1640培养基。用台盼蓝染色,血细胞计数板计数,计算活细胞数和活细胞率。调整细胞浓度为5×106cells/ml。本发明菌株发酵乳杆菌whh3906和对照商业菌株干酪乳杆菌代田株(lcs)经二代活化后,调节菌浓度为1×107cfu/ml。将细胞悬液加至96孔细胞培养板,每个处理5个重复,分为调零组(细胞培养基),空白对照组(细胞培养基+细胞悬液),诱导剂组(细胞培养基+细胞悬液+诱导剂10μg/mlcona或10μg/mllps),菌处理组(细胞培养基+细胞悬液+诱导剂10μg/mlcona或10μg/mllps+菌悬液1×107cfu/ml)。37℃条件下,co2培养箱中培养72h。培养结束后,加入mtt溶液(2.5mg/ml),37℃共孵育4h后,吸出上清,再加入100μldmso,最后于490nm下测定吸光值。结果如表16所示,在不加诱导剂的情况下,对照商业菌株lcs和whh3906均可以显著促进小鼠脾淋巴细胞的增殖(分别为p<0.01和p<0.05)。在添加诱导剂cona的条件下,对照商业菌株lcs和whh3906均可以有效提高小鼠脾淋巴细胞中t淋巴细胞的增殖能力(p<0.01),并且在添加诱导剂lps的条件下,whh3906在一定程度上可以促进小鼠脾淋巴细胞中b淋巴细胞的增殖,但是对照商业菌株lcs效果不是很明显。表明本发明菌株发酵乳杆菌whh3906在体外可以有效促进小鼠脾淋巴细胞的增殖。表16菌株对小鼠脾淋巴细胞增殖的影响结果处理方式空白对照lcswhh3906不加诱导剂0.176±0.0060.246±0.021**0.227±0.010*cona(10μg/ml)0.804±0.0580.901±0.050**0.870±0.040**lps(10μg/ml)0.803±0.0140.797±0.0140.829±0.026*:与空白对照相比,差异显著,p<0.05;**:与空白对照相比,差异极显著,p<0.01。2对脾淋巴细胞分泌炎症因子的影响按照实施例7“1对脾淋巴细胞增殖的影响”中小鼠脾淋巴细胞的制备方法制备脾淋巴细胞悬液,调整细胞浓度为5×106cells/ml。本发明菌株发酵乳杆菌whh3906和对照商业菌株干酪乳杆菌代田株(lcs)经二代活化后,调整均浓度到1×107cfu/ml。将细胞悬液加入96孔细胞培养板,每个处理5个重复,分为调零组(细胞培养基),空白对照组(细胞培养基+细胞悬液),菌处理组(细胞培养基+细胞悬液+菌悬液1×107cfu/ml),37℃条件下,co2培养箱中培养48h。培养结束后,1500rpm离心10min,吸取上清,0.22μm滤膜过滤,采用elisa试剂盒测定il-10和il-12含量。结果如表17所示,与空白对照组相比,whh3906能够显著促进脾淋巴细胞分泌细胞因子il-10,到达353.75±2.25pg/ml,显著高于商业对照菌株(305.82±4.26pg/ml),是对照商业菌株的1.16倍;同时,whh3906能够显著促进脾淋巴细胞分泌细胞因子il-12,到达218.28±1.47pg/ml,显著高于商业对照菌株(171.96±3.68pg/ml),是对照商业菌株的1.27倍。说明发酵乳杆菌whh3906能够显著促进脾淋巴细胞分泌细胞因子,且分泌il-10的能力更强,具有抗炎活性。表17菌株对小鼠脾淋巴细胞分泌il-10和il-12的影响结果组别il-10il-12空白对照192.73±2.5997.24±2.28lcs305.82±4.26***171.96±3.68***whh3906353.75±2.25***###218.28±1.47***###***:与空白对照相比,差异极极显著,p<0.001;###:与lcs相比,差异极极显著,p<0.001。3对巨噬细胞分泌炎症因子的影响建立raw264.7细胞培养体系,细胞生长于含10%胎牛血清的dmem培养基中(含青霉素100u/ml,链霉素100mg/ml)。待细胞传至第三代,采用0.25%的胰酶(含edta)消化,获得单细胞悬液,细胞以1×106细胞/孔的密度接种于24孔细胞培养板中,于37℃,5%co2培养箱中培养48h。本发明菌株发酵乳杆菌whh3906和对照商业菌株干酪乳杆菌代田株(lcs)经二代活化后,取对数生长末期菌液,4000rpm离心10min,弃上清,获得菌泥,重悬于含10%胎牛血清的dmem完全培养基(不加双抗)中,制成1×109cfu/ml的菌液。非炎症模型组每孔加入100μl菌悬液(1×109cfu/ml),炎症模型组每孔加入100μl菌悬液(1×109cfu/ml)和100μllps(10μg/ml),于37℃,5%co2培养箱中共孵育24h。然后,1500rpm离心10min,吸取上清,0.22μm滤膜过滤,采用elisa试剂盒测定no、il-10、il-6和tnf-α含量。结果如表18所示,在没有炎症诱导剂lps的条件下,与商业菌株相比,发酵乳杆菌whh3906促进raw264.7细胞分泌il-10的量显著高于商业菌株(p<0.01),分泌il-6和no的量显著低于商业菌株(p<0.01),tnf-α分泌量与商业菌株相当。在lps诱导的炎症条件下,与商业菌株相比,发酵乳杆菌whh3906促进raw264.7细胞分泌il-10的量显著高于商业菌株(p<0.001),分泌il-6的量显著低于商业菌株(p<0.05),no和tnf-α分泌量与商业菌株相当。表明在炎症条件下,本发明菌株发酵乳杆菌whh3906能够促进il-10分泌,抑制il-6、tnf-α和no分泌,具有改善炎症的功能。表18菌株对raw264.7细胞分泌细胞因子的影响*:与空白对照相比,差异显著,p<0.05,**:与空白对照相比,差异极显著,p<0.01,***:与空白对照相比,差异极极显著,p<0.001;#:与lcs相比,差异显著,p<0.05,##:与lcs相比,差异极显著,p<0.01,###:与lcs相比,差异极极显著,p<0.001。4对大鼠血清中细胞因子的影响将健康的spf级雄性大鼠(6-8周龄,200±20g),适应7天后,随机分为5组,每组10只。动物饲养保持环境温度为21±2℃,湿度为30-70%,12h光照交替,自由饮水,自由摄入饲料。饲料购自江苏省协同医药生物工程有限责任公司,基础饲料主要由鱼粉、小麦、玉米、豆粕、麸皮等组成;高脂饲料是在基础饲料中添加15%蔗糖、15%猪油、10%酪蛋白。动物实验分组如下:对照组:基础饲料喂养;模型组:高脂饲料喂养造模,诱导肥胖模型,使大鼠发生炎症;实验组:高脂饲料喂养造模,灌胃发酵乳杆菌whh3906菌株悬液,灌胃剂量为1×109cfu/d。试验周期为10周,试验结束后,称体重,1%戊巴比妥钠(0.5ml/100g体重)麻醉,采用心脏穿刺取血获取大鼠血液样本,将血液样本取出后,静置30min,4℃,4000rpm离心15min,取上清,用elisa试剂盒检测血清中il-1β、il-6、tnf-α、mcp-1和no的含量。脱颈处死后,解剖取肝脏,用elisa试剂盒检测肝脏中il-1β、il-6、tnf-α、mcp-1和no的含量。由表19可知,与对照组相比,模型组大鼠血清中促炎因子il-1β、il-6、tnf-α、mcp-1和no的含量显著高于对照组(p<0.05,p<0.01),说明大鼠体内已经发生炎症。由表19可知,与模型组相比,实验组大鼠血清中抑炎因子il-10水平显著高于模型组(p<0.01),促炎因子il-1β、il-6、tnf-α、mcp-1和no的含量显著低于模型组(p<0.05,p<0.01,p<0.001)。说明发酵乳杆菌whh3906能够显著降低大鼠体内炎症水平,具有缓解慢性炎症的功能。表19大鼠血清中细胞因子的浓度变化与模型组相比,*:p<0.05;**:p<0.01;***:p<0.001。由表20可知,与对照组相比,模型组肝脏组织中促炎因子il-6、il-1β、tnf-α、mcp-1和no的含量显著高于对照组(p<0.05,p<0.01),说明肝脏已经发生炎症。由表20可知,与模型组相比,实验组大鼠肝脏组织中促炎因子il-6、il-1β、tnf-α、mcp-1和no的含量显著低于模型组(p<0.05,p<0.01)。说明发酵乳杆菌whh3906菌株能够显著降低大鼠肝脏组织炎症水平,具有缓解炎症的功能。表20肝脏炎症指标处理il-1β(ng/l)il-6(ng/l)tnf-α(ng/l)mcp-1(ng/l)no(ng/μl)对照组17.05±0.99*229.89±9.82*296.18±10.54*399.56±12.85*0.52±0.04**模型组26.81±1.39263.59±11.26325.33±10.41490.65±15.370.97±0.05实验组19.19±3.51*222.09±16.15*307.59±7.27*424.05±6.20*0.64±0.04**与模型组相比,*:p<0.05;**:p<0.01。综上所述,发酵乳杆菌whh3906能够综合调节体内多种炎症因子水平,使抑炎因子水平提高、促炎因子水平降低,从而缓解机体慢性炎症。本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。序列表<110>杭州娃哈哈科技有限公司<120>一种基于乳杆菌的减肥粉剂及其制备方法<130>2020<160>1<170>siposequencelisting1.0<210>1<211>1440<212>dna<213>发酵乳杆菌whh3906(lactobacillusfermentumwhh3906)<400>1gcggctggctcctaaaaggttaccccaccgactttgggtgttacaaactctcatggtgtg60acgggcggtgtgtacaaggcccgggaacgtattcaccgcggcatgctgatccgcgattac120tagcgattccgacttcgtgcaggcgagttgcagcctgcagtccgaactgagaacggtttt180aagagatttgcttgccctcgcgagttcgcgactcgttgtaccgtccattgtagcacgtgt240gtagcccaggtcataaggggcatgatgatctgacgtcgtccccaccttcctccggtttgt300caccggcagtctcactagagtgcccaacttaatgctggcaactagtaacaagggttgcgc360tcgttgcgggacttaacccaacatctcacgacacgagctgacgacgaccatgcaccacct420gtcattgcgttcccgaaggaaacgccctatctctagggttggcgcaagatgtcaagacct480ggtaaggttcttcgcgtagcttcgaattaaaccacatgctccaccgcttgtgcgggcccc540cgtcaattcctttgagtttcaaccttgcggtcgtactccccaggcggagtgcttaatgcg600ttagctccggcactgaagggcggaaaccctccaacacctagcactcatcgtttacggcat660ggactaccagggtatctaatcctgttcgctacccatgctttcgagtctcagcgtcagttg720cagaccaggtagccgccttcgccactggtgttcttccatatatctacgcattccaccgct780acacatggagttccactaccctcttctgcactcaagttatccagtttccgatgcacttct840ccggttaagccgaaggctttcacatcagacttagaaaaccgcctgcactctctttacgcc900caataaatccggataacgcttgccacctacgtattaccgcggctgctggcacgtagttag960ccgtgactttctggttaaataccgtcaacgtatgaacagttactctcatacgtgttcttc1020tttaacaacagagctttacgagccgaaacccttcttcactcacgcggtgttgctccatca1080ggcttgcgcccattgtggaagattccctactgctgcctcccgtaggagtatgggccgtgt1140ctcagtcccattgtggccgatcagtctctcaactcggctatgcatcatcgccttggtagg1200ccgttaccccaccaacaagctaatgcaccgcaggtccatccagaagtgatagcgagaagc1260catcttttaagcgttgttcatgcgaacaacgttgttatgcggtattagcatctgtttcca1320aatgttgtcccccgcttctgggcaggttacctacgtgttactcacccgtccgccactcgt1380tggcgaccaaaatcaatcaggtgcaagcaccatcaatcaattgggctcaacgcgttcgac1440当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1