药物组合物和方法与流程
药物组合物和方法
1.相关申请的交叉引用
2.本技术要求于2019年12月9日提交的美国临时专利申请no.62/945,706的优先权,其全部内容通过引用并入本文。
技术领域
3.本发明一般性地涉及用于如例如在癌症治疗中降低细胞增殖的组合物、药盒(kit)和方法。
背景技术:
4.根据美国国家癌症研究所(u.s.national cancer institute)的2008年监测、流行病学和最终结果(surveillance epidemiology and end result,seer)数据库,在可获得发病率数据的最近一年中,11,958,000名美国人患有侵袭性癌症。癌症是美国第二大常见的死亡原因,仅次于心脏病,占死亡的四分之一。据估计,每天有约1600名美国人死于癌症。除了癌症的医疗、情感和心理成本之外,癌症对个人和社会都有巨大的经济成本。据国立卫生研究院(national institutes of health)估计,在2010年癌症的总成本为2638亿美元。此外,据估计,由于过早死亡,另有1401亿美元的生产力损失。
5.目前癌症治疗包括手术、激素治疗、放射、化学治疗、免疫治疗、靶向治疗、及其组合。癌症的手术切除已进展显著;然而,依然有疾病复发的高可能性。使用诸如芳香酶抑制剂和促黄体激素释放激素类似物和抑制剂的药物的激素治疗在治疗前列腺癌和乳腺癌中相对有效。放射及适形质子束放射治疗(conformal proton beam radiation therapy)、立体定向放射外科、立体定向放射治疗、术中放射治疗、化学修饰剂和放射增敏剂的相关技术有效杀伤癌细胞,但也可杀伤和改变周围的正常组织。单独和组合的化学治疗药物(例如氨基蝶呤、顺铂、甲氨蝶呤、多柔比星、柔红霉素等)通常通过改变dna复制过程有效杀伤癌细胞。生物应答调节剂(biological response modifier,brm)治疗、生物学治疗、生物治疗或免疫治疗改变癌细胞生长或影响自然免疫应答,并且涉及向患者施用生物制剂(例如干扰素、白介素和其他细胞因子)和抗体(例如利妥昔单抗(rituximab)和曲妥珠单抗(trastuzumab))以及甚至癌症疫苗(例如sipuleucel-t)。
6.最近,已开发了新的靶向治疗来对抗癌症。这些靶向治疗与化学治疗不同,因为化学治疗通过杀伤癌细胞和正常细胞二者(对癌细胞具有更大的作用)而发挥作用。靶向治疗通过影响控制癌细胞生长、分裂和扩散的过程和引起癌细胞自然死亡的信号发挥作用。一种类型的靶向治疗包括生长信号抑制剂,例如曲妥珠单抗(trastuzumab)、吉非替尼(gefitinib)、伊马替尼(imatinib)、西妥昔单抗(centuximab)、达沙替尼(dasatinib)和尼洛替尼(nilotinib)。另一类型的靶向治疗包括血管生成抑制剂,例如贝伐单抗(bevacizumab),其抑制癌症增多周围血管系统(vasculature)和血液供应。最后一种类型的靶向治疗包括能够诱导直接的癌细胞死亡的诱导凋亡的药物。
7.尽管所有这些治疗在某种程度上都有效,但它们都具有缺点和限制。除了许多治
疗是昂贵的之外,它们通常也太不精确或者癌症能够适应它们并且变得有抗性。
8.因此,非常需要另外的癌症治疗。特别地,需要用于已经对其他形式的治疗变得有抗性的癌症的治疗。
技术实现要素:
9.本发明提供了通过使患者的癌细胞与包含表面活性剂和胆汁酸或胆汁酸盐的药物组合物接触来治疗癌症的方法。
10.本发明提供了通过使患者的肿瘤与包含表面活性剂和胆汁酸或胆汁酸盐的药物组合物接触来减小肿瘤尺寸的方法。
附图说明
11.图1示出了针对用于实施例1中所述研究的载剂(即无菌水)、经皮制剂(表面活性剂5%)和胆汁酸制剂(表面活性剂5%+胆汁酸3%3%)的作为时间的函数的平均肿瘤体积。
12.图2示出了针对实施例3的研究中的组的作为肿瘤植入后时间的函数的平均肿瘤体积。
13.图3示出了针对实施例3的研究中的组的作为肿瘤植入后时间的函数的平均体重变化。
14.图4示出了针对实施例3的研究中的组的作为肿瘤植入后时间的函数的存活。
具体实施方式
15.通过参考形成本公开内容的一部分的以下详细描述可更容易地理解本主题。应理解,本发明不限于本文中所述和/或示出的特定产品、方法、条件或参数,并且本文中使用的术语仅用于通过实例来描述一些特定实施方案的目的,并非旨在对所要求保护的发明进行限制。
16.除非本文中另有定义,否则结合本技术使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,否则没有数量词修饰的名词表示一个/种或更多个/种。
17.除非另有说明,否则上文和本公开内容通篇中使用的以下术语和缩写应理解为具有以下含义。
18.除非上下文中另有明确说明,否则在本公开内容中没有数量词修饰的名词表示一个/种或更多个/种,并且对特定数值的提及包括至少所述特定值。因此,例如,提及“化合物”是指一个或更多个这样的化合物和本领域技术人员已知的其等同物等。本文中使用的术语“多个”意指多于一个。当表达值的范围时,另一个实施方案包括从一个特定值和/或至另一个特定值。类似地,当通过使用在前的“约”将值表示为近似值时,应理解特定值形成另一个实施方案。所有范围都包括端值且是可组合的。
19.本文中使用的术语“组分”、“组合物”、“化合物的组合物”、“化合物”、“药品”、“药理学活性剂”、“活性剂”、“治疗剂”、“疗法”、“治疗”或“药物”在本文中可互换使用,是指当向对象(人或动物)施用时通过局部和/或全身作用诱导期望的药理学和/或生理学效果的化合物或物质的组合物。
20.本文中使用的术语“治疗”或“疗法”(及其不同形式)包括预防性(例如,预防)、治愈性或姑息性治疗。本文中使用的术语“治疗”包括减轻或降低病症、疾病或障碍的至少一种不利或负面的作用或症状。这种病症、疾病或障碍可以是癌症。
21.以上和整个公开内容中所采用的术语“有效量”是指在剂量和必要的持续时间下有效地实现关于相关障碍、病症或副作用的治疗的期望结果的量。应当理解,本发明组分的有效量会随患者而不同,不仅与所选的特定化合物、组分或组合物,施用途径以及组分在个体中引起期望结果的能力有关,还与例如以下因素有关:待缓解的病症的严重程度或疾病状态,个体的激素水平、年龄、性别、体重,患者当时的状态以及治疗中的病理性状况的严重程度、同时使用的药物或特殊饮食,然后是特定患者以及本领域技术人员会意识到的其他因素,恰当的剂量由主治医师判断。可调整剂量方案以提供改进的治疗响应。有效量也是其中组分的治疗有益作用胜过任何毒性或有害作用的量。
[0022]“可药用”是指在合理的医学判断范围内适合用于与人和动物的组织相接触而没有过度的毒性、刺激、变态反应或其他问题并发症,与合理的收益/风险比匹配的那些化合物、材料、组合物和/或剂型。
[0023]
在本发明内,所公开的化合物可以以可药用盐的形式制备。“可药用盐”是指所公开的化合物的衍生物,其中母体化合物通过制备其酸式或碱式盐来修饰。可药用盐的一些实例包括但不限于碱性残基(例如胺)的无机或有机酸盐;酸性残基(例如羧酸)的碱式盐或有机盐;等。可药用盐包括例如由无毒性无机或有机酸形成的母体化合物的常规无毒性盐或季铵盐。例如,这样的常规无毒性盐包括来自于无机酸(例如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸、硝酸等)的那些;以及由有机酸(例如乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、扑酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、对氨基苯磺酸(sulfanilic acid)、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、羟乙磺酸(isethionic acid)等)制备的盐。通过本领域中已知的方法来制备这些生理学上可接受的盐,例如通过将游离的胺碱溶解在醇水溶液中的过量酸中,或者通过用碱金属碱(例如氢氧化物)或胺中和游离羧酸。
[0024]
本文所述的化合物可以以替代形式制备。例如,许多含氨基化合物可以作为酸加成盐使用或制备。这样的盐通常改善了化合物的分离和处理特性。例如,取决于试剂、反应条件等,如本文中所述的化合物可用作或制备成例如其盐酸盐或甲苯磺酸盐。同构的结晶形式、所有手性和外消旋形式、n-氧化物、水合物、溶剂合物和酸式盐的水合物也被考虑在本发明的范围之内。
[0025]
本发明的某些酸性或碱性化合物可作为两性离子存在。化合物的所有形式(包括游离酸、游离碱和两性离子)被考虑在本发明的范围之内。本领域中公知,含有氨基和羧基二者的化合物经常与其两性离子形式平衡存在。因此,含有例如氨基和羧基二者的任何本文中所述化合物也包括提及其相应的两性离子。
[0026]
术语“立体异构体”是指具有相同化学组成但在原子或基团的空间排列方面不同的化合物。
[0027]
术语“施用”意指直接施用本发明的化合物或组合物,或者施用将在体内形成等量的活性化合物或物质的前药、衍生物或类似物。
[0028]
术语“对象”、“个体”和“患者”在本文中可互换使用,并且是指向其提供用根据本
发明的药物组合物进行治疗(包括预防性治疗)的动物(例如人)。本文中使用的术语“对象”是指人或非人动物。术语“非人动物”和“非人哺乳动物”在本文中可互换使用并且包括所有脊椎动物,例如哺乳动物,例如非人灵长类动物(特别是高级灵长类动物)、绵羊、犬、啮齿动物(例如小鼠或大鼠)、豚鼠、山羊、猪、猫、兔、牛、马;以及非哺乳动物,例如爬行动物、两栖动物、鸡和火鸡。
[0029]
除非相反地指出,否则数值应理解为包括当简化为相同数量的有效数字时相同的数值和与所述值相差小于本技术中为确定该值所描述之类型的常规测量技术的实验误差的数值。
[0030]
本文中公开的所有范围均包括所列举的端点并且是可独立组合的(例如,“2至10”的范围包括端点2和10,以及所有的中间值)。本文中公开的范围的端点和任何值不限于精确的范围或值;其不足够精确而包括近似于这些范围和/或值的值。
[0031]
本文中使用的近似性语言可应用于修饰可变化而不导致与其相关的基本功能改变的任何定量表述。因此,在一些情况下,由例如“约/大约”和“基本上”的一个或更多个术语修饰的值可不限于所指定的精确值。在至少一些情况下,近似性语言可对应于用于测量该值的仪器的精密度。修饰词“约/大约”还应被认为公开了由两个端点的绝对值限定的范围。例如,表述“约2至约4”还公开了范围“2至4”。术语“约/大约”可指指定数的加减10%。例如,“约10%”可表示9%至11%的范围,并且“约1”可意指0.9至1.1。“约/大约”的其他含义可根据情况(例如舍入)而显而易见,因此,例如“约1”还可意指0.5至1.4。
[0032]
本文中使用的“烷基”是指具有指定数目碳原子、通常1至20个碳原子、例如1至8个碳原子、例如1至6个或1至7个碳原子的直链和支链。例如,c
1-6
烷基涵盖具有1至6个碳原子的直链和支链烷基二者。当提及具有特定数目的碳的烷基残基时,旨在涵盖具有该数目的碳的所有支链和直链形式;因此,例如“丁基”意指包括正丁基、仲丁基、异丁基和叔丁基;“丙基”包括正丙基和异丙基。烷基的一些实例包括甲基、乙基、丙基、异丙基、正丁基、仲丁基、叔丁基、戊基、2-戊基、异戊基、新戊基、己基、2-己基、3-己基、3-甲基戊基等。
[0033]
本文中使用的“烯基”是指具有至少一个碳-碳双键的不饱和的支链或直链烷基。该基团关于双键可以是顺式或反式构型。该基团还可以是芳族基团,例如苯基或亚苯基部分。典型的烯基包括但不限于:乙烯基;丙烯基,例如丙-1-烯-1-基、丙-1-烯-2-基、丙-2-烯-1-基(烯丙基)、丙-2-烯-2-基;丁烯基,例如丁-1-烯-1-基、丁-1-烯-2-基、2-甲基-丙-1-烯-1-基、丁-2-烯-1-基、丁-2-烯-1-基、丁-2-烯-2-基、丁-1,3-二烯-1-基、丁-1,3-二烯-2-基;亚苯基,等。在某些实施方案中,烯基具有2至20个碳原子。
[0034]
本文中使用的“炔基”是指通过从母体烷基的相邻碳原子除去两分子氢获得的具有至少一个碳-碳三键的不饱和的支链或直链烷基。典型的炔基包括但不限于:乙炔基;丙炔基,例如丙-1-炔-1-基、丙-2-炔-1-基;丁炔基,例如丁-1-炔-1-基、丁-1-炔-3-基、丁-3-炔-1-基;等。在某些实施方案中,炔基具有2至20个碳原子。
[0035]
本公开内容涉及在有此需要的患者中治疗癌症的方法,所述方法包括使患者的癌细胞与包含表面活性剂和胆汁酸或其盐的药物组合物接触。
[0036]
在一些实施方案中,表面活性剂是离子表面活性剂。
[0037]
在一些实施方案中,离子表面活性剂是阴离子表面活性剂。阴离子表面活性剂包括但不限于:烷基硫酸盐、烷基磺酸盐、烷基磷酸酯和烷基羧酸盐,包括月桂基硫酸铵、月桂
基硫酸钠(十二烷基硫酸钠、sls或sds)、十四烷基硫酸钠、月桂醇聚醚硫酸钠(月桂基醚硫酸钠或sles)、肉豆蔻醇聚醚硫酸钠、多库酯(二辛基磺基琥珀酸钠)、全氟辛烷磺酸盐(pfos)、全氟丁烷磺酸盐、烷基芳基醚磷酸盐、烷基醚磷酸盐、月桂酰肌氨酸钠全氟壬酸盐、全氟辛酸盐(pfoa或pfo)和乙醇胺油酸酯。
[0038]
在另一些实施方案中,离子表面活性剂是阳离子表面活性剂。阴离子表面活性剂包括但不限于:线性烷基铵和苄烷铵(benzalkonium)或烷基二甲基苄基铵、溴化十六烷基三甲基铵(ctab)、氯化十六烷基吡啶(cpc)、苯扎氯铵(bac)、苄索氯铵(bzt)、二甲基双十八烷基氯化铵和双十八烷基二甲基溴化铵(dodab)。
[0039]
在一些实施方案中,表面活性剂是非离子表面活性剂。非离子表面活性剂的一些实例包括但不限于:乙氧基化线性醇、乙氧基化烷基酚、脂肪酸酯和乙氧基化烷基酰胺、2-(十二烷氧基)乙醇,
[0040]
在一些实施方案中,表面活性剂是两性(或两性离子)表面活性剂。两性表面活性剂的一些实例包括但不限于:磺基甜菜碱chaps(3-[(3-胆酰胺基丙基)二甲基铵]-1-丙烷磺酸盐)、椰油酰胺丙基羟基磺基甜菜碱;甜菜碱例如椰油酰胺丙基甜菜碱、磷脂、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰胆碱和鞘磷脂。
[0041]
具体的阴离子、阳离子、非离子和两性(或两性离子)表面活性剂是本领域技术人员已知的。参见例如salager,j-l,surfactants
–
typesanduses,laboratoryofformulation,interfacesrheologyandprocesses,universidaddelosandes,m
é
rida-venezuela,versi
ó
n#2(2002)。
[0042]
在一些实施方案中,表面活性剂是式(i)化合物:
[0043]
r-(och2ch2)
y-oh(i)
[0044]
其中r是c
1-20
烷基、c
2-20
烯基、或c
2-20
炔基;并且y是1至25。
[0045]
在本公开内容的其中表面活性剂是式(i)化合物的一些实施方案中,r是c
1-20
烷基,其可以是直链或支化的烷基。优选的其中r是c
1-20
烷基的式i化合物包括:例如是聚西托醇1000(cetomacrogol1000)、乙氧基化的十八烷-1-醇、聚氧乙烯(12)十三烷基醚、聚氧乙烯(10)十三烷基醚、脂肪醇聚氧乙烯醚、聚氧乙烯支链壬基环己基醚(tritonn-101)、壬乙二醇单十二烷基醚、23-{[4-(2,4,4-三甲基-2-戊烷基)环己基]氧基}-3,6,9,12,15,18,21-七氧杂二十三烷-1-醇,及其组合。壬乙二醇单十二烷基醚是特别优选的。
[0046]
在另一些实施方案中,r是c
2-20
烯基,其可以是直链或支化的烯基。优选的其中r是c
2-20
烯基的式i化合物包括:例如聚氧乙烯(10)油烯基醚、聚乙二醇叔辛基苯基醚(tritonx-100),及其组合。
[0047]
在又一个实施方案中,r是c
2-20
炔基,其可以是直链或支化的炔基。
[0048]
在其中表面活性剂是式i化合物的那些实施方案中,y是1至25。在一些优选实施方案中,y是5至15,优选8至10,其中9是特别优选的。在另一些实施方案中,y是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25。
[0049]
在一些实施方案中,表面活性剂是以伯羟基封端的四官能嵌段共聚物表面活性剂。这样的化合物可以以商品名tetronic商购获得,并且包括乙二胺四(乙氧基化物-嵌段-丙氧基化物)。
[0050]
在本公开内容的另一些实施方案中,表面活性剂是失水山梨糖醇衍生物,例如,聚
氧乙烯失水山梨糖醇四油酸酯、1,4-脱水-6-o-棕榈酰基-d-葡萄糖醇(失水山梨糖醇单十六烷酸酯)、聚乙二醇失水山梨糖醇单月桂酸酯(例如,tween20、tween40、tween60、tween85),及其组合。
[0051]
在本公开内容的另一些实施方案中,表面活性剂是c
8-10
烷基铵盐,例如甲基三烷基(c8-c10)氯化铵(adogen464)。
[0052]
在另一些实施方案中,第一组分是式ii化合物:
[0053]
ho-(ch2ch2o)
m-c(ch3)(c4h9)-c≡c-c(ch3)(c4h9)-(och2ch2)
n-oh(ii)
[0054]
其中m和n各自独立地是1至25。
[0055]
在一些实施方案中,表面活性剂是式iii的酰胺:
[0056]r2-n(r1)-c(o)-r3(iii)
[0057]
其中:
[0058]
每个r1独立地是h或c
1-3
烷基;并且
[0059]
r2和r3独立地是c
1-7
烷基或与其所连接的原子一起形成具有3至10个碳原子的内酰胺。
[0060]
在式iii的酰胺的一些实施方案中,r1是h。在另一些实施方案中,r1是甲基、乙基、丙基或异丙基,其中甲基是特别优选的。
[0061]
在式iii的其中r2和r3独立地是c
1-7
烷基的那些实施方案中,r2和r3各自独立地是甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基或庚基。
[0062]
优选地,式(iii)中的r2和r3与其所连接的原子一起形成具有3至10个碳原子的内酰胺。例如,内酰胺可包含3、4、5、6、7、8、9或10个碳,其可以是内酰胺环的一部分或其可形成环外分支。优选的内酰胺的一些实例包括吡咯烷酮,例如2-吡咯烷酮、1-甲基-2-吡咯烷酮、5-甲基-2-吡咯烷酮和1-乙基-2-吡咯烷酮。优选地,内酰胺是1-甲基-2-吡咯烷酮或2-吡咯烷酮。
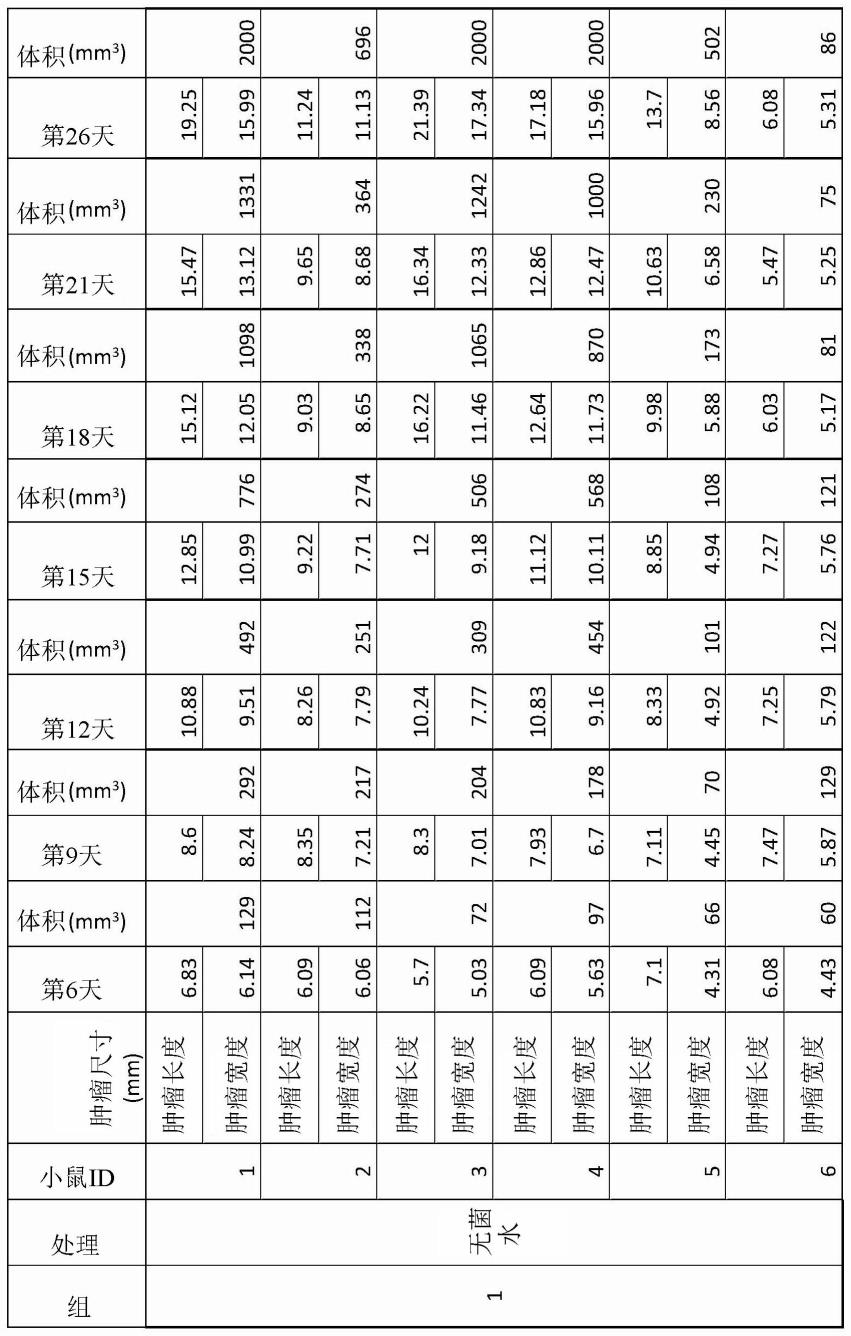
[0063]
在其中组合物包含式iii化合物的一些实施方案中,式iii化合物可占组合物的约0.01体积%至约10体积%。在一些优选实施方案中,组合物包含约0.01体积%至约5体积%的式iii化合物。在另一些实施方案中,组合物包含约0.01体积%至约4体积%的式iii化合物。例如,组合物可包含约0.01体积%、0.02体积%、0.03体积%、0.04体积%、0.05体积%、0.06体积%、0.07体积%、0.08体积%、0.09体积%、0.1体积%、0.2体积%、0.3体积%、0.4体积%、0.5体积%、0.6体积%、0.7体积%、0.8体积%、0.9体积%、1体积%、1.5体积%、2体积%、2.5体积%、3体积%、3.5体积%、4体积%、4.5体积%、5体积%、5.5体积%、6体积%、6.5体积%、7体积%、7.5体积%、8体积%、8.5体积%、9体积%、9.5体积%或约10体积%的式iii化合物。
[0064]
在一些实施方案中,本公开内容的组合物可包含约0.1体积%至约40体积%的表面活性剂。在一些优选实施方案中,组合物包含约1体积%至约40体积%的表面活性剂。在另一些实施方案中,组合物包含约0.1体积%至约5体积%的表面活性剂。例如,组合物可包含约0.1体积%、0.2体积%、0.3体积%、0.4体积%、0.5体积%、0.6体积%、0.7体积%、0.8体积%、0.9体积%、1体积%、1.5体积%、2体积%、2.5体积%、3体积%、3.5体积%、4体积%、4.5体积%、5体积%、5.5体积%、6体积%、6.5体积%、7体积%、7.5体积%、8体积%、8.5体积%、9体积%、9.5体积%、10体积%、11体积%、12体积%、13体积%、14体积%、15体
积%、16体积%、17体积%、18体积%、19体积%、20体积%、21体积%、22体积%、23体积%、24体积%、25体积%、26体积%、27体积%、28体积%、29体积%、30体积%、31体积%、32体积%、33体积%、34体积%、35体积%、36体积%、37体积%、38体积%、39体积%或约40体积%的表面活性剂。
[0065]
在一些实施方案中,表面活性剂为不是胆汁酸的有机酸。例如,具有1至25个碳原子的有机酸,例如脂肪酸和脂肪酸衍生物。
[0066]
在一些实施方案中,表面活性剂为不是胆汁酸的具有1至25个碳原子的有机酸。例如,用于本公开内容的组合物中的有机酸包括乙酸、抗坏血酸、乳酸、乙醇酸、丙酸,及其组合。
[0067]
在另一些实施方案中,表面活性剂是脂肪酸。本文中使用的术语“脂肪酸”具有其为本领域普通技术人员理解的普通含义,并且包括具有羧基和烃链的分子。本文中对脂肪酸中碳原子的数目的描述是指脂肪酸的烃链中碳原子的数目,而与烃链是直链还是支链的无关。
[0068]
本文中所使用的术语“脂肪酸”包括在烃链中不包含任何双键或三键的饱和脂肪酸。饱和脂肪酸包括但不限于丙酸(c3)(举例来说,c3表示丙酸在其烃链中具有3个碳原子;其他示例性脂肪酸的烃链中碳原子的数目在本文中以类似的方式表示)、丁酸(c4)、戊酸(valeric acid)(c5)、己酸(caproic acid)(c6)、庚酸(enanthic acid)(c7)、辛酸(caprylic acid)(c8)、壬酸(pelargonic acid)(c9)、癸酸(capric acid)(c10)、十一酸(c11)、月桂酸(c12)、十三酸(c13)、豆蔻酸(c14)、十五酸(c15)、棕榈酸(c16)、珍珠酸(margaric acid)(c17)、硬脂酸(c18)、异硬脂酸(c18)、十九酸(c19)、花生酸(c20)、二十一酸(c21)、山萮酸(behenic acid)(c22)、二十三酸(c23)、木蜡酸(lignoceric acid)(c24)、二十五酸(c25)、蜡酸(cerotic acid)(c26)、二十七酸(c27)、褐煤酸(montanic acid)(c28)、二十九酸(c29)、蜂花酸(melissic acid)(c30)、三十一酸(c31)、虫胶蜡酸(lacceroic acid)(c32)、叶虱酸(psyllic acid)(c33)、格地酸(geddic acid)(c34)、蜡塑酸(ceroplastic acid)(c35)和三十六酸(c36)。
[0069]
本文中使用的术语“脂肪酸”还包括在烃链中包含一个双键或三键的单不饱和脂肪酸和在烃链中包含多于一个双键和/或三键的多不饱和脂肪酸。这样的酸包括但不限于ω3、ω6、ω9脂肪酸;其他脂肪酸,例如肉豆蔻油酸和棕榈油酸以及共轭脂肪酸。单不饱和和多不饱和脂肪酸的实例包括但不限于:(a)ω3脂肪酸,例如十六碳三烯酸(c16:3);(举例来说,c16:3表示十六碳三烯酸在其烃链中具有16个碳原子和3个双键;其他示例性不饱和脂肪酸的烃链中碳原子和双键的数目在本文中以类似方式表示)、α亚麻酸(c18:3)和二十碳五烯酸(20:5);(b)ω6脂肪酸,例如亚油酸(18:2)、二十二碳二烯酸(c22:2)、花生四烯酸(c20:4)和二十四碳四烯酸(c24:5);(c)ω9脂肪酸,例如油酸(c18:1)、二十碳烯酸(c20:1)和神经酸(nevronic acid)(c24:1);以及(d)共轭脂肪酸,例如瘤胃酸(rumenic acid)(c18:2)、桐酸(eleostatic acid)(c18:3)和茹米烯酸(rumelenic acid)(c18:3)。
[0070]
本文中使用的术语“脂肪酸”还包括支链脂肪酸。支链脂肪酸的实例包括但不限于:单甲基支链脂肪酸,例如14-甲基十五烷酸、6-甲基辛酸、4-甲基-3-戊烯酸(焦芸香酸(pyroterebic acid))、2-甲基-2e-丁烯酸(惕各酸(tiglic acid))、2-甲基-2z-丁烯酸(当归酸(angelic acid))、多甲基支链酸、类异戊二烯脂肪酸(isoprenoid fatty acid)(维太
内酯(vittatalactone)、全反式视黄酸)、支链甲氧基脂肪酸和羟基脂肪酸及其他脂肪酸例如2-羟基辛酸和4-氧代戊酸。
[0071]
在其中组合物包含不是胆汁酸的具有1至25个碳原子的有机酸的一些实施方案中,本公开内容的组合物可包含约0.01体积%至约15体积%的有机酸。在一些实施方案中,组合物包含约1体积%至约15体积%的有机酸。在一些优选实施方案中,组合物包含约0.01体积%至约5体积%的有机酸。在另一些实施方案中,组合物包含约0.01体积%至约3体积%的有机酸。例如,组合物可包含约0.01体积%、0.02体积%、0.03体积%、0.04体积%、0.05体积%、0.06体积%、0.07体积%、0.08体积%、0.09体积%、0.1体积%、0.2体积%、0.3体积%、0.4体积%、0.5体积%、0.6体积%、0.7体积%、0.8体积%、0.9体积%、1体积%、1.5体积%、2体积%、2.5体积%、3体积%、3.5体积%、4体积%、4.5体积%、5体积%、5.5体积%、6体积%、6.5体积%、7体积%、7.5体积%、8体积%、8.5体积%、9体积%、9.5体积%、10体积%、10.5体积%、11体积%、11.5体积%、12体积%、12.5体积%、13体积%、13.5体积%、14体积%、14.5体积%或约15体积%的有机酸。
[0072]
在一些实施方案中,表面活性剂包含不同表面活性剂的混合物。在一些实施方案中,表面活性剂包含上述不同表面活性剂的混合物。
[0073]
本发明的组合物还包含胆汁酸或胆汁酸盐。在一些实施方案中,第二组分包含胆汁酸。
[0074]
在一些实施方案中,胆汁酸是脱氧胆酸、胆酸、甘氨胆酸、牛磺胆酸、牛磺熊脱氧胆酸、鹅脱氧胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱氧胆酸或石胆酸。
[0075]
在一些实施方案中,胆汁酸是牛磺熊脱氧胆酸。
[0076]
在另一些实施方案中,第二组分包含胆汁酸盐。
[0077]
在一些实施方案中,胆汁酸盐是以下的盐:脱氧胆酸、胆酸、甘氨胆酸、牛磺胆酸、牛磺熊脱氧胆酸、鹅脱氧胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱氧胆酸或石胆酸。
[0078]
在一些实施方案中,胆汁酸盐是牛磺熊脱氧胆酸的盐。
[0079]
在一些实施方案中,胆汁酸盐是牛磺熊脱氧胆酸的钠盐。
[0080]
在另一些实施方案中,胆汁酸盐是脱氧胆酸钠。
[0081]
在一些实施方案中,胆汁酸或胆汁酸盐的量可占组合物的约0.01体积%至约10体积%。在一些优选实施方案中,组合物包含约0.01体积%至约5体积%的胆汁酸或胆汁酸盐。在另一些实施方案中,组合物包含约0.01体积%至约3体积%的胆汁酸或胆汁酸盐。例如,组合物可包含约0.01体积%、0.02体积%、0.03体积%、0.04体积%、0.05体积%、0.06体积%、0.07体积%、0.08体积%、0.09体积%、0.1体积%、0.2体积%、0.3体积%、0.4体积%、0.5体积%、0.6体积%、0.7体积%、0.8体积%、0.9体积%、1体积%、1.5体积%、2体积%、2.5体积%、3体积%、3.5体积%、4体积%、4.5体积%、5体积%、5.5体积%、6体积%、6.5体积%、7体积%、7.5体积%、8体积%、8.5体积%、9体积%、9.5体积%或约10体积%的胆汁酸或胆汁酸盐。在一些实施方案中,组合物包含约3体积%的胆汁酸。
[0082]
在另一些实施方案中,用于本发明的方法的组合物还包含亚砜,例如二甲基亚砜。
[0083]
在另一些实施方案中,用于本发明的方法的组合物还包含脲类(urea),例如咪唑啉酮(imidazolidinone)。
[0084]
在另一些实施方案中,用于本发明的方法的组合物还包含乙酸乙酯。
[0085]
在其中组合物包含亚砜、脲类或乙酸乙酯的一些实施方案中,所述亚砜、脲类或乙酸乙酯可占组合物的约0.01体积%至约10体积%。在一些优选实施方案中,组合物包含约0.01体积%至约5体积%的亚砜、脲类或乙酸乙酯。在另一些实施方案中,组合物包含约0.01体积%至约4体积%的亚砜、脲类或乙酸乙酯。例如,组合物可包含约0.01体积%、0.02体积%、0.03体积%、0.04体积%、0.05体积%、0.06体积%、0.07体积%、0.08体积%、0.09体积%、0.1体积%、0.2体积%、0.3体积%、0.4体积%、0.5体积%、0.6体积%、0.7体积%、0.8体积%、0.9体积%、1体积%、1.5体积%、2体积%、2.5体积%、3体积%、3.5体积%、4体积%、4.5体积%、5体积%、5.5体积%、6体积%、6.5体积%、7体积%、7.5体积%、8体积%、8.5体积%、9体积%、9.5体积%或约10体积%的亚砜、脲类或乙酸乙酯。
[0086]
在另一些实施方案中,用于本发明的方法的组合物还包含c
1-10
烷基醇。
[0087]
用于本公开内容的组合物的醇包括具有至少一个-oh部分或至少两个-oh部分的c
1-10
烷基醇。例如,一些优选的醇包括:甘油、丙二醇、甲醇、乙醇、异丙醇、1-丙醇、丁醇、叔丁醇、戊醇、1-辛醇、苯甲醇、甲醇、乙醇、丙醇、丁醇、戊醇、己醇、辛醇、壬醇、癸醇、色醇、酪醇和苯乙醇,及其组合,其中乙醇是特别优选的。
[0088]
在其中组合物包含c
1-10
烷基醇的一些实施方案中,本公开内容的组合物可包含约0.1体积%至约99体积%的c
1-10
烷基醇。在一些优选实施方案中,组合物包含约1体积%至约50体积%的c
1-10
烷基醇。在另一些实施方案中,组合物包含约0.1体积%至约5体积%的c
1-10
烷基醇。在另一些优选实施方案中,组合物包含约90体积%至约99体积%的c
1-10
烷基醇。例如,组合物可包含约0.1体积%、0.2体积%、0.3体积%、0.4体积%、0.5体积%、0.6体积%、0.7体积%、0.8体积%、0.9体积%、1体积%、1.5体积%、2体积%、2.5体积%、3体积%、3.5体积%、4体积%、4.5体积%、5体积%、5.5体积%、6体积%、6.5体积%、7体积%、7.5体积%、8体积%、8.5体积%、9体积%、9.5体积%、10体积%、11体积%、12体积%、13体积%、14体积%、15体积%、16体积%、17体积%、18体积%、19体积%、20体积%、21体积%、22体积%、23体积%、24体积%、25体积%、26体积%、27体积%、28体积%、29体积%、30体积%、31体积%、32体积%、33体积%、34体积%、35体积%、36体积%、37体积%、38体积%、39体积%、40体积%、41体积%、42体积%、43体积%、44体积%、45体积%、46体积%、47体积%、48体积%、49体积%、50体积%、60体积%、70体积%、80体积%、90体积%、95体积%、98体积%或约99体积%的c
1-10
烷基醇。
[0089]
本公开内容的组合物可以是无水的。本文中使用的“无水的”是指组合物包含小于1体积%的水,优选小于0.05体积%或小于0.025体积%的水。确定含水量的方法是本领域中已知的。
[0090]
第一组分可任选地包含水。在一些实施方案中,第一组分可包含至多99体积%的水。在另一些方面中,第一组分可包含5体积%、10体积%、20体积%、30体积%、40体积%、50体积%、60体积%、70体积%、80体积%、90体积%、95体积%或99体积%的水。在另一些实施方案中,第一组分可包含90体积%、91体积%、92体积%、93体积%、94体积%、95体积%、96体积%、97体积%、98体积%或99体积%的水。
[0091]
包含水的本公开内容的组合物可任选地包含一种或更多种生理上可接受的盐。用于组合物中的盐包括但不限于氯化钠、氯化钾,及其混合物。氯化钠的一种优选形式是抑菌性氯化钠溶液。
[0092]
在一些实施方案中,本公开内容的组合物还包含:鱼肝油酸钠、铬酸甘油酯、组织硬化剂制剂、月桂氮酮、萜烯、烃类(例如烷烃、烯烃、卤代烷烃、角鲨烯、角鲨烯和矿物油);胺类、肉豆蔻酸异丙酯、萜烯、萜类、精油;脂类(例如磷脂)、环状寡糖(例如环糊精)、氨基酸和氨基酸的硫代酰基衍生物、烷基氨基酯和唑烷酮、酶(例如木瓜蛋白酶和药用水蛭(leech)酶)或者酮。
[0093]
在一些实施方案中,本公开内容的组合物包含以下的任意组合:a)式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐、式ii化合物、式iii化合物、亚砜、脲类或乙酸乙酯、c
1-10
烷基醇、不是胆汁酸的具有1至25个碳原子的有机酸;以及b)胆汁酸或胆汁酸盐。
[0094]
在一些实施方案中,本公开内容的组合物包含约32体积%至40体积%的式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐或式ii化合物;约2体积%至4体积%的式iii化合物、亚砜、脲类或乙酸乙酯;约40体积%至50体积%的c
1-10
烷基醇;约6体积%至12体积%的不是胆汁酸的有机酸;以及约0.01体积%至约5体积%的胆汁酸或胆汁酸盐。
[0095]
在另一些实施方案中,本公开内容的组合物包含约3.2体积%至4.0体积%的式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐或式ii化合物;约0.2体积%至0.4体积%的式iii化合物、亚砜、脲类或乙酸乙酯;约4.0体积%至96体积%的c
1-10
烷基醇;约0.6体积%至1.2体积%的不是胆汁酸的有机酸;以及约0.01体积%至约5体积%的胆汁酸或胆汁酸盐。
[0096]
在另一些实施方案中,本公开内容的组合物包含约0.32体积%至0.40体积%的式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐;约0.02体积%至0.04体积%的式iii化合物、亚砜、脲类或乙酸乙酯;约0.40体积%至99.5体积%的c
1-10
烷基醇;约0.06体积%至0.12体积%的不是胆汁酸的有机酸;以及约0.01体积%至约5体积%的胆汁酸或胆汁酸盐。
[0097]
在另一些实施方案中,本公开内容的组合物包含约4.1体积%的壬乙二醇单十二烷基醚;约0.4体积%的1-甲基-2-吡咯烷酮;约93.3体积%的乙醇;约0.9体积%的亚油酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐。
[0098]
在另一些实施方案中,本公开内容的组合物包含约3.2体积%的壬乙二醇单十二烷基醚;约0.3体积%的1-甲基-2-吡咯烷酮;约94.8体积%的乙醇;约0.7体积%的亚油酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐。
[0099]
在另一些实施方案中,本公开内容的组合物包含约0.32体积%的壬乙二醇单十二烷基醚;约0.03体积%的1-甲基-2-吡咯烷酮;约98.6体积%的乙醇;以及约0.07体积%的亚油酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐。
[0100]
在一些实施方案中,本公开内容的组合物包含约3.2体积%至4.0体积%的式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐;约0.2体积%至0.4体积%的式iii化合物、亚砜、脲类或乙酸乙酯;约4.0体积%至5.0体积%的c
1-10
烷基醇;约0.6体积%至1.2体积%的不是胆汁酸的有机酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐;以及约80体积%至94体积%的水。
[0101]
在另一些实施方案中,本公开内容的组合物包含约0.32体积%至0.40体积%的式
i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐;约0.02体积%至0.04体积%的式iii化合物、亚砜、脲类或乙酸乙酯;约0.40体积%至0.50体积%的c
1-10
烷基醇;约0.06体积%至0.12体积%的不是胆汁酸的有机酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐;以及约80体积%至98.2体积%的水。
[0102]
在另一些实施方案中,本公开内容的组合物包含约3.2体积%的壬乙二醇单十二烷基醚;约0.3体积%的1-甲基-2-吡咯烷酮;约4.3体积%的乙醇;约0.7体积%的亚油酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐;约90.5体积%的水。
[0103]
在另一些实施方案中,本公开内容的组合物包含约0.32体积%的壬乙二醇单十二烷基醚;约0.03体积%的1-甲基-2-吡咯烷酮;约0.43体积%的乙醇;约0.07体积%的亚油酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐;约98.2体积%的水。
[0104]
在另一些实施方案中,本公开内容的组合物包含约5体积%的式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物、c
8-10
烷基铵盐;约0.5体积%的式iii化合物、亚砜、脲类或乙酸乙酯;约7体积%的c
1-10
烷基醇;约2体积%的不是胆汁酸的有机酸;以及约0.01体积%至约1体积%的胆汁酸或胆汁酸盐;以及约84.5体积%的水。
[0105]
在另一些实施方案中,本公开内容的组合物包含按体积计约3%的醇;按重量计约3%的胆汁酸(溶解在醇中);约1%的式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物或c
8-10
烷基铵盐;约0.1%的式iii化合物、亚砜、脲类或乙酸乙酯,和qs抑菌水。
[0106]
在另一些实施方案中,本公开内容的组合物包含按体积计约3%的苯甲醇、按重量计约3%的脱氧胆酸钠(溶解在醇中)、按体积计约1%的98%壬乙二醇单十二烷基醚、约0.1%的99.5%无水1-甲基-2-吡咯烷酮、和qs抑菌水。
[0107]
在另一个实施方案中,本公开内容的组合物包含按体积计3%的苯甲醇、按重量计3%的脱氧胆酸钠(溶解在醇中)、按体积计1%的98%壬乙二醇单十二烷基醚、0.1%的99.5%无水1-甲基-2-吡咯烷酮、和qs抑菌水。
[0108]
在另一些实施方案中,醇可以以按体积计约0.3%至约30%的量存在。在一个实施方案中,胆汁酸可以以按体积计约0.3%至约30%的量存在。在一个实施方案中,式i化合物、四官能嵌段共聚物表面活性剂、失水山梨糖醇衍生物或c
8-10
烷基铵盐剂可以以按体积计约0.1%至约10%的量存在。在一个实施方案中,式iii化合物、亚砜、脲类或乙酸乙酯可以以约.01%至约1%的量存在。
[0109]
本发明的组合物可以以能够使组合物与癌细胞接触的任何药物剂型进行配制。这样的组合物包括用于组合物的瘤内递送的剂型。
[0110]
根据一些实施方案,可通过直接注射(例如通过注射器)在肿瘤或瘤组织或瘤前组织的部位进行施用。
[0111]
本发明的组合物可以以立即释放或控释系统来递送。在一个实施方案中,可使用输注泵来施用本发明的化合物,例如用于将化学治疗递送至特定器官或肿瘤的输注泵。
[0112]
在另一个实施方案中,本发明的化合物与生物可降解的、生物相容性聚合物植入物组合施用,所述植入物在选定部位在受控制的时间段内释放该化合物。聚合物材料的一些实例包括聚酐、聚原酸酯、聚乙醇酸、聚乳酸、聚乙烯乙酸乙烯酯、其共聚物和共混物。在又一个实施方案中,可将控释系统放置在治疗靶标附近,因此仅需要全身剂量的一部分。
[0113]
在一些实施方案中,本发明的组合物可配制成溶液剂、凝胶剂、经皮贴剂、洗剂、乳
膏剂、喷雾剂、雾剂(mist)、乳剂或分散体、片剂、胶囊剂或散剂。用于配制这样的剂型的合适赋形剂对本领域技术人员是显而易见的,并且包括但不限于稳定剂、乳化剂、增稠剂、抗微生物剂、润湿剂、抛射剂、扩散剂、聚合物和黏合剂,例如压敏黏合剂。特别地,可用于形成经皮凝胶剂的赋形剂包括但不限于醇、二醇、甘油、丁羟甲苯(butylated hydroxytoluene,bht)和水。
[0114]
本发明的方法涉及通过使患者的癌细胞与所公开的组合物接触来在患者中治疗癌症。癌细胞可作为单独的细胞或者作为团块(mass)或癌细胞或肿瘤存在于患者中。癌症可以是任何类型,包括:例如,非小细胞肺癌、脑癌、阑尾癌、胆道癌(biliary cancer)、胆管癌(choleangiocarcinoma)、结肠癌、生殖细胞瘤、胶质瘤、神经母细胞瘤、前列腺癌、舌癌、扁桃体鳞状细胞癌、尿路上皮癌、腺样囊性癌、肾上腺瘤、淀粉样变性、肛门癌、共济失调毛细血管扩张症、非典型痣综合征、贝-维综合征(beckwith wiedemann syndrome)、胆管癌、伯特-霍格-杜布综合征(birt hogg dube syndrome)、膀胱癌、骨癌、脑肿瘤、乳腺癌、男性乳腺癌、类癌瘤、卡尼综合征(carney complex)、宫颈癌、结直肠癌、导管癌、子宫内膜癌、食管癌、家族性腺瘤性息肉病、胃癌、胃肠道间质瘤-gist、her2阳性乳腺癌、遗传性前列腺癌、胰岛细胞瘤、幼年性息肉病综合征、卡波西肉瘤(kaposi’s sarcoma)、hiv和aids、肾癌、喉癌、白血病-急性淋巴细胞白血病、白血病-急性髓性aml、白血病-成人、白血病-儿童、白血病-慢性淋巴细胞-cll、白血病-慢性髓性-cml、白血病-急性淋巴细胞(leukemia-acute lymphocytic,all)、肝癌、小叶癌、肺癌、肺癌-小细胞、淋巴瘤-霍奇金氏(lymphoma
–
hodgkin’s)、淋巴瘤-非霍奇金氏、lynch综合征、恶性胶质瘤、肥大细胞增多症、黑素瘤、脑膜瘤、多发性内分泌肿瘤1型、多发性内分泌肿瘤2型、多发性骨髓瘤、骨髓增生异常综合征(myelodysplastic syndrome,mds)、鼻咽癌、神经内分泌肿瘤、痣样基底细胞癌综合征、口腔癌、骨肉瘤、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤、甲状旁腺癌、阴茎癌、腹膜癌、波伊茨-耶格综合征(peutz-jeghers syndrome)、垂体瘤、胸膜肺母细胞瘤(儿童)、真性红细胞增多症、前列腺癌、肾细胞癌、视网膜母细胞瘤(儿童)、唾液腺癌、肉瘤、肉瘤-腺泡状软组织和心脏、肉瘤-卡波西、皮肤癌(非黑素瘤)、小肠癌(small bowel cancer)、小肠癌(small intestine cancer)、小肠癌、胃癌、睾丸癌、胸腺瘤、甲状腺癌、特科特综合征(turcot syndrome)、子宫(子宫内膜)癌、阴道癌、希佩尔林道综合征(von-hippel-lindau syndrome)、肾母细胞瘤(wilms’tumor)(儿童)或着色性干皮病。
[0115]
在本发明的方法中,癌细胞与所公开的组合物接触。这种接触可通过使癌细胞与所公开的组合物进行物理接触的任何合适的方法来实现。例如,皮肤中或皮肤表面处的癌细胞可通过以下来接触:在癌细胞位置处将所公开的组合物表面施加至皮肤,使得组合物与癌细胞进行物理接触。可通过将组合物注射到患者体内肿瘤中,使患者体内肿瘤中的癌细胞与所公开的组合物进行物理接触。类似地,可通过在手术期间将组合物施加至癌细胞来使癌细胞与所公开的组合物接触。在这种模式下,在手术期间接触到肿瘤或癌细胞,并将组合物物理地施加至细胞或注射到肿瘤中。
[0116]
在另一些方面中,本公开内容涉及通过使患者的肿瘤与有效量的药物组合物接触来在患者中减小肿瘤尺寸的方法,所述药物组合物包含如本文中所述的表面活性剂和胆汁酸或胆汁酸盐。
[0117]
在另一些方面中,本发明的方法涉及通过使病灶与任何如本文中所述的药物组合
物接触来在患者中治疗病灶的方法。在一些实施方案中,病灶存在于以下组织中:乳腺、前列腺、肺、结肠、胃、胰腺、卵巢、脑、皮肤、骨、脂肪、淋巴、胃肠道、肝或软组织。在另一些实施方案中,病灶是非癌性的。
[0118]
本发明的组合物可仅施用一次,或者其可多次施用。对于多剂量,可例如每天三次、每天两次、每天一次、每两天一次、每周两次、每周一次、每两周一次或每月一次施用组合物。合适的剂量范围和方案可变化。
[0119]
在一些实施方案中,在约第1天和约第3天、在约第8天和约第10天、在约第15天和约第17天、在约第22天和约第24天、在约第29天和约第31天以及在约第36天对对象中的肿瘤进行瘤内注射。在一些实施方案中,在第一周期间,给药体积包含约50μl组合物/肿瘤。在一个实施方案中,对于第二周,给药体积包含约100μl组合物/肿瘤。在一个实施方案中,对于其余的给药施用,给药体积包含约200μl组合物。
[0120]
在另一些实施方案中,组合物的给药体积可为约5μl至约2000μl组合物/肿瘤。在另一些实施方案中,给药体积可为约5μl至约500μl组合物/肿瘤。在一些实施方案中,组合物的给药体积可为约10μl至约1000μl组合物/肿瘤。
[0121]
在另一些实施方案中,组合物的给药体积可为约20μl至约2000μl组合物/肿瘤。在一个实施方案中,给药体积包含在第一周期间的50μl组合物/肿瘤、第二周的100μl组合物/肿瘤以及其余的给药施用的200μl组合物。在另一个实施方案中,给药体积包含在第1天和第3天施用的50μl组合物、在第8天和第10天施用的100μl组合物/肿瘤以及在第15天、第17天、第22天、第24天、第29天、第31天和第36天施用的200μl组合物。确定其他合适的给药方案以及组合物剂量范围和量在普通技术人员的技术内。
[0122]
在一些实施方案中,本发明提供了治疗癌症的方法,其包括将如本文中所述的组合物与一种或更多种靶向治疗组合施用。在一个实施方案中,免疫治疗性化合物靶向由癌细胞异常表达的特定分子。在一个实施方案中,靶向治疗包含激素治疗、信号转导抑制剂、基因表达调节剂、凋亡诱导剂、血管生成抑制剂、免疫治疗或毒素递送分子。在一个实施方案中,靶向治疗利用小分子。在另一个实施方案中,靶向治疗利用抗体,在一个实施方案中,所述抗体是单克隆抗体。
[0123]
在一些实施方案中,本发明的治疗癌症的方法还包括施用第二化学治疗剂。在一些实施方案中,第二化学治疗剂是2-甲氧基雌二醇、3,3
’‑
二吲哚基甲烷、艾贝司他(abexinostat)、醋葡醛内酯、放线菌素、acutissimin aa、阿法替尼(afatinib)、阿柏西普(aflibercept)、阿仑单抗(alemtuzumab)、阿雌莫司汀(alestramustine)、阿利维a酸(alitretinoin)、全反式视黄酸(all-trans retinoic acid)、六甲蜜胺(altretamine)、氨基乙酰丙酸(aminolevulinic acid)、amphinex、安吖啶(amsacrine)、阿那格雷(anagrelide)、angiozyme、安曲霉素(anthramycin)、抗体-药物缀合物、抗癌剂(anticarcinogen)、apaziquone、apg101、三氧化二砷(arsenic trioxide)、天冬酰胺酶(asparaginase)、阿莫司汀(atrimustine)、阿西替尼(axitinib)、阿扎胞苷(azacitidine)、重氮丝氨酸(azaserine)、硫唑嘌呤(azathioprine)、bcg疫苗、苯达莫司汀(bendamustine)、贝伐单抗(bevacizumab)、贝沙罗汀(bexarotene)、biricodar、博来霉素(bleomycin)、硼替佐米(bortezomib)、博苏替尼(bosutinib)、白消安(busulfan)、丁硫氨酸亚砜胺(buthionine sulfoximine)、卡巴他赛(cabazitaxel)、卡博替尼
(cabozantinib)、卡培他滨(capecitabine)、卡铂(carboplatin)、卡莫氟(carmofur)、卡莫司汀(carmustine)、塞来昔布(celecoxib)、西妥昔单抗(cetuximab)、苯丁酸氮芥(chlorambucil)、氮芥(chlormethine)、顺铂(cisplatin)、克拉屈滨(cladribine)、氯法拉滨(clofarabine)、库潘尼西(copanlisib)、克唑替尼(crizotinib)、crotogoudin、环磷酰胺(cyclophosphamide)、阿糖胞苷(cytarabine)、cytestrol acetate、达卡巴嗪(dacarbazine)、放线菌素d(dactinomycin)、达沙替尼(dasatinib)、柔红霉素(daunorubicin)、地西他滨(decitabine)、地尼白介素(denileukin diftitox)、地诺单抗(denosumab)、多西他赛(docetaxel)、多西氟尿苷(doxifluridine)、多柔比星(doxorubicin)、倍癌霉素(duocarmycin)、efaproxiral、依沙芦星(elsamitrucin)、恩西地平(enasidenib)、依诺他滨(enocitabine)、表柔比星(epirubicin)、埃博霉素(epothilone)、艾日布林(eribulin)、厄洛替尼(erlotinib)、雌二醇芥(estradiol mustard)、estromustine、依托格鲁(etoglucid)、依托泊苷(etoposide)、依维莫司(everolimus)、exisulind、氟尿苷(floxuridine)、fluasterone、氟达拉滨(fludarabine)、氟尿嘧啶(fluorouracil)、磷雌酚(fosfestrol)、福莫司汀(fotemustine)、吉非替尼(gefitinib)、吉西他滨(gemcitabine)、吉妥单抗奥佐米星(gemtuzumab ozogamicin)、组蛋白脱乙酰酶抑制剂、hn3(氮芥)、羟基尿素(hydroxycarbamide)、羟基脲(hydroxyurea)、低甲基化剂(hypomethylating agent)、替伊莫单抗(ibritumomab tiuxetan)、ici-85966、伊达比星(idarubicin)、艾代拉利司(idelalisib)、异环磷酰胺(ifosfamide)、伊马替尼(imatinib)、咪喹莫特(imiquimod)、免疫缀合物、巨大戟醇甲基丁烯酸酯(ingenol mebutate)、伊匹单抗(ipilimumab)、伊立替康(irinotecan)、异维a酸(isotretinoin)、伊沙匹隆(ixabepilone)、kedarcidin、拉帕替尼(lapatinib)、来那度胺(lenalidomide)、洛莫司汀(lomustine)、氯尼达明(lonidamine)、洛索蒽醌(losoxantrone)、ls-1727、硫蒽酮(lucanthone)、勒托替康(lurtotecan)、马索罗酚(masoprocol)、双氯乙基甲胺(mechlorethamine)、美伦孕酮(melengestrol)、醋酸美伦孕酮(melengestrol acetate)、美法仑(melphalan)、巯基嘌呤(mercaptopurine)、转移抑制剂(metastasis suppressor)、甲氨蝶呤(methotrexate)、氨基乙酰丙酸甲酯(methyl aminolevulinate)、甲基环硫雄醇(methylepitiostanol)、米替福新(miltefosine)、米托胍腙(mitoguazone)、丝裂霉素(mitomycin)、丝裂霉素c(mitomycin c)、米托坦(mitotane)、米托蒽醌(mitoxantrone)、mtor抑制剂、奈达铂(nedaplatin)、奈拉滨(nelarabine)、新制癌菌素(neocarzinostatin)、尼罗替尼(nilotinib)、纳武单抗(nivolumab)、o6-苄基鸟嘌呤(o6-benzylguanine)、奥法木单抗(ofatumumab)、奥那司酮(onapristone)、osu-03012、奥沙利铂(oxaliplatin)、紫杉醇(paclitaxel)、帕尼单抗(panitumumab)、帕比司他(panobinostat)、帕唑帕尼(pazopanib)、培门冬酶(pegaspargase)、pegdinetanib、派姆单抗(pembrolizumab)、培美曲塞(pemetrexed)、喷司他丁(pentostatin)、帕妥珠单抗(pertuzumab)、phenestrol、溶链菌制剂(picibanil)、聚合物-药物缀合物、泊马度胺(pomalidomide)、帕纳替尼(ponatinib)、泼尼莫司汀(prednimustine)、丙卡巴肼(procarbazine)、奎诺司他(quisinostat)、雷替曲塞(raltitrexed)、瑞格非尼(regorafenib)、resimmune、雷西喹莫特(resiquimod)、核糖核苷酸还原酶抑制剂、利妥昔单抗(rituximab)、罗米地辛(romidepsin)、鲁索利替尼(ruxolitinib)、司美替尼
(selumetinib)、信号转导抑制剂、司韦芬(sivifene)、索拉非尼(sorafenib)、src抑制剂、五加前胡素(steganacin)、链脲菌素(streptozotocin)、sturamustine、舒尼替尼(sunitinib)、他米巴罗汀(tamibarotene)、替加氟(tegafur)、替莫唑胺(temozolomide)、西司他莫司(temsirolimus)、替尼泊苷(teniposide)、tesmilifene、testifenon、沙利度胺(thalidomide)、硫鸟嘌呤(tioguanine)、拓扑替康(topotecan)、托西莫单抗(tositumomab)、曲贝替定(trabectedin)、曲妥珠单抗(trastuzumab)、维a酸(tretinoin)、曲氟尿苷(trifluridine)、曲氟尿苷/替吡嘧啶(trifluridine/tipiracil)、酪氨酸羟化酶抑制剂、vadimezan、丙戊酸(valproate)、戊柔比星(valrubicin)、凡德他尼(vandetanib)、伐普肽(vapreotide)、维莫非尼(vemurafenib)、长春花碱(vinblastine)、长春新碱(vincristine)、长春地辛(vindesine)、长春氟宁(vinflunine)、长春瑞滨(vinorelbine)或伏立诺他(vorinostat)。
[0124]
在另一些实施方案中,还施用酪氨酸羟化酶抑制剂。
[0125]
在一些实施方案中,酪氨酸羟化酶抑制剂是以下中的一种或更多种:(2r)-2-氨基-3-(2-氯-4-羟基苯基)丙酸甲酯、d-酪氨酸乙酯盐酸盐、(2r)-2-氨基-3-(2,6-二氯-3,4-二甲氧基苯基)丙酸甲酯、h-d-tyr(tbu)-烯丙酯hcl、(2r)-2-氨基-3-(3-氯-4,5-二甲氧基苯基)丙酸甲酯、(2r)-2-氨基-3-(2-氯-3-羟基-4-甲氧基苯基)丙酸甲酯、(2r)-2-氨基-3-(4-[(2-氯-6-氟苯基)甲氧基]苯基)丙酸甲酯、(2r)-2-氨基-3-(2-氯-3,4-二甲氧基苯基)丙酸甲酯、(2r)-2-氨基-3-(3-氯-5-氟-4-羟基苯基)丙酸甲酯、2-(乙酰氨基)-2-(4-[(2-氯-6-氟苄基)氧基]苄基丙二酸二乙酯、(2r)-2-氨基-3-(3-氯-4-甲氧基苯基)丙酸甲酯、(2r)-2-氨基-3-(3-氯-4-羟基-5-甲氧基苯基)丙酸甲酯、(2r)-2-氨基-3-(2,6-二氯-3-羟基-4-甲氧基苯基)丙酸甲酯、(2r)-2-氨基-3-(3-氯-4-羟基苯基)丙酸甲酯、h-dl-tyr-ome hcl、h-3,5-二碘-tyr-ome hcl、h-d-3,5-二碘-tyr-ome hcl、h-d-tyr-ome hcl、d-酪氨酸甲酯盐酸盐、d-酪氨酸-ome hcl、甲基d-酪氨酸酯盐酸盐、h-d-tyr-ome
·
hcl、d-酪氨酸甲酯hcl、h-d-tyr-ome-hcl、(2r)-2-氨基-3-(4-羟基苯基)丙酸、(2r)-2-氨基-3-(4-羟基苯基)甲酯盐酸盐、(2r)-2-氨基-3-(4-羟基苯基)丙酸甲酯盐酸盐、(2r)-2-氮烷基-3-(4-羟基苯基)丙酸甲酯盐酸盐、3-氯-l-酪氨酸、3-硝基-l-酪氨酸、3-硝基-l-酪氨酸乙酯盐酸盐、dl-间-酪氨酸、dl-邻-酪氨酸、boc-tyr(3,5-i2)-osu、fmoc-tyr(3-no2)-oh、α-甲基-dl-酪氨酸、α-甲基-d-酪氨酸、α-甲基-l-酪氨酸和α-甲基-dl-酪氨酸的c
1-c
12
烷基酯盐,例如α-甲基-dl-酪氨酸甲酯盐酸盐。
[0126]
在一些实施方案中,酪氨酸羟化酶抑制剂是α-甲基-dl-酪氨酸。
[0127]
在另一些实施方案中,还向对象施用酪氨酸羟化酶抑制剂、黑素和/或黑素促进剂、p450 3a4促进剂和亮氨酸氨肽酶抑制剂的组合。
[0128]
在一些实施方案中,第二化学治疗剂是生长激素抑制剂,例如奥曲肽(octreotide)。
[0129]
第二化学治疗剂或酪氨酸羟化酶抑制剂可以以任何合适的剂型来施用,包括片剂、胶囊剂、囊片剂、无菌水性或有机溶液剂、可重构粉末剂、酏剂、液体剂、胶体或其他类型的混悬剂、乳剂、珠剂、珠粒(beadlet)、颗粒剂、微粒剂、纳米粒剂、及其组合。当然,所施用的第二化学治疗剂的量将取决于所治疗的对象、对象的体重、所治疗病症的严重程度、施用方式以及处方医师的判断。
[0130]
第二化学治疗剂或酪氨酸羟化酶抑制剂可通过任何合适的途径来施用,包括经口、经鼻、皮下、静脉内、肌内、经皮、经阴道、经直肠、或以其任意组合。
[0131]
在另一些实施方案中,本文中所述的组合物、制剂和方法可包括以在对象中有效减轻疼痛的量包含或使用疼痛减轻剂。在一些实施方案中,疼痛减轻剂包含全身麻醉剂。在另一些实施方案中,疼痛减轻剂包含局部麻醉剂。在另一些实施方案中,疼痛减轻剂包含利多卡因。在另一些实施方案中,组合物包含约1%的2%利多卡因。在另一个实施方案中,组合物包含1%的2%利多卡因。在一些实施方案中,疼痛减轻剂可存在于适合根据本文中所述的组合物和方法使用的任何制剂中,包括但不限于0.5%、1%、1.5%、2%、4%或5%可注射溶液;或200、400或800mg/ml制剂。在一个实施方案中,组合物包含约0.1%至约1%的疼痛减轻剂。在一个实施方案中,组合物包含约1%至约10%的疼痛减轻剂。
[0132]
在一个实施方案中,疼痛减轻剂包含在肿瘤减小组合物中。在一个实施方案中,疼痛减轻剂与肿瘤减小组合物分开施用。
[0133]
根据本发明使用的其他合适的疼痛减轻剂包括但不限于普鲁卡因、布比卡因、甲哌卡因、氯普鲁卡因(chloroprocine)、丁卡因、罗哌卡因、苯佐卡因,或本领域普通技术人员已知的任何其他合适的疼痛减轻剂。
[0134]
本发明方法不仅可包括所公开的施用步骤,还可包括评估所述癌症在所述对象中的进展和/或细胞增殖程度的步骤。评估步骤可以在施用步骤之前或之后进行。
[0135]
本文中还提供了包含本公开内容的组合物以及用于其的包装的药盒。该药盒还可包含第二化学治疗剂。
[0136]
还提供了在对象中降低细胞增殖的方法,其包括通过将患者的癌细胞与所公开的组合物接触。
[0137]
在一些实施方案中,该方法还包括施用第二治疗剂。
[0138]
提供了用于实施本发明的具体实施方案的以下实施例,其仅用于说明目的,并不意图以任何方式限制本发明的范围。
[0139]
还提供了施用药物组合物和组合治疗的代表性的方法。本发明的多种实施方案还涉及向人患者施用药物组合物或组合治疗以用于治疗癌症的方法。该方法可包括通过通常可接受的施用途径(例如经口、皮下、胃肠外、吸入、表面等)施用药物组合物或组合治疗。在一些情况下,药物组合物或组合治疗可经口和/或皮下施用。在一些情况下,药物组合物或组合治疗可在两餐之间向人患者施用。
[0140]
在本发明的某些实施方案中,药物组合物或组合治疗可每周5天向人患者施用,持续6周,产生30个治疗日的一个周期。根据6周或一个治疗周期之后的结果,可施用药物组合物或组合治疗的另外周期。
[0141]
实施例1
[0142]
ct26肿瘤模型中的效力研究
[0143]
在第0天,36只雌性cb17 scid小鼠(6至7周龄,适应5天)被植入ct26肿瘤细胞。
[0144]
在第6、9、12、15、18和21天,用无菌水、制剂表面活性剂5%、或制剂表面活性剂5%+胆汁酸3%注射肿瘤,对于前四次注射,剂量为50μl/肿瘤,并且对于最后两次注射为100μl/肿瘤。(小鼠#10、11、12和小鼠#22、23、24的第一次给药是在11/9,因此这些肿瘤被处理了5次。)
[0145]
组合物表面活性剂5%通过以下制备:(1)混合3ml的聚多卡醇(100%纯度)、0.3ml的n-甲基吡咯烷酮(nmp;99.5%纯度)、1ml亚油酸(67%纯度)和4ml乙醇(100%);以及(2)用水稀释所得混合物,以得到5%表面活性剂混合物和95%水的混合物。
[0146]
组合物表面活性剂5%+胆汁酸3%包含如上制备的5%表面活性剂混合物、3%的胆汁酸牛磺熊脱氧胆酸(tduca)和92%水。
[0147]
通过检查测量肿瘤体积。以下的表1-1、1-2和1-3示出了该研究的结果。表1-1示出了每只个体小鼠的肿瘤体积数据。表1-2提供了每组的平均肿瘤体积。该研究表明,相对于无菌水,制剂表面活性剂5%和表面活性剂5%+胆汁酸3%二者均减缓了肿瘤生长,其中表面活性剂5%+胆汁酸3%的混合物减缓肿瘤生长程度最高。也参见图1。表1-3示出了处理组的无肿瘤小鼠的数目。
[0148]
表1-1
[0149]
[0150]
[0151]
[0152]
[0153]
[0154]
[0155]
[0156][0157]
表1-2
[0158][0159]
表1-3
[0160][0161]
实施例2
[0162]
如下进行了对其中植入了ct26肿瘤的12只小鼠的研究。
[0163]
该研究包括接受抑菌水对照注射的6只小鼠的对照组和接受实验制剂的6只小鼠的实验组。
[0164]
实验制剂由以下构成:
[0165]
·
按体积计3%的苯甲醇;
[0166]
·
按重量计3%的脱氧胆酸钠(溶解在醇中);
[0167]
·
按体积计1%的98%壬乙二醇单十二烷基醚;
[0168]
·
0.1%的99.5%无水1-甲基-2-吡咯烷酮;和
[0169]
·
qs抑菌水
[0170]
在3至5天的适应期之后,将15只balb/c雌性小鼠在右侧胁中接种100万个ct26细胞(混悬于100μl 1
×
抑菌h2o中)。
[0171]
从细胞接种之后第4天开始,每天测量肿瘤体积直至其平均体积达到100mm3(体积=长度
×
宽度
×
宽度
×
0.52)。
[0172]
选择十二(12)只具有优选肿瘤体积的荷瘤小鼠,并将其随机分为2组(每组n=6)并单独标识(尾标或耳标)。
[0173]
在第1天和第3天、然后在第8天和第10天、第15天和第17天、第22天和第24天、第29
天和第31天以及第36天,对小鼠进行称重并瘤内注射1
×
抑菌h2o或实验制剂。
[0174]1×
抑菌h2o或实验制剂的给药体积为:第一周50μl/肿瘤,第二周100μl/肿瘤,其余给药200μl/肿瘤。
[0175]
小鼠的肿瘤体积和体重每周测量两次,直至终止研究或对照组的组平均肿瘤体积达到1500至2000mm3,此时终止研究。
[0176]
在给药后的3周观察期结束时,对照动物的肿瘤生长大于2000m3,而两只实验动物没有肿瘤,并且4只的肿瘤体积明显比对照更小。处死所有动物并评估肿瘤部位的组织病理学。
[0177]
如下评价肿瘤的组织病理学。
[0178]
示出异种移植肿瘤(n=11)用于组织病理学检查。使用标准cbi方法制备组织。对肿瘤进行大体修剪和处理,然后包埋在石蜡中。将块以5μm用切片机进行切片(microtome)并用苏木精-伊红染色。由委员会认证的兽医病理学家对组织进行组织病理学检查。所有组织均状况良好。由于组织处理而导致的人为变化极小至不存在。
[0179]
肿瘤的形态与异种移植细胞系一致。对照(包含抑菌水)与用实验制剂处理的肿瘤之间的差异在于,与对照肿瘤相比,经处理的肿瘤明显更小并且具有远远更大的坏死面积。个体的发现在下表1中示出。
[0180]
用实验制剂处理的两只小鼠失去了所有肿瘤外观,并且其组织不包括在组织学研究中。
[0181]
组织病理学发现在表2-1中示出。
[0182]
表2-1.组织病理学发现
[0183][0184]
该研究显示,与和包含抑菌水的对照接触的肿瘤相比,与本发明的组合物接触的肿瘤细胞表现出提高的瘤内坏死。
[0185]
实施例3
[0186]
进行了研究以评价经皮制剂的组分在瘤内针对在雌性balb/c小鼠中建立的皮下ct26鼠结肠癌的抗肿瘤活性。
[0187]
测试化合物、给药方案和剂量在下表3-1中示出。载剂对照是盐水溶液。3种表面活性剂的混合物是壬乙二醇单十二烷基醚、1-甲基-2-吡咯烷酮和亚油酸的混合物。
[0188]
表3-1.化合物
[0189]
[0190][0191]
下表3-2示出了研究参数。
[0192]
表3-2.研究参数
[0193][0194][0195]
皮下植入肿瘤细胞(第0天)。一旦达到入选标准,则将动物分配到处理组中,使得每组的平均肿瘤负荷在整体平均值的10%内。如上所述,在处理当天按体重对小鼠进行单
独给药(固定50μl/瘤内注射)。在第11天开始并且在第17天结束,每天对动物进行给药,持续7天。保持动物以进行肿瘤生长延迟终点/肿瘤生长抑制终点和完全消退/部分消退/无肿瘤存活者确定。平均值和中值肿瘤体积(mm3)在表3-3中示出。
[0196]
表3-3.
–
按组划分的平均值和中值肿瘤体积(mm3)
[0197][0198][0199]
研究结果在图2-4中示出。
[0200]
在一些实施方案中,本公开内容涉及以下方面:
[0201]
方面1.在有此需要的患者中治疗癌症的方法,其包括使所述患者的癌细胞与有效量的包含表面活性剂和胆汁酸或胆汁酸盐的药物组合物接触。
[0202]
方面2.方面1所述的方法,其中所述表面活性剂是离子表面活性剂、非离子表面活性剂、两性表面活性剂或其混合物。
[0203]
方面3.在有此需要的患者中减小肿瘤尺寸的方法,其包括使所述患者的肿瘤与有效量的包含表面活性剂和胆汁酸或胆汁酸盐的药物组合物接触。
[0204]
方面4.方面1至3中任一项所述的方法,其中所述表面活性剂是式(i)化合物:
[0205]
r-(och2ch2)
y-oh(i)
[0206]
其中r是c
1-20
烷基、c
2-20
烯基、或c
2-20
炔基;并且y是1至25。
[0207]
方面5.方面3所述的方法,其中r是c
1-20
烷基。
[0208]
方面6.方面4或5中任一项所述的方法,其中y是5至15。
[0209]
方面7.方面1至4中任一项所述的方法,其中所述式i化合物是聚西托醇1000、乙氧基化的十八烷-1-醇、聚氧乙烯(12)十三烷基醚、聚氧乙烯(10)十三烷基醚、脂肪醇聚氧乙烯醚、聚氧乙烯支链壬基环己基醚、壬乙二醇单十二烷基醚、23-{[4-(2,4,4-三甲基-2-戊烷基)环己基]氧基}-3,6,9,12,15,18,21-七氧杂二十三烷-1-醇,或其组合。
[0210]
方面8.方面7所述的方法,其中所述式i化合物是壬乙二醇单十二烷基醚。
[0211]
方面9.方面4所述的方法,其中r是c
2-20
烯基。
[0212]
方面10.方面4或方面9中任一项所述的方法,其中所述式i化合物是聚氧乙烯(10)油烯基醚、聚乙二醇叔辛基苯基醚,或其组合。
[0213]
方面11.方面4所述的方法,其中r是c
2-20
炔基。
[0214]
方面12.方面1至3中任一项所述的方法,其中所述表面活性剂是以伯羟基封端的四官能嵌段共聚物表面活性剂。
[0215]
方面13.方面12所述的方法,其中所述以伯羟基封端的四官能嵌段共聚物表面活性剂是乙二胺四(乙氧基化物-嵌段-丙氧基化物)。
[0216]
方面14.方面1至3中任一项所述的方法,其中所述表面活性剂是失水山梨糖醇衍生物。
[0217]
方面15.方面14所述的方法,其中所述失水山梨糖醇衍生物是聚氧乙烯失水山梨糖醇四油酸酯、1,4-脱水-6-o-棕榈酰基-d-葡萄糖醇(失水山梨糖醇单十六烷酸酯)、聚乙二醇失水山梨糖醇单月桂酸酯,或其组合。
[0218]
方面16.方面1至3中任一项所述的方法,其中所述表面活性剂是c
8-10
烷基铵盐。
[0219]
方面17.方面16所述的方法,其中所述c
8-10
烷基铵盐是甲基三烷基(c
8-c
10
)氯化铵(adogen464)。
[0220]
方面18.方面1至3中任一项所述的方法,其中所述表面活性剂是式ii化合物:
[0221]
ho-(ch2ch2o)
m-c(ch3)(c4h9)-c=c-c(ch3)(c4h9)-(och2ch2)
n-oh(ii)其中m和n各自独立地是1至25。
[0222]
方面19.方面1至3中任一项所述的方法,其中所述表面活性剂是式iii化合物:
[0223]r2-n(r1)-c(o)-r3(iii)
[0224]
其中每个r1独立地是h或c
1-3
烷基;并且r2和r3独立地是c
1-7
烷基或与其所连接的原
子一起形成具有3至10个碳原子的内酰胺。
[0225]
方面20.方面19所述的方法,其中r1是甲基、乙基或丙基。
[0226]
方面21.方面19或20中任一项所述的方法,其中r2和r3与其所连接的原子一起形成具有3至10个碳原子的内酰胺。
[0227]
方面22.方面19所述的方法,其中所述内酰胺是吡咯烷酮。
[0228]
方面23.方面22所述的方法,其中所述吡咯烷酮是1-甲基-2-吡咯烷酮。
[0229]
方面24.方面1至3中任一项所述的方法,其中所述表面活性剂为不是胆汁酸的有机酸。
[0230]
方面25.方面24所述的方法,其中所述不是胆汁酸的有机酸是脂肪酸或c
1-6
烷基酸。
[0231]
方面26.方面25所述的方法,其中所述脂肪酸是亚油酸。
[0232]
方面27.方面1至26中任一项所述的方法,其中所述胆汁酸是脱氧胆酸、胆酸、甘氨胆酸、牛磺胆酸、牛磺熊脱氧胆酸、鹅脱氧胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱氧胆酸或石胆酸。
[0233]
方面28.方面27所述的方法,其中所述胆汁酸是牛磺熊脱氧胆酸。
[0234]
方面29.方面1至26中任一项所述的方法,其中所述胆汁酸盐是以下的盐:脱氧胆酸、胆酸、甘氨胆酸、牛磺胆酸、牛磺熊脱氧胆酸、鹅脱氧胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱氧胆酸或石胆酸。
[0235]
方面30.方面29所述的方法,其中所述胆汁酸盐是牛磺熊脱氧胆酸的盐。
[0236]
方面31.方面1至30中任一项所述的方法,其中所述药物组合物还包含亚砜。
[0237]
方面32.方面1至31中任一项所述的方法,其中所述药物组合物还包含脲类。
[0238]
方面33.方面1至32中任一项所述的方法,其中所述药物组合物还包含乙酸乙酯。
[0239]
方面34.方面1至33中任一项所述的方法,其中所述药物组合物还包含c
1-10
烷基醇。
[0240]
方面35.方面34所述的方法,其中所述c
1-10
烷基醇是甘油、丙二醇、甲醇、乙醇、异丙醇、1-丙醇、丁醇、叔丁醇、戊醇、1-辛醇、苯甲醇,或其组合。
[0241]
方面36.方面1至3中任一项所述的方法,其中所述药物组合物包含壬乙二醇单十二烷基醚、1-甲基-2-吡咯烷酮、亚油酸,和胆汁酸或胆汁酸盐。
[0242]
方面37.方面1至36中任一项所述的方法,其中所述药物组合物是以溶液剂、混悬剂、凝胶剂、乳剂或分散体的形式。
[0243]
方面38.方面1至37中任一项所述的方法,其还包括向所述患者施用第二治疗剂。
[0244]
方面39.方面38所述的方法,其中所述第二治疗剂是抗癌剂。
[0245]
方面40.方面1至3中任一项所述的方法,其中所述药物组合物包含壬乙二醇单十二烷基醚、1-甲基-2-吡咯烷酮,和胆汁酸或胆汁酸盐。
[0246]
方面41.方面40所述的方法,其中所述胆汁酸是牛磺熊脱氧胆酸。
[0247]
方面42.方面40所述的方法,其中所述胆汁酸盐是脱氧胆酸钠。
[0248]
方面43.方面40至42中任一项所述的方法,其中所述药物组合物还包含亚油酸。
[0249]
方面44.方面40至43中任一项所述的方法,其中所述药物组合物还包含苯甲醇。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1