一种治疗肿瘤转移的联合用药物组合物及其应用
1.本发明涉及一种治疗肿瘤转移的联合用药物组合物,具体涉及pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物组合物及其应用,属于医药技术领域。
背景技术:
2.癌症有着较高的发病率和致死率,是严重危害人类健康的主要疾病之一,攻克癌症一直是全世界共同的研究目标。而癌症相关死亡中,90%以上是由转移性疾病引起的,因此,寻找能有效抑制转移的方法,已成为当前临床研究的热点。线粒体通过调控细胞凋亡、调节细胞内活性氧含量及转移酶活性等直接或间接参与到肿瘤细胞的增殖与转移。因此,将抗肿瘤药物靶向递送至线粒体以激活细胞死亡程序和抑制转移发生,将是癌症治疗的有效策略之一。近来,有研究者发现通过将抗肿瘤药物与线粒体靶向配体偶联,从而将其靶向递送至线粒体可显著提高抗肿瘤药物抑制肿瘤转移的作用。但是在此过程中,肽基脯氨酰顺反异构酶pin1可以通过上调胞内抗氧化应激通路维持胞内的动态氧化还原平衡以保护线粒体,这会限制线粒体靶向策略的抗肿瘤转移效果。因此,如何破坏胞内氧化还原平衡以提升线粒体对线粒体靶向抗肿瘤药物的敏感性,放大线粒体靶向抗肿瘤药物的治疗效果是目前本领域普遍面临的技术障碍。
3.pin1能特异性地催化磷酸化丝/苏-脯氨酰基发生顺反异构,影响蛋白功能,与正常组织相比,pin1在多种肿瘤组织中的表达显著上调,是细胞中许多致癌通路的关键调节剂,并在维持胞内氧化还原平衡中发挥着重要作用。pni1抑制剂在本领域主要用于抑制肿瘤生长和转移,但是还未见pin1抑制剂与线粒体靶向抗肿瘤药物联合使用,以及其是否能够增敏线粒体以放大线粒体靶向抗肿瘤药物效果的报道。
技术实现要素:
4.本发明人通过创造性的研究将pin1抑制剂和线粒体靶向抗肿瘤药物联合使用。通过pin1抑制剂破坏胞内氧化还原平衡,进一步增敏线粒体,放大线粒体靶向抗肿瘤药物对线粒体的损伤。与单药相比,不仅能显著地增加单药抗肿瘤生长的作用,并且显著地增加了单药抑制肿瘤转移的作用。
5.本发明的目的在于提供pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物组合物在治疗肿瘤转移中的应用。
6.本发明的目的通过下述技术方案实现:一种治疗肿瘤转移的联合用药物组合物及其应用,包括作为活性成分的 pin1抑制剂和线粒体靶向抗肿瘤药物。所述的线粒体靶向抗肿瘤药物为将线粒靶向配体偶联至抗肿瘤药物,将药物靶向递送至线粒体。
7.所述的治疗肿瘤转移的联合用药物组合物还可以含有至少一种药学上可以接受的载体。
8.所述的治疗肿瘤转移的联合用药物组合物可以进一步制成注射剂等多种形式,各种剂型的药物可以按照药学领域的常规方法制备。
9.所述的pin1抑制剂为全反式维甲酸、全反式维甲酸衍生物、胡桃醌、2-{[4-(4-叔丁基苯磺酰胺)-1-氧代-1,4-二氢萘-2-基]磺酰基}乙酸(kpt6566)、2-(3-氯-4-氟苯基)-异噻唑-3-酮(tme-001)、n,n'-(1-二乙基)-1,4,5,8-萘四羧基二酰胺(pib)、4,6-双(苄氧基)-3-苯基苯并呋喃(tab29)中的至少一种;优选为全反式维甲酸。
[0010]
所述的抗肿瘤药物为氯尼达明、阿霉素、表阿霉素、紫杉醇、小檗碱、喜树碱、姜黄素、鬼臼毒素、长春碱、泼尼松龙、氮芥、顺铂、奥沙利铂、美法仑、甲氨蝶呤中的至少一种;优选为氯尼达明。
[0011]
所述的线粒体靶向配体为离域亲脂性阳离子三苯基膦、地氯喹铵、罗丹明123或线粒体靶向穿膜肽mpp-cfxrfxkfxrfxk或线粒体靶向序列肽mts-lsrtraaapnsriftrc中的至少一种;优选为三苯基膦。
[0012]
具体地,所述的线粒体靶向配体通过以下原理将偶联的抗肿瘤药物靶向递送至线粒体:离域亲脂性阳离子三苯基膦、地氯喹铵、罗丹明123通过与带负电的线粒体内膜发生静电相互作用而在线粒体蓄积;线粒体靶向穿膜肽mpp-cfxrfxkfxrfxk由于其强正电和强疏水性,与带负电的线粒体内膜相互作用,从而蓄积在线粒体;线粒体靶向序列肽mts-lsrtraaapnsriftrc可被线粒体表面受体识别,从而实现线粒体靶向。
[0013]
所述的线粒体靶向配体偶联的抗肿瘤药物为将线粒体靶向配体偶联至抗肿瘤药物,从而将抗肿瘤药物靶向递送至线粒体;优选为三苯基膦偶联的氯尼达明。
[0014]
所述的三苯基膦偶联的氯尼达明优选通过如下方法制备得到:1)将溴丙胺,三苯基膦称量至圆底烧瓶中,加入溶剂乙腈溶解,加热反应24h后,反应液于正己烷中沉出,乙醚洗涤后得到氨基衍生化的三苯基膦固体。
[0015]
2)将氨基衍生化的三苯基膦固体、氯尼达明和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/ n-羟基琥珀酰亚胺分散于二氯甲烷和甲醇的混合溶剂中,室温反应24h,反应完毕后使用硅胶柱层析法纯化即得三苯基膦偶联的氯尼达明。
[0016]
所述的治疗肿瘤转移的联合用药物组合物还可以含有至少一种药学上可以接受的辅料。
[0017]
所述的pin1抑制剂与线粒体靶向抗肿瘤药物的使用质量比为1:(0.01~100);优选为1:0.5。
[0018]
所述的pin1抑制剂的有效浓度是2~200 μg/ml,线粒体靶向抗肿瘤药物的有效浓度是1~100 μg/ml。
[0019]
所述的治疗肿瘤转移的联合用药物组合物进一步制成纳米粒的形式。
[0020]
所述的联合用药物组合物在制备用于治疗肿瘤转移的药物中的应用。
[0021]
所述的肿瘤包括乳腺癌,肝癌,肺癌,结肠癌,鼻咽癌,膀胱癌,宫颈癌,食管癌,胃癌,前列腺癌和淋巴瘤;优选为乳腺癌。
[0022]
本发明是将pin1抑制剂和线粒体靶向抗肿瘤药物同时作用于肿瘤,或先用线粒体靶向抗肿瘤药物治疗后再给予pin1抑制剂,或先用pin1抑制剂治疗后再给予线粒体靶向抗肿瘤药物。
[0023]
本发明所述的pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物组合物可将药物靶向递送至线粒体,同时破坏胞内氧化还原平衡,从而有效损伤线粒体,诱导肿瘤细胞凋亡,从而抑制肿瘤的进展。
[0024]
本发明所述的pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物组合物可显著地抑制肿瘤的转移。
[0025]
本发明相对于现有技术具有如下的优点及效果:1.本发明提供一种治疗肿瘤转移的方法,涉及pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物组合物。本发明的联合用药物组合物能够将药物靶向递送至线粒体,同时通过破坏胞内氧化还原平衡放大线粒体靶向抗肿瘤药物对线粒体的损伤,更有效地治疗肿瘤转移。
[0026]
2.本发明的联合用药物组合物能够协同杀伤肿瘤细胞,抑制肿瘤细胞横向迁移及纵向迁移。
[0027]
3.本发明的联合用药物组合物能够显著抑制肿瘤细胞的线粒体呼吸链,升高胞内的活性氧含量,引起线粒体膜电位去极化从而激活内在的凋亡通路,诱导肿瘤细胞凋亡并协同抑制肿瘤转移。
[0028]
4.本发明的联合用药物组合物能够有效下调转移相关信号通路并抑制转移相关蛋白的表达从而协同抑制肿瘤转移。
附图说明
[0029]
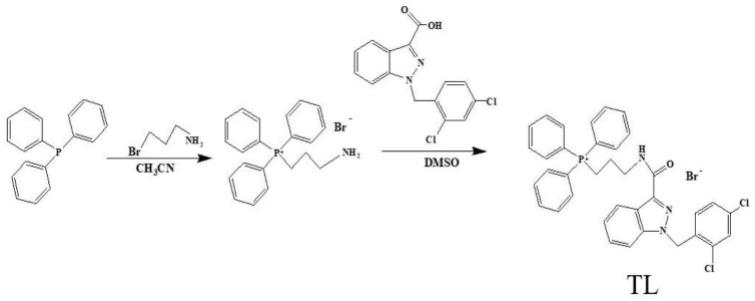
以下,结合附图来详细说明本发明的实施方案,其中:图1表示三苯基膦-氯尼达明偶联物(tl)的合成示意图。
[0030]
图2表示tl与pin1抑制剂全反式维甲酸(atra)的比例筛选及协同作用考察图:a. 不同比例的tl与atra对4t1乳腺癌细胞的细胞活力影响图;b. 不同比例的tl与atra对4t1乳腺癌细胞横向及纵向迁移的影响图。
[0031]
图3表示共载tl与atra的纳米粒(tl-atra nps)的处方筛选及稳定性考察图:a.不同比例的tl与atra的处方筛选图;b. tl-atra nps 24小时内的粒径变化图。
[0032]
图4表示tl-atra nps对4t1乳腺癌细胞迁移的影响图:a. 划痕实验考察tl-atra nps对4t1乳腺癌细胞迁移的影响图;b. transwell实验考察tl-atra nps对4t1乳腺癌细胞迁移的影响图。
[0033]
图5表示tl-atra nps对4t1乳腺癌细胞侵袭的影响图。
[0034]
图6表示tl-atra nps对4t1乳腺癌细胞胞内氧化还原平衡影响图:a. 胞内谷胱甘肽(gsh)水平图;b. 胞内活性氧(ros)水平图。
[0035]
图7表示tl-atra nps对4t1乳腺癌细胞的线粒体损伤的影响图: a. 胞内三磷酸腺苷(atp)水平图;b. 线粒体膜电位变化图;c. 氧气含量图;d. 细胞凋亡水平图。
[0036]
图8表示蛋白质免疫印迹实验(western blot)考察tl-atra nps对4t1乳腺癌细胞胞内信号通路的影响图: a. western blot考察tl-atra nps对4t1乳腺癌细胞胞内氧化还原平衡相关信号通路的影响图;b. western blot考察tl-atra nps对4t1乳腺癌细胞胞内转移相关信号通路的影响图。
[0037]
图9表示tl-atra nps在原位乳腺癌小鼠上的抑瘤结果图: a. 不同处理组小鼠原位瘤的体积增长曲线图;b. 不同处理组小鼠原位瘤的瘤重图;c. 不同处理组小鼠的抑瘤率图;d. 不同处理组小鼠的生存曲线图。
[0038]
图10表示tl-atra nps在原位乳腺癌小鼠上的抑制肺转移结果图。
具体实施方式
[0039]
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。下面参照实施例进一步详细阐述本发明,但是本领域技术人员应当理解,本发明并不局限于这些实施例以及使用的制备方法。而且,本领域技术人员根据本发明的描述可以对本发明进行等同替换,组合,改良或修饰,但这些都将包括在本发明的范围内。
[0040]
实施例1、线粒体靶向抗肿瘤药物三苯基膦-氯尼达明偶联物(tl)的合成。
[0041]
将2.05 g溴丙胺和2.62 g三苯基膦加入20 ml乙腈中, 搅拌回流24小时后,加入10 ml正己烷沉淀,并用乙醚洗涤。滤饼加入异丙醇和最少量的乙醚重结晶即得氨基衍生化的三苯基膦固体。
[0042]
将50.18 mg氯尼达明、74.65 mg 氨基衍生化的三苯基膦和59.51 mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/ n-羟基琥珀酰亚胺溶于二氯甲烷和甲醇的混合溶剂中室温搅拌反应24h,使用薄层层析监控反应进程,使用硅胶柱层析法(洗脱剂乙酸乙酯:甲醇=20:1)纯化即得tl。
[0043]
使用核磁共振氢谱法对tl进行表征,化学位移为:1h nmr (400 mhz, dmso-d6) δ 8.56 (t, j = 6.0 hz, 1h), 8.20 (dt, j = 8.2, 1.1 hz, 1h), 7.93
ꢀ–ꢀ
7.85 (m, 3h), 7.85
ꢀ–ꢀ
7.68 (m, 14h), 7.48 (ddd, j = 8.4, 6.9, 1.2 hz, 1h), 7.37
ꢀ–ꢀ
7.27 (m, 2h), 6.76 (d, j = 8.4 hz, 1h), 5.82 (s, 2h), 4.03 (q, j = 7.1 hz, 1h), 3.66 (dqd, j = 15.9, 7.7, 5.0, 4.5 hz, 2h), 3.46 (q, j = 6.7 hz, 2h), 1.99 (s, 1h), 1.92
ꢀ–ꢀ
1.77 (m, 2h), 1.18 (t, j = 7.1 hz, 1h)。
[0044]
实施例2、tl与pin1抑制剂全反式维甲酸(atra)的比例筛选及协同作用考察。
[0045]
(1)细胞毒性实验。
[0046]
分别配制atra与tl当量为50 μg/ml的储备液,并以50 μg/ml为最高浓度,设置9个浓度梯度,每个浓度设置5个复孔。将4t1乳腺癌细胞以5
×
103cells/孔的密度接种于96孔板中,于5% co2孵箱中37
ꢀ°
c培养24 h。给药后,以不加药的细胞孔作为阴性对照,不含细胞的培养基孔作为空白对照,于37
ꢀ°
c 5% co2孵箱中分别培养24 h。随后加入20 μl 5 mg/ml的mtt溶液,继续培养4 h,吸出混合液并加入200 μl 二甲基亚砜(dmso),于恒温摇床振荡 30min,使蓝紫色结晶充分溶解,采用化学发光仪在570 nm波长处测定吸光度值。采用以下公式计算相对抑制率:rir(%)=[1-(ce-c0)/(cc-c0)]
×
100(ce:实验组吸光度;c0:空白组吸光度;cc:对照组吸光度)。
[0047]
给药后的半数抑制浓度(ic50)分别使用spss软件拟合计算得到。在联合用药疗法中,两药比例的变化可引起药物协同或拮抗的相互作用的变化。为了优化atra和tl在联合用药中的比例,通过计算协同指数(ci)分析了二者不同比例的协同效果(ci,ci 《1表示协同作用; ci》 1表示拮抗作用)。
[0048]
(2)划痕实验。
[0049]
将4t1 细胞以5
×
10
4 cells/孔接种于24孔板中,于5% co
2 孵箱中培养24 h。吸除旧的培养基,用200 μl小枪头在培养板直径处划出“伤痕区”。磷酸盐缓冲液pbs轻洗1 次后,分别加入含有atra、tl及atra与tl混合的溶液(以各比例下相应的ic25值作为给药剂
量),37
ꢀ°
c培养 24 h。吸出药液,pbs 轻洗 2 次,于倒置显微镜下观察。
[0050]
(3)transwell迁移实验。
[0051]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以1
×
10
5 cell/孔接种于transwell小室内,孵育4h,待4t1乳腺癌细胞贴壁。吸去旧培养基,分别加入含有atra、tl及atra与tl混合的溶液(以各比例下相应的ic25值作为给药剂量),孵育24 h。吸出上下室溶液,pbs洗三次, 4%多聚甲醛固定15 min。pbs润洗3遍,0.1%结晶紫染色15 min,再用pbs润洗三次。用棉签将上室细胞擦去,倒置显微镜拍摄并记录。再用10%醋酸溶液溶解结晶紫,采用化学发光仪测量570 nm处吸光度。
[0052]
由图2a可以看出,在atra:tl=2:1时,在细胞毒性上二者具有最好的协同效应,且与单药组相比,联合给药组中atra的ic50从23.573 μg/ml降至6.158 μg/ml,tl的ic50从6.295 μg/ml降至3.079 μg/ml。
[0053]
由图2b可以看出,在atra:tl=2:1时,联合给药显著增加了tl抑制肿瘤细胞横向迁移及纵向迁移的效果。上述实验结果表明与单药相比,二者联用不仅具有显著增加的抑制肿瘤细胞生长作用,且抑制肿瘤细胞转移的能力显著提高。
[0054] 实施例3、tl-atra nps的处方筛选及稳定性考察。
[0055]
将tl的dmso溶液、atra的dmso溶液与dspe-peg-ome的dmso溶液同时逐滴加入探头超声的水中,室温1000 rpm搅拌2h。超滤离心三次除去有机溶剂即得tl-atra nps。对tl与atra的比例进行筛选,制备得到不同的纳米粒并对其进行表征。
[0056]
由图3a可见,atra:tl=2:1的纳米粒组具有最小的多分散指数(pdi),并且小于0.3,具有较好的均一性,粒径大小及电位也符合体内长循环的条件,因此进一步对其稳定性进行考察。图3b表明,atra:tl=2:1组的纳米粒稳定性较好。
[0057] 实施例4、tl-atra nps对4t1乳腺癌细胞迁移能力的影响。
[0058]
(1)划痕实验。
[0059]
将4t1 细胞以5
×
104cells/孔接种于24孔板中,于5% co2 孵箱中培养24 h。吸除旧的培养基,用200μl小枪头在培养板直径处划出“伤痕区”。pbs轻洗1 次后,分别加入含有atra nps、tl nps及tl-atra nps的溶液(atra当量8 μg/ml, tl当量4 μg/ml),37
ꢀ°
c培养 24h。吸出药液,pbs 轻洗 2次,于倒置显微镜下观察。
[0060]
(2)transwell迁移实验。
[0061]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以1
×
10
5 cell/孔接种于transwell小室内,孵育4h,待4t1乳腺癌细胞贴壁。吸去旧培养基,分别加入含有atra nps、tl nps及tl-atra nps溶液(atra当量8 μg/ml,tl当量4 μg/ml),孵育24 h。吸出上下室溶液,pbs洗三次,4%多聚甲醛固定15min。pbs润洗3遍,0.1%结晶紫染色15min,再用pbs润洗三次。用棉签将上室细胞擦去,倒置显微镜拍摄并记录。再用10%醋酸溶液溶解结晶紫,采用化学发光仪测量570 nm处吸光度。
[0062]
图4a表明atra nps与对照组相比几乎没有转移抑制作用,tl nps具有较好的转移抑制效果,而tl-atra nps组具有最好的转移抑制效果。
[0063]
图4b表明atra nps具有微弱的抑制迁移的作用,而tl nps抑制迁移的作用较明显,而tl-atra nps抑制迁移的作用显著高于tl nps,这与划痕实验的结果一致,表明pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物可以显著提高单药的抗转移作用。
[0064] 实施例5、tl-atra nps对4t1乳腺癌细胞侵袭能力的影响。
[0065]
先在transwell小室中加入50 μl/孔的基质胶,置于孵箱放置4 h。取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以1
×
10
5 cell/孔接种于transwell小室内,孵育4 h,待4t1乳腺癌细胞贴壁。吸去旧培养基,分别加入含有atra nps、tl nps及tl-atra nps溶液(atra当量8 μg/ml, tl当量4 μg/ml),孵育24 h。吸出上下室溶液,pbs洗三次, 4%多聚甲醛固定15 min。pbs润洗3遍,0.1%结晶紫染色15 min,再用pbs润洗三次。用棉签将上室细胞擦去,倒置显微镜拍摄并记录。再用10%醋酸溶液溶解结晶紫,采用化学发光仪测量570 nm处吸光度。
[0066]
图5表明tl-atra nps能比单药组更显著抑制细胞侵袭,表明线粒体靶向抗肿瘤药物和pin1抑制剂的联合用药物可以比单药更显著地抑制肿瘤细胞的侵袭。
[0067] 实施例6、tl-atra nps对4t1乳腺癌细胞胞内氧化还原平衡的影响。
[0068]
(1)胞内谷胱甘肽(gsh)水平考察。
[0069]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以10
5 cells/孔接种于24孔细胞培养板培养24 h。吸除培养基,每孔分别给予atra nps、tl nps及tl-atra nps溶液各1ml(atra当量12 μg/ml,tl当量6 μg/ml)各1 ml。孵育12 h后,离心收集细胞,反复冻融两次,4℃,10000 g离心10 min,取上清加入检测液,室温孵育25min后测定412 nm处的吸光度。
[0070]
(2)胞内活性氧(ros)水平考察。
[0071]
取对数生长期4t1乳腺癌细胞,计数后调整细胞悬液浓度,以105cell/孔接种于24孔板,于37℃、5% co2培养箱中培养24 h。吸去旧培养基,pbs润洗1遍,分别加入atra nps、tl nps及tl-atra nps溶液各1ml(atra当量12 μg/ml,tl当量6 μg/ml),孵育12 h后,吸出药液,pbs润洗3遍,加入胰酶消化后,离心收集细胞,并用pbs再润洗1遍,加入dcfh-da(10 μm)溶液,于37℃孵育30 min后,用无血清细胞培养液洗涤细胞三次,沉淀细胞,用pbs重悬细胞,通过流式细胞仪进行分析。
[0072]
图6表明atra nps可以降低胞内gsh水平并升高胞内ros水平,表明pin1抑制剂可以破坏胞内氧化还原平衡。而tl nps虽然不会引起胞内gsh水平变化,但会显著升高胞内ros水平,表明线粒体靶向抗肿瘤药物通过损伤线粒体增加了胞内氧化压力。而在二者联用后(tl-atra nps),ros水平进一步显著增加,表明pin1抑制剂通过破坏胞内氧化还原平衡增敏线粒体,放大线粒体靶向抗肿瘤药物对线粒体的损伤。
[0073] 实施例7、tl-atra nps对4t1乳腺癌细胞的线粒体损伤影响。
[0074]
(1)胞内三磷酸腺苷(atp)水平考察。
[0075]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以10
5 cells/孔接种于24孔细胞培养板培养24 h。吸除培养基,每孔分别给予atra nps、tl nps及tl-atra nps溶液各1ml(atra当量12 μg/ml,tl当量6 μg/ml)各1 ml。孵育12 h后,吸除样品溶液,换新鲜培养基继续孵育24 h,pbs润洗3次,加入100 μl细胞裂解液,反复吹打并裂解细胞,离心(12000 g,5 min),收集上清液,置于4℃保存备用。向96孔板孔内加入100 μl atp检测液,室温放置5 min,加入20 μl收集的上清液,混匀。用多功能酶标仪检测其生物发光强度。并用bca试剂盒测定每组样品中蛋白含量,矫正样品中的细胞数量。
[0076]
(2)线粒体膜电位考察。
[0077]
取对数生长期4t1乳腺癌细胞,计数后调整细胞悬液浓度,以105cell/孔接种于24孔板,于37℃、5% co2培养箱中培养24 h。吸去旧培养基,pbs润洗1遍,分别加入atra nps、tl nps及tl-atra nps溶液各1ml(atra当量12 μg/ml,tl当量6 μg/ml),孵育12 h后,吸出药液,pbs润洗3遍,加入胰酶消化后,离心收集细胞,并用pbs再润洗1遍,加入jc-1染色工作液,37℃孵育20分钟后使用流式细胞仪分析。
[0078]
(3)氧气含量考察。
[0079]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以10
5 cells/孔接种于24孔细胞培养板培养24 h。吸除培养基,每孔分别给atra nps、tl nps及tl-atra nps溶液各1ml(atra当量12 μg/ml,tl当量6 μg/ml)。孵育12 h后,加入液体石蜡液封,使用溶解氧测定仪测定0 h,1 h,2 h,4 h的培养基中氧气含量。
[0080]
(4)细胞凋亡考察。
[0081]
分别取对数生长期4t1乳腺癌细胞,计数后调整细胞悬液浓度,以2
×
105cell/孔接种于6孔板,于37℃、 5% co2培养箱中培养24 h。吸去旧培养基,pbs润洗1遍,分别加入atra nps、tl nps及tl-atra nps溶液(atra当量16 μg/ml, tl当量8 μg/ml)孵育24 h。离心收集细胞,并用pbs润洗2遍后,照 annexin v-fitc/apc双染色试剂盒的使用说明书进行操作,染色完毕后使用流式细胞仪进行检测。
[0082]
图7表明在给予tl nps后,4t1乳腺癌细胞胞内atp水平下降、线粒体膜电位降低、氧气消耗降低且细胞凋亡增加,表明其抑制线粒体呼吸链,引起线粒体损伤并进一步激活细胞内在凋亡通路。而在联合pin1抑制剂后,联合用药组表现出最好的线粒体损伤效果。表明pin1抑制剂和线粒体靶向抗肿瘤药物的联合用药物可以增敏线粒体从而放大线粒体靶向药物对线粒体的损伤。
[0083]
实施例8、western blot考察tl-atra nps对4t1乳腺癌细胞胞内相关信号通路的影响。
[0084]
(1)western blot考察tl-atra nps对4t1乳腺癌细胞胞内氧化还原平衡相关信号通路的影响。
[0085]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释并以10
5 cells/孔的密度接种于6孔细胞培养板培养24 h,每孔分别加入2 ml含atra nps、tl nps及tl-atra nps溶液(atra当量8 μg/ml, tl当量4 ug/ml)的样品溶液孵育24 h,同时以无药培养的细胞作为对照。pbs润洗3次,消化并收集细胞,pbs洗2次。将样品置于冰上,用添加有蛋白酶抑制剂的裂解液重悬细胞,样品涡旋振荡1 min,冰上放置3 min重复3次。用细胞超声粉碎仪超声3-5次,13000 rpm离心15 min,收集上清。用bca试剂盒测定蛋白浓度,加入sds-page蛋白上样缓冲液煮沸10 min,13000 rpm离心取上清。按sds-page快速配制凝胶试剂盒配制凝胶,上样,进行电泳分离,选取合适大小的0.2 μm的pvdf膜进行转膜。转膜结束后,取出pvdf膜在三羟甲基氨基甲烷(tbs)缓冲液中清洗5 min,再置膜于封闭缓冲液中2 h,缓慢摇动。含5
‰
吐温20的三羟甲基氨基甲烷(tbs/t)缓冲液清洗3次后(每次10 min),用合适浓度的一抗4℃孵育过夜,tbs/t缓冲液清洗3次室温孵育二抗2 h。tbs/t缓冲液清洗3次,tbs/t缓冲液清洗5 min,加入发光剂显影曝光。
[0086]
(2)western blot考察tl-atra nps对4t1乳腺癌细胞胞内转移相关信号通路的影响。
[0087]
核因子相关因子e2(nrf2)是维持胞内氧化还原平衡的重要转录因子,醌氧化还原酶1(nqo1)是其下游的重要抗氧化细胞因子,因此我们考察了4t1乳腺癌细胞在给药后pin1、nrf2及nqo1表达情况的变化。图8a表明atra nps可以明显抑制pin1、nrf2及nqo1的表达,表明pin1抑制剂通过下调胞内抗氧化应激通路破坏胞内氧化还原平衡。而tl nps组nrf2的表达显著升高,这限制了线粒体靶向抗肿瘤药物损伤线粒体和杀伤肿瘤细胞的作用。而在联合应用atra后(tl-atra nps),nrf2的表达显著降低,且nqo1的表达也显著降低,这表明线粒体靶向抗肿瘤药物和pin1抑制剂的联合用药物通过抑制pin1对线粒体的保护可以增敏线粒体,放大线粒体靶向抗肿瘤药物对线粒体的损伤从而提高药效。
[0088]
nrf2的下游信号分子缺氧诱导因子-1α(hif-1α)在肿瘤转移中发挥着重要作用,因此对4t1乳腺癌细胞胞内的hif-1α和其下游信号分子血管内皮生长因子(vegf)、基质金属蛋白酶2(mmp2)及基质金属蛋白酶9(mmp9)的表达进行了考察。图8b中可以看出与单药组相比,tl-atra nps组转移相关蛋白的目标条带颜色均显著变浅,表明线粒体靶向抗肿瘤药物和pin1抑制剂的联合用药物组合物通过下调转移相关通路抑制肿瘤转移。
[0089] 实施例9、tl-atra nps对原位乳腺癌小鼠的影响。
[0090]
取对数生长期4t1乳腺癌细胞,用胰蛋白酶消化后加培养基吹散成单细胞悬液。计数后,将细胞悬液稀释至310
6 cells/ml,每只小鼠接种100 μl细胞悬液至右侧第三对乳腺垫,建立4t1原位瘤小鼠模型。原位瘤长至约100 mm3后,将荷4t1原位瘤的小鼠随机分为5组,每组5只。以atra浓度5mg/kg,tl浓度2.5mg/kg的剂量分别将游离的atra与tl、atra nps、tl nps、tl-atra nps的生理盐水溶液通过尾静脉注射入小鼠体内。开始给药当天定义为第0天,每间隔2天通过尾静脉注射给药,共给药4次。每两天测量肿瘤大小。小鼠肿瘤生长监测通过游标卡尺测量肿瘤长(a)和宽(b),肿瘤的体积(mm3)通过公式v=ab2/2计算。于21天时处死并解剖小鼠。肺组织用pbs清洗后于bouin氏液中固定、脱色,计数肺结节。
[0091]
图9及图10表明单药纳米粒组atra nps组与tl nps组均有一定的抑制原位肿瘤生长和肺转移的作用,而tl-atra nps组具有最好的抑制原位肿瘤生长的作用,且没有观察到肺转移,表明线粒体靶向抗肿瘤药物和pin1抑制剂的联合用药物通过破坏氧化还原平衡增敏线粒体以放大线粒体靶向抗肿瘤药物对线粒体的损伤的策略可以有效增强二者的抑瘤作用及抗转移作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1