一种用于血管支架的涂层材料及制备方法
1.本发明属于医用材料制造领域,具体涉及一种用于血管支架的涂层材料及制备方法。
背景技术:
2.随着科学技术的进步,人们对医疗的要求也逐渐增加,对于植入人体材料的要求更是如此。生物医用材料起源于上个世纪40年代,涉及材料、医学和生物等多个领域,已经形成产业。生物医用材料在人类的健康和生命质量方面发挥了重要的作用。
3.生物医用金属由于具有良好的生物功能性和优异的加工性能,成为最早应用于支架的基体材料。金属裸支架的主要问题是支架内再狭窄。通过血管造影,在支架植入后管腔直径再次狭窄大于50%,可以定义为再狭窄。再狭窄的原因主要是支架植入造成血管壁内皮物理损伤,引起炎症反应,使成纤维母细胞和平滑肌细胞增生,发生支架内再狭窄。支架植入术后3到6个月,再狭窄率为20-30%,。由此可见,金属裸支架虽然解决了皮冠状动脉成形术(ptca)术后血管弹性回缩和负性重塑的问题,但难以控制内膜增生引起的再狭窄。再狭窄主要发生在支架植入处,是金属裸支架植入后的主要问题。高分子降解材料的共同特点是在人体内可以自行降解为二氧化碳(co2)和水(h2o)等小分子,并随机体的正常代谢排出体外。材料可以在血管内短期被吸收,降解成无毒的产物,对人体不会产生副作用;支架对血管提供暂时性的支撑作用,无长期的并发增;支架可以作为载体携带药物,通过控制材料的降解速度来控制药物的释放速度,降低血管的再狭窄率;材料具有良好的生物相容性。缺点是高分子支架的支撑强度比金属支架要小得多;支架的尺寸较大,输送系统与支架的释放是个难题;材料在x光下的无法显影,支架在手术中难以准确定位。
4.如果能将金属和高分子聚合物结合成复合材料作为血管支架材料,则可以解决上述缺陷。但是,高分子聚合物与金属的结合很难形成具有特定尺寸,并且粒度均匀分布的纳米材料,而且该过程是固液界面上的吸附和解吸附,不容易制备晶体而且容易受到周围环境如ph值、温度、离子强度等的影响。中国专利文献cn201910613860.5(cn110181912a)公开一种高分子复合材料,包括金属基材及金属基材上设置的仿真膜层,仿真膜层一面与金属基材连接,另一面与耐磨抗压膜层连接;所述仿真膜层包括带有凹凸纹理的底纹层、贴附于底纹层的面纹层及位于面纹层与耐磨抗压膜层之间的罩光层;所述耐磨抗压膜层为透明或亚透明pet薄膜。但是,所得金属基材上的高分子膜厚度为0.15~0.18mm。厚度太厚,无法作为血管支架使用。中国专利文献cn202011102781.7(cn112391019a)公开一种金属基高分子材料及其制备方法,其原材料组成为:聚四氟乙烯、酚醛树脂、二硫化钼、玻璃纤维、青铜粉和铁粉,以聚四氟乙烯作为基料,以酚醛树脂作为基料和多种无机填料之间的粘合剂,使得金属基高分子材料结合性更佳好,整体更易成型,二硫化钼和玻璃纤维添加至聚四氟乙烯基料中,使得基料整体的耐磨性加强,青铜粉和铁粉的加入使得基料整体的机械性更佳,同时导热性更佳。但是该材料厚度较厚,且由多种化学原料制成,无法满足血管支架关于生物相容性、无毒性的要求。
sds
cac
。
22.优选的,步骤(1)中胶原多肽溶液的浓度为4%wt。
23.优选的,所述步骤(2)中基底材料为金属、橡胶或者玻璃等材料。进一步优选的,所述基底材料为钛或其合金。
24.本发明还提供上述用于血管支架的涂层材料的制备方法,其特征在于,包括以下步骤:
25.1)将分子量为500的环氧聚硅氧烷超声分散于碳酸钠/碳酸氢钠缓冲液中得到混合溶液;
26.2)将胶原多肽单层膜g-sdscac置于混合溶液中1~3小时,温度为48~52℃;
27.3)将胶原多肽单层膜g-sdscac在丙酮中提拉多次去除掉未反应的环氧硅氧烷,用高纯氮气吹干后置于氮气中保存。优选的,步骤1)中所述于碳酸钠/碳酸氢钠缓冲液的ph为9.6。
28.优选的,步骤1)中所述混合溶液中环氧聚硅氧烷的浓度为0.01~0.03mol/l。
29.一种血管支架材料,其特征在于,所述血管支架表面涂覆有上述涂层。
30.本发明的有益效果:
31.本发明提供的用于血管支架的材料与现有血管支架材料相比,具有柔韧性强和生物相容性好的优势。多肽单层单层膜g-sdscac和分子量为500的环氧聚硅氧烷结合,使材料具有良好的柔韧性好。涂层柔韧性好,与基底材料之间的结合力较好,能够抵御大的变形。尤其是针对血管支架这种经过撑开过程植入支架而言,具有较大的优势。
32.明胶、环氧聚硅氧烷是高分子聚合物,具有金属材料不具备的血液相容性,避免金属支架与血流直接接触,平稳血流,减少不良刺激,可有效防止血栓形成。环氧聚硅氧烷本身具有无毒、耐腐蚀、抗氧化的优点,减少金属材料在血液中的腐蚀引起的宿主反应和材料反应。与金属支架结合,能够克服金属支架和高分子支架存在的缺陷。
33.本发明在金属基底以及聚硅氧烷之间利用自组装技术先制备胶原多肽单层膜,然后明胶的伯氨基与环氧聚硅氧烷的环氧基团之间通过共价键连接,提高了环氧聚硅氧烷与钛合金基体之间的结合力,提高聚合物层的稳定性,且薄膜厚度超薄易控制。另外环氧聚硅氧烷层可以形成良好的物理屏障以阻挡体液中的腐蚀性离子的侵蚀,进一步提高对钛合金基底的保护。通过多肽单层膜将金属基底与高分子材料改善了材料生物的相容性,提高了两者的结合能力和稳定性。
附图说明
34.图1各涂层表面的接触角;
35.图2实施例1所得g-sdscac接枝环氧聚硅氧烷(m=500)后涂层的xps总谱;
36.图3实施例1所得g-sdscac接枝环氧聚硅氧烷(m=500)后的si 2p高分辨图谱;
37.图4实施例1所得g-sdscac接枝环氧聚硅氧烷(m=500)后n1s高分辨图谱;
38.图5实施例1所得g(sdscac)-(pdms-e500)涂层的表面形貌图(a,实施例3,b,实施例1);
39.图6实施例1所得g(sdscac)-(pdms-e500)涂层的表面3d形貌图(a,实施例3,b,实施例1);
40.图7是实施例1所得g(sdscac)接枝环氧聚硅氧烷(mw=500)前后的杨氏模量(a)及其高斯分布(b);
41.图8各涂层表面上面附着的细胞数;
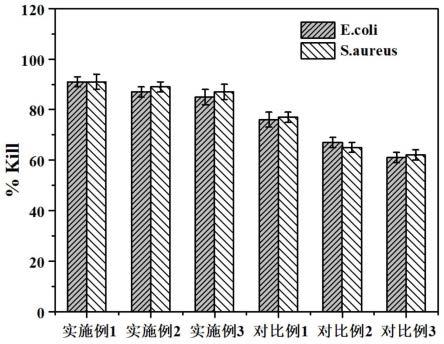
42.图9大肠杆菌(e.coli)和金黄色葡萄球菌(s.aureus)在不同涂层样品表面经过24h培养后的抑菌率柱状图。
具体实施方式
43.本发明实施例中所使用的胶原多肽为市售多肽产品(a.r.),其分子量约为5.00
×
104~1.80
×
105g/mol,经透析方法到的分子量为的多肽(1.48
±
0.2)
×
105g/mol,本发明中1g胶原多肽中含有伯氨基5.6
×
10-4
mol。其他试剂没有特别说明的均为普通市售产品。
44.本发明中所用环氧聚硅氧烷的制备方法,可参考:zhu c,xu j,hou z,et al.scale effect on interface reaction between pdms-e emulsion droplets and gelatin[j].langmuir,2017。本发明所用环氧聚硅氧烷的重均分子量为500
±
50。
[0045]
实施例1
[0046]
一种用于血管支架的涂层材料及制备方法,包括以下步骤:
[0047]
s1:制备多肽单层膜g-stsocmc,可参照中国专利文献cn 111840661 a(202010753455.6);
[0048]
(1)配制浓度为4%wt的胶原多肽溶液50ml:精确称取胶原多肽于100ml于三口烧瓶中,准确量取去离子水,把去离子水倒入三口烧瓶中,室温溶胀0.5h后,将三口烧瓶放入50
±
1℃的水浴中,加热搅拌2h,使其完全溶解,然后用2mol/l的氢氧化钠把溶液的ph调节至10.00
±
0.02,在水浴中稳定0.5h后。
[0049]
(2)向上述胶原多肽溶液中加入表面活性剂sds,得到胶原多肽-sds混合溶液,混合溶液中sds的浓度为3.50mmol/l(cac,50℃时,sds的临界聚集浓度);在水浴中稳定6h备用。
[0050]
(3)切割大小为1cm
×
1cm
×
1mm的若干方形钛片,使用金相砂纸按照,800,1500,3000,5000,7000目的顺序依次打磨抛光,依次用去离子水,无水乙醇,丙酮超声清洗钛片各15min,然后用高纯氮气吹干后在60℃烘箱干燥12h备用。配制30%h2o2和98%h2so4体积比为1:1的混酸溶液,冷却至室温后,将上述处理好的钛片用混酸处理1h,然后用自来水冲洗至中性,再用去离子水清洗5次,最后用高纯氮气吹干后在60℃烘箱干燥12h备用。
[0051]
(4)配制1mg/ml的pei聚乙烯亚胺水溶液,将上述酸蚀的钛片用pei溶液室温处理0.5h,后用去离子水清洗5次,去除掉结合不牢的电荷,最后用高纯氮气吹干后在60℃烘箱干燥12h备用。将正离子化的钛片放入沉积盒中,分别向沉积盒中倒入上述配制好的不同体系的多肽溶液,50℃下沉积10min,然后将其在去离子水中提拉20次,用高纯氮气吹干后置于氮气中保存。所得多肽单层膜标记为g-sdscac。
[0052]
s2:制备血管支架材料g-sdscac-(pdms-e500),
[0053]
1)将分子量为500的环氧聚硅氧烷加入碳酸钠/碳酸氢钠缓冲液(ph=9.6)中,超声分散15min,到混合溶液;混合溶液中环氧聚硅氧烷的浓度为0.024mol/l。
[0054]
2)将胶原多肽单层膜g-sdscac置于混合溶液中2小时,温度为50℃;
[0055]
3)将胶原多肽单层膜g-sdscac在丙酮中提拉10次去除掉未反应的环氧硅氧烷,用
高纯氮气吹干后置于氮气中保存。在相同条件下同时制备多个样品,接枝率虽会有微小差别,但不影响其本身的性能和使用环境,在误差范围之内。
[0056]
所得g-sdscac-(pdms-e500)涂层的接枝率为0.693%,接触角为119.91
°
,平均粗糙度为8.31nm。杨氏模量为4.15gpa,杨氏模量越小,柔韧性越好。
[0057]
实施例2
[0058]
一种用于血管支架材料的涂层及制备方法,包括以下步骤:与实施例1不同的是,混合溶液中环氧聚硅氧烷的浓度为0.01889mol/l。
[0059]
所得g-sdscac-(pdms-e500)的接枝率为0.648%,接触角为113.84
°
,平均粗糙度为9.58nm。平均厚度为36nm。
[0060]
实施例3
[0061]
一种用于血管支架的材料及制备方法,包括以下步骤:与实施例1不同的是,改变接枝时间为1h。
[0062]
所得g-sdscac-(pdms-e500)的接枝率为0.634%,接触角为116.42
°
,平均粗糙度为7.60nm。
[0063]
对比例1
[0064]
一种涂层材料及制备方法,与实施例1的区别在于,将步骤(2)中的表面活性剂替换为浓度为7.00mmol/l的stso(十四烷基磺酸钠)。步骤s2-1)中,环氧聚硅氧烷的浓度为0.024mol/l。
[0065]
该产品的接枝率为2.120%,接触角为109.82
°
,杨氏模量为30.42gpa。
[0066]
对比例2
[0067]
一种涂层材料,将1g明胶,加水搅拌加热至50℃,待明胶完全溶解后,加入氢氧化钠调节反应ph为10.0,得到质量浓度为5%的明胶溶液;加入十二烷基硫酸钠(sds),继续搅拌,sds的浓度为3.50mmol/l。将5mg环氧聚硅氧烷(mw=500)加入到上述溶液中,超声处理10min,反应24小时,停止搅拌和加热,得到环氧聚硅氧烷改性明胶溶液。将正离子化处理的钛片放置于溶液2中,于50℃下沉积10min,然后将其在去离子水、丙酮中各提拉20次,用高纯氮气吹干后置于氮气中保存,得到涂层。该涂层的接触角为103.58
°
,粗糙度约为13.94nm。该对比例所得涂层的厚度约为137nm,实施例1~3所得涂层的厚度为20~50nmnm。
[0068]
由以上结果可以看出,本发明通过将明胶在浓度为3.50mmol/l的十二烷基硫酸钠(sds)存在下制备成多肽单层膜后,再与分子量为500的环氧聚硅氧烷进行接枝反应,不仅可以控制膜的厚度在纳米级别,还能提高抗菌率和柔韧性等。说明多肽单层膜与明胶聚合物相比,其结构、性能均发生了一定程度改变,其与环氧聚硅氧烷接枝后,膜的性能产生了预料不到的变化。另外,先对明胶进行改性后接枝的方法接枝率不易控制,所得涂层中有未接枝成功的环氧聚硅氧烷,部分易在洗脱过程中溶出,对膜的稳固性即附着性能造成影响,未溶出部分在后续使用过程中,易溶解渗出、化学稳定性差。
[0069]
对比例3
[0070]
一种涂层材料g-stso
6%-(pdms-e1000),与实施例1的区别在于,环氧聚硅氧烷的分子量为1000,步骤s2-1)中环氧聚硅氧烷的浓度为0.0112mol/l。该产品的接枝率为3.640%,接触角为135.64
°
。
[0071]
1、涂层表面润湿性测定
[0072]
对膜样品采用dsa-100型光学接触角测量仪(kruss公司,德国)在室温下测量水接触角(ca)。使用自动分配控制器将2ml去离子水滴到样品上,并使用laplace-young拟合算法自动确定ca。通过在五个不同位置测量样本获得平均ca值,并用数码相机(日本索尼有限公司)拍摄图像,结果如图1所示。
[0073]
2、接枝后膜表面元素分析
[0074]
xps能清晰地给出薄膜表面的成分信息,还可以高分辨解析出元素的化学状态。
[0075]
图2为实施例1中g-sdscac接枝pdms-e500前后表面元素变化情况,blank指的是:g-sdscac(blank),g-m500指的是g-sdscac-(pdms-e500)。图3是实施例1中g-sdscac接枝环氧聚硅氧烷(m=500)后si 2p高分辨图谱。可以看出,在400.3ev处为-nh2的峰,在接枝反应之前,多肽单层膜样品中含有一定的n元素,环氧聚硅氧烷接枝后则能明显看出si元素的增加和n元素的减少。图4是实施例1所得g-sdscac接枝环氧聚硅氧烷(m=500)后n1s高分辨图谱,一个n1s轨道谱的峰值399.4ev出现(图4),为基团-co-nh的峰值,一个n1s轨道谱的峰值398.4ev出现(图4),为基团-n=的峰值,说明g-sdscac成功接枝g-sdscac,另外还有氨基峰,说明g-sdscac上部分的伯氨基没能成功接枝g-sdscac。
[0076]
3、膜表面平整度测定
[0077]
本发明血管支架涂层的表面平整度由multimode8型afm(bruker,德国)测定,将制备好的样品置于工作台上,以peak force模式对样品的形貌和平整度进行了表征,测试时,先用原子力显微镜自带的光学辅助系统找到边界,然后把测试范围设置为20μm以横跨样品区域,用afm针尖进行扫描,扫描速度为0.977hz,扫描范围为1μm,数据处理软件为afm自带的nanoscope analysis。
[0078]
从表面形貌图5、图6中可以看出,g(sdscac)-(pdms-e500)表面呈现颗粒堆积,表面均匀,接枝后表面的有序性主要由胶原多肽分子的二级结构、胶原多肽单层膜表面暴露的伯氨基含量和分布,伯氨基暴露量的增加促进了接枝反应得到进行,因此表面形貌表现出非常好的有序性;从三维形貌图中可以看出,接枝环氧聚硅氧烷后的表面平整度较高,规律性较好。
[0079]
4、杨氏模量测试
[0080]
杨氏模量是衡量物体抗变形能力的重要指标,它可以通过在弹性变形范围内挤压或拉伸物体时的线性应力与线性应变之比来获得。制备的样品(g(sdscac)-(pdms-e500))粘在afm工作台上,样品的相图通过tapping模式获得,数据使用asylum research(oxford,英国)进行处理。
[0081]
表1各涂层表面的杨氏模量值
[0082][0083]
杨氏模量主要是衡量物体抗变形能力,从图7中杨氏模量(图a)及其高斯分布(图b)可以看出,实施例1的样品的杨氏模量较小,有一定的柔韧性。
[0084]
杨氏模量越小,柔韧性越好,本发明实施例的涂层材料用于血管支架可以提高其柔韧性,与基底之间的结合力较好,能够抵御大的变形。尤其是针对血管支架这种经过撑开过程植入支架而言,具有较大的优势。
[0085]
5.生物相容性
[0086]
本发明涂层的细胞粘附由dmi3000b倒置光学显微镜(徕卡,德国)上测定,该显微镜配备lecia dfc 450c型ccd。对不用的样品采用结晶紫染色法来测定细胞粘附性,待测材料的制备尺寸与12孔细胞培养板中的孔相同。为便于在显微镜下观察,参照实施例的制备方法将钛片替换为玻璃片制备各涂层,玻璃片无需抛光,其他步骤均相同,在相同的制备条件下,不同基底材料,对于膜的二级结构、接枝率等几乎没有影响。将实施例1、实施例2、实施例3、对比例1、对比例2、对比例3条件下得到的样品放置在孔内,另外做两组同样的实验(即每个实验重复三次,保证实验结果的准确性),blank为空白对照。具体实验步骤:使用含10%胎牛血清的高糖dmem培养基,培养条件为5%co2、37℃恒温培养,细胞融合90%左右进行传代。待测材料的制备尺寸与12孔细胞培养板中的孔相同,将样品放置在孔内,每个样品使用三个平行孔,人脐静脉内皮细胞(huvecs,细胞/孔)接种于各孔中,对数生长期人脐静脉内皮细胞用胰酶/edta消化后用pbs冲洗两次后重悬于无血清dmem/0.5%bsa,培养箱中继续培养12h,后将培养基吸出,用pbs冲洗未粘附的细胞两次,粘附的细胞用4%多聚甲醛固定后用0.1%结晶紫染色5min,后用ddh2o清洗三次。然后用axio scope.ai光学显微镜在100x下进行拍照,样品涂层上面附着的细胞数图8所示,图8中纵坐标为各涂层表面上面附着的细胞数。
[0087]
从图8中可以看出,与blank(在培养板上生长的细胞)相比,实施例1对细胞粘附没有显著影响,表明胶原多肽中的痕量表面活性剂对细胞活力没有影响。且与对比例1~3相比,实施例1~3的涂层样品有更强的细胞粘附力,适用于血管支架材料。
[0088]
6、抗菌性测试
[0089]
金黄色葡萄球菌(s.aureus)和大肠杆菌(e.coli)生长到中对数阶段。将细菌悬浮液稀释至106cfu/ml的浓度。将样品(ti、实施例1、实施例2、实施例3、对比例1、对比例2样品)分别在1ml细菌悬浮液中37℃培养24h。孵育后,各种样品用pbs冲洗两次。用5ml的pbs将附着在标本上的细菌分离5min。将细菌悬浮液培养在mueller-hinton琼脂平板上进行菌落
计数。抗菌率(ar)按以下公式计算:ar(%)=(cfucontrol)-cfuexperiment)/cfucontrol
×
100%,其中ti为对照组,实施例1、实施例2、实施例3、对比例1、对比例2、对比例3条件下所得样品为实验组。拍照比较不同涂层的抗菌性,如图9所示,说明多肽单层膜g-sdscac接枝分子量为500的环氧聚硅氧烷(pdms-e)的样品有很好的抗菌性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1