用于治疗血栓性或出血性疾病的缓释纤溶酶原激活剂制剂的制作方法
1.发明涉及缓释纤溶酶原激活剂组合物。本发明还涉及该组合物的治疗用途,尤其是用于血栓性或出血性疾病中。
背景技术:
2.脑出血(ich)是最严重的中风形式,其每年影响全世界多达500万居民(krishnamurthi,rv et al.2015.neuroepidemiology;45(3):190
–
202;feigin,vl et al.2014.lancet;383(9913):245
–
54)。它们中的大多数死亡或仍然严重残疾。30天时的病死率在40-50%的范围内,而预计只有20%在6个月时功能独立(van asch,et al.2010,the lancet.neurology 9(2):167
–
762010;sacco,et al.2009.stroke 40(2):394
–
99)。在kaplan-meier分析中,10年存活率为24.1%。欧盟和美国目前的指南(steiner et al.2014.international journal of stroke:official journal of the international stroke society;9(7):840
–
55;hemphill,et al.2015.stroke;46(7):2032
–
60)建议将中风患者纳入专门的卒中重症监护病房(icu),目标如下:(1)逆转任何凝血异常;(2)维持血糖正常;(3)控制血压和(4)预防血栓栓塞事件和褥疮并发症。尚未批准针对脑出血(ich)的特定治疗方法。
3.大多数ich病例发生在小动脉破裂,随后血液渗入大脑时,导致快速形成实性和大量脑内血肿。血肿的质量效应会破坏周围的脑组织并压迫偏远的大脑区域,导致高死亡率或严重的运动和认知障碍,这是主要的损伤。一旦血肿形成即继发性损伤引发炎症过程,导致血肿周围水肿(phe)的形成。虽然phe体积可以在临床研究中作为一个有价值的标志物来预测患者的预后(schlunk f,et al.2015.translational stroke research;6(4):257
–
63.;urday,et al.2015.nat.rev.neurol.;11(2):111
–
22),一个明确的优先事项是减少血肿的体积,要么在最初的几个小时内停止出血,要么在最初的几天内清除血肿以限制继发性损伤。
4.研究了减轻ich负担的治疗目标作为现有药物的扩展应用,目的是早期止血(例如使用重组因子viia,fast试验(mayer,et al.2008.the new england journal of medicine;358(20):2127
–
37)或通过神经保护策略限制晚期炎症过程(例如使用铁螯合剂、去铁胺hi-def试验(yeatts,et al.2013.neurocritical care;19(2):257
–
66)。但是,这些策略都没有显示出对ich患者的益处。
5.另一种策略是提取血肿以减少血肿的占位效应和随后的继发性损伤。虽然使用标准手术的第一个结果在主要终点方面并不积极(mendelow,et al.2013.lancet;382(9890):397
–
408.),但研究了进入血肿的新方法以减少手术的有害影响。脑出血疏散(intracerebral haemorrhage evacuation)中的溶栓微创手术(mistie试验)显示副作用显著降低(hanley等人2019.lancet,383(10175):1021-1032)。研究人员表明,mistie策略降低了ich死亡率,并且更有趣的是,他们还证明了剩余血肿体积与ich患者康复之间的密切关系(awad,et al.2019.neurosurgery,84(6):1157-1168)。因此,mistie策略可能是ich
患者的正确解决方案。尽管如此,应使用正确的溶栓剂以确保提高低残疾的可能性。
6.组织型纤溶酶原激活剂(tpa)是唯一被批准用于治疗缺血性中风的药物(重组溶栓剂)。这种527个氨基酸的糖蛋白由从n末端到c末端的五个结构域组成:指结构域、egf样结构域、双环结构域和蛋白水解结构域(van zonneveld,et al.1986.journal of cellular biochemistry;32(3):169
–
78)。由于它能够在低浓度下将纤溶酶原激活为纤溶酶,tpa有利于血栓消退(hoylaerts et al.1982)。重组tpa(rtpa)已被提议作为治疗心肌梗塞、急性缺血性中风(ais)和肺栓塞的药物选择(quinn,et al.2008.expert review of neurotherapeutics;8(2):181
–
92)。
7.在过去的20年中,rtpa作为溶栓剂在治疗出血性中风、clear试验中的脑室内出血和mistie临床中的脑出血方面得到了深入评估。mistie计划建议在脑内血肿中注射重组tpa(rtpa,阿替普酶),使用细导管到达目标区域,并使得rtpa溶栓作用后液化的血液被排出。mistie 3期临床未达到主要终点(mistie治疗组的mrs评分降低)(hanley et al.2019.lancet,383(10175):1021-1032)。虽然rtpa是一种强溶栓剂,但它在治疗急性脑病方面存在三个局限性:首先,它不能快速、有效和安全地清除血肿。事实上,rtpa治疗只允许大约72小时和最多9次注射后血肿减少69%。其次,它会引发再出血(与对照组相比增加25%)(hanley et al.2019.lancet,383(10175):1021-1032)。第三,rtpa已被证明是谷氨酸能神经传递的神经调节剂,导致潜在的副作用,从而限制其在猪ich模型中的有益治疗效果(rohde et al.2002.journal of neurosurgery;97(4):954
–
62;thiex,et al.2007.journal of neurosurgery;106(2):314
–
20.;keric et al.2012.translational stroke research;3(suppl 1):88
–
93)。
8.在过去的二十年中,一些实验研究集中在延长rtpa治疗时间窗以提高其溶栓功效。但是,大多数药物在临床试验中都失败了。设计并制造纳米载体以防止rtpa在循环期间失活并允许rtpa在血凝块区域附近快速释放(chung et al.2008,biomaterials;29(2):228-237)。
9.但是,在载体中加载蛋白质和蛋白酶始终是一个问题。事实上,在药物配方中应用的过程会对配方化合物产生化学和物理压力。这可能导致诸如蛋白质和肽之类的敏感治疗剂的降解和活性丧失。
10.进行了长时间封装和递送rtpa的举措,但突显了包封效率(小于75%)或包封蛋白质浓度(0.1mg/ml)的限制(chung et al.2008,biomaterials;29(2):228-237;wang,et al.2009,j biomed mater res;91a:753-61;zhou et al.2014;acs applied materials&interfaces;6:5566-76;sivaraman et al.2016;mater sci eng c mater biol appl.59:145-156))。
11.因此,仍然需要开发新的制剂来限制纤溶酶原激活剂的副作用,同时提高其对溶栓的功效。
技术实现要素:
12.发明人出人意料地表明,与重复注射相同量的金标准组织纤溶酶原激活剂(rtpa)相比,血肿核中纤溶酶原激活剂的持续释放允许更好的溶栓功效(减少凝块重量)。
13.因此,他们研究了一种从高浓度原液(stock solution)中制备纤溶酶原激活剂组
合物的方法,以允许在几个小时内缓慢释放,从而减少注射次数并显著减少血肿所需的时间。
14.为此,已经开发了一种新的脑相容性制剂,其具有纤溶酶原激活剂的纳米颗粒和热可逆性聚合物,以允许负载高浓度的纤溶酶原激活剂和少于24小时的释放时间,同时保持纤溶酶原激活剂的功效。
15.本公开涉及组合物,其包含热可逆性聚合物和包含纤溶酶原激活剂的纳米颗粒。
16.在一种具体实施方案中,所述纳米颗粒包含泊洛沙姆,优选选自下组:泊洛沙姆188,338和237,更优选是泊洛沙姆188。
17.在一种具体实施方案中,所述热可逆性聚合物是泊洛沙姆,优选是泊洛沙姆407。优选地,所述泊洛沙姆407的浓度为15-25%(w/v),更优选为17-23%(w/v),进一步优选为17%(w/v)。
18.在一种具体实施方案中,所述纤溶酶原激活剂选自下组:rtpa、阿替普酶、替奈普酶、帕米普酶、孟替普酶、拉诺普酶、瑞替普酶、去氨普酶、尿激酶或链激酶。在另一种具体实施方案中,所述纤溶酶原激活剂是突变的纤溶酶原激活剂,优选是w253r/r275s突变体纤溶酶原激活剂,更优选是由序列seq id no:1组成的w253r/r275s突变体纤溶酶原激活剂。
19.在另一方面,本公开涉及所述组合物,其用作药物,优选用于治疗血栓性或出血性疾病。所述血栓性或出血性疾病选自下组:血栓性或栓塞性缺血、动脉或静脉闭塞、深血肿、脑出血或血肿和眼部出血或血肿,优选选自实质内出血或血肿、脑室内出血或血肿、蛛网膜下腔出血或血肿、年龄相关的黄斑变性、视网膜中央闭塞和玻璃体出血、任何外伤性或非外伤性的深血肿、任何手术后血肿,包括脑内或癌症干预后,更优选是脑出血或血肿,诸如实质内、脑室内和蛛网膜下腔出血或血肿。
20.在进一步的方面,本公开还涉及制备包含热可逆性聚合物和纤溶酶原激活剂-泊洛沙姆纳米颗粒的组合物的方法,所述方法包括以下步骤:i)制备包含纤溶酶原激活剂和泊洛沙姆的水溶液,ii)使所获得的溶液与足量的蛋白质沉淀溶剂接触,以沉淀与泊洛沙姆组合的纤溶酶原激活剂,从而形成纤溶酶原激活剂-泊洛沙姆纳米颗粒,iii)将所述纳米颗粒添加到热可逆性聚合物中。
21.在最后的方面,本公开涉及纳米颗粒,其包含与泊洛沙姆组合沉淀的纤溶酶原激活剂,优选是泊洛沙姆188。
附图说明
22.图1:optpa与rtpa的酰胺溶解(amidolytic)和纤溶表征。a)rtpa和optpa(w253r/r275s tpa)对rtpa显色底物的平均酰胺溶解活性,在浓度范围为0至200ng/孔且不存在纤维蛋白(n=4)的情况下测量。b)optpa和rtpa在不同测试浓度下的酰胺溶解活性的详细信息。酰胺溶解活性表示为最大速度(光密度/秒/μg)(测试10个浓度,每个浓度n=4);c)对于所测试的每种浓度的optpa和rtpa(n=5),通过405nm处的光密度评估的最大浊度;d)纤溶活性测量为在全血浆凝块溶解测定中用optpa或rtpa达到50%溶解的时间(人血浆库,n=5)。*表示p《0.05;****,p《0.0001;ns=不显著;空心方形,浅灰色=optpa;普通方形,深灰色=rtpa。
23.图2:optpa
151
与rtpa阿替普酶的酰胺溶解表征。a)阿替普酶和optpa
151
对
rtpa显色底物的平均酰胺溶解活性,在浓度范围为0至200ng/孔且不存在纤维蛋白的情况下测量。b)optpa
151
和阿替普酶在不同测试浓度下的酰胺溶解活性的详细信息。c)optpa(从小库中获得,克隆分离前,图1a)和optpa
151
(来自选定的研究细胞库,图2a)对rtpa显色底物的平均酰胺溶解活性的比较,在浓度范围为0至200ng/孔且不存在纤维蛋白的情况下测量。**表示p《0.01;****,p《0.0001;空心圆=optpa
151
;空心方形=rtpa;普通圆形=optpa&普通方形=图1a中的rtpa。
24.图3:使用optpa
151
与阿替普酶(rtpa)的纤溶酶原活化测定。纤溶酶原激活剂、纤溶酶原和纤溶酶的特异性底物pnapep在tris50mm-nacl 150mm ph=8.0缓冲液中孵育。在18小时内记录405nm处的吸光度,作为转化的纤溶酶活性的报告。作为时间函数的405nm处吸光度的一阶导数的最大值(最大酶活性)显示了在测试浓度范围内的剂量响应(图3左)。虽然tpa在没有纤维蛋白的情况下显示纤溶酶中纤溶酶原的活化明显增加,但optpa在相同浓度范围内(2-7nm之间)激活纤溶酶原的潜力较小(图3左),将纤溶酶原激活为纤溶酶原的能力降低了84.4%(sd=4.7)(图3右)。(针对rtpa测试6个浓度,针对optpa测试3个,两次重复;n=5);空心圆=optpa
151
;空心方形=rtpa;**p《0.01;****表示p《0.0001。
25.图4:optpa和rtpa的血栓弹力图测试比较,评估其凝血和溶栓参数。a-c)凝血参数,包括0.6μg/ml和0.9μg/ml的optpa和rtpa的凝血时间(ct-a)、最大凝块硬度(mcf-b)和凝块形成率(cfr-c);d-e)溶栓参数,包括0.6μg/ml和0.9μg/ml的optpa和rtpa的溶解开始时间(lot-d)、凝块溶解率(clr-e)和曲线下面积(auc-f)。曲线下面积考虑了凝块的形成以及该凝块的纤溶。ns=不显著;普通方形和深灰色(左)=rtpa;空心方形和/或浅灰色(右)=optpa。
26.图5:从1ng/ml到1μg/ml浸入rtpa浴中的1ml血凝块的溶栓时间过程。上图:在24小时内监测所有处理的每个实验时间点的相对剩余凝块重量。虚线表示假处理(在0.9% nacl中浸泡24小时)。黑色箭头表示在相应条件下重复暴露于30μg/ml(三次瞬时暴露15分钟,然后浸入0.9%nacl浴)。结果是相对剩余重量的平均值
±
标准差(sd),n=7。下图:按时间单位和浓度单位表示的血凝块暴露于rtpa。
27.图6:从1μg/ml到30μg/ml浸入rtpa浴中的1ml血凝块的溶栓时间过程。上图:在24小时内监测所有处理的每个实验时间点的相对剩余凝块重量。虚线表示假处理(在0.9% nacl中浸泡24小时)。黑色箭头表示在相应条件下重复暴露于30μg/ml(三次瞬时暴露15分钟,然后浸入0.9%nacl浴)。结果是相对剩余重量的平均值
±
标准差(sd),n=7。下图:按时间单位和浓度单位表示的血凝块暴露于rtpa。
28.图7:泊洛沙姆制剂候选物在24小时内对1ml人全血凝块的溶栓作用的观察研究。上图:过夜凝结的人血(1ml)。中图:在血凝块表面添加100μl候选制剂后24小时,通过自下而上倒置试管来评估血凝块的液化。下图:提取凝块并比较剩余凝块和液化血液的质地(texture)。只有经过假处理的血凝块不会液化。
29.图8:开始使用3种泊洛沙姆候选物治疗9小时后,5ml人血血肿溶解。表示为处理后的相对剩余重量(n=2)。
30.图9:开始用p407-rtpa和o2l-001(p407-optpa)治疗9小时后,5ml人血血肿溶解。用p407-rtpa从每克溶液0.03到1.00毫克(a,n=7)和用p407-optpa、o2l-001从每克溶液
0.03到1.00毫克的剂量递增后,表示为治疗后的相对剩余凝块重量(b,n=6)。$,表示与所有其他组不同的假处理,p《0.0001;*p《0.05;***p《0.001;单因素方差分析,随后是dunnett's多重比较检验。
31.图10:在usp4系统中从o2l-001释放的optpa。使用rp-hplc方法在0.9%nacl溶解介质(闭环系统)中量化optpa。采样时间为0(实验前)、15分钟、30分钟、45分钟、60分钟、120分钟、240分钟、360分钟、480分钟、1440分钟。在本实验(n=6)中,60.2%(sd=14.9)加载的optpa在实验期间被释放,并在t=(6h)时达到最大值。所述量的85%(sd=3%)在第一个小时内释放,其余15%在接下来的几个小时内释放,然后在t=6小时达到平台期。
32.图11:纳米沉淀的表征。a)在补充有4mg/ml p188(hg4)或25mg/ml p188(hg25)或4mg/ml p188和0.05% ps20(hg4ps)的己二醇中获得的纳米沉淀,重悬后记录酰胺溶解活性;或在补充有25mg/ml p188(tg25)的四甘醇中进行。b)在补充有20mg/ml p188(tg20)的四甘醇中获得的纳米沉淀,重悬后记录酰胺溶解活性。c和d)在补充20mg/ml p188(tg20)的四甘醇中获得的纳米沉淀,重悬后记录纤溶活性。*表示p《0.05,***p《0.001,****p《0.0001,ns=不显著。
33.图12:纳米沉淀后替奈普酶和optpa的酰胺溶解活性恢复。在补充4mg/ml p188(hg4)或20mg/ml p188(hg20)的己二醇中获得的替奈普酶(a)和optpa(b)纳米沉淀,重悬后记录的酰胺溶解活性;或在四甘醇中补充4mg/ml p188(tg4)或20mg/ml p188(tg20)进行。
34.发明详述
35.纤溶酶原激活剂的纳米颗粒
36.发明人惊奇地表明血肿核中纤溶酶原激活剂的持续释放,比重复注射相同量的游离纤溶酶原激活剂提供更好的溶栓功效(减少凝块重量)。发明人开发了包含热可逆性聚合物的组合物,以允许缓慢释放纤溶酶原激活剂,从而实现血肿的显著减少。
37.由于胶束的形成导致水凝胶的形成,纤溶酶原激活剂掺入热可逆性聚合物中受到限制。捕获于胶束中的纤溶酶原激活剂不能很好地释放并丧失其活性。为克服这种限制而选择的方案是纳米沉淀纤溶酶原激活剂,优选在泊洛沙姆中,以允许高浓度负载而不使蛋白质变性,并有利于纤溶酶原激活剂随着水凝胶的溶解而释放。
38.在第一方面,本公开涉及包含纤溶酶原激活剂的纳米颗粒。
39.如本文所用,术语“纳米颗粒”是指固体材料的聚集物理单元。
40.纳米颗粒理解为中值直径d50小于1μm的颗粒。本发明的纳米颗粒的中值直径优选为50nm至500nm,更优选为50nm至200nm,进一步优选为100nm至300nm,并且还进一步优选为约150nm或200nm。
41.如本文所用,术语“中值直径d50”是指使50%体积的颗粒群体具有更小直径的颗粒直径。根据本发明的中值直径d50是通过根据基于光衍射和电子显微镜的方法对悬浮液进行的粒径测量来测定。
42.纤溶酶原激活剂是丝氨酸蛋白酶,其通过催化纤溶酶原向纤溶酶的转化而促进纤维蛋白溶解。
43.纤溶酶原激活剂(pa)可以是组织纤溶酶原激活剂(tpa),其是由内皮细胞、神经元和神经胶质细胞在神经血管单元中分泌的丝氨酸蛋白酶。tpa由plat基因编码并且是指丝氨酸蛋白酶ec3.4.21.68。
44.根据本公开,纤溶酶原激活剂可以是阿替普酶替奈普酶、帕米普酶、孟替普酶、拉诺普酶、瑞替普酶、去氨普酶、尿激酶、茴香酰化的纯化的链激酶激活剂复合物(apsac;复合纤溶酶链激酶)、链激酶、尿激酶原、葡萄球菌激酶或w253r/r275s tpa。
45.如wo2013/034710所公开在优选的实施方案中,所述w253r/r275s tpa是突变的tpa,其具有良好的纤维蛋白溶解活性并且不促进n-甲基-d-天冬氨酸受体(nmdar)介导的神经毒性。在一个优选的实施方案中,w253r/r275s tpa在tpa的双环结构域中存在的赖氨酸结合位点中,特别是在lbs组成型色氨酸中特异性突变。在更优选的实施方案中,所述w253r/r275stpa是包含双突变w253r和r275s的突变体纤溶酶原激活剂。在更优选的实施方案中,w253r/r275s突变体tpa(也称为optpa)包含或由seq id no:1组成。
46.纳米颗粒可以由多种方法获得。作为非限制性实例,纳米颗粒可以通过纤溶酶原激活剂的纳米沉淀或通过使用聚合物、脂质、多糖和蛋白质获得。由于胶束的形成导致纤溶酶原激活剂活性的丧失并且不能很好地释放,纤溶酶原激活剂掺入热可逆性聚合物中可受到限制。优选在泊洛沙姆中的纤溶酶原激活剂的纳米沉淀允许具有限制蛋白质变性的高浓度负载,有利于随着水凝胶的溶解而释放活性纤溶酶原激活剂。
47.在一个优选的实施方案中,纳米颗粒通过纳米沉淀获得。纳米沉淀是基于例如通过改变ph、盐浓度、溶解度条件或添加非溶剂来降低其中溶解了纳米颗粒的主要成分的溶剂的质量的公知方法。
48.在一个优选的实施方案中,在泊洛沙姆存在下通过沉淀法获得纳米颗粒。因此,在一个优选的实施方案中,所述纳米颗粒包含纤溶酶原激活剂和泊洛沙姆。
49.如本文所用,术语“泊洛沙姆”是本领域熟知的,并且是指包含侧接聚氧乙烯亲水链的聚氧丙烯中心疏水链的非离子嵌段共聚物。嵌段共聚物可以由下式表示:h(c2h
40
)
x
(c3h
60
)z(c2h
40
)yoh,其中z是整数,使得由(c3h
60
)表示的疏水性碱具有至少2250da的分子量,并且x或y是约8-180以上的整数。泊洛沙姆也以商品名“pluronics”或“synperonics”(basf)而为人所知。聚合物嵌段的长度可以定制;因此,存在许多不同的泊洛沙姆。包括poloxamines如1107(basf)值得注意。特别优选的泊洛沙姆是亲水-亲油平衡(hlb)不小于10,优选不小于18,最优选不小于24的那些。最优选的泊洛沙姆是对于纤溶酶原激活剂颗粒的预期施用途径是药学上可接受的那些。
50.优选的泊洛沙姆由侧接两个聚氧乙烯亲水链的聚氧丙烯中心疏水链组成。优选地,泊洛沙姆选自泊洛沙姆188、338和237,更优选为泊洛沙姆188。
51.具有热可逆性聚合物的组合物
52.为了促进纤溶酶原激活剂的纳米颗粒的缓慢释放,可以将所述纳米颗粒重悬于热可逆性聚合物中,特别是重悬于一种热可逆性聚合物中,所述热可逆性聚合物允许溶解的物质在数小时内,不超过24小时内释放。
53.本公开涉及包含如上所述的纳米颗粒和热可逆性聚合物的组合物。
54.如本文所用,热可逆性聚合物是指表现出它们的物理性质随温度急剧和不连续变化的聚合物。在另一个方面,热可逆性聚合物的特征在于溶胶-凝胶转变温度,低于该温度,聚合物保持流体,高于该温度,聚合物变成半固体。
55.在一个优选的实施方案中,可以制备包含纤溶酶原激活剂的纳米颗粒和热可逆性聚合物的组合物,在低温下以溶液注射,并在体温下形成凝胶,以允许纤溶酶原激活剂从凝
胶中缓慢释放。
56.所述热可逆性聚合物优选为泊洛沙姆,优选表现出可逆热凝胶化的泊洛沙姆如泊洛沙姆407。泊洛沙姆407特别适用于本发明的用途,因为在水溶液中泊洛沙姆407表现出热可逆性,这对优化药物制剂提出极大的兴趣。实际上,尽管在低温下泊洛沙姆407和纤溶酶原激活剂的纳米颗粒为溶液形式,但是它们在体温下形成凝胶以允许蛋白质从凝胶中缓慢释放。
57.在更优选的实施方案中,所述泊洛沙姆407的浓度为15-25%(w/v),优选17-23%(w/v),优选17%(w/v)。
58.在另一个实施方案中,作为非限制性实例,所述热可逆性聚合物还可以是壳聚糖、纤维素、明胶和合成的热敏性聚合物如聚(n-异丙基丙烯酰胺)(pnipaam)。
59.治疗用途
60.所述包含纤溶酶原激活剂的纳米颗粒和热可逆性聚合物的组合物特别适用于减少血肿,特别是例如在实质内、脑室内和蛛网膜下出血或血肿疾病中发生的脑血肿。
61.本公开还涉及如先前所描述的纳米颗粒或组合物的治疗用途。
62.特别地,如上所述的纳米颗粒或组合物用于在有需要的受试者中治疗血栓性或出血性疾病。
63.术语“受试者”和“患者”在本文中可互换使用并且是指人和非人动物。如本文所用,术语“受试者”表示哺乳动物,如啮齿动物、猫科动物、犬科动物和灵长类动物。优选地,根据本发明的受试者是人。
64.如本文所用,术语“治疗(treatment)”,“治疗(treat)”或“治疗(treating)”是指旨在改善患者的健康状况的任何行为,诸如疾病的疗法、预防(prevention)、预防(prophylaxis)和延迟(retardation)。在某些实施方案中,该术语是指疾病或与疾病相关的症状的改善或根除。在其它实施方案中,该术语是指最大限度地减少因向患有此类疾病的受试者施用一种或多种治疗剂而导致的疾病扩散或恶化。。
65.特别地,本文所述的纳米颗粒或组合物可用于治疗血栓性或出血性疾病。所述血栓性或出血性疾病包括血栓性或栓塞性缺血、深血肿、动脉或静脉闭塞、脑出血或血肿和眼出血或血肿。
66.在一个更具体的实施方案中,所述血栓性或出血性疾病选自:实质内出血或血肿、脑室内出血或血肿、蛛网膜下腔出血或血肿、年龄相关的黄斑变性、视网膜中央闭塞、玻璃体出血、任何外伤性或非外伤性的深血肿、包括脑内或癌症干预后的任何手术后血肿。在更优选的实施方案中,血栓性或出血性疾病是脑出血或血肿,例如实质内出血或血肿、脑室内出血或血肿和蛛网膜下出血或血肿。
67.本公开还涉及用于在有需要的受试者中治疗血栓性或出血性疾病的方法,包括向所述受试者施用治疗有效量的如上所述的纳米颗粒或组合物。
68.如本文所用,“治疗有效量”或“有效量”是指当向受试者施用以治疗状态、疾病或病症时足以实现治疗,特别是诱导血栓溶解和减轻血凝块重量的组合物的量。治疗有效量将根据化合物、制剂或组合物、疾病及其严重程度以及待治疗的受试者的年龄、体重、身体状况和反应性而变化。
69.如本文所述的纳米颗粒或组合物的施用可以通过本领域技术人员已知的任何方
式施用,包括但不限于静脉内或病灶内施用。
70.在脑内出血或血肿包括实质内或脑室内出血或血肿的特定情况下,本文所述的纳米颗粒或组合物可经由脑内途径施用。
71.在蛛网膜下腔出血或血肿的特定情况下,本文所述的纳米颗粒或组合物可以局部施用。
72.在深血肿的特定情况下,本文所述的纳米颗粒或组合物可以经由肌内或关节内途径施用。
73.在骨髓内脊髓出血的特定情况下,本文所述的纳米颗粒或组合物可以经由骨髓内途径施用。
74.在眼部出血的特定情况下,本文所述的纳米颗粒或组合物可经由眼内途径施用。眼内途径包括玻璃体内施用和眼眶底施用途径。
75.因此,优选地,纳米颗粒或组合物可以配制为可注射制剂,并且可以含有对于能够被注射的制剂而言药学上可接受的介质,例如等渗、无菌的盐水溶液(磷酸一钠或二钠、氯化钠、氯化钾、氯化钙或氯化镁等或这些盐的混合物)或干燥的,尤其是冻干的组合物,取决于其在添加无菌水或生理盐水后允许构成可注射溶液的情况。
76.根据本公开向受试者施用如上所述的纳米颗粒或组合物可以以剂量依赖性方式表现出有益效果。因此,在宽范围内,与施用较小量相比,施用较大量的组合物预期实现增加的有益生物作用。此外,还考虑到在低于观察到毒性水平的剂量下的疗效可以以任何方便的方式进行。
77.应当理解,如本领域技术人员所公知,在任何给定情况下施用的如上所述的纳米颗粒或组合物的具体剂量将根据所施用的纳米颗粒或组合物、可有效递送至施用部位的组合物的体积、待治疗或抑制的疾病、受试者的状况和可改变组合物的活性或受试者的响应的其它相关医学因素来调节。
78.例如,用于特定受试者的纳米颗粒或组合物的具体剂量取决于年龄、体重、总体健康状态、饮食、施用的时间和模式、排泄速率、组合使用的药物和施用治疗的特定病症的严重程度。给定患者的剂量可使用常规考量来确定,例如通过常规比较本文所述组合物与已知试剂的不同活性,诸如通过适当的常规药理学方案。组合物可以单剂量方案或多剂量方案施用。
79.上述允许以高浓度缓慢释放纤溶酶原激活剂的组合物的制剂可以有利地以单剂量和任选潜在的救援剂量施用。
80.取决于施用途径,如上所述的纳米颗粒或组合物的合适的剂量范围可以约为几百微克试剂,其范围为约0.005-1mg/ml血液/天,优选0.01-1mg/ml血液/天,优选约0.03-0.20mg/ml血液/天。
81.在一个具体的实施方案中,如上所述的纳米颗粒或组合物的合适剂量可以独立于血肿体积为0.3-3mg/天。
82.制备组合物的方法
83.在另一方面,本公开涉及制备如上所述的组合物的方法。特别地,所述方法包括制备如上所述的纳米颗粒和将所述纳米颗粒添加到热可逆性聚合物中的步骤。
84.根据本公开的纳米颗粒可由多种方法获得。作为非限制性实例,本领域技术人员
公知。纳米颗粒可以通过纤溶酶原激活剂的纳米沉淀或通过使用聚合物、脂质、多糖和蛋白质获得。特别地,所述纳米颗粒通过纳米沉淀获得,例如通过改变ph、盐浓度、溶解度条件或添加非溶剂。
85.在一个优选的实施方案中,所述纳米颗粒通过如wo2009/043874中所述将纤溶酶原激活剂与泊洛沙姆组合进行纳米沉淀来获得。所述方法包括如下步骤:如前所述制备包含纤溶酶原激活剂和泊洛沙姆的水溶液,并将所得溶液与足量的蛋白质沉淀试剂接触,以沉淀纤溶酶原激活剂和泊洛沙姆的组合,从而形成纤溶酶原激活剂-泊洛沙姆纳米颗粒。
86.考虑到在保护纤溶酶原激活剂的酶促核的同时改进纤溶酶原激活剂的纳米沉淀,特别优选在形成纳米颗粒之前使用所述泊洛沙姆在水溶液中的浓度为4mg/ml-25mg/ml,优选4mg/ml,并且在形成纳米颗粒之前使用所述纤溶酶原激活剂在水溶液中的浓度为0.1mg/ml-10mg/ml,优选1-4mg/ml,更优选2mg/ml。
87.如本文所用,“蛋白质沉淀试剂”是指允许蛋白质,特别是根据本公开如上所述的纤溶酶原激活剂沉淀的试剂。在优选的实施方案中,所述蛋白质沉淀剂是溶剂,更优选生物相容性溶剂。如本文所用,“生物相容性”是指在合理的医学判断范围内适合与人和动物的组织接触而没有过度毒性、刺激、过敏反应或与合理的益处/风险比相称的其它问题并发症的那些溶剂。
88.优选蛋白质沉淀溶剂是三缩四乙二醇,也被称为四甘醇或四氢糠醇聚乙二醇醚(cas:31692-85-0)或己二醇,也被称为2-甲基-2,4-戊二醇(cas:107-41-5),优选蛋白质沉淀溶剂是三缩四乙二醇或己二醇。
89.四氢呋喃聚乙二醇醚或己二醇的体积可以占由蛋白质沉淀溶剂和水溶液组成的最终体积的80%至99%。
90.可以通过调节三个参数进一步优化蛋白质的沉淀产率:水相和蛋白质沉淀溶剂的体积比,泊洛沙姆的浓度,离子强度和蛋白质的质量。
91.蛋白质沉淀溶剂以足以使pa沉淀为纳米尺寸颗粒的量使用。蛋白质沉淀溶剂/水溶液的体积比在5至100,优选为5、10、20,更优选5,通常足以在泊洛沙姆存在下诱导pa的纳米沉淀。在一个优选的实施方案中,水相和蛋白质沉淀溶剂的体积之比为1:5。
92.pa-泊洛沙姆纳米颗粒的形成可以在较宽的温度范围内发生。因此,优选地,使蛋白质沉淀溶剂与包含pa和泊洛沙姆的所述溶液在1至25℃的温度下接触。更优选地,在2-10℃的温度下孵育,最优选约4℃的温度下孵育。实际上,已经观察到pa-泊洛沙姆颗粒的形成在低温下更具有可重复性。
93.非离子表面活性剂或盐与蛋白质沉淀试剂的组合使用可以促进和/或增强蛋白质的沉淀,并且显著地达到更好的沉淀产率。
94.因此,在一个具体实施方案中,水溶液含有非离子表面活性剂,优选选自聚山梨醇酯20,40,60或80,更优选聚山梨醇酯20。
95.在另一个具体的实施方案中,水溶液含有盐。盐的浓度优选为0.01m到3m。优选地,盐是水溶性电解质。可以使用三[羟甲基]-氨基甲烷、nacl、kcl、(nh4)2so4或其混合物。其中,特别优选是nacl。
[0096]
水溶液的盐和表面活性剂浓度可以在较宽范围内变化。对于给定量的纤溶酶原激活剂,在固定的溶液ph,固定的温度和固定的水溶液/蛋白质沉淀溶剂的体积比下,本领域1.cm-1
)计算浓度。
[0110]
活性测量
[0111]
通过产品的制剂选择过程,使用四个测试来测量蛋白质的活性。
[0112]
酰胺溶解活性
[0113]
在生色底物(2μm)(spectrozyme 444(甲基-d-环己亚硝酰基-甘氨酰-精氨酸对硝基苯胺乙酸盐))存在下孵育纤溶酶原激活剂。反应在37℃下在含有300mm nacl、50mm三-咪唑的ph=8.4的缓冲液中,以200μl的终体积进行。通过在微量培养板读数器(biotek elx 808)中测量在405nm波长下在30分钟内每单位时间产生的游离发色团(pna)的吸光度的增加量(初始速率法)来测定纤溶酶原激活剂变体的酶活性。对5-10种不同浓度进行分析,重复实验通过2-5个独立实验进行。绘制中位数和分布。
[0114]
纤维蛋白溶解活性
[0115]
用20mm氯化钙和浓度为1.5、2.0和2.5μg/ml的每种tpa变体补充人血浆池(三名供体)。通过37℃下405nm的od测量记录凝块溶解的时间。分析通过5个独立实验进行重复实验。结果表示为od最大值以比较纤维蛋白凝块的浊度(绘制中位数和分布);并表示为获得50%凝块溶解所需的时间来比较纤维蛋白溶解。绘制中位数和分布。
[0116]
溶栓活性
[0117]
对于离体凝血弹性描记法测定,血液由法国血液机构收集。使用旋转凝血弹性描记法(rotem delta,)在rtpa和optpa(0.6和0.9μg/ml)和s-extem底物的存在下研究新鲜血液(300μl/测定,在6小时内使用)。用hepes缓冲液(hepes 10mm ph 7.4,nacl 150mm)稀释纤溶酶原激活剂。测量凝血时间(ct)、最大凝块硬度(mcf)和凝块形成率(cfr)以表征和量化凝血步骤的改变。测量溶解开始时间(lot;mcf降低15%所需的时间、凝块溶解速率(clr)和曲线下面积(auc)以表征和定量血栓溶解。对5-7名独立供体进行分析。结果以平均值和95%置信区间给出。
[0118]
纤溶酶原激活
[0119]
在glu-纤溶酶原(enzyme research laboratories,0.25μm)和pnapep 1751(cryopep,0.6mm)的存在下孵育纤溶酶原激活剂。反应在37℃下在含有150mm nacl、50mm三-咪唑,ph=8.0的缓冲液中,以50μl的终体积进行。通过在微量培养板读数器(biotek elx808)中测量在405nm波长下18小时内每单位时间产生的游离发色团(pna)的吸光度的增加量来测定纤溶酶(apln)的酶活性,所述纤溶酶(apln)通过纤溶酶原激活剂对纤溶酶原(atpa)的作用而转化。apln是通过计算作为时间函数的斜率确定的atpa的一阶导数(apln=datpa/dt,,其中datpa≠0)。
[0120]
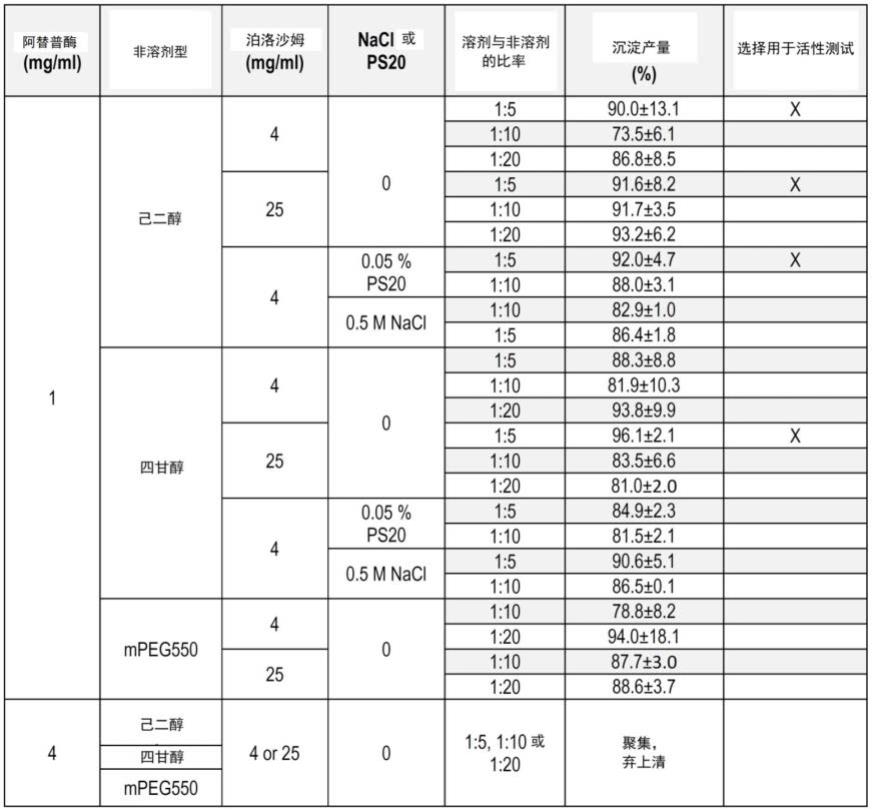
离体1ml人凝块浸入在rtpa浴中
[0121]
血液由法国血液机构收集。将来自4个个体的血液样品汇集用于每个实验。通过加入辅以合成磷脂的重组组织因子和1m氯化钙溶液,分别占最终1.00ml凝血体积的2%和2.5%来形成。将凝块在37℃下孵育过夜。在实验当天,制备rtpa(阿替普酶)的新鲜溶液。离体1ml凝块在15ml的浴中经受以下条件:
[0122]-连续暴露于pbs(对照处理),
[0123]-连续暴露于rtpa(30μg/ml、10μg/ml、1μg/ml、100ng/ml、10ng/ml以及1ng/ml),
[0124]-每4小时间歇暴露于30μg/ml的rtpa中15分钟,然后在其间浸入pbs。
[0125]-暴露于30μg/ml的rtpa中15分钟,然后浸入pbs。
[0126]
为了对凝块溶解进行评估,在处理开始前和在不同时间点(1h、3h、5h、7h以及24h)收集凝块并称重。结果以来自7个独立实验的相对剩余重量的平均值
±
标准偏差(sd)的方式给出。
[0127]
纳米制剂
[0128]
是carlina technologies的专有纳米级预制剂/制剂技术,其提供了在将肽和蛋白质包封到药物递送系统中之前使肽和蛋白质浓缩和稳定的解决方案。该技术包括向蛋白质或肽的水溶液中加入蛋白质沉淀溶剂,使得其形成稳定的纳米颗粒(纳米沉淀)。
[0129]
对于纤溶酶原激活剂的纳米沉淀,通过在室温下温和混合将泊洛沙姆p188溶解在溶有rtpa蛋白的hepes缓冲液的溶液中。加入泊洛沙姆p188使其浓度在rtpa蛋白溶液中为4mg/ml至25mg/ml。rtpa蛋白浓度通常在1-3mg/ml之间。
[0130]
通过加入蛋白质沉淀溶剂使溶解在包含4mg/ml至25mg/ml泊洛沙姆188的hepes缓冲液中的rtpa蛋白质纳米沉淀。用于rtpa蛋白质沉淀的蛋白质沉淀溶剂是四甘醇(三缩四乙二醇)。可用于蛋白质纳米沉淀的其它蛋白质沉淀溶剂的例子有mpeg400和己二醇。
[0131]
对于rtpa蛋白质的纳米沉淀,以1:5的溶剂(即蛋白质水溶液)与非溶剂(即四甘醇)比率添加四甘醇。通过温和混合将两种溶液混合,然后在冰箱中孵育30分钟。然后通过离心(10000g,30分钟)收集纳米沉淀的蛋白质。弃去上清液。
[0132]
用17%(w/v)泊洛沙姆p407溶液重悬前一步骤完成后得到的离心管中的蛋白质沉淀。将蛋白质沉淀重悬于p407溶液中以获得均匀混合物。通过hplc-uv分析测定悬浮在泊洛沙姆p407溶液中的rtpa蛋白的终浓度。
[0133]
离体5ml人血肿降解
[0134]
来自efs的血样是同一天接收并提取的。每天实验接收来自6个个体的两个血样。集中所有接收的样品并分装在50ml falcon管中。如前所述,通过加入辅以合成磷脂和cacl2的重组组织因子诱导凝块形成。将5ml凝块在37℃下孵育过夜(》12小时)。离体5ml凝块经受以下条件:
[0135]
a)对载体溶液及其浓度进行评估,以使操作者易于注射(17%-p407、20%-p407、23%-p407),
[0136]
b)对加载在p407溶液中的rtpa纳米沉淀的量进行评估,以实现凝块溶解(从0.03mg/g凝胶至1.00mg/g)
[0137]
c)对加载在p407溶液中的optpa纳米沉淀的量进行评估,以实现凝块溶解(从0.03mg/g凝胶到1.00mg/g)
[0138]
在实验当天,使用25g 0.5mm x16mm注射器(bd microlance
tm
3)将测试溶液注射到凝块的核中。阴性对照凝块(对照处理组)在凝块核注射400μl dpbs。阳性对照凝块以4小时间隔接受3次再溶解的1.00mg/ml rtpa(阿替普酶)注射(3*133μl=总计400μl),也注射在凝块的核中,以模拟mistie临床试验方案。为了评估凝块溶解,在处理开始前和实验结束时(9h)收集凝块并称重。结果以第一次评价(a)的两个实验和最后两次评价(b)和(c)的6-7个
独立实验的相对剩余重量的平均值
±
标准偏差(sd)的形式给出。
[0139]
统计分析
[0140]
对每个结果进行详细的统计测试。使用graphpad prism v9.1.0和r软件(version 3.5.0)进行统计分析。
[0141]
凝块溶解的量表示为处理后的相对剩余重量百分比。其对应于治疗后的最终重量(w_最终)除以治疗前的初始重量(w_初始)乘以100(等式1)。
[0142]
相对剩余重量百分比=w_最终/w_初始
×
100
[0143]
等式1:用于获得处理后的相对剩余重量百分比的计算式
[0144]
释放研究
[0145]
rp-hplc法测optpa
[0146]
使用hplc方法在usp4系统中定量optpa。简而言之,参数如下:c4 column jupiter(150x 4,6mm,5μm,);流动相a:0.1% tfa溶解在去离子水中v/v;流动相b:0.1% tfa溶解在乙腈中v/v以及以1.2ml/min的流速。在220nm处检测蛋白质,预期保留时间为约8.8-9.5分钟。
[0147]
usp4溶解法
[0148]
开发的基础是欧洲药典(第2.9.3章)和美国药典(第《711》章)中描述的药典流经细胞方法。该方法将被称为流经细胞或usp4,其为美国药典的术语。
[0149]
将溶解系统(sotax ce7 smart)配置为可以使用固定溶解体积的闭环系统,并使用具有离线hplc测量的活塞泵(sotax cp7-35)。
[0150]
实验是以500mg o2l-001(1mg蛋白质/g凝胶)在50ml溶解介质(0.9%nacl缓冲液ph7.4)中作为样品量进行的。其对应于溶解介质中10μg/ml的蛋白质最终浓度(optpa)。
[0151]
结果
[0152]
与rtpa相比,optpa降低了脱靶活性
[0153]
在不存在血纤蛋白的情况下,与rtpa相比,优化的重组tpa(optpa,w253r/r275s tpa)溶解rtpa(一种模拟血纤蛋白溶酶原的显色底物)的活性显示出63%的显著降低(rtpa和optpa的中值分别为1.01和0.37,n=4,p《0.05,双尾曼-惠特尼检验,图1a)。
[0154]
有趣的是,在0-20μg/ml的测试浓度范围内,optpa的酰胺溶解活性显示出的线性剂量反应低于rtpa得到的线性剂量反应(图1b,线性回归,斜率和95%置信区间为:rtpa 288.6mod/秒[275.0;302.2]和optpa 107.5mod/秒[92.4;122.6],对于每个浓度,n=4,p《0.0001,f检验)。然后在全血凝块溶解测定中,就纤维蛋白溶解活性,将optpa与rtpa进行比较。
[0155]
与rtpa相比,optpa的加入既不延迟也不减少纤维蛋白溶解前纤维蛋白底物的形成(rtpa的od最大值的中值为0.89,optpa的od最大值中值为0.93,在曼-惠特尼检验中无显著差异,n=5,图1c)。在所测试的浓度范围内,optpa显示与rtpa相比达到50%溶解的非显著差异(rtpa和optpa之间的平均差异[95% ci]在1.5μg/ml下为-13.77min[-24.00;-3.53],ns;在2.0μg/ml下为-13.90min[-24.14;-3.67],ns;在2.5μg/ml下为-2.33min[-12.57;+7.91],ns,n=5,双因素方差分析后sidak's多重比较检验)。
[0156]
在鉴定和分离产生optpa的独特克隆后,本发明人表征了称为optpa
151
的目的蛋白(使用技术产生,克隆#151-79)在spectrozyme底物上和在纤溶酶原激活为纤溶酶后的pnapep-1751底物上的酶活性。并将optpa
151
活性与阿替普酶(rtpa)进行比较。
[0157]
从分离的克隆optpa
151
获得的重组蛋白显示与从微型池获得的重组蛋白相同的图谱。与阿替普酶相比,optpa
151
显示出显著降低68%的溶解rtpa的活性(rtpa和optpa
151
的标准化的中位数分别为1.03和0.35,n=5,p《0.01,双尾曼-惠特尼检验,图2a-c)。
[0158]
记录optpa激活纤溶酶中纤溶酶原的活性,其已知是出血性转化中的一个关键角色,例如通过激活明胶酶(mmps)。由于tpa和纤溶酶原均不溶解pnapep底物(此处未显示),405nm处吸光度的增加反映了纤溶酶的形成。一阶导数能够计算纤溶酶活性,以进一步通过浓度的函数的方式标点最大纤溶酶活性。线性回归证实了阿替普酶(rtpa)与optpa
151
之间触发纤溶酶原向纤溶酶转化的活性差异,其中optpa
151
具有显著较低的能力(斜率和95%ci为:rtpa 1.9mod/分/nm[1.6;2.2]和optpa 0.3mod/分/nm[0.1;0.5],n=5;分别测试optpa
151
和rtpa的6和3个浓度,p《0.0001;f检验)(图3,左)。这些数据的标准化显示rtpa和optpa中位数分别为99%和15%(n=5,p《0.01,双尾曼-惠特尼检验,图3,右)。
[0159]
从分离的克隆纯化的optpa蛋白质optpa
151
表明出与从细胞系库中纯化的蛋白质相似的性能,表明本发明细胞系的稳健和预测性结果。
[0160]
rtpa和optpa表明出相似的溶栓能力
[0161]
使用凝血弹性描记法(rotemδ仪器),在rtpa和optpa之间进行进一步的比较分析。在0.6和0.9μg/ml下对新鲜人血(采集《6小时)比较两种血栓溶解剂。使用extem-s底物,在一小时内观察特定选择浓度下凝块的形成和完全溶解。
[0162]
双因素方差分析,随后进行sidak多重比较测试,表明药物或测试浓度对凝血参数(凝血时间,最大凝块硬度和凝块形成率)没有影响(图4a-c)。在所研究的浓度下,rtpa和optpa对凝血过程的起始没有明显影响(凝血时间,从测试开始直到达到2mm振幅的时间)(rtpa和optpa之间的平均差异[95%ci]在0.6μg/ml,为-0.45秒[-3.99;+3.10],ns;在0.9μg/ml为-0.47秒[-3.72;+2.78],ns,n=5-7),以及凝块形成率(rtpa和optpa之间的平均差异[95%ci]在0.6μg/ml为-0.01
°
[-1.84;+1.81],ns;在0.9μg/ml为+1.30
°
[-0.37;+2.98],ns,n=5-7),以及最大凝块硬度(rtpa和optpa之间的平均差异[95%ci]在0.6μg/ml为-1.43mm[-4.66;+1.80],ns;在0.9μg/ml为-1.59mm[-4.56;+1.38],ns,n=5-7,双因素方差分析后sidak's多重比较检验,图4a-c)。
[0163]
双因素方差分析表明药物对溶解开始时间,凝块溶解速率和曲线下面积没有影响。在这三个参数上观察到浓度有非常显著的影响(p《0.001)。
[0164]
多重比较不允许根据溶解开始时间区分测试浓度下的optpa和rtpa(图4d,rtpa和optpa之间的平均差异[95%ci]在0.6μg/ml为-318.9秒[-729.1;+91.31],ns;在0.9μg/ml为-245.8秒[-634.8;+143.1],ns,n=5-7),凝块溶解速率(图4e,rtpa和optpa之间的平均差[95%ci]在0.6μg/ml为-0.69
°
[-12.60;+11.22],ns;在0.9μg/ml为-1.14
°
[-13.05;+10.77],ns,n=5-7)和曲线下面积(图4f,rtpa和optpa之间的平均差[95%ci]在0.6μg/ml为-114.1mm2[-745;+516],ns;在0.9μg/ml为-199.8mm2[-820;+421],ns,n=5-7,双因素方
差分析后sidak's多重比较检验)。
[0165]
连续暴露于低浓度rtpa与重复短暂暴露于高浓度rtpa对液化所形成的血肿同样有效
[0166]
出血性中风导致的血肿在以下参数方面与缺血性中风中的血凝块不同:凝块体积,凝块组成,施加于凝块的剪切应力。因此,当在血流外形成血肿时,本发明人发明人想知道较低剂量的纤溶酶原激活剂随着接触时间的增加与更强更短的接触相比的影响。
[0167]
将过夜收缩的1ml血凝块浸入含有rtpa的溶液中,以评价实现有效溶栓所需的最小rtpa浓度。在第一组实验中,发明人将24h连续暴露于1ng/ml至1μg/ml,与重复15min暴露于30μg/ml的rtpa浓度进行比较(图5)。
[0168]
双因素方差分析表明时间(p《0.0001)和治疗(p《0.001)对血凝块溶解有非常显著的影响。与长期暴露于较低浓度(四种测试浓度ns)相比,短期暴露于高浓度rtpa(15分钟暴露于30μg/ml)导致凝块快速溶解,治疗后一小时就观察到显著效果(p《0.05)。在1小时的时间点之后,除在24小时p=0.08(双因素方差分析后dunnett's多重比较检验),7小时时的峰值差异(3x30μg rtpa与假处理之间的平均差异[95%ci]为-48.14%[-87.92;-8.36],p《0.05,n=7)外,在不同时间点仅三次连续15分钟暴露于30μg/ml rtpa与阴性对照显著不同。
[0169]
关于连续暴露,在所有条件下处理开始后1小时未观察到显著影响,但在1μg/ml连续暴露条件下直到24小时都观察到明显的凝块溶解。在7h时间点,连续暴露于100ng/ml和1μg/ml均实现了明显的血凝块溶解(平均差异[95%ci]分别为-33.0%[-5.6;-60.4],p《0.05;-39.3%[-7.2;-71.4],p《0.05,n=7)。有趣的是,以1ng/ml和10ng/ml连续暴露于rtpa从未不同于假处理(n=7)(双因素方差分析,随后是dunnett's多重比较检验)。
[0170]
作为该试验的结论,至少对于在24小时内液化所形成的血肿,连续暴露于低浓度rtpa与重复短暂暴露于高浓度rtpa是同样有效的。
[0171]
该模型的曲线下面积表明,在30μg/ml下连续15分钟的3次暴露比在1μg/ml下的连续暴露高出25%(30.2任意单位(au)与24.0au相比),并且比100ng/ml的连续暴露高1158%(30.2au与2.4au相比)(图5-底部)。与短暂的浓缩暴露相比,血栓持续暴露于较低剂量的纤溶酶原激活剂(此处为rtpa)会导致较低浓度的溶栓,其效率相似,整体暴露降低了25%至1000%。
[0172]
在第二组实验中,发明人增加了连续暴露中的rtpa浓度,以观察随着增加的连续暴露是否可观察到更多的溶栓作用或是否达到平台期。在这里,24小时内rtpa的浓度分别为1μg/ml、10μg/ml和30μg/ml(图6)。双因素方差分析揭示了时间有非常显著的影响,但rtpa浓度对血栓溶解没有影响(分别为p《0.0001和p=0.08)。连续处理(从1μg/ml到30μg/ml)和连续暴露处理(3x30μg/ml)与rtpa之间没有统计学差异(双因素方差分析后dunnett's多重比较测试)。
[0173]
为了加快和更好地实现大血肿溶解,由于酶动力学,允许在几个小时内释放浓度高于0.1μg/ml的rtpa的技术肯定超过3小时,应该与更高浓度的多次注射一样有效。
[0174]
nanoformulated rtpa(p407-rtpa)具有高溶栓活性
[0175]
发明人将rtpa纳米颗粒悬浮在泊洛沙姆407溶液中,其允许以小时为单位持续释放。泊洛沙姆是一种合成聚合物,具有可微调的tsol-gel(溶液至凝胶转变温度)的热响应
行为。
[0176]
因此产生了每克凝胶高达3.6mg rtpa的溶液,以验证使用小针头(25g 0.5mm x 16mm注射器(bd microlance
tm
3))将这种材料注射到血肿核的可行性,并检查此类rtpa制剂允许血液降解的能力。泊洛沙姆候选物在17%、20和23%(w/v)p407溶液中制备,以下分别命名为17-p407、20-p407和23-p407(rtpa的浓度分别为3.6mg/g;3.6mg/g和3.5mg/g)并在“二项式”血凝块溶解实验(血凝块溶解与否)中进行测试。如前所述在1.5ml中制备来自全人血的1ml血肿,并将100μl泊洛沙姆溶液滴在血凝块的顶部。在24小时期间观察到液化并且在24小时后收获剩余的凝块。所有的血凝块都被四个候选者液化(图7)。
[0177]
17%的p407候选物在血肿核部位具有最佳注射相容性
[0178]
随后在5ml全血血肿上测试这些制剂,在血肿核注射药物以测量9小时时的血肿液化,时间点是根据先前的实验选择的(图5)。所有候选者都实现了高凝块溶解(图8)。与17-p407相比,候选20-p407-rtpa和23-p407-rtpa需要对注射器施加高压,并且较不易于处理。因此,发明人从该选择步骤中选择了17-p407-rtpa用于扩展评估,发现剂量为0.01mg/g rtpa至1mg/g rtpa。
[0179]
与标准rtpa相比,纳米配制的纤溶酶原激活剂具有更高的溶栓功效
[0180]
在同一模型上,注射rtpa 1mg/ml(阿替普酶,400μl分3次注射,每4小时注射133μl以模拟mistie程序)后9小时测量5ml血肿的相对重量,p407-rtpa含有17%p407(400μl,单次注射给药浓度,浓度范围为0.03mg/g、0.10mg/g、0.30mg/g、1.00mg/g)(图9a)。
[0181]
使用单因素方差分析,在凝块溶解方面,不同的候选者在假处理和rtpa 1mg/ml进行比较。kolmogorov-smirnov检验证实了残差的正态性。观察到假处理组和rtpa 1mg/ml组之间存在显著差异(平均差异[95%ci]为+42.71%[+27.76;+57.67],p《0.0001,n=7)。事后分析(dunnett’s检验)显示rtpa 1mg/ml和17-p407-rtpa 1mg/g之间存在显著差异(平均差异[95%ci]为+18.00%[+3.05;+32.95],p《0.05,n=7)。在相同的注射浓度下,17-p407-rtpa比非纳米配制的rtpa更有效。有趣的是,对于rtpa 1mg/ml和17-p407-rtpa 0.10mg/g观察到的结果相似(平均差[95%ci]为-0.43%[-15.38;+14.53],ns,n=7)意味着与非纳米配制的rtpa相比,浓度低10倍的纳米配制rtpa可以实现类似的凝块溶解。所有rtpa组(非配制的和纳米配制)均与pbs显著不同,这意味着即使是较低浓度的17-p407-rtpa也是一种有效的溶栓剂(p《0.0001,n=7)。
[0182]
使用浓度范围为0.03mg/g、0.10mg/g、0.30mg/g、1.00mg/g的optpa(17-p407-optpa,也称为o2l-001)重复了这些实验,结果相似(图9b)。kolmogorov-smirnov检验证实了残差的正态性。所有纤溶酶原激活剂组(非配制的rtpa和纳米配制的optpa)与pbs显著不同,这意味着在这些组中具有有效的溶栓活性(p《0.0001,n=6)。dunnett’s比较检验表明,与之前的实验相比,假处理组和rtpa 1mg/ml组具有非常保守的效果(平均差[95%ci]为+57.5%[+45.3;+69.7],p《0.0001,n=6)。dunnett调整的进一步双边比较显示,rtpa 1.00mg/ml和17-p407-optpa 1.00mg/g这两组之间存在显著差异(平均差异[95%ci]为+21.0%[+8.8;+33.2],p《0.001,n=6)。rtpa 1.00mg/ml和17-p407-optpa 0.30mg/g之间也有显著差异(平均差异[95%ci]为+13.2%[+0.9;+25.4%],p《0.05,n=6)。同样,对于rtpa 1.00mg/ml和17-optpa 0.1mg/g观察到的结果相似(平均差[95%ci]为+4.5%[-7.7;+
16.7],ns,n=6)意味着浓度低10倍的纳米配制optpa可以实现与非纳米配制rtpa相似的凝块溶解。
[0183]
释放研究
[0184]
纳米配制的optpa(o2l-001)是一种创新的溶栓技术,它允许安全溶栓剂optpa的持续存在,以增加溶栓活性,实现更好的收益/风险平衡。在血肿中,目标是让溶栓剂在24小时内释放,以促进液化但避免因铁释放引起的毒性,并加速减少占位效应。研究了释放时间以确认该释放时间范围。
[0185]
进行了6次重复溶解过程的实验。尽管溶出分析前的凝胶化时间没有明确确定,但有趣的是,感兴趣的蛋白质的释放有两个步骤,前30分钟有一个强烈的释放时间(释放开始加载剂量的50%)并在接下来的4-6小时内缓慢释放(释放开始加载剂量的10%)(图10)。
[0186]
这些初步结果需要通过额外的实验来确认,用几个加载体积来分析初始体积的影响。然而,在这个阶段,在这个实验中观察到的动力学强烈表明,在第二阶段观察到的缓慢释放可以解释o2l-001与rtpa相比的独特效果(作为optpa单独释放,在初始爆发中),并且如先前实验中观察到的,只需要低浓度的o2l-001即可触发5ml凝块的溶栓。
[0187]
纤溶酶原激活剂纳米沉淀的高产率制造
[0188]
由于温度变化和粘度模量(g”)与弹性模量(g')相交会形成胶束,因此在泊洛沙姆热敏凝胶中掺入蛋白酶受到限制,从而导致水凝胶的形成。被困在胶束中的蛋白酶不能很好地释放并失去活性。为克服这一限制而选择的解决方案是在封装在泊洛沙姆中之前沉淀纤溶酶原激活剂的纳米颗粒,以促进蛋白酶的释放和水凝胶的溶解。
[0189]
如上所述进行纳米沉淀以允许形成纤溶酶原激活剂的可逆纳米沉淀。允许高产纳米沉淀的变量是浓度、目的蛋白质的缓冲液、蛋白质沉淀溶剂的性质、目的蛋白质的体积与蛋白质沉淀溶剂的体积之间的比率以及添加的聚山梨醇酯20(ps20)或氯化钠。
[0190]
发明人分析了多达30个rtpa纳米沉淀条件,并选择了4个条件,在hplc分析后纳米沉淀产率优于90%(表1)。
[0191][0192]
表1:使用rtpa测试纳米沉淀条件。在分析获得的纳米沉淀之前,测试了三种蛋白质沉淀溶剂、两种浓度的泊洛沙姆188和添加的添加剂(nacl和聚山梨醇酯20、ps20)。
[0193]
分析纳米沉淀的纤溶酶原激活剂在重悬后对模拟纤溶酶原的显色底物(spectrofluor 444)的酶活性(图11)。将纳米沉淀重悬在含有150mm nacl和10mm po4,ph=7.4的溶液中,并在冰上保持30分钟以允许完全重悬。kruskal-wallis试验证实,rtpa对所用蛋白质沉淀溶剂(四甘醇,tg或己二醇,hg)的性质敏感(p《0.01)。添加ps20,特别增加了纳米沉淀的酶活性(平均秩差-10.5,p《0.05,n=4,dunn's多重比较检验),而沉淀产率相似(对于hg4与hg4ps条件,结果为90.0%,+/-13.1与92.0%+/-4.7,n=3)。试验的其他条件没有统计学差异(图11a)。
[0194]
在酶活性方面研究了在四甘醇和20mg/ml p188中纳米沉淀的一系列rtpa溶液,然后测量这些纳米沉淀的纤维蛋白溶解活性以确认纳米沉淀步骤的溶栓潜力的守恒(图11b-d)。四个样品在spectrozyme444rtpa底物(n=5)上进行酶活性评估。四个样品之间没有统计学差异(kruskal-wallis检验,p=0.97),四个样品中的平均酶活性为108%+/-28;107%+/-24;108%+/-24;115%+/-30,这意味着该过程的高可重复性(图11b)。
[0195]
作为非纳米沉淀rtpa,纳米沉淀rtpa在96孔板中的凝块溶解试验模型中不损害凝血,达到拐点的时间(405nm处最大浊度的50%)介于29.1分钟和34.5分钟之间(n=5,批次或浓度的非显著影响,双因素方差分析,图11c)。在纤溶活性方面(图11d),纳米沉淀降低了
低浓度rtpa的纤溶活性(0.4μg/ml时p《0.0001,0.8μg/ml时p《0.001),在最高测试浓度时,无统计学差异(1.6μg/ml)。事实上,在最高测试浓度1.6μg/ml下,达到50%凝块溶解的时间差异被抹去(+19.0分钟+/-4.4,从凝块的形成,在四个样品中为:33.2分+/-4.6;32.1分+/-7.9;30.2分+/-6.6;26.2分+/-8.7(n=5))。有趣的是,在所有条件下都观察到完全溶解。
[0196]
还用tnkase和optpa测试了用rtpa表征的纳米沉淀条件(图12)。无论p188添加剂的浓度如何,替奈普酶(tnkase,第二代rtpa)在四甘醇中的回收率都很低(20mg/ml p188回收率为12%,4mg/ml p188回收率为14%,n=2),使用hg回收率更高(20mg/ml p188回收率为74%,4mg/ml p188回收率为48%,n=2)(图12a)。即使在己二醇加20mg/ml p188(152%+/-34)中纳米沉淀后记录到更高的酶活性,optpa,作为rtpa,在己二醇和四甘醇中有效地纳米沉淀也与p188的浓度无关。在四甘醇中,纳米沉淀产生清晰可见的颗粒,在4mg/ml和20mg/ml p188存在下分别具有113%+/-30和135.5%+/-20的酶活性(n=5)(图12b)。测试组之间没有观察到统计学差异(kruskal-wallis检验,p=0,119)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1