用于检测体液中的多种生物标志物/靶标的薄的柔性可穿戴免疫传感器
1.本发明涉及一种层状敷料,其包括配置为检测伤口流体中的一种或更多种标志物的生物传感器传感阵列。
背景技术:
2.慢性伤口是使人衰弱的病症,其可对受折磨的患者造成严重的痛苦。在全球范围内,由于日益老龄化的人口,他们对医疗保健系统造成越来越大的社会和财政负担。例如,静脉溃疡需要长期治疗来愈合,在70岁以上的人中患病率高达15%,复发率在54%至78%之间变化。慢性伤口是由于多种环境和生理因素而不能经历自然愈合过程引起的。这些因素反映在伤口渗出物流体的组成中,伤口渗出物流体在伤口愈合的进展期间表现出细胞因子、生长因子和微生物的动态混合物。
3.伤口的临床评估目前依赖于面积测定法(planimetry)来定性地评分特征,如腐肉减少、肉芽组织(granulation tissue)形成和再上皮化。目前,生化参数的定量分析通常限于下游实验室测试,如酶联免疫吸附测定(elisa)。能够原位监测伤口生物标志物的非侵入性即时的(point-of-care)伤口护理设备将能够为更有效的诊断和治疗提供及时分析。当前设计用于伤口护理的柔性传感器能够监测有限的一组参数,如ph、温度、氧气、湿度、尿酸、阻抗和压力。然而,其他标志物也具有重要的临床价值,如炎性介质和生物负载(bioburden)的指标。例如,细胞因子和生长因子是溃疡形成期间炎症的公认指标。伤口的微生物组成也是慢性伤口的关键特征,并且涉及通过持续炎症、蛋白水解和内皮功能障碍抑制愈合。基于这些指标,需要一种伤口传感器,其能够检测这些另外的生物标志物,以允许改进伤口愈合状态的分类。
技术实现要素:
4.与仅通过目视检查或单标志物测量相比,能够克服与上述现有传感器相关联的问题的伤口传感器将能够更好地指导临床伤口管理。此外,结合到敷料中的伤口传感器将提供伤口和伤口愈合过程的持续原位监测(例如监测伤口微环境、炎症和感染状态)。
5.发明人惊奇地发现,可以如本文所述提供能够检测多种相关生物标志物的伤口传感器。因此,本发明提供了优于传统单标志物传感器的许多优点,包括能够同时检测各种相关生物标志物并且可以使用基于适体的传感器调整到新的生物标志物的生物传感器传感阵列,通过使用毛细管作用将伤口流体向生物传感器传感阵列有效且高效地递送,以及无线连接到控制器的能力。
6.因此,本发明提供以下内容。
7.1.一种层状敷料,其包括:
8.渗透性伤口接触层,其用于与伤口接触放置;
9.透气性屏障层;
10.流体收集层,所述流体收集层设置在所述伤口接触层和所述透气性屏障层之间,所述流体收集层包括生物传感器壳体部分和流体收集部分,所述流体收集部分包括多个通道,所述通道各自在所述生物传感器壳体部分处具有末端(terminus);以及
11.生物传感器传感阵列,其包括一个或更多个电极,所述生物传感器传感阵列设置在所述流体收集层的所述生物传感器壳体部分和所述透气性屏障层之间,
12.其中:
13.所述流体收集层的所述流体收集部分中的所述通道配置为使得在使用时,所述通道通过毛细管作用将伤口流体从与所述伤口接触层接触的伤口递送到所述生物传感器传感阵列,其中所述生物传感器传感阵列配置为检测所述伤口流体中的一种或更多种标志物。
14.2.根据项目1所述的层状敷料,其中所述伤口接触层包括多个穿孔。
15.3.根据项目1或2所述的层状敷料,其中所述流体收集层的所述流体收集部分具有环形形状,所述环形形状具有外表面,其中环形形状限定中心部分,其中所述流体收集层的所述生物传感器壳体部分位于所述中心部分处。
16.4.根据项目3所述的层状敷料,其中所述流体收集部分具有外表面,其中所述多个通道各自从所述流体收集部分的所述外表面延伸到所述生物传感器壳体部分。
17.5.根据项目1至4中任一项所述的层状敷料,其中所述多个通道配置为使得来自伤口的流体沿着所述通道仅在单方向上流动。
18.6.根据项目5所述的层状敷料,其中所述多个通道各自包括多个互连的半开口锯齿形毛细管通道。
19.7.根据项目1至6中任一项所述的层状敷料,其中所述多个通道在其整个长度上不具有均匀的宽度。
20.8.根据项目7所述的层状敷料,其中所述通道包括第一部分和第二部分,所述第一部分配置为从与所述伤口接触层接触的伤口抽吸流体,所述第二部分与所述第一部分相比靠近所述生物传感器传感阵列,其中所述通道在所述第一部分处的宽度大于所述通道在所述第二部分处的宽度。
21.9.根据项目8所述的层状敷料,其中所述通道包括第一端(end)和第二端,其中所述通道在所述第一端处的宽度为约180μm至约220μm,所述通道在所述第二端处的宽度为约140μm至约180μm。
22.10.根据前述项目中任一项所述的层状敷料,其中所述生物传感器传感阵列包括一个或更多个电极,每个电极配置为检测选自由愈合生物标志物和生物负载生物标志物组成的组的标志物。
23.11.根据项目10所述的层状敷料,其中所述愈合生物标志物选自由tnf-α、il-6、il-8、tgf-β1和ph组成的组。
24.12.根据项目10所述的层状敷料,其中所述生物负载生物标志物包括金黄色葡萄球菌(s.aureus)的生物标志物。
25.13.根据项目10至12中任一项所述的层状敷料,其中所述生物传感器传感阵列包括两个或更多个电极,每个电极配置为检测选自由tnf-α、il-6、il-8、tgf-β1、ph和金黄色葡萄球菌的生物标志物组成的组的标志物。
26.14.根据项目13所述的层状敷料,其中所述生物传感器传感阵列包括六个电极,每个电极配置为检测选自由tnf-α、il-6、il-8、tgf-β1、ph和金黄色葡萄球菌的生物标志物组成的组的标志物,使得所述生物传感器传感阵列能够同时检测tnf-α、il-6、il-8、tgf-β1、ph和金黄色葡萄球菌的生物标志物。
27.15.根据项目12至14中任一项所述的层状敷料,其中所述金黄色葡萄球菌的生物标志物是表位。
28.16.根据前述项目中任一项所述的层状敷料,其中所述生物传感器传感阵列包括一个或更多个基于适体的工作电极,每个所述基于适体的工作电极包括与电极键合的适体,其中所述适体适于检测所述伤口流体中的标志物。
29.17.根据项目16的层状敷料,其中所述一个或更多个基于适体的工作电极包括il-8、il-6、tnf-α、tgf-β1和/或金黄色葡萄球菌的适体。
30.18.根据项目17所述的层状敷料,其中应用以下任一项:
31.(a)il-8的适体包括序列
[0032]5’‑
/5thiomc6-d/rgrgrgrgrgrcrururarurcrarururcrcrarurururargr urgrururarurgrarurararcrc/3mebln/-3’;和/或
[0033]
(b)il-6的适体包括序列
[0034]5’‑
/5thiomc6-d/ggtggcaggaggactatttatttgcttttct/3mebl n/-3’;和/或
[0035]
(c)tnf-α的适体包括序列
[0036]5’‑
/5mebln/rg*rg*ra*rg*ru*ra*ru*rc*ru*rg*ra*ru*rg*ra*rc*ra*r a*ru*ru*rc*rg*rg*ra*rg*rc*ru*rc*rc/3thiomc3-d/-3’;和/或
[0037]
(d)tgf-β1的适体包括序列
[0038]5’‑
/5mebln/cg*ctcgg*cttc*acg*ag*att*cgtgt*cgttgtgt*c*ctgt*a*c*c*cg*c*cttg*a*c*c*agt*c*act*ct*ag*agc*at*c*cgg*a*ctg/ispc3//3thiomc3-d/-3’;和/或
[0039]
(e)金黄色葡萄球菌的适体包括序列
[0040]5’‑
/5thiomc6-d/tcggcacgttctcagtagcgctcgctggtcatccc acagctacgtc/3mebln/-3’。
[0041]
19.根据项目18所述的层状敷料,其中:
[0042]
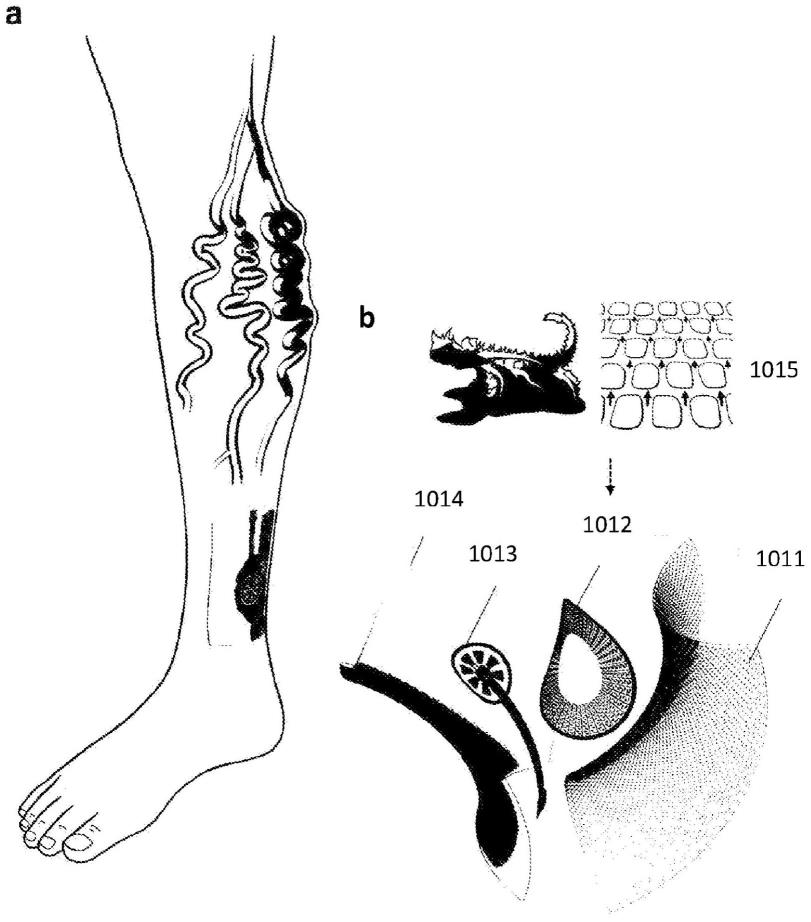
(a)il-8的适体包括序列
[0043]5’‑
/5thiomc6-d/rgrgrgrgrgrcrururarurcrarururcrcrarurururargr urgrururarurgrarurararcrc/3mebln/-3’;和/或
[0044]
(b)il-6的适体包括序列
[0045]5’‑
/5thiomc6-d/ggtggcaggaggactatttatttgcttttct/3mebl n/-3’。
[0046]
20.根据利要求16至20中任一项的层状敷料,其中所述适体包括第一端区域(the first end region)和第二端区域,其中所述适体经由所述第一端区域与所述电极键合。
[0047]
21.根据项目20所述的层状敷料,其中所述一个或更多个基于适体的工作电极的表面包括电化学剥离的石墨烯-金纳米颗粒(aunps-gp)纳米复合材料层。
[0048]
22.根据项目21所述的层状敷料,其中所述适体通过金-硫醇键与所述电极的表面键合。
[0049]
23.根据项目16至22中任一项所述的层状敷料,其中所述适体与氧化还原标记物
(redox label)缀合,任选地,其中所述氧化还原标记物是亚甲基蓝。
[0050]
24.根据项目23所述的层状敷料,其中所述适体包括第一端区域和第二端区域,其中所述适体经由所述第一端区域与所述生物传感器键合,所述适体经由所述第二端区域与所述氧化还原标记物缀合。
[0051]
25.根据前述项目中任一项所述的层状敷料,其中所述生物传感器传感阵列包括聚苯胺ph传感器。
[0052]
26.根据前述项目中任一项所述的层状敷料,其中所述生物传感器传感阵列包括温度传感器,任选地,其中所述温度传感器包括惠斯通电桥。
[0053]
27.根据前述项目中任一项所述的层状敷料,其中所述生物传感器传感阵列能够将测量数据无线传输到配对设备。
附图说明
[0054]
图1a显示了应用到静脉溃疡患者的开放性伤口上用于原位伤口监测的生物标志物分析敷料的图示。
[0055]
图1b显示了层状敷料,其包括渗透性伤口接触层1011、流体收集层1012、生物传感器传感阵列1013和透气性屏障层1014。流体收集层的灵感来自德克萨斯角蜥蜴的皮肤1015的启发,能够实现抵抗重力朝向蜥蜴鼻部的预定流动方向。
[0056]
图1c显示了被配置用于检测tnf-α、il-6、il-8、tgf-β1、金黄色葡萄球菌、ph和温度的生物传感器传感阵列的示意图。
[0057]
图1d显示了原型的硬件框图。
[0058]
图2a显示了由互连的半开口锯齿形毛细管通道2001的极轴阵列形成的仿生被动微流体收集器,所述通道具有从200μm降低到160μm的宽度,在生物传感器传感阵列2002的基电极的顶部上制造。2003显示了流体输送的方向。
[0059]
图2b显示了利用相邻锯齿形毛细管通道的互连的定向流体输送系统的机构。
[0060]
图2c-d一起显示了互连的毛细管通道中的流体输送的comsol模拟,具有分别在正向和反向方向上随时间降低的宽度(黑色,流体;白色,空气)。
[0061]
图2e显示了在不同时间点的仿生原型的流体输送过程的动力学(比例尺,500μm)。
[0062]
图2f显示了在具有一致长度和降低宽度的毛细管通道中流体输送的经过时间。
[0063]
图3a显示了静脉溃疡的微环境的图示。
[0064]
图3b显示了分别用于细胞因子和细菌检测的基于适体的生物传感器的传感机制的示意图。
[0065]
图3c显示了温度传感器的电阻相对于温度的校准。
[0066]
图3d-3h分别显示了tnf-α、tgf-β1、il-6、il-8和金黄色葡萄球菌传感器的相对峰高减少相对于血清中相应靶标的浓度的变化。误差条表示在相同条件下由三次扫描得到的平均值的标准偏差。插图显示了当分别用不同分析物浓度挑战时tnf-α、tgf-β1、il-6、il-8和金黄色葡萄球菌传感器的swv扫描。
[0067]
图3i显示了ph传感器的ocp相对于血清中的ph值的校准。误差条表示在相同条件下在20s跨度内的平均值的标准偏差。插图显示了ph传感器对于不同ph值的实时ocp。
[0068]
图4a显示了伤口监测研究的设计。
[0069]
图4b显示了具有安装在皮肤伤口上的免疫传感器的自由移动小鼠的照片。
[0070]
图4c显示切除伤口的照片。免疫传感器与右伤口直接接触,而左伤口作为对照。
[0071]
图4d显示了通过免疫传感器原位评估ph、温度、小鼠tnf-α和金黄色葡萄球菌。误差条显示标准偏差。
[0072]
图4e-f显示了伤口的图像(比例尺,5mm)和从第0天至第5天伤口面积的变化。f中的误差条显示标准偏差。
[0073]
图4g显示了第1天、第3天和第5天的伤口面积的比较(传感器接触的累积总计2、3和4小时)。误差条显示标准误差。
[0074]
图4h-i分别显示了第3天的全部的全层伤口(full-thickness wounds)和第1、3和5天的伤口边缘的h&e图像(20
×
缝线)(比例尺,1000、250μm)。虚线显示再上皮化。
[0075]
图4j-k分别显示了表皮厚度和再上皮化距离的比较。误差条显示标准误差。
[0076]
图4l-n分别显示了第5天的全部的伤口、第1、3和5天的伤口边缘处的真皮和第5天的肉芽组织区域的h&e图像(比例尺,1000、250、250μm)。图像是所有小鼠的典型代表。统计比较使用wilcoxon符号秩检验(ns=非显著性结果)。
[0077]
图5aa和5ab显示了通过免疫传感器对每个患者的ph、金黄色葡萄球菌、il-6、il-8、tnf-α、tgf-β1的每周评估。轴代表每个量化参数的独立标度,从最低水平的0%变化到最高水平的100%。显示伤口尺寸的每周变化以及生物标志物评估。
[0078]
图5b显示了通过免疫传感器评估的参数(ph、金黄色葡萄球菌、il-6、il-8、tnf-α、tgf-β1)和五周时间内的伤口尺寸的患者特异性相关矩阵。表中显示了每个患者的伤口总数和持续时间(以月计)。左上、左下和右下是男性,中上和右上是女性。比例尺代表皮尔逊相关系数(r
p
)。
[0079]
图6显示了在具有(a,b)200μm和(c,d)160μm的固定宽度的互连的毛细管通道中在分别朝向时间的正向和反向方向上的流体输送的comsol模拟(黑色,流体;白色,空气)。
[0080]
图7显示了aunps-gp纳米复合材料的表征。(a)aunps-gp分散体(左)及其滴铸膜(右)。(b)滴铸的aunps-gp膜的fesem图像(上部:比例尺,2μm;下部:比例尺200nm)。石墨烯和aunps-gp纳米复合材料的拉曼光谱。
[0081]
图8a-8d显示了aunps-gp/au在不同扫描速率下的cv扫描。(b)阳极和阴极峰电流相对于扫描速率的平方根的变化。(c)裸au、aunps-gp/au、apt/aunps-gp/au、mch/apt/aunps-gp/au和tnf-α/mch/apt/aunps-gp/au的eis评估。(d)裸au、aunps-gp/au、apt/aunps-gp/au、mch/apt/aunps-gp/au和tnf-α/mch/apt/aunps-gp/au的cv分析。
[0082]
图9a-9h显示了适体传感器的优化和再现性研究。(a)适体密度为10μm和1μm的tnf-α传感器的swv扫描的比较。(b)适体密度对tnf-α传感器的信噪比的影响。(c-g)孵育持续时间分别对tnf-α、tgf-β1、il-8、il-6和金黄色葡萄球菌传感器的适体靶标结合平衡的影响。(h)两种单独的tnf-α传感器的再现性研究。误差条表示在相同条件下从三次扫描得到的平均值的标准偏差。
[0083]
图10显示了(a)tnf-α,(b)tgf-β1,(c)il-8,和(d)il-6传感器的选择性研究。误差条表示在相同条件下从三次扫描得到的平均值的标准偏差。
[0084]
图11a-f显示了ph传感器的表征、可重复性和再现性研究。(a)随着ph值在三个循环中在酸性和碱性之间交替,血清中的实时ocp变化。(b)血清中四个单独的ph传感器的再
现性研究。(c)针对不同ph值的实时ocp。(c)的插图显示了血浆中ocp相对于ph值的校准。误差条表示在相同条件下在20s跨度内的平均值的标准偏差。(d)随着ph值在三个循环中在酸和碱之间交替,血浆中的实时ocp变化。(e)血浆中四种单独ph传感器的再现性研究。(f)血清和血浆中校准的比较。
[0085]
图12a-c显示了生物传感器调整尺寸的能力。(a)不同尺寸下免疫传感器所需的最小体积。(b)分别具有较大传感区域(16mm的直径)和较小传感区域(8mm的直径)的免疫传感器的光学图像。(c)8mm和16mm传感器的信噪比的比较。
[0086]
图13a和13b显示来自常规测定的ph、金黄色葡萄球菌、il-6、il-8、tnf-α和tgf-β1水平的每周变化。
[0087]
图14显示了小鼠tnf-α传感器的表征。随着小鼠tnf-α浓度的增加,该传感器显示峰电流高度减少(a部分)。在b部分中显示相对于没有小鼠tnf-α的峰高归一化的峰高的相对降低。
[0088]
图15a-15e分别显示了连续五周内患者1-5的伤口渗出物样本中用于金黄色葡萄球菌细胞密度估计的快速葡萄球菌(rapid'staph)琼脂平板的光学图像。
[0089]
图16a-16f显示了基于适体的传感器在四周时间内的稳定性。
[0090]
图17a-17f显示了基于适体的传感器对于不同分析物浓度的性能。
具体实施方式
[0091]
本发明提供了一种层状敷料,其包括:
[0092]
渗透性伤口接触层,其用于与伤口接触放置;
[0093]
透气性屏障层;
[0094]
流体收集层,所述流体收集层设置在所述伤口接触层和所述透气性屏障层之间,所述流体收集层包括生物传感器壳体部分和流体收集部分,所述流体收集部分包括多个通道,所述通道各自在所述生物传感器壳体部分处具有末端;以及
[0095]
生物传感器传感阵列,其包括一个或更多个电极,所述生物传感器传感阵列设置在所述流体收集层的所述生物传感器壳体部分和所述透气性屏障层之间,
[0096]
其中:
[0097]
所述流体收集层的所述流体收集部分中的所述通道配置为使得在使用时,所述通道通过毛细管作用将伤口流体从与所述伤口接触层接触的伤口递送到所述生物传感器传感阵列,并且其中所述生物传感器传感阵列配置为检测所述伤口流体中的一种或更多种标志物。
[0098]
在本文的实施方案中,词语“包括”可以被解释为需要所提及的特征,但不限制其他特征的存在。或者,词语“包括”还可以涉及仅旨在存在所列出的部件/特征的情况(例如,词语“包括”可以由短语“由...组成”或“基本上由...组成”代替)。明确地预期,更广泛和更窄的解释都可以应用于本发明的所有方面和实施方案。换句话说,词语“包括”及其同义词可以被短语“由...组成”或短语“基本上由...组成”或其同义词替换,反之亦然。
[0099]
在本文的实施方案中,可以单数或复数描述各种特征。在本文中明确地预期,对单数的引用应被理解为包括复数,并且对复数的引用应被理解为包括单数,除非这种解释在技术上是不合逻辑的。
[0100]
渗透性伤口接触层用于保护层状敷料的其余部分免于与伤口床(wound bed)直接接触,并使颗粒化组织(granulating tissue)的破坏最小化。伤口接触层是渗透性的,使得其允许伤口呼吸,并且还允许水分逸出。此外,渗透性伤口接触层允许伤口流体从伤口传递到流体收集层。在本发明的一些实施方案中,渗透性可以由多个穿孔提供,即伤口接触层可以包括多个穿孔。用于伤口接触层的合适材料是本领域技术人员已知的,并且包括聚合物,如聚氨酯和pdms(例如聚氨酯,如多孔聚氨酯)。
[0101]
透气性屏障层通常是层状敷料的最外层,并且保护层状敷料免受外部环境的影响,同时还允许皮肤呼吸和水分逸出。在一些实施方案中,透气性屏障层可以是防水透气性屏障层,其为层状敷料和伤口提供保护。透气性屏障层可以由任何合适的材料制成,例如聚合物,如聚氨酯和pdms(例如聚氨酯)。
[0102]
流体收集层执行收集伤口流体并将其引导到生物传感器传感阵列的功能。换句话说,流体收集层用于将穿过渗透性伤口接触层的流体朝向生物传感器传感阵列引导。由于重力,伤口流体可能不会被固有地朝向生物传感器引导,这可以使用毛细管作用来克服。因此,流体收集层包括生物传感器壳体部分和包括多个通道的流体收集部分,所述通道各自在生物传感器壳体部分处具有末端。流体收集层的流体收集部分内的通道配置为使得在使用时,通道通过毛细管作用将伤口流体从与伤口接触层接触的伤口递送到生物传感器传感阵列。
[0103]
流体收集层可以具有允许流体通过毛细管作用从伤口输送到生物传感器传感阵列(即,从流体收集部分输送到生物传感器壳体部分)的任何形状/布局。在一些实施方案中,流体收集层的流体收集部分可以具有环形形状,该环形形状具有外表面,其中环形形状限定中心部分,并且其中流体收集层的生物传感器壳体部分位于中心部分处。以这种方式,大量的伤口流体可以被有利地朝向生物传感器壳体部分引导,这是因为伤口流体可以从围绕生物传感器壳体部分的360
°
收集。在该实施方案的一些方面,流体收集部分可以具有外表面,其中多个通道各自从所述流体收集部分的所述外表面延伸到生物传感器壳体部分。
[0104]
流体收集层可以由任何合适的材料并通过任何适当的方法制成。例如,流体收集层可以通过精密加工过程或增材制造方法制成。用于流体收集层的合适材料包括环氧基材料,诸如su-8 2150。
[0105]
在一些实施方案中,多个通道配置为使得来自伤口的流体沿着通道仅在单方向上流动。这有助于流体朝向生物传感器壳体部分的流动,有利地增加了对生物传感器传感阵列的流体供应。在该实施方案的一些方面,当多个通道各自包括多个互连的半开口锯齿形毛细管通道时,可以实现该单方向流体流动。通道的宽度也可以沿其长度变化,因为毛细管作用导致流体从较宽的宽度到较小的宽度的通过,但通常不以相反的方向。因此,该实施方案的一些方面,通道可以包括第一部分和第二部分,第一部分配置为从与伤口接触层接触的伤口抽吸流体,第二部分与第一部分相比靠近生物传感器传感阵列,其中通道在第一部分处的宽度大于通道在第二部分处的宽度。例如,通道可包括第一端和第二端,并且其中通道在第一端处的宽度为约180μm至约220μm,并且通道在第二端处的宽度为约140μm至约180μm。
[0106]
在一些实施方案中,渗透性伤口接触层、透气性屏障层和流体收集层可以全部是透明的(或至少基本上透明的)。这允许在不移除层状敷料的情况下容易地观察愈合的伤
口。
[0107]
生物传感器传感阵列包括一个或更多个电极,并且设置在流体收集层的生物传感器壳体部分和透气性屏障层之间。因此,生物传感器传感阵列定位成使得流向流体收集层的生物传感器壳体部分的流体接触生物传感器传感阵列,从而允许检测流体中的生物标志物。生物传感器传感阵列配置为检测所述伤口流体中的一种或更多种标志物。在一些实施方案中,生物传感器传感阵列包括一个或更多个电极,每个电极配置为检测选自由愈合生物标志物和生物负载生物标志物组成的组的标志物。例如,愈合生物标志物可以选自由tnf-α、il-6、il-8、tgf-β1和ph组成的组。生物负载生物标志物的实例是金黄色葡萄球菌(s.aureus)的生物标志物,但技术人员将理解,可能需要检测其他致病性生物负载。
[0108]
在一些实施方案中,生物传感器传感阵列可以包括两个或更多个电极,其中每个电极配置为检测相关的生物标志物。例如,生物传感器传感阵列可以包括两个或更多个电极,其中每个电极配置为检测选自由tnf-α、il-6、il-8、tgf-β1、ph和金黄色葡萄球菌的生物标志物组成的组的标志物。在一些实施方案中,生物传感器传感阵列可以包括六个电极,每个电极配置为检测选自由tnf-α、il-6、il-8、tgf-β1、ph和金黄色葡萄球菌的生物标志物组成的组的标志物。以这种方式,生物传感器传感阵列可以能够同时检测tnf-α、il-6、il-8、tgf-β1、ph和金黄色葡萄球菌的生物标志物。
[0109]
可以通过表位的检测来检测病原体,如细菌(例如金黄色葡萄球菌)。
[0110]
在一些实施方案中,生物传感器传感阵列可包括一个或更多个基于适体的工作电极。如本文所用,基于适体的工作电极是指与适体缀合或以其他方式键合的电极。基于适体的工作电极可包括用于期望检测的生物标志物如il-8、il-6、tnf-α、tgf-β1和/或金黄色葡萄球菌的适体。
[0111]
在一些实施方案中,基于适体的工作电极中的适体可以在其5'或3'末端或在适体中的另一位点处键合到电极的表面。在本发明的一些实施方案中,基于适体的工作电极可以在其5'或3'末端,例如在其5'末端,与电极的表面键合。更一般地,适体可以包括第一端区域和第二端区域,其中适体经由第一端区域与电极键合。
[0112]
基于适体的工作电极可以包括氧化还原标记物,如在与电极键合的末端相对的末端处的氧化还原标记物。例如,适体可以经由第一端区域与电极键合,并经由第二端区域与氧化还原标记物缀合。因此,当适体在其5'末端与电极表面键合时,适体可以在3'末端包括氧化还原标记物。这可能是有利的,因为如图3b所示,在不存在适体结合的生物标志物的情况下,氧化还原标记物可以接近电极的表面,允许电子转移。然后可以电化学地检测法拉第电流(faradaic current)。在适体与生物标志物结合后,适体的发夹结构可以经历构象变化,在此期间氧化还原标记物远离电极移动,导致氧化还原电流降低。因此,基于适体的传感器不需要另外的试剂来在单个步骤中完成电化学测量,这使得它们适合于原位分析并且独立于下游分析。本文可以提及的合适的氧化还原标记物的具体实例是亚甲基蓝。
[0113]
如本领域技术人员将理解的,基于适体的传感器可以应用于检测几乎任何相关的生物标志物。下文提供了可用于本发明的适体序列的具体实例,但是技术人员将理解,在本发明内可以使用其他适体序列。
[0114]
il-8的合适适体包括序列
[0115]5’‑
/5thiomc6-d/rgrgrgrgrgrcrururarurcrarururcrcrarurururargrurgrurur
arurgrarurararcrc/3mebln/-3’。
[0116]
il-6的合适适体包括序列
[0117]5’‑
/5thiomc6-d/ggtggcaggaggactatttatttgcttttct/3mebln/-3’。
[0118]
tnf-α的合适适体包括序列
[0119]5’‑
/5mebln/rg*rg*ra*rg*ru*ra*ru*rc*ru*rg*ra*ru*rg*ra*rc*ra*ra*ru*ru*rc*rg*rg*ra*rg*rc*ru*rc*rc/3thiomc3-d/-3’。
[0120]
tgf-β1的合适适体包括序列
[0121]5’‑
/5mebln/cg*ctcgg*cttc*acg*ag*att*cgtgt*cgttgtgt*c*ctgt*a*c*c*cg*c*cttg*a*c*c*agt*c*act*ct*ag*agc*at*c*cgg*a*ctg/ispc3//3thiomc3-d/-3’。
[0122]
金黄色葡萄球菌的合适适体包括序列
[0123]5’‑
/5thiomc6-d/tcggcacgttctcagtagcgctcgctggtcatcccacagctacgtc/3mebln/-3’。
[0124]
在本发明的一些实施方案中:
[0125]
(a)il-8的适体包括序列
[0126]5’‑
/5thiomc6-d/rgrgrgrgrgrcrururarurcrarururcrcrarurururargrurgrururarurgrarurararcrc/3mebln/-3’;和/或
[0127]
(b)il-6的适体包括序列
[0128]5’‑
/5thiomc6-d/ggtggcaggaggactatttatttgcttttct/3mebln/-3’。
[0129]
生物传感器传感阵列可以包括ph传感器,例如聚苯胺ph传感器。生物传感器传感阵列可以包括温度传感器,例如包括惠斯通电桥(wheatstone bridge)的温度传感器。
[0130]
在生物传感器传感阵列包括一个或更多个电极(例如两个或更多个电极,其可以是例如基于适体的电极传感器)的本发明的实施方案中,电极可以包括电化学剥离的石墨烯层。在另外的这样的实施方案中,电极的表面可以包括电化学剥离的石墨烯-金纳米颗粒层,使得电极用电化学剥离的石墨烯-金纳米颗粒(aunps-gp)纳米复合材料的薄层修饰。在这种情况下,并且当电极是基于适体的电极传感器时,适体可以通过金-硫醇键与电极的表面键合。不受理论束缚,电化学剥离的石墨烯(其在本文中也可称为“石墨烯”)具有优异的性质,如高结晶度、高电导率和低氧化度。此外,认为金的存在提供高电流密度、增强的电子迁移率和快速质量传输。认为aunps和石墨烯的组合有助于基于适体的生物传感器的增强的信号标度、高灵敏度和良好的稳定性。
[0131]
如本文所解释的,生物传感器传感阵列能够将测量数据无线传输到配对设备。这可以有利地为临床医生提供对伤口微环境的实时更新的容易访问。
[0132]
本发明的层状敷料可以以生物分析敷料的形式与伤口(如静脉溃疡)直接连接,所述生物分析敷料包括用于广泛的愈合生物标志物(包括炎性介质、细菌负荷(load)和物理化学参数)的传感器(图1c)。层状敷料能够测量高度临床相关的生物标志物,如肿瘤坏死因子-α(tnf-α)、白细胞介素-6(il-6)和白细胞介素-8(il-8),与愈合溃疡相比,它们在从未愈合溃疡获得的伤口流体中是升高的。为了评估慢性皮肤损伤中真皮愈合的状态,层状敷料还可以检测转化生长因子-β1(tgf-β1),其在调节真皮成纤维细胞表型和功能中起关键作用,并且已经在临床上观察到在静脉溃疡的渗出物中浓度升高。物理化学标志物可另外包括ph、温度和细菌负荷。伤口渗出物的ph是伤口愈合状态的重要生物化学指标:难以愈合
的伤口通常表现出碱性ph,范围为7.15至8.93。伤口温度提供关于炎症和感染的信息:具有升高的温度的伤口倾向于更缓慢地愈合。金黄色葡萄球菌(s.aureus)是所有类型的慢性伤口样本中的主要物种,可以是伤口的生物负载的有用生物标志物。
[0133]
下面参考附图在以下实施例中更详细地描述本发明,这些实施例不应被解释为限制性的。
[0134]
实施例
[0135]
材料
[0136]
氯化铁(iii)(fecl3)、n,n-二甲基甲酰胺(dmf)、四烷基铵(taa)、n-甲基-2-吡咯烷酮(nmp)、六氰合铁(iii)酸钾(k3fe(cn)6)、六氰合亚铁(ii)酸钾三水合物(k4fe(cn)6·
3h2o)、氯化钾(kcl)、三(2-羧乙基)膦盐酸盐(tcep)、6-巯基-1-己醇(mch)、盐酸(hcl)、苯胺、磷酸氢二钠(na2hpo4)、柠檬酸、ph 10.00的缓冲溶液人血清和人血浆购自sigma-aldrich。pet片(st506)购自melinex。块状石墨晶体(纯度99.9%)购自hq graphene。有机球形金纳米颗粒(直径20nm,分散在dmf中)购自nanopartz inc.。修饰的寡核苷酸和idte缓冲液(10mm tris,0.1mm edta)购自integrated dna technologies。重组人tnf-α、il-6、il-8、tgf-β1、il 1β、il-2、il-7、ifn-γ、重组小鼠tnf-α和牛血清白蛋白(bsa)购自r&d systems。不含钙和镁的磷酸盐缓冲盐水(pbs)(1
×
)购自lonza。金黄色葡萄球菌hg001由新加坡国立大学微生物学和免疫学系提供。ultrapure
tm
无dna酶/rna酶蒸馏水、bd difco
tm
lb肉汤、miller(luria-bertani)和oxoid胰蛋白胨大豆琼脂(tryptone soya agar,tsa)购自thermo fisher scientific。快速葡萄球菌琼脂和含钾的蛋黄购自bio-rad。
[0137]
实施例1:层状敷料的制备
[0138]
图1a显示了包含免疫传感器的生物标志物分析敷料,其应用于静脉溃疡患者的开放性伤口上用于原位伤口监测。敷料包括渗透性伤口接触层1011、流体收集层1012、生物传感器传感阵列1013(在本文中也描述为免疫传感器)和透气性屏障层1014(图1b)。渗透性伤口接触层包括多个穿孔,并且在本文中也称为穿孔的伤口接触层。穿孔的伤口接触层的功能是保护免疫传感器不与伤口床直接接触,使对颗粒化组织的破坏最小化。该屏障通过让氧气进入和水蒸气排出以允许正常的皮肤功能。敷料基底可以是透明的,这允许在应用期间方便地原位观察和评估伤口:渗出物的表面积和颜色。
[0139]
图1d示出了描述硬件设计的电路框图。便携式电化学分析仪被设计为管理信号转导和执行电化学测量。使用低功耗蓝牙(bluetooth low energy,ble)将测量数据无线传输到配对的移动设备。移动设备可以运行包括gui的附带应用程序,以帮助管理患者的资料和医疗记录,同时促进数据收集、分析和可视化(方法)。
[0140]
流体收集层的设计
[0141]
有效的伤口流体捕获和递送对于准确的原位生物标志物检测是必不可少的。为了确保有效的伤口流体收集,发明人结合了能够将伤口流体引导到传感区域的微流体层。基于德克萨斯角蜥蜴(phrynosoma cornutum)的皮肤设计流体收集层,其使得能够抵抗重力朝向蜥蜴的鼻部的预定定向流体流动(图1b)。德克萨斯角蜥蜴皮肤的定向流体运输性归因于在鳞片之间形成特殊毛细管系统的微结构网络。基于源自该毛细管网络的理论模型,流体收集层被设计成具有环形图案(图2a)。该图案由互连的半开口锯齿形毛细管通道的极轴
阵列(polar array)组成,所述通道具有从200μm降低到160μm的宽度(从外到内)。相邻锯齿形毛细管通道的互连促进在正向方向上(即,朝向传感区域)的连续流动,但抑制在反向方向上的流体输送。具体地,在如图2b所示的正向方向上,流体由于具有无限的弯月面半径(infinite meniscus radius)的突然变宽而停止在毛细管i处,同时连续地流动到毛细管ii,在毛细管ii处流体与停止在毛细管i处的流体合并,并正向流动到毛细管iv。类似地,合并的流体将与停止在毛细管iii处的流体聚结并继续流到随后的毛细管。另一方面,流体流动在反向方向上停止在加宽部分v和vi处(图2b)。因此,形成定向流体输送系统。
[0142]
为了证明这一工作原理,建立了定向流体输送系统模型(方法)。如图2c-2d所示,在正向和反向两个方向上进行具有降低的宽度的互连的毛细管通道中的流体输送的模拟。流体在正向方向上通过;它在反向方向上的起始点处完全停止。此外,还模拟了宽度为160μm和200μm的毛细管通道的流体输送性能。观察到在200μm的宽度下,流体不能在正向方向上流动(图6的a部分),而在160μm的宽度下观察到连续流动(图6的c部分)。另一方面,流体在两个毛细管通道宽度(图6的b和d部分)中都不能在反向方向上克服起始点。基于这些模拟结果,具有降低的宽度的毛细管通道可以确保朝向传感区域的有效且连续的定向流体输送。
[0143]
使用仿生原型获得的实验结果验证了模拟结果。具体地,将具有与人血清相似的接触角的肥皂水的液滴(2μl)施加到定向流体输送系统的中间部分。图2e示出了在不同时间的动态被动流体输送过程(方法)。通过连续地利用互连的毛细管通道,流体被输送到传感区域,而在反向方向上的移动被抑制。还观察到,降低的毛细管通道宽度需要毛细管通道中更短的流体输送时间(图2f)。正向方向上的平均流速为~0.43mm3/s。无论溃疡形状或尺寸如何,定向流体输送系统的设计提供在130s内额外的~180%伤口流体捕获并递送到传感器,确保可靠的传感性能。
[0144]
用于测试流体收集层的模拟实验如下进行。使用计算流体动力学(computational fluid dynamics,cfd)模块(comsol multiphysics 5.3a,两相流,水平设置界面)模拟定向流体输送系统。使用安装在倒置显微镜系统(ix71,olympus)上的高速相机(fastcam mini ax,photron)记录实验过程,设置为125fps、1024
×
1024分辨率。
[0145]
通过在透气性屏障层(其由医用级聚氨酯膜层形成,商品名为tegaderm
tm
)的顶部上旋涂su-8 2150层(~150μm)来制备流体收集层。然后通过光刻法对流体收集层进行图案化。伤口接触层由穿孔的医用级聚氨酯膜形成。各层的制备在下面的方法中更详细地描述。
[0146]
生物传感器传感阵列(免疫传感器)的设计与表征
[0147]
免疫传感器被设计成基于电化学系统测量采样伤口流体的多种生物物理化学参数。它包括花瓣形工作电极的极轴阵列,在中心共享一个ag/agcl参比电极,在外围共享一个au对电极(图1c,方法),形成了微体积分析理想的紧凑圆形布局。tnf-α、il-6、il-8和tgf-β1电极的传感元件基于适体-分析物亲和力,而金黄色葡萄球菌电极的结合亲和力在适体与细菌细胞壁表面的特异性表位之间。
[0148]
先前的生物传感器功能化方法依赖于专用于每种生物标志物的制造技术,其不允许直接集成多种传感模态。这一点使用微滴程序借助于微孔将每个工作电极用不同的传感元件官能化来克服。微孔的优化高度(20μm)能够实现独立的滴铸、适体固定和钝化,同时还保护固定的适体和捕获的靶标免受刮擦(方法)。
[0149]
为了优化微电极的性能,每个基于适体的电极用电化学剥离的石墨烯-金纳米颗粒(aunps-gp)纳米复合材料的薄层修饰(方法)。aunps-gp的形态由场发射扫描电子显微镜(field emission scanning electron microscope,fesem)图像表征(图7的b部分)。石墨烯和aunps-gp纳米复合材料的拉曼光谱显示在图7的c部分(方法)中。d带与g带峰强度比(id/ig)反映了石墨材料中的无序程度。aunps-gp的id/ig值(0.93)略大于石墨烯的id/ig值(0.91),表明aunps向纳米复合材料引入了另外的缺陷。
[0150]
如图8a所示,使用循环伏安法(cv)以不同的扫描速率进行aunps-gp修饰电极的定性分析。阳极与阴极峰电流比(ipa/ipc)在0.92-1.15的范围内,表明系统的准可逆性(quasi-reversibility)。理论上,峰电流与扫描速率的平方根成比例。图8b显示了阳极和阴极峰电流相对于扫描速率的平方根的变化,回归系数分别为0.9867和0.9903。良好的线性表明电极处的扩散控制过程。
[0151]
设计适体序列(方法),在其一末端用亚甲基蓝(一种氧化还原标记物)修饰,并且在另一末端用硫醇基团修饰以与aunps共价结合。如图3b所示,在不存在分析物的情况下,mb接近aunps-gp修饰的电极,允许电子转移。可以电化学地检测法拉第电流。在靶标结合时,适体的发夹结构经历构象变化,在此期间mb远离电极移动,导致氧化还原电流降低。由于传感机制,基于适体的传感器不需要另外的试剂来在单个步骤中完成电化学测量,这使得其适合于原位测定并且独立于下游分析。具有化学和热稳定性、高亲和力和选择性以及非免疫原性的优点,基于适体的传感器能够提供高度有利的生物相容性分子分析敷料。在适体固定后,电极表面可以用6-巯基-1-己醇(mch)钝化以抑制非特异性吸附。
[0152]
通过电化学阻抗谱(electrochemical impedance spectroscopy,eis)验证了工作电极上不同层的逐步组装(图8c,方法)。aunps-gp修饰的电极具有比裸金电极(5.29kω)更低的电荷转移电阻(rct)(3.17kω),表明在电极连接处增强的电子转移动力学,具有更高的电活性表面积。适体和mch的固定导致rct分别增加至14.4kω和17kω。电子迁移率受到固定物质的阻碍。分析物的存在进一步阻断了由18kω的rct升高所指示的电子转移。图8d报告了不同步骤的cv分析,其中氧化还原峰电流是电导率的指标。结果与来自eis的结果一致,证实电极制备是成功的和功能性的。
[0153]
使用方波伏安法(square wave voltammetry,swv)表征基于适体的传感器,以监测与mb氧化还原标签到电极的距离相关的峰电流高度的变化。由于血清与伤口流体相似的分子组成,其用于模拟伤口渗出物。应用10μm的适体浓度(density)以确保可区分的峰高度(图9a)并优化信噪比(图9b),其中信号表示峰高度,噪声表示信号的标准偏差。对孵育过程的研究揭示,适体-靶标结合需要约30min以建立平衡(图9c-g)。每种适体传感器针对不同浓度的分析物的性能显示在图3d-h的插图中(方法)。观察到峰电流高度随着靶标浓度的增加而减少。图3d-h中表现了相对于无分析物的峰高归一化的峰高相对于分析物浓度的相对降低。二次回归线表现为tnf-α(r2=0.9798)、tgf-β1(r2=0.9931)、il-8(r2=0.9958)、il-6(r2=0.9882)和金黄色葡萄球菌(r2=0.9712)传感器的良好单调性(monotonicity)。值得注意的是,tnf-α(0-2ng ml-1
)、tgf-β1(0-150pg ml-1
)、il-8(0-30ng ml-1
)和il-6(0-30ng ml-1)的浓度范围基于来自静脉溃疡患者的伤口流体中报告的水平,结合来自用于本研究的临床样品的elisa结果。类似地,基于伤口中报告的微生物负荷以及来自本研究的cfu计数来选择金黄色葡萄球菌的范围(0-1e+09cfu ml-1)。细胞因子传感器被证明具有良好的
选择性、最小干扰(图10)和良好的再现性(图9h)。
[0154]
用于ph传感的工作电极基于聚苯胺(pani)聚合物(方法)。开路电位(open circuit potential,ocp)变化用于监测ph变化。如图3i的插图所示,ph传感器的电位保持稳定,直到ph水平变化。随着流体样品从酸性变为碱性,发现电位降低。血清中ph传感器的表征在图3i中显示。灵敏度定义为归一化为ph3.76下的ocp的每单位ph值的ocp的相对变化为-31.402%[ph]-1
。已经证明了良好的线性(r2=0.9997,从线性回归线获得),ph传感器的表征还在于良好的可重复性(图11a)和再现性(图11b)。还用产生相似结果的血浆验证了ph传感器的性能(图11c-f)。嵌入式温度传感器基于热响应电阻器(方法)。适体传感器和ph传感器在超过四周显示出良好的长期稳定性,漂移小于5%(图16,方法),提供了优于基于抗体的生物传感器的优点,基于抗体的生物传感器由于抗体变性而容易失活。温度传感器的表征如图3c所示。灵敏度定义为归一化为20℃下的电阻的每单位温度的电阻的相对变化为0.1384%℃-1
,具有良好的线性r2=0.9998。注意,考虑ph传感器(ph 4-9)和温度传感器(20-50℃)的工作范围以确保覆盖伤口流体环境中的ph和温度变化。
[0155]
嵌入在生物标志物分析敷料中的免疫传感器被设计成具有适于大多数静脉溃疡使用的传感区域(直径为16mm)。然而,可以按比例调整免疫传感器的尺寸(图12)以实现各种其他潜在应用(例如急性创伤、手术伤口、银屑病、湿疹)。不同尺寸的免疫传感器所需的最小体积如图12所示。由于在多重适体传感系统中微孔可以容纳独立适体固定的体积限制,重新定尺寸的限制被探索为传感区域的8mm直径。图12a显示了在不同尺寸下免疫传感器所需的最小体积。观察到当传感器重新定尺寸为较小尺寸(直径为8mm)时的snr损失小于5%(图12c)。
[0156]
方法
[0157]
敷料上基电极的精密加工
[0158]
使用autocad 2018设计基电极图案。为了在敷料上制造基电极,使用溅射器(atc-2200uhv,aja)在si晶片上沉积ni牺牲层(25nm)。将su-83025(~20μm)的底部绝缘层旋涂在ni层上并通过光刻法图案化。在o2等离子体清洁之后,将s1818层旋涂在su-8层上并通过光刻法图案化。使用热蒸发器(nano 36,kurt j.lesker)沉积cr/au(30nm/50nm),然后使用丙酮剥离(lifting up)。类似地,使用电子束蒸发器(e-beam evaporator)(aja)将200nm ag沉积在参比电极区域(3mm的直径)上。旋涂su-8 3025的顶部绝缘层,然后进行光刻以暴露电化学电极的工作区域,为每个工作电极提供微孔。0.1m fecl3溶液滴在ag顶部1min以产生ag/agcl参比电极。微流体伤口渗出物收集器通过在绝缘层的顶部旋涂su-8 2150(~150μm)层并通过光刻图案化来形成。ag/agcl参比电极由950pmma a4(2μm)层临时保护。在通过30%fecl3溶液蚀刻ni层之后,从si晶片释放整个堆叠。接下来,在将电极转移印刷到医用级聚氨酯膜(tegaderm
tm
)之后,通过丙酮去除pmma层。适体固定后,免疫传感器最终被穿孔的医用级聚氨酯膜包封。
[0159]
pet上基电极的精密加工
[0160]
为了在pet上制造基电极,将cr/au(30nm/50nm)直接沉积在o2等离子体清洁的pet片(125μm)上。构建堆叠层(su-8绝缘层、ag/agcl参比电极、微流体伤口渗出物收集器)的后续程序保持与上述相同。
[0161]
aunps-gp纳米复合材料的制备与表征
[0162]
首先通过阴极剥离(cathodic exfoliation)制备石墨烯薄片。简而言之,使用由双电极系统组成的电化学工作站(chi 760e)进行块状石墨的电化学剥离。放置块状石墨晶体作为工作阴极,并且使用pt线作为对电极。使用由0.01m taa盐和nmp组成的非水溶液作为电解质。使用8v的阴极电压实现块状石墨的膨胀。将膨胀的石墨烯薄片进一步剥离并使用离心分离并干燥。将干燥的石墨烯薄片分散在dmf(1.4mg ml-1
)中,然后使用超声清洁器(sw1,sonoswiss ag)超声处理3h。将过量的aunps分散体加入石墨烯分散体中,然后声处理1.5h,以在石墨烯和aunps之间产生良好的吸附。分散体进一步在13000rpm下进行离心(heraeus
tm pico
tm 17,thermo scientific)5min,然后用dmf洗涤。将该步骤重复数次以除去未吸附的aunps。最后将分散体声处理5min以获得aunps-gp纳米复合材料。当不使用时,将复合材料储存在4℃下,并在每次使用前声处理5min。使用fesem(verios 460,fei)获得aunps-gp的形态图像。使用拉曼显微镜(alpha 300r,witec)测量拉曼光谱。
[0163]
适体序列
[0164]
tnf-α适体序列是:
[0165]5’‑
/5mebln/rg*rg*ra*rg*ru*ra*ru*rc*ru*rg*ra*ru*rg*ra*rc*ra*ra*ru*ru*rc*rg*rg*ra*rg*rc*ru*rc*rc/3thiomc3-d/-3’。具体地,通过3-碳(c3)间隔物在3'末端用二硫(s-s)键修饰rna寡核苷酸,并通过氨基修饰物在5'末端用亚甲基蓝(mb)修饰rna寡核苷酸。引入硫代磷酸酯键(用*标记)以抑制rna免于rna酶降解。
[0166]
il-6适体序列是:
[0167]5’‑
/5thiomc6-d/ggtggcaggaggactatttatttgcttttct/3mebln/-3’。具体地,通过6-碳(c6)间隔物在5'末端用s-s键修饰dna寡核苷酸,并通过氨基修饰物在3'末端用mb修饰dna寡核苷酸。
[0168]
il-8适体序列是:
[0169]5’‑
/5thiomc6-d/rgrgrgrgrgrcrururarurcrarururcrcrarurururargrurgrururarurgrarurararcrc/3mebln/-3’。具体地,通过c6间隔物在5'末端用s-s键修饰rna寡核苷酸,并且通过氨基修饰物在3'末端用mb修饰rna寡核苷酸。
[0170]
tgf-β1适体序列是:
[0171]5’‑
/5mebln/cg*ctcgg*cttc*acg*ag*att*cgtgt*cgttgtgt*c*ctgt*a*c*c*cg*c*cttg*a*c*c*agt*c*act*ct*ag*agc*at*c*cgg*a*ctg/ispc3//3thiomc3-d/-3’。具体地,通过c3间隔物在3'末端用s-s键修饰dna寡核苷酸,并且通过氨基修饰物在5'末端用mb修饰dna寡核苷酸。引入内部间隔物c3以延长间隔物臂。引入硫代磷酸酯键以抑制dna免于dna酶降解。
[0172]
金黄色葡萄球菌适体序列是:
[0173]5’‑
/5thiomc6-d/tcggcacgttctcagtagcgctcgctggtcatcccacagctacgtc/3mebln/-3’。具体地,通过c6间隔物在5'末端用s-s键修饰dna寡核苷酸,并且通过氨基修饰物在3'末端用mb修饰dna寡核苷酸。
[0174]
小鼠tnf-α适体序列是:
[0175]5’‑
/5thiomc6-d/gcgccactacaggggagctgccattcgaataggtgggccgc/3mebln/-3’。具体地,通过c6间隔物在5'末端用s-s键修饰dna寡核苷酸,并通过氨基修饰物在3'末端用mb修饰dna寡核苷酸。
[0176]
ph传感器的制备
[0177]
首先使用超声波清洁器分别用丙酮和乙醇清洁基电极。为了电聚合pani层,将0.1m苯胺/0.1m hcl溶液滴加到整个电化学操作区域上,然后使用恒电位仪(compactstat.h,ivium,下文中相同)以100mv s-1
从-0.2v至1v进行25个循环的cv。
[0178]
适体传感器的制备
[0179]
在ph传感器制备之后,首先用大量灭菌的超纯(milli-)水(下文中称为“超纯水”)冲洗电极并在n2下干燥。然后将aunps-gp分散体滴铸到每个工作电极上并干燥。用大量超纯水冲洗aunps-gp修饰的工作电极,然后用无dna酶/rna酶的蒸馏水(下文称为“蒸馏水”)进行第二次洗涤。100μm寡核苷酸在室温下通过10mm tcep还原1h以裂解s-s键。连续地,然后使用idte缓冲液将寡核苷酸稀释至10μm并涡旋10秒以帮助分散。将10μm tnf-α、il-6、il-8、tgf-β1和金黄色葡萄球菌适体分散体分别滴加到每个工作电极上,并在室温下气密孵育6h。随后用大量超纯水冲洗适体固定的电极,然后用蒸馏水第二次洗涤。将3mm mch滴加到每个工作电极上,并在室温下气密孵育过夜。最后,在用大量超纯水冲洗后,接着用蒸馏水第二次洗涤,适体传感器即可使用。
[0180]
适体传感器的定性分析与表征
[0181]
适体传感器的定性评估在滴在整个电化学操作区域上的含有0.1m kcl的5mm k3fe(cn)6/k4fe(cn)6(1:1)中进行。对于cv测量,对于aunps-gp修饰电极的准可逆性分析,电位范围在不同扫描速率(150-10mv s-1
)下为-0.6v至0.6v,而对于逐步组装分析,扫描速率固定在50mv s-1
。对于eis测量,施加的电位为0.2v。电压频率范围为100khz-0.01hz,振幅为5mv。randles电路用于拟合奈奎斯特图(nyquist plots)。细胞因子传感器在具有掺入的分析物(在pbs中重构)的人血清中表征。在表征金黄色葡萄球菌之前进行细菌培养和计数。简而言之,将来自划线板的金黄色葡萄球菌菌落接种到10ml灭菌的lb肉汤(下文称为“lb肉汤”)中,并使其在37℃下以200rpm生长17h。将1ml接种物及其系列稀释剂分别与15ml灭菌的tsa培养基混合用于倾注平板培养。孵育后,使用具有显示30-300个之间的可见分离菌落的板来估计原始接种物中的金黄色葡萄球菌细胞密度。随后,在4000rpm离心5min后沉淀金黄色葡萄球菌,并在人血清中重构用于传感器表征。适体传感器的swv测量从-0.8v至0v扫描,阶跃电位为4mv。频率为50hz,脉冲振幅为40mv。此外,用于ph传感器表征的ph值为3.76、4.56、5.47、6.2、7.06和8.04的溶液通过血清和mcilvaine缓冲液的混合物制备,而ph为9.01的溶液通过血清和ph 10.00缓冲液的混合物获得。温度传感器在含有水的玻璃烧杯中表征,水的温度通过烧杯下方的热板调节。
[0182]
通过在ph 7.06下连续4周观察峰高相对于无分析物或ocp的纵向每周变化来研究适体传感器或ph传感器的长期稳定性。在每次测量之间将免疫传感器气密储存在4℃下。
[0183]
无线电化学分析仪
[0184]
借鉴开源通用无线电化学检测器(universal wireless electrochemical detector,uwed)的启发,设计并制造了一种无线电化学分析仪,以进行全面的慢性伤口监测。与被设计为采用商用三电极电池在单通道上操作的uwed不同,该设备是多通道设计,能够采用10电极传感器执行多种分析技术。
[0185]
硬件设计
[0186]
主要部件包括数模转换器(dac)、低通滤波器、恒电位仪、模拟开关、多路复用器、
温度传感电路以及微控制器rfduino。使硬件与前面部分中描述的免疫传感器连接。首先使用autodesk eagle 9.3.0设计了电路示意图。随后,设计了用于两层pcb原型和fpcb的部件布局和布线。两种设计都是使用总包pcb服务(turnkey pcb service)(interhorizon corporation pte.ltd.,新加坡)制造和部分组装的。用显微镜和万用表检查pcb,以确保所有部件之间的正确连接。
[0187]
微控制器、dac、滤波器和恒电位仪
[0188]
微控制器、dac、滤波器和恒电位仪均采用uwed。该设备的核心使用微控制器rfduino,其是一种低成本的32位arm处理器。rfduino芯片封装集成了许多gpio端口和用于与外围部件连接的i2c总线,以及用于采样测量数据的板载10位模数转换器(adc)。此外,它与arduino开发环境兼容,并且具有集成的ble前端以与支持ble的移动设备(如电话或平板电脑)通信。dac经由i2c协议从微控制器接收数字电压输入,并通过2个单独的通道将模拟电压输出到we和re。包括使用运算放大器(op-amp)的二阶低通滤波器以最小化re电位中的电噪声。直接从dac的第二输出设置电位。
[0189]
模拟开关和多路复用器
[0190]
为了实现多种技术和多通道操作,采用模拟开关和多路复用器集成电路(ic)部件(analog devices inc.triple 3-to-1多路复用器ic,adg793g)来实现必要的硬件逻辑,可分别使用通用输入输出(gpio)和i2c协议进行控制。模拟开关对于实现不同技术之间的切换是重要的。为了支持安培(swv)和电位(ocp)测量,使用一组2个开关(s1和s2,图1d)来在跨阻抗放大器和电压跟随器配置之间交替运算放大器op2。另外的开关用于实现必要的硬件逻辑以支持ocp、swv和温度测量之间的切换,而多路复用器ic允许每个we通道的可编程选择。
[0191]
温度传感电路
[0192]
基于惠斯通电桥差分放大器配置设计了温度传感电路,实现了电阻的准确测量。惠斯通电桥利用两个分压器路径来建立平衡点,在该平衡点处,热敏电阻器的电阻的小偏差将在运算放大器的输出处产生差分电压。由于热敏电阻器的电阻在感兴趣的温度范围内在2.3kω和2.5kω之间变化,因此平衡电阻器被选择为2.26kω,并且使用配置为增益为25的仪表放大器ad627arz。
[0193]
定制matlab应用程序
[0194]
使用matlab 2018b开发附带于层状敷料的移动应用程序(vecare),其提供gui以及全面的数据处理和报告。它可以在支持matlab 2018b的任何个人计算机或移动平板电脑上在ble转usb适配器的帮助下运行。该应用程序被设计为一站式患者管理、数据记录、数据分析和结果可视化系统,旨在供医疗保健提供者使用。在打开vecare时,使用通用唯一标识符(universally unique identifiers,uuid)建立到应用程序的ble连接。此后,医疗保健提供者可以使用该应用程序来管理患者资料,收集传感器数据,实时地从gui获得视觉反馈,分析数据并生成有用的结果,以及将它们记录到相应的资料以在延长的时间段内进行监测。
[0195]
电源
[0196]
硬件可以由具有期望容量的单个可再充电3.7v锂离子聚合物电池供电。在我们的实施方式中,使用190mah容量的电池组,其提供估计40小时的连续活动操作。作为即时诊断
设备,实际电池寿命可能显著更长,这取决于其需要活动的频率。低压差稳压器ics(micrel mic5205-3.3ym5)用于产生单独的3.3v数字和模拟电源,分别为rfduino微控制器和模拟外围部件提供服务,创建单独的数字和模拟电路,以防止数字噪声降低模拟性能。
[0197]
实施例2:小鼠模型中的原位伤口监测和生物相容性研究
[0198]
结果
[0199]
为了证明平台用于原位伤口监测的效用,在小鼠模型(方法)中进行纵向伤口监测。简而言之,在第0天制作两个双侧全层切除伤口,与中线等距并且在背部的两侧间隔开(图4a)。免疫传感器与右伤口直接接触(图4c),而左伤口用作对照。使受试者附着有免疫传感器自由移动1小时,然后进行原位伤口监测。免疫传感器的存在似乎是良好耐受的,在自由移动行为期间没有观察到不适迹象或传感器覆盖的伤口的任何过度刮擦(图4b)。在所有情况下,免疫传感器在与伤口接触1小时后保持功能。图4d示出了受伤时(第0天(n=9))以及受伤后第1天(n=9)、第3天(n=6)和第5天(n=3)的ph、温度、小鼠tnf-α和金黄色葡萄球菌的纵向评估。纵向ph测量显示,与第0天相比,伤口部位处的ph在第5天降低6%。这种降低对应于伤口的再上皮化,其与缺氧和乳酸产生相关。免疫传感器测量还揭示tnf-α从第0天到第1天显著增加(增加44%),对应于受伤后的炎性反应。相比之下,在伤口处测量的金黄色葡萄球菌的温度和水平在整个愈合持续时间内是恒定的,这与通过目视检查评估的不存在感染一致。这些结果证明,免疫传感器允许在与伤口愈合相关的持续时间内对伤口流体进行原位多生物标志物分析。
[0200]
伤口部位的组织学检查进一步证明了免疫传感器的生物相容性。在5天内与免疫传感器接触的皮肤表面上没有观察到明显的不良反应迹象(例如,发红、肿胀、变性)(图4e)。图4f-g显示传感器放置对伤口闭合速率没有累积影响。从苏木精和伊红(h&e)组织切片图像测量再上皮化距离和新生表皮厚度(图4h,4i)以评估传感器放置对伤口愈合的影响。在对照伤口和具有传感器接触的伤口之间未观察到显著差异(图4j、4k)。通过细胞形态和多形核存在鉴定的伤口边缘真皮中免疫细胞的定性评估表明在传感器接触的所有时间点浸润没有差异(图4l、4m)。图4n揭示肉芽组织成熟或细胞结构水平没有差异。伤口愈合小鼠模型中的行为、目视和组织学评估证明了免疫传感器用于原位伤口监测的生物相容性。
[0201]
方法
[0202]
小鼠tnf-α传感器的表征
[0203]
适体传感器显示出随着靶标浓度的增加而降低的峰电流高度(图14的a部分)。相对于无分析物的峰高归一化的峰高随分析物浓度的相对减少,其显示在图14的b部分中。值得注意的是,小鼠tnf-α的浓度范围(0-1800pg ml-1
)是基于来自小鼠模型的伤口组织中报告的水平。
[0204]
动物程序
[0205]
将小鼠圈养在12小时光照/黑暗循环的单独通风笼中。它们自由采食标准实验室饮食和水。在该研究中,使用10-12周龄、体重25-35g的雄性icr远交小鼠(icrtac:icr,由invivos提供,新加坡)。吸入异氟烷(5%mg/kg)用于诱导麻醉,其通过测试踏板反射来检查。通过用电动毛发修剪器剃刮来准备动物的背部,小心不要用剃刀齿引起任何创伤。然后将脱毛膏施用于剃刮的皮肤2min。用温水和纱布除去毛发和膏。用干净干燥的纱布擦去所有剩余的脱毛膏,以确保没有皮肤刺激或损伤的风险。动物在受伤前皮下注射丁丙诺啡
3周和第2-5周期间变得碱性较低,表明他们的伤口对那些时期的治疗有积极响应。p2(第3周)、p4(第2周)和p5(第4周)经历升高的金黄色葡萄球菌负荷,并且在其随后的随访周中表现出更多的碱性伤口流体。这些观察与报告的伤口感染和ph之间的关联一致。表现出高水平金黄色葡萄球菌的p2;在第3周具有相应升高的il-6和il-8水平。
[0213]
为了评估伤口渗出物对传感器性能的影响,使用具有不同高浓度或ph值的分析物在使用后挑战免疫传感器。图17a-e分别显示了每个适体传感器的性能。观察到每个适体传感器的峰电流高度随着靶标浓度的增加而进一步降低,分别如图17a-e的插图所示。图17f显示了ph传感器与新制备的ph传感器的一致性能。免疫传感器的性能显示在暴露于伤口渗出物后没有受损。
[0214]
在p1(第3周)、p3(第3周)、p4(第2周)和p5(第4周)中观察到相似的反应,其中金黄色葡萄球菌、il-6、il-8和tnf-α水平升高,与角质形成细胞中的观察一致。观察到显示伤口尺寸增加的p1(第2周)和p5(第4周)具有升高的il-6和il-8水平,与10个难治性静脉溃疡的初步研究中的观察一致。除此之外,p1(第3周)、p2(第3周)、p4(第2周)和p5(第4周)中的炎症和定殖趋势在下一周减少,表明临床干预(例如,用抗菌剂浸渍的局部敷料)似乎在减少微生物负荷方面是有效的。这些多生物标志物分析可以提供全面的伤口特异性参数,并告知关于治疗方式和持续时间的临床决定。使用常规方法进一步独立地评估通过免疫传感器测量的生物标志物。采用多重elisa、ph计和凝固酶阳性葡萄球菌(staphylococci)计数分别测定细胞因子、ph和金黄色葡萄球菌的水平(方法)。图13a-b呈现了每个患者的每种生物标志物水平的纵向变化。这些测量表现出与传感器读取相似的特征,证明免疫传感器能够报告临床相关范围内的客观定量数据。
[0215]
平台的多模态测量能力还使得能够评估这些伤口床表征和生物负载参数之间的关系。图5b显示了使用包括伤口尺寸的测量参数的水平之间的皮尔逊相关系数的患者特异性相关矩阵。在所有患者中观察到il-6和il-8水平之间的统计学上显著的正相关。报告存在较高负荷的金黄色葡萄球菌的伤口流体与il-6和il-8水平升高相关,与角质形成细胞对金黄色葡萄球菌的反应一致。伤口尺寸与剩余生物标志物的相关性的程度或范围是患者特异性的,可能是由于样品源自不同性别、年龄和伤口持续时间的患者。在较大患者群组中的前瞻性随机研究将进一步证实这些生物标志物用于预测伤口愈合状态的预后价值。提供当前单个或少数非炎性标志物传感器无法获得的炎症和微生物生物负载的测量,预期免疫传感系统用作现有临床医疗设备的有益补充。
[0216]
方法
[0217]
来自静脉溃疡患者伤口渗出物的临床研究
[0218]
参与者是被诊断患有静脉溃疡并用四层加压绷带治疗的患者。年龄在21岁以上,踝肱压力指数(ankle-brachial pressure index,abpi)≥0.8,且踝和膝之间的开放性溃疡未能减少尺寸超过12周的患者被认为有资格参与。从血管门诊招募五名患者(3名男性和2名女性,年龄范围57-77岁)并争得他们参与同意。伤口渗出物在其安排的每周更换敷料时使用标准方案每周收集一次,持续连续五周。简而言之,在移除四层绷带后,用生理盐水清洁伤口并用透明膜敷料覆盖。相应的腿保持依赖于坐姿持续~40min。使用皮下注射针和注射器从透明膜敷料中吸出来自受影响的腿的所有伤口的积聚的伤口渗出物。鉴于保守性清创后的血管渗漏可能损害生物标志物分析,在保守性清创之前进行伤口流体采样。使用尺
子方法测量溃疡尺寸。用抗菌剂(例如,卡地姆碘、纳米晶体银)浸渍的局部敷料用于具有定殖的伤口。在保守性清创后和在施用新鲜的四层绷带之前将它们放置在伤口上。在适用的情况下,将泡沫敷料放置在用于具有过量渗出物的伤口的绷带下面。使用本文公开的层状敷料进行伤口渗出物中的伤口床表征和生物负载生物标志物的快速和同时评估。另一方面,还使用常规方法分析伤口渗出物。简而言之,为了进行细胞因子评估,由thermofisher定制多重elisa试剂盒,并根据制造商的说明书对纯样品(neat samples)实施。使用具有xponent 3.1的luminex 200进行读取,并使用masterplex qt 2.0.0.59测定细胞因子的浓度。此外,使用商业ph计(laquatwin ph-33,horiba)测量伤口流体样品的ph值。经由凝固酶阳性葡萄球菌计数检测金黄色葡萄球菌。简而言之,首先将10μl伤口渗出物在10ml lb肉汤中稀释,然后系列稀释。将1ml原始稀释液及其系列稀释液分别与15ml灭菌的快速葡萄球菌琼脂培养基(基础培养基和含钾的蛋黄的混合物)混合,用于倾注平板培养。孵育后,金黄色葡萄球菌在不透明培养基上形成黑色菌落,菌落周围具有归因于蛋黄蛋白水解的透明晕圈。在快速葡萄球菌琼脂平板上显示30-300个之间的金黄色葡萄球菌菌落数用于估计伤口渗出物样品中的金黄色葡萄球菌细胞密度。用于患者1-5的伤口流体评估的快速葡萄球菌琼脂平板的光学图像分别如图15a-e所示。
[0219]
统计分析
[0220]
使用graphpad prism 8和r(版本3.6.1)进行统计检验和数据可视化。当比较两组时,使用wilcoxon符号秩检验。p值《0.05被认为是显著的。r包ggplot2(版本3.0.0)和ggally(版本1.4.0)用于绘制相关矩阵。
[0221]
实施例1-3中的结果总结
[0222]
本文公开了集成的柔性微流体多重免疫传感系统(层状敷料)的开发,其允许使用先进的传感器布局、功能化技术和无线、柔性电子器件同时监测多生物标志物谱。在此,设计了平台以进行患者中静脉溃疡的伤口愈合的原位询问。该平台将由渗透性(穿孔)伤口接触层、微流体流体收集层、生物传感器传感阵列(免疫传感器)和透气性屏障层组成的层状敷料并入适合于直接施加到皮肤伤口上的小集成单元中。开发了仿生被动流体收集层,以便于原位准确和有效地确定临床相关流体。由具有降低的宽度的互连的半开口锯齿形毛细管通道的极轴阵列形成的定向流体输送系统促进了用于伤口流体分析的有效伤口流体积聚。免疫传感器阵列在几分钟内同时定量评估多种临床相关生物标志物(tnf-α、il-6、il-8、tgf-β1、ph、温度)以及生物负载(金黄色葡萄球菌)。细胞因子传感器以最小的干扰表征性地表现出选择性、特异性和再现性。ph传感器的特征在于表现出线性、可重复性和再现性。重要的是,免疫传感器阵列是可扩展的并且容易调整以满足各种潜在应用。该免疫传感器揭示了在伤口小鼠模型中进行原位多生物标志物评估和生物相容性的能力。还设计了便携式无线分析仪以与免疫传感器连接。最后,开发了含有gui的附带应用程序,以帮助管理患者的资料和医疗记录,同时促进数据收集、分析和可视化,以将免疫传感平台与现有的患者记录集成,并使得能够进行快速的现场临床决策。作为原理证明,施用层状敷料以评估从患有未愈合静脉溃疡的患者收集的伤口渗出物,每周一次,持续连续五周。愈合和生物负载的临床相关指标的图形描绘用作组合的诊断/预后工具,用于患者及其伤口的更好和更精确的临床管理。层状敷料提供多个定量临床测量的快速即时提供。不受理论的束缚,认为该平台代表了其即时设备的第一类功能,并且能够提供准确且相关的个性化临床诊断信息,
以解决患有未愈合慢性溃疡(例如,静脉溃疡、糖尿病足溃疡、压力性溃疡)的众多个体的未满足的需求。设计的简单性允许层状敷料是坚固的、可适应的和可定制的。层状敷料易于重新配置以检测其他皮肤细菌(例如,粪肠球菌(enterococcus faecalis)、铜绿假单胞菌(pseudomonas aeruginosa)、表皮葡萄球菌(staphylococcus epidermidis)、棒状杆菌属(corynebacterium spp.)),使得病原体感染的伤口能够与由共生生物体定殖的伤口层状。此外并且不受理论束缚,认为传感器技术允许生物标志物的替代组用于需要多重分析的各种应用;例如,在诊断病理学和高含量筛选中。本文讨论的层状敷料易于重构以检测其他皮肤细菌(例如,粪肠球菌、铜绿假单胞菌、表皮葡萄球菌、棒状杆菌属),使得病原体感染的伤口能够与共生生物体定殖的伤口层状。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1