新型核仁素结合肽及其应用的制作方法
1.本发明涉及特异性结合核仁素的新型肽,更具体地,涉及由特定氨基酸序列表达的肽、包含该肽和抗癌剂的偶联物、包含该肽和细胞穿膜肽的融合肽、包含该肽的用于诊断癌症的组合物、以及包含该肽或该偶联物的用于预防或治疗癌症的组合物。
背景技术:
2.相比传统药物,使用癌症特异性配体作为药物载体可以针对组织或细胞特异性地递送更高有效载荷的化疗药物,从而降低全身毒性(allen tm.nat rev cancer.2002;2:750-63)。在癌症特异性配体中,纳米颗粒和抗体已在临床癌症诊断和治疗中得到广泛研究(yao vj等人,j control release.2016;240:267-86)。治疗性纳米颗粒和抗体在新兴的个性化医疗领域中显示出巨大前景,因为它们可以在早期检测和监测个体患者的癌症,并在较长时间内提供抗癌药物以增强治疗效果(palmieri d等人,proc natl acad sci u s a.2015;112:9418-23)。尽管纳米粒子是很有前途的药物载体系统,但其在循环中的不稳定性、组织分布不充分和细胞毒性在实际应用中存在未解决的限制(sukhanova a等人,nanoscale res lett.2018;13:44)。此外,治疗性抗体的局限性包括由于其较大的体积而导致的向肿瘤组织的递送和扩散缓慢(epenetos aa等人,cancer res.1986;46:3183-91)。
3.作为经典诊断和治疗方法的替代方法,癌症特异性肽可用于提高治疗效率并减少与纳米颗粒和抗体癌症治疗相关的副作用(mori t.curr pharm des.2004;10:2335-43)。肽配体具有易于大量合成、免疫原性低、生成无毒代谢物、体内生物相容性高等优点(mcgregor dp.curr opin pharmacol.2008;8:616-9)。在发现肽的众多方法中,单珠单化合物(oboc)组合方法是筛选肽配体的一种强大工具(lam ks,et al.chem rev.1997;97:411-48)。基于oboc组合库的肽筛选方法促进了对用于癌症和其他疾病的细胞靶向新型肽配体的发现(mikawa m,et al.mol cancer ther.2004;3:1329-34)。尽管使用体外oboc组合筛选或其他方法已经分离出许多癌症特异性肽,但仍存在一些挑战。具体地,将肽用作药物的主要缺点是由于不同肽酶的快速切割导致其半衰期极短((borchardt tr,et al.adv drug deliv rev.1997;27:235-56)。本技术发明人旨在通过开发一种合成多重抗原肽(map)树状形式的生物活性肽的专用方法来克服上述问题。由于对蛋白酶和肽酶活性的获得性抗性,以树状形式合成单体肽可导致稳定性增加(mcguire mj,et al.sci rep.2014;4:4480)。
4.据此,本技术发明人结合oboc组合筛选和map合成,发现了特异性结合人乳腺癌和结肠癌细胞的肽配体系列,命名为agm或agm肽。体内荧光成像表明,agm系列肽在肿瘤中的特异性分布多于在正常组织中。此外,在体外,与单独使用太平洋紫杉醇(ptx)治疗相比,使用ptx偶联的agm治疗可改善癌细胞中ptx的积累,并更有效地抑制乳腺癌和结肠癌细胞。此外,用ptx偶联的agm治疗促进了ptx在肿瘤组织中的特异性定位,从而增加了细胞毒性,增强了药物积累,并提高了乳腺癌异种移植模型中的抗癌功效。此外,拉下实验(pull-down assays)和lc-ms/ms表明核仁素(ncl)是agm的靶蛋白。ncl是核仁中最丰富的蛋白质。在本
发明中,通过使用抗ncl抗体证实了癌细胞膜中ncl的过表达和细胞膜ncl的中和,以在体外抑制癌细胞增殖并提高细胞凋亡率。由于其致癌作用和在癌细胞膜上的表达,ncl代表了癌症治疗的一个具有吸引力的目标。综上所述,这些结果表明agm系列肽是用于诊断和治疗癌症的新型肿瘤靶向肽。
5.背景技术中所公开的信息仅用于增进对本发明背景的理解,其可以不包括构成本发明所属领域中已知的现有技术的信息。
技术实现要素:
6.本发明的一个目的是提供一种特异性结合核仁素(ncl)的肽。
7.本发明的另一个目的是提供一种包含该肽和抗癌剂的偶联物。
8.本发明的又一个目的是提供一种包含两个以上的该肽的多聚体。
9.本发明的又另一个目的是提供一种包含该多聚体和抗癌剂的偶联物。
10.本发明的又一目的是提供一种该肽与细胞穿膜肽(cpp)融合的融合肽,以及一种该多聚体与细胞穿膜肽融合的融合肽。
11.本发明的又一目的是提供一种包含该肽或该多聚体的用于诊断癌症的组合物、一种诊断癌症的方法、该肽或该多聚体在诊断癌症中的用途,以及该肽或该多聚体在制备用于诊断癌症的药物中的用途。
12.本发明的又一目的在于提供一种包含该肽、该偶联物或该多聚体的用于预防或治疗癌症的组合物、一种预防或治疗癌症的方法、该肽、该偶联物或该多聚体在预防或治疗癌症中的用途,以及该肽、该偶联物或该多聚体在制备用于预防或治疗癌症的药物中的用途。
13.为实现上述目的,本发明提供了一种特异性结合核仁素(ncl)的肽,该肽包含选自由以下组成的组的氨基酸序列:(a)seq id no:1至seq id no:8中任一项所示的氨基酸序列;和(b)一种氨基酸序列,其在seq id no:1所示的氨基酸序列中包含至少一个选自下组的氨基酸突变,(
ⅰ
)取代从n末端起第5位的甲硫氨酸残基;(
ⅱ
)取代从n末端起第7位的酪氨酸残基;和(
ⅲ
)在c末端插入亮氨酸或赖氨酸残基。
14.本发明还提供了一种包含该肽和抗癌剂的偶联物。
15.本发明还提供了一种包含该肽的多聚体。
16.本发明还提供了一种包含该多聚体和抗癌剂的偶联物。
17.本发明还提供了一种融合肽,其中该肽与细胞穿透肽(cpp)融合在一起。
18.本发明还提供了一种融合肽,其中该多聚体和细胞穿膜肽融合在一起。
19.本发明还提供一种包含该肽或该多聚体的诊断癌症的组合物、一种诊断癌症的方法、该肽或该多聚体在诊断癌症中的用途,以及该肽或该多聚体在制备用于诊断癌症的药物中的用途。
20.本发明还提供了一种包含该肽、该偶联物或该多聚体的用于预防或治疗癌症的组合物、一种预防或治疗癌症的方法、该肽、该偶联物或该多聚体在预防或治疗癌症中的用途,该肽、该偶联物或该多聚体在制备用于预防或治疗癌症的药物中的用途。
附图说明
21.图1示出了偶联物的单体(agm-330m)、二聚体(agm-330d)和四聚体(agm-330t)的结构,其中根据本发明的agm-330与peg偶联;
22.图2示出根据本发明的agm-330-cpp融合肽的结构,其中agm-330-peg偶联物与细胞穿透肽(cpp)偶联;
23.图3为肽库合成及筛选步骤示意图:1.采用分开再混合(split-mix)合成法构建组合oboc库;2.合成约2,600,000个库;3.在co2培养箱中孵育oboc库与癌细胞;4.携带对细胞表面分子具有亲和力的配体的珠子被细胞覆盖;5.在倒置显微镜下用移液管挑取阳性珠;6.通过埃德曼微测序(edman microsequencing)确定阳性珠的肽序列;7.通过筛选oboc组合肽库来鉴定癌症特异性肽配体的候选。
24.图4示出了针对癌症特异性配体的oboc库筛选和map合成。
25.图4a示出了肽针对癌细胞和正常细胞的结合特异性。图4b示出了显示8个选定珠的细胞结合特异性的全细胞结合测定结果。其中,多个乳腺癌和结肠癌细胞以及正常的乳腺癌和结肠细胞以106个细胞/ml进行重悬并与珠子一起孵育。所有实验重复进行3次,比例尺为200μm。图4c示出了通过对fitc标记的agm-330、agm-331和agm-332的免疫荧光共聚焦成像确定的结合特异性。其中,细胞核被dapi(蓝色)染色,比例尺为50μm。图4d示出了agm-330的结合特异性。其中,进行了全细胞结合测定以确定agm-330的细胞结合,比例尺为200μm。图4e示出了agm-330的合成过程,其中应注意的试剂和条件:(
ⅰ
)fmoc-lys-(fmoc)-oh、哌啶、dmf;(ii)fmoc-lys-(fmoc)-oh、哌啶、dmf;(iii)rhgamvylk-oh,哌啶;(iv)哌啶、dmf。fmoc=9-芴甲氧羰基,dmf=二甲基甲酰胺。图4f示出了显示agm-330在多种乳腺癌和结肠癌细胞以及正常乳腺和结肠细胞中针对癌细胞的特异性的荧光激活细胞分选(facs)分析。其中,柱形图表示平均值
±
标准差(sd),并通过单向方差分析(anova)和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
26.图5示出了agm-330肽(agm-330m、agm-330d、agm-330t)的体内稳定性的评价结果。通过小鼠尾静脉注射2mg/kg的agm-330后,使用肝素化毛细管在第0、0.167、1、2、4、8、12、24和48小时从一只眼睛收集血样。在4℃下使血液凝固后,通过在4℃下以5,000rpm离心10分钟来收集血清。使用agm-330抗体立即将血清中剩余的肽部分固定在elisa板上。使用versamax elisa酶标仪(美谷分子仪器公司(molecular devices))在450nm波长下测量吸光度,并使用phoenix winnonlin 8.1(pharsight公司,美国加利福尼亚州山景城)程序分析药代动力学。
27.图6示出了用agm-330t或agm-330d处理后的细胞活性分析结果。将癌细胞和正常细胞(1x104个细胞/孔)接种在96孔板中。孵育24小时后,用不同血清浓度的递增浓度的agm-330t或agm-330d对细胞进行48小时的处理。根据制造商的说明,通过cellvia wst-1测定法(young in frontier公司)评估细胞的活性。使用versamax elisa酶标仪(美谷分子仪器公司(molecular devices))在450nm的波长下测量活细胞的数量。
28.图7示出了agm-330的分子靶标的表征和鉴定。
29.图7a示出了生物素拉下实验、质谱分析和蛋白质印迹的示意图。图7b示出了通过10%sds-page进行分离后从亲和柱洗脱的蛋白质的考马斯亮蓝染色。泳道1:蛋白质标记物;泳道2:生物素拉下实验前的总裂解物;泳道3:与agm-330-生物素孵育后的流穿液;泳道
4-6:珠子的洗涤部分;泳道7-8:agm-330结合蛋白的洗脱。*红星表示蛋白质条带被切除以用于胶内酶切,然后进行lc-ms/ms分析。图7c示出了对通过ms检测到的肽的蛋白质数据库搜索,确定了ncl为agm-330的结合配偶体(binding partner)。图7d示出了从lc-ms/ms分析中获得的基因列表,其中,置信度分数表示所识别的蛋白质的mascot分数。图7e示出了使用抗ncl抗体对从生物素拉下实验中洗脱的蛋白质进行免疫印迹分析的结果。其中,箭头表示ncl的存在。图7f示出了结合agm-330的ncl结构域的分析结果。其中,不同的gfp-ncl构建体被转染到hek293t细胞中。将agm-330-生物素添加至与链霉亲和素珠结合的ncl的残基1-710、残基1-322或残基323-710。使用抗gfp抗体通过免疫印迹法对珠上的蛋白质进行分析。
30.图8示出了通过spr评估的agm-330对重组ncl的亲和力(kd)的结果。图示的spr传感图来自一个代表性的实验,该实验代表一组使用了不同的传感器芯片的三个独立且结果相似的实验。重组ncl被固定到cm5传感器芯片上。将各种浓度的agm-330(20nm至2.5μm)与被固定的ncl一起孵育,并在biacore t-200仪器上进行分析。
31.图9示出了通过生物素拉下实验对agm-330和纯化ncl之间的直接相互作用进行分析的结果。使用抗ncl抗体对洗脱的蛋白进行免疫印迹分析形成生物素下拉。泳道1:蛋白质标记物;泳道2:纯化ncl的输入对照(input);泳道3:与agm-330-生物素孵育后的流穿液;泳道4-6:珠子的洗涤部分;泳道7-8:agm-330结合蛋白的洗脱。箭头表示ncl的存在。
32.图10示出了agm-330及其变体的亲和力的elisa结果。将癌细胞(1x104个细胞/孔)接种在96孔板中并培养24小时,接着用浓度递增的13种生物素偶联肽对细胞进行2小时的处理。然后,通过高亲和力的亲和素-生物素的相互作用连接亲和素-辣根过氧化物酶(hrp),并通过hrp酶将tmb底物转化为蓝色。然后,通过加入酸来终止反应,并通过elisa在450mm处对孔进行读取来评估13种肽的亲和力。
33.图11示出了agm-330在体外和体内的结合特异性。
34.图11a和图11b示出了多种癌细胞和正常细胞的荧光共聚焦显微镜的检查结果。其中,将mcf-10a、mcf-7、mda-mb-231(图11a)或ccd-18co、ht-29和hct-116(图11b)细胞与5μmol/l的agm-330-fitc在37℃下处理30分钟。用一抗ncl抗体将ncl染色,使用与alexa fluor 594染料偶联的抗小鼠二抗抗体显示agm-330和ncl的络合物。然后使用4%多聚甲醛来固定细胞,用dapi使细胞核染色。合并图(merge)展示了agm-330-fitc、ncl和dapi的核染色。agm-330-fitc展示了与fitc偶联的agm-330。比例尺为20μm。图11c示出了mcf-10a、mcf-7和mda-mb-231细胞中各种亚细胞级分中ncl分布的分析结果。其中,使用抗ncl抗体对质膜、胞质溶胶和核ncl进行免疫印迹。图11d示出了使用sirna敲低(knockdown)ncl抑制了agm-330与细胞膜的结合。其中,mda-mb-231细胞被转染48小时。然后,加入5μmol/l的agm-330-fitc等待2小时。细胞通过pbs洗涤两次并用4%多聚甲醛进行固定。使用荧光共聚焦显微镜观察荧光。agm-330-fitc是与fitc偶联的agm-330,比例尺为20μm。图11e示出了sincl1处理后的mcf-10a、mcf-7和mda-mb-231细胞中各种亚细胞级分中的ncl分布的分析结果。其中,使用抗ncl抗体对质膜、胞质溶胶和核ncl进行免疫印迹。图11f示出了实验方案的示意图。其中,在经麻醉的6周龄雄性npgtm小鼠的腺脂肪垫中接种了基质胶和1x106mda-mb-231-luc细胞的1:1混合物。肿瘤细胞接种后,当肿瘤体积达到约100mm3时,向尾静脉注射游离的alexa680或agm-330-alexa680。图11g和图11h示出了向mda-mb-231-luc荷瘤小鼠静脉注射10nmol游离alexa680(图11g)或10nmol agm-330-alexa680(图11h)后30分钟、1小时、6
小时和24小时的小鼠体内荧光图像。此处,从经过不同处理的小鼠身上移除包括心脏、脾脏、肺、脑、肝、肾和肿瘤在内的主要器官的荧光图像。agm-330-fitc是与fitc偶联的agm-330。图11i和图11j图示了来自三只动物的在肿瘤(图11i)和不同器官(图11j)中的实时成像的alexa680相关荧光的平均辐射效率。其中,柱形图表示平均值
±
标准差,并通过单向方差分析(anova)和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
35.图12示出了ncl在膜和胞质溶胶提取物中的表达的分析结果。用非靶向乱序sirna(scr)或ncl靶向的sincl1、sincl2或sincl3转染mda-mb-231细胞。24小时后,通过实时pcr确定基因沉默的效率。基于观察到的mrna水平,选择sincl1进行进一步实验,因为它显示出对目标基因的敲低具有显著效率。柱形图表示平均值
±
标准差,使用单向anova和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
36.图13示出了ncl在乳腺癌和结肠癌中的表达谱和功能研究的结果。
37.图13a示出了肿瘤发生乳腺癌或结肠直肠腺癌患者与ncl mrna表达水平之间的显著相关性,源自对通过oncomine数据集储存库(www.oncomine.org)获得的curtis和alon数据的集中观察。图13b示出了在两个独立群组(bertucci和sveen)中根据ncl的表达对患有乳腺癌和结肠癌的患者进行卡普兰一梅尔(kaplan-meier)生存分析的结果。图13c和图13d示出了在正常乳腺组织和乳腺癌组织(图13c)中以及正常结肠组织和结肠癌组织(图13d)中ncl的免疫组织化学测定(ihc)结果。比例尺为100μm。图13e至图13h示出了在无血清培养基中用指定量的抗ncl抗体或igg处理24小时的细胞的活性。其中,通过wst测定法测量mcf-10a(图13e)、mda-mb-231(图13f)、ccd-18co(图13g)和hct-116(图13h)的细胞活性。通过染色annexin v+细胞来可视化凋亡细胞。细胞通过抗ncl抗体进行中和,并在无血清培养基中孵育24小时。通过facs分析测量凋亡细胞(图13i)。柱形图表示平均值
±
标准差,并且通过单向方差分析(anova)和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
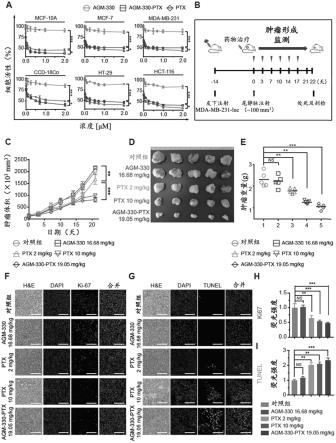
38.图14示出了agm-330t-ptx的体内肿瘤抑制功效。
39.图14a示出了在多个乳腺癌和结肠癌细胞以及正常细胞中,通过wst测定法测定48小时的agm-330-ptx处理对细胞增殖抑制的结果。图14b是实验方案的示意图。其中,在经麻醉的6周龄雄性npg小鼠的乳腺脂肪垫中接种了基质胶和1
×
106mda-mb-231-luc细胞的1:1混合物。当原发性肿瘤的体积达到约100mm3时,用载体(pbs)、agm-330t(16.68mg/kg)、ptx(分别为2mg/kg或10mg/kg)或agm-330-ptx(19.05mg/kg(n=6/组)对荷瘤小鼠进行治疗。图14c至图14e示出了在乳腺癌异种移植模型中评估的agm-330-ptx的治疗效果。如图14c所示,原发肿瘤体积每周测量两次,直至处死当天,原发肿瘤体积通过以下公式计算:体积(mm3)=(长度(mm))
×
(宽度(mm))2×
0.5。在图14d中,处死当天,分离出所有原发性肿瘤。图14e示出了原发肿瘤重量的测量结果。图14f至图14i示出了经ki-67(图14f和图14h)和tunel(图14g和图14i)染色的代表性肿瘤的免疫组织化学(ihc)切片。细胞核被dapi(蓝色)染色,比例尺为50μm。柱形图表示平均值
±
标准差,并且通过单向方差分析(anova)和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
40.图15示出通过agm-330t对癌症的特异性提高ptx功效的确认结果。在异氟烷诱导的深度麻醉下通过心脏穿刺从异种移植小鼠中收集血液。在4℃下使血液凝固后,通过在4
℃下3,000rpm离心10分钟来收集血清。根据制造商的方案,使用兽用血液分析仪(fuji dri-chem 3500s,富士胶片株式会社(fujifilm),日本东京)分析血清中的alb(图15a)、got(图15b)、gpt(图15c)、tp-ps(图15d)和ua(图15e)的水平。alb:白蛋白;got:谷草转氨酶;gtp:谷丙转氨酶;tp-ps:总蛋白/蛋白扫描;ua:尿酸。图15f示出了异种移植小鼠经过3周不同治疗后的体重变化。柱形图表示平均值
±
标准差,使用单向方差分析(anova)和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
41.图16示出了对agm-330d-ptx的抗癌作用的评估结果。图16a示出了agm-330d-ptx的结构。图16b是实验方案的示意图。其中,在经麻醉的6周龄雄性npg小鼠的乳腺脂肪垫中接种了基质胶和1x10
6 mda-mb-231-luc细胞的1:1混合物。使用载体(pbs)、agm-330d(8.34mg/kg)、ptx(分别为2或10mg/kg)或agm-330d-ptx(10.71mg/kg)(n=6/组)对携带了mda-mb-231-luc细胞瘤的小鼠进行处理。图16c和图16d示出了通过全身生物发光成像监测的肿瘤生长的结果。其中,将生长中的表达萤火虫荧光素酶的mda-mb-231细胞注射到小鼠的乳腺脂肪垫中。通过生物发光成像(图16c)来评估agm-330d-ptx的治疗效果,图16d示出了5个不同小鼠组中每5天的生物发光强度。图16e至图16g示出了对agm-330d-ptx在乳腺癌异种移植模型中的治疗效果的评估结果。在处死当天,分离所有原发性肿瘤并评估它们的体积(图16e和图16f),并且每周测量两次原发性肿瘤的重量直到处死当天(图16g)。使用以下公式计算原发肿瘤体积:体积(mm3)=(长度(mm))
×
(宽度(mm))2x0.5。图16h图示了经过3周所示的不同处理后异种移植小鼠的体重变化。柱形图表示平均值
±
标准差,使用单向方差分析(anova)和dunnett多重比较进行统计分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
42.图17示出了agm-330t-mcpp融合肽的合成过程。
43.图18示出了agm-330t-mcpp融合肽、agm-330t和马来酰亚胺-cpp的hplc和ms分析结果。
44.图19是显示agm-330t、mcpp和agm-330t-mcpp融合肽的细胞毒性作用的图。
45.图20图示了agm-330t、mcpp和agm-330t-mcpp融合肽的凋亡作用。其中,通过facs分析测量凋亡细胞。柱形图表示平均值
±
标准差,并且通过单向方差分析(anova)和dunnett多重比较进行统计分析。***表示p《0.001,ns表示不显著。
46.图21示出了agm-330t-mcpp融合肽的浓度依赖性凋亡诱导作用。
47.图22图示了agm-330m-mcpp、agm-330d-dcpp和agm-330t-tcpp融合肽的浓度依赖性细胞毒性作用。
48.图23图示了agm-330m和agm-330m-mcpp的组合、agm-330d和agm-330d-dcpp的组合,以及agm-330t和agm-330t-tcpp的组合的浓度依赖性细胞毒性作用。
具体实施方式
49.除非另有定义,否则本说明书中使用的所有技术和科学术语具有与本公开所属领域的技术人员通常所理解的相同的含义。通常,本说明书中使用的命名法是本领域公知和常规的。
50.一方面,本发明涉及特异性结合核仁素(ncl)的肽,该肽包含选自由以下所组成的组的氨基酸序列:
51.(a)seq id no:1至seq id no:8中任一项所示的氨基酸序列;和
52.(b)氨基酸序列,其在seq id no:1所示的氨基酸序列中包含至少一个选自下列组的氨基酸突变,
53.(i)n-末端起第5位的甲硫氨酸残基被取代;
54.(ii)n-末端起第7位的酪氨酸残基被取代;和
55.(iii)在c末端插入亮氨酸或赖氨酸残基。
56.能够功能性和特异性靶向肿瘤的肽配体的发现为癌症诊断和治疗提供了新的机会。然而,肽配体的使用在很大程度上受到其较短的生物半衰期的限制。
57.在本发明中,使用单珠单化合物(one-bead-one-compound,oboc)组合方法结合多抗原肽(multiple-antigen-peptide,map)合成方法合成了约2,600,000个肽库。从肽库中鉴定了新型癌症特异性肽配体agm-330、agm-331、agm-332、agm-333、agm-334、agm-335、agm-336和agm-337,它们的氨基酸序列如下表1中所示(参见图3)。使用细胞结合测定、流式细胞术和荧光共聚焦显微镜,证实了肽配体在体外和体内特异性结合癌细胞。
58.此外,通过拉下实验和lc-ms/ms分析,证实了膜核仁素(ncl)是agm-330、agm-331、agm-332、agm-333、agm-334、agm-335、agm-336或agm-337的靶蛋白。此外,证实了与单独使用紫杉醇(ptx)治疗相比,使用ptx和agm-330的偶联物治疗可明显抑制癌细胞生长。【表1】名称氨基酸序列seq id no.agm-330rhgamvylk1agm-331adhrhrrsg2agm-332avararrrr3agm-333rflknkkar4agm-334rwlknkkar5agm-335fgrlkkplk6agm-336krrrrerag7agm-337krrrkaptd8
59.八种肽中的三种(agm-330、agm-331和agm-332)显示出与乳腺癌细胞系(mda-mb-231)的强的特异性和优先的结合,与人类正常乳腺细胞系(mcf-10a)没有结合或仅有微弱结合(参见图4a和图4b)。
60.此外,证实了具有seq id no:1中的氨基酸序列的agm-330即使具存在某些氨基酸残基的突变,它仍然显示出与核仁素的强特异性结合的特性。
61.具体地,在本发明中,seq id no:1所示的氨基酸序列中的氨基酸突变可以是,但不限于选自由以下组成的组中的至少一种突变:
62.(i)n-末端起第5位的甲硫氨酸残基被取代;
63.(ii)n-末端起第7位的酪氨酸残基被取代;和
64.(iii)在c末端插入亮氨酸或赖氨酸残基。
65.优选地,该氨基酸突变可以是至少一种选自下组的突变:
66.(i)n末端第5位的甲硫氨酸残基被亮氨酸或正亮氨酸取代;
67.(ii)n末端第7位的酪氨酸残基被苯丙氨酸取代;和
68.(iii)在c末端插入亮氨酸或赖氨酸残基。
69.在本发明中,包含突变的氨基酸序列可以选自,但不限于由seq id no:9至seq id no:15和seq id no:20所组成的组(见表2)。【表2】agm-330中的氨基酸突变氨基酸序列seq id no.r1
→
k1khgamvylk9h2
→
r2rrgamvylk10a4
→
l4rhglmvylk11m5
→
l5rhgalvylk12m5
→
nle5(nle:正亮氨酸)rhga(nle)vylk13v6
→
a6rhgamaylk14y7
→
f7rhgamvflk15r1h2
→
缺失gamvylk16r1h2
→
插入rhrhgamvylk17r1h2r3h4
→
插入rhrhrhgamvylk18反向序列klyvmaghr19l10k11l12k13
→
插入rhgamvylklklk20
70.seq id no:13中的氨基酸序列中,“nle”表示正亮氨酸。
71.在本发明中,“agm”、“agm肽”或“agm肽配体”是指具有选自seq id no:1至seq id no:20的氨基酸序列的肽,或具有选自seq id no:1至seq id no:20的氨基酸序列的肽中的至少一种肽。
72.在本发明中,agm肽可以与核仁素(ncl)特异性结合。
73.尽管ncl主要位于正常细胞的细胞核中,但之前的研究表明,在许多不同类型的癌细胞中,膜ncl的过表达增强(shen n等人,oncotarget.2014;5:5494-509)。与这些研究一致,本发明证明了ncl在活跃增殖的癌细胞的膜上过表达,但在正常细胞中没有。因此,使用靶向ncl的分子可能是一种将药物选择性递送至肿瘤的同时将副作用降至最低的有效方法(li f等人,nat commun.2017;8:1390)。此外,本发明通过用特异性抗体进行中和证明了膜ncl对癌细胞的作用。如预期地,细胞凋亡率增加,随后是抗体介导的ncl中和(图13j)。总的来说,ncl是用于癌症治疗的理想治疗标志物,靶向ncl的agm-330作为诊断和治疗多种人类癌症的工具具有巨大潜力。
74.在本发明的一个实例中,agm肽,特别是agm-330,特异性地结合癌细胞但与正常乳腺细胞和结肠直肠细胞的结合微弱或根本不结合。这些结果表明agm-330具有癌症特异性,使其成为开发癌症靶向肽的主要候选。特别是,在小鼠异种移植研究中,agm-330治疗显示出其在肿瘤中的积累比在心脏、脾脏、肺或脑中的积累更多。agm-330对癌细胞的特异性靶向能力为癌症的诊断提供了潜在的分子工具。
75.本发明还涉及一种agm肽-peg偶联物,其中agm肽和聚乙二醇(peg)链偶联,该聚乙二醇(peg)链包含至少两个乙二醇基团,每个乙二醇基团具有-[ch
2-ch
2-o]-结构。
[0076]
在本发明中,聚乙二醇链的概念不仅包括具有式1结构的普通聚乙二醇链,而且包括其衍生物。聚乙二醇链的衍生物的示例包括但不限于具有式2结构的氨基聚乙二醇羧酸。
[0077]
与聚乙二醇(peg)的偶联,也称为聚乙二醇化(peg化),,已广泛用于改善治疗性蛋白质的药理特性(gupta v等人,j cell commun signal.2019;13:319-30)。在本发明中,聚乙二醇化用于降低位阻和增加亲水性。然而,聚乙二醇一向受到免疫原性的影响,对治疗性分子有负面的临床效果(moreno a等人,cell chem.biol.2019;26:634-44.e3)。早前的一项研究表明,针对聚乙二醇化分子的抗聚乙二醇免疫反应取决于对聚乙二醇化程度的免疫原性和聚乙二醇的分子量(wan x等人,process biochem.2017;52:183-91)。
[0078]
在本发明中,聚乙二醇链可具有2至24个乙二醇单元,优选地具有4至20个,更优选地具有6至18个,最优选地具有6至12个乙二醇单元,但不限于此。
[0079]
聚乙二醇链可以通过接头与agm肽连接。因此,agm肽-peg偶联物可具有,但不限于由以下结构式1表示的结构。agm-l
1-peg
ꢀꢀꢀꢀ
(结构式1)
[0080]
在结构式1中,peg表示聚乙二醇链,l1表示接头。
[0081]
接头l1优选地选自但不限于由单键(直接键)、c
1-c
20
烷基、c
1-c
20
亚烷基、-s-、-nh-和-o-组成的组,并且可以包括与agm肽的c末端氨基酸的羧基形成-conh-的肽键,但不限于此。
[0082]
此外,在结构式1的agm肽-peg偶联物中,可以在与agm偶联的peg的另一端引入用于与另一种物质,优选与药物偶联的官能团。官能团的实例包括但不限于羧基(cooh)、氨基(nh2)和硫醇基。
[0083]
例如,如结构式2至4所示,agm肽-peg偶联物的形式可以是,但不限于具有氨基(nh2)的赖氨酸(k)和/或具有硫醇基的半胱氨酸(c)偶联至与agm肽偶联的peg的另一端。agm-l
1-peg-k
ꢀꢀꢀꢀ
(结构式2)agm-l
1-peg-c
ꢀꢀꢀꢀ
(结构式3)agm-l
1-peg-k-c
ꢀꢀꢀꢀ
(结构式4)
[0084]
出于说明性目的,在本发明的一个实施例中,一种agm-330单体(agmm)可以具有如结构式5所示的结构,其中在agm-330-peg偶联物中的与agm偶联的peg的另一端引入赖氨酸和酪氨酸。rhgamvylk-l
1-peg-k-c
ꢀꢀꢀꢀ
(结构式5)
[0085]
在上述的结构式5中,通过c末端赖氨酸的羧基与氨基之间的缩合反应,peg可以如
结构式6所示通过包括肽键的接头(l1)连接到agm-330的c末端,但不限于此。
[0086]
另一方面,本发明涉及一种包含agm肽或agm肽-peg偶联物,以及药物的agm肽-药物偶联物或agm肽-peg-药物偶联物。
[0087]
在本发明中,药物是表现出药理作用的药剂,具体地,可以是化疗剂、毒素、微rna(mirna)、sirna、shrna或放射性同位素。化疗剂可以是,例如细胞毒剂或免疫抑制剂。具体地,它可以包括能够用作微管蛋白抑制剂、有丝分裂抑制剂、拓扑异构酶抑制剂或dna嵌入剂的化疗剂。此外,化疗剂的示例包括免疫调节化合物、抗癌剂和抗病毒剂或它们的组合。
[0088]
优选地,该药物可以是抗癌剂。抗癌剂可以是选自由以下所组成的组中的至少一种:例如太平洋紫杉醇(paclitaxel)或多西紫杉醇(docetaxel)的紫杉醇类((axols)和紫杉烷类、美登木素生物碱、奥瑞他汀、氨基蝶呤、放线菌素、博来霉素、沙利度胺、喜树碱、n8-乙酰基亚精胺、1-(2-氯乙基)-1,2-二甲基磺酰肼、埃斯培拉霉素、依托泊苷、6-巯基嘌呤、尾海兔素、单端孢霉烯、卡利奇霉素、甲氨蝶呤、长春新碱、长春碱、多柔比星、美法仑、丝裂霉素a、丝裂霉素c、苯丁酸氮芥、倍癌霉素、l-天冬酰胺酶(l-asparaginase)、巯基嘌呤(mercaptopurine)、硫鸟嘌呤(thioguanine)、羟基脲(hydroxyurea)、阿糖胞苷(cytarabine)、环磷酰胺(cyclophosphamide)、异环磷酰胺(ifosfamide)、亚硝基脲(nitrosourea)、顺铂、卡铂、丝裂霉素、达卡巴嗪(dacarbazine)、甲苄肼(procarbazine)、托泊替康(topotecan)、氮芥(nitrogen mustard)、癌得星(cytoxan)、α-鹅膏菌素、依托泊苷(etoposide)、5-氟尿嘧啶(5-fluorouraci)、cnu(双氯乙基亚硝基脲)、伊立替康(irinotecan)、喜树碱(camptothecin)、博来霉素(bleomycin)、伊达比星(idarubicin)、柔红霉素(daunorubicin)、更生霉素(dactinomycin)、普卡霉素(plicamycin)、米托蒽醌(mitoxantrone)、天冬酰胺酶(asparaginase)、长春瑞滨(vinorelbine)、苯丁酸氮芥(chlorambucil)、美法仑(melphalan)、吡咯并苯并二氮杂卓、卡莫司汀(carmustine)、洛莫司汀(lomustine)、白消安(busulfan)、曲奥舒凡(treosulfan)、达卡巴嗪(dacarbazine)、依托泊苷(etoposide)、替尼泊苷(teniposide)、托泊替康(topotecan)、9-氨基喜树碱(9-aminocamptothecin)、克立那托(crisnatol)、丝裂霉素c(mitomycin c)、三甲曲沙(trimetrexate)、霉酚酸(mycophenolic acid)、噻唑呋林(tiazofurin)、利巴韦林(ribavirin)、5-乙炔基-4-胺甲酰基-1-β-呋喃糖基咪唑(eicar)、羟基脲(hydroxyurea)、去铁胺(deferoxamine)、氟尿苷(floxuridine)、去氧氟尿甙(doxifluridine)、雷替曲塞(raltitrexed)、阿糖胞苷(cytarabine(ara c))、胞嘧啶阿糖胞苷(cytosine arabinoside)、氟达拉滨(fludarabine),他莫昔芬(tamoxifen),雷洛昔芬(raloxifene)、甲地孕酮(megestrol)、戈舍瑞林(goserelin)、醋酸亮丙瑞林(leuprolide acetate)、氟他胺(flutamide)、比卡鲁胺(bicalutamide)、eb1089、cb1093、kh1060、小檗碱(berberine)、维替泊芬(verteporfin)、姜黄素、白蛋白结合型紫杉醇(abraxane)、folfirinox、奥沙利铂、希罗达(xeloda)和吲哚甲酰胺、酞菁(phthalocyanine)、微管溶素、光敏剂pe4、去甲氧基竹红菌甲素(demethoxy-hypocrellin a)、干扰素-α、干扰素-γ、肿瘤坏死因子、吉西他
滨(gemcitabine)、万珂(velcade)、瑞复美(revlimid)、沙利度胺(thalomid)、洛伐他汀(lovastatin)、1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium ion)、星形孢菌素(staurosporine)、放线菌素d(actinomycin d)、更生霉素(dactinomycin)、博来霉素a2(bleomycin a2)、博来霉素b2(bleomycin b2)、培洛霉素(peplomycin)、表柔比星(epirubicin)、吡柔比星(pirarubicin)、佐柔比星(zorubicin)、米托蒽醌(mitoxantrone)、维拉帕米(verapamil)、毒胡萝卜素(thapsigargin)、核酸酶,和细菌或动植物来源的毒素。
[0089]
在本发明的一个实例中,在人乳腺癌异种移植小鼠模型中,与在太平洋紫杉醇(ptx)治疗组中观察到的相比,用agm-330-ptx(agm-330-peg偶联物与ptx的偶联物)治疗导致肿瘤的体积和重量分别降低60%和46%(参见图14c至图14e)。agm-330对癌细胞和组织的高效靶向能力为癌症治疗中的抗癌药物递送提供了一种有前景的方法。
[0090]
太平洋紫杉醇(ptx)被认为是最有前途的癌症化疗药物之一,并且已经针对许多不同的人类恶性肿瘤进行了测试(ramalingam s,belani cp.expert opin.pharmacother.2004;5:1771-80)。然而,ptx的高疏水性及其配制过程的相关困难阻碍了使用ptx进行治疗,此外,许多与ptx治疗相关的副作用也归结于配置过程中使用的稀释溶剂(hennenfent kl,govindan r.ann oncol.2006;17:735-49)。然而,与ptx不同的是,与agm肽偶联的ptx,特别是agm肽-peg偶联物,是高度亲水的。这种亲水性可以改善其药代动力学特征,并使得可以使用更少量的有毒稀释缓冲液,从而进一步降低化法的总体毒性。agm肽介导的靶向递送的优点是可降低毒性等副作用并显著提高治疗效果。
[0091]
在本发明中,agm肽或agm肽-peg偶联物可以直接地或通过接头(ld)与药物,优选地与抗癌剂连接。
[0092]
接头(ld)可以是可裂解的(cleavable)。可裂解接头(ld)使得药物以在胞内条件下(即在细胞内环境中)可裂解的形式通过接头的裂解从抗体中被释放。
[0093]
接头(ld)可以被存在于细胞内环境(例如,溶酶体或核内体)中的裂解剂裂解。例如,它可以是可被例如胞内肽酶或蛋白酶(例如溶酶体或内体蛋白酶)裂解的可裂解肽接头。通常,肽接头的长度至少为两个氨基酸。裂解剂可包括组织蛋白酶b、组织蛋白酶d和纤溶酶,并且水解肽以允许药物被释放到靶细胞中。
[0094]
肽接头可以被在癌组织中过表达的硫醇依赖性蛋白酶,组织蛋白酶-b裂解。例如,可以使用phe-leu或gly-phe-leu-gly接头。此外,肽接头可以是例如val-cit接头或phe-lys接头,其可被胞内蛋白酶裂解。
[0095]
在一个实施例中,可裂解接头是ph敏感接头,其在某些ph值下可对水解敏感。一般而言,ph敏感接头可在酸性条件下水解。其示例包括可在溶酶体中水解的酸不稳定接头,例如腙、缩氨基脲、缩氨基硫脲、顺乌头酰胺、原酸酯、缩醛、缩酮等。
[0096]
在另一个实施例中,接头可以是例如可以在还原条件下裂解的二硫化物接头。可以通过sata(n-琥珀酰亚胺基-s-乙酰硫基乙酸酯)、spdp(n-琥珀酰亚胺-3-(2-吡啶基二硫基)-丙酸酯)丙酸酯)、spdb(n-琥珀酰亚胺-3-(2-吡啶二硫基)丁酸酯),和smpt(n-琥珀酰亚胺-氧羰基-α-甲基-α-(2-吡啶二硫基)甲苯)形成多种二硫键。
[0097]
此外,接头可以是例如不可裂解的接头。在这种情况下,药物仅通过一个步骤(抗体水解)释放,产生例如氨基酸-接头-药物偶联物。这种类型的接头可以是硫醚基团或马来
酰亚胺基己酰基团,其可以在血液中保持稳定。
[0098]
在一些情况下,agm肽或agm肽-peg偶联物可以直接地或通过非共价键或共价键连接至药物,优选为抗癌剂,但不限于此。
[0099]
非共价键可以,例如是选自由氢键、静电相互作用、疏水相互作用、范德华相互作用、π-π相互作用和阳离子-π相互作用组成的组中的至少一种。
[0100]
另一方面,本发明涉及一种包含两个以上agm肽或agm肽-peg偶联物的多聚体。
[0101]
在本发明中,多聚体可以但不限于包含2至8个,优选2至6个,更优选2至4个agm肽或agm肽-peg偶联物。
[0102]
例如,在本发明中,多聚体可以是二聚体,其中两个agm肽或两个agm肽-peg偶联物通过接头(l2)连接,或者多聚体可以是四聚体,其中二聚体通过额外的接头(l3)连接,但不限于此。此外,对于本领域技术人员来说显而易见的是,可以通过与上述连接类似的连接获得多聚体,例如六聚体、八聚体和更高级的寡聚体。
[0103]
例如,根据本发明的agm肽-peg偶联物的二聚体和四聚体可分别具有如结构式7和8所表示的结构,但不限于此。
[0104]
接头l2和l3可以彼此相同或不同,并且可以独立地可裂解或不可裂解。
[0105]
接头l2和l3可以各自独立地选自由单键(直接键)、氨基酸或其衍生物、c
1-c
20
烷基、c
1-c
20
亚烷基、-s-、-nh-和-o-所组成的组,但不限于此。优选地,接头可以各自独立地为氨基酸或其衍生物,更优选地为具有至少两个氨基的赖氨酸(lys,k)或精氨酸(arg,r),但不限于此。
[0106]
最优选地,接头l2和l3可以各自独立地是赖氨酸(lys,k),并且在这种情况下,赖氨酸的氨基(nh2)可以以类似于肽键例如-c-conh-的形式与peg结合,但不限于此。
[0107]
此外,可以在agm肽或agm肽-peg偶联物的接头的一端引入用于偶联另一种物质,优选为药物的官能团。例如,可以将用于偶联药物的官能团引入结构式7中的l2或结构式8中的l3。
[0108]
官能团的示例包括但不限于氨基(nh2)和硫醇基。例如,可以引入具有氨基(nh2)的
赖氨酸(k)和/或具有硫醇基的半胱氨酸(c)作为官能团,但不限于此。
[0109]
例如,在本发明的一个实施例中,agm-330二聚体(agm-330d)和agm-330四聚体(agm-330t)可以具有下表3中的结构,但不限于此。【表3】【表3】
[0110]
在本发明的一个实施例中,使用agm-330d-ptx测试了抗癌功效(图16a)。结果显示,与在ptx治疗的小鼠中观察到的相比,使用agm-330d-ptx治疗的小鼠显示出的荧光素酶活性明显降低(图16c和图16d)。此外,与在ptx治疗组中观察到的相比,使用agm-330d-ptx治疗导致肿瘤的体积和重量显著减少(图16e至图16g)。与使用agm-330t-ptx获得的结果一致地,与从使用载体(pbs)处理的小鼠中观察到的相比,小鼠体重不受agm-330d-ptx给药的影响(图16h)。agm-330d的癌症特异性可能增强了ptx的疗效,增加了肿瘤组织中的治疗药物浓度。
[0111]
另一方面,本发明涉及一种多聚体-药物偶联物,其包含:包含两个以上agm肽-peg偶联物的多聚体;和药物,优选为抗癌剂。
[0112]
在本发明中,对agm肽-药物偶联物或agm肽-peg-药物偶联物的描述可同等适用于多聚体-药物偶联物,因此各接头或药物如前文有关agm肽-药物偶联物或agm肽-peg-药物偶联物中所描述的那样。
[0113]
另一方面,本发明涉及一种agm肽-peg-cpp融合肽,其中agm肽-peg偶联物与细胞穿膜肽(cpp)融合在一起。
[0114]
如本文所用,术语“细胞穿膜肽(cpp)”是一种信号肽,是特定氨基酸的组合,用于细胞内递送高分子量物质,例如蛋白质、dna、rna等。目前为止,细胞穿膜肽已被用于细胞内递送各种低分子量化合物或高分子量物质,如蛋白质、肽、rna和dna。大多数细胞穿膜肽来源于蛋白质转导结构域或膜移位序列。与外来物质进入细胞的一般进入途径不同,细胞穿膜肽可在不损坏细胞膜的情况下进入细胞,并且被期待于在递送已知不能穿过细胞膜的dna或蛋白质方面发挥创新作用。
[0115]
本发明的融合肽使用细胞穿膜肽。对细胞穿膜肽没有特别地限制,只要它具有通过细胞内吞机制进入细胞的性质即可。优选地,本发明使用的细胞穿膜肽可以选自下表4中列出的细胞穿膜肽或其变体。【表4】
[0116]
更优选地,细胞穿膜肽可以选自由下表5中列出的细胞穿膜肽或其变体所组成的组。对于表5中所示的肽的合成方法和性质,可以参考韩国专利no.10-1169030。最优选地,
细胞穿膜肽可包含seq id no:48的氨基酸序列。【表5】
[0117]
在本发明的一实例中,选择了表5中表示为ds4-3肽的seq id no:48的细胞穿膜肽用于实验。然而,对于本领域技术人员显而易见的是,即使将除了实际使用的细胞穿透肽以外的细胞穿透肽与本发明的肽融合,也会出现与本发明的效果相似的效果。
[0118]
在本发明中,agm肽-peg偶联物和细胞穿膜肽可以通过接头连接在一起。优选地,它们可以通过马来酰亚胺-羧基双功能接头连接在一起,但不限于此。
[0119]
另一方面,本发明涉及多聚体-cpp融合肽,其中包含两个以上agm肽-peg偶联物的多聚体和细胞穿膜肽(cpp)连接在一起。
[0120]
在本发明中,对agm肽-peg-cpp融合肽的描述可同样用于描述多聚体-cpp融合肽,因此每个接头或细胞穿膜肽与之前在agm肽-peg-cpp融合肽中定义的一样。
[0121]
另一方面,本发明涉及一种用于诊断癌症的组合物,其包含agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽。
[0122]
另一方面,本发明涉及一种使用agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽诊断癌症的方法。
[0123]
另一方面,本发明涉及agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽在诊断癌症中的应用。
[0124]
另一方面,本发明涉及agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽在制造用于诊断癌症的药物中的应用。
[0125]
可以使用本发明的诊断组合物预测其发作或发作可能性的癌症包括白血病、骨髓增生性疾病、淋巴瘤、乳腺癌、肝癌、胃癌、卵巢癌、宫颈癌、神经胶质瘤癌、结肠癌、肺癌、胰腺癌、前列腺癌、肝癌、胃腺癌、子宫癌、膀胱癌、甲状腺癌、黑色素瘤、鳞状细胞癌、造血系统癌、肾癌和头颈癌,但不限于此。
[0126]
如本文所用,术语“诊断”包括确定受试者对特定疾病或病症的易感性、确定受试者目前是否患有特定疾病或病症、确定患有特定疾病或病症的受试者的预后(例如,鉴定转移前或转移性癌症病症、确定癌症阶段或确定癌症对治疗的反应性)或治疗学(例如,监测受试者的状态以提供有关治疗功效的信息)。为了本发明的目的,诊断是指确认上述疾病的发病或发病的可能性(风险)。
[0127]
另一方面,本发明涉及一种用于预防或治疗癌症的组合物,其包含agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽。
[0128]
另一方面,本发明涉及一种预防或治疗癌症的方法,包括向受试者施用agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合
肽或多聚体-cpp融合肽。
[0129]
另一方面,本发明涉及agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽在预防或治疗癌症中的用途。
[0130]
另一方面,本发明涉及agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽在制备用于预防或治疗癌症的药物中的用途。
[0131]
可以用本发明的组合物治疗的癌症或癌瘤没有特别限制,并且可以是与核仁素相关的癌症,例如实体癌或白血病。此类癌症的实例包括白血病、骨髓增生性疾病、淋巴瘤、乳腺癌、肝癌、胃癌、卵巢癌、宫颈癌、神经胶质瘤癌、结肠癌、肺癌、胰腺癌、前列腺癌、肝癌、胃腺癌、子宫癌、膀胱癌、甲状腺癌、黑色素瘤、鳞状细胞癌、造血细胞癌、肾癌和头颈癌,但不限于此。
[0132]
在本发明中,术语“癌症”和“肿瘤”可互换使用,其指代或描述哺乳动物中通常以不受控制的细胞生长/增殖为特征的生理状况。
[0133]
如本文所用,术语“预防”是指任何通过施用包含肽或偶联物的组合物来抑制或延缓癌症的操作。此外,术语“治疗”是指任何通过施用包含agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm-肽peg-cpp融合肽或多聚体-cpp融合肽的组合物来减轻或治愈癌症症状的操作。
[0134]
根据本发明的用于预防或治疗癌症的组合物可以包含药学有效量的agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽本身或与至少一种药学上可接受的载体、赋形剂或稀释剂一起。如本文所用,术语“药学有效量”是指足以预防、改善和治疗癌症症状的量。
[0135]
如本文所用,“药学上可接受的”是指生理学上可接受的添加剂,并且当施用至人类时,不会引起过敏反应,例如胃肠道紊乱和头晕,或类似的反应。载体、赋形剂和稀释剂的示例包括乳糖、葡萄糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯树胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁和矿物油。此外,该组合物还可以包含填充剂、抗凝剂、润滑剂、润湿剂、调味剂、乳化剂和防腐剂。合适的药学上可接受的载体和试剂如remington的pharmaceutical sciences(第19版,1995)中所详细描述的。
[0136]
此外,本发明的组合物可以包含至少一种已知的具有癌症治疗作用的活性成分,以及agm肽、agm肽-peg偶联物、agm肽-peg-药物偶联物、多聚体、多聚体-药物偶联物、agm肽-peg-cpp融合肽或多聚体-cpp融合肽。
[0137]
可以使用本领域已知的方法配制本发明的药物组合物,以便在对人类以外的哺乳动物给药后快速、持续或延迟地释放活性成分。该组合物可以具有散剂、颗粒剂、片剂、乳剂、糖浆剂、气雾剂、软或硬明胶胶囊、灭菌注射液或灭菌散剂的形式。
[0138]
本发明的组合物可以通过多种途径给药,包括口服、透皮、皮下、静脉内或肌内途径。活性成分的剂量可根据各种因素进行适当选择,包括给药途径,以及病人的年龄、性别、体重和疾病严重程度。根据本发明的用于预防或治疗癌症的组合物可以与具有预防、改善或治疗癌症症状作用的已知化合物组合施用。
[0139]
在下文中,将参考实例更详细地描述本发明。这些实施例仅出于说明本发明的目的,对于本领域的普通技术人员来说显而易见的是,本发明的范围不应解释为受这些实施例的限制。
[0140]
实例1:材料和方法
[0141]
实例1-1:oboc库的合成
[0142]
在固相tentagel mb nh2树脂(rapp polymere公司,图宾根,德国)上合成oboc库。通过“分开-混合(split-mix)”合成方法来构建组合oboc库,每个库包含数百万个珠子/配体的随机文库。使用5g tentagel mb nh2树脂(200μm,520,000个珠子/g)合成大约2,600,000个oboc库。珠子表面的配体通过标准固相肽合成技术合成,使用9-芴甲氧羰基(fmoc)化学和n-羟基苯并三唑(hobt;上海吉尔生化公司,中国)/n,n'-二异丙基碳二亚胺(dic;吉尔生化公司)偶联。通过茚三酮试验确认偶联完成。将珠子储存在4℃的70%乙醇中直至使用。
[0143]
实例1-2:伦理学和细胞培养
[0144]
与人体组织相关的所有工作均由光州科学技术学院(gwangju institute of science and technology)的机构审查委员会(irb)预先批准(#20191008-br-48-03-02)。所有动物实验均根据光州科学技术学院动物护理和使用机构委员会(iacuc)(gist-2019-040)进行。所有培养物均在加湿培养箱中生长,培养箱温度保持在37℃,含95%空气/5% co2。mcf-10a正常人乳腺细胞系获取自美国模式培养物集存库(american type culture collection),并在补充有牛垂体提取物(美国凯姆布雷克斯生化公司(cambrex bioscience),美国马里兰州沃克斯维尔)的megm完全培养基(megm,龙沙公司(lonza),美国马里兰州沃克斯维尔)中繁殖。正常人结肠直肠细胞系ccd-18co获取自韩国细胞系银行(韩国首尔)。人乳腺癌和结肠癌细胞系,包括mcf-7、mda-mb-231、ht-29和hct-116,获自韩国细胞系银行。jurkat t细胞也来自韩国细胞系银行。表达荧光素酶的mda-mb-231癌细胞系获自美国珀金埃尔默公司(perkinelmer,美国马萨储塞州霍普金顿)。每个癌细胞系在补充有10%热灭活胎牛血清(fbs;gibco公司)、0.1mg/ml链霉素(gibco公司)和100单位/ml的青霉素(gibco公司)的rpmi1640(gibco公司,美国沃尔瑟姆)和dmem(gibco公司)中生长。
[0145]
实例1-3:筛选癌症特异性配体的oboc库
[0146]
在筛选前,用重蒸馏水和磷酸盐缓冲盐水(pbs;韩国威健公司(welgene inc.))彻底洗涤珠子。用胰蛋白酶/edta(gibco公司)从培养皿中分离癌细胞和正常细胞,用相应的培养基进行洗涤,以106个细胞/ml进行重悬,并在培养皿中与oboc珠一起在加湿的co2培养箱中于37℃下摇动(60rpm)孵育。与细胞结合的珠子在显微镜下呈花团状(rosettes),中央珠子被一层或多层细胞覆盖。在倒置显微镜下用移液管挑取阳性珠,用盐酸胍进行处理(8m,20分钟)去除珠子表面的细胞和蛋白,用正常乳腺上皮细胞进行二轮筛选,去除假阳性结合。只对在两轮都有细胞结合的珠子进行肽测序。
[0147]
实例1-4:肽和2'-马来酰亚胺-ptx的化学合成
[0148]
所有肽和2'-马来酰亚胺-ptx分别由anygen公司(韩国光州)使用固相肽合成法和steglich酯化法进行合成。肽和2'-马来酰亚胺-ptx的纯度和分子量分别使用hplc和基质辅助激光解吸电离飞行时间质谱(maldi-tof ms)(岛津公司,日本京都)进行测定。
[0149]
实例1-5:agm-330-ptx的合成
[0150]
将肽支链硫醇中间体溶解在500μm二甲基甲酰胺(dmf;韩国德山化工公司)中,并
与2'-马来酰亚胺-ptx的dmf溶液(5mm;10当量)和0.1%体积比的n,n-二异丙基乙胺(dipea;德山化工公司)混合。将混合物在室温下搅拌30分钟,然后通过hplc(岛津公司)进行纯化。通过hplc纯化后,使用maldi-tof ms(岛津公司)测定agm-330-ptx的分子量。
[0151]
实例1-6:血清稳定性试验
[0152]
用预热的100%人血清(西格玛奥德里奇公司)将肽的储备液(100μm)稀释10倍,并在37℃下孵育0、3、6、9和24小时。将pbs中的肽作为对照。通过在4℃下用终浓度为3m的尿素使血清蛋白变性10分钟来停止孵育,然后用终浓度为7%(体积比)的三氯乙酸使血清蛋白沉淀(4℃,10分钟)接着进行离心(17,000x g,10分钟)。回收每个样品的上清液并在分析柱上运行,线性梯度为5-65%,溶剂b(90%(体积比)乙腈和0.045%(体积比)tfa的水溶液)在溶剂a(0.05%(体积比)tfa水溶液)中,流速为1ml/min,进行25分钟,并在215nm处进行监测。从0时间点开始,通过pbs样品鉴定每种肽的洗脱曲线。通过将在每个时间点获得的肽峰的高度与在0时间点获得的肽峰的高度进行比较来确定残留在血清处理的样品中的肽的百分比。将每个实验进行三次。
[0153]
实例1-7:流式细胞术分析
[0154]
荧光激活细胞分选(facs)分析用于检查fitc标记的肽(fitc-肽)的结合。fitc肽(100μm)的储备溶液是通过将肽溶解在pbs中制备的。将mcf-10a、mcf-7、mda-mb-231、ccd-18co、ht-29和hct-116细胞接种到6孔板中,每孔105个细胞,每孔含3ml培养基,培养板在37℃下过夜孵育。第二天,将培养基更换为含有fitc肽(1μm)的新鲜无fbs培养基(1ml),并在37℃下进一步孵育30分钟。此后,除去培养基,用冷pbs洗涤细胞以除去任何残留的肽。此后,除去培养基,用冷pbs洗涤细胞以除去任何残留的肽。向每个孔中加入足够的胰蛋白酶/edta,然后在37℃下孵育3至5分钟。立即加入培养基中和胰蛋白酶/edta,将细胞悬液转移至离心管中。分离细胞并用pbs洗涤两次。将对照细胞进行类似的处理但不使用肽。用facscanto ii(美国bd biosciences公司)流式细胞仪分析制备的细胞。使用flowjo(treestar)分析facs数据。
[0155]
实例1-8:生物素拉下实验
[0156]
将细胞裂解物(500μg/ml)与生物素化的agm-330(500ng/ml)在4℃下孵育12小时,然后通过链霉亲和素珠(赛默飞世尔科技公司,美国伊利诺斯州罗克福德)在室温下进行1小时拉下实验。温育后,用洗涤缓冲液洗涤珠子3次。然后,将洗脱缓冲液加入到珠子中,从珠子中提取蛋白质,最后通过sds-page进行分析。为了鉴定和表征生物素拉下实验中获得的蛋白质,在proteometech公司(韩国首尔)进行了lc耦合esi-ms/ms分析。
[0157]
实例1-9:agm-330结合域的鉴定
[0158]
ncl构建体,包括gfp-ncl(残基1-710)、gfp-δn-ncl(残基322-710)和gfp-δc-ncl(残基1-321)从人ncl cdna克隆(addgene)产生并亚克隆到pegfp-c2载体(addgene)的xhoi和bamhi位点。根据制造商的建议,这些载体通过lipofectamine 2000(英杰公司(invitrogen),美国加利福尼亚州卡尔斯巴德)转染到细胞中。将生物素化的agm-330肽添加到链霉亲和素珠(赛默飞世尔科技公司)中,并将混合物在室温下振荡孵育1小时。用洗涤缓冲液将珠子洗涤3次。洗涤后,将珠子添加到由含有gfp标记的ncl蛋白的转染细胞裂解物制备的裂解物(300μl)中。将反应混合物在4℃下孵育12小时,以允许agm-330和gfp标记的ncl蛋白结合。随后用洗涤缓冲液洗涤珠子。然后,将等体积的2x电泳样品缓冲液添加到珠
子中,并通过在95℃下加热5分钟从珠子中提取蛋白质。然后,最后通过sds-page和免疫印迹分析对蛋白质进行分析。
[0159]
实例1-10:从jurkat细胞中纯化ncl
[0160]
通过在以下试剂中在4℃下进行1小时裂解1.0x 109个jurkat细胞来制备ncl:25ml的20mm三羟甲基氨基甲烷盐酸盐(tris/hcl)、ph 7.5、150mm nacl、5mm mgcl2、5mmβ-巯基乙醇、0.5%(体积比)曲拉通x-100(triton x-100)、1mm马立马司他(adooq生物科技公司(adooq bioscience),美国加利福尼亚州尔湾)和蛋白酶抑制剂混合物(cocktail)(millipore公司,美国马萨诸塞州比尔里卡)。1200xg离心5分钟使细胞核沉淀,然后将上清液以12,000xg离心30分钟,然后在-80℃下储存。使用快速两步色谱法从无核提取物中纯化ncl。所有步骤均在4℃下进行,使用包含1mm马立马司他和完整蛋白酶抑制剂混合物的冰冷却的缓冲液和柱。用20mm磷酸钠(ph 7.0)将jurkat细胞的胞质溶胶提取物(25ml)稀释10倍,并使其通过5ml mono q 5/50gl色谱柱(西格玛奥德里奇公司)。用150ml 20mm磷酸钠、ph 7.0洗涤柱子后,用10ml含有1m nacl的相同缓冲液洗脱吸附的蛋白质。用50mm tris/hcl、ph 7.9、5mm mgcl2、0.1mm edta、1mmβ-巯基乙醇(缓冲液a)将洗脱液稀释10倍,并装载到用相同的缓冲液平衡的1ml的hifiq肝素hp柱(英国protein ark公司)。用20ml含0.2m硫酸铵的缓冲液a洗涤凝胶,用2ml含0.6m硫酸铵的缓冲液a将蛋白质洗脱成50μl级分。收集ncl并针对含有1mm马立马司他的pbs在4℃下透析2小时,然后储存在-80℃下。对用考马斯蓝染色的10% sds丙烯酰胺凝胶的进一步控制证实了纯化的ncl作为单个105kda蛋白质条带的存在。观察到两个70和50kda蛋白质条带,对应于ncl的部分降解产物,其含量低于总蛋白质的10%。
[0161]
实例1-11:结合亲和力
[0162]
通过spr(表面等离子体共振)光谱(biacore t-200)测试结合亲和力。将重组核仁蛋白固定在cm5传感器芯片上,并用不同浓度(20nm至2.5μm)的agm-330进行处理。分析每个样品的传感图以确定kd值。
[0163]
实例1-12:蛋白质分离和蛋白质印迹分析
[0164]
在含有蛋白酶抑制剂混合物(millipore公司)的ripa缓冲液(20mm tris-hcl,ph 7.5、200mm nacl和0.5% triton x-100)中裂解细胞。按照制造商的方案,使用蛋白质测定试剂盒(bio-rad公司)测量蛋白质浓度。对总蛋白进行sds-page并转移到聚偏二氟乙烯膜上。用针对ncl(abcam公司)和gfp(abcam公司)的一抗检测印迹。作为上样对照,使用了抗-β-肌动蛋白抗体(santa cruz生物科技公司(santa cruz biotechnology))、抗-p-钙粘蛋白(abcam公司)和核纤层蛋白a/c抗体(abcam公司)。随后,将印迹在tbst缓冲液(10mm tris-hcl、50mm nacl和0.25% tween-20)中进行洗涤,并与辣根过氧化物酶偶联的二抗一起孵育。使用增强型化学发光试剂(赛默飞世尔科技公司)检测目标蛋白的存在。
[0165]
实例1-13:免疫荧光染色
[0166]
将mda-mb-231-luc异种移植组织经福尔马林固定和石蜡包埋以用于免疫荧光染色。将细胞接种在聚-l-赖氨酸和i型胶原蛋白涂层的盖玻片上,并用4%福尔马林进行固定。组织载玻片和细胞用0.1% triton x-100透化并用2%bsa(西格玛奥德里奇公司)封闭。如前所述使用抗ncl(1:200)、抗tunel(1:200)和抗ki-67(1:500)一抗进行染色。所有细胞核都用dapi复染。免疫荧光图像与h&e染色图像相匹配。
[0167]
实例1-14:小干扰rna(sirna)介导的敲低(knockdown)
[0168]
靶向ncl的sirna(ncbi数据库中的nm_005381.3)和随机打乱序列的sirna(scramble sirna(scr))购自bioneer公司(韩国大田)。为了有效的ncl转染,根据制造商的方案使用lipofectamine 2000(英杰公司)进行sirna转染。使用了三种不同的sirna序列,并通过实时pcr评估它们的效率。
[0169]
sincl1:(正义链)5
’‑
gagcuaacccuuaucugua(dtdt)-3’(seq id no:21)
[0170]
(反义链)5
’‑
uacagauaaggguuagcuc(dtdt)-3’(seq id no:22)
[0171]
sincl2:(正义链)5
’‑
cacaaggaaagaagacgaa(dtdt)-3’(seq id no:23)
[0172]
(反义链)5
’‑
uucgucuucuuuccuugug(dtdt)-3’(seq id no:24)
[0173]
sincl3:(正义链)5
’‑
gacgaaguuugaauagcuu(dtdt)-3’(seq id no:25)
[0174]
(反义链)5
’‑
aagcuauucaaacuuc guc(dtdt)-3’(seq id no:26)
[0175]
根据rt-qpcr分析确定的mrna水平选择最有效的sirna,并通过蛋白质印迹分析验证所得蛋白质水平。
[0176]
实例1-15:实时pcr
[0177]
使用rnaiso(takara公司,日本滋贺)提取总rna,并通过测量260/280的吸光度比值来验证rna纯度。使用primescript
tm
第一链cdna合成试剂盒(takara公司,日本滋贺)合成第一链cdna,每个pcr混合物都由十分之一的cdna与powergreen pcr master mix(美国应用生物系统公司)混合形成。使用steponeplus实时pcr系统(美国应用生物系统公司)进行实时pcr。将所选基因的相对mrna表达标准化为β-肌动蛋白的表达,并使用ddct方法进行量化。pcr引物的序列如下表6中所示。【表6】引物序列seq id no.ncl(正向)aaagtgccccagaacccaca27ncl(反向)tggctgacttctcgcattagg28β-肌动蛋白(正向)gagcaatgatcttgatcttca29β-肌动蛋白(反向)agatgagtatgcctgccgtg30
[0178]
实例1-16:抗体中和试验
[0179]
将癌细胞系和正常细胞系以1
×
104细胞/孔接种于含有100μl培养基的96孔板中,并将板在37℃下过夜孵育。过夜孵育后,在不存在或存在抗ncl抗体(cell signaling technology公司,美国马萨诸塞州贝弗利)的情况下,将细胞在37℃下孵育24小时过夜。孵育后,根据制造商的说明,通过cellvia wst-1测定法(young in frontier公司,韩国首尔)评估细胞活性。
[0180]
实例1-17:细胞凋亡试验(annexin v)
[0181]
使用annexin v-异硫氰酸荧光素(fitc)凋亡检测试剂盒i(bd biosciences公司)对凋亡细胞进行定量评估。收集细胞并用冷pbs洗涤两次,然后重悬于结合缓冲液(1
×
106个细胞/ml)中。接着,将100μl悬浮液转移到管中并与5μl的fitc annexin v和碘化丙啶(pi)混合。然后,在轻微涡旋后,将混合物在室温下在黑暗中孵育15分钟。孵育后,加入400μl的1
×
结合缓冲液,用流式细胞仪检测细胞。
[0182]
实例1-18:细胞增殖试验
[0183]
将癌细胞和正常细胞(1
×
104细胞/孔)接种在96孔板中。孵育24小时后,用浓度递增的agm-330、ptx和agm-330-ptx处理细胞48小时。根据制造商的说明,通过cellvia wst-1测定法(young in frontier公司)评估细胞活性。使用versamax elisa酶标仪(molecular devices公司)在450nm的波长下测量活细胞的数量。
[0184]
实例1-19:肿瘤发生实验
[0185]
所有动物实验均按照iacuc指南(gist-2019-040)进行。对于肿瘤发生实验,麻醉的6周龄雌性nod-scid il2rg-/-小鼠(npg
tm
,vitalstar公司)在乳腺脂肪垫中接种1
×
106mda-mb-231-luc细胞,体积为100μl(每组n=5~6)。接种肿瘤细胞后,当肿瘤体积达到约100mm3时,将小鼠随机分为以下五组:(i)对照组,(ii)低剂量太平洋紫杉醇(2mg/kg),(iii)高剂量太平洋紫杉醇(10mg/kg)、(iv)agm-330(16.68mg/kg或8.34mg/kg)和(v)agm-330-ptx(19.05mg/kg或10.71mg/kg)。每周测量两次肿瘤大小,肿瘤体积计算公式如下:
[0186]
体积(mm3)=(长度(mm))
×
(宽度(mm))2x 0.5。
[0187]
针对生物发光成像实验,将d-萤光素(150mg/kg;珀金埃尔默公司)经由腹膜内注射到每只小鼠中,并且使用ivis 100成像系统(xenogen公司,美国加利福尼亚州阿拉米达)进行生物发光监测。用汽化异氟醚(bk pharm公司,韩国一山)麻醉小鼠并放置在成像室中。10分钟后,以1分钟的曝光时间对每只动物成像。所有生物发光图像数据均由living image软件(版本4.5.2,珀金埃尔默公司)提供。从肿瘤检测到的光子被转换为平均辐射值(光子/秒/cm2/sr),平均辐射值为从强度区域(roi)获得的定量数据,包括从每只老鼠生物全身的指定矩形区域内的发光细胞发射的光子。
[0188]
实例1-20:生物信息学
[0189]
使用oncomine cancer microarray数据库(http://www.oncomine.org/)分析正常乳腺和结肠组织以及乳腺癌和结肠腺癌组织中ncl的表达水平。这些基因表达数据经过log2转换并以中位数为中心。所有图表和统计值均通过graphpad prism 5.0进行分析,通过双尾学生t检验计算p值(p《0.05)。使用r2平台生成卡普兰一梅尔(kaplan-meier)图,并根据乳腺癌和结肠肿瘤中的ncl表达水平对患者进行分组。
[0190]
实例1-21:统计分析
[0191]
所有统计数据表示为平均值
±
sd(n=3)。两组之间的统计比较由学生t检验确定,多组之间的比较由单向方差分析和dunnett多重比较确定。在体内实验的情况下,小鼠的数量显示在每个图例中。使用对数秩检验进行卡普兰一梅尔分析。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0192]
实例2:通过oboc组合筛选和map合成方法鉴定和表征癌症靶向肽配体
[0193]
为了鉴定新型癌症特异性肽配体,本发明人使用5g的tentagel mb nh2树脂(200μm,520,000珠/g;图3)合成了约2,600,000个库。将珠子上的肽库(一次使用50,000至100,000个珠子)与人乳腺癌细胞系(mda-mb-231)混合。总共筛选了约1,000,000个珠子,检测到8个阳性珠子并分离出来用于微测序。这8种肽中的三种(agm-330、agm-331和agm-332)显示出与mda-mb-231的强烈优先结合,并且显示出未与人正常乳腺细胞系mcf-10a结合或仅有微弱结合(图4a和图4b)。然后,将这3种肽用异硫氰酸荧光素(fitc)标记,并确定它们是否能与mda-mb-231细胞结合。与agm-331和agm-332相比,agm-330检测到最强的荧光信号(图4c)。为了确认珠上细胞生长试验和荧光成像的筛选结果,在tentagel mb nh2树脂上重新
合成了agm-330。珠上细胞生长试验表明,agm-330珠在15分钟内被人乳腺癌细胞系(mcf7和mda-mb-231)和人结肠癌细胞系(ht-29和hct-116)完全覆盖(图4d)。相比之下,agm-331和agm-332相对地非特异性,与人正常乳腺细胞系mcf-10a和人正常结肠细胞系ccd-18co结合。此外,agm-330与mcf-10a或ccd-18co细胞结合非常弱或根本不结合,使它们成为成像和治疗性靶向剂的优秀候选者。
[0194]
迄今为止,肽作为治疗药物的用途在很大程度上受到其低稳定性的限制:肽主要在体内被蛋白酶和肽酶分解(bottger r等人,plos one.2017;12:e0178943)。在本发明中,为了提高肽配体的稳定性,合成了map树状形式的agm-330,由于对蛋白酶和肽酶活性的获得性抗性,它可以表现出增强的稳定性。agm-330的合成(图4e)在20%哌啶和dmf的存在下从fmoc-cys(trt)wang树脂(1)和fmoc-lys(fmoc)-oh开始,以提供赖氨酸核心偶联的wang树脂(2、3)。然后,在20%哌啶的存在下,通过用rhgamvylk-peg12-oh处理生成fmoc和trt保护的agm-330(4)。使用哌啶的dmf溶液快速去除agm-330(4)中的fmoc和trt保护基,生成agm-330(5)。
[0195]
为了增强所选肽配体agm-330的体内稳定性和结合亲和力,通过map(多抗原肽)合成法将其合成为二聚体和四聚体形式。
[0196]
为了评估肽的稳定性是否增强,分析了肽的体内半衰期。向c57bl/6小鼠尾静脉注射2mg/kg的agm-330m、agm-330d或agm-330t,立即将血清中剩余的肽部分用抗agm-330抗体固定在elisa板上。使用versamax elisa酶标仪(molecular devices公司)在450nm波长下测量吸光度,并使用phoenix winnonlin 8.1(pharsight公司,美国加利福尼亚州山景城)程序分析药代动力学。分析结果表明,agm-330m、agm-330d和agm-330t的半衰期(t
1/2
)分别为0.42
±
0.33小时、1.82
±
0.36小时和9.43
±
1.21小时,并且所有肽在血液中的最大浓度时间(t
max
)均为0.167小时。最大血药浓度(c
max
)分别为1.27
±
0.12μg/ml、1.71
±
0.11μg/ml和1.875
±
0.67μg/ml,曲线下面积(auc)分别为0.64
±
0.09μg/h/ml、1.77
±
0.12μg/h/ml和21.42
±
0.81μg/h/ml(图5)。结果证实四聚体agm-330(agm-330t)比单体或二聚体肽具有更高的稳定性。
[0197]
随后,为了检查map配体是否可以选择性地结合癌细胞,将用fitc标记的agm-330(agm-330-fitc)处理过的癌细胞与未处理的细胞进行比较。agm-330-fitc与细胞(1
×
105)在无血清培养基中在37℃下孵育2小时,以保持偶联物完整。然后,基于与未处理细胞相比的平均荧光强度(mfi)值的变化来比较和测量经肽处理的细胞的固有荧光(图4f)。结果表明,如经处理的细胞相对于未处理的细胞的mfi增加所证明的,agm-330-fitc显示出与mcf-7、mda-mb-231、ht-29和hct-116的显著的癌细胞结合。相比之下,在孵育2小时后,相比偶联物与癌细胞的结合,其与正常细胞(包括mcf-10a和ccd-18co)的结合显著降低。
[0198]
为了检查agm-330是否具有细胞毒性,本发明人评估了多种癌细胞(包括mcf-7、mda-mb-231、ht-29和hct-116)和正常细胞(包括mcf-10a和ccd-18co)中的ic
50
值。agm-330t和agm-330d的ic
50
值在所有细胞系中均大于100μm(图6)。这表明agm-330不会明显影响癌症和正常细胞系的细胞活性。总之,这些数据表明agm-330可用于靶向癌细胞而不影响靶细胞活性。
[0199]
实例3:ncl-癌细胞生长的有效调节剂-是agm-330的潜在靶标
[0200]
为了鉴定agm-330的未知靶蛋白,采用亲和柱层析和基于质谱的蛋白质组学方法
从mda-mb-231细胞的细胞裂解物中鉴定agm-330的相互作用蛋白(图7a)。在亲和柱层析之后,sds-page分析揭示了几个不同的蛋白质条带(从55至100kda),它们仅存在于洗脱级分中(图7b)。使用lc-ms/ms分析鉴定了六种蛋白质,对这些切除条带的肽鉴定表明,在100kda处的主要蛋白质条带之一被表征为核仁素(ncl)。ncl由710个氨基酸组成,通过lc-ms/ms分析鉴定出的22个不同的肽片段与ncl的氨基酸序列匹配(总分881,对ncbi数据库中人类ncl的序列覆盖率为24%(登录号:gi189306;图7c和图7d)。此外,使用抗ncl抗体的免疫印迹分析进一步证实了agm-330亲和柱的洗脱物中的ncl富集(图7e)。因此,蛋白质组学研究结果表明ncl是agm-330的相互作用蛋白。
[0201]
为了检查agm-330对ncl的结合亲和力,使用agm-330进行了spr(表面等离子体共振)测试。如图8所示,确认kd值约为57.7nm,表明agm-330对ncl具有非常高的结合亲和力。
[0202]
为了研究涉及agm-330和ncl之间相互作用的结构域,本发明人使用了生物素拉下测定法。生物素化的agm-330(agm-330-生物素)被用作诱饵来下拉ncl突变体。产生了几个ncl的缺失突变体。从通过编码野生型ncl和各种ncl突变体的表达载体(包括ncl1(1-710)、ncl2(323-710)和ncl3(1-322))转染的hek293t细胞制备细胞提取物,它们均与gfp融合。agm-330-生物素拉下了野生型ncl1(1-710)和ncl3(1-322)但未拉下ncl3(323-710)(图7f)。这些结果表明,ncl的n末端区域(1-322)对于其与agm-330的结合很重要。为了进一步证实agm-330和ncl之间的直接相互作用,使用纯化的ncl和agm-330-生物素进行生物素拉下实验。使用抗-ncl抗体获得的免疫印迹分析结果显示ncl富集在洗脱级分中(图9)。
[0203]
综上所述,这些结果表明agm-330直接与ncl相互作用。
[0204]
实例4:鉴定agm-330和ncl相互作用所必需的氨基酸残基
[0205]
将癌细胞(1
×
104个细胞/孔)在96孔板中培养24小时。将agm-330和表2所示的12种聚乙二醇化(peg化)肽进行生物素偶联,将细胞用浓度递增的13种肽处理2小时。
[0206]
接着,通过高亲和力的亲和素-生物素相互作用连接亲和素-hrp,并通过hrp酶将tmb底物转化为蓝色。然后,通过加入酸来终止反应,并通过elisa通过在450mm处读取孔来评估13种肽的亲和力。
[0207]
图10示出了13种聚乙二醇化肽的吸光度。seq id no:9、10、11和14的四种肽显示出与agm-330相似的吸光度。此外,seq id no:12、13、15和20的四种肽显示出比agm-330更高的吸光度。用亮氨酸或正亮氨酸取代位置(m5)上的甲硫氨酸残基、用苯丙氨酸取代位置7(y7)上的酪氨酸残基、在c末端插入重复的亮氨酸(l)和赖氨酸(k)残基增加了结合亲和力。这表明用疏水性氨基酸取代m5和y7残基或在c末端插入l和k可以增加结合亲和力。
[0208]
然而,seq id no:16至19的肽显示出比agm-330更低的吸光度。位置1(r1)精氨酸和位置2(h2)的组氨酸残基的缺失、n末端处重复的精氨酸(r)和组氨酸(h)残基的插入以及反向序列降低了结合亲和力。这表明应该保留序列的方向性,包括r1和h2。
[0209]
实例5:agm-330在体外和体内特异性结合癌细胞
[0210]
本发明人使用荧光显微镜通过针对不同细胞系的细胞结合测定评估了agm-330对ncl的特异性。该实验使用多种癌细胞系(mcf-7、mda-mb-231、ht-29和hct-116)以及正常细胞系(mcf-10a和ccd-18co)进行。在将细胞与5μmol/l agm-330-fitc孵育1小时后,通过共聚焦成像确定结合特异性。将细胞与dapi一起孵育以对细胞核进行复染(蓝色荧光)。用与ncl的n末端结构域结合的抗ncl抗体和agm-330-fitc进行的双重免疫荧光染色揭示了ncl
visualization platform(http://r2.amc.nl)”)(图13b),这与之前显示高ncl表达作为乳腺癌和结肠癌患者的不良预后标志的报告一致(van long fn等人,cancers.2018;10:390)。为了确定人类癌症和正常组织中ncl表达的分布,本发明人通过免疫组织化学(ihc)分析分析了ncl表达。与免疫荧光成像(图11a和图11b)和蛋白质印迹(图11c)的结果一致,ihc结果显示,与在正常乳腺和结肠组织中观察到的那些相比,ncl水平在人乳腺癌和结肠癌组织的细胞膜和细胞质区域中也增加了(图13c和图13d)。此外,先前的报告显示,升高的膜ncl作为参与癌症增殖和抑制细胞凋亡的配体的受体进行相互作用(chen sc等人,oncotarget.2015;6:16253-70)。因此,为了检查膜表达的ncl是否对调节癌细胞的功能至关重要,本发明人在体外对mda-mb-231和hct-116细胞以及mcf-10a和ccd-18co细胞使用了单克隆抗ncl抗体中和膜表达的ncl。首先,对用不同浓度的抗体处理了24小时的正常细胞和癌细胞进行细胞活性评估。与对照组和igg处理组相比,用ncl抗体(50μg/ml)进行处理导致mda-mb-231和hct-116细胞的细胞活性分别降低了35%和32%,但在正常细胞中未观察到显著降低(mcf-10a和ccd-18co)(图13e至图13h)。此外,进行了细胞凋亡测定以调查抗ncl抗体对癌细胞的细胞毒性作用的原因。用不同浓度的抗体处理mda-mb-231和hct-116细胞,24h后使用annexin v和pi染色。流式细胞术结果表明,早期和晚期凋亡阶段的癌细胞百分比的增长对抗ncl抗体剂量具有依赖性(图13i)。
[0216]
本发明人证实了,ncl在各种类型的癌症的细胞膜和细胞质中过度表达,并且ncl过度表达与癌症患者的不良预后生存相关。这些结果证明了ncl膜部分在癌细胞中的重要作用,特别是在控制癌细胞增殖和凋亡方面。综上所述,这些结果表明ncl在癌症生长中起着重要作用,靶向膜ncl可能是用化疗药物治疗癌症的有前景的生物标志物。
[0217]
实例7:确认太平洋紫杉醇偶联的agm-330在体外和小鼠异种移植模型中抑制癌症生长的作用
[0218]
太平洋紫杉醇(ptx)与agm-330(agm-330-ptx)偶联以获得与公认的化疗剂连接的癌症靶向配体。ptx适用于与马来酰亚胺-羧基双功能接头的正交缀合。为了检查agm-330-ptx是否抑制癌细胞增殖,本发明人评估了其在多种癌细胞系(包括mcf-7、mda-mb-231、ht-29和hct-116细胞)中的ic
50
值(图14a)。在mda-mb-231细胞中,使用单独的ptx和使用agm-330t-ptx的ic
50
值分别为6.8和3.6μm。
[0219]
在对癌细胞系进行体外增殖分析后,本发明人研究了agm-330t-ptx是否可以作为潜在的体内治疗剂。将mda-mb-231-luc细胞接种到npg小鼠的乳腺脂肪垫中。在皮下肿瘤长到100mm3后,将动物分成五组(n=5/组)进行比较疗效研究,每周两次分别通过尾静脉注射载体(pbs)、agm-330t(16.68mg/kg)、ptx(2或10mg/kg)或agm-330t-ptx(19.05mg/kg)(图14b)。通过在3周的过程中使用卡尺每周两次测量肿瘤体积来监测肿瘤生长。与体外实验一致,经载体(pbs)处理的小鼠和经agm-330处理的小鼠在平均肿瘤体积方面没有显著差异。然而,相较于使用相同剂量ptx处理的动物的肿瘤体积(2mg/kg的为1671
±
199mm3,n=5,p《0.001),使用agm-330t-ptx处理的小鼠的平均肿瘤体积减少了约52%(19.05mg/kg的为807
±
90mm3,n=5)。此外,在第21填,与经剂量增加5倍的ptx治疗的小鼠(988
±
78mm3,10mg/kg,n=5,p《0.05)相比,经agm-330t-ptx治疗的小鼠显示出增强的药效(图14c和图14d)。与上述结果一致,与注射ptx的小鼠的平均肿瘤重量(2mg/kg和10mg/kg治疗组分别为2.1
±
0.4和1.5
±
0.1g;n=5)相比,注射agm-330t-ptx的小鼠的平均肿瘤重量显著降低(19.05mg/kg
的为1.3
±
0.1g,n=5)(图14e)。
[0220]
本发明人还对切除的肿瘤进行了组织学染色,并由独立的病理学家评估载玻片。分别如h&e染色、ki-67和tunel测定所证明的,从agm-330t-ptx处理的小鼠中切除的中位肿瘤表现出癌细胞数量的减少和凋亡细胞核的增加(图14f至图14i)。相比之下,载体(pbs)和agm-330t处理的肿瘤含有更多的肿瘤细胞,并且几乎没有细胞凋亡的迹象。此外,与载体(pbs)给药相比,小鼠体重不受agm-330t-ptx给药的影响,并且血液化学分析结果显示在agm-330t-ptx处理的小鼠中没有不良毒性迹象(图15a至图15f)。因此,这些发现表明agm-330的肿瘤特异性可以增强ptx的功效而没有可检测到的副作用。结果表明,根据本发明的agm-330可以作为用于癌症治疗的潜在治疗药物载体。
[0221]
此外,为了降低peg化免疫原性的影响,本发明人使用agm-330d-ptx测试了抗癌功效,其peg化程度低于agm-330t(图16a)。结果显示,与在ptx处理的小鼠中观察到的相比,通过agm-330d-ptx处理的小鼠显示出的荧光素酶活性显著降低(图16c和图16d)。此外,与在ptx治疗组中观察到的相比,agm-330d-ptx治疗导致肿瘤的体积和重量显著减少(图16e至图16g)。与使用agm-330-ptx获得的结果一致,与在经载体(pbs)处理的小鼠中观察到的相比,小鼠体重不受agm-330d-ptx给药的影响(图16h)。agm-330d的癌症特异性可能增强了ptx的疗效,增加了肿瘤组织中的治疗药物浓度。
[0222]
实例8:合成agm-330与cpp融合的融合肽
[0223]
为了增加agm-330的细胞穿透能力,通过融合细胞穿膜肽(cpp)产生融合蛋白。
[0224]
当agm-330t与马来酰亚胺偶联cpp(rimrilrilklar;seq id no:48)在ph7.0至7.5发生反应时,agm-330t的官能团——硫醇基,通过硫醇-马来酰亚胺反应结合到agm-330t,从而合成agm-330t-mcpp融合肽(图17)。
[0225]
对产生的agm-330t-mcpp融合肽进行hplc和ms分析的结果确认了该融合蛋白的保留时间(retention time,rt)为23.2分钟,分子量为7,876da。图18显示了融合肽的分析结果以及agm-330t和马来酰亚胺-mcpp的分析结果。
[0226]
实例9:agm-330与cpp融合的融合肽的细胞毒性评估
[0227]
为了检测实例8中产生的agm-330t-mcpp融合肽的细胞毒性,本发明人评估了其在多种癌细胞系(包括mcf-7、mda-mb-231、ht-29、hct-116和panc-1)以及正常细胞系(ccd-18co)中的ic
50
值(表7)。【表7】细胞类型细胞系ic
50
(μm)人乳腺癌细胞系mcf-77.173人乳腺癌细胞系mda-mb-231》20人结肠癌细胞系ht-297.829人结肠癌细胞系hct-1164.714人胰腺癌细胞系panc-1》20人结肠正常细胞系ccd-18co》20
[0228]
agm-330t-mcpp融合肽对结肠癌细胞系ht-29和hct-116的ic
50
值分别为7.829和4.714μm,对乳腺癌细胞系mcf-7和mda-mb-231的ic
50
值分别为7.173和超过20μm(图19)。这意味着agm-330t-mcpp融合肽具有癌细胞特异性抑制作用。
[0229]
实例10:agm-330与cpp融合的融合肽癌细胞凋亡诱导作用的体外评估
[0230]
为了研究实例8产生的agm-330t-mcpp融合肽的癌细胞凋亡诱导作用,使用了hct-116、ht-29和ccd-18co细胞,经cpp、agm-330t和agm-330t-cpp处理48小时,分别用annexin v和pi染色。结果证实了其癌细胞特异性细胞凋亡诱导作用(图20)。在不同浓度的agm-330t-mcpp下进行的实验证实了细胞凋亡促进蛋白的增长的浓度依赖性(图21)。
[0231]
实例11:agm-330和agm-330-cpp联合使用效果评价
[0232]
为了研究实例8中产生的agm-330m-mcpp、agm-330d-dcpp和agm-330t-tcpp融合肽各自及其组合的细胞毒性,本发明人评估了它们在hct-116、ht-29、mcf-7和mda-mb-231细胞系中的ic
50
值。
[0233]
agm-330m-mcpp、agm-330d-dcpp和agm-330t-tcpp融合肽对于结肠癌细胞系hct-116的ic
50
值分别为23.3、5.47和3.79μm,对于ht-29分别为20.67、3.75和3.3μm。此外,对乳腺癌细胞系mcf-7的ic
50
值分别为》20、4.208和3.802μm,对mda-mb-231的ic
50
值分别为》20、3.843和3.497μm(图22)。因此,可以确认agm-330-cpp融合肽具有癌细胞特异性抑制作用。
[0234]
agm-330m和agm-330m-mcpp融合肽的组合、amg-330d和agm-330d-dcpp融合肽的组合以及agm-330t和agm-330t-tcpp融合肽的组合的对于结肠癌细胞系hct-116的ic
50
值分别为14.3、4.25和3.15μm,对于ht-29分别为14.2、4.76和3.05μm。此外,它们对乳腺癌细胞系mcf-7的ic
50
值分别为18.7、3.416和3.309μm,对mda-mb-231的ic
50
值分别为14.7、3.662和3.258μm(图23)。因此,可以确认agm-330和agm-330-cpp的组合也表现出癌细胞特异性抑制作用。
[0235]
工业实用性
[0236]
在本发明中,已经证实使用map合成方法和oboc组合方法筛选的agm肽配体及其变体特异性结合癌细胞,并且其与抗癌剂的偶联物抑制癌症生长(体外和体内)。因此,靶向ncl的agm可有效用于癌症诊断和癌症治疗中的靶向药物递送。
[0237]
尽管结合具体特征对本发明进行了详细描述,但是对于本领域技术人员来说显而易见的是,该描述仅是对其优选实施例的描述,并不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1