用于治疗肝硬化的配体结合的金团簇,组合物和方法与流程
用于治疗肝硬化的配体结合的金团簇,组合物和方法
1.本技术是cn113398279a(申请日为2020年10月28日、申请号为2020111723118、发明创造名称为用于治疗肝硬化的配体结合的金团簇,组合物和方法)的分案申请。
技术领域
2.本发明涉及肝硬化治疗技术领域,尤其涉及用于治疗肝硬化的配体结合的金团簇,包含配体结合的金团簇的组合物和使用配体结合的金团簇治疗肝硬化方法。
背景技术:
3.肝脏是人体最大的实体器官,并具有许多重要功能,其中包括:制造有助于凝血,输送氧气和帮助免疫系统的血液蛋白质;以及储存多余的营养物质并将部分营养物质返回血液;制造胆汁以帮助消化食物;帮助人体以糖原形式储存糖(葡萄糖);清除体内有害物质,包括毒品和酒精;分解饱和脂肪并产生胆固醇。
4.肝硬化是一种缓慢进行性疾病,由于长期,持续的肝脏损害而发展多年。随着肝硬化的发展,健康的肝脏组织逐渐被破坏,并被疤痕组织所取代。这些疤痕组织会阻止血液流经肝脏,并减慢肝脏处理营养物质,激素,药物和天然毒素的能力。它还减少了肝脏产生的蛋白质和其他物质的产生。肝硬化可能最终导致可能需要进行肝移植肝衰竭和/或肝癌。
5.肝硬化早期,肝代偿功能强,无明显症状。晚期症状包括肝功能损害、门脉高压、上消化道出血、肝性脑病、继发感染、脾脏功能亢进、腹水、癌变等并发症。肝脏逐渐变形和硬化,发展为肝硬化。在组织病理学上,肝硬化表现为广泛的肝细胞坏死,残留肝细胞的结节状再生,结缔组织增生和纤维间隔形成,导致肝小叶结构的破坏和假小叶的形成。
6.肝硬化有不同的原因。一些肝硬化患者有多种原因造成肝损害。肝硬化的常见原因包括长期酗酒、慢性乙型和丙型肝炎感染、脂肪肝疾病、有毒金属、遗传性疾病、营养失调、工业毒物、药物、血液循环失调、代谢失调、胆汁淤积、血吸虫病等等。
7.肝硬化可以通过许多测试/技术来诊断。例如,如果包括丙氨酸转氨酶(alt),天冬氨酸转氨酶(ast)和碱性磷酸酶(alp)的肝酶和胆红素的水平升高而血液蛋白的水平降低,则血液检查可能提示肝硬化。
8.当前,尽管治疗可以通过消除导致肝硬化的原因来延缓其发展,但尚无针对肝硬化的具体疗法。
技术实现要素:
9.本发明提供配体结合的金团簇在治疗患者肝硬化中的用途,利用配体结合的金团簇治疗患者肝硬化的方法,和配体结合的金团簇在制备治疗患者肝硬化的药物中的用途。
10.本发明的一些实施方案利用配体结合的金团簇治疗患者肝硬化;其中所述配体结合的金团簇包含金核,和与金核结合的配体。
11.在该治疗用途的一些实施方案中,金核的直径为0.5-3nm。在一些实施方案中,金核的直径为0.5-2.6nm。
12.在该治疗用途的一些实施方案中,配体是选自l-半胱氨酸及其衍生物、d-半胱氨酸及其衍生物、含半胱氨酸的寡肽及其衍生物、和其他含硫醇化合物中的一种。
13.在该治疗用途的一些实施方案中,l-半胱氨酸及其衍生物选自l-半胱氨酸、n-异丁酰基-l-半胱氨酸(l-nibc)和n-乙酰基-l-半胱氨酸(l-nac),d-半胱氨酸及其衍生物选自d-半胱氨酸、n-异丁酰基-d-半胱氨酸(d-nibc)和n-乙酰基-d-半胱氨酸(d-nac)。
14.在该治疗用途的一些实施方案中,含半胱氨酸的寡肽及其衍生物是含半胱氨酸的二肽、含半胱氨酸的三肽或含半胱氨酸的四肽。
15.在该治疗用途的一些实施方案中,含半胱氨酸的二肽选自l(d)-半胱氨酸-l(d)-精氨酸二肽(cr)、l(d)-精氨酸-l(d)-半胱氨酸二肽(rc)、l(d)-组氨酸-l(d)-半胱氨酸二肽(hc)和l(d)-半胱氨酸-l(d)-组氨酸二肽(ch)。
16.在该治疗用途的一些实施方案中,含半胱氨酸的三肽选自甘氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(gcr)、l(d)-脯氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(pcr)、l(d)-赖氨酸-l(d)-半胱氨酸-l(d)-脯氨酸三肽(kcp)和l(d)-谷胱甘肽(gsh)。
17.在该治疗用途的一些实施方案中,含半胱氨酸的四肽选自甘氨酸-l(d)-丝氨酸-l(d)-半胱氨酸-l(d)-精氨酸四肽(gscr)和甘氨酸-l(d)-半胱氨酸-l(d)-丝氨酸-l(d)-精氨酸四肽(gcsr)。
18.在该治疗用途的一些实施方案中,其他含硫醇的化合物选自1-[(2s)-2-甲基-3-硫醇-1-氧代丙基]-l(d)-脯氨酸、硫代乙醇酸、巯基乙醇、苯硫酚、d-3-巯基缬氨酸、n-(2-巯基丙酰基)-甘氨酸和十二烷基硫醇。
[0019]
本发明的一些实施方案使用配体结合的金团簇来制备用于治疗受试者肝硬化的药物,其中所述配体结合的金团簇包含金核,和与金核结合的配体。
[0020]
在该制备用途的一些实施方案中,金核的直径为0.5-3nm。在一些实施方案中,金核的直径为0.5-2.6nm。
[0021]
在该制备用途的一些实施方案中,配体是选自l-半胱氨酸及其衍生物、d-半胱氨酸及其衍生物、含半胱氨酸的寡肽及其衍生物、和其他含硫醇化合物中的一种。
[0022]
在该制备用途的一些实施方案中,l-半胱氨酸及其衍生物选自l-半胱氨酸、n-异丁酰基-l-半胱氨酸(l-nibc)和n-乙酰基-l-半胱氨酸(l-nac),d-半胱氨酸及其衍生物选自d-半胱氨酸、n-异丁酰基-d-半胱氨酸(d-nibc)和n-乙酰基-d-半胱氨酸(d-nac)。
[0023]
在该制备用途的一些实施方案中,含半胱氨酸的寡肽及其衍生物是含半胱氨酸的二肽、含半胱氨酸的三肽或含半胱氨酸的四肽。
[0024]
在该制备用途的一些实施方案中,含半胱氨酸的二肽选自l(d)-半胱氨酸-l(d)-精氨酸二肽(cr)、l(d)-精氨酸-l(d)-半胱氨酸二肽(rc)、l(d)-组氨酸-l(d)-半胱氨酸二肽(hc)和l(d)-半胱氨酸-l(d)-组氨酸二肽(ch)。
[0025]
在该制备用途的一些实施方案中,含半胱氨酸的三肽选自甘氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(gcr)、l(d)-脯氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(pcr)、l(d)-赖氨酸-l(d)-半胱氨酸-l(d)-脯氨酸三肽(kcp)和l(d)-谷胱甘肽(gsh)。
[0026]
在该制备用途的一些实施方案中,含半胱氨酸的四肽选自甘氨酸-l(d)-丝氨酸-l(d)-半胱氨酸-l(d)-精氨酸四肽(gscr)和甘氨酸-l(d)-半胱氨酸-l(d)-丝氨酸-l(d)-精氨酸四肽(gcsr)。
[0027]
在该制备用途的一些实施方案中,其他含硫醇的化合物选自1-[(2s)-2-甲基-3-硫醇-1-氧代丙基]-l(d)-脯氨酸、硫代乙醇酸、巯基乙醇、苯硫酚、d-3-巯基缬氨酸、n-(2-巯基丙酰基)-甘氨酸和十二烷基硫醇。
附图说明
[0028]
现在将参考附图描述根据本发明的优选实施例,其中相同的附图标记表示相同的元件。
[0029]
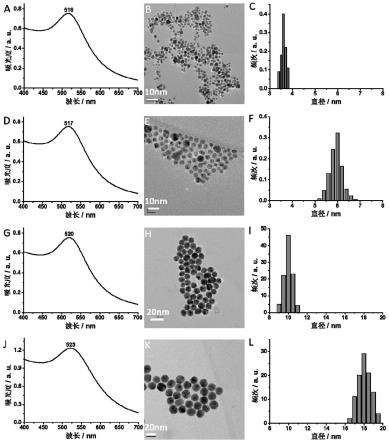
图1显示具有不同粒径的配体l-nibc-修饰的金纳米粒子(l-nibc-aunps)的紫外-可见(uv)光谱、透射电子显微镜(tem)图像和粒度分布图。
[0030]
图2显示具有不同粒径的配体l-nibc-结合的金团簇(l-nibc-aucs)的紫外可见(uv)光谱、tem图像和粒度分布图。
[0031]
图3显示具有不同粒径的l-nibc-aucs的红外光谱。
[0032]
图4显示配体cr-结合的金团簇(cr-aucs)的uv、红外、tem和粒度分布图。
[0033]
图5显示配体rc-结合的金团簇(rc-aucs)的uv、红外、tem和粒度分布图。
[0034]
图6显示配体1-[(2s)-2-甲基-3-硫醇-1-氧代丙基]-l-脯氨酸(即cap)结合的金团簇(cap-aucs)的uv、红外、tem和粒度分布图。
[0035]
图7显示配体gsh-结合的金团簇(gsh-aucs)的uv、红外、tem和粒度分布图。
[0036]
图8显示配体d-nibc-结合的金团簇(d-nibc-aucs)的uv、红外、tem和粒度分布图。
[0037]
图9显示配体l-半胱氨酸-结合的金团簇(l-cys-aucs)的uv、红外、tem和粒度分布图。
[0038]
图10显示不同剂量a-01和a-02给药对肝硬化模型小鼠血清(a)alt、(b)ast、(c)tbil、(d)mao及(e)alb水平的影响,其中阳性对照组为索拉菲尼。
[0039]
图11显示不同剂量b-01和b-02给药对肝硬化模型小鼠血清(a)alt、(b)ast、(c)tbil、(d)mao及(e)alb水平的影响,其中阳性对照组为索拉菲尼。
[0040]
图12显示高剂量药物c给药对肝硬化模型小鼠血清(a)alt、(b)ast、(c)tbil、(d)mao及(e)alb水平的影响,其中阳性对照组为索拉菲尼。
[0041]
图13显示he染色病理检测结果:(a)空白对照组;(b)模型对照组;(c)阳性对照组;(d)a-01金团簇低剂量给药组;(e)a-01金团簇高剂量给药组。
[0042]
图14显示d、e、f药物给药对肝硬化模型小鼠血清(a)alt、(b)ast、(c)tbil、(d)mao及(e)alb水平的影响。
具体实施方式
[0043]
通过参考以下对本发明一些实施方案的详细描述,可以更容易地理解本发明。
[0044]
在引用出版物的情况下,这些出版物的公开内容被整体引用到本技术中,以便更全面地描述本发明相关的现有技术。
[0045]
配体结合的金团簇(aucs)是存在于金原子和金纳米粒子之间的一种金的特殊形式。配体结合的金团簇的金核尺寸小于3nm,由仅仅几个到几百个金原子组成,导致金纳米粒子的面心立方堆叠结构的崩溃。因此,与金纳米粒子的连续或准连续能级不同,金团簇表现出具有不同homo-lumo间隙的分子状离散电子结构。这导致常规金纳米粒子所具有的表
面等离子体共振效应和相应的在紫外-可见光谱下等离子体共振吸收带(520
±
20nm)的消失。
[0046]
本发明提供配体结合的金团簇。
[0047]
在一些实施方案中,配体结合的金团簇包含配体和金核,其中配体与金核结合。配体与金核的结合表示配体通过共价键,氢键,静电力,疏水力,范德华力等等与金核一起形成在溶液中稳定的复合物。在一些实施方案中,金核的直径为0.5-3nm。在一些实施方案中,金核的直径在0.5-2.6nm的范围内。
[0048]
在一些实施方案中,配体结合的金团簇的配体是含硫醇的化合物或寡肽。在一些实施方案中,配体通过au-s键与金核键合以形成配体键合的金团簇。
[0049]
在一些实施方案中,配体是,但不限于,l-半胱氨酸,d-半胱氨酸或半胱氨酸衍生物。在一些实施方案中,半胱氨酸衍生物是n-异丁酰基-l-半胱氨酸(l-nibc)、n-异丁酰基-d-半胱氨酸(d-nibc)、n-乙酰基-l-半胱氨酸(l-nac)或n-乙酰基-d-半胱氨酸(d-nac)。
[0050]
在一些实施方案中,配体是,但不限于,含半胱氨酸的寡肽及其衍生物。在一些实施方案中,含半胱氨酸的寡肽是含半胱氨酸的二肽。在一些实施方案中,含半胱氨酸的二肽是l(d)-半胱氨酸-l(d)-精氨酸二肽(cr)、l(d)-精氨酸-l(d)-半胱氨酸二肽(rc)或l(d)-半胱氨酸-l(d)-组氨酸二肽(ch)。在一些实施方案中,含半胱氨酸的寡肽是含半胱氨酸的三肽。在一些实施方案中,含半胱氨酸的三肽是甘氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(gcr)、l(d)-脯氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(pcr)或l(d)-谷胱甘肽(gsh)。在一些实施方案中,含半胱氨酸的寡肽是含半胱氨酸的四肽。在一些实施方案中,含半胱氨酸的四肽是甘氨酸-l(d)-丝氨酸-l(d)-半胱氨酸-l(d)-精氨酸四肽(gscr)或甘氨酸-l(d)-半胱氨酸-l(d)-丝氨酸-l(d)-精氨酸四肽(gcsr)。
[0051]
在一些实施方案中,配体是含硫醇的化合物。在一些实施方案中,含硫醇的化合物是1-[(2s)-2-甲基-3-硫醇-1-氧代丙基]-l(d)-脯氨酸、硫代乙醇酸、巯基乙醇、苯硫酚、d-3-巯基缬氨酸或十二烷基硫醇。
[0052]
本发明提供用于治疗受试者的肝硬化的药物组合物。在一些实施方案中,受试者是人。在一些实施方案中,受试者是宠物动物,例如狗。
[0053]
在一些实施方案中,药物组合物包含如上公开的配体结合的金团簇和药学上可接受的赋形剂。在一些实施方案中,赋形剂是磷酸盐缓冲溶液或生理盐水。
[0054]
本发明提供上述公开的配体结合的金团簇用于制造用于治疗受试者的肝硬化的药物的用途。
[0055]
本发明提供了上述公开的配体结合的金团簇用于治疗受试者的肝硬化的用途或使用上述公开的配体结合的金团簇治疗受试者的肝硬化的方法。在一些实施方案中,治疗方法包括向受试者施用药学有效量的配体结合的金团簇。药学有效量可通过常规体内研究确定。
[0056]
提供以下实施例仅用于说明本发明的原理;它们决不是要限制本发明的范围。
[0057]
实施例
[0058]
实施例1、制备配体结合的金团簇
[0059]
1.1将haucl4溶于甲醇、水、乙醇、正丙醇或乙酸乙酯中,得到溶液a,其中haucl4的浓度为0.01~0.03m;
[0060]
1.2将配体溶解在溶剂中得到溶液b,其中配体的浓度为0.01~0.18m;配体包括,但不限于,l-半胱氨酸,d-半胱氨酸和其他半胱氨酸衍生物,如n-异丁酰基-l-半胱氨酸(l-nibc)、n-异丁酰基-d-半胱氨酸(d-nibc)、n-乙酰基-l-半胱氨酸(l-nac)和n-乙酰基-d-半胱氨酸(d-nac),含半胱氨酸的寡肽及其衍生物,包括,但不限于,二肽,三肽,四肽和其他含有半胱氨酸的肽,例如l(d)-半胱氨酸-l(d)-精氨酸二肽(cr),l(d)-精氨酸-l(d)-半胱氨酸二肽(rc),l(d)-半胱氨酸l(d)-组氨酸(ch),甘氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(gcr),l(d)-脯氨酸-l(d)-半胱氨酸-l(d)-精氨酸三肽(pcr),l(d)-谷胱甘肽(gsh),甘氨酸-l(d)-丝氨酸-l(d)-半胱氨酸-l(d)-精氨酸四肽(gscr)和甘氨酸-l(d)-半胱氨酸-l(d)-丝氨酸-l(d)-精氨酸四肽(gcsr),和其他含巯基化合物,如1-[(2s)-2-甲基-3-硫醇-1-氧代丙基]-l(d)-脯氨酸,巯基乙酸,巯基乙醇,苯硫酚,d-3-巯基缬氨酸和十二烷基硫醇中的一种或多种;溶剂是甲醇,乙酸乙酯,水,乙醇,正丙醇,戊烷,甲酸,乙酸,乙醚,丙酮,苯甲醚,1-丙醇,2-丙醇,1-丁醇,2-丁醇,戊醇,乙酸丁酯,三丁基甲基醚,乙酸异丙酯,二甲基亚砜,甲酸乙酯,乙酸异丁酯,乙酸甲酯,2-甲基-1-丙醇和乙酸丙酯中的一种或多种;
[0061]
1.3将溶液a和溶液b混合,使haucl4与配体的摩尔比为1:(0.01~100),在冰浴中搅拌0.1~48h,加入0.025~0.8m nabh4水、乙醇或甲醇溶液,继续在冰水浴中搅拌反应0.1~12h。nabh4与配体的摩尔比为1:(0.01~100);
[0062]
1.4反应结束后,用mwco 3k~30k超滤管以8000~175r/min的速度离心反应液10~100min,得到不同平均粒径的配体结合的金团簇沉淀。不同mwco的超滤管的过滤膜的孔直接决定了可以通过膜的配体结合的金团簇的尺寸。可以任选地省略该步骤;
[0063]
1.5将在步骤(1.4)中得到的不同平均粒径的配体结合的金团簇沉淀溶于水中,置于透析袋中,室温下在水中透析1~7天;
[0064]
1.6透析后冷冻干燥配体结合的金团簇12~24h,得到粉末状或絮凝剂物质,即配体结合的金团簇。
[0065]
如所检测的,通过前述方法获得的粉末状或絮凝剂物质的粒度小于3nm(通常分布在0.5-2.6nm)。在520nm处没有明显的吸收峰。确定所获得的粉末或絮凝物是配体结合的金团簇。
[0066]
实施例2、制备和鉴定用不同配体结合的金团簇
[0067]
2.1制备l-nibc-结合的金团簇,即l-nibc-aucs以配体l-nibc为例,详细描述了制备和鉴定配体l-nibc结合的金团簇。
[0068]
2.1.1称取1.00g haucl4,将其溶于100ml甲醇中,得到0.03m溶液a;
[0069]
2.1.2称取0.57g l-nibc,将其溶于100ml冰醋酸(乙酸)中,得到0.03m溶液b;
[0070]
2.1.3量取1ml溶液a,分别与0.5ml、1ml、2ml、3ml、4ml、或5ml溶液b混合(即haucl4与l-nibc之间的摩尔比分别为1:0.5、1:1、1:2、1:3、1:4、1:5),在冰浴中搅拌反应2h,当溶液从亮黄色变为无色时,快速加入1ml新制备的0.03m(称取11.3mg nabh4并溶于10ml乙醇中)nabh4乙醇溶液,在溶液变为深棕色后继续反应30分钟,并加入10ml丙酮终止反应。
[0071]
2.1.4反应后,将反应溶液进行梯度离心,得到不同粒径的l-nibc-aucs粉末。具体方法:反应完成后,将反应液转移至mwco为30k,体积为50ml的超滤管中,以10000r/min离心20min,将内管中的保留物溶于超纯水中。获得粒径约为2.6nm的粉末。然后,将外管中的混合溶液转移至体积为50ml,mwco为10k的超滤管中,并以13,000r/min离心30分钟。将内管中
的保留物溶解在超纯水中,得到粒径约为1.8nm的粉末。然后将外管中的混合溶液转移至体积为50ml,mwco为3k的超滤管中,并以17,500r/min离心40分钟。将内管中的保留物溶解在超纯水中,得到粒径约为1.1nm的粉末。
[0072]
2.1.5沉淀通过梯度离心得到的三种不同粒径的粉末,分别除去溶剂,用n2吹干粗产物,溶于5ml超纯水中,放入透析袋(mwco为3kda),将透析袋放入2l超纯水中,每隔一天换水,透析7天,冷冻干燥后备用。
[0073]
2.2鉴定l-nibc-aucs
[0074]
对上面得到的粉末(l-nibc-aucs)进行鉴定实验。同时,配体l-nibc修饰的金纳米粒子(l-nibc-aunp)用作对照。配体为l-nibc的金纳米粒子的制备方法参考文献(w.yan,l.xu,c.xu,w.ma,h.kuang,l.wang and n.a.kotov,journal of the american chemical society 2012,134,15114;x.yuan,b.zhang,z.luo,q.yao,d.t.leong,n.yan and j.xie,angewandtechemie international edition 2014,53,4623)。
[0075]
2.2.1通过透射电子显微镜(tem)观察形态
[0076]
将测试粉末(l-nibc-aucs样品和l-nibc-aunps样品)溶解在超纯水中至2mg/l作为样品,然后通过悬滴法制备测试样品。更具体地,将5μl样品滴在超薄碳膜上,自然挥发直至水滴消失,然后通过jem-2100f stem/eds场发射高分辨率tem观察样品的形态。
[0077]
l-nibc-aunp的四个tem图像显示在图1的b幅,e幅,h幅和k幅中;l-nibc-aucs的三个tem图像显示在图2的b幅,e幅和h幅中。
[0078]
图2中的图像表明每个l-nibc-aucs样品具有均匀的粒径和良好的分散性,并且l-nibc-aucs的平均直径(指金核的直径)分别为1.1nm、1.8nm和2.6nm,与图2的c幅,f幅和i幅中的结果完全一致。相比之下,l-nibc-aunps样品具有更大的粒径。它们的平均直径(指金核的直径)分别为3.6nm、6.0nm、10.1nm和18.2nm,与图1的c幅,f幅,i幅和l幅中的结果有很好地一致。
[0079]
2.2.2紫外(uv)-可见(vis)吸收光谱
[0080]
将测试粉末(l-nibc-aucs样品和l-nibc-aunps样品)溶解在超纯水中直至浓度为10mg
·
l-1,并在室温下测量uv-vis吸收光谱。扫描范围为190-1100nm,样品池是标准石英比色皿,光程为1cm,参比池内充满超纯水。
[0081]
具有不同尺寸的四种l-nibc-aunp样品的uv-vis吸收光谱示于图1的a幅,d幅,g幅和j幅中,并且粒度的统计分布示于图1的c幅,f幅,i幅和l幅中;具有不同尺寸的三种l-nibc-aucs样品的uv-vis吸收光谱示于图2的a幅,d幅和g幅中,并且粒度的统计分布示于图2的c幅,f幅和i幅中。
[0082]
图1表明,由于表面等离子体效应,l-nibc-aunp在约520nm处具有吸收峰。吸收峰的位置与粒径有关。当粒径为3.6nm时,uv吸收峰出现在516nm处;当粒径为6.0nm时,uv吸收峰出现在517nm处;当粒径为10.1nm时,uv吸收峰出现在520nm处,当粒径为18.2nm时,吸收峰出现在523nm处。四个样品中没有一个在560nm以上具有任何吸收峰。
[0083]
图2表明,在三种不同粒径的l-nibc结合的金团簇样品的紫外吸收光谱中,520nm处的表面等离子体效应吸收峰消失,在560nm以上出现两个明显的吸收峰,吸收峰的位置不同与金团簇的粒径略有差异。这是因为由于面心立方结构的坍塌,金团簇表现出类分子的性质,这导致金团簇的状态密度的不连续性、能级分裂、等离子共振效应的消失和在长波方
向新的吸收峰的出现。可以得出结论,上面获得的三种不同粒径的粉末样品都是配体结合的金团簇。
[0084]
2.2.3傅里叶变换红外光谱
[0085]
红外光谱在bruker制造的vertex80v型傅立叶变换红外光谱仪上采用固体粉末高真空全反射模式测定,扫描范围为4000-400cm-1
,扫描64次。以l-nibc结合的金团簇样品为例,测试样品为三种粒径不同的l-nibc结合的金团簇干粉,对照样品纯净l-nibc粉末。结果见图3。
[0086]
图3为具有不同粒径的l-nibc结合的金团簇的红外光谱。与纯l-nibc(底部曲线)相比,不同粒径的l-nibc结合的金团簇在2500-2600cm-1之间的s-h伸缩振动均完全消失,而仍观察到l-nibc的其他特征峰。证明l-nibc分子通过金硫键成功结合到金团簇表面。该图还显示配体结合的金团簇的红外光谱与其尺寸无关。
[0087]
用上述类似的方法制备由其它配体结合的金团簇,只是溶液b的溶剂、haucl4与配体之间的进料比、反应时间和加入的nabh4的量稍作调整,例如:当使用l-半胱氨酸、d-半胱氨酸、n-异丁酰基-l-半胱氨酸(l-nibc)或n-异丁酰基-d-半胱氨酸(d-nibc)作为配体时,选择乙酸作为溶剂;当使用二肽cr、二肽rc或1-[(2s)-2-甲基-3-巯基-1-氧代丙基]-l-脯氨酸作为配体时,选择水作为溶剂,依此类推;其他步骤类似,因此这里不再提供进一步的细节。
[0088]
本发明通过上述方法制备并获得了一系列配体结合的金团簇。配体和制备方法的参数如表1所示。
[0089]
表1.本发明不同配体结合的金团簇的制备参数
[0090]
[0091][0092]
表1中列出的样品通过前述方法确认。六种不同配体结合的金团簇的特征示于图4(cr-aucs),图5(rc-aucs),图6(cap-aucs)(cap表示1-[(2s)-2-甲基-3-巯基-1-氧代丙基]-l-脯氨酸),图7(gsh-aucs),图8(d-nibc-aucs),图9(l-cys-aucs)。图4-图9显示uv光谱(a幅),红外光谱(b幅),tem图像(c幅)和粒度分布(d幅)。
[0093]
结果表明,用表1得到的不同配体结合的金团簇的直径均小于3nm。紫外光谱还显示在520
±
20nm处峰的消失,并且在其他位置出现吸收峰,该吸收峰的位置随配体和粒径以及结构的不同而有所变化,有的情况并不出现特殊的吸收峰,这主要是由于多种尺寸不同和结构不同的金团簇形成混合物或者某些特殊金团簇使吸收峰的位置在常规紫外可见吸收光谱测定范围之外。同时,傅里叶变换红外光谱也显示配体的硫醇红外吸收峰消失(图4-8中b幅的虚线之间),而其他红外特征峰都保留,表明配体分子已成功与金原子结合形成了配体结合的金团簇,表明本发明成功地获得了用表1中列出的配体结合的金团簇。
[0094]
实施例3
[0095]
3.1材料和动物
[0096]
3.1.1测试样品
[0097]
a-01:配体l-nibc结合的金团簇(l-nibc-aucs),0.9
±
0.2nm。
[0098]
a-02:配体l-nibc结合的金团簇(l-nibc-aucs),1.9
±
0.5nm。
[0099]
b-01:配体l-cys结合的金团簇(l-cys-aucs),1.0
±
0.2nm。
[0100]
b-02:配体l-cys结合的金团簇(l-cys-aucs),1.7
±
0.3nm。
[0101]
c:l-nibc修饰的金纳米粒子(l-nibc-aunps),6.3
±
1.5nm。
[0102]
所有测试样品的制备方法参照前述方法,略有改动;他们的质量通过了上述方法的鉴定。
[0103]
3.1.2阳性对照样品
[0104]
索拉菲尼(sorafenib)。
[0105]
3.1.3试验用动物和分组
[0106]
spf级雄性c57bl/6n小鼠(购自北京华阜康实验动物技术有限公司(生产许可证号:scxk(京)2019-0008)120只,6-8周龄,体重16-20g,按体重随机分成12组(n=10):空白对照组、模型组、阳性对照组、a-01低剂量组、a-01高剂量组、a-02低剂量组、a-02高剂量组、b-01低剂量组、b-01高剂量组、b-02低剂量组、b-02高剂量组、c高剂量组。
[0107]
3.2建模方法
[0108]
除空白对照组外,采用四氯化碳(ccl4)诱导法处理其他各组小鼠,制备肝硬化模型。造模方法如下:(1)每只小鼠按照7μl/g体重腹腔注射10%的ccl4(橄榄油稀释),每周2次,共注射8周;空白对照组小鼠腹腔注射等量橄榄油溶剂。(2)从第6周开始,每周最后一次注射48h后挑选2只小鼠处死,观察小鼠肝脏外观,外观符合肝硬化特点后(第8周),肝组织福尔马林固定,进行he染色、masson染色等评价肝硬化模型的建模情况。
[0109]
3.3给药
[0110]
造模成功后,对阳性对照组小鼠灌胃给予25mg/kg索拉菲尼;对a-01、a-02、b-01、b-02低或高剂量组分别按照2.5或10mg/kg剂量腹腔注射给予相应的供试品;对c高剂量组按照40mg/kg剂量腹腔注射给予供试品;对空白对照组和模型组小鼠按照10ml/kg腹腔注射给与生理盐水。每天给药1次,连续给药20天。
[0111]
3.4生化检测
[0112]
给药结束后,将小鼠进行眼眶采血,收集血清,使用中生北控试剂盒,生化分析仪(西门子)对白蛋白(albumin,alb),总胆红素(total bilirubin,tbil),丙氨酸氨基转移酶(alanine aminotransferase,alt)、天门冬氨酸氨基转移酶(aspartate aminotransferase,ast)和单胺氧化酶(monoamine oxidase,mao)共5个指标进行检测。检测方法严格按照试剂盒说明书进行。
[0113]
表2显示用于生化检测的试剂盒的产品信息
[0114][0115]
3.5病理检测
[0116]
3.5.1he染色
[0117]
小鼠安乐死后,对小鼠肝组织样品采用4%多聚甲醛固定液固定48小时以上,固定后采用酒精梯度脱水,采用二甲苯和乙醇透明化处理。然后将肝组织浸蜡、包埋。对包埋的材料进行修块、粘块、整修后,采用石蜡切片机将肝组织切片,切片厚度为4μm。he染色主要流程如下:将切片在65℃烤箱烤片后,将切片采用二甲苯处理及乙醇梯度脱水。依次采用苏木精染色液染,促蓝液返蓝及0.5%曙红液染色后将切片进行梯度乙醇及二甲苯处理,中性树胶封片。采用显微镜观察肝组织的纤维化改变。
[0118]
3.5.2masson染色
[0119]
将小鼠肝组织切片烤片后脱蜡脱水,铬化处理后用regaud氏苏木精染液核染。水洗后将切片用masson丽春红酸性复红液染色,以2%冰醋酸水溶液浸洗片后采用1%磷钼酸水溶液分化。直接用苯胺蓝或光绿液染后以0.2%冰醋酸水溶液浸洗片刻,采用95%酒精、无水酒精及二甲苯透明化后采用中性树胶封固。采用显微镜观察肝组织。
[0120]
3.6实验结果
[0121]
3.6.1造模成功
[0122]
模型组小鼠肝脏被增生的纤维隔分隔成大小不等的圆形或椭圆形团块,血清中alt、tbil、ast指标相对于空白对照组显著升高,alb相对于空白对照组显著下降,mao指标与空白对照组无显著性差异,但数值也有所升高。以上所有结果提示本次实验造模成功。
[0123]
3.6.2试验药物对丙氨酸氨基转移酶(alt)、总胆红素(tbil)、天门冬氨酸氨基转移酶(ast)、单胺氧化酶(mao)和白蛋白(alb)的影响
[0124]
3.6.2.1试验药物a-01和a-02
[0125]
由图10a可知,模型组的alt活性相对于空白对照组的alt活性显示极显著升高(从平均43.5
±
8.1u/l上升至188.5
±
4.9u/l,p《0.01),提示肝硬化模型小鼠的肝功能发生病变。a-01和a-02高和低剂量给药后,所有给药组的alt活性均明显下降,恢复至空白对照组水平,甚至更低(最高为a-02的低剂量组41.5
±
5.4u/l,最低为a-01高剂量组30.0
±
5.9u/l,阳性对照组为42.8
±
5.4u/l),与模型组alt活性存在极显著差异(p《0.01)。
[0126]
由图10b可知,模型组的ast活性相对于空白对照组的ast活性显示显著性升高(从141.8
±
13.5u/l上升到192.0
±
11.3u/l,p《0.05)。a-01和a-02给药后,所有给药组的ast活性均有下降,其中高剂量a-01和a-02给药显著性降低ast活性(a-01高剂量组为130.4
±
12.8u/l,a-02高剂量组为131.3
±
9.9u/l,p均《0.01),明显优于阳性对照组(165.5
±
11.6u/l)。
[0127]
由图10c可知,模型组的tbil浓度相对于空白对照组的tbil浓度显示显著升高(从1.02
±
0.20μmol/l上升至2.91
±
0.39μmol/l),与空白对照组存在显著差异(p《0.01)。a-01和a-02高和低剂量给药后,tbil均显著降低(最高0.91
±
0.13μmol/l,最低0.78
±
0.26μmol/l),与空白对照组处于同一水平,但是,与模型组存在极显著差异(p《0.01)。
[0128]
由图10d可知,模型组的mao活性相对于空白对照组的mao活性有所升高(空白对照组:18.8
±
2.9u/l,模型组:21.5
±
0.7u/l),但不存在统计学差异,提示四氯化碳诱导的肝硬化小鼠mao活性指标的变化不明显。a-01和a-02给药未显著性影响所有给药组的ma0活性,但所有给药组的mao活性均有下降(最高19.3
±
1.5u/l,最低18.5
±
1.9u/l),与空白对照组处于同一水平,与此相比,阳性对照组未降低mao活性(21.3
±
2.1u/l),此结果提示a-01和a-02可能将所有给药组的mao活性调整至空白对照组水平,对肝硬化小鼠的肝功能恢复发挥了作用。
[0129]
由图10e可知,模型组的alb水平相对于空白对照组的alb水平显示显著降低(从24.2
±
0.6g/l降低至22.1
±
1.3g/l),与空白对照组有显著性差异(p《0.05),表明四氯化碳处理可以显著降低血清alb水平。a-01和a-02不同剂量以及阳性对照组给药均未显著性影响血清中alb水平。
[0130]
阳性药物索拉菲尼显著性降低alt,ast,tbil水平但在mao指标上对肝硬化小鼠可能无缓解作用。此结果提示a-01和a-02对肝硬化小鼠的肝功能起到了修复作用,且效果优于阳性对照药物。
[0131]
3.6.2.2试验药物b-01和b-02
[0132]
由图11a可知,b-01和b-02低和高剂量给药均可显著性降低alt活性(最高46.3
±
7.4u/l,最低33.0
±
7.1u/l),与空白对照组处于同一水平,与模型组(188.5
±
4.9u/l)存在显著差异(p均《0.01)。
[0133]
由图11b可知,与模型组(192.0
±
11.3u/l)相比,b-01低或高剂量给药(分别为132.3
±
10.0u/l,p《0.01;129.7
±
26.6u/l,p《0.01)和b-02低剂量(149.6
±
21.8u/l,p《0.05)给药均可显著性降低ast活性至正常水平(p《0.01),但b-02高剂量给药虽一定程度降低ast活性,但差异无显著性(p》0.05)。与之相比,阳性药物索拉菲尼也能降低ast水平至165.5
±
11.6u/l(p《0.05),但效果不如b-01低高剂量及b-02的低剂量给药。
[0134]
由图11c可知,b-01和b-02低和高剂量给药均将tbil显著降低(最高1.28
±
0.12μmol/l,最低0.96
±
0.15μmol/l),与空白对照组(1.02
±
0.20μmol/l)处于同一水平,与模型组(2.91
±
0.39μmol/l)均存在显著差异(p《0.01)。
[0135]
由图11d可知,与模型组(21.5
±
0.7u/l)相比,b-01低剂量(17.3
±
1.3u/l,p《0.01)和b-02高剂量(18.3
±
0.6u/l,p《0.05)均显著降低血清mao水平至空白对照组水平(18.8
±
2.9u/l),但阳性对照索拉菲尼(21.3
±
2.1u/l)对血清mao水平无影响。
[0136]
由图11e可知,各给药组及阳性对照组对alb水平均无显著影响。
[0137]
以上结果表明b-01和b-02显著降低alt,ast,tbil及mao水平,且有一定剂量依赖性,对肝硬化小鼠的肝功能恢复发挥作用,其效果至少在部分指标上优于阳性对照药物。
[0138]
3.6.2.3试验药物c
[0139]
由图12可知,与模型组相比,药物c高剂量给药对(a)alt、(b)ast、(c)tbil、(d)mao、(e)alb水平相对于模型对照组均无明显改善作用,甚至有一定恶化趋势,提示c药物对肝硬化小鼠的肝功能改善无效,且可能有毒。
[0140]
3.6.3病理检测
[0141]
肝硬化以肝组织弥漫性纤维化和假小叶的形成为病理特征。he染色病理检测结果显示,如图13a所示,空白对照组小鼠的正常肝组织结构清晰,肝小叶完整,肝细胞索排列整齐,以中央静脉为中心呈放射状排列,肝细胞核正常,汇管区仅有少量纤维组织;如图13b所示,模型对照组小鼠的肝脏中,肝细胞排列紊乱,出现气球样变,肝小叶接近消失,假小叶(图13b中向右箭头)大量出现,胶原纤维大量增生并形成圆形或椭圆形的纤维间隔(图13b中向左箭头)。与模型对照组相比,如图13c所示,阳性对照组,肝损伤程度明显减弱,细胞排列明显趋于整齐,胶原纤维虽存在增生,但明显减弱,未形成纤维间隔,假小叶几乎消失;但与正常肝组织相比,阳性对照组肝脏细胞之间的间隙明显增大(图13c中向下箭头)。与模型对照组相比,四种金团簇药物(a-01、a-02、b-01和b-02)给药组的肝细胞均呈现极显著的肝损伤恢复现象,表现在肝脏中纤维增生和假小叶明显减少,且表现出一定的剂量依赖性。
[0142]
图13d和图13e分别显示了以a-01金团簇为代表的低剂量和高剂量给药对肝组织损伤修复效果的he染色图。如图13d所示,a-01金团簇低剂量给药组,肝细胞排列较整齐,假小叶几乎消失,胶原纤维增生也明显减弱,但肝脏细胞间隙相对于正常肝组织有一定程度的增大(图13d中向下箭头所指)。如图13e所示,a-01金团簇高剂量给药组相对于低剂量给药组改善效果更加明显,假小叶完全消失,未观察到胶原纤维增生,肝脏细胞间隙增大现象几乎不可见,与正常肝细胞无明显差异。从这里可以看到,a-01金团簇药物表现出比阳性对照药物更好的修复肝组织损伤的效果。
[0143]
masson染色结果与he染色结果结论相同。
[0144]
其他三种金团簇药物也与a-01药物表现出类似效果,在此不赘述。
[0145]
综上所述:a-01、a-2、b-01、b-02四个金团簇受试药物显著性地降低肝脏纤维增生,减少肝脏假小叶。肝功能指标检测结果同样显示了肝功能恢复的现象,其中丙氨酸氨基转移酶(alt)和总胆红素(tbil)的变化最为明显。天门冬氨酸氨基转移酶(ast)及单氨氧化酶(mao)也有明显恢复,白蛋白(alb)的变化则不明显。四种金团簇受试药物在肝硬化小鼠体内可显著改善肝硬化小鼠的肝功能及肝脏的病理结构,且总体效果优于阳性对照索拉非尼,为今后进一步应用提供实验依据。但c药物则无明显治疗作用,显示不能用于肝硬化治疗。
[0146]
实施例4
[0147]
4.1材料和动物
[0148]
4.1.1测试样品
[0149]
d:配体l-nac结合的金团簇(l-nac-aucs),尺寸0.5-3nm。
[0150]
e:配体cr结合的金团簇(cr-aucs),尺寸0.5-3nm。
[0151]
f:配体rc结合的金团簇(rc-aucs),尺寸0.5-3nm。
[0152]
所有测试样品的制备方法参照前述方法,略有改动;他们的质量通过了上述方法的鉴定。
[0153]
4.1.2试验用动物和分组
[0154]
spf级雄性c57bl/6n小鼠(购自北京华阜康实验动物技术有限公司(生产许可证号:scxk(京)2019-0008)50只,6-8周龄,体重16-20g,按体重随机分成5组(n=10):空白对照组、模型对照组、d给药组、e给药组、f给药组。
[0155]
4.2建模方法
[0156]
除空白对照组外,采用四氯化碳(ccl4)诱导法处理其他各组小鼠,制备肝硬化模型。造模方法如下:(1)每只小鼠按照7μl/g体重腹腔注射10%的ccl4(橄榄油稀释),每周2次,共注射8周;空白对照组小鼠腹腔注射等量橄榄油溶剂。(2)从第6周开始,每周最后一次注射48h后挑选2只小鼠处死,观察小鼠肝脏外观,外观符合肝硬化特点后(第8周),肝组织福尔马林固定,进行he染色、masson染色等评价肝硬化模型的建模情况。
[0157]
4.3给药
[0158]
造模成功后,三个给药组均按照40mg/kg剂量腹腔注射相应的金团簇药物;对空白对照组和模型对照组小鼠按照10ml/kg腹腔注射给与生理盐水。每天给药1次,连续给药20天。
[0159]
4.4生化检测
[0160]
试剂和方法与3.4节相同。
[0161]
4.5实验结果
[0162]
4.5.1造模成功
[0163]
模型组小鼠肝脏被增生的纤维隔分隔成大小不等的圆形或椭圆形团块,血清中alt、tbil、ast指标相对于空白对照组显著升高,alb相对于空白对照组显著下降,mao指标与空白对照组无显著性差异,但数值也有所升高。以上所有结果提示本次实验造模成功。
[0164]
4.5.2试验药物对丙氨酸氨基转移酶(alt)、总胆红素(tbil)、天门冬氨酸氨基转移酶(ast)、单胺氧化酶(mao)和白蛋白(alb)的影响
[0165]
由图14a可知,模型组的alt活性相对于空白对照组的alt活性显示极显著升高(p《0.01,**),提示肝硬化模型小鼠的肝功能发生病变。d、e、f给药后,所有给药组的alt活性均明显下降,恢复至空白对照组水平,与模型对照组alt活性存在极显著差异(p《0.01)。
[0166]
由图14b可知,模型对照组的血清ast活性相对于空白对照组的ast活性显示显著性升高(p《0.05,*)。d、e、f给药后,所有给药组的ast活性均显著性下降(p均《0.05,*)。
[0167]
由图14c可知,模型对照组的tbil浓度相对于空白对照组的tbil浓度显示显著升高,与空白对照组存在显著差异(p《0.01,**)。d、e、f给药后,tbil均显著降低至空白对照组水平,但是,与模型对照组存在显著差异(p《0.01,**)。
[0168]
由图14d可知,模型对照组的mao活性相对于空白对照组的mao活性有所升高,但不存在统计学差异(p》0.5),提示四氯化碳诱导的肝硬化小鼠mao活性指标的变化不明显。d、e、f给药未显著性影响各给药组的ma0活性,但所有给药组的mao活性均下降至空白对照组水平。
[0169]
由图14e可知,模型对照组的alb水平相对于空白对照组的alb水平显示降低,但差异无显著性(p》0.05)。但是,d、e、f给药对血清中alb水平有所提升,但差异无显著性(p》
0.05)。
[0170]
综上所述,d、e、f三个金团簇受试药物显著性地改善了肝功能。其中丙氨酸氨基转移酶(alt)和总胆红素(tbil)的变化最为明显。天门冬氨酸氨基转移酶(ast)及单氨氧化酶(mao)也有明显恢复,白蛋白(alb)也有改善,但不明显。为今后进一步应用提供实验依据。
[0171]
具有不同尺寸的l-半胱氨酸结合的金团簇、l-nibc结合的金团簇、l-nac结合的金团簇、cr结合的金团簇和rc结合的金团簇,以及其他配体结合的不同尺寸的金团簇也具有同样的效果,他们的效果会有所差别。这里不再详细描述它们。
[0172]
工业实用性
[0173]
配体结合的金团簇可用于治疗肝硬化。它们适用于工业应用。
[0174]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1