制备人工血管模具的方法与流程
本申请涉及医疗器械领域,尤其涉及一种制备人工血管模具的方法。
背景技术:
随着现代医学的发展,可通过建立各种生物医学模型对疾病进行研究或者教学辅助。例如,人体针灸模型、诊断技能模型、孕婴技能模型等,上述模型主要用于教学辅助,对模型的仿真性没有太高的要求。而对于疾病研究而言,生物医学模型需要与真实的生物体构造及其相似才能够有助于提升研究结果的精确性。例如,在对人类的许多种疾病进行研究或治疗时需要建立人体的血管模型。目前,与人类血管相关的医学研究或治疗可以用动物的血管代替,但是,在相当一部分研究或治疗场景中,用于研究的血管与人类血管结构的一致性是决定研究结果的是否可靠的关键因素。
现有技术中,为了拟合原有血管的直径,不同型号的人工血管逐渐被开发,但这些人工血管通常直径均匀。与此同时,这些人工血管大多具有一定塑形性,在形态上多为直管状或Y字型,在尺寸上和形状上都是粗略的模拟,无法达到与真实血管的高度一致,对研究结果的可靠性有很大影响。
技术实现要素:
本发明的目的是提供一种制备人工血管模具的方法,用以提高人工血管的制备精度。
本发明实施例提供一种数制备人工血管模具的方法,包括:
获取血管的多个数字图像;
基于所述多个二维数字图像,构建所述血管的三维数字模型;
根据所述血管的三维数字模型,生成人工血管的模具模型;
根据所述人工血管的模具模型,采用三维打印技术打印出所述人工血管模具。
进一步可选地,所述基于所述多个二维数字图像,构建所述血管的三维数字模型,包括:从所述多个数字图像中提取血管的轮廓数据;获取三维建模参数;根据所述血管的轮廓数据和三维建模参数,构建所述血管的三维数字模型。
进一步可选地,所述根据所述血管的三维数字模型,生成人工血管的模具模型,包括:对所述血管的三维数字模型进行轮廓面的识别,得到所述血管的轮廓面;对所述轮廓面进行抽壳处理,得到所述人工血管的模具模型。
进一步可选地,所述轮廓面包括血管的内腔轮廓面和外壁轮廓面;相应的,所述对所述轮廓面进行抽壳处理,得到所述人工血管的模具模型,包括:对所述内腔轮廓面进行抽壳处理,得到人工血管内腔模具模型;以及,对所述外壁轮廓面进行抽壳处理,得到人工血管外壁模具模型;所述人工血管内腔模具模型以及所述人工血管外壁模具模型构成所述人工血管的模具模型。
进一步可选地,所述根据所述血管的三维数字模型,生成人工血管的模具模型,还包括:对所述轮廓面进行面优化处理;以及,所述对所述轮廓面进行抽壳处理,得到人工血管的模具模型,包括:对优化后的所述轮廓面进行抽壳处理,得到人工血管的模具模型。
进一步可选地,所述对所述轮廓面进行面优化处理,包括:将所述轮廓面转换为点阵得到点阵模型;对所述点阵模型中的点阵进行均一化处理;将均一化处理后的所述点阵模型生成面模型;对所述面模型进行平面光滑处理、力面松弛处理、去噪处理以及破洞修补处理中的至少一种或多种。
进一步可选地,根据所述人工血管的模具模型,采用三维打印技术打印出所述人工血管模具,包括:根据打印需求,设置打印参数;根据所述人工血管的模具模型,采用可溶性尼龙粉末并基于所述打印参数,打印得到所述人工血管模具。
本申请实施例提供的制备人工血管模具的方法,通过获取血管数字图像并根据该数字图像进行三维建模,获得了血管的三维数字模型。基于该三维数字模型生成的人工血管的模具模型,打印该模具模型的到人工血管模具,采用该模具模型制备出的人工血管,在形状与尺寸上与真实的血管高度一致。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1是本申请实施例提供的制备人工血管模具的方法的流程示意图;
图2是本申请实施例提供的制备人工血管模具的方法的另一流程示意图;
图3是本申请实施例CT扫描获取的乙状窦图像示意图;
图4是本申请实施例三维建模得到的血管的三维数字模型的示意图;
图5是本申请实施例三维打印获取的血管模具示意图;
图6是本申请实施例提供的制备人工血管模具的方法对应的装置结构示意图。
具体实施方式
现有技术中制作出的人工血管,通常血管的管径是均匀的,形态也多为单一的直管状或者Y字形。用这些人工血管来代替真实的血管做医学研究或者医学的辅助教学时,因其与真实血管之间管径和形态之间存在较大差异,将导致制造出的人工血管和真实血管在性能上产生巨大差别。从而这些人工血管一旦投入使用医学研究和辅助教学,易产生导向性的错误。
本申请实施例的核心在于,在人工制造血管之前,获取血管的真实图像,并基于这些真实图像进行三维建模获得血管的模具模型,打印该模具模型,便得到了能够制备出与该血管形状以及管径一模一样的人工血管模具。从而,基于该人工血管模具获得的人工血管,克服了现有技术中血管形状与管径与真实血管不符的缺陷。以下将配合附图及实施例来详细说明本申请的实施方式,藉此对本申请如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
图1是本申请实施例提供的一种制备人工血管模具的方法的流程示意图,结合图1,该方法包括:
步骤101、获取血管的多个数字图像。
步骤102、基于多个数字图像,构建血管的三维数字模型。
步骤103、根据血管的三维数字模型,生成人工血管的模具模型。
步骤104、根据人工血管的模具模型,采用三维打印技术打印出人工血管模具。
在本实施例中,所述的血管可以是被模拟的生物体任意部分的血管,例如,人类的脑部血管、心血管等等。获取血管的多个数字图像,其目的在于根据该多个数字图像获取血管真实的管径以及形态,从而保证制作出的人工血管与被模拟的血管具有高度相似性。
在步骤101中,获取血管的数字图像的一可选的实施方式为:对血管所在的区域进行计算机断层扫描(Computed Tomography,CT),根据计算机断层扫描获得的原始数据重建得到血管的多个数字图像。具体的,对血管所在的区域进行断层扫描,采用螺旋CT实现。螺旋CT在环滑时,X线球管进行单方向的连续旋转运动,同时检查床以匀速平移前进或后退,探测器可以连续地采集血管所在区域的体积数据。其中,所述的体积数据为断层扫描的电子密度值,是体元组成的三维网格数据,根据体积数据可以进行任意平面的图像重建。
可选的,本步骤采用64层螺旋CT(Philips Healthcare,Cleveland,Ohio)对血管所在的区域进行断层扫描。64排螺旋CT的探测器的排数达到64排,可以同时采集64层图像对应的体积数据。在采集的过程中,每层图像的厚度达到亚毫米层厚级别。在这样一种体积数据的获取方式中,基于螺旋CT的扫描层厚能够达到亚毫米层数量级的优势,可以获取血管中包含的丰富的细节信息,获取真实血管的精确的形状以及尺寸信息。
获得血管所在区域的体积数据之后,可以通过多平面重建获取血管的多个数字图像。多平面重建具体的过程为:根据体积数据,结合重建参数,对某一重建基线所标定的组织进行横断、冠状、矢状以及任意角度斜位图的重建。本实施以重建横断面为例对本申请的技术方案进行说明。应当理解,本发明实施例并不限与此。
其中,重建参数包括重建层厚、重建层间距以及窗位、窗宽等重建参数。在一种可选的实施方式中,通过CT view软件实现螺旋CT扫描的图像重建,以获得多幅血管的数字图像。其中,重建基线以及重建参数可由CT view软件进行图像识别后选取,也可以由人工进行设定,不再赘述。
在步骤102中,基于获取到的血管的多个数字图像,建立血管的三维数字模型。具体的,步骤102可由如下的几个步骤实现:
步骤1021、从多个数字图像中提取血管的轮廓数据。
在一种可选的实施方式中,针对血管的多个数字图像,可以采用Mimics软件提取数字图像中血管的轮廓数据。血管的轮廓数据包括血管的轮廓线以及血管的轮廓分区。
将血管的数字图像导入Mimics软件之后中,Mimics软件能够根据横断面的断层扫描图像生成矢状面以及冠状面图像,并在三个视图中展示血管的数字图像。这三个视图是相互关联的,可以通过鼠标和定位工具栏进行定位。例如,在其中一个视图中定位某一组织,其余两个视图关联显示定位点,从而结合三个视图实现目标组织的准确定位、轮廓线以及轮廓分区的选取。
生成三视图之后,在Mimics软件的在三视图可编辑操作界面里,根据横断面图像中血管与包裹血管的其他组织之间的灰度值差异提取出血管轮廓线,将该轮廓线包围的区域作为建模对象。具体操作为:开启Mimics软件的“阈值设定”功能,设置阈值。阈值的设定可以由软件根据当前数字图像的灰度自动生成,也可以是人工输入。阈值设定是否准确是血管轮廓线提取是否完整与准确的关键,阈值设置的过高或过低都有可能出现组织丢失或者噪点过多等情况,因此需要根据实际情况设置相应组织的阈值范围,本申请实施例不做限制。
在提取到血管的轮廓线之后,进一步通过区域增长法,在血管的数字图像的三视图上进行热区的选择。应当理解,选择热区的目的在于,基于血管的大致轮廓线,对数字图像进一步进行图像区域分割以及冗余数据去除,以实现血管内腔分区以及血管外壁分区的分离。可选的,首先选定横断面的图像中血管外壁分区对应的区域,在矢状面与冠状视面中观察该区域是否对应血管外壁分区,若为是,则保留该选区,并基于该选区执行区域增长操作,以获取与该选区的灰度值相同的区域。若为否,则在横断面图像中矫正选区的位置,继续观察。理论上,执行区域增长之后,在三个视图上分别能够得到连续的选区。反复执行上述步骤,在血管的数字图像上能够得到血管外壁分区以及血管内壁分区。在某些情况下,由于CT成像灰度值不不均匀,将导致区域增长之后仍然无法在三视图上得到连续的选区。在上述情境下,可以执行多次选区以及观察操作,进行非连续区域的修补。
步骤1022、获取三维建模参数。
其中,三维建模参数可以通过读取步骤101中螺旋CT扫描的图像重建的重建参数,以及螺旋CT扫描时的扫描参数获得。具体的,可从重建参数中获取三维建模的层厚以及三维建模的层间距等,可从螺旋CT的扫描参数中获取采集矩阵的大小,从而获取三维建模时显示矩阵的大小。
其中,显示矩阵的大小影响着三维建模后的图像的显示质量。通常三维建模的显示矩阵越大,包含的像素越多,三维建模后图像显示质量越好。三维建模的显示矩阵的大小的具体值可根据采集矩阵的大小而定,一般情况下,显示矩阵的大小等于或者大于显示矩阵的大小。例如,CT扫描采集图像时,采集矩阵的大小设置为512*512,则三维建模的显示矩阵可以设置为512*512或者1024*1024。
其中,三维建模的层间距,是三维建模时两幅断层图像之间的间距,一般而言,三维建模的层间距等于体积数据重建时的重建层间距;三维建模的层厚,是三维建模时每一断层扫描图像的厚度,一般而言,三维建模的层厚等于体积数据重建时的重建层厚。从而,根据该三维建模的层间距以及该三维建模的层厚,更加完整地恢复出体积数据重建时每一幅数字图像包含的血管的形状以及尺寸信息。
上述三维建模参数的设置可由软件自动读取也可由人工进行设置,本实施例不做限制。
步骤1023、根据血管的轮廓数据和三维建模参数,构建血管的三维数字模型。
获取血管的轮廓数据以及三维建模参数之后,执行Mimics软件的“三维计算”功能,获得血管的三维数字模型。
在得到血管的三维数字模型后,在步骤103中,基于得到血管的三维数字模型,执行抽壳处理。其中,步骤103进一步包括如下的两个步骤:
步骤1031、对血管的三维数字模型进行轮廓面的识别,得到血管的轮廓面。
步骤1032、对轮廓面进行抽壳处理,得到人工血管的模具模型。
在抽壳的处理过程中,对血管的三维数字模型进行轮廓面的识别,分别得到所述血管的外壁轮廓面以及内腔轮廓面。
对内腔轮廓面进行抽壳处理,得到人工血管内腔模具模型;对外壁轮廓面进行抽壳处理,得到人工血管外壁模具模型。人工血管内腔模具模型以及所述人工血管外壁模具模型构成所述人工血管的模具模型。
在本实施例中,采用Geomagic软件执行抽壳处理。在抽壳处理的过程中,设置偏移值。偏移值的大小等于轮廓面的厚度值,例如,指定抽壳的偏移值为1mm,则在抽壳处理的过程中,为三维数字模型的内腔轮廓面以及外壁轮廓面抽壳出1mm的厚度。抽壳的偏移值可以由软件自动获取,也可以由用户指定。
在步骤104中,基于人工血管的模具模型,采用三维打印技术打印得到固态实体的人工血管的模具。
本实施例中,采用三维成型机Z Corp进行人工血管模具的打印。在具体操作时,将上述步骤得到的人工血管的模具模型导入至Z Corp系统的计算机中,设置打印参数并开启打印按钮即可进行打印。具体的,该打印参数包括:打印切片的厚度、三维打印层厚以及打印速度。
本实施例的一种可实现方式中,设置打印切片的厚度为0.1~0.2mm,设置三维打印层厚为1mm,设置打印速度为2~10mm/s。在这样的打印参数下,能够获得效果精细且效率高的三维打印。当然上述数字具有特殊性,本申请实施例在实际操作中,打印参数包括但不限于上述举例。
通常,三维打印时,为避免被打印对象与操作台的直接接触造成分离困难,需要配合被打印对象设置相应的支撑结构。支撑结构放置在打印操作台上,人工血管直接打印在支撑结构上。打印时,人工血管与支撑结构连接在一起。因此,在打印获取人工血管时之后,需要去除去支撑结构才能将人工血管投入使用。
可选的,为了不破坏人工血管的表面结构与形状,本申请实施例中,采用可溶性材料作为打印材质,并在打印结束后,采用溶解剂对支撑结构进行溶解,获得所需的人工血管。
可选的,所述可溶性材料可以是高抗聚苯乙烯(HIPS)或聚乙烯醇(PVA),所述溶解剂可以是柠檬烯。
本实施例中,通过获取血管数字图像并根据该数字图像进行三维建模,获得了血管的三维数字模型。基于该三维数字模型生成的人工血管的模具模型,打印该模具模型的到人工血管模具,采用该模具模型制备出的人工血管,在形状与尺寸上与真实的血管高度一致。间接地,基于该人工血管的模具模型打印人工血管模具,能够应用于个体化高仿真血管的制备,奠定了临床血管外科个体化血管的替代基础,提升了医学研究、治疗以及教学的可靠性。
针对图1对应的实施例,获取血管的三维数字模型的过程中,可能因为血管的数字图像的灰度分布不均导致轮廓提取以及热区选择时出现误差,这些误差将直接导致获取的三维数字模型出现破洞噪声等。在图2对应的实施例中,将进一步对三维数字模型进行优化以获取更优质的血模具。
图2是本申请实施例提供的制备人工血管模具的方法的另一方法流程图,结合图2,该方法包括:
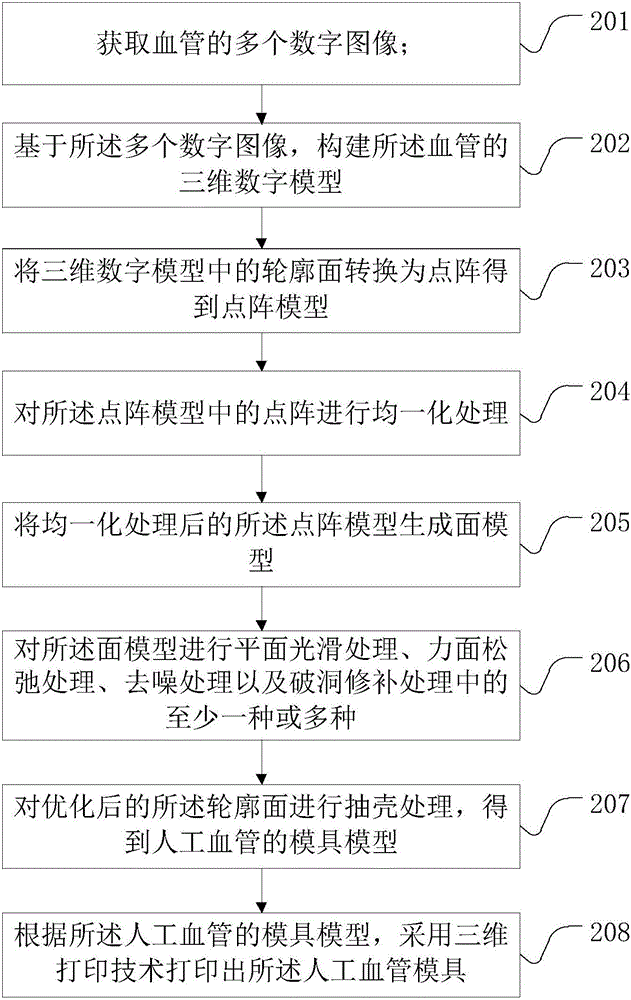
步骤201、获取血管的多个数字图像;
步骤202、基于所述多个数字图像,构建所述血管的三维数字模型;
步骤203、将三维数字模型中的轮廓面转换为点阵得到点阵模型。
步骤204、对点阵模型中的点阵进行均一化处理。
步骤205、将均一化处理后的点阵模型生成面模型。
步骤206、对面模型进行平面光滑处理、力面松弛处理、去噪处理以及破洞修补处理中的至少一种或多种。
步骤207、对优化后的所述轮廓面进行抽壳处理,得到人工血管的模具模型。
步骤208、根据所述人工血管的模具模型,采用三维打印技术打印出所述人工血管模具。
具体的,本实施例中对三维数组模型的轮廓面的优化过程均可采用Geomagic软件中的命令工具实现,不再赘述。
本实施例中,被处理的轮廓面是三维建模后得到的每个轮廓面。通过上述优化处理,血管的每个轮廓面上的破损部位或者噪点部位得到修补,从而将三维数字模型优化至光滑无坏面。基于优化后的血管的三维数字模型进行人工血管模具的打印,得到的人工血管模具将更加精致无瑕疵。采用该人工血管模具浇筑得到的人工血管也将与真实血管具有更高的一致性。
应用实例
以下部分将以耳部血管静脉窦的获取为例对本申请实施例的技术方案进行详细阐述。
首先,采用Philips Brilliance 64层螺旋CT(Philips Healthcare,Cleveland,Ohio)进行血管所在区域的体积数据的采集。具体操作位:设置患者呈仰卧位,扫描范围自颅底至窦汇,以包括全部乙状窦。扫描参数设置为120kV,300mAs;准直设置为64×0.625mm;采集矩阵设置为512×512;螺旋CT的旋转时间0.75s。采集部位自颅底向头顶方向采集体积数据。
将采集到的原始数据传输至处理工作站,本实施例中采用的是Extended Brilliance Workspace 4.0(Philips,荷兰))。利用处理工作站自带的CT viewer软件重建横断面图像。在重建的过程中,设置重建参数。例如,设置重建基线平行于水平半规管,重建层厚1mm,层间距1mm,窗宽4000HU,窗位700HU。得到重建后的数字图像如图3所示,保存为dicom文件格式导出。
将上述步骤得到的图像导入Mimics软件中,得到静脉窦血管的三视图。设定三维建模层厚为1mm,层间距为1mm,三维建模的显示矩阵为512×512。在三视图的横断面视图中,选择乙状窦外壁,反复修改、校正选区,直到三视图上的选区均呈连续状态。采用“区域增长”法,选中连续选区,利用三视图选区,初步建立静脉窦模型的三维实心内腔及空心外腔模型。将静脉窦模型保存为stl文件格式导出。
将stl格式的静脉窦模型导入Geomagic软件中,设置合适的坐标系。将静脉窦模型转化为点阵模型,采用点密度均一化将点阵优化;将点阵生成面模型,配合使用平面光滑、力面松弛、去噪等手段,修补模型破损部位;反复以上步骤,直到模型光滑无坏面;利用抽壳功能,设置厚度,将无厚度的面模型变为有厚度的面封闭实体,如图4所示,将静脉窦模型以stl文件格式导出。
开启三维成型机Z corp,将上述stl文件文件导入计算机,按online链接打印机和计算机进行喷墨打印。在打印材料的选择上,以可溶性材料高抗冲聚苯乙烯或聚乙烯醇为打印材质,打印成功后获取实体静脉窦内腔模具和外腔模具。获得静脉窦的内腔模具和外腔模具后,采用柠檬烯溶解的支撑部件,得到如图5所示的模型。
图6是本申请实施例提供的制备人工血管模具的方法对应的装置的结构示意图,结合图6,该装置包括:
图像获取模块61,用于获取血管的多个数字图像;
三维建模模块62,用于基于所述多个数字图像,构建所述血管的三维数字模型;
模具模型生成模块63,用于根据所述血管的三维数字模型,生成人工血管的模具模型;
模具打印模块64,用于根据所述人工血管的模具模型,采用三维打印技术打印出所述人工血管模具。
在一种可选的实施方式中,所述三维建模模块62,用于:从所述多个数字图像中提取血管的轮廓数据;获取三维建模参数;根据所述血管的轮廓数据和三维建模参数,构建所述血管的三维数字模型。
在一种可选的实施方式中,所述模具模型生成模块63,用于:对所述血管的三维数字模型进行轮廓面的识别,得到所述血管的轮廓面;对所述轮廓面进行抽壳处理,得到所述人工血管的模具模型。
在一种可选的实施方式中,所述轮廓面包括血管的内腔轮廓面和外壁轮廓面;相应的,所述模具模型生成模块63用于:对所述内腔轮廓面进行抽壳处理,得到人工血管内腔模具模型;以及,对所述外壁轮廓面进行抽壳处理,得到人工血管外壁模具模型;所述人工血管内腔模具模型以及所述人工血管外壁模具模型构成所述人工血管的模具模型。
在一种可选的实施方式中,所述模具模型生成模块63,还用于:对所述轮廓面进行面优化处理;以及,所述对所述轮廓面进行抽壳处理,得到人工血管的模具模型,包括:对优化后的所述轮廓面进行抽壳处理,得到人工血管的模具模型。
在一种可选的实施方式中,所述模具模型生成模块63,用于:将所述轮廓面转换为点阵得到点阵模型;对所述点阵模型中的点阵进行均一化处理;将均一化处理后的所述点阵模型生成面模型;对所述面模型进行平面光滑处理、力面松弛处理、去噪处理以及破洞修补处理中的至少一种或多种。
在一种可选的实施方式中,所述模具打印模块64,用于:根据打印需求,设置打印参数;根据所述人工血管的模具模型,采用可溶性尼龙粉末并基于所述打印参数,打印得到所述人工血管模具。
本申请实施例提供的制备人工血管模具的及装置,通过获取血管数字图像并通过三维建模获取血管的三维数字模型,基于该三维数字模型生成的人工血管的模具模型,在形状上与血管的形状高度一致性。基于该人工血管的模具模型打印人工血管模具,能够应用于个体化高仿真血管的制备,奠定了临床血管外科个体化血管的替代基础,提升了医学研究、治疗以及教学的可靠性。
如在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可理解,硬件制造商可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名称的差异来作为区分组件的方式,而是以组件在功能上的差异来作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。此外,“耦接”一词在此包含任何直接及间接的电性耦接手段。因此,若文中描述一第一装置耦接于一第二装置,则代表所述第一装置可直接电性耦接于所述第二装置,或通过其他装置或耦接手段间接地电性耦接至所述第二装置。说明书后续描述为实施本申请的较佳实施方式,然所述描述乃以说明本申请的一般原则为目的,并非用以限定本申请的范围。本申请的保护范围当视所附权利要求所界定者为准。
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的商品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种商品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的商品或者系统中还存在另外的相同要素。
上述说明示出并描述了本发明的若干优选实施例,但如前所述,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!