一种具有放射状孔道的介孔生物玻璃纳米球及其制备方法与流程
本发明属于生物医用材料领域,更具体地讲,涉及一种具有放射状孔道的介孔生物玻璃纳米球及其制备方法。
背景技术:
介孔生物玻璃(mesoporous bioactive glass,MBG)是以硅基质为基础组成成分,并具有介孔结构的新型纳米材料。目前,通过在溶胶-凝胶反应过程中加入表面活性剂可制备介孔尺寸在2-10nm的介孔生物玻璃。基于介孔生物玻璃具有高比表面积,均一可调的的孔径,其在生物催化、骨组织修复和药物载体等领域的潜在应用已经吸引了广泛关注。我们最近发现介孔生物玻璃支架植入大鼠股骨髁部后,可在12周内显著促进新骨生成,并提高成骨相关基因的表达水平。吴成铁等人的研究发现介孔生物玻纳米颗粒能够负载盐酸阿霉素,并在通过对药物的释放抑制人骨肉瘤细胞的活性。
然而,随着纳米技术的不断发展,为真正满足不同应用领域的需求,人们对介孔生物玻璃的结构提出了更高的要求。如作为纳米反应器的理想载体应具有空心介孔结构;应用于光学反应器应的纳米材料应具有一维结构等等。而用作药物控释的纳米载体则可能需要具备放射状孔道结构。这主要是由于纳米药物载体径向开放的多级孔道结构有利于药物的负载和传递,可能会大大提高了该类结构的介孔材料在药物控释领域的应用效率。然而,目前利用十六烷基三甲基溴化铵、聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物等表面活性剂制备的介孔生物玻璃纳米颗粒其介孔通道往往呈无序排列的状态,并不具备这种放射状孔道结构,由此可能会限制介孔生物玻璃在纳米药物载体领域的应用前景。
因此,有必要采用一种新的方法来制备一类具有放射状孔道的介孔生物玻璃纳米球。这一方法的关键,首先在于选择一种合适的模板剂,保证其在溶解过程中极性基团内向聚集的同时自身的长链分子能够向外辐射;此外,还要保证硅源在溶剂中水解后生成的表面带负电的Si(OH)4粒子能够通过电荷匹配的机制在模板剂表面生长,进而形成具有放射状孔道的介孔生物玻璃纳米球。
技术实现要素:
本发明的第一个目的在于提供一种具有放射状孔道的介孔生物玻璃纳米球的制备方法。
本发明的第二个目的在于提供一种具有放射状孔道的介孔生物玻璃纳米球。
本发明的第三个目的在于提供具有放射状孔道的介孔生物玻璃纳米球的应用。
为实现本发明第一个目的,本发明公开以下技术方案:一种具有放射状孔道的介孔生物玻璃纳米球的制备方法,其特征在于,所述方法包括如下步骤:
步骤1,将硅源、钙源、磷源、模板剂和助模板剂溶解于去离子水,并加入氢氧化钠,18-37℃下搅拌,获得凝胶,其中硅源、钙源和磷源的摩尔比以硅、钙、磷元素记为(60-90):(5-35):5,所述模板剂为溴代十六烷基吡啶,所述助板剂为聚乙烯醇或聚乙烯吡咯烷酮中的一种或两种;
步骤2,将获得的凝胶移入聚四氟乙烯反应釜中,60-80℃下反应;
步骤3,待反应结束后,取出聚四氟乙烯反应釜中的凝胶,分别用无水乙醇和去离子水洗涤,干燥;
步骤4,待干燥后,500-800℃煅烧,得到具有放射状孔道的介孔生物玻璃纳米球。
作为一个优选方案,所述硅源选自正硅酸乙酯。
作为一个优选方案,所述钙源选自硝酸钙和其水合物中的至少一种。
作为一个优选方案,所述磷源选自磷酸三乙酯。
作为一个优选方案,所述氢氧化钠的加入量为0.023-0.01M NaOH,优选0.048M NaOH。
为实现本发明第二个目的,本发明公开以下技术方案:利用上述方法制备获得的具有放射状孔道的介孔生物玻璃纳米球。
作为一个优选方案,纳米球的大小尺寸为50-250nm,介孔通道宽度为2-10nm。
为实现本发明第三个目的,本发明公开以下技术方案:具有放射状孔道的介孔生物玻璃纳米球在制备药物、蛋白和基因载体中的应用。
本发明的优点在于:该方法可以通过调整硅源、钙源和磷源的比例,获得具有不同尺寸的放射状孔道介孔生物玻璃纳米球。本发明制备工艺简便易行,所制备的放射状孔道的介孔生物玻璃纳米球在医药领域具有巨大的应用前景,可作为药物、蛋白和基因的纳米载体用于体内治疗。
附图说明
图1是实施例1制得的放射状孔道的介孔生物玻璃纳米球的透射电镜图。
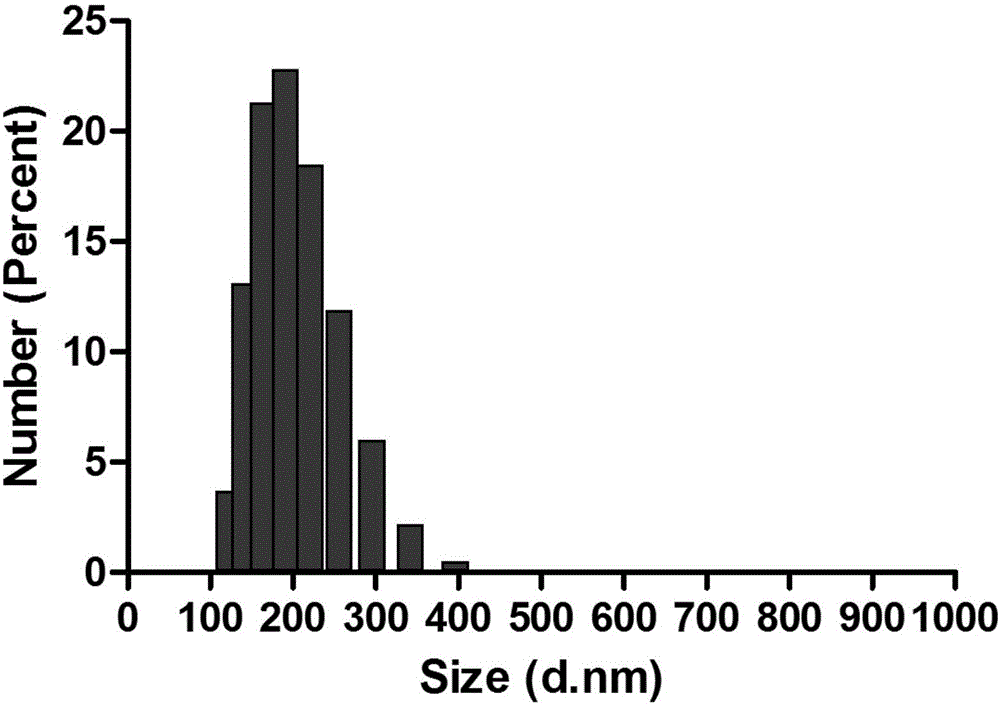
图2是实施例1制得的放射状孔道的介孔生物玻璃纳米球的粒径分布结果。
图3是实施例1制得的放射状孔道的介孔生物玻璃纳米球的能谱分析结果。
图4是实施例1制得的放射状孔道的介孔生物玻璃纳米球的氮气吸附-脱附图。
图5是实施例2制得的放射状孔道的介孔生物玻璃纳米球的透射电镜图。
图6是实施例3制得的放射状孔道的介孔生物玻璃纳米球的透射电镜图。
图7是实施例4制得的不具备明显放射状孔道的介孔生物玻璃纳米球的透射电镜图。
图8是实施例5制得的共聚生长且介孔通道无序排列的介孔生物玻璃纳米球的透射电镜图。
图9是实施例6具有放射状介孔通道结构的MBG纳米球装载阿霉素的载药率结果。
具体实施方式
下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1.
将0.23g氢氧化钠,1.0g聚乙烯吡咯烷酮溶解于120mL去离子水中,并搅拌10分钟;加入1.4g阳离子表面活性剂溴代十六烷基吡啶继续搅拌60分钟;加入1.1g四水合硝酸钙(Ca(NO3)4·4H2O),5.22g正硅酸四乙酯(TEOS),0.56g磷酸三乙酯(TEP),室温下搅拌24小时,得到稳定的溶胶;将溶胶转移至聚四氟乙烯反应釜内,于80℃条件下行水合反应48小时。待反应结束后,将产物分别用无水乙醇和去离子水洗净三次,100℃干燥过夜。最后将干燥后的凝胶在马弗炉内550℃烧结5小时,即可得到具有放射状孔道的介孔生物玻璃纳米球。
图1的结果显示,制备的介孔生物玻璃纳米球具有明显的放射状介孔通道结构,纳米球大小均匀,约为50-90nm;流体粒径的测试结果(图2)显示纳米球的流体粒径为245.53±7.56nm。图3的结果表明具有放射状孔道的介孔生物玻璃纳米球的主要组分为硅(53.58Wt%)和钙(4.1Wt%)。合成的介孔生物玻璃纳米球具有高比表面积,为593.7660m2/g(图4)。
实施例2.
将0.11g氢氧化钠,1.0g聚乙烯吡咯烷酮溶解于120mL去离子水中,并搅拌10分钟;加入1.4g阳离子表面活性剂溴代十六烷基吡啶继续搅拌60分钟;加入1.1g四水合硝酸钙(Ca(NO3)4·4H2O),5.22g正硅酸四乙酯(TEOS),0.56g磷酸三乙酯(TEP),室温下搅拌24小时,得到稳定的溶胶;将溶胶转移至聚四氟乙烯反应釜内,于80℃条件下行水合反应48小时。待反应结束后,将产物分别用无水乙醇和去离子水洗净三次,100℃干燥过夜。最后将干燥后的凝胶在马弗炉内550℃烧结5小时,即可得到具有放射状孔道的介孔生物玻璃纳米球。图5的结果显示,制备的介孔生物玻璃纳米球大小为50nm左右,仍具有放射状孔道结构。
实施例3.
将0.23g氢氧化钠,1.0g聚乙烯吡咯烷酮溶解于120mL去离子水中,并搅拌10分钟;加入1.4g阳离子表面活性剂溴代十六烷基吡啶继续搅拌60分钟;加入2.57g四水合硝酸钙(Ca(NO3)4·4H2O),3.92g正硅酸四乙酯(TEOS),0.56g磷酸三乙酯(TEP),室温下搅拌12小时,得到稳定的溶胶;将溶胶转移至聚四氟乙烯反应釜内,于80℃条件下行水合反应48小时。待反应结束后,将产物分别用无水乙醇和去离子水洗净三次,80℃干燥过夜。最后将干燥后的凝胶在马弗炉内600℃烧结5小时,即可得到具有放射状孔道的介孔生物玻璃纳米球。图6显示为该条件下制备的介孔生物玻璃纳米球,大小200-250nm作为,外层仍具有放射状孔道结构。
实施例4.
将0.23g氢氧化钠,1.0g聚乙烯吡咯烷酮溶解于120mL去离子水中,并搅拌10分钟;加入1.4g表面活性剂十六烷基三甲基溴化铵继续搅拌60分钟;加入1.1g四水合硝酸钙(Ca(NO3)4·4H2O),5.22g正硅酸四乙酯(TEOS),0.56g磷酸三乙酯(TEP),室温下搅拌24小时,得到稳定的溶胶;将溶胶转移至聚四氟乙烯反应釜内,于80℃条件下行水合反应48小时。待反应结束后,将产物分别用无水乙醇和去离子水洗净三次,100℃干燥过夜。最后将干燥后的凝胶在马弗炉内550℃烧结5小时,获得介孔生物玻璃纳米球。
图7的结果显示,当选用十六烷基三甲基溴化铵替代溴代十六烷基吡啶作为阳离子表面活性剂是,制备的介孔生物玻璃纳米球呈现蠕虫状介孔结构,并不具有明显的放射状介孔通道结构。
实施例5.
将0.7ml 2M氢氧化钠0.14g聚乙烯吡咯烷酮溶解于96mL去离子水中,并搅拌10分钟;加入0.189g阳离子表面活性剂溴代十六烷基吡啶继续搅拌60分钟;加入1.25g正硅酸四乙酯(TEOS)室温下搅拌24小时后将溶胶转移至聚四氟乙烯反应釜内,于80℃条件下行水合反应48小时。待反应结束后,将产物分别用无水乙醇和去离子水洗净三次,100℃干燥过夜。最后将干燥后的凝胶在马弗炉内550℃烧结5小时。
图8的结果显示,当在制备过程中,不加入钙源与磷源时,合成的介孔生物玻璃纳米球介孔孔道无序排列,且纳米球出现了共聚生长,没有形成分散良好的独立纳米球。
实施例6.
MBG纳米球载药率的测定
(1)阿霉素(DOX)标准曲线的建立:
精密称取DOX 10mg,加水溶解并定容至10ml,配置成为1mg/mL的储备液。精密量取适量别稀释成浓度为5,12.5,17.5,25和30ug/mL的标准溶液。利用紫外分光光度计测定其吸光度,并以浓度为X轴,吸光度为Y轴进行线性回归。DOX的标准曲线为Y=0.0232X-0.0063,相关系数R2=0.9995,在5-30ug/ml的浓度范围内,线性关系良好。
(2)MBG纳米球装载DOX
DOX分别按125,250和500ug/mL溶于PBS溶液中。选用实施例1中制备的MBG纳米球4mg,分别加入到不同浓度的、4mL DOX-PBS溶液中。在避光条件下,室温振荡24小时后,8000rpm离心15分钟,分离上清和装载DOX的MBG纳米球。利用紫外分光光度计,通过装载药物前后DOX-PBS溶液的浓度变化,计算MBG纳米球的药物负载量。
图9的结果显示,当DOX与MBG的投料比在1:4和1:8时,MBG纳米球展现出了较高的载药率,分别为90.46%±0.84%和93.06±0.78%,表明具有放射状孔道结构的MBG纳米球可以作为一种极具潜力的纳米药物载体进行更为深入的研究。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!