碳酸钴的制备方法以及四氧化三钴的制备方法与流程
本发明涉及一种碳酸钴的制备方法以及四氧化三钴的制备方法。
背景技术:
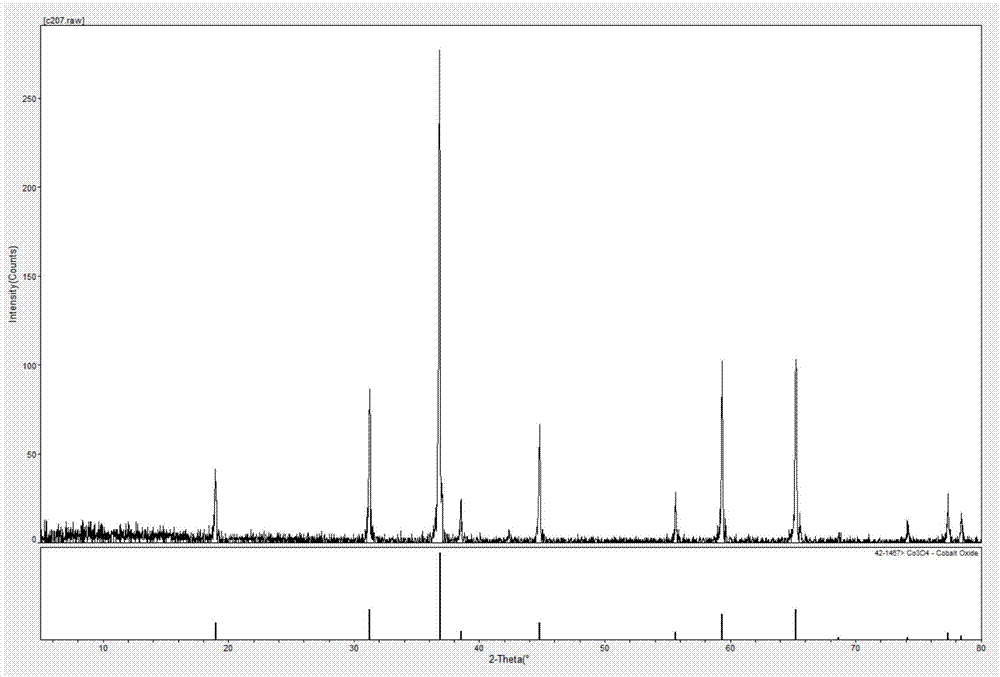
:四氧化三钴常应用于电化学领域,主要用作生产锂离子电池正极材料的前驱体—钴酸锂,也可用在耐腐蚀、耐高温和磁性材料等领域,另外,在硬质合金、催化剂、颜料添加剂和制备其他材料等方面也有广泛的应用。传统的四氧化三钴粉体的制备主要采用草酸钴热分解工艺,近几年来,草酸价格上涨较快,导致四氧化三钴的制备成本大幅上升,且传统的工艺生产的四氧化三钴的形貌为针状,导致四氧化三钴的应用范围小。技术实现要素:基于此,有必要提供一种原材料价格低、可控度比较高的碳酸钴的制备方法,还提供一种原材料价格低、可控度比较高且制备出的四氧化三钴粒度和形貌均匀的四氧化三钴的制备方法。一种碳酸钴的制备方法,包括如下步骤:配制碳酸氢铵溶液以及氯化钴溶液;在反应容器中加入预定量的去离子水,加热所述去离子水至预定温度;加入部分所述碳酸氢铵溶液至所述反应容器内,并调节所述反应容器内的溶液的酸碱度至ph为7.1-7.6;加入所述氯化钴溶液与剩余的所述碳酸氢铵溶液至所述反应容器内,搅拌反应,反应生成碳酸钴。一种四氧化三钴的制备方法,包括如下步骤:配制碳酸氢铵溶液以及氯化钴溶液;在反应容器中加入预定量的去离子水,加热所述去离子水至预定温度;加入部分所述碳酸氢铵溶液至所述反应容器内,并调节所述反应容器内的溶液的酸碱度至ph为7.1-7.6;加入所述氯化钴溶液与剩余的所述碳酸氢铵溶液至所述反应容器内,搅拌反应,反应生成碳酸钴;收集生成的所述碳酸钴,并进行煅烧处理,得所述四氧化三钴。在其中一个实施例中,所述碳酸氢铵溶液的浓度为230g/l-250g/l,所述氯化钴溶液的浓度为100g/l-120g/l。在其中一个实施例中,所述碳酸氢铵溶液与所述氯化钴溶液分别通过高位槽加入至所述反应容器内。在其中一个实施例中,所述高位槽内的所述碳酸氢铵溶液与所述高位槽内的所述氯化钴溶液通过并流加料的方式加入至所述反应容器内。在其中一个实施例中,搅拌反应时的搅拌速率为80r/min-120r/min。在其中一个实施例中,还包括如下步骤:间隔预定时间检测生成的所述碳酸钴粒度的大小。在其中一个实施例中,对所述碳酸钴进行煅烧处理的煅烧温度为690℃-780℃。在其中一个实施例中,煅烧的时间为2h-4h。在其中一个实施例中,所述加热所述去离子水至预定温度是将所述反应容器中的所述去离子水加热至50℃-60℃。在其中一个实施例中,加热所述反应容器中的所述去离子水的温度至54℃。上述四氧化三钴的制备方法制得的四氧化三钴为纯立方相尖晶石结构,四氧化三钴晶粒较大,晶体结构较为完整,振实密度高,粒度和形貌均匀且一致。上述四氧化三钴的制备方法具有工艺路线技术起点低,原材料成本低,易于实现和掌握,可控度比较高等优点。附图说明图1为一实施例制得的四氧化三钴的xrd图谱,其中横坐标为时间递耗,纵坐标为强度值;图2-图5为一实施例制得的四氧化三钴在不同放大倍数电镜扫描的颗粒形貌图;图6为另一实施例制得的四氧化三钴的xrd图谱,其中横坐标为时间递耗,纵坐标为强度值;图7-图10为另一实施例制得的四氧化三钴在不同放大倍数电镜扫描的颗粒形貌图。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本发明提供了一种四氧化三钴的制备方法。本实施例所需实验试剂:取碳酸氢铵(nh4hco3)以及六水合氯化钴(cocl2·6(h2o))。其中,碳酸氢铵,芷江化工股份有限公司生产,六水合氯化钴,广西银亿股份有限公司生产。本实施例所需实验仪器包括:烧杯、玻璃棒、恒温水浴锅、反应容器、搅拌器、温度计、雷磁ph计、马弗炉、(shb-3)循环水多用真空泵(苏州奇乐电子科技有限公司)以及malvern2000激光粒度仪(德国马尔文仪器有限公司)。四氧化三钴的制备方法包括如下步骤:取碳酸氢铵(nh4hco3),用纯水溶解,配制成浓度为230g/l-250g/l的碳酸氢铵溶液,加入至高位槽内,备用。取六水合氯化钴(cocl2·6(h2o)),用纯水溶解,配制成浓度为100g/l-120g/l的氯化钴溶液,加入至另一高位槽内,备用。在反应容器中加入预定量的去离子水,加热去离子水至50℃-60℃,温度由温度计测量。打开高位槽的阀门,加入部分碳酸氢铵溶液至反应容器内,并调节反应容器内的溶液的酸碱度至ph为7.1-7.6,溶液的的酸碱度通过雷磁ph计测量。高位槽内的剩余的碳酸氢铵溶液与高位槽内的氯化钴溶液通过并流加料的方式加入至反应容器内,通过搅拌器搅拌,反应生成碳酸钴,碳酸氢铵溶液与氯化钴溶液反应时的反应方程式为:nh4hco3+cocl2=coco3+nh4cl+hcl。碳酸钴是一种难溶的化合物,溶度积很小,很容易达到过饱和度。碳酸钴沉淀形成过程主要包括两个阶段,粒子的成核过程与晶核的生长过程。在有nh4+络合剂存在的情况下,反应体系中co2+与nh4+先形成钴铵络离子,钴铵络离子接着再与co32-反应生成碳酸钴。搅拌是通过搅拌器实现的,搅拌器的搅拌速率为80r/min-120r/min,使碳酸钴颗粒围绕晶核缓慢而均匀地长大。间隔一定的时间通过马尔文激光粒度仪检测生成的碳酸钴粒度的大小,以保证碳酸钴的粒度在控制范围之内。同时,用光学显微镜观察碳酸钴结晶粒子的形貌与粒度增长的变化,进行监控。将合格的碳酸钴料浆进行陈化之后,通过(shb-3)循环水多用真空泵对反应容器内的溶液以及碳酸钴进行过滤,得到碳酸钴。通过循环真空泵洗涤碳酸钴。通过马弗炉对碳酸进行煅烧,得黑色或灰黑色的四氧化三钴粉末,煅烧的时间为2h-3h。煅烧反应生成四氧化三钴的方程式如下:6coco3+o2=2co3o4+6co2。上述四氧化三钴的制备方法制得的四氧化三钴为纯立方相尖晶石结构,四氧化三钴晶粒较大,晶体结构较为完整,振实密度高,粒度和形貌均匀且一致。上述四氧化三钴的制备方法具有工艺路线技术起点低,易于实现和掌握,可控度比较高等优点。本发明采用碳酸氢铵作为沉淀剂,其ph值在反应过程中比较稳定,碳酸氢铵能够在溶液中形成缓冲体系,碳酸氢铵易得,价格低廉,无污染。采用碳酸氢铵作为沉淀剂,制得的四氧化三钴具有细晶球形的表面形貌,粒度更加均匀,表面活性高。实施例1本实施例涉及了一种四氧化三钴的制备方法,其包括如下步骤:取nh4hco3,用纯水溶解,配制成浓度为240±4g/l的碳酸氢铵溶液,加入至高位槽内,备用。取cocl2·6(h2o),用纯水溶解,配制成浓度为110±3g/l的氯化钴溶液,加入至另一高位槽内,备用。在反应容器中加入预定量的去离子水,加热去离子水至54℃。打开高位槽的阀门,将部分碳酸氢铵溶液加入至反应容器内,并调节反应容器内的溶液的酸碱度至ph为7.2±0.05。高位槽内的碳酸氢铵溶液与高位槽内的氯化钴溶液通过并流加料的方式加入至反应容器内,通过搅拌器搅拌反应,搅拌器的搅拌速率为100r/min,反应时间10h,生成碳酸钴,使碳酸钴颗粒围绕晶核缓慢而均匀地长大。搅拌对碳酸钴的结晶过程有重要影响,搅拌可以使整个体系的反应过程均匀进行,防止局部了钴浓度过高而产生大量的晶核,从而可以保证晶体长大过程的同时进行。适当的加强搅拌有利于晶核的长大。另外,合理的搅拌方式可以产生一定的流向有利于类球形晶体的形成。间隔一定的时间通过马尔文激光粒度仪检测生成的碳酸钴粒度的大小,以保证碳酸钴的粒度在控制范围之内。同时,用光学显微镜观察碳酸钴结晶粒子的形貌与粒度增长的变化,进行监控。将合格的碳酸钴料浆进行陈化之后,通过(shb-3)循环水多用真空泵对反应容器内的溶液以及碳酸钴进行过滤,得到碳酸钴。通过(shb-3)循环水多用真空泵洗涤碳酸钴。通过马弗炉对碳酸进行煅烧,煅烧温度720℃±30℃,煅烧时间为2h,得黑色或灰黑色的四氧化三钴粉末。对本实施例所制得的四氧化三钴进行检测与分析,通过马尔文粒度仪(malvern2000激光粒度仪,德国马尔文仪器有限公司)检测得知制得的四氧化三钴的d50为7.341μm,通过x-粉末射线衍射仪进行晶相分析。参见图1所示,带有数字的坐标轴上的谱线代表了四氧化三钴的标准谱线,而图中的各衍射峰与标准谱线吻合度极高,无其它杂质峰,表明制得的四氧化三钴为纯立方相尖晶石结构;而且各衍射峰比较尖锐,表明在煅烧分解时形成的四氧化三钴晶粒较大,晶体结构较为完整。通过蔡司sigmahd场发射扫描电子显微镜进行观察颗粒的形貌和能谱分析,参见图2-图5所示,其中,图2、图3、图4、图5分别为不同放大倍数(倍数依次增大)电镜扫描下所观察到的四氧化三钴的颗粒形貌,从图2中可以看出本发明四氧化三钴的制备方法制备出的四氧化三钴为类球形颗粒,球形度较差,不同颗粒之间粒径相差较大,从图3-图5中可以明显看出四氧化三钴的颗粒表面并不圆滑,颗粒表面有很多凹面,表示四氧化三钴的晶体致密程度相对较差。通过能谱分析发现其钴含量比预想含量要低,四氧化三钴的能谱分析元素含量表见下表1所示。表1元素重量百分比原子百分比c9.8618.17o47.6165.86co42.5215.97实施例2本实施例涉及了一种四氧化三钴的制备方法,其包括如下步骤:取nh4hco3,用纯水溶解,配制成浓度为240±4g/l的碳酸氢铵溶液,加入至高位槽内,备用。取cocl2·6(h2o),用纯水溶解,配制成浓度为110±3g/l的氯化钴溶液,加入至另一高位槽内,备用。在反应容器中加入预定量的去离子水,加热去离子水至57℃。打开高位槽的阀门,将部分碳酸氢铵溶液加入至反应容器内,并调节反应容器内的溶液的酸碱度至ph为7.5±0.05。高位槽内的碳酸氢铵溶液与高位槽内的氯化钴溶液通过并流加料的方式加入至反应容器内,通过搅拌器搅拌反应,搅拌器的搅拌速率为85r/min,反应时间48h,生成碳酸钴,使碳酸钴颗粒围绕晶核缓慢而均匀地长大。间隔一定的时间通过马尔文激光粒度仪检测生成的碳酸钴粒度的大小,以保证碳酸钴的粒度在控制范围之内。同时,用光学显微镜观察碳酸钴结晶粒子的形貌与粒度增长的变化,进行监控。将合格的碳酸钴料浆进行陈化之后,通过(shb-3)循环水多用真空泵对反应容器内的溶液以及碳酸钴进行过滤,得到碳酸钴。通过(shb-3)循环水多用真空泵洗涤碳酸钴。通过马弗炉对碳酸进行煅烧,煅烧温度750℃±30℃,煅烧时间为4h,得黑色或灰黑色的四氧化三钴粉末。对本实施例2制得的四氧化三钴进行检测与分析,通过马尔文粒度仪(malvern2000激光粒度仪,德国马尔文仪器有限公司)检测得知制得的四氧化三钴的d50为17.108μm,通过x-粉末射线衍射仪进行晶相分析。参见图6所示的xrd图可以看出,通过x射线衍射仪检测分析得到的图谱衍射峰与标准谱线基本一致。且不含其它杂质峰,表明所制得的产物为纯立方相尖晶石结构的四氧化三钴;且各衍射峰较为尖锐,表明颗粒较大,晶粒结构较为完整。对比实施例1与实施例2可知,从实施例1与实施例2两种工艺条件下制得的四氧化三钴的xrd图看出两个批次的产品各衍射峰并无明显差别,这就表明在同种制备方法下改变其工艺条件并不影响其晶粒的结构和纯度。通过蔡司sigmahd场发射扫描电子显微镜进行观察颗粒的形貌和能谱分析。实施例2的工艺条件下制得的四氧化三钴的sem图如图7-图10所示,图7、图8、图9、图10分别为不同放大倍数(倍数依次增大)电镜扫描下所观察到的四氧化三钴的颗粒形貌,从图7中可以看出本发明四氧化三钴的制备方法制备出的四氧化三钴为类球形颗粒,球形度较差,不同颗粒之间粒径相差较大,从图8-图10中可以明显看出四氧化三钴的颗粒表面并不圆滑,颗粒表面有很多凹面,表示四氧化三钴的晶体致密程度相对较差。从图7-图10中可以看出四氧化三钴的产品颗粒形貌为球形或类球形,形貌比较单一,颗粒分散性良好且颗粒比较均匀,颗粒表面比较平整,但是也可以看出大颗粒中也有夹带小颗粒,且颗粒有开裂的现象。通过比较实施例1及实施例2两种工艺条件下的四氧化三钴的sem图得出,同一种制备方法其工艺条件的改变对四氧化三钴的颗粒的形貌会产生影响,可原因是制备过程中工艺参数的改变对四氧化三钴粒子的成核速度与晶核的长大速度产生影响,改变其聚集方式,导致最终形成的四氧化三钴颗粒形貌不一致;而改变工艺之后所制得的四氧化三钴颗粒有裂纹,原因是烧结的温度过高。通过能谱分析发现其钴含量比预想含量要低,四氧化三钴的能谱分析元素含量表见下表2所示。表2元素重量百分比原子百分比c5.7213.49o32.0156.62co62.2629.89比较实施例1及实施例2两种工艺条件下制得的四氧化三钴能谱分析元素含量表,可以得到工艺变更后的实施例2所得四氧化三钴的钴含量比工艺变更前的实施例1所得四氧化三钴的钴含量要高,可以初步得出结论煅烧温度的提高有利于四氧化三钴中的钴含量的提高。但实施例1及实施例2两种工艺条件下制备的四氧化三钴含量都偏低,所以需要根据实践经验来调整煅烧温度和时间,来提高最终产品的钴含量。本发明的四氧化三钴的制备方法采用碳酸氢铵作为沉淀剂的液相沉淀法,此法具有工艺路线技术起点低,易于实现和掌握,可控度比较高,可以根据实际生产指标进行调整。通过实施例1及实施例2工艺参数的改变制得的两个批次四氧化三钴经xrd检析,发现工艺参数的改变并未改变四氧化三钴的各衍射峰的特征,所以得出一个结论,统一制备方法下,工艺参数的改变对晶粒的结构无明显影响。通过实施例1及实施例2制得的两个批次四氧化三钴的sem图,可以得出,工艺参数的改变对晶粒的形貌有重要影响。工艺参数的改变影响了碳酸钴沉淀时的过饱和度,而过饱和度的变化会影响碳酸钴结晶过程中的的晶核生成速度以及晶核的长大速度,碳酸钴的粒度形貌一定程度上决定了四氧化三钴的形貌。工艺参数中ph值控制是制备较高振实密度碳酸钴关键因素之一。因为ph值的变化可以改变碳酸钴沉淀生成时的过饱和度,进一步会影响碳酸钴结晶过程中的晶核生成速度以及晶体的长大速度。通过实验表明,在一定的ph值范围内,ph升高有利于晶核生成并进一步长大成粒径较大的沉淀粒子。当ph值超过这个范围时,由于随着过饱和度的增加晶核生成速度比晶核长大速度幅度大,因此随着ph值升高,会造成体系中晶核生成速度大幅增加,而晶核长大速度相对较慢,最后得到的碳酸钴和四氧化三钴的振实密度都会低于规定范围。通过实施例1与实施例2的实验对比得知制备四氧化三钴的最适ph值范围为7.5±0.05。通过实施例1及实施例2工艺参数的改变制得的两个批次四氧化三钴可知,反应温度升高,溶液的过饱和度会随之下降,而过饱和度的高低决定了碳酸钴结晶过程的成核速度。温度升高,反应物分子动能会增加,那么可能会造成各个过程的反应速度都会加快。但随着反应温度升高,溶液过饱和度就会降低,沉淀的成核速度增加幅度会小于沉淀的生长速度。所以提高温度会有利于晶核长大。但是,温度太高不利于生成稳定的晶核,温度升高有利于小晶核的溶解重新聚集在大颗粒表面,所以从生成粒度较大,振实密度较高的四氧化三钴考虑,应选择较高的反应温度,但温度过高,会使反应耗能增加,通过工艺研究,所以选择温度范围50-60℃,最终确定最适反应温度为54℃。通过实施例1及实施例2对比可知,搅拌对碳酸钴的结晶过程有重要影响,搅拌可以使整个体系的反应过程均匀进行,防止局部了钴浓度过高而产生大量的晶核,从而可以保证晶体长大过程的同时进行。适当的加强搅拌有利于晶核的长大。另外,合理的搅拌方式可以产生一定的流向有利于类球形晶体的形成。煅烧温度对四氧化三钴的影响:提高煅烧温度有利于提高产品的钴含量和振实密度,但产物比表面积却会降低。反应时间对四氧化三钴的影响:碳酸钴晶体的形成过程即晶核的生成和长大是需要一定时间,反应时间不够,随着反应时间的变化,碳酸钴颗粒的粒径大小及分布,形貌都在发生着变化,反应时间短,颗粒较小,形貌为类球形,粒径分布范围较宽,有大量小颗粒存在,此时碳酸钴晶体的结晶致密程度相对较差。随着反应时间变长,碳酸钴颗粒的粒径进一步增大,大颗粒相对增多,粒子间堆积的间隙也相应变大,此时可能会造成振实密度下降。本发明将碳酸氢铵作为沉淀剂的液相沉淀法通过工艺条件的改变可以制备出性能优良的四氧化三钴。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1